







热分析&电镜&表面分析,分享最新国内外仪器技术成果进展


无味无毒的气体一氧化二氮(N2O,nitrous oxide)可以通过生物和非生物两类过程形成,这导致大气中 N2O 浓度每年稳定增加 0.2-0.3 %。一氧化二氮是一种消耗臭氧的物质;它的全球变暖潜力超过了二氧化碳的 300 倍,因此已经被认为是 21 世纪最关键的人为排放物。
微生物可以将 N2O 转化为 N2,这是反硝化过程的最后一步,这一反应完全由一氧化二氮还原酶(N2OR 酶)催化。大气中 N2O 释放和不断积累的一个主要因素是,在高流量氮的环境下,微生物还原 N2O 的能力有限。
因此,利用 N2OR 酶的性能进行农业或生物修复应用是相当有意义的,这需要对该酶及其反应过程有一个详细的了解。除了 [ 4Cu:2S ] CuZ 簇,它还含有混合价的双铜电子转移中心 CuA,这使其成为目前已知最复杂的含铜酶。
各种真核生物和原核生物酶在涉及氧运输、电子转移或氧化还原催化的过程中都会使用过渡金属铜,但其巨大的细胞毒性、对铁硫簇代谢的不利影响以及产生活性氧的倾向性,使得细胞内必须进行严格的平衡和调节。
N2O 还原剂通过完全在细胞质外组装 CuA 和 CuZ 来规避与细胞内铜有关的风险,尽管 apo-N2OR 已经以折叠状态通过 Tat 途径被输出。
然而,这种策略导致了新的复杂情况,特别是包括在周质中没有还原当量和高能化合物,如核苷三磷酸酯。I 族 N2O 还 原催化剂的共同结构包括两个核苷酸结合结构域(NosF)和两个跨膜结构域(NosY)。一些细菌输出体进一步与附属蛋白相互作用,以建立复杂的运输系统,NosD 蛋白被认为是与 NosFY 一起发挥这种作用。
由于 NosDFY 的实际货物分子尚未被确定,不能排除 CuZ 成熟所需的周质硫源。为了了解 N2OR 成熟的分子基础,这项研究制作并表征了 NosDFY 复合物,并通过冷冻电子显微镜(cryo-EM)研究了它与 NosL 和 N2OR 的相互作用,揭示了由细胞质中 ATP 水解驱动的周质酶铜位点的顺序组装线。
2022 年 7 月 27 日,德国弗莱堡大学生物物化学研究所所长奥利弗 · 艾因斯(Oliver Einsle)与美国范 · 安德尔(Van Andel)研究所首席研究员杜娟合作,在 Nature 发表其最新论文,题为《一氧化二氮还原酶的组装机制中的分子相互作用》(Molecular interplay of an assembly machinery for nitrous oxide reductase ) [ 1 ] 。该工作详细地解析了 N2OR 酶的三维结构和组装机理。

▲图 | 相关论文(来源:Nature)
p. stutzeri (施氏假单胞,一种革兰氏阴性细菌)在大肠杆菌中被生产为稳定的五亚基复合物 NosDF2Y2,并在膜部分溶解后通过色谱方法分离出来。NosF2Y2 异源四聚体形成了复合物的核心,45kDa 的 NosD 蛋白从其中突出到周质中,成为一个细长的 β 螺旋,与糖类结合的蛋白质以及糖水解酶家族具有结构相似性。NosD 的主轴从与 NosFY 对相关的双轴上倾斜,打破了分子的对称性。
在 NosD-NosY 界面,NosD 的 C 端折叠成三个 α - 螺旋(hI-III),部分位于膜内,紧紧楔入 NosY 二聚体。
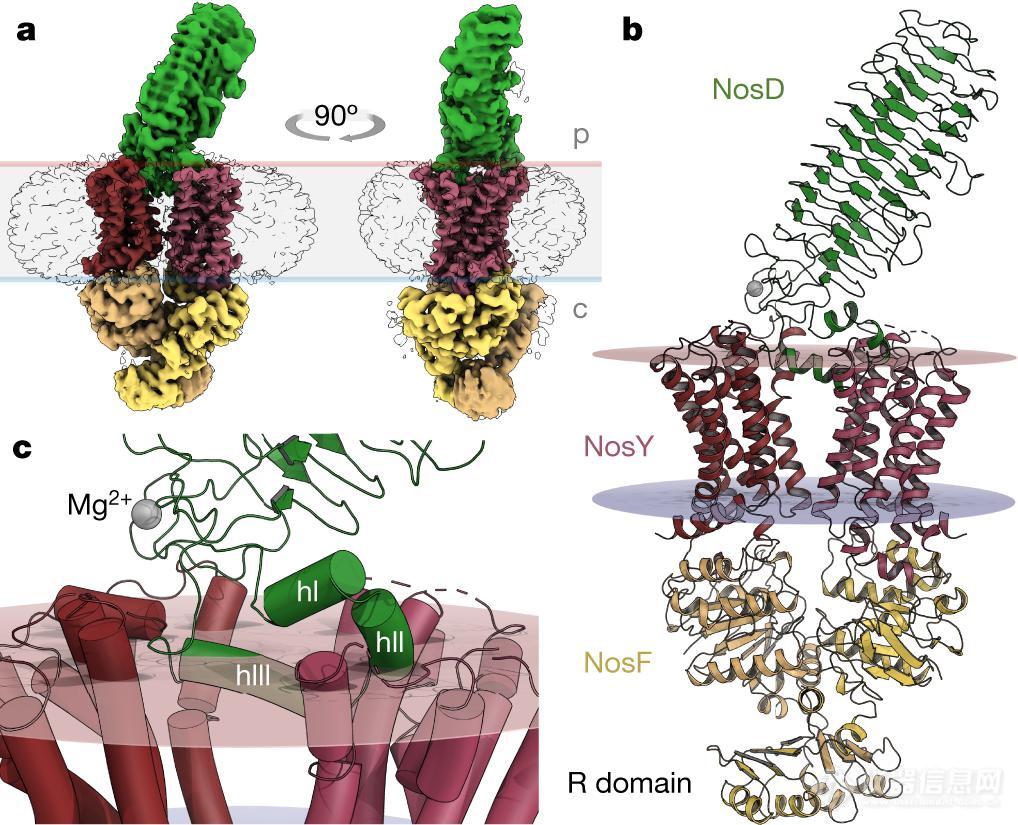
▲图 | 无核苷酸状态下 P.stutzeri NosDFY 的三维结构(来源:Nature)
为了描述 NosDFY 的 ATP 结合状态,研究者们产生了一个 NosF(E154Q)变体。在这一变体中,非活性谷氨酰胺取代了催化性谷氨酸残基 154,且该单点变体的 ATP 水解活性降低得十分明显。当在特定的背景下表达时,它会使得 N2OR 酶缺乏活性位点 CuZ 簇,从而导致功能失调。
无效的 E154Q 变体使 NosF 处于 ATP 结合状态,正如其他 ABC 蛋白(ATP 结合盒式蛋白,ATP-binding cassette transporter)已经报道的那样。具体来说,ATP 的结合使得 NosF2 二聚体大幅度闭合,这一动作将直接传导到 NosY 二聚体,从而实现关闭跨膜间隙,最终诱导 NosD 在周质中发生复杂的构象变化。这一过程可以用三种主要的旋转模式来描述。
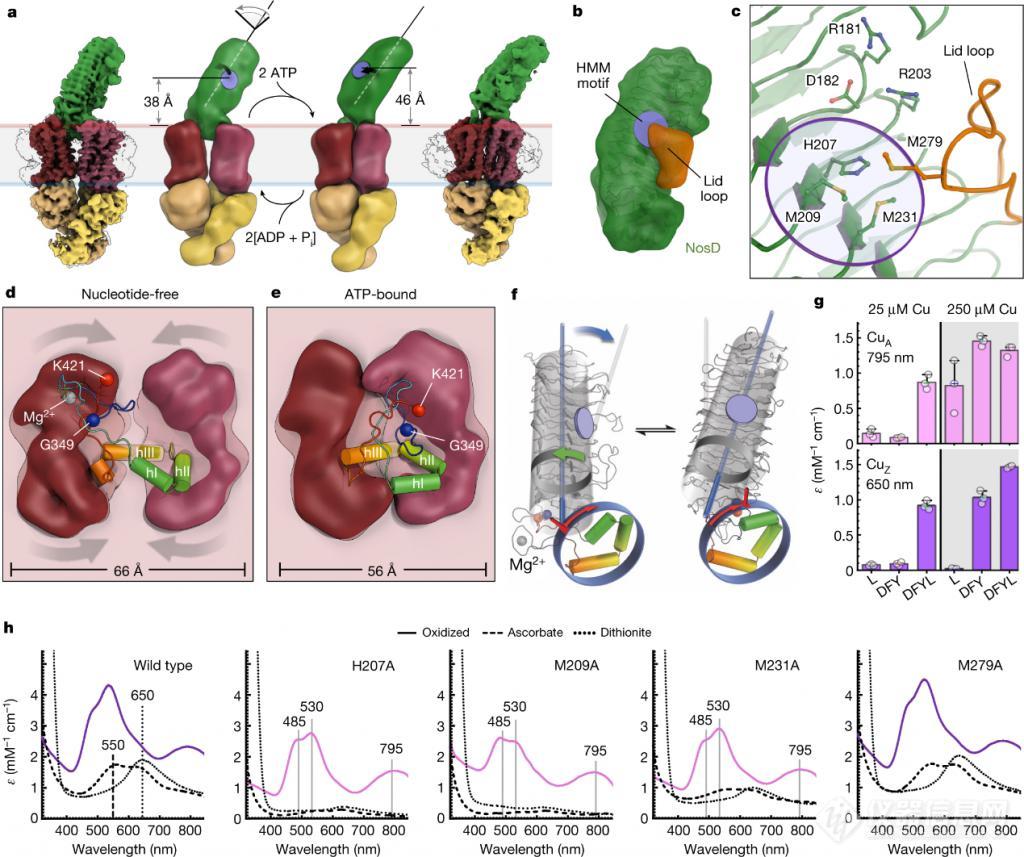
▲图 | NosDFY 及铜与 NosD 的结合的构型动力学(来源:Nature)
据悉,NosDFYL 在正十二烷基 β -D- 麦芽糖苷(DDM)中会被分离出来,并被重组到糖二醇胶束(GDN)和膜支架蛋白(MSP)纳米盘中,以 3.3- (纳米盘)或 3.04- (GDN 胶束)的分辨率进行冷冻电镜观察。
NosL 在复合物中的位置立即变得清楚,其 N 端被解析到 NosL ( C24 ) 的脂质附着点,该位点正好位于膜界面,而脂质附着点本身并没有被解析。这种排列明晰了 NosL 实际上并不像以前提出的那样位于外膜中,而是位于细胞质膜的外叶中。
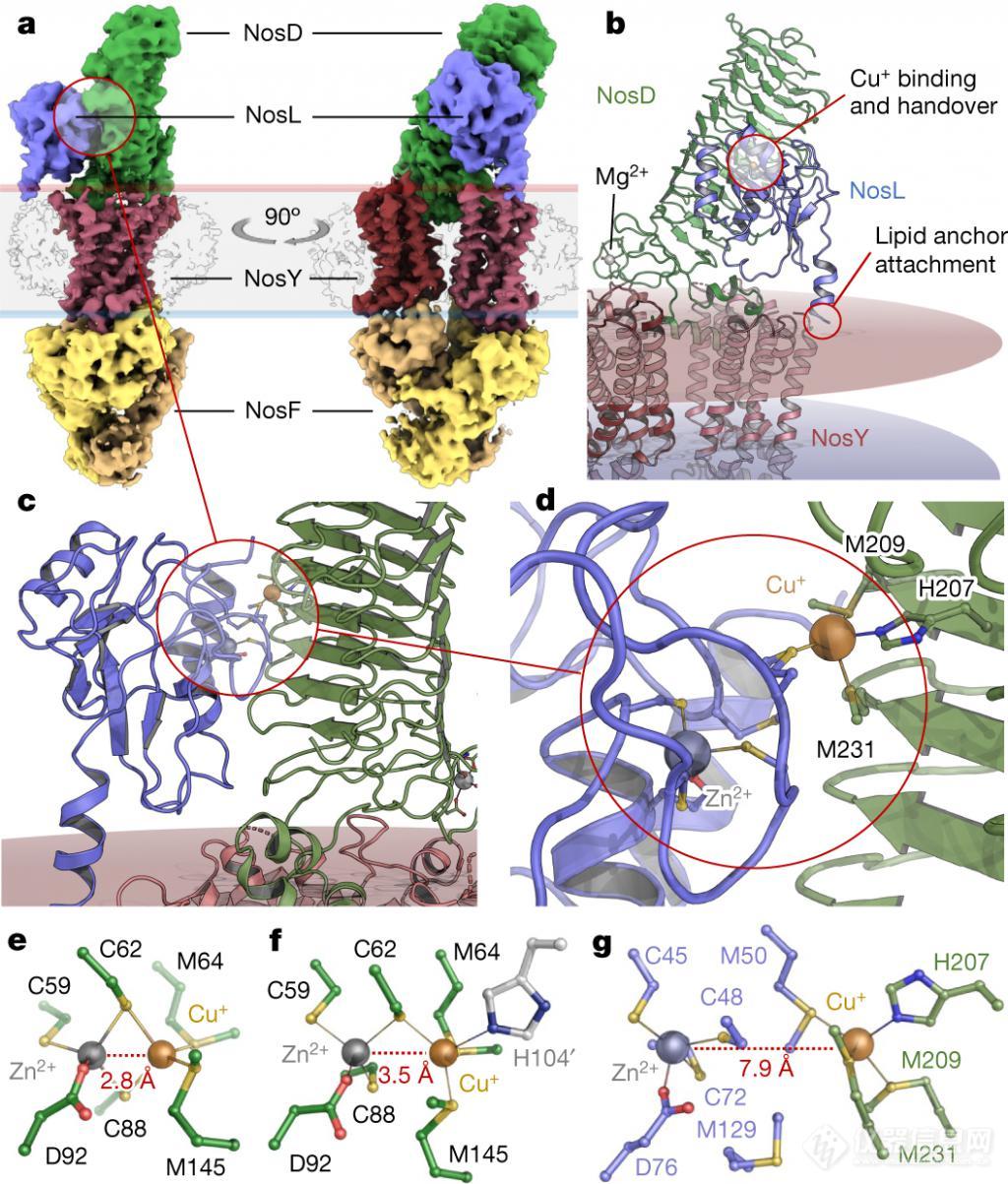
▲图 | 无核苷酸的 NosDFY 接受来自 NosL 的 Cu+(来源:Nature)
在三个组成部分的相互作用中,ATP 驱动的 NosD 的旋转运动控制着与其伙伴 NosL 和 N2OR 的相互作用,其具体相互作用模式见下图。
负载铜的 NosL 只能在无核苷酸状态下与 NosDFY 结合,在这种状态下,NosD 上的铜结合点朝向膜,允许 Cu+ 从 NosL 转移到 NosD。随后 ATP 与 NosF 的结合引发了 NosD 的旋转,而与膜相连的 NosL 无法跟随,导致其释放。
在这种构象中,NosD 现在可以通过相同的界面与 N2OR 相互作用,将其 " 含铜货物 " 转移到该酶的金属位点。然后 NosF 中的 ATP 水解使 NosDFY 回到其无核苷酸的开放构象,而 N2OR 二聚体向膜的移动最终将迫使其释放,并释放出 NosD 上 HMM 三联体的铜结合位点,以装载 NosL 的另一个金属阳离子。
在任何一个方向,各自的相互作用伙伴的释放都是通过 NosD 的旋转运动机械地触发的,NosDFY 及其伙伴的复合物的结构十分详细地显示了 ATP 驱动的 NosD 的变形如何使单核伴侣 NosL 的单个铜离子逐步转移,最终组装成四核 CuZ 簇。
因此,ABC 运体 NosDFY 作为一个跨膜能量转换器,动态地促进新生酶与 NosD 的铜供体的结合和分离,将一个主要的活性转运蛋白重新利用为 ATP 驱动的杠杆,跨越分隔两个非常不同的细胞区间的边界。
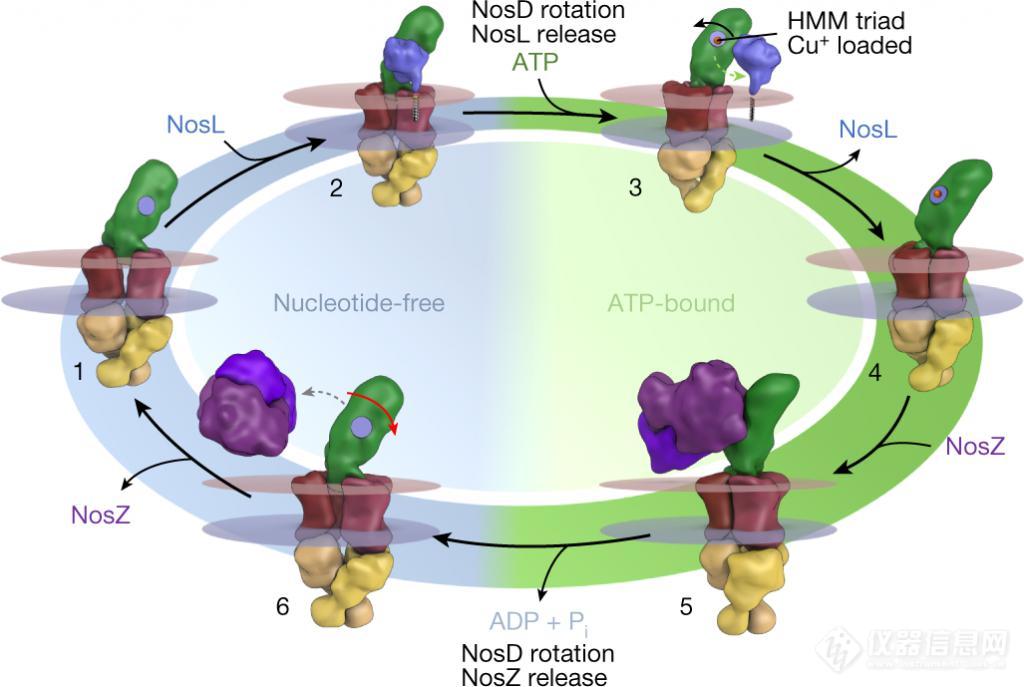
▲图 | 铜从 NosL 经 NosDFY 到 N2OR 的运输模型(来源:Nature)
总之,该研究以 NosDFY 与 NosL 和 N2OR 酶组成的复合结构为解析对象,这一结构中含有高度复杂的铜位点,利用冷冻电镜,复合结构的组装途径被完全展示。
在这一途径中,NosDFY 作充当机械能量转换器的角色,而并不直接起到转运作用。这项工作是科学家首次解析如此复杂的 N2O 还原酶结构,将为微生物 N2O 降解提供完整的理论支撑,并有望推动 N2O 还原降解的技术研究。
[来源:DeepTech深科技]
 冷冻电镜,两篇Science!
冷冻电镜,两篇Science!
2022.08.03

2024.07.03

8000万!北京昌平实验室300kV冷冻透射电子显微镜采购项目
2024.06.01

2024.05.13
2024.03.13
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~