







热分析&电镜&表面分析,分享最新国内外仪器技术成果进展


转载自Knowable Magazine "Structural biology: How proteins got their close-up"
前言
从细菌到人类,所有的生物都由细胞组成。细胞由四种大型生物分子构成:碳水化合物、脂肪、核酸(即DNA和RNA)和蛋白质。这些生命的重要组成部分小到肉眼无法观测,甚至用光学显微镜也难以成像。因此,尽管19世纪的科学家们知晓这些"隐形"分子的存在,也能够通过实验找出它们的化学成分,但科学家们却看不到它们:这些分子结构的任何细节始终是个谜题。这就是今天的主题:这些"隐形"分子是如何在20世纪被人们成功观测到的。
"许多基础的生物问题是非常容易解决的:只要能看到它们就行!" —理查德•费曼
这是一个漫长而艰辛的故事:关于开发能够解析生物分子结构的工具和技术,以及对这些分子结构的解析如何使我们能够理解它们的功能,并设计出阻止或加强其作用的药物。
为了讲述这个故事,我们将重点放在蛋白质上:这些大分子参与了我们身体中几乎所有的化学过程:它们解读遗传密码、催化化学反应、并充当我们细胞的守门员。蛋白质由名为氨基酸的小分子链构成。了解这些链如何折叠成三维结构至关重要,因为正是蛋白质的三维形态决定了它们的功能。
若要创建一个准确的蛋白质三维模型,我们需要知道组成该蛋白质的所有氨基酸中的所有原子在空间中的排列。 我们无法看到原子,因为它们比可见光的波长还要小。 为了探测这些原子,我们需要一种波长更短且穿透性极佳的波:这种波使我们能够同时对蛋白质内部和外部的原子进行观测。
因此,今天的故事开始于德国的维尔茨堡大学城。在那里,伦琴发现了X射线。
X射线的发现
那是1895年,威廉•伦琴正在实验室里工作。像他那一代的许多物理学家一样,他正在做阴极射线的实验:在一个叫做克鲁克司管的设备中产生的电子流。但与他同时代的人不同的是,伦琴注意到了一些意想不到的事情:离克鲁克司管相当远的一个屏幕在发光。伦琴认为,那个屏幕太远了,发光绝不可能是由阴极射线引起的。在接下来的几周里,他研究了这种发光的荧光,并意识到他发现了一种能够穿透固体物体的新型射线。 就在圣诞节前,他把他的妻子带到实验室,给她的手拍了一张照片。 在照片中,她的血肉消失了,但骨头和戒指都清晰可见。

威廉•伦琴
因发现X射线
于1901年获首届诺贝尔物理奖
关于他的发现,伦琴写了一份的报告。1896年初,一份英文译本发表了在《自然》杂志上。
"我们看到,一些剂能够穿透对紫外线、阳光或弧光不透明的黑色纸板。所以,研究其他物体能在多大程度上被同一个剂穿透是很有意义的。"
该报告继续说道:
"厚的木块仍然是透明的。两三厘米厚的松木板只吸收了很少的光线。一块15毫米厚的铝板仍然能够让X射线通过,但大大减少了发出的荧光。"
伦琴的发现立即产生了影响。在几个月内,医生们就开始用X射线来拍摄骨折。人们为X射线写诗,奇妙的X射线也成为各大展览中的热点。1901年,伦琴因其发现被授予第一个诺贝尔物理学奖:这是本故事中授予科学家们的众多诺贝尔奖中的第一个。
与此同时,在实验室里,物理学家们对X射线的性质感到困惑。它们究竟是波还是粒子?另一位德国物理学家马克斯•冯•劳厄推断,如果X射线是波,那么它们的波长可能与晶体中原子之间的规则空间相似,从而提供一种破译晶体结构的方法。
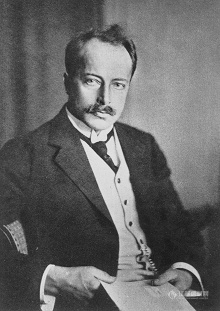
马克斯•冯•劳厄
因发现晶体中X射线的衍射现象
获得1914年诺贝尔物理学奖
这是一个非常重要的推断,它启蒙了X射线晶体学的发展,这种技术最终将使科学家们能够弄清蛋白质结晶的结构,但走到这一步却花了几十年。起初,X射线晶体学被应用于更小的分子。而在这之前,弄清楚该技术的原理也花费了很长的时间。
X射线晶体学时代
1912年夏天,数学家和物理学家威廉•亨利•布拉格和他的儿子,另一位物理学家劳伦斯•布拉格在英国的海边度假时听闻了冯•劳厄的一个讲座。 假期结束后,父子俩回到他们的大学,思考晶体对X射线的衍射问题。那年晚些时候,老布拉格给《自然》杂志写信。 他首先描述了通过发射X射线获得的显著效果。
"...细小的X射线流在通过晶体后并被发射到照相板时,有了显著效果。在照相板上发现了一种奇怪的斑点排列,其中一些斑点与中心斑点相距甚远,以至于它们必须被解释为大角度的散射....."
这些是被晶体中的原子散射的X射线,在胶片上形成了一个独特的斑点图案。
"这些斑点的位置似乎取决于简单的数字关系,以及晶体对入射流的呈现方式。我发现,当晶体(锌闪石)被放置到入射光线平行于晶体中立方体的边缘时,斑点的位置可以通过以下简单规则预测。假设原子以矩形方式排列,相邻原子产生的斑点距离为NA,其中A是相邻原子之间的距离,而N是一个整数......"
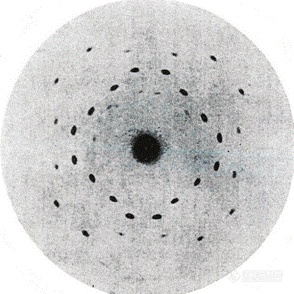
闪锌矿的X射线衍射照片
布拉格父子找到的数学规则提供了一种解释X射线产生的衍射图案的方法,从而揭示了晶体中原子的排列。
老布拉格设计了一种新的、更强大的方法来进行X射线衍射,发明了一种叫做X射线光谱仪的仪器。
1914年,冯•劳埃因其工作获得了诺贝尔奖。第二年,布拉格父子也得到了诺贝尔奖。当时只有25岁的小布拉格目前仍是最年轻的诺贝尔奖科学得主。

布拉格父子的布拉格定律
使科学家能够解析各种晶体的原子结构
获1915年诺贝尔物理奖
起初,布拉格的方法被应用于简单物质,如食盐、苯和糖分子,揭示了它们结构的秘密。许多科学家对像蛋白质结构这样复杂的东西能否用这种方法解析持怀疑态度。1936年,《生物化学年度评论》中讨论了X射线研究的进展。DOI: 10.1146/annurev.bi.05.070136.000431
"对于像糖和氨基酸这样的晶体物质,晶体内分子和原子的排列是能被完全解析的;但对于像多糖和蛋白质这样的物质,其中原子的排列不太规则,同时缺乏共同的晶体外观,我们不能指望完全解析它们。"
但几年后,即1939年,有人提出了一个更乐观的观点:作者指出,像X射线晶体学这样的技术,正在深刻地改变生物学。 当作者考虑到各种可能性时,他似乎相当兴奋。DOI: 10.1146/annurev.bi.08.070139.000553
"生物学迅速成为了一门分子科学,站在物理学和化学的肩膀上,生物学的前景广阔,人们迫切地想知道生物学会将人类带向何方。生物分子的结构成为了学界的主流追求。这些分子中最重要的是蛋白质,而蛋白质的结构解析也是最激动人心的。"
为了解决蛋白质问题,需要取得一些进展:寻找更好的蛋白质结晶方法,并用新的数学方法解析X射线的衍射图案;以及用计算机计算数据。 英国剑桥的科学家们正致力于应对所有这些挑战。
1953年,X射线晶体学获得了巨大突破:它被用于解析一个极其重要的结构, 并不是蛋白质,而是DNA,詹姆斯•沃森、弗朗西斯•克里克和莫里斯•威尔金斯为此获得了诺贝尔奖。

因解析DNA分子结构,以及一些相关研究
获1962年诺贝尔生理学或医学奖的三位得主
约翰•肯德鲁是沃森和克里克在剑桥的同事,作为一位非常积极的研究人员,他下决心解析肌红蛋白的结构。 肌红蛋白是在肌肉中储存氧的蛋白质。肯德鲁选择它的原因是尺寸:肌红蛋白并不大。 他的首要任务是培育适合被X射线解析的晶体。在尝试对马、鼠海豚、海豹、海豚、企鹅、乌龟和鲤鱼的肌红蛋白进行结晶后,他终于成功地培育出从抹香鲸肉中提取的肌红蛋白的美丽晶体。
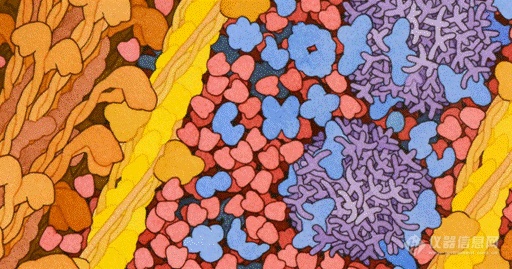
鲸鱼肌肉细胞内部的含氧肌红蛋白(红色)以及肌动蛋白和肌球蛋白纤维(黄色和棕色)。大量的蛋白质结构现在已经被确定,这是一个曾经无法想象的成就--为生命的生物化学提供了关键的见解,也为新型药物设计和其他发明提供了素材。
与此同时,肯德鲁的同事马克斯•佩鲁兹开发了一种向蛋白质分子添加"重"原子的技术。这些重原子并不会改变蛋白质的结构,但它们为比较不同角度的X射线照片提供了一个参考框架。经过多年的工作,肯德鲁仍然不知道肌红蛋白中每一个原子的精确位置,但他拥有了足够的信息,使得他可以制作一个蛋白质的三维模型。 这个模型并不像DNA的双螺旋那样漂亮;它看起来更像一根扭曲的香肠。

马克斯•佩鲁兹(左)与约翰•肯德鲁(右),
因发现血红蛋白分子结构
获1962年诺贝尔化学奖

肯德鲁和他的肌红蛋白3D模型
就在这个时候,理查德•亨德森加入了这个小组。直到今天,亨德森仍然在剑桥从事蛋白质结构解析的工作,并以开拓新技术而闻名,我们稍后将听到这些技术。但那时他刚刚毕业,正在寻找一个博士生职位。他还记得从爱丁堡到剑桥参观实验室的情景:

理查德•亨德森(右)
冷冻电镜三位开创者之一
于2017年获诺贝尔化学奖
理查德•亨德森: "他们有一个开放日,也就是星期六上午,他们周末居然也在工作!而在我去过的其他实验室,科学家都回家了,积极性也不够高。所以我当时就想:“哦,这是个非常好的实验室”。
亨德森加入了这个勤奋的剑桥团队。这项工作虽令人激动,但进展极慢。
理查德•亨德森: "在1959年,他们以非常高的分辨率得到了肌红蛋白的结构,1960年这项研究成果发表,之后的五年没有任何其他结构被发表,直到伦敦的皇家研究所发表了溶菌酶。然后在那之后,又过了三年才有了第三个结构。"
难以相信科学家们花了这么久的时间,为什么进展如此缓慢?一开始,X射线晶体学家研究的小分子包含不到50个原子,例如苯和糖环。相比之下,肌红蛋白,一种相对较小的蛋白质,包含了超过1000个原子。为了弄清这么多原子的位置,科学家不得不拍摄数百张X光照片,测量每张照片中每个光点的强度,并进行繁琐的计算。这是一个对数据处理的巨大挑战。
理查德•亨德森:"在我的博士论文中,我拍摄了大约300张这样的照片,一开始我必须亲自测量它们:我得把胶片放在胶片扫描仪里,一束光沿着一排斑点移动,然后每隔三分钟,就能得到一张印有痕迹的纸,上面可能有40个斑点。这时我需要用尺子在纸上测量斑点被衍射的强度,然后再把这个数字打到电脑纸上。而这仅仅是一排斑点的工作量。"
这是非常耗费时间的。研究人员逐渐渴望如何将这一过程的一部分自动化。他们发明了自动的X射线探测器和仪器,以加快斑点的测量。约翰•肯德鲁意识到,解析一个结构所需的计算可以由计算机来完成。幸运的是,剑桥大学数学实验室刚刚建成了第一批具有存储程序的电子计算机。它们被称为EDSAC,肯德鲁便学习了如何为它们编程。随着更强大的计算机的出现,X射线晶体学家们开始使用借助计算进行结构解析。亨德森回忆说,在20世纪60年代,他们前往伦敦,使用帝国学院的IBM 7090。剑桥大学的团队每天可以使用这台计算机1个小时。

最早的两台IBM7090之一
理查德•亨德森 :"于是,每天下午4点,一辆出租车就来了,带着一批研究人员和一箱箱打包好的电脑卡,送到剑桥的火车站。她们上了去伦敦的火车,上了地铁,在南肯辛顿站和帝国学院之间的隧道里带着所有这些沉重的盒子走上大约有一公里。然后从晚上7点到8点,剑桥大学的MRC程序在计算机上运行,操作程序的人大多数是被招募的年轻女性,在当时被我们称为 "计算机女孩",她们现在都是大师了。在当时,她们做的极其完美:数据会被打印好并带回来。第二天早上9点,每个研究员都会检视他们前一天的数据,并为下午4点的寄送工作做好准备"。

罗莎琳•富兰克林
“DNA之母”
世界公认的名誉诺奖得主
难怪这是个缓慢的工作! 女士们不仅要携带着成箱的数据穿越伦敦,她们还要抽出时间去做X射线晶体学解析。在伦敦国王学院,罗莎琳•富兰克林制作了DNA的X射线衍射图案。她的照片使沃森和克里克能够制作他们著名的模型。 在牛津,多萝西•霍奇金解决了青霉素的结构,后来又研究了其他重要的医学分子,包括维生素B12和胰岛素。她于1964年获得了诺贝尔奖,该领域的另一个诺贝尔奖!

多萝西•霍奇金
因解析青霉素、维生素B12等结构
获1964年诺贝尔化学奖
随着更多计算机的出现和计算能力的提高,更多的结构被解决了。计算机的持续进步是另一个主题,我们将回到这里。
对结构生物学这一新领域的兴奋之情日渐高昂。一些科学家认为,最终他们甚至不需要X射线晶体学便能弄清蛋白质的结构。
"人们甚至希望有一天可以完全从氨基酸序列中推断出构象。"
那是在1965年在《生物化学年鉴》上被提出的。 当时的想法是,如果你知道展开的蛋白质链中的氨基酸序列,那么通过遵循原子和分子如何相互作用的简单规则,你可以算出蛋白质链将如何折叠起来。DOI: 10.1146/annurev.bi.34.070165.001335
化学家克里斯蒂安•安芬森在1972年的诺贝尔奖演讲中重复了这一主张。
"我们对序列和三维结构之间相关性的大量数据积累,加上多肽链折叠的能量学理论的日益成熟,预测蛋白质构象的想法越来越现实了。"
这是一个有吸引力的想法。 如果可以用蛋白质折叠的规则对计算机进行编程,并输入氨基酸序列,那么结构可能在几天而不是几年内得到解决,为昂贵和耗时的实验方法提供一个替代方案。

克里斯蒂安•安芬森
因对核糖核酸酶的研究
获1972年诺贝尔化学奖
但现在还不行。为了实现这样的目标,生物学家首先必须通过使用和改进X射线晶体学来解决更多蛋白质的结构。并通过发明新的方法来观察蛋白质。而这项工作将产生更多的诺贝尔奖。
在1999年的最后几周,生物化学家罗杰•科恩伯格终于抵达了他十多年工作的顶点:他在斯坦福同步辐射实验室成功解析出他一直在研究的蛋白质的结构。

罗杰•科恩伯格
因对真核转录的分子基础所作的研究
获得2006年诺贝尔化学奖
罗杰•科恩伯格: "一开始的时候,我们远远不清楚是否可以做到。当然,这是让我们从也许永远不会成功的恐惧中解脱出来的原因,也是对最终结果感到振奋的原因。"
科恩伯格和他的团队已经解决了RNA聚合酶的结构。 这是一个巨大的成就,并且得到了另一个诺贝尔奖的认可。
罗杰•科恩伯格: "在我们解析这个结构的时候还是20年前,但迄今为止,这依然是通过X射线衍射法研究的最大和最具挑战性的结构。"
RNA聚合酶可以说是生物学中最重要的蛋白质。 这是一个挑战,因为它不是一个单一的蛋白质。该团队研究了来自酵母的RNA聚合酶,它实际上是由12种蛋白质组成的。更重要的是,它是一个有活动部件的分子机器。
罗杰•科恩伯格:"RNA聚合酶实际上是在读取遗传信息。因此,它负责决定哪些信息将被储存在基因组的DNA中,以指导每个生物的活动能力。简单如病毒,或复杂如人类,没有生物体不依赖RNA聚合酶而生存。"
为了解决RNA聚合酶的结构,科恩伯格和他的团队花了数年时间,为他们的蛋白质寻找合适的晶体和 "重 "原子。但这还不够。他们还需要更强烈的X射线束。
罗杰•科恩伯格: "X射线衍射的方法依赖于结构中各个原子的X射线光子散射--原子数量越多,为此必须记录的散射光子数量就越大。 如果光束强度太低,光子的数量就太少了,获得的信息也会因此不足。使用强度较高的光束,可以检测和记录更多的原子"。
这一难题的解决方案便是同步加速器。同步加速器是一种粒子加速器,它以极高的速度推动电子束,这些高速电子发出的X射线比传统的X射线要亮几百万倍。它本质上是伦琴发现X射线时使用的克鲁克司管的一个升级版本。
来自同步加速器的高强度X射线和不断提高的计算机能力相结合,使得像科恩伯格这样的科学家能够解决更复杂的蛋白质结构。
2007年至2019年,当我在《自然》杂志工作时,我们经常对结构生物学论文的数量开玩笑:似乎每周都有一个新的、重要的蛋白质结构发表。
但这是有限制的。X射线晶体学仍然很耗时,尽管不像早期那样耗时。 而且一些类型的蛋白质被证明很难或不可能结晶。
冷冻电镜时代
在世纪之交,一种新的技术进入了人们的视野。或者说,一种新的技术让科学家们对蛋白质有了新的认识。 该技术不使用X射线,而使用电子束。 这就是所谓的冷冻电镜。称之为冷冻,是因为蛋白质样品会被冻结。理查德•亨德森是最早使用该技术的人之一。

ThermoFisher Krios G4 冷冻透射电镜
理查德•亨德森: "当你照射任何东西时,无论是用X射线还是电子,除了得到一个美丽的图像外,分子实际上在被破坏,在一定的曝光后,分子已经失去了它的结构,所以在不得不因照射次数太多而停止之前,能得到的信息量是有限的,因为样品已经失活了。而事实证明,对于同样数量的有用信息,电子所造成的损害要比X射线小一千倍。"
对于冷冻电镜,蛋白质不需要是一个晶体。相反,它被从细胞中分离出来,然后冷冻到液氮温度或以下。 冷冻有助于保护蛋白质免受辐射损害。
亨德森将该技术应用于嵌入细胞膜的蛋白质。事实证明,这些大型蛋白质复合物极难通过X射线晶体学进行研究。 冷冻电镜变得非常流行。 在2000年代,科学家们谈到了一场 "冷冻电镜革命",许多人从X射线晶体学转向了这种新的、更快的技术。2017年,理查德-亨德森被授予诺贝尔奖。
与X射线晶体学一样,随着计算能力的提高,冷冻电镜成为一个更强大的工具,使更多的数据能够更快地被分析出来。
罗杰•科恩伯格:"我们不能低估计算能力的非凡进步所做出的贡献。从这个角度来看,就RNA聚合酶而言,当我们在1999年底记录RNA聚合酶的X射线衍射以解决其结构时,需要在制造商提供给我们的特制计算机上进行一个多月的计算。今天,同样的计算可以在几分钟内在一台笔记本电脑上完成"。
计算机一直是X射线晶体学和冷冻电镜成功的关键。 现在我们是否可以完全摒弃这些实验技术,而仅仅使用计算能力来预测蛋白质的结构?还记得克里斯蒂安•安芬森在其诺贝尔演讲中提出的挑战吗?
"...使预测蛋白质构象的想法更加现实。"
AlphaFold的盛大登场
为了预测一串氨基酸将如何折叠起来,科学家们使用了一个叫做"自由能"的概念。自由能使蛋白质不稳定。我们的想法是,氨基酸将以这样一种方式折叠起来,以使自由能最小化。
理查德•亨德森: "你可以通过能量最小化来做结构,最多可达60或70个氨基酸。所以美国西雅图的大卫•贝克小组在这方面做得特别好。但是一旦你想尝试1000个氨基酸左右的蛋白质,答案就会迅速变得遥不可及。"
因此,这项技术对于弄清一个蛋白质的一小部分,也许是一个重要的侧链,是有效的。但是对于有数百或数千个氨基酸的整个蛋白质,科学家们采用了不同的方法。他们并不是要求计算机从第一原理中找出结构,而是利用已知的蛋白质结构数据库训练一种算法。 这就是谷歌的人工智能实验室最近所做的,他们的蛋白质预测算法AlphaFold在2020年的一次比赛中超过了所有其他的算法。
罗杰•科恩伯格:"AlphaFold的基础确实来自于蛋白质结晶学的悠久历史和它的巨大成功,以及已经解析并存入蛋白质数据库的巨量的结构。AlphaFold的不同之处可能在于,其公司背景下大量的人工智能专家,这远远超出了任何个人学术研究者所能做到的,他们所拥有的计算能力,来自于分布在全球各地的顶级计算中心。从某种程度上说,他们除了将他们所拥有的资源用于解决一个经过充分研究的、现在看来已经解决的问题之外,也没做太多贡献嘛。
科恩伯格当然认识到像AlphaFold这样的蛋白质预测程序在预测非常多的蛋白质结构方面的潜力,包括那些以前没有被解决的蛋白质。
罗杰•科恩伯格: "而如果预测的数量足够多,那么AlphaFold对生命科学,尤其是生物学的影响是深远的。"
了解蛋白质的结构本身就很有启发性和满足感,但它也使我们能够设计出更好的药物,最近对新冠病毒的研究就表明了这一点。 称为蛋白酶的酶帮助病毒进行复制,其中也包括冠状病毒。所以它们一直是药物的靶点。
罗杰•科恩伯格: "针对蛋白酶的药物已经用X射线衍射法进行了改进,通过观察药物与其靶点的结合,然后看看如何改进药物的结构以获得对靶点的更好效果。"
X射线晶体学和冷冻电镜已经非常成功,理查德•亨德森认为我们已经接近解析所有蛋白质的结构了。
理查德•亨德森: "我们基本上已经通过实验确定了几乎所有蛋白质的结构--可能是其中的一半,可能是其中的四分之三。而如果不是你感兴趣的蛋白质,例如一个瞄准病毒的药物,就会有一些同源结构。"
实验技术和人工智能的结合是否会如此成功,以至于让结构生物学家失业?亨德森记得,多年前科学家们有一长串他们想解决的蛋白质结构清单。
理查德•亨德森:"我记得我们年轻的时候,在会议上,每个人都在研究一种蛋白质,然后他们会说 ‘我们接下来应该研究什么?’ 每个人都会有自己的预期名单。我还记得我的名单,有核糖体、肌动蛋白、肌球蛋白、ATP酶、氧化还原酶、细菌素,所有这些结构都是几十年前解决的。所以现在如果你问人们什么结构,他们会告诉你他们正在研究的那个,但他们已经没有一个大的名单了。"
现在他们已经把大多数蛋白质从名单上勾掉了,那么结构生物学家还能做什么?
理查德•亨德森: "一旦你知道了所有东西的结构,并且你已经有了一种激活剂或抑制剂的药物,之后你总是可以发明东西,尽管这个话题存在一些争议。有这样一个思路,即从所谓的发现科学到发明科学,在那里你为一些东西申请专利并开发一种新的化合物,这可能是一种新的蛋白质。"
亨德森正在谈论的是合成生物学,这是一个相对较新的领域,在这个领域中,科学家们试图制造新型的氨基酸和蛋白质,对遗传密码进行设计,或从头开始构建简单的细胞。
生物学家们似乎有很多乐观的看法。
“分子生物学家孤军奋战的日子已经一去不复返了。实验室、研究团队和国家正在进行前所未有的合作,以解决那些紧迫的问题,从污染到能源到大流行。”
这句振奋人心的话出自2021年的《生物物理学年度评论》。DOI: 10.1146/annurev-biophys-091720-102019
随着基因编辑、结构解析等令人眼花缭乱的方法改进,以及AI计算的预测可靠性不断提高,科学家们完全有能力解决科学、健康和工业方面的许多重要问题。
[来源:水木未来]
 王策研究员团队招聘工程师岗位需求
王策研究员团队招聘工程师岗位需求
2022.06.02


中科院应用物理所发明一种用于X射线共振非弹性散射光谱仪的自动控制系统
2024.03.27

2024.03.22
2024.03.13
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~