







山东大学药学院教授,博士生导师,齐鲁青年学者,山东省杰出青年基金获得者。从事抗病毒、抗痛风创新药物研究。先后承担国家自然科学基金、山东省重大科技创新工程等项目10余项,发现了一系列具有开发前景的先导化


上一期,主要介绍了抗病毒药物研究的共同靶标相关内容,本文将继续从抗病毒药物研究的共性环节、 抗病毒药物研究的通用策略方面进行阐述与探讨。
2 抗病毒药物研究的共性环节
2.1 靶向病毒膜融合过程
在包膜病毒的复制周期中,需要病毒和细胞膜融合才能进入细胞。病毒通过受体识别以及膜融合或内吞等步骤进入靶细胞是首要环节。 在该过程中, 介导病毒与细胞受体识别的病毒表面蛋白(surface protein,SP)的 受体结合亚基、介导膜融合的病毒 SP 跨膜亚基、细胞上的受体、切割 SP 所需 的宿主细胞蛋白酶等均是常见的抗病毒靶点[30]。
CoV 是 I 型包膜病毒,位于包膜表面的 S 蛋白介导病毒入侵宿主细胞过程,包括受体结合及膜融合等步骤。在膜融合的过程中,形成六螺旋束(six-helix bundle,6-HB)是一个非常保守且关键的机制。目前发现感染人的冠状病毒(HCoV) 中,其 HR1 (heptad repeat- 1)三聚体与 HR2 (heptad repeat-2)作用的表面氨基 酸大都为保守的疏水性氨基酸,因此 HR1 是 CoV S 蛋白上非常保守的药物靶点[30]。
2018 年,姜世勃与刘克良团队发现靶向病毒融合蛋白的α-螺旋脂肽具有广 谱抗 MERS-CoV(EC50 = 0.11 μmol ·L-1 ,CC50 > 100 μmol ·L- 1 )及甲型流感病 毒(influenza A virus,IAV)活性(H1N1 EC50 = 1.73 μmol ·L- 1,CC50 > 100 μmol ·L-1)[31] 。近日,复旦大学姜世勃/陆路团队与上海科技大学杨贝/Wilson 团队合作, 通过系统地筛选与结构修饰,发现了能够广谱抑制多种 HCoV 感染的多肽类融 合抑制剂 EK1 及脂肽 EK1C4,并揭示了其作用靶点与分子机制[32,33] 。该研究同时证明了 CoV 刺突蛋白的 HR1 区域是一个重要且保守的药物靶点, 为后续广谱抗 HCoVs 药物研发提供了思路。
2.2 核酸复制
病毒进入靶细胞后, 病毒基因组 DNA/RNA 被释放到细胞中, 作 为模板指导病毒蛋白的合成。 RNA 病毒的基因组复制需要 RNA 依赖的 RNA 或 DNA 聚合酶(RNA-dependent RNA polymerase ,RdRp ;RNA-dependent DNA polymerase,RdDp),这类酶在人体中不存在且相对保守,成为抗病毒药物研发 的重要靶点。不同病毒聚合酶的结构和功能有许多相似之处,因此针对某一种病 毒聚合酶设计的抑制剂往往对其他病毒也有较好的抑制作用[34,35]。
自从 1962 年世界第一个抗病毒药物碘苷被批准上市以来,全球已有众多抗病毒核苷类似物药物获批上市。 在病毒疫情暴发时, 核苷类药物往往成为人们的首选。 早在 2014 年西非暴发的大规模 EBOV 疫情中,部分核苷类似物药物在临床阶段均表现出一定的抗病毒活性——例如日本富山化学的新型抗流感药物法匹拉韦(favipiravir)以及瑞德西韦(remdesivir,图 3),特别是瑞德西韦目前已经完成 EBOV 的试验药物 III 期临床试验。随着研究的深入, 瑞德西韦被发现具有广谱抗病毒活性, 涵盖丝状病毒科病毒(EBOV 和马尔堡病毒等) 、沙粒病毒科病毒(拉沙病毒和胡宁病毒等)、 CoV 科病毒(SARS 、MERS 和猫科冠状病 毒等)和黄病毒科病毒(ZIKV 等) 等,因此也成为了治疗 SARS-CoV-2 的首个 小分子药物[36]。阿兹夫定(azvudine ,FNC,图 3)具有抑制 HIV 、丙型肝炎病毒(hepatitis C virus ,HCV)、肠道病毒 71 型等 RNA 病毒复制的功能,2021 年 7 月, 已在 中国上市用于治疗高病毒载量的成年 HIV- 1 感染者。此外, 阿兹夫定在新冠肺炎 临床研究中也取得显著效果[37]。
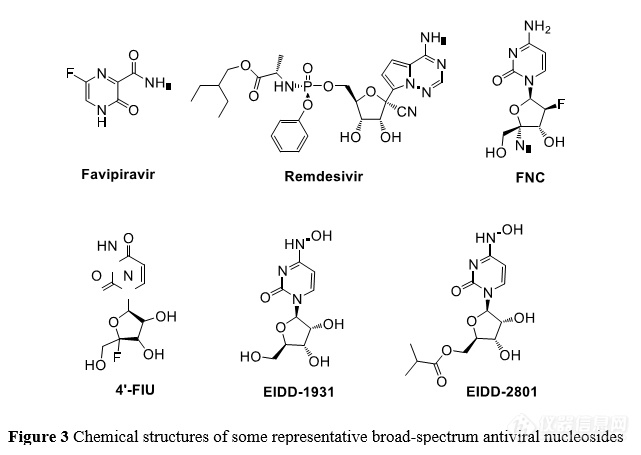
瑞德西韦进入临床研究后,其抗病毒效果与预期有一定差距,原因可能是: 疾病的病程及动物模型与人体药动学差异、药物之间的相互作用和个体差异。 此 外, CoV 特有的“复制矫正”(proofreading)机制,即将掺入 RNA 产物链的核 苷药物“剔除”,进而逃逸核苷类抗病毒药物的抑制, 可能是此类抗病毒药物效 果不佳的一个重要原因[38]。
近日,美国乔治亚州立大学的研究人员报道了一种抑制呼吸道合胞病毒 (respiratory syncytial virus,RSV)、相关 RNA 病毒和 SARS-CoV-2 的广谱抗病 毒核苷分子——4'-氟尿啶(4'-FlU,EIDD-2749,图3),它在细胞和分化良好的 人气道上皮中具有高选择性指数。RSV 和 SARS-CoV-2 体外 RdRp 聚合酶抑制显 示掺入后 i 或 i+3/4 位出现转录暂停。每日一次的口服治疗对 RSV 感染的小鼠或SARS-CoV-2 感染的雪貂非常有效[39]。
EIDD- 1931(即NHC,图3),是一种核苷酸类似物。 NHC 上的肟形式模仿 尿苷, 与腺苷匹配, 而另一个互变异构体模仿胞苷, 与鸟苷匹配。它的原理是通 过给病毒 RNA 引入大量的突变,“瘫痪”病毒的基因组,进而导致遗传信 息大量错误使病毒无法存活[40-45]。目前仅有 NHC 及其衍生物能够躲避病毒复制 矫正机制的干扰。 在体外模型中,NHC 对 RSV、流感病毒、CHIKF、EBOV、委内瑞拉马脑炎病毒、东部马脑炎病毒、MERS-CoV、SARS-CoV 以及 SARS-CoV- 2(多数变异毒株)等具有广谱抗病毒活性,无明显细胞毒性[46-48];但在食蟹猕 猴中口服生物利用度较差。 EIDD-2801(molnupiravir,图 3)是 NHC 的异丙 酯前体药物,旨在改善 NHC 体内药代动力学以及在人类和非人类灵长类动物的 口服生物利用度。Molnupiravir 在雪貂和非人类灵长类动物中具有较好的口服 生物利用度。对感染流感病毒的雪貂进行 molnupiravir 口服治疗,可将大流行 流感和季节性甲型流感的病毒载量降低数个数量级, 并可减轻发热、呼吸道上皮 组织病变和炎症[39,49] 。Molnupiravir 使轻 中度新冠肺炎患者的住院率或死亡风险降低了约 50% 。2021 年 11 月 4 日, 英国药品和保健产品监管局(MHRA)已在英国批准 molnupiravir 上市,用于治疗重症和住院风险较高的轻至中度新冠肺炎成人患者( http:// www.21jingji.com/article/20211104/herald/f0b15254b2fcc17b70b26b839e32b1c6.html)。
除了 molnupiravir 之外,法匹拉韦也可以掺入到病毒 RNA 链,诱发病毒的基因组突变, 并通过累积这种突变,导致病毒失活或失去感染能力[50]。总之, 靶向病毒最为保守的 RdRp 是一种开发广谱抗病毒药物非常有前景的策略。 目前处于临床研究阶段的多个新冠病毒 RdRp 抑制剂类药物结构差异较大,靶向 RdRp 影响病毒复制的机制也不尽相同,特别需要从结构生物学角度解析抑制剂与 RdRp 复合物结构,明确作用机制,为精准开发高效特异的、以 RdRp 为靶标的广谱抗病毒药物提供理论基础。
2.3 核糖体移码 (ribosomal frameshifting)
在正常细胞内,核糖体(ribosome) 以 3 个碱基为单位(即密码子codon)由 5 到 3 端单向、连续地读取 mRNA 中的 遗传信息, 合成蛋白质[51]。由于体积的限制, 病毒的基因组通常较小, 所携带的 遗传信息较少。 包括 SARS-CoV-2 在内的各种 RNA 病毒在复制过程中会利用一 些特殊的机制调控病毒基因表达,扩展其所携带遗传信息的利用率, 其中一种常 用的机制是称为程序性“移码”的蛋白质合成重编码机制(programmed ribosomal frameshifting,PRF)[52-54]。即核糖体不遵循常规读取 3 个字母的步骤, 而是会漏 掉一两个 RNA 字母。核糖体发生的这种错位被称为“移码”,会导致核糖体错误读取遗传密码。例如, SARS-CoV-2 严重依赖其 RNA 折叠引起的“移码”来 合成蛋白[52-54]。理论上, 任何通过靶向 RNA 折叠来抑制“移码”的化合物都可能作为一种 治疗感染的药物。 “移码”现象在人类自身基因的表达中极为罕见, 因此靶向读 码框“移码”是一个可行的抗病毒策略。
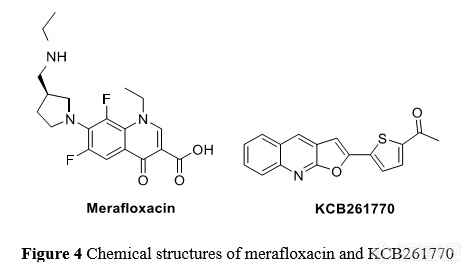
研究者通过运用荧光蛋白报告基因系统联合高通量筛选技术, 鉴定出了一个可以高效抑制读码框“移码”的小分子化合物美拉沙星(merafloxacin,图 4),它能在细胞水平(Vero E6 细胞)显著抑制 SARS-CoV-2 复制[55] 。美拉沙星抑制读码框“移码”的机制尚不清楚,可能直接作用于核糖体与病毒 RNA 的结合,或者抑制内源性调控蛋白。
近期, Ahn 等[56]从9689 个小分子中发现了一种新型的呋喃[2,3-b]喹啉类化合物 KCB261770(图 4),它能够抑制 MERS-CoV 的“移码”和细胞水平 MERS-CoV 的复制。此外,该化合物还能抑制 SARS-CoV 和 SARS-CoV-2 的“移码”,具有广谱抗病毒活性。
3 抗病毒药物研究的通用策略
3.1 细胞纳米“海绵”
SARS-CoV-2 的细胞结合和进入是由其刺突糖蛋白(S 蛋 白)介导的, S 蛋白不仅与人类血管紧张素转换酶 2(angiotensin convertingenzyme II,ACE2)受体结合, 还与肝素等糖胺聚糖结合。 近期研究发现细胞膜包被的纳 米颗粒(细胞纳米“海绵”)模拟宿主细胞,通过自然的细胞受体吸引和中和 SARS-CoV-2 ,可作为一种广谱抗病毒策略,还发现增加细胞纳米海绵表面肝素密度可以提高抗 SARS-CoV-2 作用[57]。
3.2 抗体募集/杀死细胞
2009 年, 研究者设计了一种新的小分子 ARM-H,有可 能通过两种机制抑制 HIV:①通过招募抗体到 gp120 表达病毒颗粒和受感染的人 类细胞, 从而增强其吸收和人类免疫系统的破坏; ②通过结合病毒糖蛋白 gp120, 抑制其与人 CD4 结合和防止病毒进入。研究人员通过实验证明了 ARM-H 能够 同时结合 gp120 和抗 2,4-二硝基苯抗体(DNP ,存在于人血液中) [58]。抗体、 ARM-H 和 gp120 之间形成的三元复合物具有免疫活性,导致补体介导的表达 env 细胞的破坏。此外, ARM-H 可以阻止病毒进入人类 T 细胞, 因此应该能够通过两种相互强化的机制(抑制病毒进入和抗体介导的杀伤) 来抑制病毒复制。这些研究表明, 通过抗体招募的小分子具有可行的抗艾滋病毒活性, 并有可能启动 HIV 治疗的新范式。
2020 年,Low 团队通过将神经氨酸酶抑制剂扎那米韦与高免疫原性半抗原2,4-二硝基苯(DNP)结合, 设计并合成了一种双功能小分子, DNP 专门针对游离病毒和病毒感染细胞的表面。该类分子抑制病毒释放的同时, 通过免疫介导清除游离病毒和病毒感染的细胞,对感染 100 倍 MLD50 病毒的小鼠进行鼻内或腹腔注射单剂量药物,可以根除 A 型和 B 型流感毒株的晚期感染[59]。
近期研究发现, 抗生素分子 concanamycin A 可让免疫系统杀死被 HIV 感染的人体细胞[60]。DDX3 抑制剂可以让 HIV- 1 感染的细胞选择性死亡,进而耗竭病毒潜伏库[61],为根治艾滋病提供了新思路。
3.3 多价结合——靶向病毒表面的非特异作用
细胞表面的糖链是细菌、病毒、 免疫细胞的接触点。病毒进入宿主细胞的过程涉及与不同细胞表面受体稳定但短 暂的多价相互作用。几种病毒的最初接触始于在细胞表面附着硫酸肝素蛋白聚糖, 最终导致病毒进入。已经开发出的广谱抗病毒药物如肝素或类肝素材料模拟细胞 表面糖负责最初的病毒附着, 如硫酸乙酰肝素(heparan sulfate)。高磺化金纳米 粒子具有广谱杀病毒性能。然而, 由于未知的清除机制和潜在的长期毒性是金纳 米颗粒成药性的不利因素。环糊精(cyclodextrins,CDs)是天然的葡萄糖衍生物, 具有一种刚性的环状结构,由α(1-4)连接的吡喃葡萄糖组成。磺化环糊精对HIV 具有可逆及特异的抑制活性。最近,英国曼彻斯特大学研究小组对天然葡萄糖衍生物环糊精进行磺化修饰 开发出了一种能够破坏病毒的外壳且对耐药性病毒也有效的新的广谱抗病毒分 子,其有望治疗 HSV 、RSV 、HCV 、HIV 和 ZIKV 等多种病毒感染[62]。基于多价相互作用的抗病毒药物,如柔性纳米凝胶,通过干扰病毒颗粒和阻 断与细胞受体的初始相互作用已经成为广谱抗病毒药物研究的有效策略。
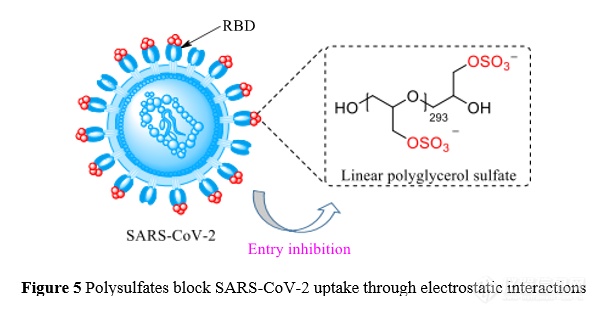
负电荷多硫酸盐可以结合 SARS-CoV-2 受体结合区域( receptor binding domain,RBD)上的正电荷斑块(patches),阻止病毒与宿主细胞相互作用进而 抑制感染。 与肝素相比, 合成的线型聚甘油硫酸酯(linear polyglycerol sulfate , 图 5)的抗病毒活性更高,且抗凝血活性较低[63]。巨大球状多价糖富勒烯、糖基化碳纳米管能抑制 EBOV、ZIKV 和 DENV 的 感染, 活性可达皮摩尔水平[64-66]。多价唾液化(sialylated)聚甘油对甲型流感毒 株(含耐药株)具有广谱抑制活性[67]。
3.4 基于拓扑匹配的药物设计
IAV 颗粒表面均匀分布血凝素和神经氨酸酶。近 期,Nie 等[68]运用拓扑匹配(topology-matching design)的药物设计理念, 设计了 一种纳米颗粒抑制剂(纳米抑制剂, 图 6A), 它与 IAV 病毒粒子的纳米拓扑结 构匹配,对血凝素和神经氨酸酶具有多价抑制作用, 可以在细胞外中和病毒颗粒, 阻断其附着和进入宿主细胞。病毒复制显著减少了 6 个数量级, 即使在感染24 h 后使用, 仍能达到 99.999%以上的抑制作用。 2020 年, 该团队用类似的思路, 发现了与 IAV 表面空间匹配的尖峰纳米抑制剂(spiky nanoinhibitor,图 6B),峰 值在 5~10 nm 之间的纳米结构与病毒粒子的结合明显优于平滑的纳米粒子,获 得的红细胞膜(erythrocytemembrane,EM)包覆的纳米结构可以有效地阻止 IAV 病毒粒子与细胞的结合, 并抑制随后的感染。 EM 包覆的纳米结构在细胞无毒剂 量下降低了>99.9%的病毒复制[69]。
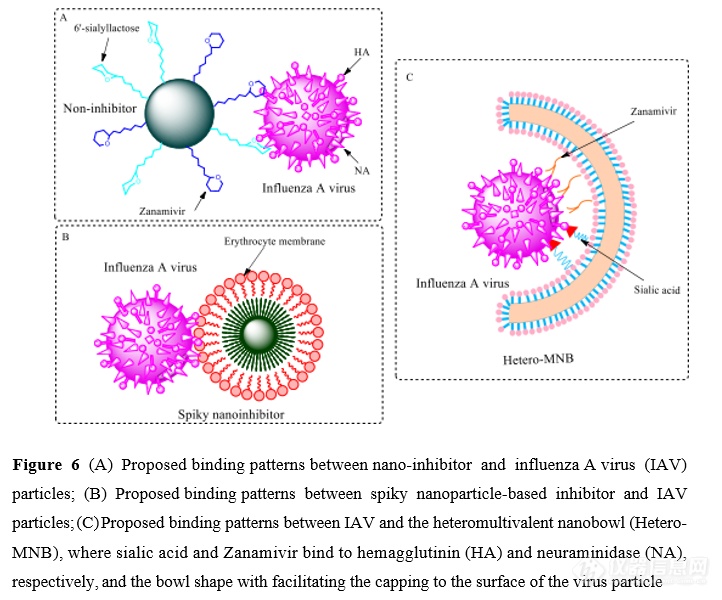
2021 年,该课题组运用拓扑匹配设计理念,基于宿主红细胞膜设计了与病 毒状球面相匹配的碗状纳米结构(“纳米碗”,heteromultivalent nanobowl,Hetero- MNB,图 6C),可作为广谱病毒进入抑制剂。与传统的同多价抑制剂不同, 该 类异多价抑制剂由于协同多价效应和拓扑匹配的形状,其半最大抑制浓度为 32.4 ± 13.7 μg ·mL- 1 。在不引起细胞毒性的剂量下,可减少>99.99%的病毒传播。由 于在 SARS-CoV-2 的 S 蛋白上也发现了多个结合位点, 因此, 异多价纳米结构有 望为开发一种有效的预防 CoV 感染提供新思路[70]。
3.5 靶向病毒核酸
病毒 RNA 会折叠成复杂的 RNA 结构,在病毒的生命过程调 控中起重要作用,为开发抗病毒疗法的靶标提供了新的机会。很多研究已经发现 多种病毒的非编码区 RNA 结构可以调控病毒的翻译、复制以及稳定性,它们通 常在相关病毒中高度保守[71-73] 。例如,黄病毒中 5'UTR 和 3'UTR 之间的分子内 RNA-RNA 相互作用促进基因组环化并帮助协调复制;HCV 5'UTR 内部核糖体 进入位点的结构对于翻译至关重要;并且 ZIKV 和其他黄病毒的 3'UTR 中的多 假性结构已显示出使 RNA 外切核酸酶 Xrn1 失速,从而产生了亚基因组黄病毒 RNA,有助于病毒逃避细胞抗病毒过程[74,75]。
需要指出的是,与蛋白质类药物靶标相比, RNA 结构的动态性与复杂性为药物筛选增加了困难, 往往需要借助于高通量筛选。例如, SARS-CoV-2 的 RNA基因组含有 15 个独立的 RNA 调节元件。 研究者通过基于 NMR 的片段筛选, 从含有 768 个小分子的片段库中发现了 SARS-CoV-2 的 RNA 配体[76]。
近日,新加坡科学家使用多种 RNA 分子结构探测方法以及 RNA-RNA 相互作用分析技术, 解析了 SARS-CoV-2 基因组 RNA 的二级结构信息和病毒-宿主之间的 RNA 相互作用;同时发现在 SARS-CoV-2 基因组 RNA 上广泛存在 2'-O- 甲基化修饰, 推测可能有助于新冠病毒逃避宿主免疫攻击,揭示病毒逃避宿主免疫的潜在机制[77]。
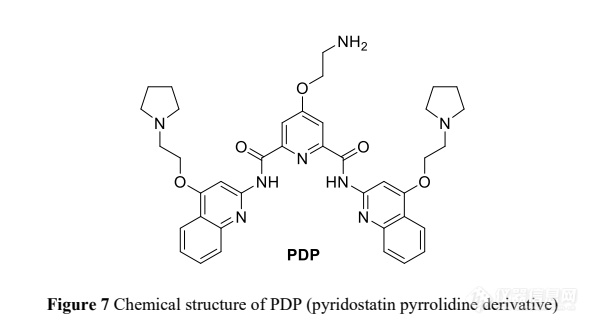
G- 四链体是由 G-quartet 层叠而形成的 DNA 或 RNA 四链构象, 是最重要的非典型核酸二级结构之一, 因其独特的构象、重要的基因功能和生物学意义而备受关注,是很有前途的药物靶点[78]。中国科学院长春应用化学研究所曲晓刚团队使用多种生物物理技术和分子生物学技术,发现 SARS-CoV-2 基因组中存在 G-四链体结构 RNA ,证实 SARS-CoV-2 中的富 G 序列(位于 SARS-CoV-2 核衣壳 磷酸化蛋白 N 编码序列区域)可以在活细胞中折叠成稳定的单分子 RNA G- 四 链体结构。该 G- 四链体 RNA 可以被 G- 四链体特异结合配体 PDP(图 7)等识别 并稳定,进而影响 G- 四链体 RNA 的生物功能。因此,该 G- 四链体可能是抗 SARS- CoV-2 药物新靶点[79]
3.6 超分子配位化学
病毒基因组的未翻译区域(the untranslatedregions,UTR) 包含多种保守和动态结构,这些功能性的 RNA 结构对病毒复制至关重要,为广 谱抗病毒研发提供了药物靶点。 然而, 计算机对接筛选对于具有内在柔性特征的 RNA 结构仍存在较大挑战。 研究者将体外 RNA 分析与分子动力学模拟相结合, 构建 SARS-CoV-2 基因组 5'UTR 关键区域结构和动力学的3D 模型,进而确定了 圆柱形金属超分子螺旋([Ni2L3]4+ 、[Fe2L3]4+)对这种 RNA 结构的约束。这些纳 米尺寸的金属超分子螺旋分子可以与核酸结合,并且在细胞水平具有抗 SARS- CoV-2 等病毒复制作用[80,81]。
3.7 核糖核酸酶靶向嵌合体
核糖核酸酶靶向嵌合体( ribonuclease targeting chimeras,RIBOTACs)是降解 RNA 的新策略, RIBOTACs 基于小分子选择性结 合 RNA(特别是形成复杂的二级和三级结构的RNA), 进而激活核糖核酸酶 L(ribonuclease L,RNase L)。RNase L 是一种在脊椎动物细胞中广泛表达、具有单链 RNA 内切活性的蛋白质。该技术已被用于靶向 SARS-CoV-2 的 RNA 基因组,抑制 RNA 的移码,并且募集细胞核糖核酸酶彻底杀死 SARS-CoV-2。该策略有望用于抗其他病毒药物研发[82]。
3.8 反义核酸技术
反义核酸(antisense oligonucleotides)可以序列特异性地与靶 标 RNA 结合,实现高效的寻靶和抑制活性。近期,北京大学的研究人员构建了 一类靶向 SARS-CoV-2 包膜蛋白 RNA(E-RNA)和刺突蛋白 RNA(S-RNA)的 单链嵌合反义寡聚核苷酸, 通过在 2'甲氧基修饰的反义核酸序列 5'端缀合 RNase L 招募基团 2-5A,可实现有效的病毒 RNA 降解并抑制病毒增殖[83]
3.9 核酸适配体技术
核酸适配体(nucleic acid aptamers)是一小段经体外筛选 得到的寡核苷酸序列(单链 DNA 或 RNA 分子),能与相应的配体进行高亲和 力和强特异性的结合[84] 。适配体已经在抗病毒药物开发方面 (含 SARS-CoV-2) 展现出巨大的潜力[85-87]。
3.10 基于蛋白自组装的配体发现
动态组合化学( dynamic combinatorial chemistry,DCC)融合了组合化学和分子自组装过程两个领域的特点, 开辟了使 用相对较小的库组装很多的物质的途径, 而不必单独合成每一个物质。早在 2003 年,研究者通过基于点击化学的蛋白模板诱导片段组装, 发现了高活性的 HIV 蛋 白酶抑制剂[88]。2008 年,研究者通过动态连接筛选(dynamic link screening,DLS) 开发了一种潜在的抗 SARS 药物,其亲核片段通过与醛抑制剂的可逆反应将亲核 片段指向蛋白质的活性位点。它们的抑制作用可以通过与荧光酶底物的竞争检测 到。有了这一概念, 与活性位点特异性结合的低亲和力片段在功能酶分析中迅速 被识别出来[89]。2021 年,基于 Knoevenagel 反应的蛋白模板诱导片段组装策略用 于 Enterovirus D68 蛋白酶抑制剂的发现[90]。总之,动态组合化学在抗病毒药物 发现领域仍具有广阔的前景。
参考文献,点击查看《浅谈广谱抗病毒药物研发的普适性策略(一)》文末。
[来源:仪器信息网] 未经授权不得转载

2021.07.21
2021.12.31

2021.08.11

2024.08.05

关注!国家标准《纳米技术 动态光散射法粒度分析仪技术要求》正式发布
2024.08.02

3i流式新品|盛涵生物Curiox层流洗涤新品,升级助力流式样本前处理
2024.08.02
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~