









双特异性T细胞衔接器(bispecific T-cell engager,BiTE)是一种能够同时结合肿瘤相关抗原(tumor associate antigen, TAA)和 CD3 复合物的抗体类抗肿瘤药物。传统的技术是通过靶向TAA 来实现肿瘤内T细胞上CD3信号通路的再激活,从而达到杀伤肿瘤细胞的效果【1-3】。自上世纪90年代起,针对双特异性抗体疗法的设计和改进已经有了近30年的研究。然而,目前为止只有安进公司(Amgen)的Blinatumomab (针对CD19 的 BiTE) 被FDA 批准用于治疗复发或难治性急性淋巴细胞白血病 (acute lymphoblastic leukemia, ALL)【4,5】。以细胞因子风暴(cytokine storm)为主的副作用限制了其他针对实体瘤的BiTE所进行的临床测试。仅在2021年,安进公司就暂停了4种 BiTE的一期临床试验, 所涉及的抗原包括FLT3, BCMA, CD33和EGFRVIII。除了严重的副作用之外,半衰期短,TAA特异性低以及抑制性肿瘤微环境都是限制BiTE在体内发挥抗肿瘤效应的重要因素。因此,提升双特异性抗体的有效性并降低其副作用能够极大的促进该疗法在临床的广泛应用。
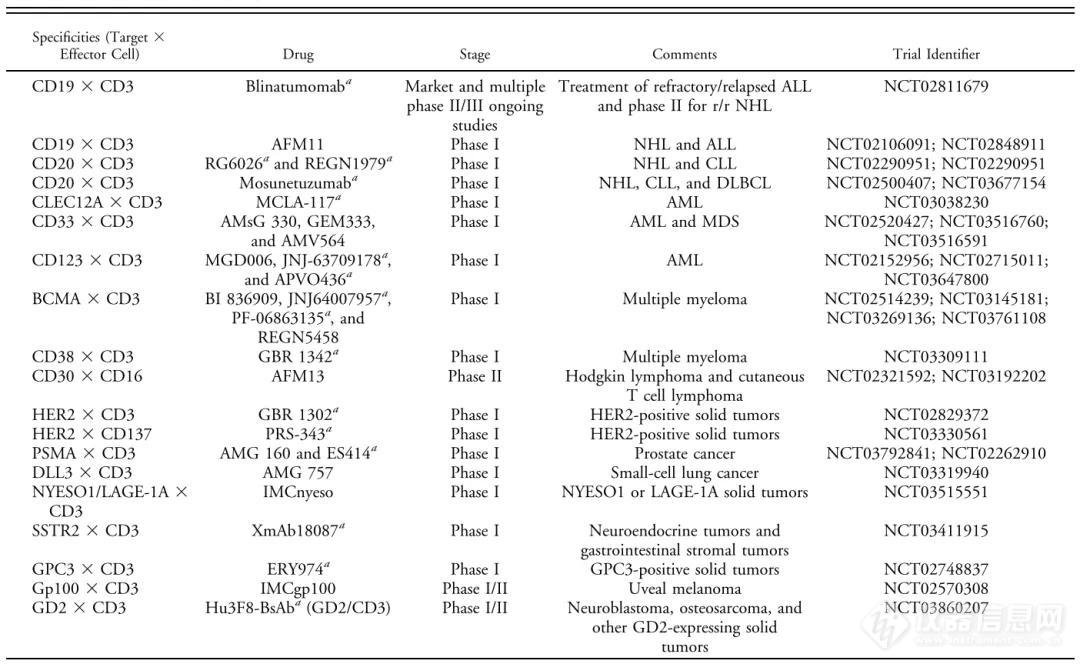
图1 正在以单药形式进行临床测试的双特异性抗体
2021年11月1日,美国德克萨斯大学西南医学中心傅阳心团队在Nature Biomedical Engineering杂志上发表了题为Rejuvenation of tumour-specific T cells through bispecific antibodies targeting PD-L1 on dendritic cells的文章。该研究构建了靶向免疫检验点PD-L1 和CD3ε的双特异性抗体 (PD-L1xCD3)。在多种小鼠肿瘤模型上,PD-L1xCD3比传统的TAA靶向性双特异性抗体(ErbxCD3)展现出了更强的抗肿瘤效果。利用多种条件性敲除小鼠表明,PD-L1xCD3在体内主要结合树突状细胞(dendritic cells, DCs)表达的PD-L1而并非肿瘤细胞或巨噬细胞表达的PD-L1,进而重新激活了肿瘤内部的抗原特异性CD8 T 细胞免疫反应来达到治疗肿瘤的效果。进一步的机制研究表明,PD-L1xCD3与DC上PD-L1的结合,促进了共刺激分子B7和CD28之间的相互作用,从而避免T细胞发生激活诱导的细胞死亡(activation-induced cell death),进而实现肿瘤内T 细胞长效激活的效果。
研究团队首先在体外验证了制备的PD-L1xCD3能够同时结合PD-L1和CD3ε,并能够以PD-L1依赖的方式刺激T细胞活化并分泌IFNγ,杀伤肿瘤细胞。体内实验进一步表明PD-L1xCD3能够在MC38模型上产生良好的抗肿瘤效果并优于anti-PD-L1和anti-CD3的联合治疗,从而表明PD-L1xCD3具有其独特的作用机制。通过细胞过继转移和删除实验表明,PD-L1xCD3能够诱导抗原特异性CD8 T细胞反应并产生免疫记忆,而这一现象依赖于肿瘤内预存的CD8 T 细胞。
为了研究PD-L1xCD3是否比传统的TAAxCD3具有更强的抗肿瘤效果,作者们制备了靶向TAA的ErbxCD3双特异性抗体,并通过体外实验证明其具有与PDL1xCD3相似的亲和力,激活T细胞能力和肿瘤细胞杀伤能力。然而体内实验却表明,在相同剂量下PD-L1xCD3比ErbxCD3展现出了更强的抗肿瘤效果,并且这一现象在TC1,B16F10,TuBo等多种模型上均得到了验证,提示靶向免疫检验点PD-L1的双特异性抗体比靶向TAA具有更好的激活T细胞能力。
为了进一步探究产生这种区别的本质原因,作者们首先通过在不同的细胞上敲除了PD-L1来探寻哪种细胞表达的PD-L1对于PD-L1xCD3在体内的抗肿瘤效果是必须的。出乎意料的是,尽管肿瘤细胞本身是最主要的PD-L1阳性的细胞,但敲除肿瘤细胞上的PD-L1并没有影响PD-L1xCD3的治疗效果。与之相反,敲除宿主细胞上的PD-L1却彻底废除了PD-L1xCD3的治疗效果。通过条件性PD-L1敲除小鼠实验表明,树突状细胞而并非巨噬细胞表达的PD-L1起到了至关重要的作用。作者进一步利用Batf3敲除小鼠确认树突状细胞亚群(cDC1)对于PD-L1xCD3的治疗效果是不可或缺的。前期研究表明,anti-PD-(L)1 治疗能够通过增强B7-1(CD80) 与CD28的相互作用来达到激活T 细胞的效果6, 7。由此,研究人员提出了PD-L1xCD3治疗是通过增强共刺激信号来发挥作用的假设。结果也表明,用抗体阻断CD80/86后,PD-L1xCD3的治疗效果消失同时抗原特异性T细胞反应也大大减弱。通过体外共培养实验证明,PD-L1xCD3能够通过增强共刺激信号的方式促进IL-2的分泌,避免T细胞因过度激活导致的凋亡,从而实现肿瘤内T细胞的长效激活。
传统BiTE的设计理念是通过单链抗体(ScFv)衔接T细胞与肿瘤细胞,促使T细胞活化并直接进行肿瘤细胞杀伤。然而,在肿瘤微环境里T细胞的数量和质量都非常有限。而肿瘤细胞不仅数量“占优”并且能够通过激活抑制性信号通路(如PD-L1/PD-1)来逃逸杀伤。与此同时,由于肿瘤细胞本身并不表达共刺激分子,其激活T细胞的效果非常有限。面对数倍于己的“敌军”,T细胞在反复杀伤的过程中很容易产生耗竭而败下阵来。与之相反,作为新型双特异性抗体,PD-L1xCD3能够将T细胞与树突状细胞衔接在一起,从而为其激活提供充足的条件(共刺激分子)。通过与树突状细胞的相互作用,T细胞不仅得到了有效的激活并且能够通过IL-2实现自我扩增。最终实现T细胞的持续性激活并获得持久的抗肿瘤免疫反应。
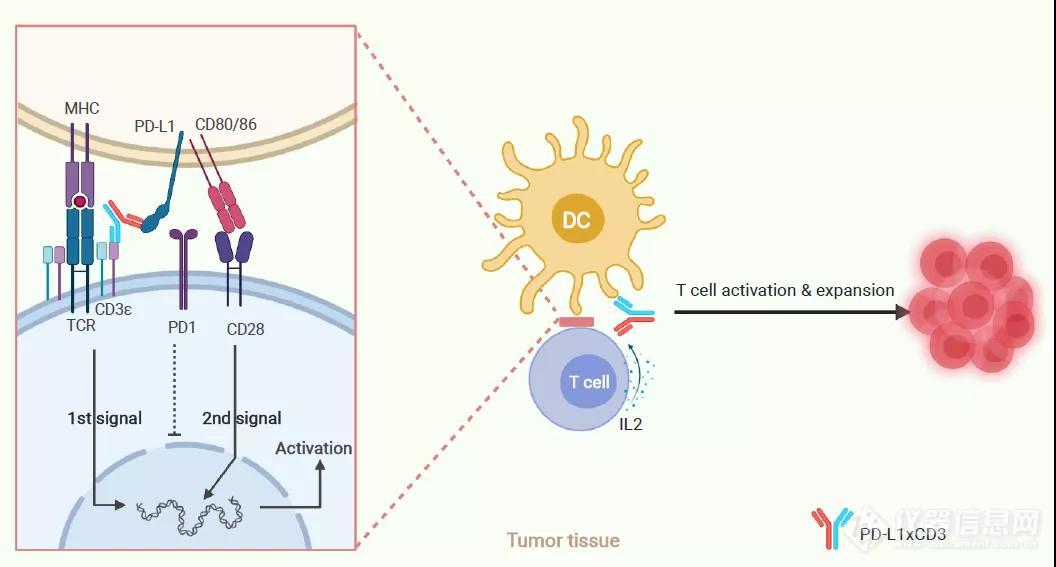
图二:PD-L1xCD3的作用机理
综上所述,该研究为新一代双特异性抗体设计提供了思路。证明了PD-L1xCD3 具有优于传统BiTE的如下特点:1)靶向肿瘤组织降低毒性;2)阻断PD-L1/PD-1相互作用,解除T细胞抑制;3)靶向DC细胞为T细胞激活提供共刺激信号,从而促进IL-2介导的T细胞存活。
据悉,该论文已被选为Nature Biomedical Engineering 杂志11月份的封面故事。
该研究的通讯作者是美国德克萨斯大学西南医学中心的乔健博士和傅阳心教授。刘龙超博士为论文的第一作者。
[来源: BioArt]

2021.10.24

Cancer Cell亮点 | 鲁勇团队首次发现能防止肿瘤复发的Th9细胞治疗方法
2021.10.27

因美纳收购Fluent BioSciences,助力更广泛的客户加速单细胞分析与发现
2024.07.10


重磅!20项推荐性卫生行业标准发布,流式细胞仪、PCR、血细胞分析仪等被提及
2024.07.08

1010万!中国科学院分子细胞科学卓越创新中心流式细胞分选仪、共聚焦显微镜等采购项目
2024.07.03
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~