







流式观察,细胞分析投稿:liuld@instrument.com.cn


国家药品监督管理局官方微信公众号“中国药闻”发布了临床急需境外新药审评审批工作程序之二的图解版本,该版本为广大受众群体提供了更加清晰、直观的政策解读方式。
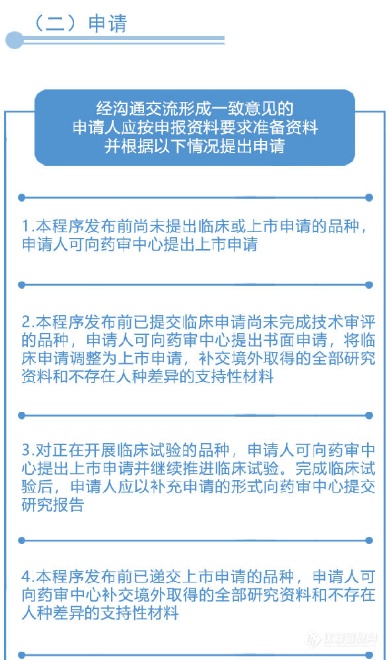
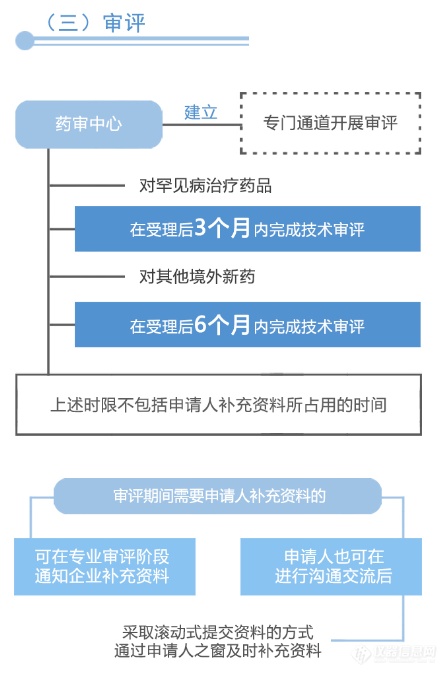
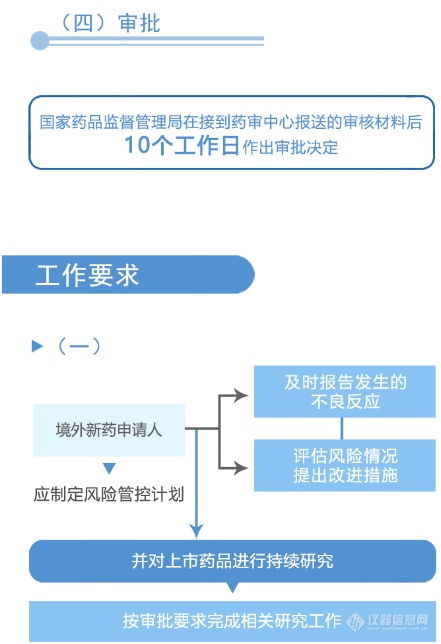
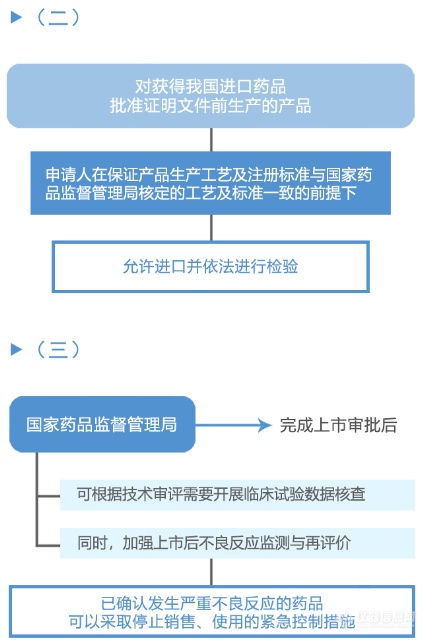
从图解中可以看到,国家药品监督管理局、国家卫生健康委员会建立专门通道对临床急需的境外已上市新药进行审评审批的工作程序(之二)主要为:第一,进入审评审批程序,凡列入专门通道审评审批品种名单的,其在美国、欧盟或日本首次上市的持证商经研究认为不存在人中差异的,可以按照以下程序开展注册工作:沟通交流、申请、审评与审批。之后,国家药品监督管理局在接到药审中心报送的审核材料后10个工作日做出审批决定。附图解



[来源:仪器信息网] 未经授权不得转载

2024.08.26
2024.08.26

近5亿!77台(套)仪器!吉林大学第一医院公布9月设备更新采购清单
2024.08.26

2024.08.26

2024.08.26

曾任职赛默飞和安捷伦,Steve Becker入职腾讯跟投的基因组学公司
2024.08.26
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~