血脑屏障(BBB)由内皮细胞、周细胞和星形细胞胶质板组成,可以防止有害物质从血液进入脑组织,是维持中枢神经系统(CNS)微环境的重要选择性屏障。然而,BBB的存在严重限制了血液循环中大分子的通过,导致外周给药的生物制剂进入CNS的浓度无法发挥治疗作用。据估计,血液循环大分子对CNS的暴露仅为0.1-0.4%。因此,研究人员致力于开发能调节或绕过BBB递送治疗药物的方法,其中受体介导的胞吞作用(RMT) 是一种很有前景的策略。RMT利用内皮细胞的囊泡运输机制将多种必需营养素(如转铁蛋白和胰岛素)运输到大脑。最近,Wouters等人(2020)发现了一种小鼠抗转铁蛋白受体纳米抗体,能够通过RMT将生物活性肽递送到小鼠的大脑中。
在潜在CNS药物的开发过程中,准确测量药物在作用部位的浓度是至关重要的一部分。微透析和脑开放式微灌流(cOFM)等技术被开发出来,用于直接从脑间质液中采集分子样本。微透析技术使用带有半透膜的探针,可以从脑间质液中连续采集内源性和外源性化合物,主要用于神经递质及其他小分子的采集,对于高分子量物质的采样具有局限性。最近,截留分子量为100 kDa至3 MDa的探针已经被开发出来,这种探针可以透过分子量较大的化合物,其物质交换基于超滤原理,通过对流扩散,采用推拉泵系统来控制液体流路。然而,由于压力波动,此类探针的采样仍具有挑战性。为解决这一问题,Takeda等人(2011)引入了一种带有通气孔的探针组件(AtmosLM™),可以使探针内的压力差迅速与大气压平衡。微透析实验通常在有限的时间内进行,在大多数已发表的研究中,实验在探针植入16-24小时后开始,根据BBB的功能和胶质疤痕组织的形成情况,持续时间最长为48-72小时。
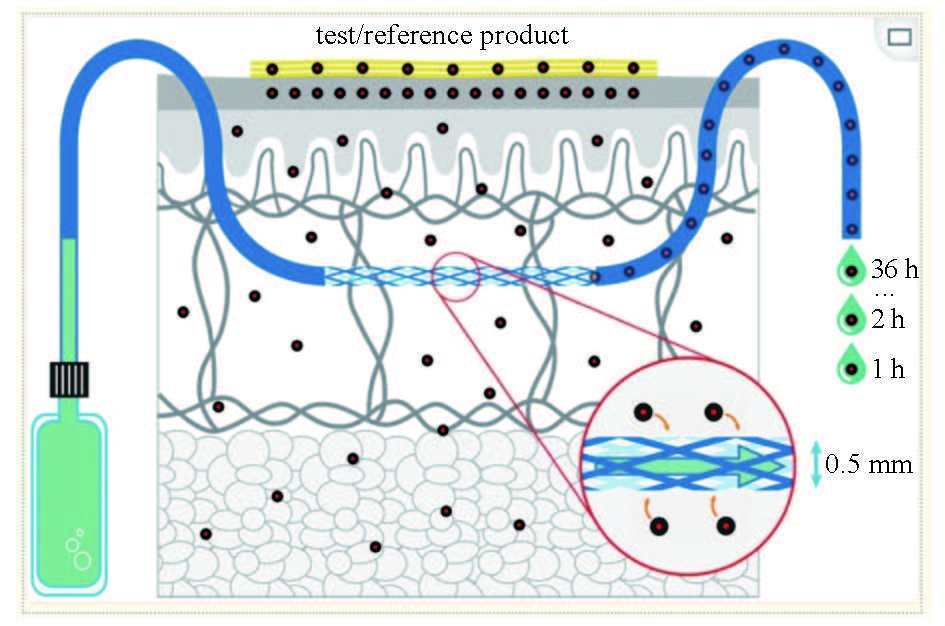
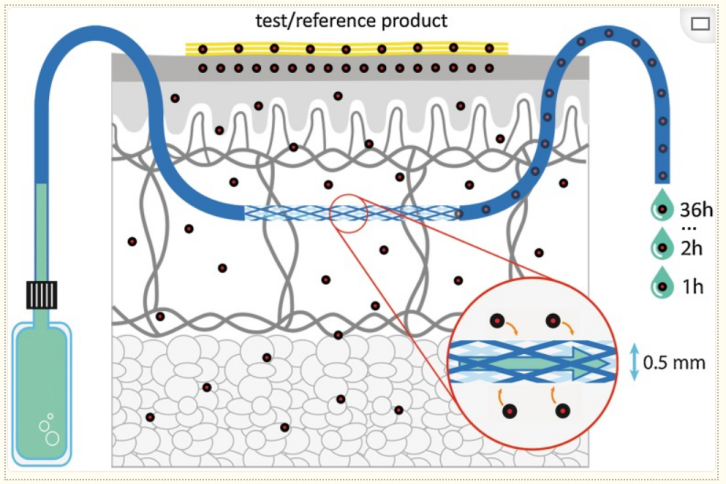
cOFM(脑开放式微灌流)是一种新型的体内采样技术,它延用微透析采样技术,采用100微米孔口的无膜探针,物质交换通过对流进行,并通过推拉泵系统来控制液体流路。该无膜探针的开放孔口结构和生物相容性材料使亲脂性和高分子量物质的采样得以实现。此外,研究表明,在大鼠中探针植入后最长30天内不会形成阻碍物质交换的胶质疤痕。采样实验可以在探针植入后14天开始,经过这段时间的恢复后,大鼠血脑屏障重新建立起来。探针直接植入目标脑区域,愈合假体防止组织长入探针。在14天的恢复期后,将愈合假体替换为采样插入件,并可在1小时的预运行期后开始采样。本研究比较了cOFM(脑开放式微灌流)和微透析作为大分子采样技术的适用性,两种采样技术均用于定量小鼠CNS中脑穿透性抗转铁蛋白受体纳米抗体的浓度。针对小鼠转铁蛋白受体的Nb62与针对绿色荧光蛋白(GFP)的纳米抗体融合,标记为Nb105。作为阴性对照(Nb109),针对GFP的纳米抗体与一个针对鸡溶菌酶的无关纳米抗体融合。两种双特异性纳米抗体的分子量均为±31 kDa (Nb105=31.1 kDa, Nb109=31.7 kDa)。cOFM(脑开放式微灌流)采样在14天后开始,微透析在20-24小时后进行。通过评估神经炎症反应、BBB完整性、体外回收率和体内AUC来比较两种方法的性能。这是cOFM(脑开放式微灌流)首次在清醒状态的小鼠脑部进行的研究,并在小鼠大脑中评估了这些参数。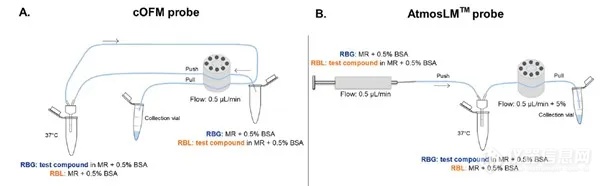
图1. A. 脑开放微灌流(cOFM)和 B. 微透析 AtmosLM™ 的体外实验设置。BSA:牛血清白蛋白,MR:改良林格氏液,RBG:增益回收,RBL:损失回收。
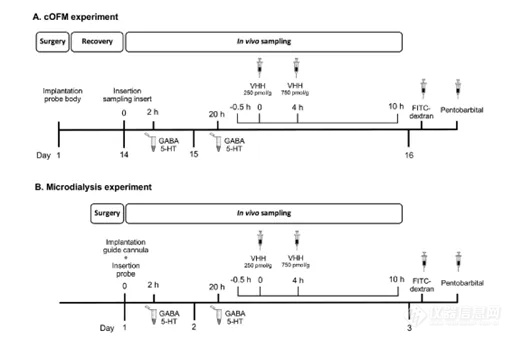
图2. A脑开放式微灌流(cOFM)和B微透析AtmosLM™的体内实验时间表。5-HT:5-羟色胺,FITC-葡聚糖:异硫氰酸-葡聚糖荧光素,GABA: γ-氨基丁酸,VHH:纳米抗体。
在进行微透析实验时,考虑采样的最佳持续时间非常重要。神经胶质瘢痕组织通常在长期植入的探针周围形成。这可能会影响物质分子在灌注液中的交换。新型cOFM(脑开放式微灌流)技术采用生物惰性材料,使探针能够在小鼠体内植入长达30天。考虑到BBB完整性恢复情况,探针植入14天后开始采样。在本研究中,我们评估了采样结束时小鼠大脑海马区的炎症反应,根据实验方案,微透析约为3天后,cOFM约为16天后(图2)。通过免疫组织化学可视化和量化反应性星形胶质细胞和小胶质细胞,这是胶质瘢痕形成的关键细胞类型(见图3A/B)。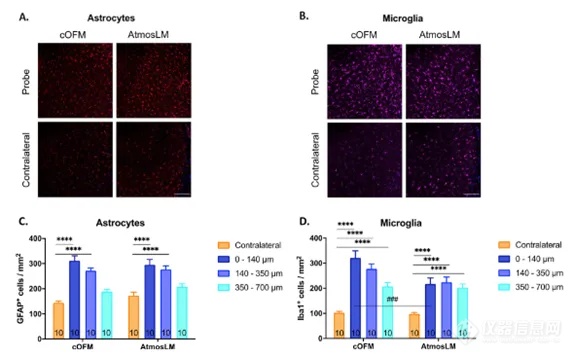
图3. 探针植入后神经炎症反应评估。A和B与对侧半球相比,探针轨迹周围星形细胞和小胶质细胞的代表性共聚焦图像。比例尺表示150mm。C、D分别定量GFAP和Iba1阳性细胞/mm2。将靠近探针轨迹拍摄的图片分为3个亚区,分别表示为1区:0-140 μm、2区:140-350 μm和3区:350-700 μm。数据以平均值±SEM(n=10)表示。cOFM:脑开放微灌流,GFAP:胶质纤维酸性蛋白,Iba1:离子钙结合适配器分子1。对于这两种探针,在实验结束时,沿着植入轨迹的邻近区域可以看到星形细胞和小胶质细胞反应,这可能会影响回收率。此外,我们可以得出结论,在植入cOFM(脑开放式微灌流)探针超过14天后,与仅植入约3天的微透析探针相比,组织反应仅略显著。这证实了cOFM(脑开放式微灌流)探针在小鼠大脑中植入的更长时间是可能的。cOFM(脑开放式微灌流)探针采用生物相容性材料替代AtmosLM导管的金属材料,可能会显著减少在测试期间观察到的神经炎症反应。
为了深入了解探针植入对BBB完整性的影响,实验结束时,在探针轨迹周围给予FITC-葡聚糖,并测量荧光强度。使用分子量为40 kDa的FITC-葡聚糖,是因为它的分子量接近双特异性纳米抗体(±31 kDa)。此外,对冠状脑切片进行小鼠抗IgG抗体染色。结果与阳性对照进行了比较(见图4)。
结果表明,FITC-葡聚糖和IgG外渗在探针轨迹周围增加,其中微透析探针的外渗更为明显,但与阳性对照相比,BBB明显愈合。然而,我们在恢复期后仍然可以观察到一些有限的损伤,当使用微透析技术进行BBB研究时,探针植入后推荐的24小时恢复期存在质疑。我们观察到在cOFM(脑开放式微灌流)实验中,FITC-葡聚糖的渗漏与IgG实验相比不明显,可能表明BBB的完整性在14天后重新建立,IgG染色代表了探针植入血脑屏障的残留效应。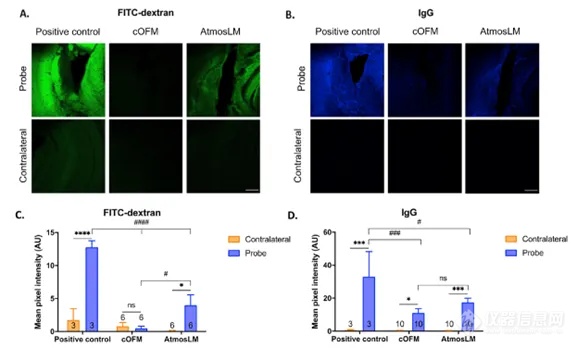
图4. 探针植入后血脑屏障完整性评估。A、B与阳性对照、cOFM和微透析实验中对侧半球相比,FITC -葡聚糖和IgG在探针轨迹周围外渗的共聚焦图像。比例尺表示250 mm。C和D荧光信号的定量描述为平均像素强度。样本量如图所示。AU:任意单位,cOFM:脑开放式微灌流,FITC-葡聚糖:异硫氰酸酯-葡聚糖荧光素,IgG:免疫球蛋白G, ns:无统计学意义。在体内实验之前,先在体外测试探针的性能。通过在灌注液中添加BSA,来限制流体通过大孔膜的损失,也可以作为阻断剂,避免靶标化合物对探针和管道表面的非特异性吸附。在灌注液中加入0.5% BSA获得最佳效果。Nb105、5-HT和GABA的体外回收试验结果见表1。cOFM(脑开放式微灌流)探针的相对RBG和RBL接近100%,而AtmosLM™探针的相对回收率低2-4倍。表1 体外相对回收率(mean±SEM)
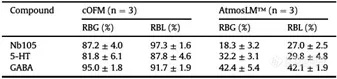
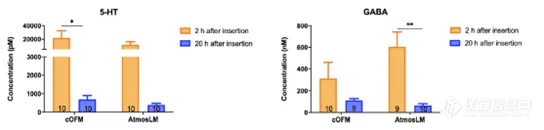
注:5-HT:5-羟色胺,cOFM:脑开放式微灌流,GABA: γ -氨基丁酸,RBG:增益回收,RBL:损失回收。由于实验是在清醒的小鼠身上进行的,所以能够在更长的时间内采集样本。为了深入了解可能的脑环境干扰,在采样插入物更换/探针插入后2和20小时测定cOFM(脑开放式微灌流)/微透析样品中的5-HT和GABA水平。如图5所示,两种探针在插入后2小时所取样品中的5-HT浓度约为20小时的30倍。探针插入后2小时的样品与20小时相比,GABA浓度高3-10倍。考虑到血液中也存在高浓度的5-HT和GABA,这可以表明cOFM(脑开放式微灌流)/微透析样本中存在血液,可能是由于BBB没有完全恢复。这些结果同时表明,1小时的预运行期不足以保证大脑环境的稳定。因此,在本研究中,我们对cOFM(脑开放式微灌流)和微透析实验都维持了20小时的预运行期。图5. 体内神经递质5-HT和GABA取样。样本量如图所示。5-HT:5-羟色胺,cOFM:脑开放式微灌流,GABA: γ -氨基丁酸。累加剂量效应实验用来量化Nb105,并使用两种探针采样评估其与阴性对照相比的BBB穿透能力(图6A/E)。结果通过比较AUC(曲线下面积)进行评估。使用cOFM(脑开放式微灌流)探针,Nb105的AUC与阴性对照之间没有统计学差异(图6B-D)。然而,AtmosLM™探针的剂量效应实验显示,首次注射后Nb105与阴性对照的AUC(图6F)和总AUC(图6H)之间存在统计学显著差异,但第二次注射剂量增加3倍后没有(图6G,)统计学差异。
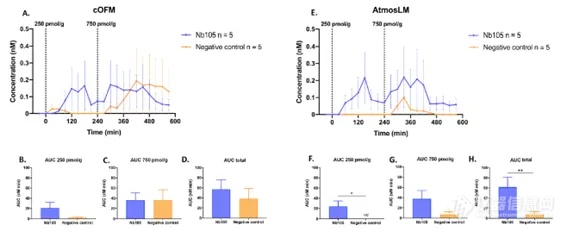 图6. 纳米抗体的体内取样。A和E腹腔注射指定纳米抗体和剂量后的剂量效应测量。B-D和F-H:曲线下相应面积。AUC:曲线下面积,cOFM:脑开放式微灌流。
图6. 纳米抗体的体内取样。A和E腹腔注射指定纳米抗体和剂量后的剂量效应测量。B-D和F-H:曲线下相应面积。AUC:曲线下面积,cOFM:脑开放式微灌流。如图6所示,数据波动较大,除了生物变异性外,可能是因为一些数据点位于定量检测方法的下限以下,因此在部分动物中无法定量检测到纳米抗体。
虽然cOFM(脑开放式微灌流)探针取样的体外回收率比微透析探针高4倍,但两种探针的Nb105体内AUC是相同的(cOFM: 57.0±18.9 nM min和AtmosLM: 61.7±19.4 nM min)。本研究中使用的探针是专门设计用于克服渗透和超滤相关的问题,并进行了验证,因此,我们认为由脑实质引起的数据波动可能是体外与体内回收率差异的可能解释,而非渗透和超滤方面的问题。在Nicholson和Phillips(1981)的研究中,提出了在林格氏液中加入0.3%琼脂(w/v)以更好地模拟体外脑微环境中分子的扩散。事实上,0.3%的琼脂可以防止热对流,但不会显著阻碍自由扩散。因此,与体内实验相比,在体外实验中使用0.3%琼脂,可能会减小差异性。本研究评估了cOFM(脑开放式微灌流)和微透析(AtmosLM™,截留分子量1 MDa)在小鼠中采集脑穿透性双特异性纳米抗体(约31 kDa)的适用性。通过评估神经炎症反应、BBB完整性、体外回收率和体内AUC来比较两种方法的性能。对于cOFM(脑开放式微灌流),这是第一次在清醒、自由移动的小鼠中进行的研究,得到了小鼠大脑炎症和BBB完整性的数据。免疫组化染色显示,在这两种探针的植入轨迹附近,都有星形细胞和小胶质细胞反应。冠状面切片显示,与cOFM(脑开放式微灌流)相比,微透析探针轨迹周围有更高的FITC-葡聚糖和IgG外渗,但与BBB被破坏的阳性对照相比,这种外渗非常有限。根据实验结果,我们建议在使用cOFM(脑开放式微灌流)探针进行BBB研究时,延长预运行阶段的时间。
这是首次在脑间质液中采集双特异性纳米抗体随时间变化的研究,展示了CNS中纳米抗体的药代动力学特征。这项研究表明,在考虑生物分析因素的前提下,微透析和cOFM(脑开放式微灌流)均适用于CNS中纳米抗体定量的体内采样技术。

可用于小分子/大分子药物,亲水/亲脂性物质,多肽,蛋白,抗体,结合药物与游离药物,转运体,酶,纳米载体和囊泡等的取样,同时分别检测PK与PD;可以通过OFM直接在目标组织对所要分析化合物进行取样,然后进行随后的质谱检测,取样时间可长达48小时。咨询热线:400-0880-782







![]()