Gator® 新一代 BLI 平台应用文集
2024/09/14 10:07
阅读:5
分享:方案摘要:
产品配置单:
Gator 生物分子相互作用分析系统 Gator® Pivot
型号: Gator® Pivot
产地: 上海
品牌: Gator Bio
面议
参考报价
联系电话
方案详情:

8 月 24 日,2023 年国家自然基金放榜,毫无疑问登上科研圈子的 “ 热搜 ” ,相信研究人员也已经明确了自己的方向。生物分子互作是生物功能研究中的一个关键内容,通过探索分子之间的相互作用,揭示细胞内复杂的信号传递和调控网络。不仅有助于我们理解疾病的发生机制,还为药物研发和治疗策略的开发提供了重要的参考。
从传统的终点法酶联免疫吸附测定( Enzyme-linked Immuno Sorbent Assay, ELISA )、免疫共沉淀( Co-Immunoprecipitation, Co-IP )、蛋白质免疫印迹( Western Blot, WB )、凝胶迁移实验( Electrophoretic Mobility Shift Assay,EMSA )等,到近年迅速火热的实时分子互作技术——生物膜干涉技术( Biolayer Interferometry, BLI ),研究分子互作的检测技术层出不穷。
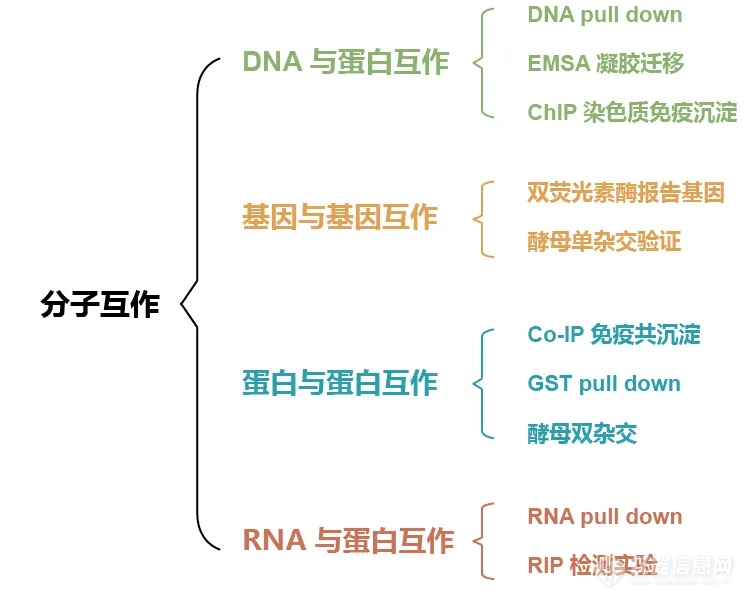
图 1. 传统分子互作技术
有些老师同学可能还没接触过 BLI,我们将在本期介绍 BLI 技术原理,以及它能解决传统分子互作技术面临的哪些问题。
BLI
生物膜干涉技术
BLI 技术基于光干涉的原理:
在其配套使用的光纤生物传感器顶端表面,镀有一层薄薄的具有生物分子相容性的光学膜层。当可见光通过光纤传感器时,会在膜层两个表面分别发生反射,所产生的两束反射光发生干涉,形成原始干涉图谱。当有配体结合到膜层上时,膜层厚度发生一定变化,可见光通过时会形成新的干涉图谱。相较于之前的图谱,新图谱产生的位移即反映了膜层厚度的变化。此时,BLI 仪器就可以实时监测相对位移变化,并将其转化为系统特有参数和图谱呈现出来,包括结合速率常数( ka )和解离速率常数( kd ),以及起始结合速率,并通过拟合计算分析得到亲和力常数( KD )和浓度信息。BLI 技术已应用于各类小分子化合物、多肽、蛋白质、寡核苷酸、脂质、噬菌体、病毒和细胞等领域。
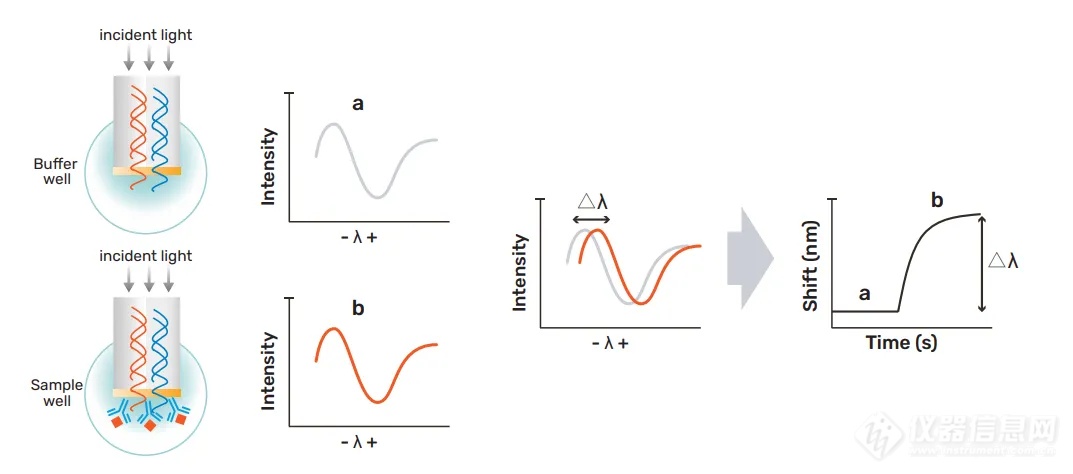
图 2. BLI 技术原理图
BLI 与传统分子互作技术携手科研之路
#1
蛋白质免疫印迹
Western Blot
提起 WB,相信大家都再熟悉不过,它是一种用于检测蛋白质的定性和半定量的实验方法。其基本原理是将待测样品经过 SDS-聚丙烯酰胺凝胶电泳分离,然后将蛋白质从凝胶转移到固相载体上,并使用特异性抗体作为探针来检测靶抗原蛋白质。对于 WB,小编可是 “ 深受其毒害 ”,本科和研究生课题都没离开过它,时不时还会想起那段不太美好的回忆。每天都是固定的流程,一大早开始配胶,跑电泳,转膜,封闭,孵一抗,再对膜进行 “ 洗刷刷 ”,上二抗,加显影液,最后 “ 上刑场 ”,有条带就喜大普奔,空空如也就代表重新再来。。。。。。做个 WB,整天提心吊胆,生怕哪一步错了,就浪费一整天的时间,这应该也是很多 “ 科研打工人 ” 的辛酸往事。

图 3. Western Blot 实验流程
泛素化是蛋白质翻译后修饰的一种形式,其过程包括蛋白酶体的蛋白质降解、细胞周期进程、转录调控、DNA 修复和信号转导。泛素通过其 C 末端与赖氨酸的 ε-氨基共价连接,或( 较少 )与蛋白质的 N 末端形成肽键。检测蛋白泛素化最常用的方法就是 WB,但往往因为其耗时长,步骤繁琐,导致研究进度大大减慢。来自迈阿密大学的 Richard C. Page 团队[1],基于 BLI 开发了一种新型的蛋白泛素化检测方法,以 E3 泛素连接酶 CHIP 和底物 Hsc70 作为研究例子,实现快速且实时检测泛素化过程。图 4A 为 BLI 检测结果,当加入 CHIP/EI/E2/Ub/ATP-Mg/Ub 混合物,随着时间延长,相比其他对照组,与 Hsc70 有更明显的结合信号,表明 Hsc70 逐渐与泛素发生结合。图 4B 为 WB 检测结果,同样能明显看到时间增长,Hsc70 泛素化增多。

BLI 检测步骤:
Anti-GST 光纤生物传感器固化 gst-tag Hsc70,结合 [ 0.5 μM E1、20 μM E2、100 μM 泛素、20 mM ATP-Mg( 先提前在 37℃ 预混 30 min )] 与 CHIP 的混合物,即可实时得到泛素的结合信号。除了能检测泛素化过程外,BLI 还可以直接检测细胞裂解液中蛋白表达量的高低。
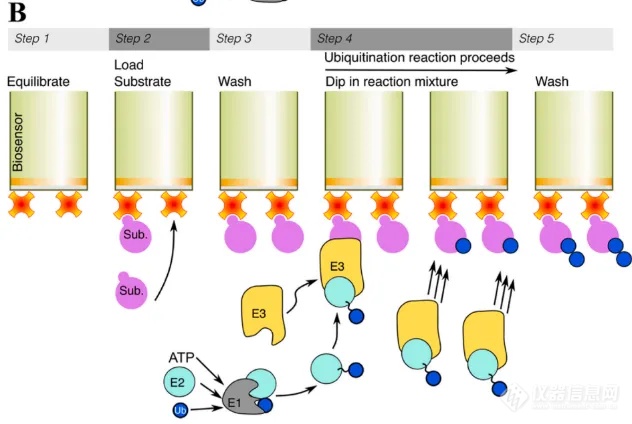
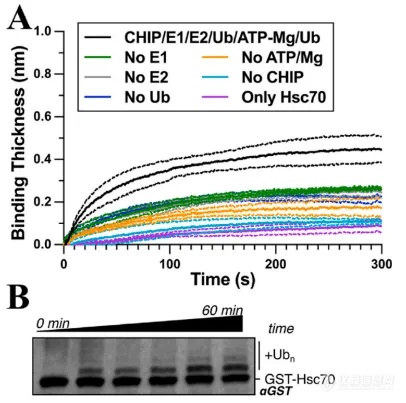
图 4. BLI 检测蛋白泛素化流程图,BLI 检测结果(A),WB 检测结果(B)
#2
免疫共沉淀
Co-IP
该技术是以抗体-抗原特异性互作为基础的用于研究蛋白-蛋白相互作用的经典方法,是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。Co-IP 的实验原理为( 图 5a ):利用靶蛋白( Protein X )为诱饵,将特异性识别 Protein X 的抗体与总蛋白进行共孵育,促进免疫复合物的形成;随后加入能够与抗体结合的 Protein A/G ( 预先固化在磁珠上 ),这样与 Protein X 有相互作用的蛋白( Protein Y )就会一起被沉淀下来;之后通过进一步洗脱,再对蛋白复合物进行 Western Blot 检测,即可获得蛋白相互作用的信息。Co-IP 的优点是能够在天然状态下分析蛋白质之间的相互作用,排除了人为因素的干扰,同时还能分离这种复合物。但 Co-IP 的缺点也很明显,Co-IP 是验证两种蛋白结合后相互作用,假如存在多个其他蛋白在其中发挥桥接作用,Co-IP 是无法有效论证这种间接关系的( 图 5b ),并且这种相互作用的强弱( 亲和力 )也无从可知。比如图 5a 中如果通过 Western 鉴定出含有 Protein Y,此时只能得到 Protein X 和 Protein Y 在同一个复合物中的结论,而不能获得两者存在直接相互作用的结论。
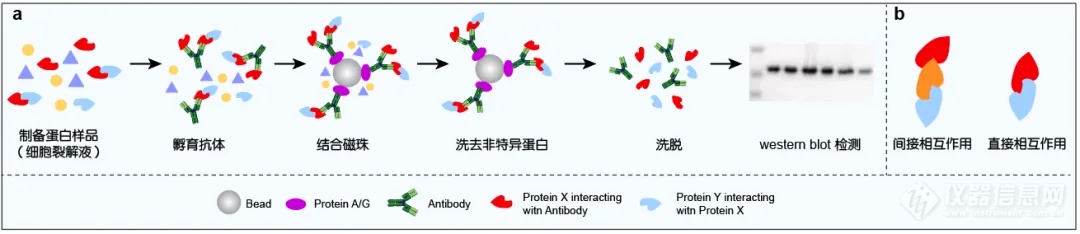
图 5. Co-IP 实验原理图

BLI 检测步骤:
为了验证两个蛋白是否存在直接相互作用,以及相互作用的强弱如何,可使用 BLI 方法进行快速检测。如在复旦大学许杰等人近期发表的一篇文章中[2],为了验证半乳糖凝集素 Galectin-8 可作为天然配体与白细胞免疫球蛋白样受体 B4( LILRB4 )之间发生相互作用,从而可以抑制单核细胞吞噬功能,发挥免疫抑制作用。文中先使用 Co-IP 实验验证了在细胞中 Galectin-8 和 LILRB4 存在相互作用( 图 6C )。接着使用 BLI ( Gator® )方法在体外表征了 Galectin-8 和 LILRB4 的直接相互作用,且得到结合亲和力 KD = 1.02 μM( 图 6E )。使用 Gator® 系统进行动力学检测流程也很简单、快速( 15 min 内即可完成一对分子的检测 ):使用 Protein A 光纤生物传感器固化 Fc-tagged 的 LILRB4 ECD 蛋白,再结合不同浓度的 Galectin-8,得到结合动力学参数 ka、kd 和 KD。
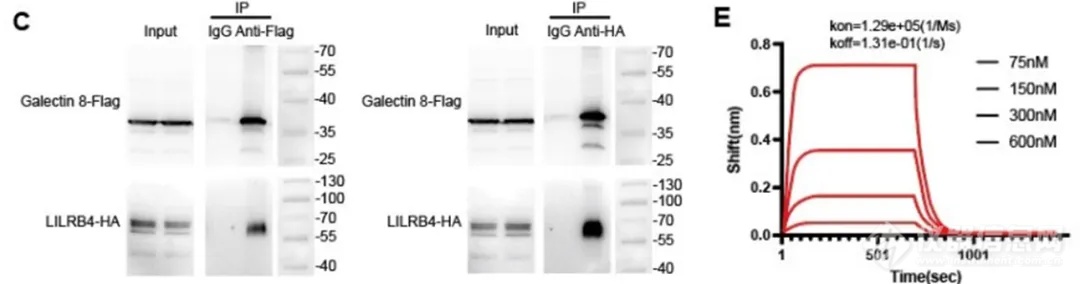
图 6. Co-IP(C)和 BLI(E)验证 Galectin-8 和 LILRB4 的相互作用
#3
Pull down, 又称蛋白质体外结合实验
Binding assay in vitro
该技术原理为将靶蛋白亲和固定于某种基质上,充当 “ 诱饵蛋白 ”,当细胞抽提液经过该基质时,可与靶蛋白相互作用的配体蛋白被吸附,而其他非互作的杂质蛋白则随洗脱液流出。被吸附的蛋白可以通过改变洗脱液或者洗脱条件洗脱下来。Pull-Down 实验中最常用的是 GST 标签,即谷胱甘肽巯基转移酶。基于 GST 可以与谷胱甘肽( Glutathione,GSH )结合。将 GSH 固定于琼脂糖珠上,形成 GSH-琼脂糖珠,将已知蛋白 X 与 GST 融合表达,获得的 GST-X 可与 GSH-琼脂糖珠结合,若环境中存在与 X 蛋白互做的蛋白 Y,则会形成 “ 琼脂糖珠-GSH-GST-X-Y ” 复合物,与 X 蛋白互做的蛋白即可被分离并检测。
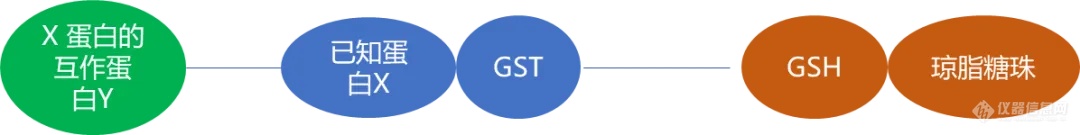
图 7. GST pull down 原理

BLI 检测步骤:
GST Pull-Down 可以验证已知蛋白的互作,也可以筛选与已知蛋白互作的未知蛋白。但其实验步骤繁琐、耗时长、且只能定性分析。若想快速检测两个分子间相互作用,可利用 BLI 技术,15 分钟内完成实验,得到分子之间准确动力学结合常数。
瑞士洛桑联邦理工大学 Andrea Ablasser 团队在《 Nature 》上发表了题为 “ Clathrin-associated AP-1 controls termination of STING signalling ” 的文章[3],揭示了 STING 信号终止的机制。该研究发现 STING 蛋白的 C 端存在着一个高度保守的、被 AP-1 识别的序列:[D/E]xxxL[L/I]。使用 BLI 验证得到 STING 和 AP-1 可直接结合,亲和力为 393 nM。当把人源 STING 的 364 位的亮氨酸( L )和 365 位的异亮氨酸 ( I ) 突变为丙氨酸 ( A ) 时,利用 Pull Down ( 图 8d ) 和 BLI ( 图 8g ) 得到的实验结果非常一致,表明即使使用 STING 的激活剂处理,STING 也无法结合 AP-1。该实验利用基于 BLI 原理的 Gator® 检测过程很简单:只需分别将 STING, STING mutants 进行生物素标记后固化到 SA 光纤生物传感器上,再与 AP-1 ΔµCTD 结合,即可获得各自的体外亲和力数据。除此之外,利用 Gator® 也能进行垂钓实验,筛选出与已知蛋白互作的未知蛋白。
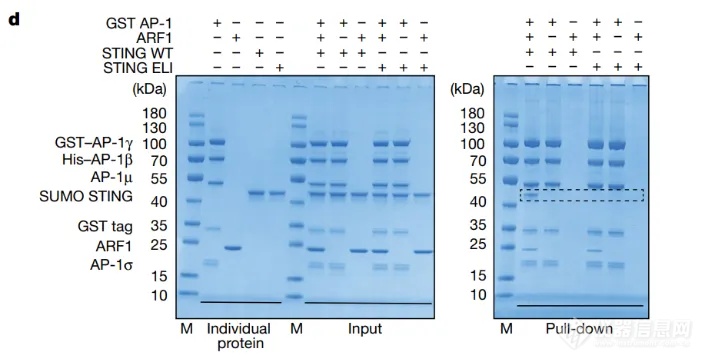
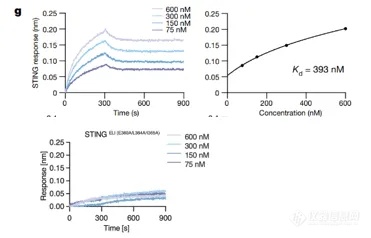
图 8. Pull-Down(d)和 BLI(g)检测 STING 和 AP-1 相互作用
#4
凝胶迁移实验
EMSA
EMSA 技术基于 DNA/蛋白质或 RNA/蛋白质复合物在聚丙烯酰胺凝胶电泳( PAGE )中有不同迁移率的原理,研究蛋白与核酸相互作用。首先让蛋白质与末端标记的核酸探针结合,再进行 PAGE 电泳,结合了蛋白质的复合物电泳的速度会变慢( 凝胶延滞 ),这样,从 PAGE 电泳结果就可以判断,该蛋白是否和特定序列结合或者该序列是否和特定蛋白结合。
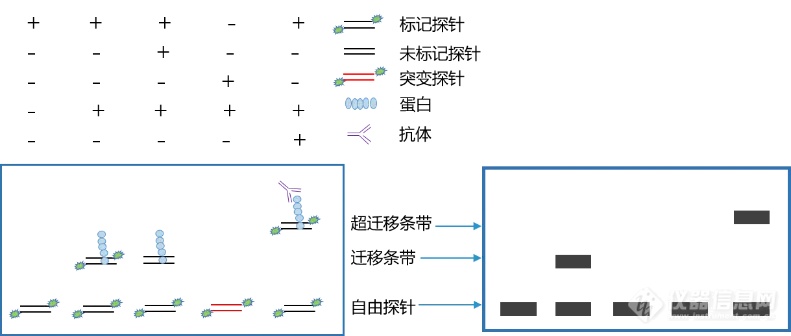
图 9. EMSA 原理图
该方法主要包含探针标记和纯化、配制胶、电泳、转膜以及分析等步骤,耗时冗长且操作繁琐,假阳性和假阴性率高。虽然结果可用于定性和半定量分析,但实验者经常被定量不准确、重复性差等问题所困扰。

BLI 检测步骤:
利用 BLI 同样可以完成 DNA/RNA-蛋白配对,样品仅需稀释就可完成检测。如在中国科学研究团队近期发表的一篇文章中,首次表明 TNF-α 在体外和体内均可特异性结合某些细胞内或循环炎症相关的 microRNAs[4]。其中分别通过 EMSA ( 图 10C ) 和 BLI ( 图 10D )技术检测 rTNF-α 与 microRNAs 的结合,并对能与 rTNF-α 结合的 microRNAs 进行筛选,两者实验结果非常一致;进一步研究中,还利用 BLI 技术探索 TNF-α 与 microRNA 结合的关键氨基酸以及特异性序列。实验过程非常方便:将不同的 microRNAs 标记 Biotin 后固化到 SA 光纤生物传感器上,再与 TNF-α 进行结合与解离,在极短的时间就能快速获得大量有效数据。
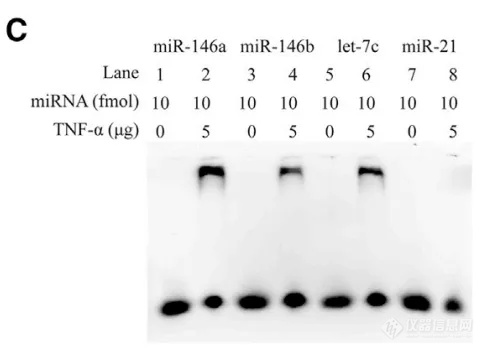
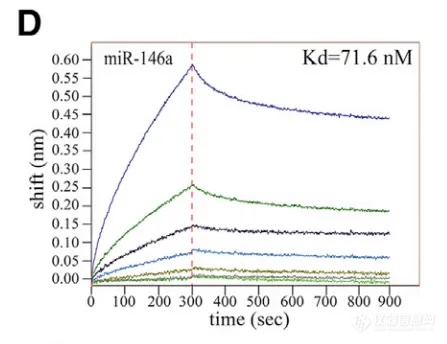
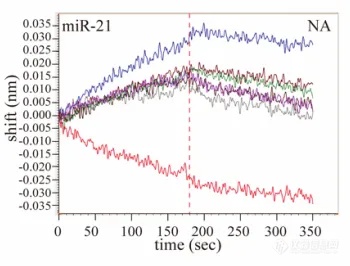
图 10. EMSA 检测结果(C),BLI 检测结果(D)
除了以上介绍的分子互作技术外,还有 ELISA、Chip 实验等。然而这些传统互作技术所需样本量大、步骤多、耗时长、无法实时检测,而 BLI 技术不仅解决了这些传统方法的问题,同时还具备高通量筛选、定量分析、重复性好等优点。
下载本篇解决方案:
更多![]()









