颠覆传统!基于PROTAC技术的“靶向降解组学”鉴定中药成分靶点
2022/08/17 14:29
阅读:135
分享:方案摘要:
产品配置单:
NanoTemper Monolith 生物分子互作检测仪
型号: Monolith
产地: 德国
品牌: NanoTemper
面议
参考报价
联系电话
方案详情:
方案标题: 颠覆传统!基于PROTAC技术的“靶向降解组学”鉴定中药成分靶点
检测样品:中药千金子活性成分千金子二萜醇,MAFF蛋白
检测项目:千金子二萜醇及其衍生物ZCY020与MAFF蛋白亲和力
应用领域: 制药
方案摘要:
蛋白降解靶向嵌合体(PROTAC)技术是目前小分子药物研发领域最火热的技术之一。它颠覆了传统药物化学中“占位驱动 (occupancy driven)”的开发理念,借助内源性的泛素蛋白酶体系统有效地特异性降解致病蛋白,尤其是“不可成药(undruggable)”靶点。如此优秀的技术,不但让国内外众多制药巨头和Biotech公司趋之若鹜,更为科学家们打开了新世界的大门。中国科学院司龙龙课题组刚刚在Nature子刊发表了基于PROTAC技术的流感疫苗[1],沈阳药科大学陈丽霞和李华团队又创造性地将这项技术引入到了中药研究领域,在Acta Pharmaceutica Sinica B(APSB)发表了题为“PROTAC Technology as a Novel Tool to Identify the Target of Lathyrane Diterpenoids”的研究论文 [2]。
方案详情:
中药活性成分和其作用靶点的鉴定均在中药研发领域具有重要的科学意义和实用价值。尤其是靶点鉴定,它是理解中药机制和下游药物开发的基础和关键。但由于中药“多靶点、多成分”的作用模式,以及与靶点蛋白瞬时、弱亲和力的相互作用,导致中药的靶点鉴定存在巨大挑战,亟需研究的思路创新和技术创新。
PROTAC技术中的蛋白降解剂是一种含有两个活性端的小分子化合物,一个活性端可与靶蛋白结合而另一个活性端结合E3连接酶配;两个活性端通过linker相连接。鉴于PROTAC分子往往无需很强的亲和力即可有效地特异性降解靶蛋白,研究团队大胆猜想该技术可用于鉴定中药成分及天然产物的作用靶点。研究人员将PROTAC技术与定量蛋白组学、微量热泳动(MST)分子互作检测技术相结合,从被降解的差异蛋白中找到中药靶点,并通过下游的一系列分子、生物化学和动物实验得到了功能验证。该流程被研究团队称为“靶向降解组学”,可以为中药成分的靶点鉴定提供新的解决方案。
该团队在前期研究中从中药千金子中获得了一系列千金烷二萜类化合物,其中ZCY-001化合物具有最强的抗炎活性,并且具有低毒性。研究人员将该化合物的核心骨架Lathyrol((即千金子二萜醇)与沙利度胺 (E3连接酶CRBN配体) 通过PEG linker相连,得到了PROTAC分子ZCY-PROTAC。使用该PROTAC分子对细胞进行处理后提取蛋白,并使用TMT串联质谱标签进行标记定量蛋白组学分析(图1 A)。比较蛋白组学分析发现MAFF蛋白在ZCY-PROTAC处理后发生了最为显著的降解。Western Blot结果也显示, MAFF蛋白的降解水平与ZCY-PROTAC的剂量和作用时间是正相关的(图1 B)。这些结果表明,该蛋白可能是Lathyrol等千金烷二萜类化合物的最主要靶点。
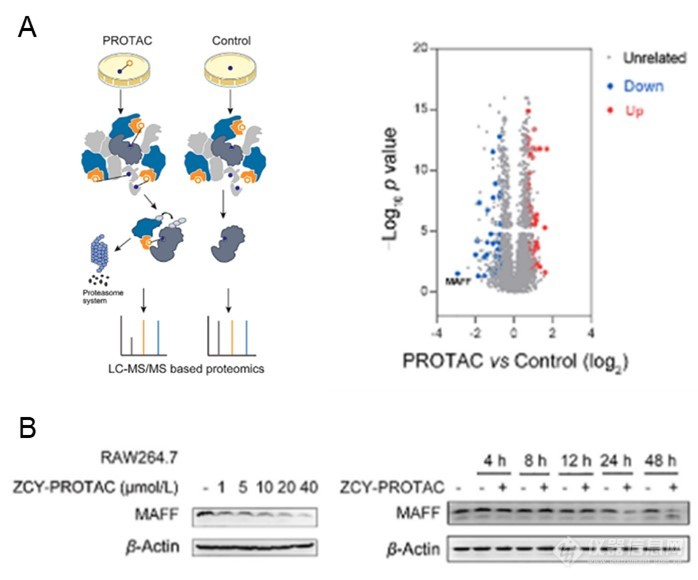
图1 ZCY-PROTAC可显著降解MAFF蛋白
为了验证比较蛋白组学发现的靶点蛋白,研究人员采用微量热泳动(MST)技术直接检测Lathyrol及其衍生物ZCY020与MAFF蛋白的结合能力。如下图所示,Lathyrol与MAFF的亲和力为20.90 μM,ZCY020对MAFF的亲和力也在同一水平。以上亲和力检测结果也通过表面等离子共振(SPR)、细胞热迁移分析(CETSA)以及DARTS等实验得到了验证。这些结果证实了MAFF蛋白是中药千金子成分的直接作用靶点。
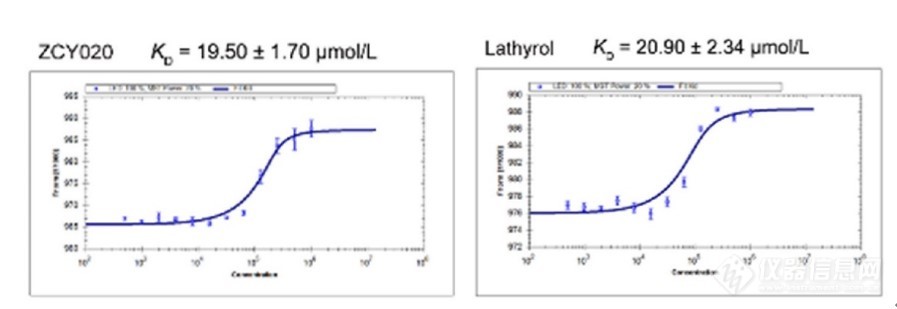
图2 微量热泳动技术(MST)检测中药千金子活性成分与MAFF蛋白相互作用
研究人员进一步采用生化和药理学实验深入研究阐明了千金烷二萜ZCY020以MAFF为靶点蛋白, Nrf2/HO-1信号通路为作用途径发挥抗炎作用。ZCY02可以促进MAFF-Nrf2异源二聚体的形成而抑制MAFF同源二聚体,进而调节HO-1的下游表达,从而在体内外发挥抗氧化和抗炎活性。
本研究创造性地将PROTAC技术应用在了中药成分靶点的鉴定上,首先以中药活性成分为基础合成出PROTAC分子探针,再通过蛋白的特异性降解来发现中药活性成分的靶点蛋白。以MST为代表的的分子互作检测技术在靶点验证中发挥了重要作用,可直接定量分析中药活性成分与靶点蛋白的亲和力。作者将这一系列技术手段整合为一套可行的中药成分靶点鉴定新方法,可以有力地补充甚至替代现有技术。
参考文献
[1] Si L, Shen Q, Li J, et al. Generation of a live attenuated influenza A vaccine by proteolysis targeting. Nat Biotechnol. 2022 Jul 4. doi: 10.1038/s41587-022-01381-4.
[2] Wu Y, Yang Y, Wang W, et al. PROTAC Technology as a Novel Tool to Identify the Target of Lathyrane Diterpenoids. Acta Pharmaceutica Sinica B. 2022 Jul 16. doi: 10.1016/j.apsb.2022.07.007.
仪器链接 https://www.instrument.com.cn/netshow/C438212.htm
下载本篇解决方案:
更多![]()
结构生物学膜蛋白研究必看!
NanoTemper 与美国麻省理工学院 Imperiali 实验室及德国 Cube Biotech 公司进行深度合作,共同开发了一种更加简化的工作流程,通过使用Prometheus Panta 多参数蛋白稳定性分析仪进行快速筛选来自NativeMPTM平台的共聚物纳米盘(Copolymer nanodiscs),从而事半功倍的找到结构分析的最佳溶解条件。
制药/生物制药
2024/10/30
【设备更新】NanoTemper抗体药物开发实验指南
我们将介绍用于检测生物治疗药物稳定性的各种技术,阐明单克隆抗体配方的来龙去脉,介绍新药临床试验申请(IND)和新药上市申请(NDA)的典型时间线,并深入研究存储条件如何影响单抗稳定性。
制药/生物制药
2023/07/14
【设备更新】生物制剂研究人员必备宝典-DLS动态光散射技术指南
动态光散射(DLS)是一种强大的技术,是一种测量颗粒大小、低聚化和分散性,以及环境变化(如药物偶联物的添加或储存缓冲液的变化)对它们的影响的方法。可提供有关生物制剂制备物的纯度和聚集状态的信息,并增加对候选物稳定性的更深入了解。 阅读DLS技术指南电子书,了解其工作原理,以及它如何帮助您优化候选药物的筛选过程。 我们介绍了在整个生物制药流程中,DLS技术如何帮助您改善每一个决策,同时也提供了一些设计DLS实验的实用技巧。
制药/生物制药
2023/04/06
【设备更新】MST 技术在中药成分靶点检测中的解决方案
中药成分及天然产物的药效是通过与多个靶点的相互作用来实现的,它们与靶蛋白瞬时、弱亲和力相互作用,这种作用机制的复杂性为其靶点鉴定带来很大挑战。 传统的基于亲和力的靶点垂钓方法取决于小分子化合物和靶点蛋白质的亲和力,这种结合需要足够强,以便从整个蛋白质组中分离目标蛋白质,而NanoTemper的微量热泳动技术(MST)检测结合亲和力的范围非常广,可发现从皮摩尔级 (pM) 到毫摩尔级 (mM) 的极强和极弱结合分子。
制药/生物制药
2023/06/25












