NanoTemper案例分享 | MST解析RAS/RAF复合物结构,提供KRAS抑制剂开发新思路
研究背景
RAF激酶家族是 RAS-RAF-MEK-ERK 信号级联(MAPK信号)的核心组成部分,可传导细胞增殖、分化等信号。RAF在细胞质中保持自我抑制状态,并通过活化的RAS募集到质膜,被激活后进行信号传递。该信号通路异常通常会导致癌症发生。尽管对KRAS/RAF识别有比较详细的了解,但这种相互作用如何导致RAF激活仍不清楚。研究中涉及到不同激活状态的RAF复合物和RAS结合,互作体系中将含有到3个及以上的分子,传统的方法很难获得准确互作结果。这次我们带来的这篇文献讲述美国丹娜-法伯癌症研究所的工作人员使用MST技术来解析RAF蛋白激活和与RAS互作的关系。

https://doi.org/10.1038/s41467-023-40299-6IF: 16.6 Q1
研究内容
先前对KRAS与RAF的结构研究主要集中在RAF的两个结构域:富含半胱氨酸结构域CRD和RAS结合结构域RBD。为了更好的了解二者的结合以及RAF的激活,作者分析了在MEK1和14-33二聚体的自抑制状态下,KRAS与完整BRAF结合的冷冻电镜结构,并使用MST技术检测不同状态RAF与KRAS亲和力。综合其他实验发现,KRAS结合不足以激活BRAF,说明了RAS结合和激活RAF是可分离的,并提出小分子抑制剂的新思路。
研究结果
为了探究RBD对KRAS结合的可及性,作者使用MST技术检测了不同结构域的RAF与KRAS亲和力。单独的RBD结构域的亲和力最强(26nM),表明RBD结构域是RAF和KRAS结合的主要区域。此外,通过MST技术检测了RAS蛋白与自抑制(Autoinhibited)和活性状态(Active dimmer)下全长BRAF的亲和力。结果显明,二者亲和力相似(126nM/108nM),也就是RAF在自抑制状态下,RBD参与结合KRAS没有任何空间障碍。在获得自抑制或活性状态时,需将RAF蛋白与MEK或者14-3-3二聚体形成复合物,再检测与KRAS互作。MST技术无需固定样品,避免固定过程对复合物的影响,并且在溶液条件下检测,保证互作分子达到结合解离平衡状态,从而获得更加准确的Kd值。
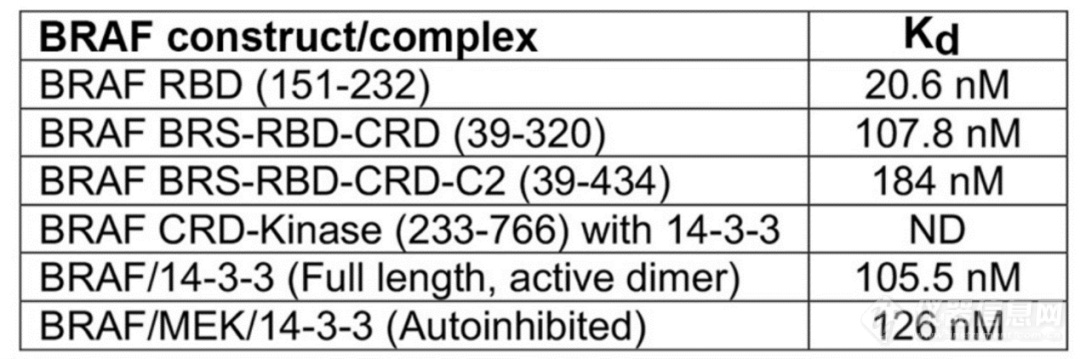
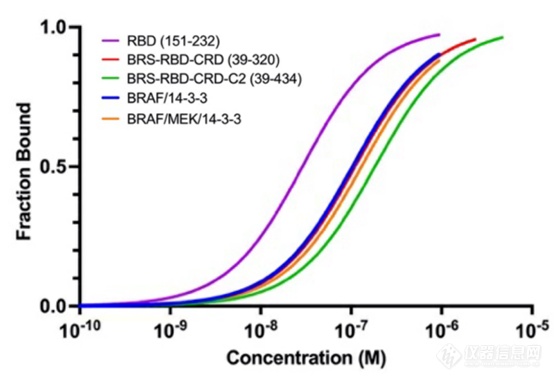
图:MST检测KRAS和BRAF片段或者复合体的亲和力
技术优势
MST技术是在溶液中进行的检测,无需固定操作,能够使靶标蛋白或者复合物保持稳定状态,在涉及到复合物或者多元互作时,可获得更加准确的亲和力结果。

更多![]()
Cell主刊 | MST助力人体抑癌基因研究取得新发现!
厂商
2024.08.14
新品上市 | Andromeda X 全新蛋白质表达和功能快速筛选系统
新品
2024.08.08
让痛风不再痛,NanoTemper专利MST技术精准助力小分子检测 !
厂商
2024.07.24
Eurofins Discovery | 片段药物发现新「组合拳」
厂商
2024.07.18













