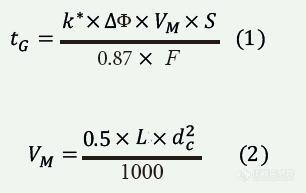第二届药物杂质分析分离学术研讨会即将召开
菲罗门诚邀各位客户参与活动介绍 药物杂质研究是药品研发的一项重要内容,贯穿于药品研发的整个过程,涵盖范围包括新的或仿制化学原料药及制剂。能否规范地进行药物杂质的研究,并将其控制在一个安全、合理的限度范围内,直接关系到上市药品的质量及其安全性,也是药物质量控制的重点。对此,本专委会在各级领导和同仁的支持下,于2018年9月成功主办了“第一届药物杂质分析分离学术研讨会暨实验技术培训班”,并取得了预期的效果。本次会议为广大一线从事药物质量控制的专业技术人员搭建了一个优质的学术与技术交流平台。 籍借第一次会议的成功经验,应广大从业人士的要求,本会定于2019年9月20 ~ 22日在广州召开“第二届药物杂质分析分离学术研讨会”。针对当下药学研究中的异构体杂质、未知杂质、基因毒性杂质、药物包材相容性研究等热点和难点,会议将继续邀请国内知名企业的专家和高校有关研究人员,聚焦于药物杂质研究与质量控制的法规要求、杂质研究疑难案例、色谱分离纯化的理论和实践、手性绝对构型的确定方法等方面,分享其心得。欢迎广大同仁积极参与此次学术盛会,并予以赐稿和分享!会议安排药物杂质分析分离学术研讨会:详见以下会议议程: 时间:2019年9月20日-9月22日; 地点:广州市裕通大酒店4楼国际厅会议时间安排 2019年9月20日 全天报到 2019年9月21日 学术报告 2019年9月22日 离会承办单位1主办单位2承办单位3赞助单位 4媒体支持大会学术委员会名誉主任委员:姚新生主任委员:陈新滋副主任委员:胡文浩委员(按字母顺序):李向军、刘维屏、王越奎、张万斌、章慧大会组委会成员主任委员:章伟光常务副主任委员:高昊副主任委员(按字母顺序):陈金香、曹德榕、李文佳、罗海彬、王健松、吴剑峰、谢斌、叶伟平委员(按字母顺序):陈国栋、范军、关东、何祥久、贺利民、胡丹、胡庆忠、胡祥龙、黄新安、贾丽、江正瑾、姜春来、雷红涛、赖烨才、李娟、廖国超、罗春、刘博、龙玉华、任娇艳、孙平华、吴月华、徐亮、徐振林、严春艳、张鸿、郑俊霞、郑盛润、周小明、周忠玉、朱秋华、王传喜秘书:暴雪风、阮丽君
厂商
2019.09.06
核苷酸专用柱是什么柱?菲罗门为您解答
核苷酸专用柱是什么柱?菲罗门为您解答核酸碱基、核苷和核苷酸的HPLC分析核苷是由含氮碱基与核糖或脱氧核糖缩合而成,核苷与磷酸合成核苷酸。核苷酸主要参与构成核酸,在人体内广泛分布,具有多种生物学功能,如与能量代谢有关的三磷酸腺苷(ATP)、脱氢辅酶等。为满足不同物质的分离要求,菲罗门推荐多款色谱柱对其进行HPLC分析。一、 核苷异构体的分离1.β-胸苷(dT)与α-胸苷的分离ACE C18-AR是一种独特的C18键合的HPLC色谱柱,结合了C18烷基链的疏水作用和苯基的芳香选择性,而且可以耐100%水相,非常适合芳香化合物的分离。色谱条件:色谱柱ACE Excel C18-AR 5μ 150 × 4.6 mm货号:EXL-129-1546U2.尿苷和阿糖尿苷的分离ACE C18-Amide是一款嵌入极性酰胺基团的C18柱,相当于同时具备C18与酰胺基的选择性,同样耐100%水相,很适合分析含氢键给体的物质。色谱柱:ACE Excel C18-Amide 3μ 100 X 4.6 mm货号:EXL-1112-1046U二、 核酸碱基和核苷的分析ACE HILIC-N是ACE三款亲水作用色谱柱中的中性柱,相对于阴阳离子都显示出较低的离子交换能力,通过极性相互作用、吸附和一定程度的分散(分配能力)来保留分离核酸碱基、核糖核苷和脱氧核糖核苷。色谱柱:ACE HILIC-N 5μ 150 X 4.6 mm货号:HILN-5-1546U三、 核酸碱基、核苷和核苷酸的分析Titank C18有机硅胶杂化色谱柱,是在硅胶的硅氧网状构造中以更加稳定的烷基来取代在碱性条件下不稳定的硅氧桥连接,具有宽pH耐受范围(1-12)、低背压和100%水相稳定的特点,对于较大极性的物质有很好的保留。色谱柱:菲罗门 Titank C18 3μ 50 × 3.0mm货号:FMB-5559-YONU四、 单磷酸核苷酸的分离ACE NH2是氨丙基键合的硅胶柱,与ACE其它固定相的色谱柱一样,都是采用超惰性的硅胶制成,具有很好的稳定性和使用寿命。色谱柱:ACE Excel 3μ NH2货号:EXL-1114-1546U五、 九种核苷酸的分离Comixshell AIRP是阳离子嵌入烷基键合的核壳硅胶柱,同时具有反相和阴离子交换选择性,是Comix系列色谱柱中的一种。Comix系列色谱柱可以用来同时检测无机和有机化合物、分离大极性物质及复杂体系。色谱柱:菲罗门 Comixshell AIRP 2.7μ 150 × 4.6 mm货号:FMF-AIRP-EONU总之,不同的疏水性或是极性作用力的固定相可以提供不同的选择性,所以选择正确的固定相是至关重要的第一步。
厂商
2019.09.06
HPLC和LC/MS 缓冲液选择指南:为什么要控制PH值?
HPLC和LC/MS 缓冲液选择指南:为什么要控制PH值?适用于HPLC和LC/MS的缓冲液如果样品中含有离子化化合物,对于反相HPLC(RP-HPLC)分离,流动相pH值可作为控制保留的最重要的变量之一。然而,如果控制不当,pH值也可能诱发诸多问题。由于经RP-HPLC分析的大多数化合物含有一个或多个酸性或碱性官能团,因此大多数流动相需要控制pH值。基于此,缓冲液的使用非常广泛。本手册为实际操作的色谱分析人员重点介绍了流动相pH值的一些重要方面。为什么要控制PH值?图1表明,如果存在离子化化合物,则需要控制pH值。如果酸性溶剂pKa上下浮动超过2个pH单位,则至少99%的部分将分别离子化或非离子化。低于其pKa时,碱基将被离子化;而超过其pKa时,将被非离子化。非离子化形式将具有较小的极性(更疏水),因此在反相体系中能够更加有效地保留下来。所以,pH值较低时,会保留更多的酸性(图1a),而在高pH值下,会保留更多的碱性(图1b)。为什么要控制PH值?如果流动相pH值接近pKa值,那么即便pH的变化极为微小,也会导致保留情况的巨大变化,因此,这不适合稳定分离。图2a说明了部分化合物对pH的微小变化极为敏感。0.1个pH单位的变化就会导致分辨率两倍的变化,这是许多实验室常见的pH调节误差量。图2b显示了酸性、碱性和中性化合物pH值与保留情况的关系。pH为3时,其保留情况比pH为5时更加敏感(对于酸性),而对于碱性,则pH需要大于等于6。而且,当pH接近pKa时,保留时间将不稳定;如果存在类似结构的化合物,相应的峰值间距(选择性)会发生改变。图2 流动相pH值的微小变化对分离的影响。(a)碱性分析物:对氨基苯甲醚、间甲苯胺、对氯苯胺、间氨基苯甲腈(按保留次序);27:73甲醇/磷酸盐缓冲液。(b)酸性(酸):水杨酸;碱;甲基苯丙胺;中性;非那西丁。在选择流动相pH时还应考虑的另一个因素是色谱柱的稳定性。一般来说,硅基色谱柱应在2pH大于8时,硅胶骨架可溶性变强。较高纯度的硅胶比较低纯度的产品更耐受较高的pH值。另一个较为复杂的问题是,硅胶颗粒表面上可能会电离出未键合的硅醇(-Si-OH)基团。对于较老的、纯度低的硅胶(通常称为“A型”硅胶),这些硅醇基团的pKa在pH4-5的范围内。也就是说,在pH>6时,这些材料会发生显著的硅烷醇电离。为什么要控制PH值?一直以来这都是通过阳离子交换过程使碱性化合物达到峰拖尾的主要原因。较新的高纯度(“B型”)硅胶的pKa>7,因此由离子化硅烷醇位点的阳离子交换引起的峰拖尾是最小的。因此,高纯度硅胶比较老的硅胶的峰形更好,正如图3所示分离中的几种碱基成分那样。除了峰形得到改善之外,由于这些不可预测的次级硅烷醇相互作用的减少,高纯度硅胶比低纯度硅胶具有更好的再现性。图3. 高纯度硅胶在减少碱基硅烷醇拖尾的效果。成分:去甲麻黄碱、去甲替林、甲苯(中性)、丙咪嗪、阿米替林。条件:250 x 4.6 mm, 5μm色谱柱;80:20甲醇/25 mM 磷酸盐(pH 6.0);1.00mL/min为什么要控制PH值?未完.....待续
厂商
2019.08.26
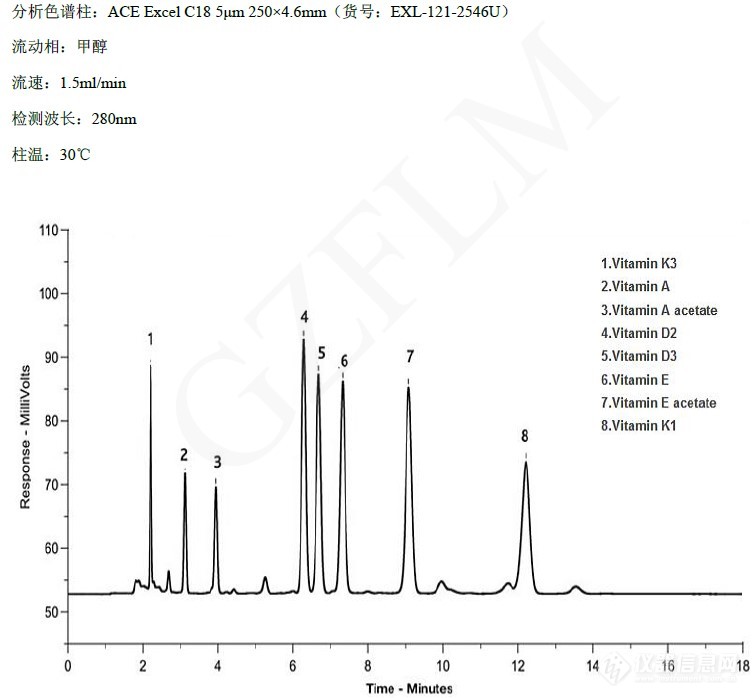
【菲罗门】维生素HPLC分析知多少?
维生素(Vitamin)是一系列有机化合物的统称,最先由波兰化学家卡西米尔?冯克于1912年提出。它是生物体所需要的微量营养成分,而一般不能通过饮食等手段获得。维生素对生物体的新陈代谢起调节作用,适量摄取维生素可以保持身体健康,但过量摄取却可能会导致中毒。维生素也是药店里保健品版块的热门品种。但是ScienceDaily网站报道,近期,美国约翰霍普金斯大学发表在《内科年报》上的一份研究表明,几乎所有的维生素、矿物质和其他保健品都不能延长寿命或预防心脏病,而复合钙和维生素D补充剂可能会略微增加中风的风险。虽然这是可能存在争议的研究结果,但对于国内越来越热的维生素补剂市场也是起到了一定的降温作用。维生素作为重要的食品或者饲料添加剂,在国标或者各种行业、企业标准都有涉及到含量的检测。本文分享一下我们对一些维生素分析的检测的案例: 一、食品中维生素A、D、E的测定(基于GB 5009.82-2016)第一法:食品中维生素A和维生素E的测定 反相高效液相色谱法国标中用的是C30柱,水/甲醇的流动相体系,30 min的梯度方法,我们使用ACE C18-PFP,用磷酸溶液/乙腈体系,14 min的梯度方法就可以实现目标成分的分离,总体更节约分析时间。第二法:食品中维生素E的测定 正相高效液相色谱法国标中用的UPLC的酰胺基柱(1.7u,150*3.0mm)或者HPLC的Si 60硅胶柱(5u,250*4.6mm),以适配不同实验室的仪器条件。其中用硅胶柱的方法中流动相使用了环境不友好的二氧六环,我们在开发方法中避开了该溶剂,使用的流动相为正己烷和异丙醇。第三法:食品中维生素D的测定 液相色谱-串联质谱法固相萃取柱(硅胶):Superclean Silica 500 mg/6ml(货号:9B-T005-06500)色谱柱:ACE Excel C18 1.7um 100*2.1mm(货号:EXL-171-1002U) 第四法:食品中维生素D的测定 高效液相色谱法半制备正相高效液相色谱,色谱柱 ACE Excel SIL 5u 250*4.6mm(货号:EXL-127-2546U)反相液相色谱,国标为甲醇/水=95/5的体系,我们用纯甲醇体系:一、其他维生素分析应用(基于中国药典和其他企业标准)维生素包括脂溶性和水溶性维生素,由于在色谱上表现差异很大,很多会选择不同的色谱柱来分析。比如ChP. 2015中使用氨基柱来分析水溶性的维C银翘片中维C的含量,但也有用户反馈这个方法的稳定性不是太好:另外,对于大极性的水溶性维生素,也有用HILIC柱来分析,如使用TitanK HILIC来分析能量饮品中的水溶性维生素(混标):对于脂溶性维生素,除了TitanK C18,我们还有ACE C18-amide的应用,其中比较难分离维生素D2和D3的分离度非常不错:最后,如果大家有维生素分析的问题,欢迎咨询您专属的菲罗门工程师,我们可以提供案例分享、方法推荐和方法开发等服务,尽最大可能为您解决分析难题。
厂商
2019.08.23
【菲罗门色谱柱】菲罗门色谱柱质量可以吗?
菲罗门技术部电话日常:— 我( 董丽华):您好,菲罗门技术部,请问有什么可以帮助您?— 客户:新柱子,测出来的柱效咋这么低?柱子是不是有问题?肿么回事? 我内心:“听,那是心碎的声音。死亡三联问,击碎了我弱小脆弱的心。突然想到,与其每次授人以鱼,不如借此平台授人以渔。” 言归正传喽首先,常识是:新色谱柱拿到手里,一定要进行色谱柱效能测试。这样,先判断这根色谱柱是否是合格品,很关键的一点是,及时测试柱效后发现问题。一经核实,可向厂家提出退换货。一旦色谱柱正常使用,后续再出现问题,用户很难向厂家申请到退换货的。所以,做新柱子的性能测试,可以保证您的利益。 我们先来了解下色谱柱效能评价(以下以反相色谱柱作为例子)一、反相色谱柱评价条件对于一根填充柱来说,最基本的柱性能评价指标是柱效和峰对称的测定。反相色谱柱评价所需常用的流动相一般是甲醇或者乙腈与水的体系,对于含有酸碱性组份的样品,流动相为甲醇或者乙腈与缓冲盐的体系;检测波长一般在254nm下检测,因为在此波长处,甲醇、乙腈,磷酸缓冲盐均没有紫外吸收,而且标准样品多为含苯环的物质,在254nm波长紫外吸收强,选择此波长检测可以避免流动相戏外吸收的干扰;柱温一般在室温下测定,均不超过30℃;对于通常的标准柱型,即Φ4.6mm×250mm的柱子来说,流速以1ml/min为宜。柱压则为实测值,它不仅与色谱柱有关,而且取决于流动相,以及评价色谱柱的温度与流速。二、反相色谱柱评价的标准物质通常,以指定的一组标准溶质为样品,测定它们在柱子上的理论塔板数,以作为柱效的衡量指标。这种标准溶质的选择,因不同的色谱模式而异,也因不同的使用目的而有所不同。一般情况下,仅选用3-4中中性,例如芳香烃,最多选用5种。要求它们具有不同的保留因子(例如,第一个化合物k=0,其余的在2~10范围内),能反映出对柱子性质的基本要求,而且能在一般的HPLC装置上得到清晰的信号。反相色谱柱评价所用的标准样品各不相同,采用NaNO3,NH2NO3,尿嘧啶,硫脲等作为样品,进行死时间的测定,一般可得较近的结果。虽然很多资料证实尿嘧啶有保留,但因其峰型相对较好等原因一直得到广泛得应用。衡量柱效的物质则千差万别,由苯、萘、菲或苯、甲苯、二甲苯等,一般以最后洗脱出的组分衡量柱效(可以弱化死体积的影响外,同时与色谱柱填料充分接触)。衡量色谱柱分离碱性样品的柱效,不对称度,可用阿米替林。三、可能的影响柱效的因素(除色谱柱本身) 这里我们先不谈峰的对称性,当峰不对称的时候,柱效一定低的,我们暂时只考虑柱效低的影响因素有哪些。柱外效应是指色谱柱之外的造成色谱峰展宽的成因,从进样系统到检测器之间色谱柱以外流路部分,主要由进样装置、检测池及它们与柱之间的连接管路所产生,并对柱效能产生的影响。进样装置的影响:例如手动进样,样品注射的速度影响样品的扩散范围大小,使峰展宽,影响柱效。检测池的影响:检测池体积大,使样品被流动相稀释,不仅会降低检测灵敏度,还使峰展宽。除了池体积大小的影响外,池的结构特点(几何形状)和池内的流动特性(从连接管到样品池由于直径变化引起的)都会影响峰展宽。假如样本同时达到检测池,通过纵向和横向扩散,在检测池中扩散的范围极端值为检测室的体积。所以池体积小,峰展宽会小。目前使用的检测池体积大多数都小于等于8μL,对于常规分析一般没有多大影响。另外,当使用小体积高效柱时,故希望检测池体积小于5μL,微量色谱柱的体积应减少到1μL,甚至更小。连接管对色谱峰扩展的影响,是由于流动相在空管中的流动速度分布的纵断面呈抛物线状,管中心的样品分子比管壁部分的样品分子先到达样品池,因此引起了峰扩展。检测池与色谱柱出口的连接,或者几个检测器之间的连接,应采用细内径连接管并控制最短的距离,以使峰扩展最小。但应注意,连接管内径减小时,管内压力降会有所增加。一般最好使用内径0.1mm(或0.2mm)的不锈钢或PEEK管,长度应尽可能地短。题外话:有时候做方法时,理论上两个物质的分离度大于1.5,但实际最好达2.0,因为不同仪器的样品池和连接管对峰扩展的贡献有可能使在色谱柱上已经分离了的组分在样品池中又重叠混合,转移后的方法重现不出。检测器的参数影响。检测器的时间常数包括检测器传感器和电子元件的响应时间,它间接对色谱系统的最小检测量和最低检测浓度产生影响。一般说来,传感器的响应较快。而检测器放大器和记录仪的时间常数有可能过大,使色谱峰变形失真,导致柱效下降,也影响色谱分析的可靠性和准确性。目前使用的检测器和记录仪的时间常数一般在0.5s-1.0s 就是合适的。标准物质的浓度与进样体积的影响。用两个极端(正常至超载连续图)的例子,用柱效的数学来解释原理。N=16(tR/W)2.其中tR是保留时间;W为峰宽。左图:样品质量对峰宽和峰型的影响,峰1到峰4,进样质量逐渐增大。右图:样品体积对峰宽和峰型的影响,峰1到峰4,进样体积逐渐增大。 上面的图显示,随着样品质量和体积的增大,W增大的程度远大于tR增量,所以tR/W总比值是变小的,此比值与柱效呈正相关,所以柱效会下降。四、总结通过上述的讲解,大家有没有明白柱效为什么会降低呢?有没有体会到拥有“渔技”的快乐?有没有内心从容一些?色谱柱在出厂的过程中有专门优化过的机器来进行色谱柱测试性能,各方面条件和现实中是有差异。所以新购来的柱子在实验室中所测得的柱效,往往低于生产厂家给出的柱效。色谱柱测试时,可以根据厂家随柱附带的测试报告来测试。当然,各实验室可根据自己的要求配制自己的标准溶质。我们技术部建议:第一次柱测试,最好和厂家提供的标准图相比较,选用与厂家相同的测试条件,有可靠的参考标准。1. 常规HPLC色谱柱,数值超过柱报告柱效上70%,则属于合格品。2. 标准物质的浓度与进样体积,请向厂家询问清楚。3. 测试物质选取的不同,作用也是不同的。对于柱效这个参数,一般测定混合物的较靠后面的峰的数值作为比较标准。4. 在HPLC仪器上测试内径小于3mm的色谱柱时,柱效这个数据已经不准确,这个时候要关注出峰时间是否与柱报告上的物质相近(管路长短、宽窄引起时间微小差异),峰是否变形。最好UHPLC仪器来测定UHPLC的小粒径小体积柱。
厂商
2019.08.19
菲罗门展会预告:第二届药物杂质分析分离学术研讨会
菲罗门作为金牌赞助商,将全力支持本次交流活动菲罗门诚邀各位客户参与活动介绍 药物杂质研究是药品研发的一项重要内容,贯穿于药品研发的整个过程,涵盖范围包括新的或仿制化学原料药及制剂。能否规范地进行药物杂质的研究,并将其控制在一个安全、合理的限度范围内,直接关系到上市药品的质量及其安全性,也是药物质量控制的重点。对此,本专委会在各级领导和同仁的支持下,于2018年9月成功主办了“第一届药物杂质分析分离学术研讨会暨实验技术培训班”,并取得了预期的效果。本次会议为广大一线从事药物质量控制的专业技术人员搭建了一个优质的学术与技术交流平台。 籍借第一次会议的成功经验,应广大从业人士的要求,本会定于2019年9月20 ~ 22日在广州召开“第二届药物杂质分析分离学术研讨会”。针对当下药学研究中的异构体杂质、未知杂质、基因毒性杂质、药物包材相容性研究等热点和难点,会议将继续邀请国内知名企业的专家和高校有关研究人员,聚焦于药物杂质研究与质量控制的法规要求、杂质研究疑难案例、色谱分离纯化的理论和实践、手性绝对构型的确定方法等方面,分享其心得。欢迎广大同仁积极参与此次学术盛会,并予以赐稿和分享!会议安排药物杂质分析分离学术研讨会:详见以下会议议程: 时间:2019年9月20日-9月22日; 地点:广州市(具体通知见后续通知)时间安排 2019年9月20日 全天报到 2019年9月21日 学术报告 2019年9月22日 离会承办单位1主办单位2承办单位3赞助单位 4媒体支持大会学术委员会名誉主任委员:姚新生主任委员:陈新滋副主任委员:胡文浩委员(按字母顺序):李向军、刘维屏、王越奎、张万斌、章慧大会组委会成员主任委员:章伟光常务副主任委员:高昊副主任委员(按字母顺序):陈金香、曹德榕、李文佳、罗海彬、王健松、吴剑峰、谢斌、叶伟平委员(按字母顺序):陈国栋、范军、关东、何祥久、贺利民、胡丹、胡庆忠、胡祥龙、黄新安、贾丽、江正瑾、姜春来、雷红涛、赖烨才、李娟、廖国超、罗春、刘博、龙玉华、任娇艳、孙平华、吴月华、徐亮、徐振林、严春艳、张鸿、郑俊霞、郑盛润、周小明、周忠玉、朱秋华、王传喜秘书:暴雪风、阮丽君大会邀请演讲嘉宾1、胡文浩 (“长江学者” 特聘教授,中山大学药学院院长):杂质研究与工艺优化。2、董顺玲 (主任药师,广州市药品检验所副所长):杂质测试方法开发案例分析。3、朱碧君 (主任药师,药包材室主任,江西省药品检验检测研究院):药用复合膜软包装与中药制剂相容性的思考及安全性评价研究。4、陈英 (中国药典委员会化学药品第二专业委员会副主任委员、药品GMP检查员,广东省药检省辅料室副主任):题目待定。5、习宁 (国家千人计划“专家”博士首席科学官、广东省珠江人才计划“创新团队带头人”,广东东阳光药业):合成工艺路线改进的控制基毒杂质策略。6、徐新军 (广东省药品注册评审专家、中山大学药学院教授):基因毒性杂质检测的相关问题。7、谢斌 (珠海润都制药股份有限公司研发总监、博士、珠江青年优秀人才):题目待定。8、赖烨才 (广东研捷医药科技有限公司副总经理, 广东省首批“珠江人才计划”海外青年人才,广州市开发区高层次人才):药物研发中基因毒性杂质的分析策略9、魏少勇 (广州菲罗门科学仪器有限公司副总,液、气相色谱柱技术专业培训师):液相色谱柱的全面认知及其应用选择。10、岛津公司:题目待定。论文征集和口头报告征集1、论文征集:征集与本会主题相关的研究论文、摘要和综述等,将收录在本次会议论文集。格式请参照《今日药学》杂志要求,提交word文档,优秀论文将推荐到《今日药学》杂志;2、口头报告征集:与色谱分离分析发展相关的技术报告,提交PPT,优秀报告将提供10 min的口头报告;3、论文和口头报告征集截稿日期:2019年8月20日;会议费用1、学术大会会务费:会务费:800元/人(学生:600元/人),包含会议资料费等(交通、住宿自理); 由于参会人数有限,请尽早注册。联系我们参会报名
厂商
2019.08.19
菲罗门学术论文奖励活动启动
各位客户: 大家好! 为了激励科研工作者,菲罗门特别设立期刊论文奖励,以鼓励科技创新者。 一、奖励设置 柱名 影响因子 影响因子0-5 影响因子5-10 影响因子10以上 Titank 400元优惠券 800元优惠券 1200元优惠券 Comix 500元优惠券 1000元优惠券 1500元优惠券 手性柱 500元优惠券 1000元优惠券 1800元优惠券 FBX 300元优惠券 600元优惠券 900元优惠券 备注:一篇论文只奖励一位作者,有多位作者的请自行分配奖品 二、申请事项 1.国内各大高校化学、生物医药、食品检验、环保等相关专业的硕士、博士和博士后,各企业,事业单位的工作人员; 2.文章被刊载的时间为2019年8月1日以后; 3.文章中需要注明广州菲罗门科学仪器有限公司、色谱柱品牌和型号; 4.详细信息请联系我司
厂商
2019.08.01
水溶性人造色素分析
水溶性人造色素分析artificial colours (water soluble)conditions column: ace 3 c18 dimensions: 100 x 4.6 mm part number: ace-111-1046 mobile phase:a: 3 mm tetrabutylammonium bromide and 5 mm kh2po4 in h2o b: 5 mm tetrabutylammonium bromide in meoh time(mins) %b 0 45 20 70 30 45 40 45 flow rate: 0.8 ml/min injection: 10 μl temperature: ambient detection: uv-vis, 420 nm, 520 nm and 600 nm 1. amaranth 2. sunset yellow 3. allura red 4. red 2g 5. ponceau 4r 6. carmoisine 7. erythrosine
厂商
2019.07.30
色谱分析 - 氨基酸特点
氨基酸既有酸性又有碱性,意味着它既包含酸性基团(羧酸),又包含碱性基团(伯胺)。 但这些基团通过肽键与残基缩合。 多个氨基酸通过肽键连接形成肽链。 蛋白质/多肽的特征由氨基酸侧链决定。 本文包含详细描述和功能概述。 包括氨基酸的名称、三字母缩写和单字母符号。 氨基酸特性结构丙氨酸ala a类型:疏水性功能:侧链由疏水性甲基组成。与其它疏水性氨基酸一样,丙氨酸协助形成并维持蛋白质的三级结构。精氨酸arg r类型:碱性功能:精氨酸侧链有三个紧密结合的氮原子,是一种碱性极强的氨基酸,ph高达12.5。 精氨酸与天冬氨酸或谷氨酸形成静电复合物(盐桥),强化蛋白质的三级结构。 它还与附着在蛋白质的酸性基团相互作用,例如核酸的磷酸基团。天冬酰胺 asnn类型:弱极性功能:天冬酰胺是脱酰胺的主要位置,也是甘氨酸(低聚糖)的结合点。天冬氨酸asp d类型:酸性功能:天冬氨酸的ph为4,与碱性氨基酸相互作用形成静电复合物(盐桥)。 天冬氨酸还是金属离子等带正电荷基团的结合位点,其功能的发挥在多种蛋白质中很重要。半胱氨酸cys c类型:弱极性(含硫)功能:半胱氨酸在蛋白质的三级结构中具有重要作用,其与其它半胱氨酸侧链发生反应并在多肽链的不同部分形成共价键(二硫键)。谷氨酰胺gln q类型:弱极性功能:谷氨酰胺的脱酰胺作用与天冬酰胺相比较难,因此基本不作为脱酰胺位点。谷氨酸glu e类型:酸性功能:谷氨酸的ph稍高于4,与碱性氨基酸相互作用形成静电复合物(盐桥)。 谷氨酸还是金属离子等带正电荷基团的结合位点,其功能的发挥在多种蛋白质中很重要。甘氨酸gly g类型:中性功能:甘氨酸非常小,侧链仅有一个氢,它作为中性氨基酸在肽链中延伸。组氨酸his h类型:碱性功能:组氨酸侧链为弱碱性,ph在6~7之间。组氨酸能够与酸结合,但取决于环境ph。异亮氨酸ile i类型:疏水性功能:与其它疏水性氨基酸一样,异亮氨酸残基协助形成并维持蛋白质的三级结构。亮氨酸leu l类型:疏水性功能:与其它疏水性氨基酸一样,亮氨酸协助形成并维持蛋白质的三级结构。赖氨酸lys k类型:碱性功能:赖氨酸侧链是伯胺类,ph为~10.5。 赖氨酸与天冬氨酸或谷氨酸形成静电复合物(盐桥),强化蛋白质的三级结构。 它还与附着在蛋白质的酸性基团相互作用,例如核酸的磷酸基团。甲硫氨酸met m类型:弱疏水性(含硫)功能:甲硫氨酸是最可能被氧化的氨基酸。它是发生氧化作用的指示剂。甲硫氨酸氧化还可能影响生物活性。苯丙氨酸phef类型:疏水性、芳香性功能:与其它疏水性氨基酸一样,苯丙氨酸协助形成并维持蛋白质的三级结构。 由于具有芳香性,苯丙氨酸还是紫外光吸收的有效检测目标。脯氨酸pro p类型:弱疏水性功能:脯氨酸是一种独特的氨基酸,其疏水侧链与氨基酸末端连接,在肽链中产生张力,使肽链弯曲。 该结构特征协助形成蛋白质的三级结构。丝氨酸ser s类型:极性(含羟基)功能:丝氨酸通过氢键与其它氨基酸残基或部分蛋白质结合。还能通过氢键与其它蛋白质或基团结合。 丝氨酸还是细胞蛋白质磷酸化的位点。苏氨酸thr t类型:极性(含羟基)功能:苏氨酸通过氢键与其它氨基酸残基或部分蛋白质结合。还能通过氢键与其它蛋白质或基团结合。 苏氨酸还是细胞蛋白质磷酸化的位点。酪氨酸tyr y 类型:极性(含羟基)、芳香性功能:酪氨酸通过氢键与其它氨基酸残基或部分蛋白质结合。还能通过氢键与其它蛋白质或基团结合。 酪氨酸还是细胞蛋白质磷酸化的位点。酪氨酸具有芳香性,提供紫外吸收位点。 色氨酸trp w类型:疏水性、芳香性功能:色氨酸具备多环结构,能够通过氢键延长。由于具备芳香性,色氨酸提供紫外光吸收位点。 色氨酸还能发出微弱的天然荧光。 缬氨酸val v类型:疏水性功能:缬氨酸侧链是一个疏水性异丙基。 与其它疏水性氨基酸一样,缬氨酸协助形成并维持蛋白质的三级结构。 各个氨基酸的丰度 疏水性氨基酸在蛋白质三级结构的形成中起到关键作用,通常位于蛋白质的核心区。 它们约占蛋白质中氨基酸的50%。 极性氨基酸具有很多重要的结构性或功能性作用,丰度一般较高。 丰度最低的氨基酸包括甲硫氨酸、组氨酸、半胱氨酸及色氨酸。
厂商
2019.06.26
ACE色谱柱的特征
ace色谱柱的特征 色谱柱 柱内径(mm) 常规流速(l/min) 样品容量(μg) 最大实际负载 毛细管柱 0.0750.150.300.50 0.000250.0010.0050.01 0.10.212 ---- 微径柱 1.0 0.05 10 - 细孔柱 2.1 0.2 50 - 分析型 4.6 1.0 200 10mg 半制备型 10 5.0 1mg 50mg 制备型 21.1 10-30 5mg 200mg 流速可在不损失分辨率的情况下改变2倍。 样品容量指在不损失分辨率的情况下可分析的多肽量。 最大实际负载指产量和纯度合理的前提下允许纯化的最多多肽量。
厂商
2019.06.26
蛋白质组学
蛋白质组学 蛋白质组学是鉴定和定量细胞、组织或生物体蛋白质的科学,目的是了解生物学变化和疾病状态,开发疾病的生物标记和治疗药物的靶点。 如果将一个基础蛋白的各个修饰蛋白算作一个蛋白,那么哺乳动物细胞含多达3~4万个蛋白。当计算各个修饰后的蛋白时,蛋白质的数量远远超过了10万。 细胞内不同蛋白质的丰度或浓度可能因不同的数量级而变化。 细胞系统的任何变化,如老化、患病或接受药物治疗等均会导致一个或多个蛋白质相对丰度或表达发生变化。 蛋白质组学旨在鉴定细胞系统内的蛋白质,并识别和监测蛋白质的变化,如对蛋白质的修饰(翻译后修饰)或蛋白质相对浓度的变化。 如果某一事件使蛋白质丰度增加,那么我们就说该事件上调蛋白表达。如果某一事件使蛋白质丰度降低,那么我们就说该事件下调蛋白表达。 受细胞变化影响时,蛋白质丰度可能会发生显着变化,蛋白质丰度的变化是事件变化的信号。 翻译后修饰(PTM)是指蛋白质在翻译后的化学修饰。PTM包括寡糖链的添加(糖基化)、醋酸盐等含烷基蛋白质N-端的修饰(乙酰化等)、丝氨酸、苏氨酸或酪氨酸上磷酸基团的加入(磷酸化)等相似活动。 磷酸化等PTM活动在很大程度上是临时性的,用于细胞在细胞内和细胞间信息的传递。 糖基化等PTM活动为结构性改变,通常影响蛋白质折叠、与其他分子的相互作用以及与细胞壁的相互作用。 所有这些代表了活细胞内发生的动态变化。 蛋白质组表示细胞内或任何研究样品中全部的蛋白质。 一个完整的细胞蛋白质组由40000种单个蛋白质组成,具有多达10~20种不同的修饰形式,丰度也因数量级的不同而变化。 蛋白质组学的目标显然是巨大的,要求最强大的分离和分析技术。 电泳A为了实现蛋白质的鉴定和/或定量,必须尽可能地将单个蛋白质与其它蛋白质分离。 很多年来,凝胶电泳法均为分离完整蛋白质的初级手段。 双向凝胶电泳(2DGE)根据蛋白质的等电点(第一向)和分子量(第二向)实现蛋白质的分离(见图48)。 完整细胞蛋白质组的2DGE相当复杂,且在分离多达2000~3000个蛋白质的同时,很难实现蛋白质间的相互分离,或由于某些蛋白质丰度低而很难在凝胶上看到。2DGE仍是强大的蛋白质分离工具,它是一项发展成熟的技术,具有许多经验丰富的用户,能够实现高分辨率和多种蛋白质的定量。 目前,2DGE的局限性是其不仅耗时而且费力,主要衡量丰度更高的蛋白质,较难实现膜结合蛋白等重要蛋白质的衡量。 图48. 双向凝胶电泳可分离出多达2000~3000种单个蛋白质。 每一个斑点代表一个或多个蛋白质。 横向分离由等电点引起,与电荷有关。 纵向分离由分子量大小引起(SDSPAGE)。 分子量较小的蛋白质移到凝胶底部,而分子量较大的蛋白质留在凝胶顶部。 色谱分析色谱技术已发展成一种强大的分离技术,能够分离大量蛋白质和多肽。 但任何一种单独的色谱技术仍然只能分离出一小段蛋白质。 因此,多种色谱技术的结合使用已成为蛋白质组分析中蛋白质分离的一种普遍方法。 二维色谱在长期的蛋白质纯化模式的基础上,John Yates和同事开发了一种名为多维蛋白质鉴定技术(MudPIT)的蛋白质组分析技术。 在该技术中,采用胰蛋白酶等蛋白水解酶首先将蛋白质组中的蛋白质水解成分子量相对较小的多肽。 随后利用离子交换色谱法通过逐步增加盐浓度将这些肽分离。 每一步,略提高盐浓度,将结合能力较弱的肽洗脱至反相磁珠。流动相为乙腈梯度洗脱液,借助疏水性洗脱多肽。MudPIT 法中,依次将离子交换磁珠和反相磁珠装入毛细管柱,从反相部分流出的洗脱液直接进入电喷雾质谱仪(图49)。 这一过程重复多次,能够实现蛋白质组水解产物肽的重要分离(图50)。 二维色谱法分离蛋白酶水解产物多肽的优点是将蛋白质分解成肽,允许凝胶电泳法无法实现的蛋白质分离和鉴定,例如一些疏水性膜结合蛋白和低丰度蛋白。 缺点是有关PTM的信息通常在MudPIT法中丢失。 此外,形成肽的数量要远远多于蛋白质,平均每个蛋白质水解得到20~50个肽,且必须分离。 图49. 多维蛋白质鉴定技术(MudPIT)包括通过离子交换色谱法实现的整个蛋白质组蛋白酶水解产物的初步分离以及对离子交换分离出片段中多肽的反相分离。 将离子交换磁珠和反相磁珠装入毛细管柱,从反相部分流出的洗脱液直接进入电喷雾质谱仪。 图50. 在多维蛋白质鉴定技术(MudPIT)中,盐浓度的逐步增加会使多肽洗脱至柱的反相部分,且乙腈梯度洗脱液会根据疏水性分离多肽。 PTM信息通常在 MudPIT 法中丢失。 此外,形成肽的数量要远远多于蛋白质,平均每个蛋白质水解得到20~50个肽,且必须分离。 较先进的做法是使用亲和色谱法,固定金属亲和层析和卵磷脂亲和层析,以在离子交换分离前或后期进一步分离多肽的亚片段。 蛋白质鉴定用凝胶电泳法分离的蛋白质通常用蛋白酶水解(多数情况下为胰蛋白酶),通过 MALDI 质谱分析得到的多肽,并借助蛋白数据库鉴定。 通过MudPIT和相关方法分离的肽进入电喷雾质谱仪,并借助蛋白质数据库通过质谱法和串级质谱法鉴定。 当鉴定出某种蛋白质的几种肽时,可相应鉴定出该种蛋白质。
厂商
2019.06.26
蛋白质纯化
蛋白质纯化RP-HPLC 是一种有效的蛋白质/多肽纯化工具。 通过 RP-HPLC 法可以从杂质中分离目标蛋白/多肽,采集到的片段可用于进一步研究,以及借助正交分析技术的分析,甚至可作为治疗药物。 在蛋白质/多肽分析过程中,色谱条件优化的目标是优化分辨率和保留时间。 制备色谱法分离蛋白质/多肽时,色谱条件的开发主要是三个参数的优化(参见图45): 产量是从色谱法每一步中得到的纯化的目标蛋白/多肽含量。高产量可提高纯化过程的实用性,并降低成本。 纯度是从目标产物中去除杂质的程度。纯度高有助于从后续分析中获得更佳的数据或获得高纯度产物。 通量用来衡量制备周期中纯化的物质量。高通量说明在给定的成本和时间内获得更多研究或分析用物质,或更多原料药,用于制药领域。 由于制备色谱的目的与分析色谱的目的不同,因此色谱条件优化也不同。 图45. 在蛋白质或多肽的制备纯化中,通过寻求产量、纯度及通量的最佳平衡实现分离条件的优化。 样品装载在分析色谱中,将小样品装载到色谱柱上以确保加样量不影响分辨率。 如果样品量过高,则峰会加宽,进而分辨率会下降。 在不发生峰展宽的情况下允许加载到色谱柱的样品量(“样品容量”)取决于柱的大小(附录列表显示了柱的大小和样品容量)。 制备色谱法纯化蛋白质/多肽时,通常会超出样品容量,使柱“过载”,从而增加产量和通量(图46)。 当允许一定的分辨率损失时,加载的样品量可为样品容量的10~50倍(附录,最大实际负载)。 图46中,尽管由于柱过载使得峰变宽,但峰形相对较好,说明严重过载在增加产量的同时还能保持纯度,但目标蛋白/多肽的损失不可避免。 由于样品过载,图47中峰也同样加宽。 片段收集、分析和利用当柱过载时,通常会抛弃起始峰和结尾峰。 图46中,对红色区标示的峰的中间区域进行了收集。去掉了峰首和峰尾。 这避免了分离度较差的杂质峰的收集,增加了纯度,但降低了产量。 在制备色谱中,对几种感兴趣的峰进行了片段收集,用于杂质分析。 图46.在多肽纯化示例中,制备分离包括柱的过载加样,以增加产量。 分辨率降低,为了增加纯度必须抛弃峰首和峰尾,但产量稍微有所降低。 基于分析结果,收集了少杂质或无杂质的片段,抛弃了峰首和峰尾附近杂质较多的片段。 收集和抛弃片段的选择应考虑纯度和产量的平衡。 例如,在不损失分辨率的情况下,4.6 x 250 mm的“分析”柱可用于纯化少量多肽(最多约200微克)。 但为了增加产量和通量,同样大小的柱最多可纯化10毫克,但会有一定的纯度或产量损失。 恰当的收集峰选择有助于实现纯度和产量间的最佳平衡。 在制备色谱中,尽管重点在样品质量,但样品体积也可能会很大。 尽管可采用样品环和注射器,但通过将样品“泵”至柱上可以注入更多样品。 将泵的吸入管置于样品容器内,样品通过洗脱泵加载至色谱柱。 当有机溶剂浓度低(通常,样品装在水相中)且目的蛋白/多肽以有机溶剂梯度洗脱时,可通过这种方式装入大量样品。 吸附剂粒径分析色谱常用的吸附剂粒径为5μm,制备色谱常用的吸附剂粒径更大。 尤其是加样量超过样品容量时(柱过载),柱效较分析色谱影响较小。 当柱过载时,大粒径填充柱同小粒径填充柱分离蛋白质和多肽的效果一样。 因此,制备色谱常用10μm或以上粒径的吸附剂。粒径分布也往往更宽。 不同于0.5μm或更窄的粒径分布范围,制备色谱的粒径范围更大,例如10~15μm。 由于制备色谱柱反压和成本更低,因此更倾向于采用大粒子。 柱内径由于样品容量很低,纯化过程很少使用小孔柱(内径小于2mm)。 小规模实验室纯化采用细孔柱(内径约2mm)和分析柱(4.6 mm内径)。 这种小规模制备分离的色谱条件通常与分析分离的色谱条件相同。 需要大量蛋白质/多肽时,采用10mm和22mm内径的柱子。1 mg蛋白质或多肽的纯化可采用10 mm柱子,5 mg纯化可采用22 mm柱子。 允许柱过载时,可纯化更多蛋白质/多肽,10mm柱最多可纯化50mg,22mm柱最多可纯化200mg。 大量蛋白质或多肽的纯化采用50 mm、100 mm或内径更大的大内径柱子。50mm内径的柱上已知最多可纯化5克蛋白质/多肽。 柱长与分析柱相比,制备柱往往相对较短。 这是因为在制备色谱法中,柱的总体积比柱长更重要,特别是蛋白质的分离。 内径60cm、柱长12-15 cm(“圆饼状”柱)的色谱柱已应用到蛋白质治疗药物的大规模纯化中。 由于在制备色谱法中,柱通常过载,且效益的重要性远不及产量、纯度及通量重要,因此根据其实用性而非效益优化柱尺寸。 流动相组成同分析色谱法一样,采用10~22mm内径柱的小规模纯化常用乙腈-TFA体系。 大规模纯化通常采用乙醇等溶剂替代乙腈,采用乙酸替代TFA。 尽管采用这些溶剂作流动相会降低分辨率,但它们更适合大规模使用,且分辨率的降低与柱过载固有的分辨率损失相同 蛋白质变性通常认为反相色谱法会使蛋白质变性,因此洗脱出来的蛋白质不是天然蛋白,且可能不具备生物活性。 尽管反相HPLC的操作条件会使蛋白质变性,但洗脱后仍可获得天然、具有生物活性的蛋白质。 有机溶剂可能减弱疏水力,造成蛋白质三级结构的损失。吸附剂的疏水面也可能导致蛋白质的去折叠。 但与色谱分离时间相比,蛋白质去折叠通常较慢,且蛋白质在反相色谱分离期间仅发生轻微变性。 由于二硫键的作用,蛋白质保持球形结构,且仅发生部分去折叠,因此从反相柱洗脱出的蛋白质通常可通过在恰当的重折叠缓冲液中处理,从而恢复其天然结构而恢复至天然状态。 目前有许多实例均显示采用反相HPLC纯化后的蛋白仍维持天然三级结构和生物活性。 胰蛋白酶的反相纯化,其中活性得到了保留,且随后用于蛋白质的胰蛋白酶酶切。 重组人红细胞生成素是一种成功商业化的蛋白质治疗药物,采用了反相高效液相色谱法将蛋白药物从其细胞培养表达系统中分离出来。 采用反相HPLC对另一种商业蛋白质治疗药物——粒细胞刺激因子进行了纯化。 此外,还采用反相HPLC对重组人胰岛素进行了纯化,维持了活性结构。 纯化实例图47显示了合成肽——促性腺激素释放激素(GnRH)拮抗剂的纯化过程。该纯化过程通过以下几个步骤展开: 在4.6 x 250 mm 的分析柱上构建洗脱条件。 在50 x 300 mm 的柱上装载1.2克合成肽混合物,基于第一步构建的条件洗脱(图47)。 对 GnRH 拮抗剂各洗脱峰的片段进行收集并借助分析法分析,最终实现最高产量和纯度。 用乙腈和TFA作为洗脱剂,在反相色谱柱上再次进行色谱分析,完成收集到片段的脱盐处理。 收集片段实现最高产量和纯度。 在该色谱纯化步骤中,从1.2 gm的反应混合液中可收集128 mg的纯化肽。 该纯化过程采用了与分析色谱分离相同的有机溶剂——乙腈,但采用磷酸三乙胺替代了TFA。 由于柱过载,洗脱峰更宽,分辨率不如分析色谱。但峰仍然较为紧密,且容易收集到含目的多肽和GnRH的洗脱液。 图47. 128mg的合成肽——促性腺激素释放激素的纯化。 柱严重过载,导致峰非常宽。 条件 色谱柱:C18宽孔柱,15~20μm粒径,50 x 300 mm。 流动相:乙腈和磷酸三乙胺水溶液梯度洗脱。 样品:促性腺激素释放激素
厂商
2019.06.25
二硫键测定
二硫键测定蛋白质依靠正确的二硫键键合维持其三级结构和生物活性。 如果二硫键被还原或交换,则蛋白质会失去天然三级结构和生物活性。 HPLC保留值取决于蛋白质“疏水脚”的大小(图41),它会受到三级结构的影响。 二硫键的改变通常会使“疏水脚”增大,从而使蛋白质在反相HPLC中的保留值增大。 图42中,天然白细胞介素II的出峰远远早于被还原的白细胞介素II,这是由于当二硫键被还原时,蛋白质的三级结构发生了改变。 图41. 蛋白质保留值取决于“疏水脚”的大小。被还原的二硫键会使蛋白结构发生部分变性,这将增大“疏水脚”和反相保留值。图42. 随着二硫键的还原,白细胞介素II的“疏水脚”会增大,从而增加蛋白质在反相HPLC上的保留值。条件色谱柱:C18 宽孔柱, 4.6 x 250 毫米流动相:44.5%~50.8% 乙腈,以2 ml/min的流速进行90分钟的梯度洗脱样品:白细胞介素II突变蛋白质图43. 对二硫键合正常和发生二硫键交换的类胰岛素生长因子的分离。条件色谱柱:C4 宽孔柱, 4.6 x 250 毫米流动相:20~38% 乙腈:异丙醇(88:12)—0.1% TFA体系,梯度洗脱,27分钟。 即使是细微的二硫键改变也足以对疏水脚产生影响,从而改变保留值。 天然类胰岛素生长因子(IGF)的Cys52和Cys47以及Cys48和Cys6之间都有二硫键(图43A红色部分所示)。 经过36小时的空气氧化,一些IGF蛋白分子内出现了二硫键交换,变成了Cys52和Cys48以及Cys47和Cys6间的二硫键键合(图43A蓝色部分)。 发生了二硫键交换的IGF比天然IGF出峰晚(图43),表明了疏水脚的增大。 天然蛋白的反相色谱法通常以反相保留值的变化揭示二硫键或蛋白三级结构的改变。在蛋白酶水解蛋白过程中(通过省去DTT和羧甲基化过程),如果二硫键未被还原,则肽图中仍会包含二硫键合的二肽。 分别比较二硫键未还原和还原的肽图能够确定二硫键的位置。 在二硫键还原和未还原条件下水解白细胞介素II,通过RP-HPLC法得到两种水解产物的肽图(图44)。 图44A中,以T7+T10标记出的肽是一种二硫键合的二肽。 在二硫键被还原的条件下得到的肽图显示了两种肽,分别为T7和T10(图44B)。 这证实了二硫键存在于这两种肽之间。 监测蛋白质水解产物肽能够确定各个二硫键在蛋白质中的位置。 如果一个胰蛋白酶肽段内存在两个半胱氨酸,则必须利用另一种蛋白酶确定参与到二硫键中的半胱氨酸。通常将肽图分析和质谱法联用确定二硫键的位置和状态。 图44. 分别比较二硫键未还原(A图)和还原(B图)情况下白细胞介素II的肽图。条件色谱柱:C18 宽孔柱, 4.6 x 250 毫米流动相:5~80% 乙腈—0.1% TFA体系,混合梯度洗脱,99分钟。样品:A二硫键未还原情况下白细胞介素II的肽图。B二硫键还原情况下白细胞介素II的肽图。
厂商
2019.06.24
蛋白脱酰胺作用
脱酰胺作用 - 蛋白质和多肽反相HPLC分析和纯化指南蛋白质在高温或高pH值下会降解。 在胁迫条件下,最有可能发生的化学降解是酰胺侧链上的天冬酰胺转变为天冬氨酸或异天冬氨酸(图37)。 天冬酰胺脱去酰氨基时,许多蛋白都会失去生物活性,但也有部分蛋白的生物活性不受影响。 即使脱酰胺作用不造成生物活性的减弱,脱酰胺作用也是蛋白接触不利条件的指示。 特定天冬酰胺残基脱酰胺的可能性取决于其在蛋白质三级结构中的位置。 只有那些与溶剂接触表面接近的天冬酰胺残基才会发生脱酰胺作用。 相邻的氨基酸残基同样影响脱酰胺作用的可能性。与天冬酰胺相邻的甘氨酸极大地增加了脱酰胺作用的可能性。 与天冬酰胺相邻的亮氨酸和异亮氨酸等大分子疏水性氨基酸降低了脱酰胺作用的可能性。 由于脱酰胺作用会影响生物活性并能指示不利条件,因此惯常的做法是监测蛋白质治疗药物中天冬酰胺的脱酰胺作用。 图37. 当酰胺侧链暴露在高温和/或高pH条件下时,天冬酰胺转化为天冬氨酸。 图38. 人生长激素脱酰胺作用的反相色谱分析条件色谱柱:C4 宽孔柱, 4.6 x 250 毫米流动相:29% 异丙醇,71% 10 mM Tris盐酸缓冲液、pH=7.5这通常由反相高效液相色谱法实现。 图38显示了通过完整蛋白分子的反相色谱法测量人生长激素的脱酰胺作用的一个试验。 该试验pH为7.5,以使脱酰胺作用产生的天冬氨酸电离。 这使得脱酰胺的生长激素相较于天然蛋白疏水性减弱,从而比天然蛋白先洗脱出来。更常见的一种方法是通过肽图中含天冬酰胺/天冬氨酸多肽的保留时间来测定脱酰胺作用。 在pH为2的肽图中,含有天冬氨酸的脱酰胺肽的疏水性比含天冬酰胺的天然肽略强,因此比天然肽略晚洗脱出来,如图39所示。 脱酰胺肽容易鉴别测定,为脱酰胺作用的判定提供了较好的方法。图39. 部分脱酰胺的核糖核酸酶的肽图条件色谱柱:C18 宽孔柱, 4.6 x 250 毫米流动相:5%~38% 乙腈—0.1% TFA体系,混合梯度洗脱,100分钟。有时,脱酰胺肽较难从天然肽中分离或会在肽图中出现与其它肽的共洗脱峰。 如果分辨率不足,则可以增加pH。 如图40所示,在低pH值下分离较差的脱酰胺肽能够在6.5的高PH值下从天然肽中有效分离。 在部分脱酰胺的人生长激素的低pH肽图中(图40A),脱酰胺肽出峰稍晚于天然肽,但与肽图中的另一种肽未分离。 对肽峰进行收集后以更高的pH(pH6.5)重新进行色谱分离。在高pH值下,脱酰胺肽中的天冬氨酸被电离,出峰早于含天冬酰胺的天然肽,且峰形好(图40B)。图40. 部分脱酰胺的人生长激素的肽图中脱酰胺肽从天然肽的分离。A pH=2时,部分脱酰胺的hGH的肽图(0.1% TFA)B 收集含天然肽(顶部)和脱酰胺肽(底部)的肽图A中的肽段,在6.5的pH下重新进行色谱分析。色谱柱:C4 宽孔柱, 4.6 x 250 毫米A. 流动相:乙腈-0.1% TFA体系梯度洗脱,pH 2.0B. 流动相:乙腈-30 mM 磷酸钠体系梯度洗脱,pH 6.5
厂商
2019.06.21
蛋白质氧化
蛋白质氧化 - 蛋白质和多肽反相hplc分析和纯化指南在氧化环境条件下,尽管蛋白质的几个氨基酸都可能受影响,但最有可能被氧化的氨基酸是甲硫氨酸;甲硫氨酸可被氧化成甲硫氨酸亚砜(图34)。 对甲硫氨酸残基的氧化取决于其在蛋白质中的位置。埋藏在蛋白质内部的甲硫氨酸不可能被氧化。接近表面且与溶剂接触的甲硫氨酸侧链最有可能被氧化。 氧化条件包括热、过渡金属的存在以及溶液中氧气的存在。 同脱酰胺作用一样,甲硫氨酸的氧化可能导致生物活性的丧失或减弱,或者,在一些情况下对生物活性无影响。 这取决于甲硫氨酸在蛋白质中的位置。但另一方面,甲硫氨酸亚砜的存在说明蛋白质经受过氧化条件,因此甲硫氨酸氧化可以指示蛋白质经受过胁迫条件。 图34. 在氧化环境条件下,甲硫氨酸被氧化为甲硫氨酸亚砜。 图35. 天然蛋白水解产生的重组人凝血因子viia的一氧化物和二氧化物的反相色谱法分离。 条件色谱柱:c4 宽孔柱, 4.6 x 250 毫米流动相:37~47% 乙腈-0.1% tfa体系,30分钟梯度洗脱。样品:被过氧化氢部分氧化的重组人凝血因子 viia。通常会监测蛋白质治疗药物的氧化反应,因为它既可能影响生物活性,也可作为一种指示。 甲硫氨酸的氧化反应会导致蛋白质疏水性下降,因此在反相hplc中,氧化蛋白会先于天然蛋白洗脱出来,如图35所示。 重组人凝血因子viia(rcf viia)被过氧化氢部分氧化后利用反相hplc对溶液进行分析。 氧化蛋白(两个甲硫氨酸残基被氧化)先洗脱出来。 只有一个甲硫氨酸被氧化的两种蛋白随后洗脱出来,最后是天然蛋白。四种蛋白具有良好的分辨率。 尤其是只有一个甲硫氨酸被氧化的两种蛋白间分辨率很高。这几种蛋白均有一个氧化甲硫氨酸,仅区别于被氧化甲硫氨酸的不同。通常利用肽图监测甲硫氨酸的氧化。 如图36所示,含氧化甲硫氨酸的多肽比含天然甲硫氨酸的多肽出峰时间早很多。t2 metox 先于天然t2胰蛋白酶水解片段洗脱出来;t11 metox先于天然 t11洗脱出来,使得鉴别和监测更容易。图36. 部分氧化的人生长激素的肽图。 条件色谱柱:c18宽孔柱,4.6 x 250 mm流动相:0~40% 乙腈—0.1% tfa体系,梯度洗脱,120分钟。
厂商
2019.06.20
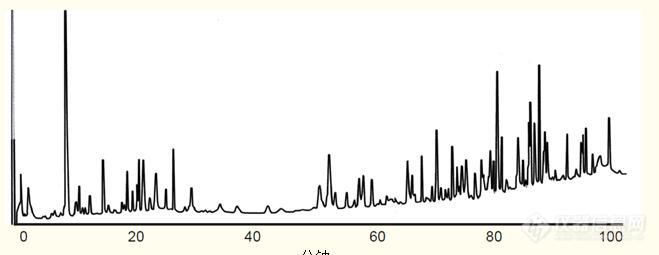
肽图分析法
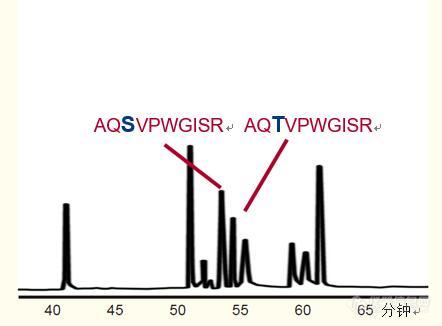
肽图分析法 - 蛋白质和多肽反相HPLC分析和纯化指南反相高效液相色谱已成为蛋白质分析和表征的标准方法,尤其是治疗性药物的分析和表征。 反相色谱分析法分辨率高,检测灵敏度好,能够提供大量关于蛋白质的信息。 有些时候,蛋白质作为完整的分子分析,但更多的时候采用蛋白水解酶作用于特殊的氨基酸残基将碳骨架断开,从而将蛋白质裂解成小片段。 随后用反相高效液相色谱法对裂解产生的肽段进行分析。 该技术叫作肽图分析,是一种标准的蛋白质分析方法。通过反相色谱分析蛋白质裂解后的肽段能够获得蛋白质的大量信息。通过比较表达蛋白与参照标准蛋白的肽图能够得出蛋白纯度和表达的准确性。肽图通常作为蛋白质治疗药物的鉴定分析工具。 通过肽图可以确定蛋白质降解产物,如发生脱酰胺作用的天冬酰胺和氧化甲硫氨酸。肽图可以确认或验证二硫键连接,以此得出蛋白质三级结构和疗效。肽图能够确定糖基化(加入碳水化合物)位点,为详细鉴定连接在其上的寡糖提供了条件。利用质谱检测得到的肽图为蛋白质鉴定、肽序列分析和数据确认提供了一种先进的手段。在生物蛋白质组研究中,蛋白酶水解产物还用于蛋白质的鉴定和定量分析。 有许多蛋白水解酶都能断开蛋白质的碳骨架,通常作用于特殊氨基酸残基。包括: 蛋白酶特异性特性胰蛋白酶作用于赖氨酸和精氨酸的羧基端平均每10~12个氨基酸产生一个肽。胰蛋白酶是最常用的蛋白水解酶。胞内蛋白酶 Lys-C作用于赖氨酸的羧基端能够产生胰蛋白酶水解蛋白生成多肽的60~70%。Lys-C 的优点是在高达4M的尿素浓度中仍能保持活性。S.aureus V8 蛋白酶作用于酸性氨基酸和天冬氨酸的羧基端。为胰蛋白酶水解法提供补充信息。胞内蛋白酶 Asp-N作用于天冬氨酸的羧基端为胰蛋白酶水解法提供补充信息。 胰蛋白酶是最常用的蛋白水解酶(蛋白酶)。以下为胰蛋白酶水解蛋白的五个阶段:(注:参考文献21详细回顾了胰蛋白酶的水解) 变性。要在合理的时间内完成蛋白质水解,必须对蛋白质作变性处理。高温下(37℃),将蛋白质置于6M 盐酸胍或8M 尿素等离液剂中,在中性pH值(~7.5)缓冲液下处理30分钟,蛋白质即可变性。二硫键的还原。二硫键会阻止蛋白质的完全变性。 通常可通过在待水解蛋白的变性过程中加入浓度为~20 mM 的二硫苏糖醇(DTT)等还原剂将二硫键还原。游离半胱氨酸的羧甲基化。如果还原性半胱氨酸保持游离状态,则有可能以错误的方式重新形成二硫键。为了避免这种情况,可加入浓度为~60mM的碘乙酸等试剂,在37℃温度下处理30分钟,使游离半胱氨酸甲基化。该反应由100 mM DTT 退火。脱盐。当溶液中存在尿素或胍盐时,水解反应无法进行,因为胰蛋白酶自身作为一种蛋白质会变性,失去酶活性。 尿素或胍盐必须通过离子交换或渗析去除或将浓度降低至1M以下。胰蛋白酶水解。脱盐后,将蛋白质溶解在pH7.5~8.5(胰蛋白酶的最高活性pH)的缓冲液中——Tris或碳酸铵,并在20~100个待水解蛋白组分中加入一份胰蛋白酶,随后在低温至37℃的温度区间内处理蛋白质。 低温处理时间长达16个小时。在37℃下,水解可在1~4小时内完成,具体取决于蛋白质。如果胰蛋白酶的时间、温度或相对浓度均过低,则水解将不完全,一些潜在裂解可能不发生,最终导致形成含赖氨酸或精氨酸的大分子肽。 如果胰蛋白酶的水解时间、温度或浓度均过高,则会发生胰蛋白酶自身溶解,产生“自溶产物”,即胰蛋白酶水解产生的肽段,从而造成混淆。 惯常的做法是忽略蛋白质,考虑胰蛋白酶。按照蛋白质完全水解的条件对得到的样品进行色谱分析,了解胰蛋白酶自溶的程度以及肽图中任何胰蛋白酶自溶肽产物的位置。 开发胰蛋白酶水解协议过程中,对胰蛋白酶和蛋白质的水解时间、温度和相对浓度进行了优化。当利用肽图确定二硫键的位置时,必须在不还原二硫键的情况下水解蛋白。但在二硫键未被还原的情况下,许多蛋白质的水解速度非常慢。在缺还原剂的情况下,如果水解速度很慢或水解不佳,可利用Lys-C代替胰蛋白酶,并在4M尿素中水解,维持水解过程中蛋白质的变性。 水解过程中有时采用表面活性剂维持溶液中的蛋白质,但表面活性剂会降低色谱分辨率,应尽量避免。 胰蛋白酶水解分析。蛋白质水解产生的肽段利用反相高效液相色谱分析,流动相采用含TFA体系(参见第15-17页),以起始浓度约5%的乙腈梯度洗脱(乙腈起始浓度低于5%可能导致较早洗脱出肽的色谱的不可重现性),乙腈浓度逐渐升至70%(参见图31)。 梯度洗脱的时间取决于待水解蛋白的大小。 大分子蛋白比小分子蛋白水解产生更多的肽段,因此肽段的分离需要更长洗脱时间。 小分子蛋白(小于20kd)水解产生的肽通常可在45~60分钟内完成分离。 大分子蛋白(20-50kd)需要较长的洗脱时间,一般为60~120分钟。 分子量大于50kd的蛋白质需要120~180分钟的洗脱时间。 采用1~2 ml/min 的流速和适宜的温度时分辨率最佳。通常采用C18 反相柱。可以使用孔径为100埃或300埃的柱子,其选择性通常不同。图31. 牛血清白蛋白的肽图 色谱柱:ACE 5 C18-300 宽孔柱,4.6 x 150 mm 流动相:4%~70%乙腈-0.1% TFA 体系,混合梯度洗脱120分钟。 蛋白质修饰引起肽保留时间的变化。如果蛋白质因翻译或表达错误,降解(脱酰胺作用、氧化反应)或过程变异而改变,则这种改变将会反映在一种或多种肽段。 由于与肽的反相相互作用的灵敏度,肽的任何变化都将导致该肽保留时间的变化。 在图32示例中,相差一个氨基酸的两种十肽,其中一个为苏氨酸,另一个为丝氨酸,在反相HPLC图谱中出现了两个峰。 不仅仅是一个氨基酸的差别,而且两种氨基酸均为羟基氨基酸,它们的不同之处在于苏氨酸侧链上加了一个甲基。 这说明了蛋白质的任何变化都会反映为肽的变化,从而导致该肽保留时间的改变。 肽图分析的本质是反相HPLC能够实现差别细微的多肽的分离。图32. 以RP-HPLC对紧密关联的肽类进行分离。 仅有一个氨基酸不同的两种十肽菌素,一种含丝氨酸,而另一种含苏氨酸。条件色谱柱:C18 宽孔柱, 4.6 x 250 毫米洗脱液:A. 含有0.1%三氟乙酸的水溶液B. 含有0.08%三氟乙酸的乙腈溶液梯度:0 - 35%的B溶液超过73分钟 试样肽图与参照蛋白质肽图的比较。肽图能够提供有关蛋白质的很多信息。 惯常做法是对试样的肽图和参照蛋白质的肽图进行比较。 图33对重组人生长激素(在大肠杆菌中表达)的肽图和天然人生长激素(缺乏甲硫氨酸)的肽图进行了比较。 由于甲硫氨酸的疏水性质,重组人生长激素比天然人生长激素较晚洗脱出来。 在这个例子中,为了便于比较,将第二幅图谱倒置显示。 在一些情况下,为了确认微小的变化和证明分析工具与肽图的变化无关,会将两种水解产物混合进行色谱分析。肽图比较揭示了蛋白质的改变和修饰,如:基因改变、翻译错误、蛋白降解(脱酰胺作用、氧化反应),以及翻译后修饰的改变。图33. 重组人生长激素和天然人生长激素(缺乏甲硫氨酸)肽图的比较。条件:色谱柱:C18宽孔柱,4.6 x 150 mm流动相:0~70% 乙腈-0.1% TFA 体系梯度洗脱
厂商
2019.06.19
质谱联用蛋白质和多肽反相HPLC分析
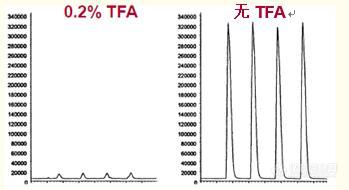
反相高效液相色谱和质谱(MS)的联用为蛋白质/多肽分析提供了强大的工具。20世纪80年代,约翰·贝内特·芬恩和他的同事们开发了电喷雾离子源,使质谱与反相高效液相色谱得以联用。 采用液相色谱-质谱联用的好处包括: 质谱是非常灵敏的检测技术。质谱可以提供所分离多肽/蛋白质的分子量。质谱可利用分子量特异性检测蛋白质。片段信息有助于确认多肽。质谱基于电荷和质量进行分离和测定,因此,与基于疏水性分离的反相色谱“正交”。高效液相色谱-质谱联用广泛用于肽图的分析,提供了一种正交检测肽法(参考文献15)。 如图26所示,总离子质量色谱图与紫外色谱图相似,但由于正交检测的使用,峰的大小不同。 事实上,采用紫外检测出现的小峰在质谱图中会更明显(见图26“*”)。 图26. 肽图的分离可以通过紫外检测和质谱检测来监测。 峰高是检测法的一个函数,在紫外图谱和质谱图谱间有明显不同。 特别是用“*”标示的肽对。它们在UV检测图谱中显示的峰值较小,但在质谱图中峰值较大。 通过测定每个峰中肽的分子量,质谱分析法为识别RP-HPLC法分离的峰提供了有用的信息。 由于质谱与反相高效液相色谱正交,因此质谱还能确定峰纯度或显示两种或两种以上肽的共洗脱,并能提供肽的分子量。 图27以肽图中的三个峰值展示了这一点。A峰较早洗脱出来,是分子量为439道尔顿的四肽。B峰是一种糖肽,有寡糖或多聚糖吸附。 通过质谱图中B峰存在质荷比为204和366两种离子确定,这表明存在糖基化反应。C峰是一种二硫化物连接的二肽——由二硫键连接的两个多肽。 显示该肽有四种离子形式:+1、+2、+3和+4。只有含两个氨基末端和两个碱性氨基酸的二肽才会出现+4离子。图27. 反相色谱强大的分离能力与第二个维度的质谱的结合为肽图提供了大量的信息。A. MS确认A峰代表小分子肽。B. 检测到的B峰代表含多聚糖(糖)的肽。C. C峰代表一种二肽——由二硫键连接的两个肽。HPLC-MS联用的两个重要因素是电喷射接口的最佳流速及三氟乙酸对肽电离的影响基本电喷雾接口的信号在5~10μL/min的流速区间上迅速下降(图28)。 这与采用标准分析型HPLC柱的流速不相容。 目前,商用电喷雾提供一种高剪切流氮气辅助的电喷雾(气流辅助电喷雾),它将电喷雾的最佳流速区间提升到了200~500μL/min。 这仍然低于标准分析柱通常所用的最佳流速,因此,目前科学家在使用HPLC-MS时,普遍采用流速为200~300μL/min的细孔柱(内径~2 mm)图28. 红线表示基本电喷雾接口流速与信号响应的关系。蓝线同样表示气流辅助电喷雾的信号响应。 如图29所示,流动相中的TFA流入电喷雾接口导致蛋白质和多肽的信号减弱。 这是由于TFA和多肽间强烈的相互作用将多肽中和。图29. 使用电喷雾接口时,TFA的流入会大幅减弱多肽的信号。有两种方法可纠正由TFA引起的信号减弱:忽略信号损失。通常,当信号足够强大时,即使信号减弱也仍能获得有用的数据。在这种情况下可以忽略信号损失。当信号损失过多时,最佳的解决方案是将高纯度硅胶柱与低浓度TFA结合使用。高纯度硅胶柱与低浓度TFA一同使用仍能维持较好的峰形(图30)。 采用高纯度硅胶柱能得到良好的信号响应和峰形。其它方案包括用甲酸代替TFA或柱后采用乙酸或丙酸代替TFA。 但采用甲酸得到的峰形不如TFA,分离度也不如TFA,因此会影响性能。 这在蛋白质组学应用中可以接受,但在蛋白质治疗药物中不可行。 柱后替换TFA较为棘手,且会导致分辨率下降。图30. 高纯度硅胶与低浓度TFA一同使用,保持肽的峰形。 色谱柱:ACE 5 C18, 4.6 x 250 mm(高纯度硅胶)洗脱液:加入如图所示的TFA,以10%-55%的乙腈(ACN)梯度洗脱,洗脱时间为37.5分钟。
厂商
2019.06.18
蛋白质和多肽反相HPLC分析的检测和温度
灵敏的检测 - 蛋白质和多肽反相HPLC分析和纯化指南利用反相高效液相色谱法分离多肽时,通常通过在214-215 nm波长附近的紫外吸收检测。肽键在这一波长范围内吸收较好,为各类型多肽提供最灵敏的检测。 采用短波紫外波段检测的一个问题是流动相的吸收。 在波长215 nm处,乙腈不吸收紫外光,但TFA会略有吸收。 在梯度洗脱期间,增加有机溶剂的浓度会使溶液的介电常数发生改变,这将引起TFA在短波紫外波段吸收光谱的变化。 这一吸光度变化会导致基线上飘,如图21所示。在需要灵敏检测时尤其明显。在示例中,多肽图谱经常显示出基线飘高(图22)。避免基线漂移的常见做法是降低有机溶剂中TFA的浓度(相对于水溶性溶剂)。 如果在水溶性溶剂中加入0.1%的TFA,则在有机溶剂中加入0.08-0.09%的TFA。这将使多肽图谱中的基线趋平。 图21. 梯度洗脱期间,增加乙腈的浓度会改变流动相的介电常数,从而由于TFA吸收光谱的变化导致基线飘高。 图22. 随着有机溶剂浓度的增加,TFA吸收率变化可能引起多肽图谱中基线的漂移。 温度的影响 - 蛋白质和多肽反相HPLC分析和纯化指南柱温和流动相温度会以两种方式影响多肽的分离。 随着温度上升,保留值会略微降低。 但更重要的是,肽对的相对保留值(选择性)取决于温度。 选择性随温度的变化影响分辨率,且在一系列多肽分离的优化中,温度是重要因素,如蛋白酶水解蛋白质期间产生的多肽。温度在一系列合成肽分离中的作用如图23所示。 随着温度的增加,多肽保留值略有下降,但更重要的是,肽对间的分辨率随着温度的变化而变化。 因此,在多肽的分离中,控制柱温和流动相温度很重要。 此外,温度还是肽分离优化的重要变量,尤其是肽图谱中的分离。温度会显着影响肽图谱中多肽的分离,如图24所示。 该示例为从人生长激素的胰蛋白酶水解物中分离多肽,增加柱温不仅影响肽的选择性,还会造成洗脱顺序的逆转。肽7和8在较高温度下的分辨率更高。 肽11~13的最佳分离温度为40°C,温度提升至60℃会出现肽11和12的共洗脱峰。 肽14和15的最适分离温度为20°C,肽15先出峰。 温度升至40℃时会使肽14先于肽15洗脱。 温度升至60℃时会提高肽14和15的分辨率。 在肽图谱中可以明显看出柱温对分辨率有显着的影响。图23. 多肽保留值随着温度的增加而降低。更重要的是,温度影响相对保留值或选择性,进而影响分辨率。条件色谱柱:C8,2.1 x 150 mm流动相:0~30% 乙腈—0.05% TFA体系,梯度洗脱,60分钟。样品:合成螺旋多肽和非螺旋多肽图24. 通常,蛋白水解产生多肽的相对保留值会受到温度的影响。 条件色谱柱:C8宽孔柱,4.6 x 150 mm流动相:0~60% 乙腈—0.1% TFA体系,混合梯度洗脱,60分钟。样品:人生长激素的胰蛋白酶水解物与多肽分辨率相比,蛋白质分辨率受温度的影响较小,但温度较高时,蛋白质的峰形和回收率均有所改善,特别是大分子蛋白或疏水性蛋白。在环境温度下,单克隆抗体图谱的峰形较差,但当温度升高时,峰形会有明显改善(图25)。通常在高温下用色谱法分析大分子蛋白或疏水性蛋白的效果最佳。图25.温度对反相高效液相色谱法(RP-HPLC)分析重组单克隆抗体的影响。 条件色样品:重组单克隆抗体谱柱:C8 宽孔柱,3.5 微米,4.6 x 150 mm流动相:混合液梯度洗脱:20-90% 乙腈-0.1% TFA体系
厂商
2019.06.17
蛋白质/多肽液相分析中的流动相选择
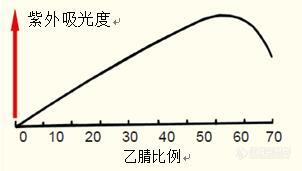
蛋白质/多肽液相分析中的流动相选择有机溶剂可将吸附在疏水界面的蛋白质洗脱(图14)。 在梯度洗脱期间,当有机溶剂量达到针对每一蛋白质的特定浓度时,蛋白质就会从疏水界面上解吸,继续顺着柱向下,从而从柱中洗脱。图14. 当有机改性剂的浓度达到特定值时,蛋白质从疏水界面洗脱。乙腈。在多肽的反相色谱分离时最常用的有机溶剂为乙腈。为什么选择乙腈? 乙腈易挥发,易从样品中去除。乙腈黏度低,柱压低。乙腈的紫外吸收截止波长较短。乙腈长期用于分离应用。异丙醇。异丙醇在多肽的色谱分离中具有重要作用。尽管异丙醇黏度大(会增大柱压),很少单独用作有机改性剂,但其在提高一些多肽的回收率方面具有重要作用,尤其是强疏水性蛋白。 在此类情况下,以1%~5%的恒定浓度加入异丙醇,以提高疏水性多肽的回收率或洗脱。 其它有机改性剂。很少使用甲醇或乙醇等有机改性剂,除非在分离强疏水性蛋白时。此外,由于乙醇毒性低,因此还用于蛋白质的大规模纯化。 梯度洗脱。多肽的洗脱几乎都采用梯度洗脱法,采用梯度洗脱法分离时,逐渐增大有机溶剂的相对浓度。 当有机改性剂的浓度升到解吸所需的特定浓度时,蛋白质和多肽就从柱上洗脱。如图15所示,有机改性剂的浓度(梯度)变化速率越慢,这些蛋白亚基的分辨率越高。 在该例中,相较于每分钟0.5%的梯度变化速率,每分钟0.25%的梯度变化显着提高了分辨率。蛋白质/多肽的保留机制的图1中显示了采用每分钟0.15%的梯度变化速率时几种胰岛素的分离过程。采用每分钟0.05%的梯度变化速率洗脱时,分辨率最大。 图15. 一般情况下,降低有机溶剂浓度变化速率会提高分辨率。 A. 细胞色素c亚基 B. 色谱图A中间片段的重现。 色谱柱:C4 宽孔柱, 4.6 x 250 毫米 降低梯度变化速率增加分辨率时,所需的分析时间必须尽可能短。但是,梯度变化速率的调整在优化蛋白质和多肽的分辨率方面非常重要。 有时,降低梯度变化速率时,多肽会表现出特异行为(图16)。分辨率有时不会按照预期增加,反而会降低,导致出现共洗脱,甚至洗脱顺序也会颠倒。在图16的示例中,洗脱时间为45分钟时多肽11和12表现出最佳的分离效果。当洗脱时间增加至90分钟时,多肽11和12间的分辨率降低;而当洗脱时间增加至160分钟时,出现共洗脱峰。这种保留行为是多肽表面相互作用的结果,导致这种行为的原因目前尚不清楚。因此,在进行多肽分离时,尤其是在分离蛋白酶水解物时,观察分辨率随梯度坡度降低的变化很重要。如果分辨率未增加,反而降低,则必须优化梯度变化速率,以最大化整体分辨率。图16. 多肽间分辨率有时随着溶剂浓度变化速率的降低(洗脱时间增加)而降低。 这将导致分辨率降低或共洗脱峰的出现,如人生长激素肽图中多肽11和12例示。 在一些情况下,多肽甚至会逆转洗脱顺序。 样品人生长激素的胰蛋白酶水解物。部分显示了多肽图谱。 色谱柱:C18宽孔柱,4.6 x 150 mm洗脱液:梯度:0~60%乙腈与水溶性溶剂和0.1%TFA混合液和有机溶剂与0.08%TFA混合液在一定时间内形成梯度洗脱。 蛋白质和多肽的反相色谱分析法需要“离子对试剂”。 在流动相中加入离子对试剂,以实现良好的峰形。 目前认为,在没有离子对试剂的情况下,硅胶表面的金属杂质是导致蛋白质/多肽峰形较差的原因。 三氟乙酸。三氟乙酸(TFA)是最常用的离子对试剂。将浓度为~0.1%的三氟乙酸加入流动相,会在大多数柱上产生良好的峰形(图17)。 降低TFA的浓度能提高LC-MS的检测灵敏度(见22~25页),但由于硅胶表面存在杂质,可能会导致硅胶柱上的峰形较差。 但采用高纯度硅胶柱时,可加入低浓度TFA(图17A——0.01% TFA)。图17. TFA浓度对峰形和选择性的影响 洗脱液:加入如图所示的TFA,以20%~32%的乙腈(ACN)梯度洗脱,洗脱时间为15分钟。样品1.血管紧张素II 2.血管紧张素III3.血管紧张素I 其它离子对试剂。尽管目前为止TFA仍是最常用的离子对试剂,但蛋白质/多肽分离有时会采用磷酸和七氟丁酸(HFBA)等其它试剂。 如图18所示,一些情况下,磷酸可分离一些TFA无法分离的多肽。通常磷酸盐使用浓度约为20-30 mM,pH为2~2.5。此外,磷酸盐缓冲液对一些蛋白质的分离效果要优于TFA。 尽管同TFA一样,磷酸盐缓冲液使用的pH通常较低,但磷酸盐缓冲液也能适应较高的pH,为选择性和分辨率的改变提供了机会(见17页)。 将磷酸盐作为离子对试剂的主要弊端是:磷酸盐不挥发,很难从肽中去除。 一些时候,七氟丁酸用作组蛋白等碱性蛋白分离的离子对试剂 图18. 使用除TFA以外的离子对试剂可能会产生不同的选择性条件色谱柱:C18 宽孔柱, 4.6 x 250 毫米洗脱液:A.4%~40% 乙腈—0.1%TFA体系,pH=2,18分钟梯度洗脱。B.4%~40% 乙腈—20mM 磷酸体系,pH=2,18分钟梯度洗脱。样品:缓激肽神经降压素蛙皮素章鱼唾腺精pH值对多肽保留行为的影响。不论采用TFA和磷酸,还是其它离子对试剂,用于多肽分离的反相流动相通常适应的pH值较低。 在低pH值条件下,羧酸基团——端羧基,以及天冬氨酸和谷氨酸的侧链会进行质子化,且仅有轻微极性。 将流动相的pH值增加至6~7将会使羧酸基团离子化,减弱多肽的疏水性。这将降低各种多肽的保留值,但尤其影响含天冬氨酸或谷氨酸的多肽(图19)。 与其它多肽相比,含天冬氨酸和谷氨酸的多肽的保留值降低更多,从而改变了选择性。尽管增加多肽分离流动相pH的做法不经常采用,但它可以在一些特定情况下发挥作用。 图19. 流动相的pH值会影响多肽的保留值,尤其是含酸性氨基酸残基(天冬氨酸和谷氨酸)的多肽。条件色谱柱:ACE 5 C18-300,4.6 x 250 mm洗脱液:A.20%~32% 乙腈—0.1%TFA体系,pH=2,15分钟梯度洗脱。B.20%~32% 乙腈—10mM NH4OAc体系,pH=7,15分钟梯度洗脱。样品血管紧张素II血管紧张素III血管紧张素I流速。流动相的流速对反相高效液相色谱法分离的分辨率影响不大。 如图20所示,流动相流速为0.5、1.0或2.0 ml/min时,胰蛋白酶图谱中多肽的分辨率大致相同。 但梯度体积必须恒定才能维持分辨率一致。 这需要随着流速的增加减少梯度洗脱时间。 体系压力随着流速的增加而增加;体系压力可能会限制可用的流速。 此外,较高的流速还会使检测灵敏度稍有降低,但可能增加大分子蛋白或疏水性蛋白的溶解度。 图20. 流动相的流速对多肽的分辨率影响不大。随着流速的变化,总梯度体积必须保持恒定才能维持分辨率一致。 条件色谱柱:C18小孔柱,4.6 x 250 mm洗脱液:10%~50% 乙腈~0.1% TFA 体系,时间、流速如图所示 样品β-乳球蛋白的胰蛋白酶水解物
厂商
2019.06.14
为蛋白质和多肽分析选择合适的色谱柱
选择合适的色谱柱 微粒。通过与柱内填充微粒疏水表面的相互作用实现蛋白质与多肽的分离。 柱内填充粒通常以硅胶为基础,这是因为硅胶的稳定性高,能够在大多数溶剂条件下(除了pH大于6.5的情况)保持稳定,此外,硅胶可以形成各种大小的具有不同直径的多孔球形颗粒。硅胶纯度。高效液相色谱柱所用硅胶填料的纯度对分离性能至关重要。金属离子杂质会导致峰拖尾和分辨率下降,如图7A所示(0.01%和0.005%的TFA)。 含金属离子杂质(图7A)的硅胶需要采用高浓度离子对试剂(如三氟乙酸(TFA))维持良好的峰形。 图7. 硅胶纯度会影响多肽的峰形,尤其是加入的离子对试剂浓度较低时。高纯度硅胶所需离子对试剂的浓度远比低纯度硅胶低。 洗脱液:加入如图所示的TFA,以10%-55%的乙腈(ACN)梯度洗脱,洗脱时间为37.5分钟。低浓度TFA会导致峰形较差且分辨率下降。硅胶纯度较高时(图7B),0.005%的低浓度TFA会产生良好的峰形。这在液相色谱-质谱联用法中尤其重要,因为在使用电喷雾接口时TFA会导致信号减弱。液相色谱-质谱联用法中低浓度的TFA会获得更好的检测信号。孔径。通常,反相高效液相色谱法中小孔(~100埃)硅胶分离蛋白质的效果较差。大孔硅胶(~300埃直径)可以更好地分离蛋白质(参考文献4)。 如图8所示,蛋白质无法进入小孔,只与极小的外表面相互作用实现分离。 大孔硅胶允许蛋白质,甚至更大的多肽进入小孔,从而与疏水界面充分作用,因此最终的峰形更好,分辨率更高。如今,大孔硅胶已普遍应用于蛋白质的分离中。 由蛋白酶水解等产生的小分子肽能够进入小孔硅胶的孔隙内,从而与疏水界面相互作用,因此小孔硅胶也可用于蛋白质水解物的分离。 但是大孔硅胶也能较好地分离多肽,且具有不同的选择性和分辨率。 图8. 反相高效液相色谱(左侧)常用的小孔(~100埃)粒子只允许少量蛋白质进入孔内,因此限制了表面相互作用。大孔粒子(~300埃,右侧)允许蛋白质进入孔内与疏水界面相互作用。疏水界面。用碳氢化合物分子对硅胶进行改性,从而形成疏水界面。含烃链的氯硅烷,如十八烷基氯硅烷,与硅胶(表面有极性硅烷醇基)反应使碳氢化合物附着在硅胶表面(图9)。由于位阻效应,有机硅烷分子仅与硅胶表面部分硅烷醇基反应,因此大量的极性硅烷醇基仍然会留在硅胶表面。在“封端”过程中,较小的有机硅烷依次与极性硅烷醇基反应,从而减少硅胶表面极性硅烷醇基的数量。选择分离表面。硅胶表面改性所用的化学过程允许多种有机基团附着在硅胶表面。最常见的改性是键合一条十八碳线性脂肪链,形成“C18”柱或ODS柱(图10A)。如图所示,有机氯硅烷与大多数硅烷醇基反应,但仍有部分不反应,这会在硅胶表面形成一层较厚的碳氢化合物层。蛋白质和多肽可以吸附到该碳氢化合物层。C18柱尤用于分子量小于2~3000道尔顿多肽的分离,并且通常是分离由蛋白酶水解蛋白(见26~31页)产生的多肽以及分离天然和合成肽的选择柱。由丁基键合至硅胶表面形成的疏水相较少(图10B)。丁基相最适合蛋白质分离,但也可用于分离大分子肽或疏水性肽。图9. 通过利用有机氯硅烷将疏水性配体化学键合到硅胶表面形成了疏水界面。蛋白质可用C18柱分离,但一些蛋白质利用C18柱分离峰形较差或出现拖尾峰,因此蛋白质分离推荐用C4柱。其它用于多肽分离的柱包括苯基柱(参考文献6),其在疏水性方面与C4柱类似,是一种极性嵌入或极性封端柱,能够增强多肽与硅胶粒子表面的相互作用。因此,对多肽具有不同的选择性。多肽选择性。柱对多肽的选择性受键合相性质和特征以及底层硅胶表面的影响。不同的反相柱具有不同的多肽选择性。尤其是:硅胶表面的相数(碳负载)影响选择性。当键合到硅胶表面的碳氢化合物较少时(较低的碳负载),相比于碳负载更高的柱,极性硅烷醇基对分离的影响更大,因此会导致选择性不同。不同的制造工艺会产生性质不同的硅胶,从而影响多肽的选择性。图10.A C18疏水柱用于分子量小于2000-3000道尔顿多肽的分离效果极佳B C4疏水柱用于分子量大于3000道尔顿的多肽以及蛋白质的分离效果极佳。 柱长度。小分子与硅胶粒子表面相互作用越多,分辨率就越高;采用长柱比短柱的分辨率高。但吸附在柱顶附近的蛋白质随后会被洗脱下来,被洗脱后与硅胶粒子表面的相互作用就不再明显(图11)。 尽管数据显示蛋白质与硅胶粒子表面仍存在部分相互作用,但这种相互作用不具选择性,不能提高蛋白质间的分辨率。柱的长度对蛋白质的分离没有影响,短柱和长柱的分离效果相同。由于与蛋白质相比,多肽与疏水性反相粒子表面的相互作用较弱,因此柱的长度在多肽和蛋白质水解物的分离中的影响更大。如图12所示,采用长柱分离多肽的分辨率通常比短柱要高。多肽分离建议采用长度为15或25厘米的色谱柱。图11. 蛋白质在柱顶附近吸附和解吸。解吸后,蛋白质几乎不与疏水相发生相互作用,因此增加柱的长度不会提高与蛋白质的分辨率,而会提高与小分子的分辨率。图12. 与蛋白质相反,多肽通常在长柱上分辨率更高。色谱柱:C18小孔,4.6 x 150或250 mm洗脱液:梯度:0 - 70% 乙腈,60分钟洗脱 柱内径。分析型HPLC柱的标准内径为4.6 mm。此类柱的最佳流速为~1 ml/min。市场上可买到孔径更小的柱,多用于满足特定要求和目的。细孔柱(~2 mm内径)的流速为~ 200微升/分钟,因此与4.6mm内径的分析柱相比,所用溶剂更少。同时,细孔柱的灵敏度约为标准分析柱的五倍。这是因为每分钟流过检测器的溶剂量更少,导致蛋白质或多肽的峰值浓度更高。紫外检测器和电喷射质谱仪等浓度型检测器对小孔柱的灵敏度更高。微径柱的流速为~50微升/分钟,因此采用微径柱的灵敏度更高,约为分析柱的50倍。毛细管柱的流速为1~50微升/分钟,具有更高的相对灵敏度,约为分析柱灵敏度的200倍。但由于所采用的流速和更大的死体积,微径柱和毛细管柱需要特殊仪器。在使用微径柱的过程中必须格外小心。图13和附录中总结了柱的特性。 图13. 不同内径色谱柱的特性
厂商
2019.06.13
蛋白质/多肽的保留机制
引言反相HPLC已成为分离和分析蛋白质和多肽的重要工具。 它在生物技术行业中被广泛应用于蛋白质类治疗产品的表征,以及这些产品和杂质的鉴定。 在通过质谱鉴定蛋白质之前,反相HPLC在从消化后的蛋白质组中分离多肽方面有着至关重要的作用。 它也被用于探索性研究中多种蛋白质和多肽的纯化,以及蛋白类治疗药物的大规模纯化。 反相HPLC灵敏、通用性强,还可与质谱等技术结合使用,在蛋白质研究中具有重要的地位。 此外,它还能够分离结构近乎相同的蛋白质,因而得到了广泛的应用。 正如牛、人和猪胰岛素变异体的分离过程所示(图1),反相HPLC能够分离非常相似的蛋白质。 牛胰岛素和人胰岛素仅有三个氨基酸的差别,也能够被完全分离开来。 牛胰岛素在胰岛素“a”链的第8位为丙氨酸,第10位为缬氨酸,“b”链的第30位为丙氨酸。 而人胰岛素在胰岛素“a”链的第8位为苏氨酸,第10位为异亮氨酸,“b”链的第30位为苏氨酸。 图1. 以RP-HPLC对紧密关联的胰岛素变异体进行分离 条件色谱柱:ACE 5 C18,4.6 x 250mm洗脱液:含有29.3 - 31.7% 乙腈的 0.1% 三氟乙酸溶液,以1.0毫升/分钟的速率洗脱至少16分钟样品:牛、人和猪胰岛素 猪胰岛素和人胰岛素仅有一个氨基酸的差异(猪胰岛素的“b”链第30位为丙氨酸,人胰岛素该位置为苏氨酸),在基线即已分离。在另一个实例中,尽管兔胰岛素和人胰岛素仅有一个氨基酸的差异,即以苏氨酸取代了丝氨酸,但也同样得到了分离(参考文献1)。反相HPLC的高分离能力也被扩展应用到了多肽上。在图2中,两种多肽尽管只有一个氨基酸的差异,即丝氨酸对苏氨酸,但也得到了完全的分离。这种高分离能力是反相HPLC在蛋白质和多肽分离中得到广泛应用的基础性因素。 图2. 以RP-HPLC对紧密关联的多肽进行分离。仅有一个氨基酸不同的两种十肽菌素,一种含丝氨酸,而另一种含苏氨酸。条件 色谱柱:C18 宽孔柱, 4.6 x 250 毫米 洗脱液: A. 含有0.1%三氟乙酸的水溶液 B. 含有0.08%三氟乙酸的乙腈溶液 梯度:0 - 35%的B溶液超过73分钟(参考文献2)蛋白质/多肽的保留机制在反相HPLC中,颗粒表面是十分疏水的,因为其表面通过化学连接有羟基(图3中的波浪形红线)。通过疏水表面对蛋白质一面(被称为“疏水性足”)的吸附,蛋白质被保留下来(图3)。与疏水表面的厚度相比,蛋白质要大得多,因此蛋白质仅有一部分被疏水表面所吸附。大部分蛋白质位于表面上方并与流动相接触。由这种疏水性吸附所导致的净相互作用非常强,会导致蛋白质保持吸附在表面上(图4A),直至接触到特定浓度的有机溶剂,这时蛋白质会从表面上解吸附并从色谱柱上洗脱(图4B)。在最初的吸附/解吸附之后,尽管蛋白质在从色谱柱上移动下来时仍会与表面产生一些相互作用,但却是十分微弱的,对分离过程无影响。分离是由单次吸附/解吸附过程完成的。解吸蛋白质所需要的有机改性剂的浓度十分精确,并与疏水足的大小呈函数关系。详情请参阅参考文献3。图4. 进入色谱柱的蛋白质被吸附在柱顶端附近的疏水表面上(A)并且一直保持吸附,直至有机改性剂的浓度达到特定值,此时蛋白质从表面解吸附(B)。在反相HPLC中,吸附/解吸保留机制导致蛋白质的保留行为与小分子不同。小分子的保留行为随着有机溶剂浓度的改变而缓慢改变时(图5,联苯),一旦有机溶剂的浓度达到所需要的值,蛋白质的保留行为即发生突然改变,引起保留时间的快速变化(图5,蛋白质)。该过程产生的尖锐峰形常见于蛋白质和多肽(图6A)。由于有机溶剂浓度的微小变化会引起的显着的保留行为变化,等度洗脱很少被用于蛋白质中,因为峰变宽了,而有机溶剂的微小改变会导致蛋白质保留行为的巨大变化(图6B)。图5.有机溶剂浓度对应的保留行为图6.A. 梯度洗脱过程中多肽和蛋白质洗脱出尖锐峰形。B. 等度洗脱下,蛋白质的峰形(本例中为溶菌酶)很宽,有机溶剂的微小改变都会引起保留时间的巨大变化。
厂商
2019.06.13
菲罗门与ACE色谱柱的保养方法
菲罗门与ACE色谱柱的保养方法 色谱柱是一种消耗品,因此使用寿命有限。对于大多数应用,色谱柱应持续进行500-2000次注射(进样),但这会因样品的清洁度、流动相的pH值和保护柱卡套的使用(是否使用保护柱)而不同。这里列出的做法有助于最大限度地提高硅基(硅胶基质)色谱柱的使用寿命。一、色谱柱的平衡:当从一个流动相更换为另一个流动相时,或者在回收梯度(梯度循环)时,应需要10-20个柱体积。下表显示了各种色谱柱尺寸(规格)的色谱柱体积。如果溶剂的变化不太剧烈(例如80%至20%的ACN/水与ACN至THF(与之相对的由ACN至THF)),则需要的体积较少。检查平衡最简单方法是进行两次样品注射。如果保留相同,则色谱柱充分平衡;如果保留变化,应增加平衡体积并重新试验。平衡与溶剂的体积有关,与时间无关。所以较高的流量(流速)可以减少平衡时间。 近似的色谱柱容量(mL) 色谱柱直径 柱长度 50 mm 150 mm 250 mm 2.1 mm 0.1 0.3 0.5 3.2 mm 0.3 0.7 1.2 4.6 mm 0.5 1.5 2.5 10.0 mm 2.4 7.1 11.8 21.2 mm 11.6 34.7 57.8 二、色谱柱冲洗是一个简单的过程,可以通过清洗色谱柱中的顽固(保留较强的)物质来延长色谱柱的寿命。每天结束色谱柱的使用时,应除去一切缓冲液(应除去色谱柱中的缓冲盐),然后用100%强溶剂(通常为ACN或MeOH,采用反相方法)冲洗色谱柱。下一页列出的详细冲洗程序可以有效恢复色谱柱的性能,但应牢记:色谱柱是一种消耗品,因此请勿期望它能够永远的持续使用!避免用100%的水冲洗反相色谱柱(嵌入极性基团或“AQ”色谱柱除外),因为相(固定相)去湿会影响清洗效果,而且流动相色谱柱的重新平衡会非常缓慢。对于您的色谱柱,请按照以下所述的一般步骤,使用特定溶剂进行色谱柱冲洗。应在冲洗之前查看制造商的建议(生产商说明书),以免损坏色谱柱。1. 拆掉并翻转色谱柱(拆下色谱并反接)2. 将色谱柱连接到泵上,而非检测器(不接检测器)3. 用10-20个柱体积的溶剂进行冲洗,且流速不得高于QC色谱图的流速4. 如果改变以下步骤,应确保在每个连续步骤中使用可混溶溶剂(溶剂可互溶)反相色谱柱(C18,C8,C4,苯基,CN,'AQ'型)a. 流动相无缓冲液b. MeOH或ACN如果金属离子被认为是污染的致因,应使用0.05M EDTA水溶液冲洗,然后用水冲洗,并按上述顺序冲洗。使用离子对试剂的色谱柱应专门用于离子对的应用之中。未键合的硅胶柱(SIL)a. IPA b. MeOH c. 乙酸乙酯键合正相柱(CN、NH 2、二醇)a. 三氯甲烷b. IPA c. 二氯甲烷d. 己烷阴离子交换柱(SAX,WAX)a. 水b. 甲醇c. 三氯甲烷d. 甲醇e. 水阳离子交换柱(SCX,WCX)a. 水(冲洗时注入4x200 L的DMSO)b. THF蛋白质的体积排阻柱 对于弱保留的蛋白质a. 0.1M磷酸盐缓冲液,pH为3对于强保留的蛋白质a. 100%水至100%ACN的梯度,运行60分钟三、色谱柱的合理存放有助于延长柱的使用寿命。最简单的存放步骤为:从柱中除去一切缓冲液,然后用10-20个柱体积的强流动相溶剂(例如用于反相的MeOH或ACN)清洗柱,以除去柱中的顽固(强保留)物质。然后用制造商指定的存储流动相,以10-20个柱体积的容量冲洗色谱柱(该信息应随色谱柱提供,并在QC检测色谱图中进行详细的说明)。最后,安全地盖上柱帽(拧紧堵头),以防流动相蒸发。 除了色谱柱制造商明确建议的特定情况(例如一些离子交换柱)外,请勿使用缓冲液或者少于约25%的有机溶剂来用于储色谱柱存储,因为它们会导致微生物的滋生。(保存色谱柱,以防微生物的滋生)• 每个新项目应使用一种全新的B型高纯度硅胶柱,并与最高质量的HPLC级试剂结合使用。 • 定期冲洗HPLC系统,去除盐和缓冲液,并定期保养系统,从而最大限度地减少止回阀(单向阀)和泵密封(密封圈)问题。 样本清理过程越彻底,样本就越干净;同时,与样本相关的问题发生概率就越小。 • 完成一系列(系统多次)运行(或在某些情况下,每次运行后)后,应使用强溶剂冲洗,这样有助于除去柱中的顽固残留(吸附较强的)物质,并将未来运行中的干扰降至最低(尽量减少对以后的测试的干扰),延长色谱柱的使用寿命。 色谱柱不能永久使用,但良好维护可减少不必要的更换支出
厂商
2019.06.05
HPLC故障排除3 - 鬼峰的出现及解决
3.鬼峰问题 鬼峰问题 预防措施和解决方案 鬼峰 柱或注射器被污染 (色谱柱或进样器污染) 1. 仅使用HPLC级溶剂 2. 冲洗柱,以去除杂质 3. 在注射器用于下一个分析物时,应先进行冲洗 前一个注射导致的迟洗脱峰(前一次进样的后洗脱峰) 1. 延长运行时间 2. 每次运行结束时用强流动相冲洗色谱柱 3. 对于梯度运行,应以较高浓度结束(有机相比例结束梯度) 在RP HPLC中,水被污染 1. 使用HPLC级水 样本中的未知(未知杂质)干扰 1. 使用样品清理(净化措施)(例如SPE) 负峰 溶质折射率低于流动相(RI检测器) 1. 使用折射率较低的流动相 2. 调换检测器极性以获得正峰值 溶质的吸收低于流动相的吸收(溶质的紫外吸收低于流动相的紫外吸收)(UV检测器) 1. 更改UV波长 2. 使用UV吸收较低的流动相 样品溶剂和流动相的成分不同 1. 如可能,更换样品溶剂并将样品溶解在流动相中 (更换样品溶剂,如有可能,使用流动相溶解样品) 峰值(毛刺) 流动相中存在气泡 1. 对流动相脱气 2. 在检测器出口端,安装背压限制器。 3. 确保所有配件安装紧固 柱储存时未使用端帽 (堵头) 1. 柱储存时应使用端帽 2. 用脱气的甲醇冲洗RP柱 3.1.等度分离中出现的意外宽峰是因前次运行产生的峰洗脱延迟(在等度分离中,前次运行中的迟洗脱组分以宽峰的形式意外出现)。对于等度分离,保留时间越长,峰应(色谱峰)越宽;但色谱图狭窄区域内的所有峰应具有大致相同的峰宽。如图11(箭头)所示,当窄峰中出现宽峰时,可能是因为之前注射(前次进样)的化合物发生了洗脱延迟。这很容易检查。只需进行正常注射(进样),但将运行时间延长两到三倍。如果在正常运行时间结束后出现峰值(出峰),那就是因洗脱延迟导致的。可以通过延长正常运行时间,以涵盖此峰的洗脱(洗脱时间将峰洗脱出来);也可以在每次运行结束时加入强溶剂冲洗液,以(来)清洗柱中的顽固物质。 图11.峰延迟洗脱通常在38.5分钟时出现(迟洗脱峰(正常情况下在第38.5分钟出现的洗脱峰)),位于(出现在了)下一个缩短的等度运行的色谱图的12.0分钟(箭头)处。来源[6]。3.2.通过运行非注射(无进样)空白梯度并观察基线,可以分离梯度运行中的鬼峰。如图12a所示,当空白梯度出现过多的峰时,试剂污染可能是导致此问题的原因之一(可能是溶剂污染所致)。在这种情况下,图12a显示运行过程中的峰值(峰)非常小(1-3 mAU),并且在0.8-1.0 AU范围内的主要成分分析中几乎没有峰值(对0.8-1.0 AU大小的主要成分检测峰没有影响);但是对于稳定性(性指标检测)或杂质的测定,1-2 mAU范围内的峰值应需要量化(也需要定量)。在这种情况下,则需要进一步的研究。在梯度运行之间的平衡期间,流动相中的非极性杂质一般沉积(聚集)在柱的顶部位置。然后,在梯度过程中,像其它峰一样,这些杂质被洗脱出来。通过将平衡时间延长至三倍,检查问题的根源。如果空白梯度中的峰值(峰)增加约三倍,则水状溶剂最有可能是问题的致因(则极可能是水溶液中的杂质所致)。如图12b所示,可将水和/或添加剂换成纯度较高的成分,以解决这一问题。 图12. 运行空白梯度:(a)A容器受到污染的水(A容器中溶剂有杂质)和(b)A容器中纯度较高的水。色谱柱:150x4.6mm C18;1.5mL/min;35℃;在255 nm处进行UV检测。梯度:0-83%ACN /水运行13分钟,并保持5分钟。来源[7]。3.3.等度或梯度运行的负峰不如正峰常见(相对于正峰较为少见),但也会发生。负峰在离子对或其它方法中更为常见,其中流动相试剂在选定的检测波长下具有显著的紫外线吸光度(倒峰在有离子对或流动相在检测波段下有明显紫外吸收的情况下更为常见)。在这种情况下,背景吸光度将极为重要(背景吸收可能较显著)(可能为0.5 AU或更多),但不会被注意到(较难觉察),因为系统在每次运行开始时会自动调节至零点,并检测信号。如果化合物的吸光度低于流动相背景(背景吸光度),其会显示为负峰。致因的确认和峰的消除方式与正峰相同(确认问题来源并消除倒峰的方法与正峰相同):检查水、试剂或样品的制备过程。
厂商
2019.06.04
菲罗门2019端午节放假安排
致全体菲罗门同事及菲罗门广大客户: 根据国家2019年节假日放假规定,同时结合菲罗门公司实际情况,我司2019年端午节放假安排如下: 一、放假时间: 放假时间:2019年6月7日(星期五)至2019年6月9日(星期日),共3天; 二、温馨提示: 放假期间,我司将不安排发货,请广大用户提前做好备货准备。 如有需要,还请及时与我们联系 020-22826668; 祝大家端午节快乐!
厂商
2019.05.30
HPLC故障排除1 - 峰形问题
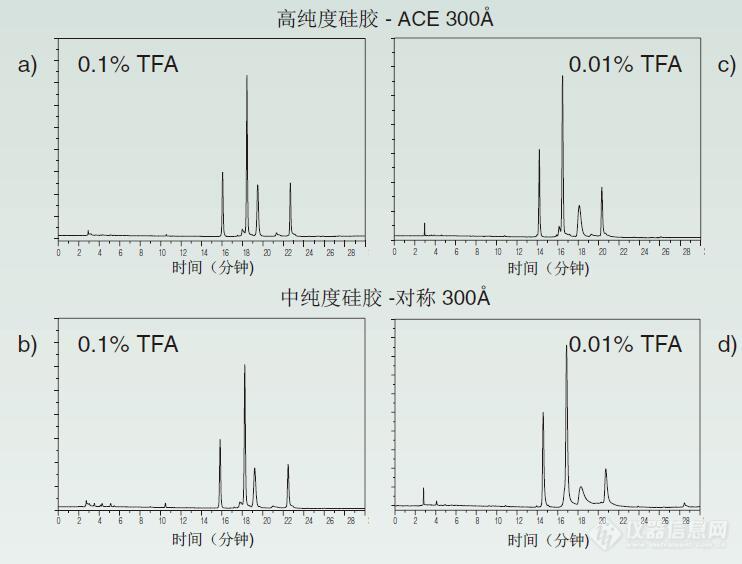
峰形问题 可能致因 预防措施/解决方案 峰拖尾 与活性硅醇的相互作用 使用超高纯度硅基(硅胶基质)固定相添加碱性流动相添加剂(如TEA)- 超高纯度相则不需要 在固定相中与金属离子螯合 同上 错误的流动相pH值(流动相pH值不当) 降低流动相pH值以抑制硅烷醇电离增加缓冲液浓度 玻璃料阻塞(筛板堵塞) 倒冲洗柱(反冲色谱柱)使用串联(在线)过滤器 柱无效(色谱柱失效) 倒冲洗柱(反冲色谱柱)更换柱 (色谱柱) 死体积未清扫(过大) 尽量减少连接器数量使用较短的连接管 检查所有配件是否紧固分裂峰 保护柱或分析柱入口(进样)端污染 拆下保护柱卡套(卸除保护柱芯)并进行分析 - 必要时更换保护柱倒冲洗(反冲)分析柱 对于顽固残留(强保留污染物),应尝试再生法(对色谱柱进行再生)更换柱 玻璃料阻塞 (筛板堵塞) 倒冲洗柱(反冲色谱柱)使用串联(在线)过滤器样品溶剂与流动相不兼容 在流动相中注入样品 (用流动相溶解样品)同时洗脱第二组分 注射前使用样品清理 (进样前先净化样品)通过改变流动相或柱相(色谱柱固定相) 来改变选择性 柱超载(色谱柱过载) 使用更高容量的固定相增加柱的直径 (增加色谱柱内径) 减少样本(样品)量伸舌峰 柱中通道的形成 (色谱柱内形成通道) 更换柱 (色谱柱)在建议的色谱柱(色谱柱建议的)pH值范围内操作柱超载 (色谱柱过载) 注入更少量或更稀释的样品溶液 (减少进样体积或进一步稀释样品)使用更高容量的固定相 样品溶剂与流动相不兼容 在流动相中注入样品(用流动相溶解样品进样)低温 增加柱的温度 (升高柱温) 1. 峰形1.1.在RP-HPLC应用之初,峰拖尾就是最常见的峰形问题(拖尾峰是RP-HPLC自出现以来最普遍的峰形问题)。大多数峰拖尾是由于柱内硅胶颗粒表面上的酸性或离子化硅烷醇基团之间相互作用而导致的。低纯度硅胶(通常称为“A型”或酸性硅胶)具有高含量的酸性硅烷醇(-Si-OH)基团,其富含的金属杂质(特别是铁和铝)可提供阳离子交换位点,进一步促使这些基团电离成-Si-O-。这些材料的pKa在pH4-5区域中,这意味着在pH>6时,大部分硅烷醇基团会被电离(已离子化)。通过提高纯度并降低硅胶的酸度可获得更高纯度的硅胶颗粒(“B型”),并且自引入(其出现)以来,这些硅胶填料的纯度已经得到了改善(有所提高)。高纯度硅胶的pKa> 8,因此对于大多数色谱柱,在2 碱性化合物极易受到硅醇拖尾(影响而导致拖尾),并且由于大多数样品分子含有碱性氮官能团,所以没有多少(很少有)化合物可以完全对硅醇交互作用免疫(不受硅醇基的影响)。图1显示了硅醇拖尾的情况。甲苯是一种中性化合物,不会产生硅醇拖尾现象,但图1中剩余(其他)的分析物为强碱性药物。流动相pH值是6,这是影响分离的另一个因素,它会使纯度较低的硅胶色谱柱出现硅烷醇离子化现象(对于该分析更大的挑战在于流动相pH=6,这一条件下低纯度硅胶色谱柱的硅醇基已离子化)。低纯度硅胶(“A型”硅胶)(图1a)会与碱发生强烈的相互作用,致使分析物不会从柱上洗脱下来(以至不能从色谱柱中洗脱这些分析物)。早期的B型材料(图1b)显着改善了峰形,尽管它们均出现严重拖尾现象,但样品中的所有峰形均可见(可以看到样品中所有分析物出峰)。通过进一步改善(提高)硅胶纯度(图1c),可使峰拖尾降低至可接受的水平。只要在RP-HPLC中使用含硅烷醇的硅胶,就不可能消除峰拖尾现象。虽然使用高纯度硅胶色谱柱是改善硅烷醇拖尾的最佳办法,但仍存在其它解决拖尾现象的技术(技术可以减少拖尾)。近年来,多采用将三乙胺(TEA)(一种小(低)分子量碱)加入到流动相(例如25mM)中的方法改善峰拖尾。TEA是酸性硅烷醇基团的有力竞争者,但对于当今的高纯度硅胶,几乎无需或很少使用TEA。图1: 图1. 硅胶纯度和峰拖尾(a) 低-、(b) 中-、和(c) 高-纯度硅胶。 色谱柱:250x4.6mm, 5 m;流动相:80:20 MeOH/25mM KH2PO4(pH 6.0); 流量:1.0 mL/min;成分:1, 去甲麻黄碱;2, 去甲替林;3, 甲苯;4, 丙咪嗪;5, 阿米替林。1.2.缓冲液或流动相添加剂不足也会导致峰拖尾。缓冲液主要用来使样品处于(保持)恒定的离子化状态,从而稳定保留情况(时间),并在最大程度上减少因离子相互作用而导致的峰拖尾现象。缓冲液还可抑制硅胶表面上的硅烷醇基团的电离现象(的硅醇基离子化)。但是对于低纯度硅胶材料来说,由于其硅烷醇更容易被电离,所以它的挑战性更高(当然,这对于低纯度的硅胶材料是更大的挑战,因为可能更多硅醇基会离子化的)。添加剂浓度对峰形的影响如图2所示。在这种情况下,三氟乙酸(TFA)会作为蛋白质样品成分的离子对试剂,也会产生(可提供)低pH流动相以抑制硅烷醇电离。通常,0.1%TFA可以(作为添加剂)用于蛋白质和肽分离。如图2a和b所示,该浓度足以在最大程度上改善高纯度和中纯度硅胶柱的拖尾现象。然而,如果TFA浓度下降(降低)十倍(图2c,d),两个相(两个固定相)的拖尾均会随之增加。高纯度硅胶仍可(仍然)保持可接受的峰形,但中纯度色谱柱的峰拖尾则无法接受。缓冲液和其它流动相添加剂的一个共同特征是:作用效果(例如峰拖尾的减少、保留时间的稳定)会从低浓度开始(开始显现),并随着浓度的增加而继续作用(增加),但会逐渐(趋平)维持在一个稳定水平。稳定水平之下的添加剂浓度,可以保持稳定的运行;浓度过高会产生(可能导致)溶解性问题。对于大多数应用来说,10-25mM内的添加剂已经足够了,但最好根据具体情况确定。 图2. 缓冲液浓度对峰拖尾的影响。0.1%TFA与(a)高纯度(b)中纯度硅胶柱;0.01%TFA与(c)高纯度和(d)中纯度硅胶柱。色谱柱:250x4.6mm, 5 m, C18 300?;流动相:A: 0.1%或0.01%的TFA溶于水中;B: 0.1%或0.01%的TFA溶于ACN;5-70% B,30分钟;流量:1.0 mL/min, 280nm。成分(保留顺序):核糖核酸酶A、细胞色素C、全铁转铁蛋白、脱辅基肌红蛋白。1.3.色谱图中所有峰拖尾或峰变形通常是由物理作用导致的,而非化学作用。如果色谱图中的峰形均表现相同类型的变形(图3),则问题最早应出现在分析物通过色谱柱迁移之前(主要问题发生在分析物在色谱柱中迁移之前)。这种峰形变形最常见的致因是:玻璃料或柱头的空隙部分堵塞(此类峰变形最常见的原因是筛板部分堵塞或色谱柱头塌陷)。除非在推荐的pH范围之外使用色谱柱,否则现在的柱子基本不会受到空隙的影响(轻易不会发生塌陷)。但是,玻璃料(筛板)堵塞仍然是一个普遍存在的问题。对于5 m颗粒柱(的色谱柱),入口端的玻璃料(筛板)通常具有2.0 m的孔隙度;对于(颗粒) 3 m的色谱柱,具有0.5 m的孔隙度。 如果颗粒物来自于样品,或颗粒物是因泵密封磨损或流动相到达色谱柱而产生的(磨损的泵密封圈或者流动相颗粒物进入色谱),它们通常会集中在玻璃料上(都聚集在筛板上)。这些颗粒会影响样品在色谱柱入口端的分流,使得部分样品通过不同的流动路径到达色谱柱,因此会晚于另一部分样品。 由于此时(此位置)未发生分离,因此所有分析物会以相同的方式变形(被扰乱),进而色谱图显示所有峰均具有相似(类似)的峰拖尾或变形。为了防止(避免)这一问题,如果流动相可能含有颗粒(如缓冲沉淀物或灰尘),应对其进行过滤;并在泵密封严重磨损(导致颗粒物的产生)之前更换新的泵密封(密封圈)。如果样品含有颗粒碎片(屑),应对样品进行过滤(例如0.5 m孔隙度过滤器(微孔滤膜))或对其进行短暂离心(例如5分钟,>1500×g),以去除颗粒。我们强烈建议在自动进样器下游(之后)安装0.5 m孔隙度的串联(在线)过滤器,以过滤任何意外进入HPLC系统的颗粒物。如果串联(在线)过滤器玻璃料(滤片)发生堵塞,系统背压会升高;而更换玻璃料(滤片)十分简单、快速和经济。采用串联(在线)过滤器可显著延长色谱柱的使用寿命,而且经济实惠。 图3. 由于玻璃料或色谱柱空隙被部分堵塞(色谱柱筛板部分堵塞或色谱柱塌陷),色谱图中所有峰形均出现了变形。1.4.如果峰形解析不正确(未完全分离的重叠峰),可能会被误认为柱(色谱柱)或缓冲液的问题。如果仅部分解析两个峰形(两个峰仅有部分分开),则可能会认为其是裂峰或双峰。如图4显示的情形。在图4a中,可观察到与图3极为类似的峰值变形(峰变形),其表明玻璃料被堵塞(筛板堵塞)。改变柱并未纠正这个问题(更换色谱柱不能解决此问题),所以玻璃料(筛板)堵塞并非导致这一现象的原因。如果柱上样品的质量减少(减少上样量)(图4b),峰形看起来更像是两个峰,而不是一个肩形峰。这便需要进一步研究,以确定是否存在第二个峰。可以通过修改方法条件来完全分离两个峰(由此进行了进一步的研究,证实了存在第二个峰。调整方法的条件后,两个峰完全分离)。 图4. 由于存在第二个组分而产生分裂峰。(a)25ng / mL,和(b)等离子体中10ng/ mL的药物(第二个峰)(10 ng/mL血浆中的药物(第二个峰))。来源[1]。1.5.由于目前的色谱柱性能优良,因此极不可能出现伸舌峰(伸舌峰的现象随着现今柱填充技术的提高已相当少见)。伸舌峰一般是由柱过载或柱结构塌陷导致的(发生伸舌峰的一个原因是色谱柱内发生沟流或色谱柱结构的坍塌)。如果在制造商推荐的条件下使用色谱柱,这种情况则很少发生。大多数硅胶柱在pH2-8的范围内可以保持稳定。pH低于2时,键合相会发生水解;pH高于8时,硅胶会溶解。如果(如果您需要)在此pH范围以外使用(操作)HPLC系统,请确保选择在选定条件下会保持稳定的色谱柱。图5显示了因柱过载(色谱柱发生沟流)导致的伸舌峰。图5a中显示了正常的峰值形(峰形);在大约500次注射(进样)后,观察到伸舌峰(图5b)。使用这种方法便会出现这种变化,并且在每次运行的过程中会经常出现(这种改变是该方法所特有,经常在前一次分析结束后,下一次分析开始时突然发生)。出现伸舌峰后,唯一有效的解决办法就是更换色谱柱。该柱为100x2.1mm(直径(内径)),色谱柱填充5 mC18颗粒(柱内填充5μm 粒径的C18填料) 。流动相A是10mM碳酸氢铵(pH9.0) ; B是甲醇(MeOH)。该方法包括5%B等度洗脱段,接下来是80%B的冲洗(然后用80%B淋洗)。这种特殊的色谱柱可专门用于高达100%的水流动相,且无封端。当流动相pH值升高时,封端可保护硅胶免于溶解。在这种情况下,所使用的色谱柱流动相pH应远高于推荐的范围,并且无需保护性封端。硅胶在pH为9时会逐渐溶解,直到柱床结构不再稳定,并且柱床会发生移动, 产生空隙(塌陷)或通道,而这又会导致图5b伸舌峰的形成。可以使用较低的流动相pH或采用在较高pH下能够保持稳定状态的色谱柱,以避免这一问题(避免这一问题)。 图5. 过载导致的伸舌峰。(a)正常的峰形;(b)伸舌峰。来源[2]。
厂商
2019.05.30
HPLC故障排除2 - 保留时间问题
2.保留时间问题 可能致因 预防措施/解决方案 减少保留时间 键合固定相的损失 (流失) 更换柱 (更换色谱柱)在pH值为2-8的硅基(硅胶基质)RP柱上操作 固定相上的(存在)活性基团 在流动相中使用有机改性剂增加缓冲强度 (增加缓冲液离子强度) 增加流量 (流速) 检查并调整泵的流量(流速)柱超载 (色谱柱过载) 减少注入的样本量 (减小进样量)使用具有更大内径的柱 (色谱柱) 延长保留时间 改变流动相的成分 覆盖溶剂容器(盖紧溶剂瓶)制备新的流动相键合固定相的损失 (流失) 更换柱 (更换色谱柱)减少流量 (流速) 检查并调整泵的流量(流速)检查系统是否存在泄漏,包括泵的密封 (泵密封圈)流动相中存在气泡 检查流量和压力对流动相脱气(流动相脱气)波动保留时间 柱平衡(色谱柱平衡时间)不足 在运行之间(在两次进样之间用更长时间)充分平衡柱 用浓缩样品调整色谱柱流动相成分的变化 检查流动相的成分,必要时补充新的成分(新配流动相) 检查比例阀的准确度缓冲能力不足 使用> 20mM的缓冲液浓度波动柱的温度 (柱温波动) 稳定的(稳定)室温保持柱恒温 2. 保留变量(时间变动) 如果所有峰(色谱峰)的保留时间均发生了变化,其致因很可能是如下因素发生了变化:流动相的组成、色谱柱的化学性质、色谱柱的温度或流速。如果等度或梯度流动相在在线式混合中出现错误,也可能导致保留时间出现问题。下面将简要介绍这些问题来源(对上述每个原因都简述如下)。2.1.如果操作人员操作不当,则会导致流动相组成的意外变化,例如使用在线式混合系统时,流动相混合物(系统)设置不正确;或替换新批次流动相时,未妥善制备新的流动相(新流动相配制不正确)。在极少数情况下,会出现流动相组分选择性损失的情况,例如蒸发。当流动相发生变化时,峰形(色谱峰)通常会向相同的方向移动,以缩短或延长保留时间(保留时间变长或变短);而相对保留(选择性因子,a)通常会发生变化。检查流动相组成错误的最佳方法是仔细检查(复查)系统设置;如有必要,应制备新的流动相。方法文件应包含特定流动相变化影响的相关信息。例如,有机溶剂或pH值的微小变化会对色谱图产生特征(在色谱图体现出特征性的)影响,如分辨率或保留的变化(分离度的变化或保留时间的漂移)。如果您怀疑设备出现故障,请将色谱柱和流动相移至另一个HPLC系统,然后再次运行。如果问题依然存在,则问题在于流动相或色谱柱;如果问题不再出现,则可能与其他系统组件或参数相关。2.2.色谱柱化学(化学性质)变化会在色谱柱的整个生命周期内出现,并且一般会在数周或数月内逐渐变化。柱老化一般伴随着柱背压的上升、保留时间的逐渐变化(漂移)(更长或更短)以及更多的峰拖尾。更换新柱以确定是否是柱老化导致的问题(可确证色谱柱老化)。500-2000次注射(进样)的柱寿命是较为理想的;在这一点上,柱成本相较于整体分析,是十分微小的,所以更换新柱的可行性较高(色谱柱在整个分析的成本中所占比例低,因而可以合理更换色谱柱)。如果色谱柱的使用寿命过短,应仔细检查操作条件,以确保它们适用于该色谱柱。图5显示了在极端操作条件下,色谱柱寿命较短的示例(缩短的寿命)。2.3.色谱柱温度变化会导致保留时间的变化:每1°C的温度变化会引起1-3%的保留时间变化。如果不使用柱温箱(即“室温”条件),由于实验室温度的变化,温度通常会在日间(和夜间)循环(周期性)变化。虽然在室内恒温器的测量下,实验室温度显示为恒定,但是HPLC系统的微观(微)环境可能会发生显著变化,尤其是当供暖或空调通风口直接吹向系统时,温度变化极为明显。使用柱温箱可以避免色谱柱出现这样的温度问题,且HPLC系统应远离通风口放置。2.4.流量(流速)问题可能是因存在气泡、泄漏或泵问题(故障)导致的。 气泡问题应和低压(或脉动压力)以及保留时间的增加相关(可能伴有柱压过低或柱压波动,且保留时间延长)。对于双头泵,如果只有一个泵头存在气泡,则流量和压力可能会发生脉动(跳动)。应对流动相进行脱气,然后打开放气阀清空泵,并向泵中多次加入5-10mL的流动相,以正常流速流经泵,从而排出气泡(打开排气阀以正常流速的几倍泵入5-10ml流动相经过泵,以排出气泡)。在某些情况下,可能需要使用低粘度的脱气溶剂,如甲醇(MeOH)或乙腈(ACN)来清除泵中顽固的气泡。泄漏也会延长保留时间。配件(接头)上的滴水配件或玻璃体内的结晶沉淀都是泄漏的证据(查看接头如有液滴或结晶析出,可证明有泄露)。请特别注意色谱柱上游的配件(之前的接头)。自动进样器内的配件和密封件(接头和密封圈)可能难以检测,可借助手电筒和小镜子进行检查。如果使用不锈钢配件,通常1/4的紧固螺母(将接头螺好再拧紧1/4圈)便可以阻止泄漏。使用PEEK配件(接头)时,应停止泵,松开接头,将管子推到配件(接口)端口的底部,然后在重新启动泵之前拧紧配件(接头)。拧紧PEEK配件(接头)时如果存在流动的液体,会导致管道在配件中滑动,产生柱外死体积,进而影响分离效果。存在缺陷的止回阀(单向阀)或磨损的泵密封件(圈)会导致流量偏低或波动。止回阀(单向阀)出现问题将导致压力的波动。如果在清除泵中气泡后还无法改善压力波动的情况,则止回阀(单向阀)可能存在故障。可以更换新的止回阀(单向阀);也可以将止回阀(单向阀)放置在(装有)MeOH的烧杯中,对其进行超声处理,以实现有效的清洁。如果无法有效区分入口端和出口端之间的止回阀(如不易分清入口单向阀和出口单向阀),请划线标记或用标签标记烧杯。将每个止回阀(单向阀)放入单独的烧杯中进行清洁,使其分开清洁。如果部件滑出,应小心组装,以免受到污染(无尘手套,避免划伤部件等)。随着使用时间的增加,泵密封件(圈)会出现磨损;而且使用缓冲流动相或将其置于高盐条件下(例如离子交换法),会缩短它的使用寿命。您可以建立一个预防性维护计划,定期更换密封件并做相应记录(准确记录更换密封圈的时间间隔,就可以建立预防性的维护计划),从而在故障发生前更换密封件。如果无其它指标(征兆),应至少每年更换一次密封件(圈)。2.5.比例阀和在线混合发生故障会降低梯度洗脱的效果(使梯度洗脱效果变差)。图6示例显示了两次连续注射肽样品的梯度洗脱分析。在这种情况下,系统适用性测试允许两次运行之间存在0.1分钟的变化(保留时间变化);第一个峰值不符合该标准,最后一个峰值勉强通过而中间两个峰值明显超出规定值。 图6. 两个连续梯度运行的(两次连续梯度洗脱)色谱图显示了梯度中点附近的峰形具有较大的误差(保留时间的误差较大)(13分钟)。来源[3]。下面介绍了一种检查流动相配比(混合)精度的简单方法。将柱更换为0.005英寸直径约1米长(0.12mm)的管道(取下色谱柱,换上长约1米,内径0.005英寸(0.12mm)的管路),在A容器中加水,且B容器中放有含有0.1%丙酮的水,将检测器波长设置为265nm,并使用足够高的流速使止回阀(单向阀)能够有效工作(例如2mL/min)。以10%为增量运行一系列梯级(梯级实验)(10%、20%、30%……90%、100%B)。由于问题经常出现在50%B附近,所以在45%B和55%B处增添了额外的梯级。其结果应是平滑的阶梯状(参见图8a)。对于图6的样品,在40%-60%B的梯级中观察到图7的曲线。梯级是扭曲的(已变形),且45%到50%B的梯级(梯级变化)是8.4%而不是5%。图7中的虚线近似于(拟合了该)梯度,同时(在)45%和50%B之间存在偏移。因此,此处应是由具有较大保留变量的峰被洗脱导致的(不幸的是,这正是那些保留时间偏差较大的峰出峰的位置)。HPLC系统可对比例阀进行调节。当执行此操作时,梯级会变得平滑且保留时间也会处于规格范围之内。 图7. 在图6的梯度中点附近执行配比(比例)阶梯测试的结果。理论值显示在括号内。来源[3]。如果系统性能良好,其阶梯测试的结果应与图8a类似,在整个图中呈现阶梯状。未注射的0-100%B梯度是应运行的对比测试(另需同时进行一无进样的0-100%B梯度试验)。它应显示为线性基线、线性梯度部分和线性后期梯度保持,每个部分之间均是平滑的曲线过渡(线性梯度部分以及一段梯度升高后维持直线,每两段之间为平滑曲线过度)。图9的示例显示了在约25%、50%和75%B的线性(箭头)条件下,空白梯度运行呈现有规律的偏移。 图8. 图9显示了HPLC系统的梯度阶梯测试结果。(a)0、10、20、30、40、45、50、55、60、70、80、90和100%B的梯级;(b)以1%的梯级向上跟踪至45-55%。箭头显示了50和51%之间的“较短”梯级。来源[4]。与这些条件相对应的阶梯测试如图8a所示,并且在这个度量(放大比例)下表现良好。为了更仔细地检查问题区域,在45-55%B范围内以1%的增量进行阶梯测试,如图8b所示。这个扩展(放大)图清楚地显示了在50%和51%之间的梯级中,存在不规则性。在线性图中的定期(有规律间隔的)误差(图9)表明,控制比例阀的算法或比例阀本身存在问题。在目前的情况下,调整控制(控制软件)软件无法解决问题,因此应更换比例阀,以解决问题(因此更换了比例阀,问题被解决)。 图9. 故障比例阀线性梯度图。箭头显示线性偏离;绘制下面的虚线以供参考(虚线为标准参考线)。以1mL/min的速度运行梯度0-100%B 15分钟;A =水、B = 0.1%丙酮水溶液;检测UV 265nm。来源[4]。尽管可以假设单一来源是导致特定HPLC问题的原因(虽然通常可以假定某HPLC问题只有一个故障原因),但情况并非总是如此。图10a显示了以非常浅的梯度(30分钟内19-24%ACN)连续三次注射肽样品的结果(显示了一种多肽样品三次连续进样,窄梯度洗脱(30分钟内19-24%乙腈梯度洗脱))。由于怀疑存在流量(流速)问题,因此在双活塞双泵系统中更换了所有8个止回阀(单向阀)和4个泵密封件(圈)。这大大改善了保留变量(保留时间大为改善),保留范围从2.1分钟变化到1.0分钟(图10b),但仍然是(此偏差仍)不可接受的。为了进一步研究问题,将溶剂预混合到装有15% ACN的A容器和装有25%ACN的B容器中(在A瓶中预混合15% 乙腈,在B瓶中预混合25% 乙腈)。当调整仪器设置以产生与图10a和b相同的梯度时,获得图10c所示的结果。尽管仪器的配比精度在±0.1%的规格范围内,但对于非常浅(窄)的梯度来说仍是不够的。预混合溶剂将有效精度从0.1%提高至0.01%,如果该样品希望具有令人满意的保留时间再现性,这点是必需的。预混合可以提高系统性能,以满足苛刻的分离要求。 图10.三次连续注射肽样品的扩充(放大)色谱图。产生的色谱图:(a)使用原始系统配置(b)更换所有止回阀(单向阀)和泵密封件(圈)后(c)使用预混流动相。色谱柱:250×4.6mm、5 mC18以1.5mL/min和35℃运行,并在215nm检测。梯度:30分钟内19-24%ACN / 0.1%TFA的水溶液。来源[5]。
厂商
2019.05.30
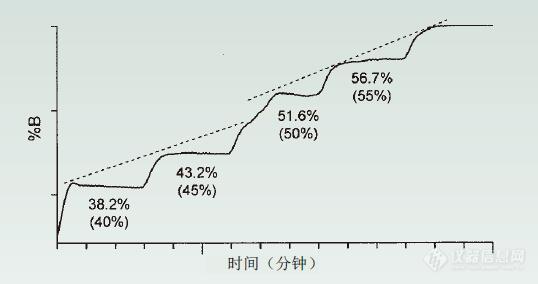
ACE反相系统性方法开发方案
使用ACE方法开发工具包(MDKs)进行色谱柱筛选方法开发的四个简化步骤• ACE MDKs包括了为互补选择性而精心设计的3支色谱柱。• 色谱柱筛选是一种简单而又功能强大的方法, 可以快速识别最合适的色谱柱。• 通过筛选2种不同的流动相有机改性剂可以使方法更全面。• 以下的流程图总结了如何通过4个简单步骤执行方法开发筛选。 开始第一步:选择流动相pH和缓冲液 根据分析物性质 (即pKa, logP和logD数据) 进行选择。对于未知分析物,使用酸性流动相作为起点。第二步:使用ACE 方法包 (3或6支色谱柱)梯度扫描以MeOH和MeCN作为有机溶剂,进行5-95%梯度筛选。第三步:查看数据 选择最佳色谱柱和有机改性剂。第四步:方法优化 如有必要, 检查温度, pH值, 梯度斜率,梯度范围等。是否实现分离? 是-方法开发完成 否-改变流动相条件(pH值,缓冲液等),回到第二步继续实验。 选择色谱柱和粒径尺寸。 由LC系统和用户的偏好决定。对于400 bar的HPLC系统来说, 5μm 150 x 4.6mm是个不错的选择。 对于600 bar优化的HPLC系统, 可使用2 和3μm粒径的较短色谱柱 (如100mm)。1.7μm粒径的短柱 (如50mm)适用于UHPLC系统。如何确定合适的筛选梯度时间? 梯度时间可以使用公式1计算。VM可用公式2计算。tG = 梯度时间 (mins.) k* = 梯度保留系数 (通常设置约为5)ΔΦ = 梯度范围 (即对于5-95%B梯度,ΔΦ= 0.9) VM = 柱内体积 (mL) S = 5 对于小分子 (<1000沓)F = 流速 (mL/min) L = 色谱柱长度 (mm) dc = 柱内径 (mm)请务必记住在下一次注射前, 在梯度洗脱后以至少10倍VM (柱内体积) 进行一次等度重新平衡。为何使用色谱柱筛选? • 改变色谱柱的固定相可能对选择性造成显著影响 (图1)。• 在相同的流动相条件下, 筛选不同的色谱柱可以帮助您以更高的分辨率更快地实现所需的分离。 图1:改变色谱柱固定相的影响。色谱柱:50x2.1mm 流动相:A = 0.1%甲酸的水溶液,B = 含0.1%甲酸的甲醇:水(9:1 v/v) 梯度:5分钟内3-100%B,流速:0.06mL/min 温度:40°C 检测:UV,254nm 样品:1)甲硝唑,2)苄醇,3)氢氯噻嗪,4)香草醛,5)羟苯甲酯,6)1,2-二硝基苯 • ACE MDKs将具有不同相互作用机制的色谱柱组合在一起, 以最大限度地提高选择性并增加分离具有挑战性的混合物的可能性。• 性价比高, ACE MDKs与单支色谱柱价格相同!• 两种最受欢迎的ACE反相 (RP) MDK (参见下表) 包括了为利用不同的保留机制和最大化选择性而独特设计的相。• 所有六个相都可以在反相 (RP) 条件下使用, 并且具有与C18一样的稳定性。 1近似值– 通过半定量机制加权和/或通过参考使用>100特征分析物的其他ACE相来确定。 • 其他的ACE方法包还有HILIC分析包, 生物大分子300?分析包和实心核(UltraCore) 分析包• 同样提供微孔柱尺寸 (内径0.5和1.0mm)。 成功范例 对乙酰氨基酚及有关物质 • 基于分析物的pKa和logD来选择流动相pH值。• 使用MeOH或MeCN作为最常见的方法开发 (C18)的起点无法分离所有的分析物。所以, 需要进一步的方法开发。• 使用6支色谱柱/2次流动相筛选, 即刻就可识别6种方案。• 无须进一步的方法开发了! 条件:色谱柱: 2 μm 100 x 3.0mm流动相:A = 20mM 乙酸胺 pH6.0B = 有机溶液含有 (20mM 乙酸胺 pH6.0):水 (9:1 v/v)梯度:10分钟内5-95%B流速:1.2 mL/min柱温:40 °C进样体积:2 μL样品:1)对乙酰氨基酚 (扑热息痛)2)4-氨基苯酚3)对苯二酚4)2-氨基苯酚5)2-乙酰胺基苯酚6)苯酚7)4-硝基苯酚8)2-硝基苯酚9)4-氯乙酰
厂商
2019.05.28
ACE EXCEL色谱柱 100%置换ACE产品的说明
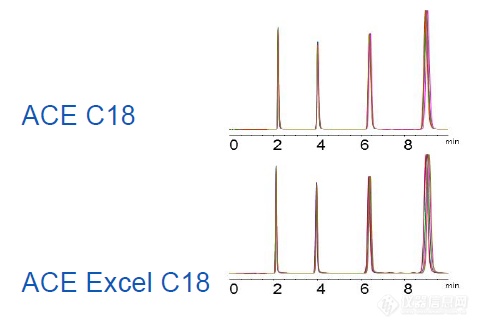
所有的ACE公司的UHPLC/HPLC固定相都是基于超惰性硅胶的特殊键合与封尾,以此最小化的二级反应从而获得了优异的峰形ACE的色谱柱采用了两种柱管: ACE的色谱产品有采用HPLC级柱管填装的,这种柱管的最大耐压是275bar,它适合3um与5um的色谱产品,所有的产品货号是以“ACE-”开头;ACE的产品也有采用HPLC/UHPLC兼容柱管填装的,这种柱管的耐压上限是1000bar。它适合于1.7um,2um,3um以及5um等合种粒径的产品,所有的产品是以货号“EXL-”。两种柱管的设计都确保了填料的低分散性以及稳定性以获得高柱效对于同样的3um,5um填料填装于两种柱管时,都给以相同的柱效例如一支ACE C18 150 x 4.6mm, 5um(货号:ACE-121-1546) 色谱柱相比于一支ACEExcel 150 x 4.6mm, 5um C18(货号:EXL-121-1546U) 色谱柱,将获得同样的选择性与保留行为(对于固定相一样的两种柱管填装柱都有是一样的置换) ACE C18, 150 x 4.6mm, 5um每种5支: ACE C18 和ACE Excel C18所有柱都采用同批次填料Mean (n=5) Peak 4 Mean (n=5) Peak 4ColumntR (mins) Efficiency (plates)ACE C18 8.8 12,900ACE Excel C18 8.9 13,200 优秀的重现性基于柱柱间以及两种柱管之间 ACE的1.7um与2um的色谱产品只能采用兼容的UHPLC/HPLC柱管基于背压的需要,所有货号以“EXL-开头”ACE的UHPLC/HPLC兼容的高压柱管所填装的产品(货号EXL-开头)可以完全取代HPLC柱管填装的同等固定相产品(货号ACE-开头)。不改变分离与保留行为。同时对于3u的小粒径产品,因为压力原因,“EXL-”置换“ACE-”更有利于获得更长的寿命。
厂商
2019.05.27
ACE色谱柱保护柱安装使用说明
ACE色谱柱保护柱安装使用说明 ACE独立式保护柱套是专为内径为1.0 - 4.6mm 的 ACE HPLC色谱柱而设计的,与ACE柱耦合器 (C0001)配合使用。 ACE色谱柱保护柱安装使用说明 1. 将保护柱芯放入柱套螺纹较短的那一半内。 保护柱芯是非定向的。 2. 用手将两半的柱套拧紧直至感觉到阻力为止, 然后再用扳手拧紧四分支一圈。 3. 将柱套螺旋纹较短的那一端与手拧柱耦合器 (C0001)一起连接到分析柱上。 这里请用手拧紧,千万不要用扳手。 4. 如果在加压后,两半柱套之间发现有渗漏的情况,请用扳手小心地将两半稍稍拧紧,直到渗漏 停止。 5. 如果在加压后,柱子和保护柱套之间有任何渗漏的情况,请用手小心地拧紧直到渗漏停止。 6. 柱耦合器(C0001)的活动中轴是自适应无实体积匹配各种色谱柱头,切勿抽出遗失。切勿让该配件非均 匀受力,以免折断。
厂商
2019.05.24
ACE色谱柱超惰性固定相对生物分子反相HPLC的益处介绍Ⅲ - 增加PH范围
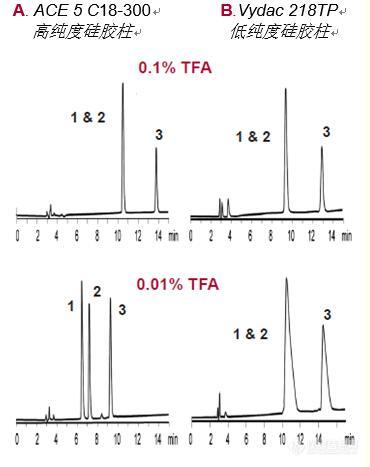
ACE色谱柱超惰性固定相对生物分子反相HPLC的益处增加PH范围 大多数生物分子是带电荷的。 肽类和蛋白质带有多种电荷。从小分子的经验来看,已流动相pH可以成为改变保留值并因此而优化带电化合物分离度的有力工具。 肽类也是如此。 再次以使用血管紧张素II和III作为实例,下图显示在pH=2的条件下,ACE超惰性色谱柱或填充有更具活性固定相的色谱柱上这两种肽未实现分离。 通过将pH增加至7,这两种色谱柱则均能提供良好的分离度。 然而,尽管ACE超惰性色谱柱保持了良好的峰形,但填充低纯度硅胶的色谱柱显示其峰形较差和性能损失。 在极性化合物的许多反相应用中观察到了这种现象。 在中等pH值时,硅醇相互作用更为普遍,因此峰拖尾在活性固定相上变得更加明显。流动相pH对分离度的影响 色谱柱:250 x 4.6mm, 5μm C18 300?流动相:pH 2 A:0.1% TFA(溶于水中) B: 0.1% TFA(溶于乙腈中)pH 7 A: 10mM NH4OAc(溶于水中) B: 乙腈 15分钟内25%-40% B流速:1.0 mL/min检测:UV 215nm化合物:1.血管紧张素II 2.血管紧张素III 3.血管紧张素IACE 5 C18-300超惰性硅胶 Vydac 218TP低纯度“活性”硅胶 调节流动相的pH是提高选择性的有力工具。只有基于超纯硅胶的色谱柱才能在更高的pH值下保持性能。 备注:比较性分离物不代表所有应用。
厂商
2019.05.22