推荐厂家
暂无
暂无



 400-629-8889
400-629-8889
 留言咨询
留言咨询

 400-629-8889
400-629-8889
 留言咨询
留言咨询

 400-629-8889
400-629-8889
 留言咨询
留言咨询



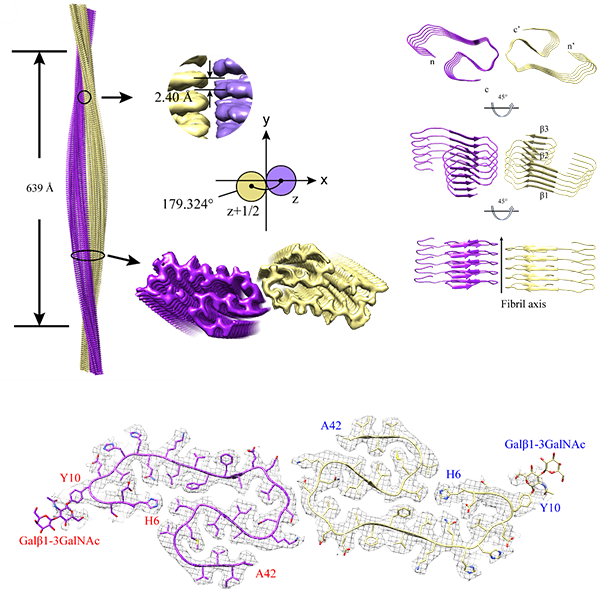
有没有同学用CE-SDS测高糖基化蛋白的?现有的方法多数是测单抗的,对我目前检测的蛋白不适用。想要改进方法又没有方向。希望有类似研究方向的同学交流一下,怎么能建立一个适用的方法。我用的仪器是贝克曼PA800plus
附件中是有关抗体IgG 的糖基化相关研究;希望对大家有用!祝新年好!
[align=center][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖[/color][/size][size=16px][color=#0d0d0d]基[/color][/size][size=16px][color=#0d0d0d]化[/color][/size][size=16px][color=#0d0d0d]及其[/color][/size][size=16px][color=#0d0d0d]糖蛋白规模化的鉴定[/color][/size][/align]O- [size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化是一种发生在蛋白质丝氨酸或苏氨酸上的具有一个糖单元结构的翻译后修饰,广泛分布在细胞核和细胞质中,是一种重要的胞内修饰调控方式。它参与细胞的多种应激响应和细胞进程,如信号转导、转录、翻译、蛋白降解、基因调控与细胞周期调控等。目前,已发现的[/color][/size][size=16px][color=#0d0d0d]1000[/color][/size][size=16px][color=#0d0d0d]多种[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白中,主要有细胞骨架蛋白、核孔蛋白、转录因子、激素受体、磷酸酶、激酶等。[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化异常与一些疾病,如糖尿病、帕金森病、阿尔兹海默症等有紧密联系。因此,系统地对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化蛋白质进行鉴定与分析[/color][/size][size=16px][color=#0d0d0d],[/color][/size][size=16px][color=#0d0d0d]对于研究其生物学功能和在疾病发生发展中的作用都具有重要意义。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][1][/color][/size][/sup][/font][size=16px][color=#0d0d0d]与目前磷酸化蛋白的鉴定规模相比,[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]蛋白的鉴定尚处于初级水平。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][2-4][/color][/size][/sup][/font][size=16px][color=#0d0d0d]导致[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]难以鉴定的原因主要有:[/color][/size][size=16px][color=#0d0d0d]1[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰在胞内是动态变化的,并且在细胞裂解时糖苷键容易被破坏;[/color][/size][size=16px][color=#0d0d0d]2[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白表达丰度较低,[/color][/size][size=16px][color=#0d0d0d]且糖基[/color][/size][size=16px][color=#0d0d0d]化水平不一;[/color][/size][size=16px][color=#0d0d0d]3[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白在进行质谱检测时容易发生中性丢失,难以被完全检测。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][5][/color][/size][/sup][/font][size=16px][color=#0d0d0d]由于[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰具有表达丰度低、高度动态变化、容易分解等特点,常规质谱鉴定手段难以对其实现高灵敏度、规模化的分析鉴定,因此对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]的鉴定往往需要先对糖蛋白[/color][/size][size=16px][color=#0d0d0d]/[/color][/size][size=16px][color=#0d0d0d]糖肽进行分离富集后方能成功进行。[/color][/size][size=16px][color=#0d0d0d]在近年来发展了多种针对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化修饰蛋白质和[/color][/size][size=16px][color=#0d0d0d]肽段[/color][/size][size=16px][color=#0d0d0d]的分离与富集新策略,已有的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽富集方法包括凝集素富集法、抗体富集法、代谢标签富集法、化学酶促反应标签富集法以及酰肼富集法等。[/color][/size][size=16px][color=#0d0d0d]基于亲和作用的直接捕捉方法操作简便,但由于亲和力较弱,难以避免非特异性吸附,导致特异性差;而通过非天然糖基的代谢标记法或化学酶促标记法将生物兼容性的反应基团([/color][/size][size=16px][color=#0d0d0d]炔[/color][/size][size=16px][color=#0d0d0d]基、叠氮基等)引入[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽,再由点击化学反应进行捕捉可以显著提高糖肽的富集特异性,但点击化学等反应不可逆,容易造成糖肽修饰基团的质量标签过大,影响糖肽的鉴定效率,而且操作复杂。[/color][/size][size=16px][color=#0d0d0d]因此,应该开发特异性高、覆盖高度、操作简便,并且不会影响质谱鉴定的新方法实现[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白规模化的鉴定。[/color][/size]