有没有同学用CE-SDS测高糖基化蛋白的?现有的方法多数是测单抗的,对我目前检测的蛋白不适用。想要改进方法又没有方向。希望有类似研究方向的同学交流一下,怎么能建立一个适用的方法。我用的仪器是贝克曼PA800plus
附件中是有关抗体IgG 的糖基化相关研究;希望对大家有用!祝新年好!
[align=center][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖[/color][/size][size=16px][color=#0d0d0d]基[/color][/size][size=16px][color=#0d0d0d]化[/color][/size][size=16px][color=#0d0d0d]及其[/color][/size][size=16px][color=#0d0d0d]糖蛋白规模化的鉴定[/color][/size][/align]O- [size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化是一种发生在蛋白质丝氨酸或苏氨酸上的具有一个糖单元结构的翻译后修饰,广泛分布在细胞核和细胞质中,是一种重要的胞内修饰调控方式。它参与细胞的多种应激响应和细胞进程,如信号转导、转录、翻译、蛋白降解、基因调控与细胞周期调控等。目前,已发现的[/color][/size][size=16px][color=#0d0d0d]1000[/color][/size][size=16px][color=#0d0d0d]多种[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白中,主要有细胞骨架蛋白、核孔蛋白、转录因子、激素受体、磷酸酶、激酶等。[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化异常与一些疾病,如糖尿病、帕金森病、阿尔兹海默症等有紧密联系。因此,系统地对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化蛋白质进行鉴定与分析[/color][/size][size=16px][color=#0d0d0d],[/color][/size][size=16px][color=#0d0d0d]对于研究其生物学功能和在疾病发生发展中的作用都具有重要意义。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][1][/color][/size][/sup][/font][size=16px][color=#0d0d0d]与目前磷酸化蛋白的鉴定规模相比,[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]蛋白的鉴定尚处于初级水平。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][2-4][/color][/size][/sup][/font][size=16px][color=#0d0d0d]导致[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]难以鉴定的原因主要有:[/color][/size][size=16px][color=#0d0d0d]1[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰在胞内是动态变化的,并且在细胞裂解时糖苷键容易被破坏;[/color][/size][size=16px][color=#0d0d0d]2[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白表达丰度较低,[/color][/size][size=16px][color=#0d0d0d]且糖基[/color][/size][size=16px][color=#0d0d0d]化水平不一;[/color][/size][size=16px][color=#0d0d0d]3[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白在进行质谱检测时容易发生中性丢失,难以被完全检测。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][5][/color][/size][/sup][/font][size=16px][color=#0d0d0d]由于[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰具有表达丰度低、高度动态变化、容易分解等特点,常规质谱鉴定手段难以对其实现高灵敏度、规模化的分析鉴定,因此对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]的鉴定往往需要先对糖蛋白[/color][/size][size=16px][color=#0d0d0d]/[/color][/size][size=16px][color=#0d0d0d]糖肽进行分离富集后方能成功进行。[/color][/size][size=16px][color=#0d0d0d]在近年来发展了多种针对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化修饰蛋白质和[/color][/size][size=16px][color=#0d0d0d]肽段[/color][/size][size=16px][color=#0d0d0d]的分离与富集新策略,已有的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽富集方法包括凝集素富集法、抗体富集法、代谢标签富集法、化学酶促反应标签富集法以及酰肼富集法等。[/color][/size][size=16px][color=#0d0d0d]基于亲和作用的直接捕捉方法操作简便,但由于亲和力较弱,难以避免非特异性吸附,导致特异性差;而通过非天然糖基的代谢标记法或化学酶促标记法将生物兼容性的反应基团([/color][/size][size=16px][color=#0d0d0d]炔[/color][/size][size=16px][color=#0d0d0d]基、叠氮基等)引入[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽,再由点击化学反应进行捕捉可以显著提高糖肽的富集特异性,但点击化学等反应不可逆,容易造成糖肽修饰基团的质量标签过大,影响糖肽的鉴定效率,而且操作复杂。[/color][/size][size=16px][color=#0d0d0d]因此,应该开发特异性高、覆盖高度、操作简便,并且不会影响质谱鉴定的新方法实现[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白规模化的鉴定。[/color][/size]
[b][font='微软雅黑',sans-serif][color=black][back=white]【序号】:4【作者】: 曹翠岩【题名】:N-糖链/糖肽纯化与免疫球蛋白G Fc糖基化定量分析[/back][/color][/font][/b][align=left][font='微软雅黑',sans-serif][color=black][back=white]【期刊】:大连理工大学 博士论文[/back][/color][/font][font='微软雅黑',sans-serif][color=black][/color][/font][font='微软雅黑',sans-serif][color=black][back=white]【年、卷、期、起止页码】:2022[/back][/color][/font][font='微软雅黑',sans-serif][color=black][/color][/font][font='微软雅黑',sans-serif][color=black][back=white]【全文链接】:[/back][/color][/font][url=https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C447WN1SO36whLpCgh0R0Z-ia63qwICAcC3-s4XdRlECrS5ECsmZMDd20ZXc0ZZUotUGtkXc-cNy_5YsXaID81b6&uniplatform=NZKPT]N-糖链/糖肽纯化与免疫球蛋白GFc糖基化定量分析研究 - 中国知网 (cnki.net)[/url][/align][align=left] [/align]
[align=center][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化修饰蛋白质和[/color][/size][size=16px][color=#0d0d0d]肽段[/color][/size][size=16px][color=#0d0d0d]的分离与富集新策略[/color][/size][/align][size=16px][color=#0d0d0d]作为[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]成功鉴定的前提,糖肽的分离富集一直是国内外研究的重点。近年来,针对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化修饰丰度低,质谱响应性差,难以实现高灵敏度、规模化分析等难点,发展了凝集素法、抗体富集法、亲水富集法等多种针对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化修饰蛋白质和[/color][/size][size=16px][color=#0d0d0d]肽段[/color][/size][size=16px][color=#0d0d0d]的分离与富集新策略。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][7-8][/color][/size][/sup][/font][size=16px][color=#0d0d0d]凝集素作为一类糖结合蛋白,能专一识别某种单糖或聚糖结构,并与之可逆的共价结合,因此被广泛[/color][/size][size=16px][color=#0d0d0d]应用于糖基[/color][/size][size=16px][color=#0d0d0d]化蛋白的分离富集中,其中,小麦胚芽凝集素([/color][/size][size=16px][color=#0d0d0d]WGA[/color][/size][size=16px][color=#0d0d0d])是富集[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽的常用策略。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][9][/color][/size][/sup][/font][size=16px][color=#0d0d0d]WGA[/color][/size][size=16px][color=#0d0d0d]以二聚体形式作用,每个单体含有[/color][/size][size=16px][color=#0d0d0d]4[/color][/size][size=16px][color=#0d0d0d]个结合位点,识别专一性不高,对聚糖的亲和力高,对单糖亲和力比较低,[/color][/size][size=16px][color=#0d0d0d]对糖链末端[/color][/size][size=16px][color=#0d0d0d]的唾液酸([/color][/size][size=16px][color=#0d0d0d]sialic acid[/color][/size][size=16px][color=#0d0d0d])、[/color][/size][size=16px][color=#0d0d0d]N-[/color][/size][size=16px][color=#0d0d0d]乙酰葡糖胺([/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]以及壳[/color][/size][size=16px][color=#0d0d0d]二糖([/color][/size][size=16px][color=#0d0d0d]chitobiose[/color][/size][size=16px][color=#0d0d0d])等结构均有识别。由于[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]是单糖修饰,直接用[/color][/size][size=16px][color=#0d0d0d]WGA[/color][/size][size=16px][color=#0d0d0d]富集特异性比较差。针对存在问题,[/color][/size][size=16px][color=#0d0d0d]Wosseller[/color][/size][size=16px][color=#0d0d0d]等[/color][/size][size=16px][color=#0d0d0d]人制[/color][/size][size=16px][color=#0d0d0d]备了一种基于[/color][/size][size=16px][color=#0d0d0d]WGA[/color][/size][size=16px][color=#0d0d0d]的凝集素层析柱,发展了一种凝集素弱性亲和色谱法([/color][/size][size=16px][color=#0d0d0d]LWAC[/color][/size][size=16px][color=#0d0d0d])对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖蛋白进行分离富集鉴定。利用装有[/color][/size][size=16px][color=#0d0d0d]WGA[/color][/size][size=16px][color=#0d0d0d]偶联珠的长柱,用低流速等压洗脱分离[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]肽,[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]肽[/color][/size][size=16px][color=#0d0d0d]由于与材料的亲和作用[/color][/size][size=16px][color=#0d0d0d]而被柱阻滞[/color][/size][size=16px][color=#0d0d0d],从而实现分离富集。除此以外,琥珀酰化后的小麦胚芽凝集素([/color][/size][size=16px][color=#0d0d0d]sWGA[/color][/size][size=16px][color=#0d0d0d])可以实现对末端[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖链的[/color][/size][size=16px][color=#0d0d0d]特异的亲和性,专一性有所改善,但结和力减弱。因此,凝集素方法依然存在制备困难、成本高、稳定性差、亲和力和选择性不足等缺点,影响[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽的高效分离富集。[/color][/size][size=16px][color=#0d0d0d]基于抗体的富集方法比凝集素[/color][/size][size=16px][color=#0d0d0d]法拥有[/color][/size][size=16px][color=#0d0d0d]更好的亲和力和特异性,是最简单的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽富集方法之一,运用[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]泛特异性抗体,可以识别[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]连接的丝氨酸或者苏氨酸残基,目前用到的主要有两种[/color][/size][size=16px][color=#0d0d0d]RL2[/color][/size][size=16px][color=#0d0d0d]和[/color][/size][size=16px][color=#0d0d0d]CTD110.6[/color][/size][size=16px][color=#0d0d0d],但是这些抗体往往具有位点依赖性,需要结合多个单糖才能表现出较强的亲和力,存在亲和力不够高的问题,多个抗体联合使用则会提高富集特异性。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][10][/color][/size][/sup][/font][size=16px][color=#0d0d0d]Wells[/color][/size][size=16px][color=#0d0d0d]等人通过对抗体富集策略进行改进发展,开发了新前处理方式等手段,从小鼠的突触组织样本中鉴定到[/color][/size][size=16px][color=#0d0d0d]1750[/color][/size][size=16px][color=#0d0d0d]个[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰位点,大大提高了[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽鉴定的准确度和广泛性。抗体较凝集素而言,特异性更强,结合力更大,但价格昂贵,易产生非特异性吸附导致假阳性结果,[/color][/size][size=16px][color=#0d0d0d]且单抗[/color][/size][size=16px][color=#0d0d0d]富集的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽具一定的选择性,每种抗体富集到的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽重合度不高,因此,普适性通用[/color][/size][size=16px][color=#0d0d0d]性抗体的开发成为了基于抗体富集[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽研究的关键。[/color][/size][size=16px][color=#0d0d0d]亲水富集方法利用糖肽中聚糖的羟基与固定相之间的亲水作用进行[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽的分离富集,[/color][/size][size=16px][color=#0d0d0d]Qian[/color][/size][size=16px][color=#0d0d0d]等人利用表面引发原子转移自由基聚合[/color][/size][size=16px][color=#0d0d0d](SIATRP)[/color][/size][size=16px][color=#0d0d0d]合成了亲水聚合物改性二氧化硅微粒,微粒子表面密集填充聚乙二醇,具有高度亲水性,为[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]肽的保留提供强大的[/color][/size][size=16px][color=#0d0d0d]HILIC[/color][/size][size=16px][color=#0d0d0d]相互作用。利用该材料从人的尿液样本鉴定到[/color][/size][size=16px][color=#0d0d0d]470[/color][/size][size=16px][color=#0d0d0d]个[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]肽,[/color][/size][size=16px][color=#0d0d0d]457[/color][/size][size=16px][color=#0d0d0d]个[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]蛋白,大大提高了[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽鉴定的覆盖度。但仍然存在假阳性较高的问题。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][11][/color][/size][/sup][/font]
现有基因重组表达的糖蛋白想进行以下几项委托检测, C端氨基酸测序、氨基酸组分分析、肽图、质谱分子量、糖基化分析如果有意者请联系,将样品要求、检测费用以及合作流程发到邮箱,如有疑问可以加qq联系。 qq:278569901 邮箱:wbz5102@gmail.com
带有糖基的化合物,一般在溶液中有异构体,比如果糖基,在重水中有开环式、闭环式,其中闭环式又有a-呋喃式、a-吡喃式、b-呋喃式、b-吡喃式,这样造成H谱和C谱比较复杂,如何解析这样的化合物?
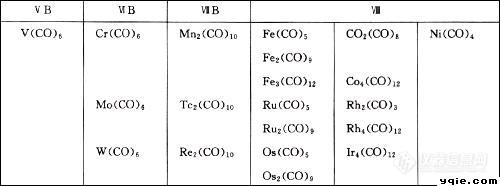
曾经在工作中接触过一点金属羰化物的红外分析,当时为了做好这项工作,我做了不少案头工作,现在我要离开分析行业了,整理了一下自己曾经做过的一些东西,真的还是有点留恋,就拿这些内容整理一下,作为原创大赛的最后一篇告别文。我这人其实挺烦为发表而作的八股文的,所以更喜欢比较自由的论坛帖子。好了,下面言归正传:一.基础知识 金属羰基化合物是指羰基和金属原子形成含σ-π配键的配位化合物,几乎全部的过渡金属可以和一氧化碳形成稳定的羰化物。这种配合物中金属离子的氧化态一般很低,有的甚至等于零,如4]、Na[Co(CO)[sub]4]、[Mn(CO)[sub]5Br]、Co[sub]2(CO)[sub]8]等。有些金属羰化物及其衍生物在一些有机合成中用作催化剂,有的已用于工业生产中,例如工业上常在高温高压下由合成气(CO+H[sub]2)与金属铑、钴或它们的盐合成羰化物作为催化剂。这里是别人列出的一些金属羰化物.[img]http://ng1.17img.cn/bbsfiles/images/2010/12/201012142027_267014_1640192_3.jpg[/img] 我接触到的是合成中用于均相催化剂的钴\铑\铱的羰基化合物.[/size]
如何消除羰基化合物在核磁谱中的烯醇异构化?
发现另类DNA修复机制 被烷基化或脱氨基的DNA碱基,在一个保护基因组完整性、但同时又会干预癌症烷基化疗法的过程中被DNA糖基化酶(修复酶)清除。迄今所研究的DNA糖基化酶采用一个被修饰的碱基插入活性点的机制。现在,最近发现的DNA糖基化酶AlkD的结构已被确定,并且也显示了一个非常不同的机制。按这种机制,被修饰的碱基从一个“螺旋外”位置伸出,这个位置只使N3- 和N7-被烷基化的碱基发生解理。DNA与AlkD的串联HEAT重复段的相互作用使DNA 骨干发生扭曲,从而使“非Watson–Crick碱基对”能够被检测到。AlkD酶在细菌、古细菌、植物和真核生物中普遍存在,这便提出了一个有趣的问题:为什么消除基因组烷基化损伤会有另一种机制?
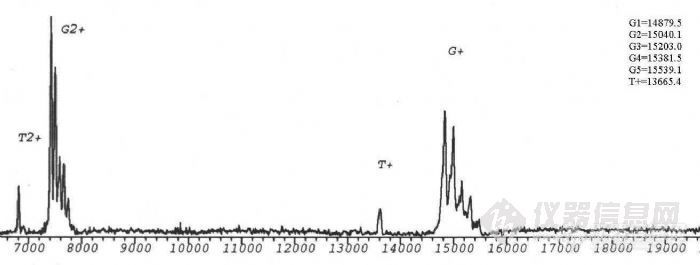
生物质谱在糖蛋白结构分析中的应用项目完成人:桑志红 蔡 耘项目完成单位:国家生物医学分析中心 随着人们对糖蛋白参与生命活动机理的日益深入了解,对天然糖蛋白及重组糖蛋白类药物的分析越来越受到重视。重组糖蛋白类药物的质量控制更是直接关系到药物的疗效及至人类的健康。九十年代以来,随着带有反射功能的基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)和纳升电喷雾串联质谱(nano-ESI-Q-TOF)等具有软电离方式的现代质谱 技术的发展,质谱以其高灵敏度和强有力的分析混合物的能力,提供了生物大分子的分子量、序列、一级结构信息以及结构转换、修饰等方面的信息,使糖基化分析有了重要的进展。 通常研究糖蛋白的方法是把蛋白链上的寡糖切下来,分别研究蛋白部分和寡糖部分的结构,因此无法研究与两部分共同相关的结构问题,也不能区分不同糖基化位点上切下来的寡糖。自90年代初,国外有人开始用质谱法研究糖蛋白的结构,同时描述了各个位点的不均一性。我们用建立的现代生物质谱技术研究糖蛋白一级结构的方法,将其应用与基因重组糖蛋白的结构分析。为糖蛋白结构分析及基因重组糖蛋白类药物的质量控制提供新的手段。一、 生物质谱研究糖蛋白结构方法的建立实验所用仪器为:1.德国BRUKER 公司的REFLEXIII型基质辅助激光解吸附电离飞行时间质谱仪,N2激光器,波长337nm,线性飞行距离150cm,加速电压2kv。2.英国Micromass 公司Q-TOF型电喷雾串联质谱仪。源温80°C,气体流速40L/h,枪头电压650V,检测频率2.4S,氩气碰撞池压力6*10-5mbar。1. 基质的选择,在MALDI-TOF-MS分析中,基质起着相当重要的作用。不同的基质对不同类的物质响应不同,a-氰基-4-羟基肉桂酸用于测定糖蛋白核糖核酸酶B效果相对较好。2. 糖蛋白分子量的测定,糖蛋白核糖核酸酶B由124个氨基酸组成,在34位Asn处连有一个高甘露糖型N-糖链。由于糖链的微不均一性,与普通蛋白质及核酸不同,其分子离子峰在MALDI-TOF-MS 质谱图上表现为一簇峰,各峰之间约相差一个糖基。正是由于这种微不均一性,使得其分子离子峰变宽,灵敏度降低。糖链分子量越大,峰越宽,灵敏度越低,所以一般只有糖链较短,蛋白的质量不太大的糖蛋白才能测定其平均分子量。用MALDI-TOF可直接测定糖蛋白核糖核酸酶B的平均分子量为 15208.6Da。http://ng1.17img.cn/bbsfiles/images/2011/03/201103211511_284179_1604317_3.jpg3. 糖含量的测定,采用O聚糖酶及内糖苷键酶F分别作用于核糖核酸酶 B,只有内糖苷键酶F能够是其分子量发生变化,表明核糖核酸酶B分子中不存在O-连接糖链存在着N-连接糖链。内糖苷键酶F切断N-糖链五糖核心最内侧的GlcNAc-GlcNAc糖苷键,得到含一个GlcNAc的肽链,减去GlcNAc,可以计算出准确的肽链分子量T=13695.6,与糖蛋白平均分子量之差为糖链的平均分子量G=1513.4,平均糖含量为:(糖链大小/糖蛋白分子量)×100%=9.95%。4. 糖基化位点的确定,研究糖基化类型及糖基化位点的策略:采用蛋白酶酶解与糖苷内切酶酶解相结合的方法,通过酶切前后含糖肽片的位移,结合网上数据库检索,可以确定糖基化类型和糖基化位点。以不同类型的糖苷内切酶作用于糖蛋白(N-糖苷键酶或O-糖苷键酶),在MALDITOF-MS 上观察其质量的变化,可以直接确定糖蛋白中是否含有响应类型的糖链,这是我们确定糖蛋白中糖苷键类型的基础。我们采用先将核糖核酸酶B还原烷基化,加Glu-C酶切,产物再用内糖苷肩酶F酶切,可观察到含糖肽段出现位移,将核糖核酸酶B的肽质量指纹图进行数据库检索,证实发生位移的肽段中含有N-糖链特异连接位点,由此确定34位Asn为糖基化位点。另外我们采用内糖苷键酶F及肽-N-聚糖酶F两种酶进行差位酶切法对含糖肽段进行验证,两种酶酶切后分子离子峰的差值除以GlcNAc的质量,结果就是N-糖基化位点的个数5. 质谱测定氨基酸序列, 我们对核糖核酸酶B肽质量指纹谱中的含糖肽段进行了串联质谱测定,首先在一级质谱图中选择离子4972.23,在串联质谱的碰撞活化室以氩气与其碰撞产生碎片,从碎片的质荷比推算出此肽片中的一段氨基酸序列,检索结果为核糖核酸酶B,从而判断其理论序列是否一致。6. 糖链结构的研究,凝集素对糖肽的亲和提取,进一步分析糖肽序列及糖链结构的关键是含糖肽段的提取。核糖核酸酶B中糖链为高甘露糖型,我们选用对其有特异性吸附的伴刀豆球蛋白对其进行提取利用这种简捷的亲和质谱的方法,对糖肽段进行了分析。建立了亲和质谱分析糖肽类物质的方法,为今后糖肽序列分析及糖链结构分析奠定了基础。二、基因重组糖蛋白人促红细胞生成素(rhEPO)的结构分析。 利用以上建立的方法,我们对样品重组人促红细胞生成素进行了分析,断定此样品为非完全糖基化,样品中只存在N-连接的糖链,无O-糖链。应用酶切法用肽-N-聚糖酶处理后,得到两个含糖肽段,进行数据库检索,测得38位及83位为N-糖基化位点,与文献报道相符,结果可靠。因此,该项课
2017年能力验证计划 CNAS PT0031-1603固体化工品 化学品熔点的测定 CNASPT0031-1702甲醇羰基化合物的测定羰基化合物02450247GB/T 6324.5报名截止日期:2017年6月31日,具体实施时间:2017.7-2017.11
【序号】:8【作者】: 程珍华【题名】:壳聚糖的羟丙基化、季铵盐化修饰及其衍生物的结构与性能研究【期刊】:浙江工业大学【年、卷、期、起止页码】:2018【全文链接】:[url]https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201801&filename=1017246430.nh&uniplatform=NZKPT&v=Sj53myVTRIHhcZwzkOJsh3h3El6tssU6oZpVOnZImBUkxEECiiP2f-I53b5DxJ2G[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=152826]大气中羰基化合物GC/MS分析方法[/url]摘要:介绍了一种灵敏度高、可靠并且能同时检测大气中2O种羰基化合物(C 一C 。)的分析方法.该方法是采用涂布PFPH(衍生剂)的TenaxTA作为固体吸附剂采集大气样品,然后再经过溶剂洗脱和[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]/质谱(GC/MS)分离检测的一项分析技术.校正曲线的可决系数(R。)、检测限(LOD)、平行样标准偏差(RSD,n=6)、回收率分别为0.995—1.00,0.15—1.04ngm~ ,7.3% 一15.8% 和92.7% ~109.2%.该方法成功地应用到对大气中羰基化合物的定量检测.对羰基化合物浓度的日变化分析表明,上海大气中羰基化合物浓度变化与大气光化学反应的强弱有密切关系.
急求乙烯中羰基化合物测定的相关标准,多谢
我们在测定甲醇中羰基化合物时,严格按照操作步骤进行,先制备无羰基甲醇,再按步骤一步一步进行,但当进行到加入氢氧化钠甲醇溶液时,过一会出现白色沉淀,如加入盐酸,沉淀又消失,为什么?白色沉淀是什么物质?
急求乙烯中羰基化合物测定的相关标准,多谢!
抗炎饮食的烹饪方式应健康化,主要采用蒸、煮、烩、炒等方式,减少煎、炸、烤等高温烹调方式的使用。油炸食物中不仅含有较多反式脂肪酸,并在高温烹调或煎炸过程中产生促炎物质,如杂环胺和多环芳烃,同时还会产生糖基化终产物。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=115955]GB/T9733-2008化学试剂 羰基化合物测定通用方法[/url]
单一的甜菊糖苷与瑞鲍迪A或者是纯度高的葡萄糖基甜菊糖苷的基线波动小,分离也不错。但是有时候做比较杂的葡萄糖基甜菊糖苷,会有小杂峰密集出现并带着基线波动。是按照国标方法做的,求方法解决
我们有进厂原料己烯-1,需要分析其中的羰基化合物,燕山石化有分光光度测定法,但我们建项做曲线时发现空白的吸光度都非常大,颜色很深,无法调零,想请教有经验的老师,这是怎么回事?具体步骤因为家里没有,没记住,有做过的应该知道吧。
http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gifAB SCIEX公司生物药研究的解决方案及其案例分析讲座时间:2014年11月13日 14:00 主讲人:郭立海、赵 健郭立海 博士 AB SCIEX公司应用专家 ;赵 健 博士 北京天广实生物技术股份有限公司http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gif【简介】TripleTOF 4600在生物制药领域中的应用完整蛋白分子量的测定肽指纹谱分析二级氨基酸全序列分析蛋白翻译后修饰和化学修饰分析 –翻译后修饰,如糖基化,磷酸化,去酰胺化(Deamidation) –化学修饰,如聚乙二醇(PEG)修饰,氧化(M)宿主细胞杂质蛋白及降解产物分析定量分析---蛋白药物PK 质谱在抗体类药物表征中的应用IntroductionCharacterization of therapeutic antibodies -Intact mass -Peptide mapping -Glycosylation analysis -Other PTM:Characterization of charge variants -Disulfide bonds and Cys-linked variantCharacterization of Antibody-Drug Conjugate(ADC) -Intact mass tested for DAR -Antibody Conjugation Site MappingOthersAcknowledgements-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2014年11月13日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/11825、报名及参会咨询:QQ群—231246773
药物水溶性,很好,分子量350左右,带有乳糖基,口服吸收会好吗?会不会被胃酸就降解掉了?
质谱技术是抗体药物分析最重要的技术手段之一。本文简述了抗体药物的发展和质谱技术的原理。对于质谱技术在抗体药物的分析中应用进行了归类整理,主要分为在一级结构和高级结构分析中的应用。抗体类药物是指含有抗体片段的蛋白类药物,所以在恶性肿瘤、自身免疫性疾病、心血管疾病、感染和器官移植排斥等重大疾病上得到了快速的发展,是当前生物药物领域增长最快的一类药物.1.抗体药物发展新趋势在生物药物领域,抗体药物占据着越来越重要的地位,全球销售排名前10位的药物中有6个为抗体药物,抗体药物按来源分类可以分为:鼠源单克隆抗体、人鼠嵌合抗体、人源化抗体和全人源抗体。目前,批准的单克隆抗体药物中,人源化单抗和全人源单抗数量已占据大多数。1.1 抗体药物偶联物(ADC)抗体药物偶联物(ADC)由单克隆抗体和小分子化合物两部分组成。通过抗体的靶向作用,ADC 的抗体部分和肿瘤细胞表面抗原特异性识别并结合,通过细胞内吞作用,将抗体和小分子化合物一起带进肿瘤细胞内部,释放出小分子化合物。这样既可以降低小分子药物的毒性,同时具有靶向结合的作用。已经上市的两个ADC 是Kadyla 和Adcetris。1.2 双特异性抗体(BsAb)双特异性抗体(BsAb)是含有两种特异性抗原结合位点的人工抗体,能在靶细胞和功能分子(细胞)之间架起桥梁,由于基因工程的发展,目前双特异性抗体已经研发出多种类型,主要类型有三功能双特异性抗体、IgG-scFv、三价双特异性分子、串联单链抗体(串联scFv)、DVD-Ig 等多种形式。2.质谱技术近年来质谱仪性能的显著改进主要基于开发出的两种离子化技术:一种是介质辅助的激光解吸/离子化技术。另一种是电喷雾离子化技术。由于这两种电离技术的出现,使原本只能检测小分子的质谱技术,可以运用于检测生物大分子。在过去质谱技术主要运用于对一级结构和序列的表征,而现在质谱技术越来越多地运用于高级结构的分析,而高级结构对于抗体药物的生物活性至关重要。3.质谱技术在抗体药物一级结构分析中的应用3.1 完整抗体药物精确分子量测定当得到抗体药物时,可以直接通过高分辨率的MALDI-TOF或者ESI-MS进行分子量的检测。通过对于脱糖后分子量的检测,可以对于抗体药物进行初步定性分析,并将可以作为药物常规放行的分析方法。对于脱糖前的抗体药物进行分析,可以得到抗体药物的糖基化类型的信息及糖基化水平的分布,对于快速了解生产工艺与药物质量的关系具有十分重要的意义。3.2 药物抗体偶联比(DAR)对于赖氨酸链接的抗体偶联药物,采用C4色谱柱及联用的质谱对去糖基化样品进行分析,根据偶联不同数目药物分子的质量数增加判断偶联数目。对于质谱测定的结果,不仅可以给出确切的药物抗体偶联比值,更能够给出链接不同个小分子药物的分布情况,及反应过程副产物空链接头的分布情况。3.3 肽图谱分析蛋白被特异酶切后的蛋白酶水解后得到的肽片段质量图谱。由于不同的抗体药物具有不同的氨基酸序列,蛋白质被酶水解后,产生的肽片段也各不相同,肽混合物的质量数具有唯一特征。可以通过LC-ESI-MS进行肽片段的一级质量数的鉴定,也可以通过LC-ESI-MS/MS对于每个肽片段进行进一步确证,提高肽图谱的准确性。3.4 翻译后修饰研究蛋白质的翻译后修饰(PTM)对于抗体药物的生物学功能十分重要。常见的翻译后修饰有:磷酸化、脱酰胺、甲硫氨酸氧化、糖基化修饰、N端焦谷氨酸环化,C端赖氨酸切除等。质谱分析仪检测蛋白和肽片段的分子量偏差,可以实现高灵敏、高通量和高精确地鉴别蛋白质的翻译后修饰的种类。3.5 N端氨基酸序列检测常规N端氨基酸检测用Edman降解法进行检测,但是抗体药物有时候会出现N 端环化的现象,在这种情况下用Edman降解法需要先对抗体进行去封闭处理,而直接使用质谱可以直接测出N端的氨基酸序列,同时可以检测出N端环化的相对比例。4.质谱技术在抗体药物高级结构分析中的应用4.1 氢/氘交换质谱(HDX-MS)常规的质谱只能获得蛋白的一级结构信息。氢/氘交换质谱(HDX-MS)可以进行蛋白质构象,溶液动力学和表位映射进行分析。在能够调查的蛋白质的高阶结构和动态结构技术中,HDX-MS已经证明适合单克隆抗体和单克隆抗体-抗原复合物的构象分析。4.2 离子淌度质谱法(IM-MS)离子淌度是根据蛋白的电荷和形状选择性分离的方法,可以区分相同分子量的蛋白和肽段,可用于检测蛋白的简单高级结构。4.3 高分辨率傅立叶变换离子回旋共振质谱(FTICR-MS)高分辨率傅立叶变换离子回旋共振质谱(FTICR-MS)能够检测最高质量数的质谱仪器,并且有着很高的分辨率。FTICR-MS 是目前被公认为是蛋白质组学研究的有力工具,特别是和完整的蛋白质鉴定和上/下调翻译后修饰(PTM)蛋白质的鉴定。
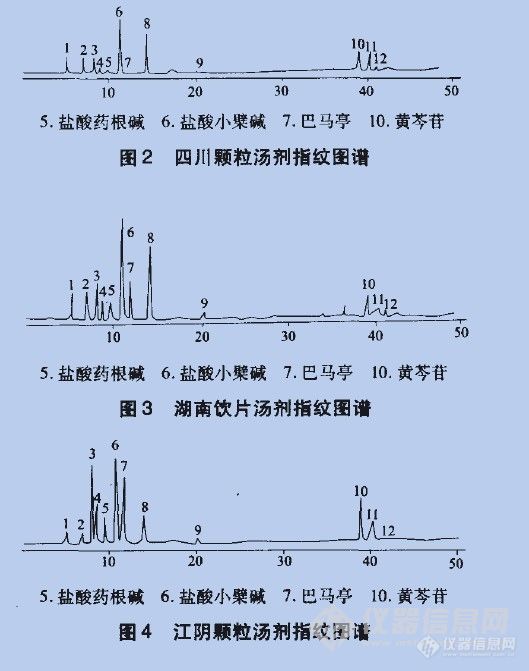
黄连解毒汤饮片汤剂和颗粒汤剂的指纹图谱比较刘韶 雷鹏 李新中 戴智勇 王海波(中南大学湘雅医院药剂科长沙410008)摘要目的:用指纹图谱对黄连解毒汤传统饮片汤剂和现代颗粒汤剂进行比较。方法:采用RP—HPLC梯度洗脱进行分析,色谱柱:Diamonsil(TM)一ClB柱-(250 mm×4.6 mm);流动相:水-甲醇一0.05%磷酸(梯度洗脱);检测波长:254 nm;柱温:35℃。结果:所建立分析方法得到的HPLC色谱图有较好重现性。结论:不同厂家饮片汤剂、颗粒汤剂指纹图谱存在一定的差异。关键词HPLC;指纹图谱;黄连解毒汤;饮片汤剂;颗粒汤剂http://ng1.17img.cn/bbsfiles/images/2012/07/201207232331_379313_2355529_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/07/201207232332_379314_2355529_3.jpg
我想用液相色谱鉴定马铃薯中所含花色苷,带糖基的标样和不带的我应该用哪种?我不知道马铃薯中花色苷的结
本文引用自发酵《在发酵工艺角度看蛋白表达》引用发酵 的 在发酵工艺角度看蛋白表达在分子生物学角度讲,找到或合成外源蛋白基因,构建质粒,并导入细胞以表达具有生物活性的折叠正确的蛋白,是一种成熟的常规技术。目前,包括酶,抗原,抗体,激素,其他小分子调节蛋白在内的很多蛋白,都已经用这种技术实现了工业化生产。在具体的工艺选择上,历史沿袭习惯和表达体系的选择,对工艺稳定性,成本,有巨大的影响。 目前,常用的蛋白表达系,有3个类别:1,大肠杆菌表达系。大肠杆菌的遗传背景十分清楚,代谢相对简单,发酵副产物少,在不是很严格的情况下,是表达蛋白的首选。通过按经验选择合适的菌株及合适的质粒,既可以以包涵体的形式得到大量的目标蛋白,又可以在细胞外得到可溶性蛋白,是常见的一种表达系。2,酵母菌表达系。用酵母做表达系,理由之一,也是遗传背景清楚,而且,当蛋白分子量过小,不能形成包涵体时,或蛋白的二硫键过多,不易体外复性时,酵母菌就成了合适的选择。另外,酵母对蛋白也会有一个简单的修饰,近似于高等动物的蛋白糖基化过程。这样,在合成在体液中发挥作用的蛋白,而且,又不能(技术水平限制)用动物细胞时,就可以退而求其次的选用酵母菌表达。一般是用信号肽把蛋白导出细胞,在发酵液中以可溶性蛋白的形式存在。这也是一个常见的表达系。3,动物(或说,人的)细胞表达系。这种情况,在纯度或毒性方面有较高要求的产品应用。一般国外产品应用较多,国内还没有用动物细胞表达蛋白实现商业化生产的报道。由于技术限制,国内工业化生产用这个方法目前还有较大难度。这3种表达系,各自有自己的优缺点。首先,在潜在的毒性影像方面讲,由于和真核生物亲缘关系太远,大肠杆菌就最不合适。其次是酵母菌。而在表达量和代谢控制成本上来讲,酵母菌和动物细胞又是差强人意的。现在,很多蛋白习惯性的选用酵母菌做表达系,就是因为早期提取蛋白技术低下,而动物细胞培养技术又不过关的原因所致。目前,虽然提取工艺提高了,但作为蛋白这种高附加值产品,运作成本集中在销售而不是生产,所以,降低生产成本的诉求很低。站在降低开发难度的角度讲,一方面,质粒构建和质粒与菌株的匹配方面依赖大量经验,另一方面,发酵工艺策略选择与发酵工艺优化又需要很大的投入,所以,技术开发部门沿用自己熟悉的,已经积累了大量经验的表达系,是合理的。不过,随着分子技术进一步的发展,分子技术进入低附加值的产品领域又是必然的,降低生产成本就变的越来越必要了。 大肠杆菌表达系有两种得到外源蛋白的方法:1,缓慢的表达,得到可溶性蛋白,这种方法产量和酵母菌表达类似,与酵母菌比,不具有明显的优势,一般是有做大肠杆菌传统的研究机构生产小分子蛋白的一种沿袭性做法。2,使用T7启动子表达蛋白,这样,高速的蛋白表达速率使蛋白来不及折叠,在细胞内形成非水溶性的包涵体。最后目标蛋白可以达到总细胞质量的15%-25%,这样,就为降低成本提供了一种可能。不过,在使用T7启动子表达时,也存在两个难点:1,蛋白的复性技术,如果形成可溶性蛋白,那利用(使用分子技术加载在目标蛋白上)信号肽,只要过一遍柱子就能分离得到纯度非常高的,具有生物活性的产品,而形成包涵体,对提取,复性就有较高的要求,特别是二硫键的存在,会对复性产生很大的影响。在目前国内和国际流行技术看,并不是所有的蛋白都能在预定成本下复性的。2,任何情况下,高产都是代谢网络互相依赖与作用的结果。在如此高的表达量下,甚至细胞的形态都已经发生很大变化,正常代谢受到严重干扰,以至于放大时,摇瓶工艺对发酵工艺几乎没有任何参考价值。发酵工艺策略的选择将直接依赖于工程人员在生化,生理水平对菌株的理解,而匮乏可资参考的数据资料。发酵工艺的优化要离开摇瓶经验在发酵罐上逐步进行,这样,整个发酵工艺的确立就需要比想象中要大得多的人员与时间的投入。另外,再说一下糖基化的问题。在动物细胞内合成的折叠正确的蛋白,在分泌入体液前会有一个糖基化的过程,加上一个糖链就不会很快被蛋白酶当做折叠错误的蛋白水解掉。但是以微生物为表达系表达的蛋白,不具有动物细胞的修饰过程,用大肠杆菌表达的目标蛋白,很快会在血液中被降解。解决或回避这个问题,有两种方法:1,用动物细胞表达,一般,是用癌化的人类细胞。由于动物细胞培养技术要求过高,在国外比较昂贵的医药中有应用,国内不常见。2,由于酵母菌也有一个对蛋白的粗略的修饰过程,可以用酵母菌表达目标蛋白。这个技术,国内国外都在用,可以是一个权宜之计。主要难点集中在对合适菌株的分子水平的改造,以达到尽可能接近满意的修饰效果。这样,就可以在不同目标蛋白上表达系和发酵工艺上做出选择。如果是小分子,无糖基化修饰或不在体液中发挥作用的蛋白,可以选择大肠杆菌和酵母菌表达系,得到可溶性蛋白,然后提取。如果分子量合适,并对生产成本有诉求,而且可以比较方便的复性,则选用大肠杆菌表达系,得到包涵体,然后复性。如果是需要在体液中发挥活性并有糖基化要求的 蛋白,则选用经过分子生物学改造的酵母菌表达系。当然,并不是任何一个实验室都同时拥有或擅长所有的方向的。而难点,往往集中在以下3个方面:1,大肠杆菌蛋白包涵体复性。2,糖基化修饰。3,发酵工艺(工程菌株的工业水平)的确定。做工程一般是理科实验室的弱项,而工科实验室做基础又很少,在把工科和理科结合方面,我们实验室还是有经验和成功先例的。下面,以溶菌酶为例,阐述一下蛋白表达系的选择和工艺的确定。溶菌酶是一类具有种属差异的非特异性免疫物质,在动物界中普遍存在,种类繁多,其实,在植物和微生物中也有发现。但研究最多的还是动物。开发兽用溶菌酶,主要是想作为抗生素的替代物,作为添加剂使用。因此是一个低附加值的产品。下面一切的工作,都会围绕“兽用”和“低附加值”展开。首先,比较几种常见和认为有效的溶菌酶,杀菌效果最好的是人的溶菌酶,但考虑到潜在的危险(具有对人溶菌酶产生抗性,并使抗性基因扩散),舍尔求其次,用了鸟类蛋清溶菌酶,作为表达对象。然后,在得到溶菌酶蛋白的一级结构后,对此进行了分析。此蛋白不会用于体液内,故没有糖链修饰的问题。分子量不是很大,但也不太小,130左右的氨基酸构成,足以形成包涵体,这就为用大肠杆菌表达系高效表达提供了可能。讨厌的是有4个二硫键,其中有两个在结构复杂区域,折叠正确有一定的困难。但是,如果用酵母菌做,可能没法解决成本问题,即便优化工艺现在过去了,也不会是最终版本----肯定会有人用大肠杆菌做。所以,结论就是必须知难而进,拿下复性工艺。另外,由于是低附加值产品,发酵吨位就不能太小。以往分子生物学流行的50升,100升小罐发酵,肯定是不行的。发酵罐的放大,除了溶氧,剪切力发生变化,更重要的是搅拌线速度改变了胞外酶以及包括细胞本身的代谢方式和速度。在胞内体现就是氧化还原电势的改变,这在工艺上会带来很多麻烦。虽然说,一般是放大后产量往往提高,但放大过程中,小罐的经验就不能照搬了。同时,也因为是低附加值产品,发酵过程中诸如质粒丢失等稳定性要求,就很高了,应为只有稳定,才能控制成本。这样,工艺就成了第二个难点。明白这些之后,按照大肠杆菌的喜好,合成了溶菌酶的基因。然后构建质粒,导入细胞。在摇瓶水平表达溶菌酶。在筛选复性条件的同时,就同时在发酵罐水平对工艺稳定性进行了优化。首先,为了进一步提高质粒稳定性,对初始培养基进行了重新设计。并改动发酵工艺策略,由于是胞内产物,我们应用高细胞密度发酵控制法延长限制性生长时间(不能用经典发酵的延长对数期生长时间的办法,对工程菌不适合,会造成质粒丢失,代谢紊乱等一系列问题),提高细胞量,并改变了诱导时机,得到了稳定的高产,具体数据比较枯燥,就不在此展开了。提取方面,经过不懈的努力,我们也掌握了比较成功的复性条件(具体由另外人员负责,也不做详细介绍了)。这样,工艺才基本拼凑好。进一步优化,在试生产多次重复时在进行。以上,是外源蛋白表达的粗略的技术和工艺的过程。
[align=center][size=16px][color=#0d0d0d]代谢标记富集法[/color][/size][size=16px][color=#0d0d0d]及[/color][/size][size=16px][color=#0d0d0d]化学酶促标记法[/color][/size][size=16px][color=#0d0d0d]富集糖肽[/color][/size][/align][size=16px][color=#0d0d0d]代谢标记富集法由[/color][/size][size=16px][color=#0d0d0d]Bertozzi[/color][/size][size=16px][color=#0d0d0d]等人提出,用疏水的过乙酰化的叠氮乙酰葡萄糖胺([/color][/size][size=16px][color=#0d0d0d]Ac4GlcNAz[/color][/size][size=16px][color=#0d0d0d])培养细胞,经过系列[/color][/size][size=16px][color=#0d0d0d]酶反应[/color][/size][size=16px][color=#0d0d0d]后生成可被[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基转移酶识别的叠氮化底物类似物[/color][/size][size=16px][color=#0d0d0d]UDP-[/color][/size][size=16px][color=#0d0d0d]GlcNAz[/color][/size][size=16px][color=#0d0d0d],使糖蛋白带上代谢标签,最后通过亲和树脂实现对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖基化蛋白的分离富集。该方法利用特异性化学实现对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽富集,但由于细胞更倾向于利用内源性的[/color][/size][size=16px][color=#0d0d0d]UDP-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]而对代谢类似物[/color][/size][size=16px][color=#0d0d0d]UDP-[/color][/size][size=16px][color=#0d0d0d]GlcNAz[/color][/size][size=16px][color=#0d0d0d]的利用率较低,影响了富集效果。此外,代谢过程中引入的其他糖基化修饰标签也会造成假阳性的结果。[/color][/size][size=16px][color=#0d0d0d]化学酶促标记法是近年来被广泛使用的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]糖肽富集策略,该方法得益于[/color][/size][size=16px][color=#0d0d0d]Gal-T1-Y289L[/color][/size][size=16px][color=#0d0d0d]突变体的发现,[/color][/size][size=16px][color=#0d0d0d]Gal-T1-Y289L[/color][/size][size=16px][color=#0d0d0d]突变体可以将含酮的[/color][/size][size=16px][color=#0d0d0d]UDP[/color][/size][size=16px][color=#0d0d0d]半乳糖以及叠氮修饰的[/color][/size][size=16px][color=#0d0d0d]UDP[/color][/size][size=16px][color=#0d0d0d]半乳糖作为供体底物,转糖之后[/color][/size][size=16px][color=#0d0d0d]酮[/color][/size][size=16px][color=#0d0d0d]官能团与氨氧基生物素形成[/color][/size][size=16px][color=#0d0d0d]肟[/color][/size][size=16px][color=#0d0d0d],或者是叠氮基团与生物素基团通过生物正交化学(通常是点击化学)连接起来,从而对[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]进行富集。基于[/color][/size][size=16px][color=#0d0d0d]Gal-T1-Y289L[/color][/size][size=16px][color=#0d0d0d]的富集方法已经取得了相当大的进展,发展了基于生物素可切割接头和基于可逆反应的释放的方法。常规富集方法通常分为两步,第一步:采用重组半乳糖基转移酶[/color][/size][size=16px][color=#0d0d0d] ([/color][/size][size=16px][color=#0d0d0d]GalT[/color][/size][size=16px][color=#0d0d0d]) [/color][/size][size=16px][color=#0d0d0d]将含有叠氮基的[/color][/size][size=16px][color=#0d0d0d] N-[/color][/size][size=16px][color=#0d0d0d]乙酰半乳糖胺[/color][/size][size=16px][color=#0d0d0d] ([/color][/size][size=16px][color=#0d0d0d]GalNAz[/color][/size][size=16px][color=#0d0d0d])[/color][/size][size=16px][color=#0d0d0d]从相应的尿苷二磷酸连接糖供体共价转移到[/color][/size][size=16px][color=#0d0d0d] O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d];第二步:[/color][/size][size=16px][color=#0d0d0d] Cu(I) [/color][/size][size=16px][color=#0d0d0d]介[/color][/size][size=16px][color=#0d0d0d]导的叠氮烷基环加成[/color][/size][size=16px][color=#0d0d0d] ([/color][/size][size=16px][color=#0d0d0d]CuAAC[/color][/size][size=16px][color=#0d0d0d]) [/color][/size][size=16px][color=#0d0d0d]反应将叠氮官能团转移到含有[/color][/size][size=16px][color=#0d0d0d]炔[/color][/size][size=16px][color=#0d0d0d]基的小分子上。两步化学酶标记方法可以使用不同的糖基转移酶,应用于复杂聚糖的检测,但是由于连接缓慢以及细胞内具有各种副反应,第二步反应通常不完全。浙江大学易文教授研究组推测仅依赖[/color][/size][size=16px][color=#0d0d0d]酶转移[/color][/size][size=16px][color=#0d0d0d]的一步标记策略,显著提高了糖基化蛋白质的鉴定灵敏度。他们利用计算机辅助设计生成[/color][/size][size=16px][color=#0d0d0d]GalT[/color][/size][size=16px][color=#0d0d0d] [/color][/size][size=16px][color=#0d0d0d]突变体,能够将生物素修饰的[/color][/size][size=16px][color=#0d0d0d] UDP-GalNAc [/color][/size][size=16px][color=#0d0d0d]类似物转移到[/color][/size][size=16px][color=#0d0d0d] O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d],并且通过实验验证了[/color][/size][size=16px][color=#0d0d0d]一[/color][/size][size=16px][color=#0d0d0d]步法标记显著改善的普遍性。利用一步标记方法成功鉴定到新的[/color][/size][size=16px][color=#0d0d0d]O-[/color][/size][size=16px][color=#0d0d0d]GlcNAc[/color][/size][size=16px][color=#0d0d0d]修饰蛋白[/color][/size][size=16px][color=#0d0d0d]FEN1[/color][/size][size=16px][color=#0d0d0d],揭示了[/color][/size][size=16px][color=#0d0d0d]FEN1[/color][/size][size=16px][color=#0d0d0d]在[/color][/size][size=16px][color=#0d0d0d]DNA[/color][/size][size=16px][color=#0d0d0d]损伤修复中的动态调节作用。[/color][/size][font='times new roman'][sup][size=16px][color=#0d0d0d][12-13][/color][/size][/sup][/font]
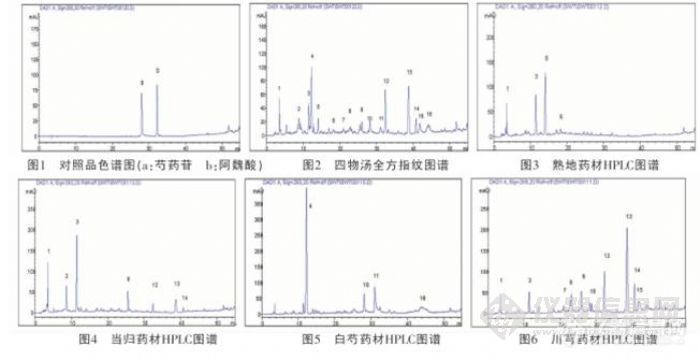
【作者】:雷艳青,雷 鹏,刘 韶,李新中【摘要】: 目的:为探讨中药配方颗粒在中药复方中应用的可行性,本研究选取补血名方“四物汤”为实验对象,对该方的传统饮片汤剂与配方颗粒汤剂进行中药指纹图谱的比较。方法:采用高效液相色谱、二极管阵列检测器:色谱柱为C18(Dia-monsil 250 mm×4.6 mm,5 μL);流动相中,流动相组分A为水,B为甲醇,C为0.05%磷酸;梯度洗脱,条件为组分C保持10%不变,组分B从0到90%;检测波长为280 nm;流速为1.0 mL·min-1;柱温:35 ℃。结果:同一批药材的两种汤剂其HPLC指纹图谱相似性好,相似度0.924。6批不同厂家的汤剂间指纹图谱基本一致,相似度在0.70-0.98。结论:方剂四物汤的中药配方颗粒与传统饮片汤剂比较,指纹图谱相似性好,提示内在化学成分基本相同。【作者单位】:湖南省脑科医院,中南大学湘雅医院【关键词】: 四物汤;传统饮片汤剂;配方颗粒汤剂;HPLC指纹图谱http://ng1.17img.cn/bbsfiles/images/2012/07/201207310921_380753_1838299_3.jpg
建议少吃煎炸食品。肉类经高温油炸、煎烤可产生杂环胺和多环芳烃,并产生糖基化终产物,具有促建议少吃煎炸食品。肉类经高温油炸、煎烤可产生杂环胺和多环芳烃,并产生糖基化终产物,具有促炎性,会增加结直肠癌的发病风险。大量食用煎炸食品容易引发心血管疾病、心力衰竭和糖尿病。炎性,会增加结直肠癌的发病风险。大量食用煎炸食品容易引发心血管疾病、心力衰竭和糖尿病。