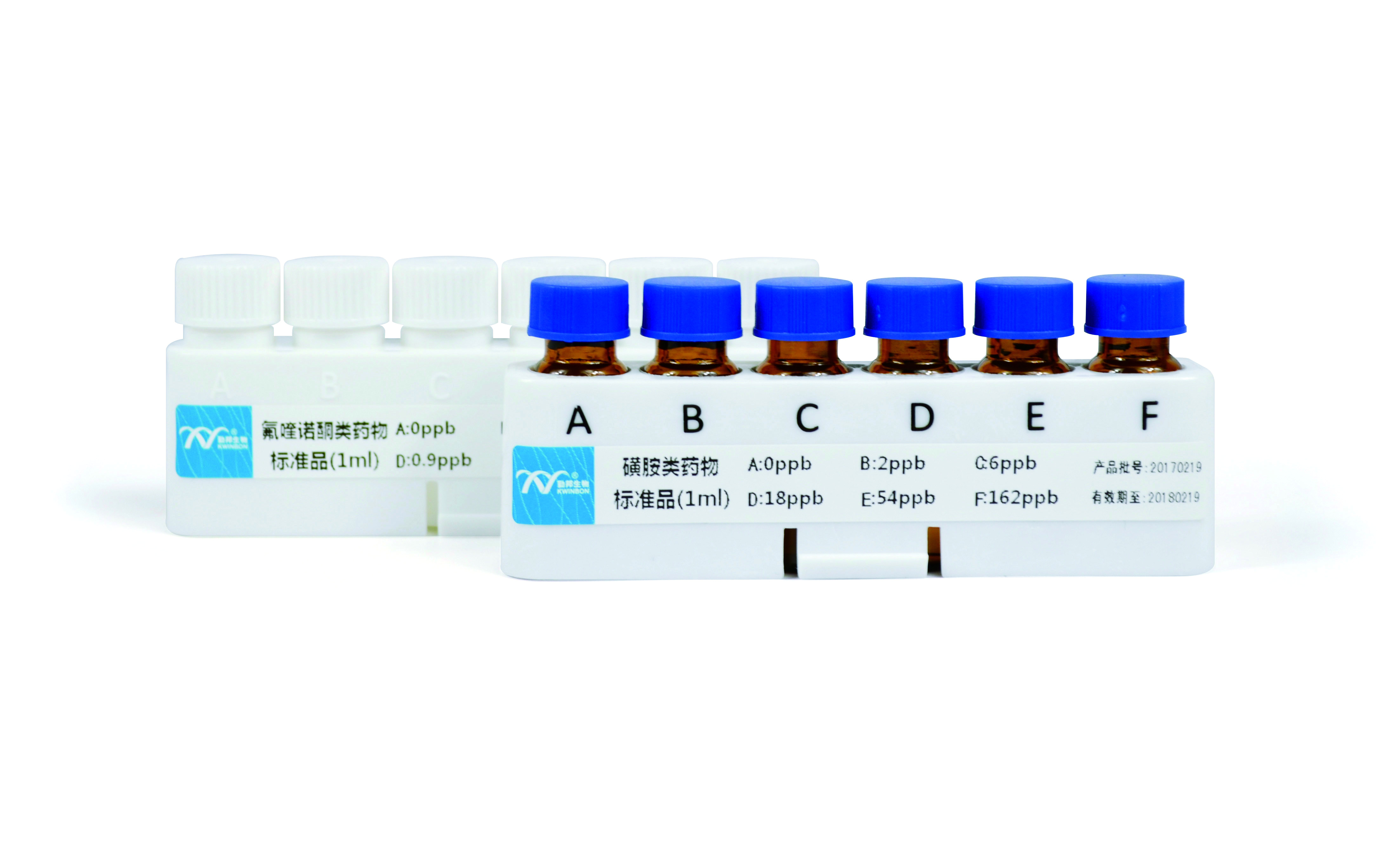
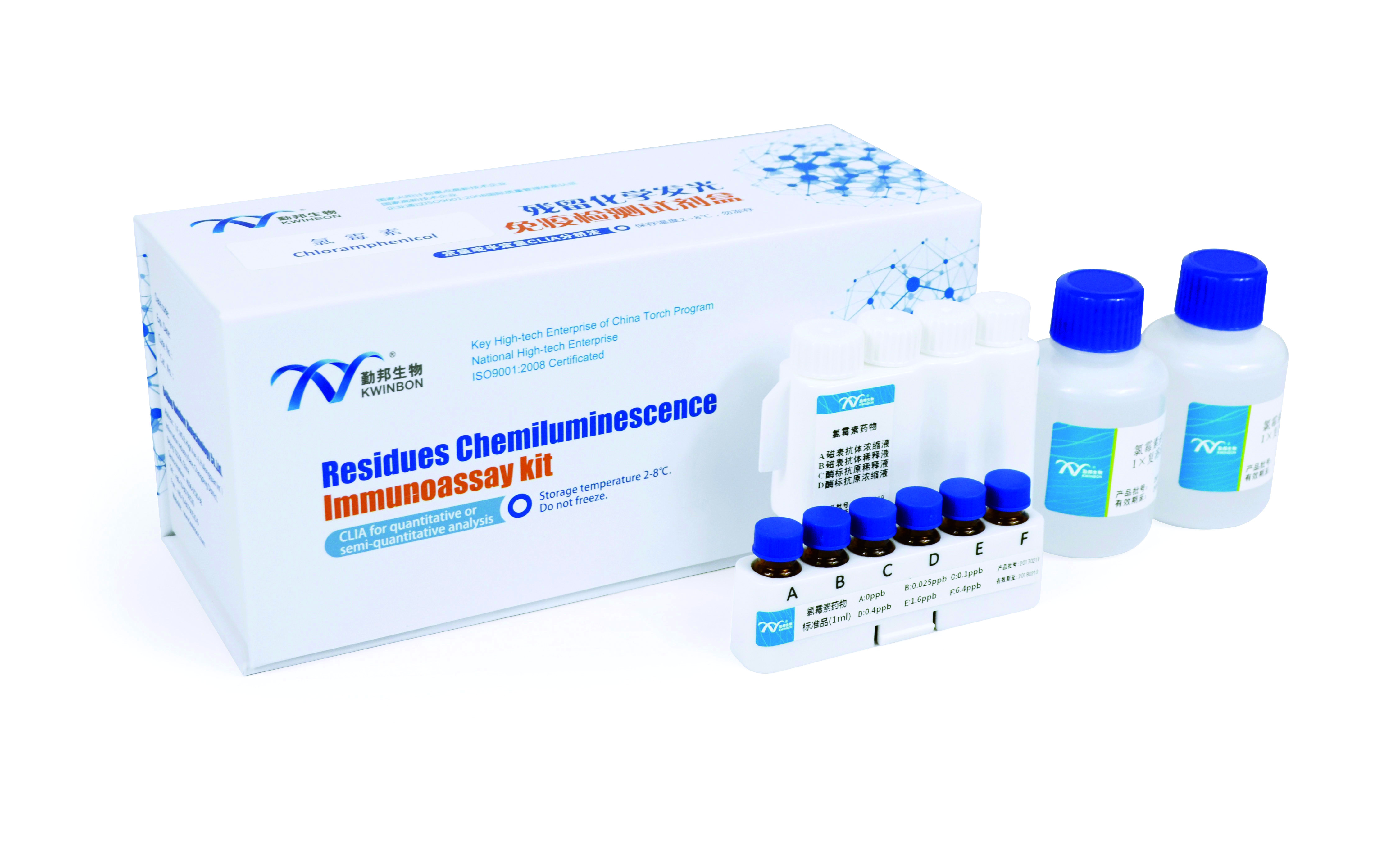
推荐厂家
暂无
暂无

[align=center]蔬菜中敌百虫、丙溴磷、灭多威、克百威、[/align][align=center]敌敌畏残留的快速检测[/align][align=center]1 范围[/align]本方法规定了蔬菜中敌百虫、丙溴磷、灭多威、克百威、敌敌畏残留的快速检测方法。本方法适用于油菜、菠菜、芹菜、韭菜等蔬菜中敌百虫、丙溴磷、灭多威、克百威、敌敌畏残留的快速测定。[align=center]酶抑制(率)法(分光光度法)[/align]2 原理在一定条件下,有机磷和氨基甲酸酯类农药对胆碱酯酶正常功能有抑制作用,其抑制率与农药的浓度呈正相关。正常情况下,酶催化神经传导代谢产物(乙酰胆碱)水解,其水解产物与显色剂反应,产生黄色物质,用分光光度计在412nm处测定吸光度随时间的变化值,计算出抑制率。3 试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水。3.1 试剂3.1.1 丙酮(CH[sub]3[/sub]COCH[sub]3[/sub])。3.1.2 磷酸氢二钾(K[sub]2[/sub]HPO[sub]4[/sub])。3.1.3 磷酸二氢钾(KH[sub]2[/sub]PO[sub]4[/sub])。3.1.4 5,5-二硫代双(2-硝基苯甲酸)(C[sub]14[/sub]H[sub]8[/sub]N[sub]2[/sub]O[sub]8[/sub]S[sub]2[/sub])。3.1.5 碳酸氢钠(NaHCO[sub]3[/sub])。3.1.6 碘化乙酰硫代胆碱( C[sub]7[/sub]H[sub]16[/sub]INOS)。3.1.7 pH8.0缓冲溶液:分别称取11.9 g无水磷酸氢二钾及3.2 g磷酸二氢钾,溶解于1000 mL水中,混匀。3.1.8 显色剂:分别取160 mg 5,5-二硫代双(2-硝基苯甲酸)(DTNB)和15.6 mg碳酸氢钠,用20 mL缓冲溶液溶解,4 ℃冰箱中保存。3.1.9 底物:取125 mg碘化乙酰硫代胆碱,加15 mL蒸馏水溶解,摇匀后置于4 ℃冰箱中保存备用。保存期不超过两周。3.1.10 乙酰胆碱酯酶:4 ℃冰箱中保存备用。3.2 参考物质3种有机磷和2种氨基甲酸酯类农药参考物质的中文名称、英文名称、CAS登录号、分子式、相对分子质量见表1,纯度均≥98%。[align=center]表1 有机磷和氨基甲酸酯类参考物质中文名称、英文名称、[/align][align=center]CAS登录号、分子式、相对分子质量[/align] [table][tr][td] [align=center]序号[/align] [/td][td] [align=center]中文名称[/align] [/td][td] [align=center]英文名称[/align] [/td][td] [align=center]CAS登录号[/align] [/td][td] [align=center]分子式[/align] [/td][td] [align=center]相对分子质量[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]克百威[/align] [/td][td] [align=center]Carbofuran[/align] [/td][td] [align=center]1563-66-2[/align] [/td][td] [align=center]C[sub]12[/sub]H[sub]15[/sub]NO[sub]3[/sub][/align] [/td][td] [align=center]221.25[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]灭多威[/align] [/td][td] [align=center]Methomyl[/align] [/td][td] [align=center]59669-26-0[/align] [/td][td] [align=center]C[sub]5[/sub]H[sub]10[/sub]N[sub]2[/sub]O[sub]2[/sub]S[/align] [/td][td] [align=center]162.23[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]丙溴磷[/align] [/td][td] [align=center]profenofos[/align] [/td][td] [align=center] 41198-08-7[/align] [/td][td] [align=center]C[sub]11[/sub]H[sub]15[/sub]BrClO[sub]3[/sub]PS[/align] [/td][td] [align=center]373.63[/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]敌敌畏[/align] [/td][td] [align=center]Dichlorvos[/align] [/td][td] [align=center]62-73-7[/align] [/td][td] [align=center] C[sub]4[/sub]H[sub]7[/sub]Cl[sub]2[/sub]O[sub]4[/sub]P [/align] [/td][td] [align=center]220.98[/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]敌百虫[/align] [/td][td] [align=center]Dipterex[/align] [/td][td] [align=center]52-68-6 [/align] [/td][td] [align=center]C[sub]4[/sub]H[sub]8[/sub]Cl[sub]3[/sub]O[sub]4[/sub]P[/align] [/td][td] [align=center]257.44[/align] [/td][/tr][/table]3.3 标准溶液的配制3.3.1 克百威、灭多威、敌敌畏、敌百虫标准储备液(1000 μg/mL):冷藏、避光、干燥条件下保存。3.3.2 丙溴磷标准储备液(100 μg/mL):冷藏、避光、干燥条件下保存。3.3.3 克百威、灭多威、敌敌畏、敌百虫标准中间液A(100 μg/mL):精密移取上述标准储备液(1000 μg/mL)(3.3.1)各1mL,分别置于10mL容量瓶中,用丙酮(3.1.1)稀释至刻度,摇匀,制成浓度为100μg/mL的标准液A。3.3.4 克百威、灭多威、敌敌畏、敌百虫、丙溴磷标准中间液B(1 μg/mL):精密移取标准中间液A(100 μg/mL)(3.3.3)及丙溴磷标准储备液(100μg/mL)(3.3.2)各1 mL,分别置于100 mL容量瓶中,用缓冲溶液(3.1.7)稀释至刻度,摇匀,制成浓度为1μg/mL的标准中间液B。4 仪器和设备4.1 恒温水浴锅。4.2 天平:感量为0.1g。4.3 分光光度计或相应商品化测定仪。4.4 环境条件:温度15℃~35 ℃,湿度≤80%。5 分析步骤5.1 试样的提取5.1.1 整株提取法选取韭菜、芹菜有代表性的样品,擦去表面泥土,称取试样3 g(精确至0.1g)置于表面皿中,加入10 mL缓冲液(3.1.7),残缺面不得接触缓冲液,轻轻振摇50 次,静置2 min以上,取上清液备用。5.1.2 整体测定法选取油菜、菠菜有代表性的样品,擦去表面泥土,剪成1 cm左右见方碎片,称取3 g(精确至0.1 g)放入离心管中,加入10 mL缓冲溶液(3.1.7),振摇50 次,静置2min以上,倒出提取液,静置3 min~5 min,待用。5.2 测定步骤5.2.1 对照液的测定先于反应管中加入3 mL缓冲溶液(3.1.7),再加入适量酶液、0.1 mL显色剂,摇匀后于37 ℃水浴锅中放置15 min。加入0.1 mL底物摇匀,立即测定吸光度,3min后再测定一次,记录反应3min的吸光度值的变化∆ A[sub]0[/sub]。5.2.2 样品液的测定先于反应管中加入3 mL提取液,其他操作与对照液操作(5.2.1)相同,记录反应3 min的吸光度值的变化∆ A[sub]t[/sub]。5.3 质控试验每次测定应同时进行空白试验和加标质控试验。5.3.1 空白试验称取空白试样,按照5.1和5.2步骤与样品同法操作。5.3.2 加标质控试验5.3.2.1 韭菜、芹菜加标实验取空白试样,擦去表面泥土,称取5份试样各3g(精确至0.1 g)置于表面皿中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液B(1μg/mL)(3.3.4),加入10mL缓冲液(3.1.7),残缺面不得接触缓冲液,轻轻振摇50 次,静置2min以上,取上清液备用。其余操作按照5.2步骤同法操作。5.3.2.2 油菜、菠菜加标实验取空白试样,擦去表面泥土,剪成1 cm左右见方碎片,称取5 份试样各3 g(精确至0.1g)放入小离心管中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液 B(1μg/mL)(3.3.4),加入10mL缓冲溶液(3.1.7),振摇50 次,静置2min以上,倒出提取液,静置3 min~5 min,待用。其余操作按照5.2步骤同法操作。6 结果的表述6.1 结果计算抑制率(%)=[(∆ A[sub]0[/sub]-∆ A[sub]t[/sub])/∆ A[sub]0[/sub]]×100式中:∆ A[sub]0[/sub][sub]───[/sub]对照溶液反应3 min吸光度的变化值;∆ A[sub]t[/sub][sub]───[/sub]样品溶液反应3 min吸光度的变化值;6.2 结果判定结果以酶被抑制的程度(抑制率)表示。当抑制率≥50%时,表示蔬菜中有机磷和氨基甲酸酯类农药残留高于检测限,判定为阳性,阳性结果的样品需要重复检验2 次以上。6.3 质控试验要求空白试验测定结果应为阴性,加标质控试验测定结果应均为阳性。7 结论当检测结果为阳性时,应采用其他分析方法进行确证,进一步确定农药品种和含量。8 性能指标8.1 检测限:敌百虫0.1mg/kg,丙溴磷0.5 mg/kg,灭多威0.2 mg/kg,克百威0.02 mg/kg,敌敌畏0.2 mg/kg。8.2 灵敏度:灵敏度应≥95%8.3 特异性:特异性应≥85%。8.4 假阴性率:假阴性率应≤5%。8.5 假阳性率:假阳性率应≤15%。注:1.性能指标计算方法见附录A。 2.吸光度变化∆ A[sub]0[/sub]值应控制在0.2~0.3之间。具体的酶量,应根据产品说明书上标识的使用量,测定∆ A[sub]0[/sub]值。根据测定值,增加或减少酶量,使∆ A[sub]0[/sub]值控制在0.2~0.3之间。[align=center]检测卡法[/align]9 原理样品中的有机磷和氨基甲酸酯类农药残留经缓冲液提取,有机磷和氨基甲酸酯类农药对胆碱酯酶(白色药片)有抑制作用,抑制胆碱酯酶催化靛酚乙酸酯(红色药片)水解为乙酸与靛酚(蓝色),从而导致速测卡颜色深浅的变化。通过空白颜色比较,对样品中有机磷和氨基甲酸酯类农药进行定性判定。10 试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水。10.1 试剂10.1.1 丙酮(CH[sub]3[/sub]COCH[sub]3[/sub])。10.1.2 磷酸氢二钾(K[sub]2[/sub]HPO[sub]4[/sub])。10.1.3 磷酸二氢钾(KH[sub]2[/sub]PO[sub]4[/sub])。10.1.4 pH8.0缓冲溶液:分别称取11.9 g无水磷酸氢二钾及3.2 g磷酸二氢钾,溶解于1000 mL水中,混匀。10.2 参考物质同3.2。10.3 标准溶液的配制同3.3。10.4 固化有胆碱酯酶和靛酚乙酸酯试剂的纸片(检测卡)。11 仪器和设备11.1 恒温水浴锅。11.2 天平:感量为0.1 g。11.3 环境条件:温度15℃~35 ℃,湿度≤80%。12 分析步骤12.1 试样的提取12.1.1 整株提取法选取韭菜、芹菜有代表性的样品,擦去表面泥土,称取试样3 g(精确至0.1g)置于表面皿中,加入10mL缓冲液(10.1.4),残缺面不得接触缓冲液,轻轻振摇50 次,静置2min以上。12.1.2 整体测定法选取油菜、菠菜有代表性的样品,擦去表面泥土,剪成1 cm左右见方碎片,称取3 g(精确至0.1 g)放入小离心管中,加入10 mL缓冲溶液(10.1.4),振摇50 次,静置2min以上。12.2 测定步骤吸取2 滴左右待测液于白色药片反应区域,在37 ℃恒温装置中放置15 min进行预反应,预反应后的药片表面必须保持湿润。将速测卡对折,手捏3 min或置于37 ℃恒温装置3min,保证红色药片反应区域与白色药片反应区域完全叠合发生反应。每次测定需有一个缓冲溶液的空白对照。12.3 质控试验每次测定应同时进行空白试验和加标质控试验。12.3.1 空白试验称取空白试样,按照 12.1 和 12.2 步骤与样品同法操作。12.3.2 加标质控试验12.3.2.1 韭菜、芹菜取空白试样,擦去表面泥土,称取5份试样各3g (精确至0.1g)置于表面皿中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液B(1μg/mL)(3.3.4),按照12.1和12.2步骤与样品同法操作。12.3.2.2 油菜、菠菜选取空白试样,擦去表面泥土,剪成1 cm左右见方碎片,称取5份试样各3 g(精确至0.1g)放入小离心管中,分别加入检出限水平的有机磷和氨基甲酸酯类标准中间液 B(1μg/mL)(3.3.4),按照12.1和12.2步骤与样品同法操作。13 结果判定白色药片区域不变色或略有浅蓝色为阳性结果;白色药片区域变为天蓝色或与空白对照卡相同,为阴性结果。通过对比空白和样品白色药片区域的颜色变化进行结果判定。目视判定示意图见图1。[img=,524,323]https://ng1.17img.cn/bbsfiles/images/2019/04/201904161528477750_5223_2166779_3.png!w524x323.jpg[/img]13.1 无效白色药片区域干燥,表明取样量偏少,检测结果无效。13.2 阴性样品白色药片区域颜色比空白对照卡颜色颜色相当或为天蓝色,表明样品中有机磷和氨基甲酸酯类农药残留低于方法检测限,判定为阴性。13.3 阳性样品白色药片区域不变色或略有浅蓝色,表明样品中有机磷和氨基甲酸酯类农残高于检测限,判定为阳性。1.1 质控试验要求空白试验测定结果应为阴性,加标质控试验测定结果应均为阳性。2 结论当检测结果为阳性时,应采用其他分析方法进行确证,进一步确定农药品种和含量。3 性能指标3.1 检测限:敌百虫0.1mg/kg,丙溴磷0.5 mg/kg,灭多威0.2 mg/kg,克百威0.02 mg/kg,敌敌畏0.2 mg/kg。3.2 灵敏度:灵敏度应≥95%3.3 特异性:特异性应≥85%。3.4 假阴性率:假阴性率应≤5%。3.5 假阳性率:假阳性率应≤15%。注:性能指标计算方法见附录A。4 其他葱、蒜、萝卜、韭菜、芹菜、香菜、茭白、蘑菇及番茄汁液中,含有对酶有影响的植物次生物质,容易产生假阳性。处理这类样品时,采取整株蔬菜浸提。对一些含叶绿素较高的蔬菜,也可采取整株蔬菜浸提的方法,减少色素的干扰。本方法所述试剂、试剂盒信息及操作步骤是为给方法使用者提供方便,在使用本方法时不做限定。方法使用者在使用替代试剂、试剂盒或操作步骤前,须对其进行考察,应满足本方法规定的各项性能指标。本方法参比标准为 NY/T 761—2008 《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》。
我在做生物胺的实验 其中需要配10mg/mL的丹磺酰氯丙酮溶液 最后发现不溶 丹磺酰氯是新买新开封的 丙酮也开了瓶新的 超声效果也不理想 这是什么原因 有人能帮帮我吗
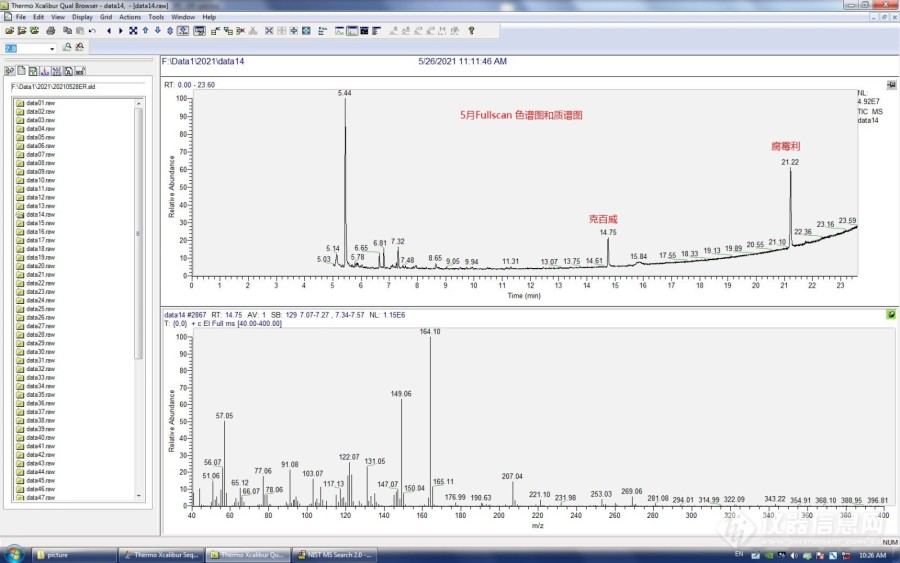
[align=left][b][font=宋体][/font][/b][/align][align=center][b][font=宋体] [size=16px]“探秘”消失的农残克百威组分到哪里去了?[/size][/font][/b][/align][size=16px]一、摘要:[font=宋体]采用[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url][/font][font='Times New Roman','serif']-[/font][font=宋体]质谱分析农药残留组分时,一般做法,先配制好各组分标液,按照规范方法进行测定,得到图谱后先进行定性分析,谱库检索,再可以提取各组分特征离子,以其保留时间定性。以此确定各组分的出峰时间,确定好各组分峰后再进行定量分析,拟合曲线,达标后就可以开始进行样品测试了。小编在一次克百威(呋喃丹)农残检测时,根据年度监测方案要求,上下半年各进行一次采样检测,其中上半年克百威标准组分做得很正常,但到下半年再次做时,却发现克百威组分在原来出峰的位置上消失不见了!所有实验条件都是一样的,而且同时测定其他农残组分都正常,就偏偏克百威组分峰不见了!百思不得其解!下面就跟随小编一起“探秘”解析消失的克百威到哪里去了呢?看看我们能不能成功把它找回来![/font][b][font=宋体]二、实验过程[/font][/b][/size][align=left][size=16px][b][font='Times New Roman','serif']1[/font][font=宋体]、[/font][/b][font=宋体]监测方案:小编的实验室负责食品安全风险检测任务,每年都会进行一些蔬菜水果类型样品的农药残留检测,分批按上下半年进行两次检测,今年监测任务如下表。三月份收到监测任务后,制定试剂耗材采购计划,申报,四月底左右实验物资采购到位,五月开始按方案实施检测工作。其中[/font][font=宋体]采购的克百威(呋喃丹)标物如下图,因为要分上下半年监测,所以同一个批号购买了两支,有效期限为[/font][font='Times New Roman','serif']2[/font][font=宋体]年。[img=,690,361]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021656347539_2906_2694188_3.png!w690x361.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021700398354_673_2694188_3.png!w690x517.jpg[/img][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021701121334_6415_2694188_3.png!w690x517.jpg[/img][/font][/size][/align][align=left][size=16px][b][font='Times New Roman','serif']2[/font][font=宋体]、[/font][/b][font=宋体]实验操作:[/font][font=宋体]按照监测手册方法要求进行操作,使用设备、仪器条件、标准物质如下表。仪器操作软件为[/font][font='Times New Roman','serif'] Xcalibur [/font][font=宋体]谱库检索库为[/font][font='Times New Roman','serif'] NIST MS search2.0[img=,690,545]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021702088719_7524_2694188_3.png!w690x545.jpg[/img][b][font=宋体]三、五月份的实验结果[/font][/b][/font][/size][/align][align=left][size=16px][b][font='Times New Roman','serif']1[/font][font=宋体]、[/font][/b][font=宋体]五月中旬上半年采样一半量送检,具体实验结果分析如下:[/font][font=宋体]([/font][font=&]1[/font][font=宋体])稀释配制好标准系列溶液,按方法进行仪器设置,调谐,达到最佳状态后开始实验。进样测定,先进中间[/font][font=&]0.5ug/ml[/font][font=宋体]标液,进行[/font][font=&]Fullscan[/font][font=宋体]([/font][font=&]40-400[/font][font=宋体])检测,得到如下色谱图和质谱图。克百威组分在[/font][font=&]14.75min[/font][font=宋体]处出峰,[/font][font=&]21.22min[/font][font=宋体]为腐霉利。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021703586897_8935_2694188_3.jpg!w690x431.jpg[/img][/font][/size][/align][align=left][size=16px][font=宋体]([/font][font='Times New Roman','serif']2[/font][font=宋体])对[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]峰进行定性谱库检索,结果如下图。右上框为实测标液的质谱图,右下框为谱库匹配度最高物质的谱图。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021705163915_213_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']3[/font][font=宋体])提取克百威三个特征离子[/font][font='Times New Roman','serif']164[/font][font=宋体],[/font][font='Times New Roman','serif']149[/font][font=宋体],[/font][font='Times New Roman','serif']221[/font][font=宋体],得到色谱图如下。可以明显看到三个特征离子的保留时间均一致。综合这些信息判断[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]峰为克百威组分峰。同法得出[/font][font='Times New Roman','serif']21.22min[/font][font=宋体]为腐霉利组分峰。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021706572612_3011_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']4[/font][font=宋体])再进行[/font][font='Times New Roman','serif']SIM[/font][font=宋体]([/font][font='Times New Roman','serif']164[/font][font=宋体],[/font][font='Times New Roman','serif']149[/font][font=宋体],[/font][font='Times New Roman','serif']221[/font][font=宋体])检测,得到色谱图和质谱图如下。出峰时间与全扫描完全一致。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021707598290_6320_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']5[/font][font=宋体])最后对标准系列图谱进行数据处理,拟合标准曲线,结果如下图。[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021709171133_6340_2694188_3.jpg!w690x431.jpg[/img][/font][/size][/align][align=left][size=16px][b][font='Times New Roman','serif']2[/font][font=宋体]、[/font][/b][font=宋体]综合分析,五月份做的农残组分分析过程都比较顺利,按照方法进行各个组分识别,图谱解析,都符合预期。让我们觉得挺有成就感的,然而到了下半年再次进行测定时,却出现了一些意想不到的情况,几番波折。[b][font=宋体]四、九月份的实验结果[/font][/b][/font][font='Times New Roman','serif']1[/font][font=宋体]、[/font][font=宋体]九月中旬下半年采样另一半量送检,具体实验结果分析如下:[/font][font=宋体]([/font][font='Times New Roman','serif']1[/font][font=宋体])九月再测,按照完全相同的方法,仪器设置状态也是完全一样,实验结果,标准溶液图谱如下。同一批的另一支克百威标液配制标准系列,相同的浓度,相同的仪器方法。最后做出来的结果却不一样了!出现异常情况!在全扫描中克百威组分在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处消失不见了!其他组分如腐霉利却正常还是[/font][font='Times New Roman','serif']21.22min[/font][font=宋体]!真是太奇怪了![img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021712282188_7927_2694188_3.jpg!w690x431.jpg[/img][/font][/size][/align][align=left][size=16px][font=宋体]([/font][font='Times New Roman','serif']2[/font][font=宋体])再进行[/font][font='Times New Roman','serif']SIM[/font][font=宋体]([/font][font='Times New Roman','serif']164[/font][font=宋体],[/font][font='Times New Roman','serif']149[/font][font=宋体],[/font][font='Times New Roman','serif']221[/font][font=宋体])检测,也没有在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处找到克百威组分!图谱如下。真是大惑不解啊!克百威怎么就不翼而飞了?到底怎么回事?反思实验过程都和五月做的完全一样啊?为什么得到不同的结果?挠头![img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021713243112_5137_2694188_3.jpg!w690x431.jpg[/img][font=宋体]([/font][font='Times New Roman','serif']3[/font][font=宋体])对无端消失的克百威组分进行查因,先是检查仪器状态都是正常;再是检查标液都是在有效期限内使用,配制过程也没发现异常;最后又更换寸管、隔垫,再次测定,结果还是异常!就是找不到克百威组分!虐心啦[/font][font='Times New Roman','serif']……[/font][font=宋体]改进一个大浓度的标液,结果稍微好一点,[/font][font='Times New Roman','serif']14.75[/font][font=宋体]处有一个很小的峰![/font][font='Times New Roman','serif']……[/font][font=宋体]这似乎看到了一些希望?![/font][font='Times New Roman','serif']……[/font][font=宋体]再次对图谱进行分析,发现端倪了!!结果在[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]处发现有一个比较大的异常的未知峰,对其进行谱库检索,结果如下图。[/font][img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021714351977_5610_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']4[/font][font=宋体])检索结果显示[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]匹配度最高的化合物是呋喃酚![/font][font='Times New Roman','serif']……[/font][font=宋体]呋喃酚([/font][font='Times New Roman','serif']CAS[/font][font=宋体]号[/font][font='Times New Roman','serif']1563-38-8[/font][font=宋体])?呋喃丹([/font][font='Times New Roman','serif']CAS[/font][font=宋体]号[/font][font='Times New Roman','serif']1563-66-2[/font][font=宋体])?两者看着很相似!到底怎么关系?通过[/font][font='Times New Roman','serif']CAS[/font][font=宋体]化合物号码查询,两者谱库里的标准质谱图如下。查资料结果如下:[img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021715584878_1169_2694188_3.jpg!w690x431.jpg[/img][img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021716053486_9007_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体]([/font][font='Times New Roman','serif']5[/font][font=宋体])网上查询资料,显示呋喃酚是合成呋喃丹的中间体!!一定条件下,呋喃丹的首步降解途径为氨基甲酸酯键发生水解断裂生成呋喃酚!!!综合上述实验资料,至此,终于恍然大悟,原来是标准溶液克百威发生了降解,变成新的组分呋喃酚!新的化合物!分子结构不一样了,所以在相同的色谱质谱条件下,当然不会在原来位置上出峰了!!所以标准峰“漂移”到[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]处出现!!原本应该出峰的位置[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处就没有了!!至于后面高浓度标液该处又有峰,说明呋喃丹大部分降解变成呋喃酚!但扔有少许未降解,浓度较低[/font][font='Times New Roman','serif'],[/font][font=宋体]所以加大浓度测定后才在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处出现小峰!标液此时是大部分呋喃酚和少许呋喃丹的混合状态!——如此理解,之前的所有异常现象就都可以解释得通了!!!为印证此想法,我们又对五月份做的全扫描质谱图进行解析,发现五月做的图谱,虽然克百威在[/font][font='Times New Roman','serif']14.75min[/font][font=宋体]处正常出峰,但在[/font][font='Times New Roman','serif']7.32min[/font][font=宋体]处也存在呋喃酚组分峰出现!只是峰很小!当时做完没注意到而已!!提取特征离子图,如下图(呋喃丹[/font][font='Times New Roman','serif']164[/font][font=宋体]、[/font][font='Times New Roman','serif']149[/font][font=宋体]、[/font][font='Times New Roman','serif']221[/font][font=宋体]保留时间均一致,而呋喃酚[/font][font='Times New Roman','serif']164[/font][font=宋体]、[/font][font='Times New Roman','serif']149[/font][font=宋体]时间一致,[/font][font='Times New Roman','serif']221[/font][font=宋体]不一致时间有偏差,因为呋喃酚没有该特征离子)。说明克百威标液从四月购买到五月第一次测定,再到九月第二次测定,一直有在降解,只是五月降解少,没有出现异常,一直到九月降解很多了,再做就出现这种异常情况!!如此解释,感觉所有的实验异常情况都豁然而通了!所有的疑惑都解除了![img=,690,431]https://ng1.17img.cn/bbsfiles/images/2022/11/202211021717345001_3752_2694188_3.jpg!w690x431.jpg[/img][/font][font=宋体][b][font=宋体]五、追根究底[/font][/b][font=宋体] 最后总结分析,五月九月前后两次做的克百威(呋喃丹)组分实验出现反差的原因,最大可能就是标液保存不当造成的待测组分降解导致结果异常!经查克百威(呋喃丹)标液一直保存在冰箱冷藏柜[/font][font='Times New Roman','serif']4[/font][font=宋体]度左右!查看标液证书说明,建议保存条件为[/font][font='Times New Roman','serif']-18[/font][font=宋体]度!如此才最低减少呋喃丹的降解!最后我们还就此问题咨询了上级监测部门,说起此“灵异”事件,不巧他们以前也曾经发生过类似问题![/font][font='Times New Roman','serif']……[/font][font=宋体]一语言之,要多交流学习,才能少走弯路啊![/font][b][font=宋体]六、[/font][font=宋体]后记[/font][/b][font='Times New Roman','serif'] [/font][font=宋体]话说,既然克百威(呋喃丹)较易降解,那我们日常监测的水果蔬菜样品中的农残呋喃丹组分,会不会也降解了?那我们只检测呋喃丹组分会不会造成偏差导致结果误判呢?或者还是需要增加做一下降解物呋喃酚?[/font][/font][font=宋体][/font][/size][/align][size=16px][font=宋体][/font][font=宋体][b][font=宋体][/font][/b][/font][/size][font=宋体][/font]






 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-860-5168转0952
400-860-5168转0952
 留言咨询
留言咨询