器官芯片革新产品Omi,小到可放培养箱,薄到可放显微镜
点击此处或上方图片,可观看Omi视频从没见过这么“多才多艺”的器官芯片平台。点击此处或图片进入产品详情页一个培养箱可放6个OMIOMI,可用于多种器官芯片模型(肝脏、肠道、皮肤等),其卡槽设计,兼容几乎所有类型的器官芯片,灌注和循环等培养操作均可以自动完成,个头只有手掌大,可同时将6个OMI串联(或并联)放入培养箱(40cm * 40cm),每个OMI带有4个4ml的储液池,自带电池续航达到了2小时,支持网页和平板远程无线控制,其数据可以存放至云端,让您告别数据丢失。(通用型微流控芯片卡槽)(培养箱里的Omi)OMI可以单独使用,也支持多个OMI串并联使用,例如使用两个OMI对一块器官芯片进行灌注,可以用于模拟液/液界面或血脑屏障再生。(两个Omi联合培养使用)OMI支持流程自动化,所有操作均可设定程序自动完成,可以完成诸如灌注、循环、采样等多种流体控制实验。(试剂循环控制的程序界面)OMI应用领域将多个OMI串并联使用,可以完成一些复杂器官的建模,同时也是药物发现(如ADME-Tox)的理想平台,联系我们,我们免费提供相关white paper和应用文档。应用方向:血管再生、癌症药物发现、液体/液体界面、血脑屏障BBB、肠道芯片、肺芯片、心脏芯片。OMI规格参数手掌大小的OMI,重量不到800g,40cm * 40cm的培养箱便可以放下6个OMI,可轻松从培养箱转移至显微镜下做细胞成像或细胞分析,其两个小时的续航支持完成大多数器官培养。更多参数需见datasheet,欢迎联系我们!
新品
2023.04.06
第二届微流控论文大赛已完成全部奖杯、证书及红酒发放工作
第二届微流控论文大赛完美落幕,我们已将奖杯、证书和法国红酒全部发放完毕,接下来我们将对五名获奖者的论文作品在公众号与大家进行分享。精致水晶奖杯水晶奖杯正面精致获奖证书获奖证书正面所有物品将以顺丰快递安全送达!再次恭喜以下五名获奖者!并再次感谢所有的参赛者!愿微流控行业蓬勃发展!关注我们!
企业动态
2023.02.15
希伯来大学-3D水凝胶单细胞培养研究
希伯来大学-3D水凝胶单细胞培养研究这是微纳立方第32篇微流控推文。Bavli等人基于液滴微流控技术,研发了一种名为“CloneSeq”的高灵敏单细胞分析平台,可用于3D细胞培养的全面表征,揭示了新的癌症特异性亚群的存在,并于2021年在Dev. Cell期刊发表论文(影响引子12.861,论文链接见文末)。(科学家和他们的微流控实验平台:为了实现稳定又精确的微流体控制,获取误差最小的数据,他们采购了几十个法国Fluigent的压力泵、流量计和旋转阀等部件,搭建了一套通用型微流控综合实验平台)Bavli等人的实验大致可分为两步:第1步,在3D水凝胶中完成单细胞的封装,并进行克隆扩增,流速范围为8至34μL/min,每秒生成700个水凝胶微球。(水凝胶单细胞封装方案示意图)(单细胞封装与克隆示意图)第2步,进行克隆分析,作者设计了另一种微流体方案来捕获微滴中的克隆,并使用InDrops protocol对其进行条码化。(InDrops protocol的微流体方案)(捕捉到的图像:Single Clone和Barcode Bead被封装于同一微滴)实验完成后,作者使用Fluigent十转一阀门M-Switch清洗方案,自动完成实验仪器和管路的清洗。论文:Bavli, D. et al. CloneSeq: A highly sensitive analysis platform for the characterization of 3D-cultured single-cell-derived clones. Dev. Cell (2021).DOI: 10.1016/j.devcel.2021.04.026关注我们!
应用实例
2022.12.07
一种多功能复合乳液制备平台(双乳滴)
一种多功能复合乳液制备平台这是微纳立方第31篇微流控推文。多重乳液在医药、化妆品等领域具有显著优势,如在医药领域,可同时运载水溶性、脂溶性药物和在油水中均有一定溶解度的药物,这就可以有效控制药物扩散速率,以达到更好的治疗效果。本文介绍的微流控复合乳液平台,具备微流控技术优势(稳定、重复性高、低PDI)的同时,还可以有效制备常见的双乳液(W/O/W和O/W/O),更能胜任多重乳液包裹(三核、四核及更多,可调节)。(使用此复合乳液平台制备的多重乳液)此平台采用两步乳化法制备乳液,有意思的是,所使用的微滴发生结构是一种3D打印的玻璃喷嘴(微滴发生器字叫RayDrop),微滴生成不仅稳定,还可以重复、长期使用。实验时,将两个Raydrop串联在一块,先在Raydrop 1中生成微滴,再在Raydrop 2中将其包裹为多重乳液。(Raydrop微滴发生器及其内部结构)(串联的两个Raydrop微滴发生器)那怎么才能包裹多重乳液呢?其实原理就是改变Raydrop 1中的分散相的流量(流量稳定至关重要!)。在本文实验里,流量为0.5μL/min时,将近6成的乳液包裹了1个微滴,4成包裹了2个微滴。而当分散相流量为2.3μL/min时,包裹3个和4个微滴的乳液量,差不多各占了4成,详细数据见下图。(分散相流量变化与包裹微滴数的频率分布)值得一提的是,此平台集成度很高,不仅包含稳定驱动的压力泵Flow EZ、微阀和管道等流体学部件,还集成了xyz的位移平台、LED光源和摄像头,可以动态观察多重乳液形成的过程。(此复合乳液平台由比利时Secoya和法国Fluigent联合推出)欢迎联系我们!注:本文首发于微纳立方科技(北京)有限公司(Microblox_Lab)官方公众号,未经许可,谢绝转载。
应用实例
2022.11.24
微流控软骨芯片:体外重现关节病变过程
软骨芯片:体外重现关节病变过程这是微纳立方第30篇微流控推文。今年3月,Lab on a chip上发表了一篇关节软骨芯片的文章(链接在文末),可以模拟软骨细胞所受到的多向机械刺激,拿膝关节为例,就是说可以模拟运动员、超重人员等各种人群的膝关节负荷情况,并且可以观察软骨细胞在这种负荷下是如何一步步发生炎症的,进而采取更精准的诊断及治疗措施,造福社会。下面简单介绍下帕吉(Paggi)等人的成果。(软骨芯片,单面约硬币这么大)帕吉他们的想法很有意思,在软骨芯片上做了3个并排的弹性PDMS腔体,腔体紧挨着下方的软骨细胞,它们的每次形变都是对软骨细胞的刺激,利用3个腔体的组合刺激来模拟软骨在日常及运动中所受的多向机械刺激,芯片结构见下图。膝关节运动案例如下,蓝色箭头表示软骨细胞受到PDMS膜的压缩刺激,绿色箭头为软骨细胞受到的剪切力方向。经过一段时间的培养与刺激,软骨细胞出现了促炎反应(释放细胞因子),并且这种反应在不同的刺激强度下,反应强度也出现了差距。在培养第15天(刺激14天)后,糖胺聚糖(细胞外基质主要成分)产物显著增加。(无刺激、压缩刺激和多向机械刺激对软骨细胞表型的影响,细胞外基质浓度不同)本研究里,PDMS腔体的厚度为50μm,其形变量即反应了对软骨细胞的刺激强度,为了精准控制刺激大小及变化,需要一款精密压力控制仪器,帕吉他们选择了法国Fluigent的压力泵MFCS,4个独立压力输出通道,性能出色,响应快且稳定性佳,是微流控研究人员手里的好工具。(法国Fluigent 4通道压力泵MFCS)现在更多科学家会选择单手操作的Flow EZ压力泵,可以一边使用一边做显微镜观察。(法国Fluigent 单手操作压力泵Flow EZ)不要忘记关注我们论文请点击阅读原文查看:Lab on Chip, 2022, 22 (DOI: 10.1039/d1lc01069g)
应用实例
2022.11.23
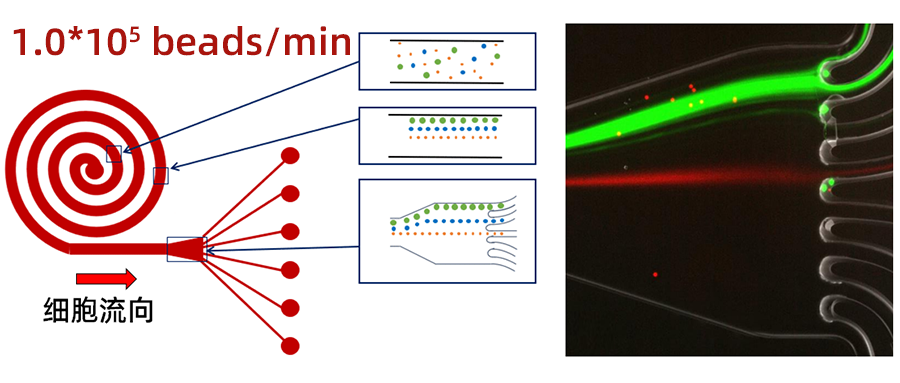
一种高性价比细胞分选微流控平台
一种高性价比细胞分选微流控平台这是微纳立方第29篇微流控推文细胞分选是许多诊断和治疗里的关键步骤,例如,从血液里分离出循环肿瘤细胞(CTC)。流式荧光分选(FACS)作为细胞分选行业金标准,高通量且自动化,但依旧存在笨重、挤压细胞的缺陷,哪怕其价格十分昂贵。随着细胞分选的需求日益增长,市面需要更多更具有效益的分选方案,本文介绍了一种无标记无额外设备(如电场、磁场)的微流控平台,采用一种螺旋式微流控芯片,利用细胞自身物理属性(如形状、密度)来完成高通量(1.5*105 beads/min)被动式细胞分选,为细胞分选提供了一种新思路。(螺旋式微流控芯片,红色端为进样口,蓝色端为出样口)效果展示采用直径7.5μm和15μm的聚苯乙烯微粒来模拟细胞,浓度调制1.0*105 beads/ml,分别用FITC(绿色)和TRITC(橙红色)对微粒染色,设定流速为1.5ml/min(即1.5*105 beads/min),将所拍摄到的图像进行合成,以显示两种微粒的运动轨迹,见下图。(左为细胞分选效果示意图,右为实际效果的合成图像)如上右图,分选效果很明显,绿色线为FITC染色的7.5μm微粒的运动轨迹,从第1、2通道流出,橙红色线TRITC为染色的15μm微粒的运动轨迹,在第4通道流出。(细胞分选实验平台,使用倒置显微镜拍摄图像)此微流控平台配置简单、体积小巧更易用,通量高且易于调节,是一种比较有性价比的细胞分选解决方案。具体实验配置:1个法国Fluigent压力泵,1个流量计,1块chipshop分选芯片(含4个分选单元)。往期回顾:细胞培养实测 压力泵VS蠕动泵用压力泵实时检测细胞增殖(培养)给我们点个关注吧,后续会分享更多微流控行业文章!
应用实例
2022.11.23
用压力泵实时检测细胞增殖(培养)
用压力泵实时检测细胞增殖(培养)这是微纳立方第28篇微流控推文咱做细胞增殖检测,有计数法、染色法……但很多方法都只能检测一个时间点,就是说只能看到细胞增殖的结果,而不清楚过程,并且往往需要额外的仪器和试剂。这次和你分享一个不一样的视角,用压力泵去实时检测细胞增殖,这个实验由康比涅技术大学 (UTC)的一个生物工程实验室完成。实验比较简单:用1个压力泵往1块细胞培养芯片里泵入培养基(5组采用同款芯片,且均含流量计)。老规矩,咱先来看一组实验数据,下图里的纵坐标是压力泵的输出压力,横坐标是芯片里的细胞数。图里值得说的是3个颜色区域的点:绿色点位,设置恒定流量10μL/min,这时微流控芯片里还没有细胞。蓝色点位,芯片里有细胞贴壁了,恒流模式使得所需压力增大。红色点位,养了3天的细胞,细胞增殖数目变多,恒流所需压力更大。图中蓝色虚线是拟合出的压力和细胞数的线性函数——到这你可能看不下去了,就这么点数据还拟合函数?有没有点数学常识?但事实上,这个函数的样子,正好符合了数学公式:微流控芯片里流道的流量=压力/流阻(Q=△P/R),Q表示流量,△P表示压力,R表示流阻。如果细胞正常增殖,细胞数增多了,会造成芯片内流道变窄,肯定会导致流阻变大(流阻R与h^3*w成反比,h和w分别为芯片流道道的高和宽,点这看流阻是怎么计算的),为了满足咱设定的10μL/min的流量,压力泵的输出压力一定会增大。就是说,恒流模式下,细胞正常增殖,流阻变大,压力泵输出压力就应该变大,如果压力不变或者缩小(细胞被冲走),反而是问题。所以重要的不是拟合出什么样的函数,而是这个函数要符合压力和细胞数的正相关关系,就是说这个函数上某个点的斜率,一定得是正的,不然细胞增殖就有问题。也许在你的实验里,它就变成了个指数函数(有点夸张了,如果压力像指数函数那样增加,一定是发生堵塞了)。你可能觉得检测要精准,不能这样看大概,但做一次细胞增殖(培养)动不动就好几天,等做完才发现问题,浪费时间还耽误进度,而这个办法,只需要你看一眼压力泵的输出压力。就像是如果你发烧了,一定要去医院让医生来告诉你吗?自己摸摸额头也能知道。P.s. 以上说的细胞增殖为理想情况,如果染菌,菌类生长也会让压力变大。最后附上这个实验的配置:法国Fluigent的压力泵Flow EZ和流量计,加细胞培养芯片、细胞系和培养基,以及连接配件相关链接:如何计算微流控系统里的流阻?不要忘记关注我们的公众号!微纳立方All for Microfluidics
应用实例
2022.11.18
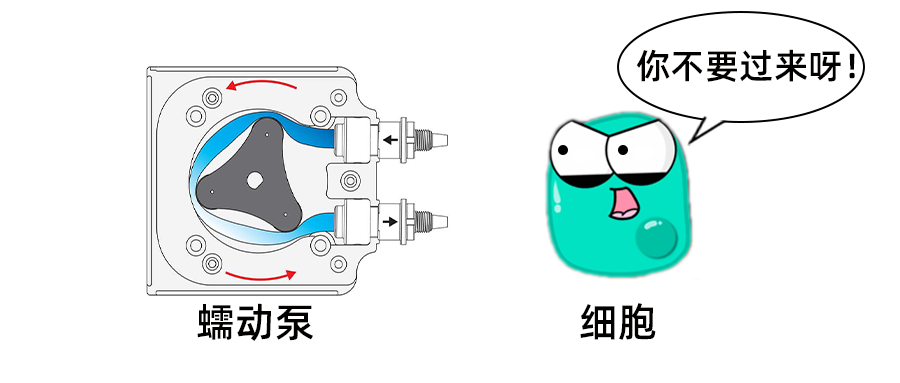
细胞动态培养实测 | 压力泵VS蠕动泵
细胞动态培养实测 | 压力泵VS蠕动泵这是微纳立方第27篇微流控推文用微流控芯片做动态细胞培养,是体外培养开拓性的一招,那以前用的蠕动泵,还能不能接着用呢?咱直接来看一组实验,血管模型的内皮细胞灌注。实验是这样的,在两块同款芯片里做好细胞贴壁,细胞密度在80%左右,然后分别用蠕动泵和压力泵来做24小时的循环灌流,流量设为50μL/min,下面是观察到的细胞影像。先看蠕动泵这边,24小时后,芯片内细胞密度显著降低了,还有的细胞呈圆形(实验前是条状的,像小蝌蚪),这表明细胞在芯片内出现了不同程度的脱离,粘附性降低,存活率降低。而压力泵那组变化就小很多,细胞形态依旧是小蝌蚪状。为什么?两组实验最大区别在动力源上,在实验里反应为流量变化,所以我们再来看流量变化,见下图。蠕动泵这组的流量波动已经到了视觉上不能接受的程度,其流量波动已经超过50μL/min的30%,甚至40%+,这什么概念呢?相当于我们人体的血液流动,1分钟内就有数十次上下波动超过30%的血流变化,这可不得了,血压一言不合就往160mmHg奔去了~~~人受不了,细胞也受不了。而压力泵这组的流量变化低于2%。所以我们可以确认,流量波动是细胞培养成功与否的一个强相关因素。蠕动泵用来做动态细胞培养,缺陷实在太明显,而压力泵可以提供高出好几倍的细胞动态培养稳定环境。(P.s. 我们用了同款流量计从头到尾记录了两组实验的流量变化)下面是小小的广告和细胞动态培养视频链接。这是我们做细胞培养的简易配置,法国Fluigent品牌,06年就开始研发压力泵并推向市场。其实压力泵做循环也没什么神奇的地方,加一个阀就搞定了,芯片里的介质流向从头到尾都不会变(点我了解怎么做循环)。这是压力泵和蠕动泵的重点参数对比。点我看“怎么做细胞动态培养”的视频还有不要忘记关注我们的公众号!微纳立方All for Microfluidics
应用实例
2022.11.18
用于糖尿病药物发现的悬滴器官芯片,在一滴悬着的水里养个小器官
用于糖尿病药物发现的悬滴器官芯片,在一滴悬着的水里养个小器官我们知道,器官芯片(Organ-on-Chips, OOC)一般是多层或者多个腔室的结构,例如皮肤芯片、肺芯片。但这次要和你分享的是一种悬滴式的器官芯片,也就是把微组织放在一滴悬着的培养液里培养,这滴培养液可以晃来晃去,但又不会掉下来,也就是你看到的封面图那样,看起来就像是在一滴悬着的水里养了个小器官。左图是胰岛微组织,右图是在悬滴器官芯片里培养微组织的示意图。这可不是什么不靠谱的设计,这项研究由苏黎世联邦理工学院的帕特里克博士(Dr. Patrick Misun)和瑞士InSphero公司布尔卡克博士(Dr. Burcak Yesildag)一同完成,文献链接放在了文末。左为帕特里克博士(Dr. Patrick Misun),右为布尔卡克博士(Dr. Burcak Yesildag)。这个芯片设计简单但很独特,你看下图,它就一个入口一个出口,再加一个半球形的培养区,芯片底部那滴培养液直接正对着显微镜——这根本就不是在一个密闭腔室里面做实验,是一个十分大胆但又很有创意的设计,它看起来好像不稳定,但这种设计又打破现有芯片设计壁垒,谁说芯片一定要设计成密封好的样子?悬滴器官芯片图示,研究人员使用此芯片能让微组织持续保持在悬滴中。帕特里克说,在这种悬滴里做微组织的药物测试,已经被证实是绝对可靠的,并且是可重复的。在他们的实验里,胰腺微组织会“跑”到那滴培养液和空气的交界处,这时往芯片里灌注少量液体,为微组织提供营养的同时,也将其暴露于药物环境中,然后用处于胰腺微组织正下方的显微镜记录数据。咱再来看看实验数据。当胰腺微组织刚开始暴露在高浓度葡萄糖环境中时,胰岛素的分泌会出现一次爆发性增长,然后在之后的几分钟,分泌的胰岛素会稍降低一些,处于一个持续震荡的状态。这和咱们正常人的调节机制是一致的,而糖尿病患者的这些反应机制是受损的。胰岛微组织在不同血糖浓度下的胰岛素分泌情况,先出现一次爆发增长,随后处于震荡状态。现在利用这个悬滴器官芯片平台,可以在高时间分辨率下观察到这些反应细节,这非常有利于研究糖尿病背后的潜在生物学机制。这分辨率有多高呢?帕特里克说,到目前,他们的平台提供了前所未有的高时间分辨率(2020年)。帕特里克:悬滴已被证明为微组织药物测试提供了绝对可靠和可重复的环境。我们将单个微组织放置在单个液滴中,它们在液滴底部的水-空气界面处沉淀(见图 2)。我们直接通过这些悬滴灌注少量液体,为组织提供营养并将其暴露于药物中。与封闭室中的流动相比,悬滴内的流动液体具有独特的流动模式。我们利用这种特定的流动模式来获得高时间分辨率的分泌曲线。你可能有疑问,他们用的微组织从哪来的?是否能反应人体真实情况呢?事实上,他们使用了真正的胰腺微组织。InSphero公司的布尔卡克博士(Dr. Burcak Yesildag),专门负责从供体器官中制备胰腺微组织,分离胰岛(是分泌激素的微器官,比如胰岛素),并把它们拆分为不同大小和成分的胰岛,再重新组装成标准化3D微组织,这样就保留了胰岛微组织对各种刺激的自然反应,从而保证获得真正有生理意义和可重复的数据。帕特里克说,这些微组织样本越规则,实验结果可重复性就越高。这个研究公开后,很快就有人就关心“能否商用”的话题。布尔卡克回答,这个平台很容易和InSphero其他项目达成合作。帕特里克也表示,现在做的虽只是一个平台原型,但已经实现对单个胰岛的高灵敏测量。不管是学术交流还是工业合作,他们都十分愿意一同优化现有平台,希望这项技术进展能帮助糖尿病研究人员找到新药,并更深入地了解胰岛生物学。下一步研究,帕特里克他们暂定了两个目标:一个是提高实验吞吐量,这也是复合测试(Compound testing)的关键要求之一;另一个是降低实验复杂度,让更多人实验人员也能完成此项实验。测试平台,该平台将帮助糖尿病研究人员找到新药并更深入地了解潜在的生物学机制。带有悬滴的器官芯片平台图示模型图——该芯片使研究人员能够将样本组织保持在悬滴中。您在芯片上使用人体细胞?帕特里克:没错。我们建立了在尽可能类似于活体器官的条件下在体外测试药物的平台。我们的目标是获得生理上有意义和可重复的数据。在这种特殊情况下,我们研究了胰腺微组织随时间的胰岛素分泌。对人体胰岛组织和悬滴内的组织进行采样图 2(左)人类胰岛组织样本。(右)悬滴内的组织。营养物质和药物顺利通过悬滴。样本组织来自哪里?Patrick: 这是我在 InSphero 的同事 Burcak 的问题。对于这个项目,我们进行了出色的合作,其中苏黎世联邦理工学院负责芯片上器官测试的工程部分,InSphero 负责制备微组织。Burcak:确实,我们的互补技能会派上用场。在 InSphero,我们从供体器官制备胰腺微组织。我们获得了分离的人类供体胰岛,它们是胰腺中分泌激素(如胰岛素)的微器官,可调节我们体内的血糖水平。我们拆解不同大小和成分的胰岛,并将它们重新组装成标准化的 3D 微组织。样本组织越规则,这些组织的实验结果就越具有可重复性。这些制造的微组织仍然是天然的吗?布尔卡克:我们的胰腺微组织密切模仿原始人类胰岛的结构,并保持其对各种刺激的自然反应。当暴露于高浓度的葡萄糖时,它们会显示出胰岛素分泌的第一次瞬时爆发。几分钟后,随之而来的是强度稍低但持续良好的胰岛素振荡释放(见图 3)。在糖尿病的情况下,这些反应受损,并且有多种策略旨在恢复健康的胰岛素分泌。研究人员希望以高时间分辨率观察这些细节,以便他们能够更好地了解糖尿病的潜在机制并开发用于治疗的化合物。据我们所知,功能强大的胰岛微组织与 Patrick 的悬滴平台相结合,提供了前所未有的时间分辨率。图表显示随时间推移的胰岛素分泌和相应的葡萄糖水平图 3 微组织在暴露于升高的血糖水平时分泌胰岛素。胰岛素分泌遵循一个非常典型的模式:第一次爆发,然后是脉动的第二阶段。最后一个问题:器官芯片平台是否可以商用?Burcak:微组织很容易用于与 InSphero 的合作项目。帕特里克:目前我们有工作平台原型,我们愿意与学术和工业合作伙伴合作以优化我们的平台。我们的原型使我们能够对单个胰岛进行非常灵敏的测量。我们希望这项技术进步将帮助糖尿病研究人员找到新药并更深入地了解胰岛生物学。在下一步中,我们希望提高实验吞吐量,因为这是复合测试的关键要求之一。此外,我们正在进一步降低操作复杂性,目标是使该系统可供不同实验室的研究人员使用。文献链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adbi.201900291
应用实例
2022.11.14