







中山大学药学院教授,博士生导师。主要从事生物质谱新技术的开发及应用。


大家好,本周为大家介绍一篇发表在Proc. Nat. Acad. Sci. U.S.A上的文章,HDX-MS performed on BtuB in E. coli outer membranes delineates the luminal domain’s allostery and unfolding upon B12 and TonB binding1,文章作者是华盛顿大学的Tobin R. Sosnick。
TonB-依赖的转运体(TBDTs)广泛存在与革兰氏阴性菌的外膜上,通过其摄取营养。但TBDTs转运时的机制尚不明确,尤其是可供底物通过的跨膜β-桶孔径打开时的结构变化机理。BtuB是一种典型的大肠杆菌TBDT,其功能和生物物理环境都得到了广泛的研究。目前推测BtuB在行使转运功能时,其通道孔径形成需要BtuB与底物维生素B12结合,其N-端7个残基(称为“Ton box”)产生较大的构象转变,从β-桶中甩出进入胞质并与下游蛋白TonB发生相互作用。但孔径形成的过程具体机理存在两个具有争议的猜想:力依赖模型认为,TonB通过将BtuB从β-桶拽出到胞质,并从膜内侧将能量传递给BtuB,这些力可能重塑塞区并导致孔径形成;而非力依赖模型则认为孔径的形成跟BtuB自身保守的Ionic Lock(IL,即R14和D316间的盐桥)相互作用有关,当B12存在时只需要IL解锁TonB就能与BtuB结合产生成孔运动。晶体学研究捕捉到了Apo BtuB、BtuB:B12和BtuB:B12:TonBCTD的结构(图1),但晶体学研究一来存在晶体堆积导致其结构与溶液态蛋白结构产生一定差异的问题,二来静态的结构“截图”无法提供动态变化过程信息。因此,本文选择氢氘交换质谱法(HDX-MS)解析BtuB和配体结合时产生结构动态变化过程,以深入推测该过程的具体机制。
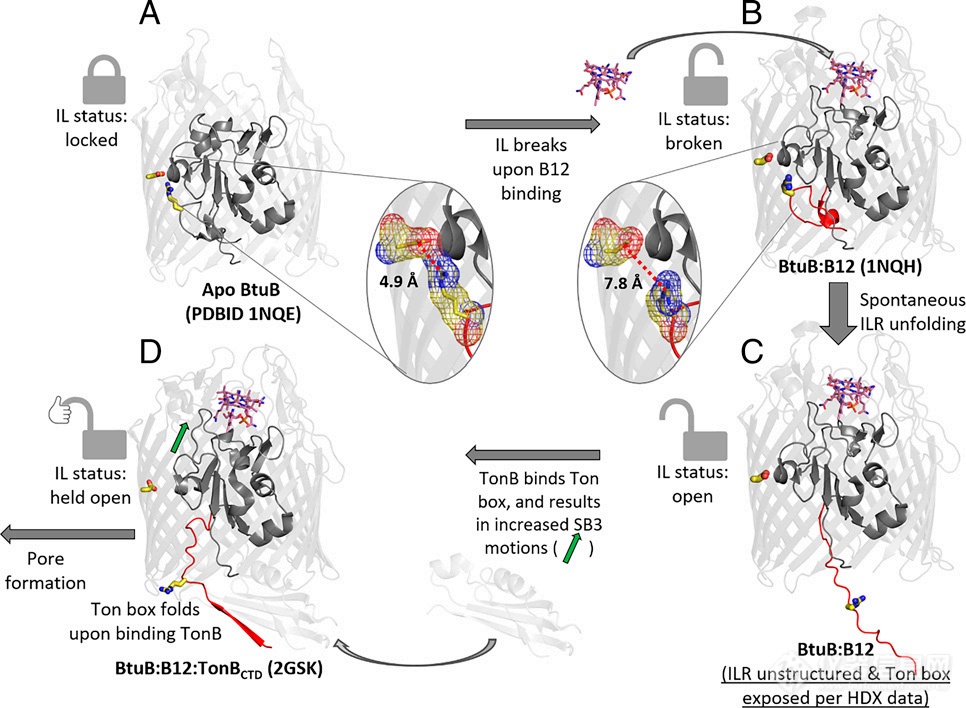
图1. BtuB腔体结构域与两个配体结合事件的构象响应模型。
该实验共设有4组,包括:Apo BtuB、BtuB + B12、BtuB + TonB和BtuB + B12 + TonB。作者对BtuB + B12的HDX速率及保护因子(PF)进行了分析(图2):其中,N-端2-29残基(包括Ton box在内及IL中的R14)、pre-SB3区域属于快速氘代区域,SB1、SB2、SB3属于中速氘代区,其他区域属于慢速氘代区。
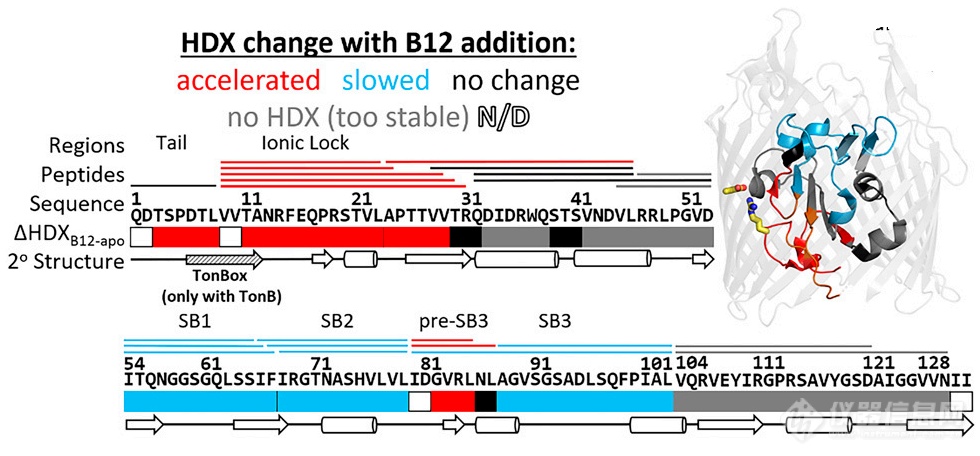
图2. HDX速率分区并映射至结构。
随后作者分析了Apo BtuB、BtuB + B12的HDX-MS实验数据(图3)。其中IL区域及其相连的Fisrt Strand区域的HDX变化情况最为显著(氘代上升),从氘代动力学图中我们可以看到添加B12后该区域的氘代速率从较慢的水平转变为较快的水平,这说明B12的结合足以使得IL区域发生较大的构象变化,该现象呼应了TonB从较为紧凑的结构转变为较为动态/溶剂可及性高的结构。除此之外,N-端前5个残基区域经历了轻微的氘代上升;底物结合区SB1、SB2和SB3经历了一定程度的氘代下降,而SB3的前端经历了一定的氘代上升。
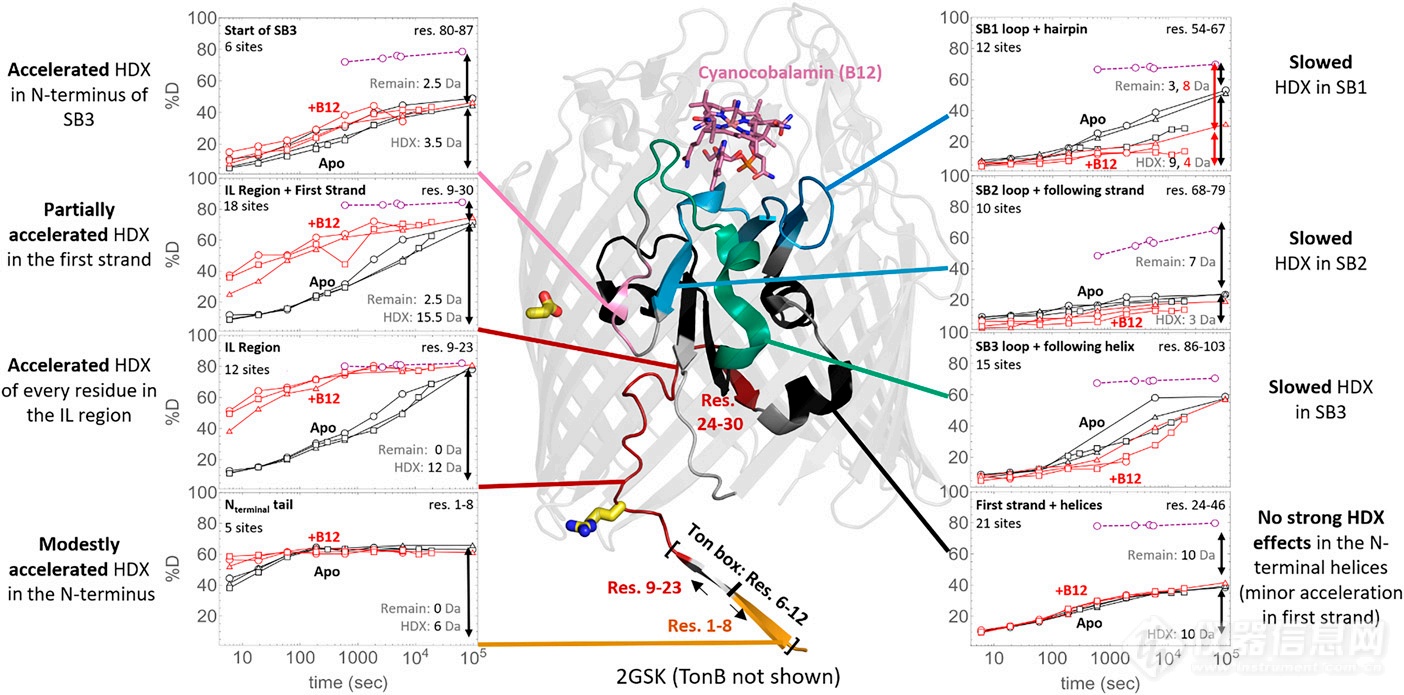
图3. BtuB + B12和Apo BtuB的HDX比较。
接着作者也考察了BtuB + TonB和BtuB + B12 + TonB的HDX-MS结果(图4)。结果发现,只加TonB时BtuB的IL区域并未发生较大的HDX变化,而同时添加B12和TonB的BtuB IL区产生了明显的氘代变化,这些现象进一步证实了BtuB的Ton box发生结构改变是B12结合后IL解锁产生的效应。这些实验结果支持非力依赖型假说机制,即B12结合后通过別构效应使得IL处的盐桥打破,使得Ton box区被释放至胞质中,进一步跟下游蛋白结合从而打开通道孔径。
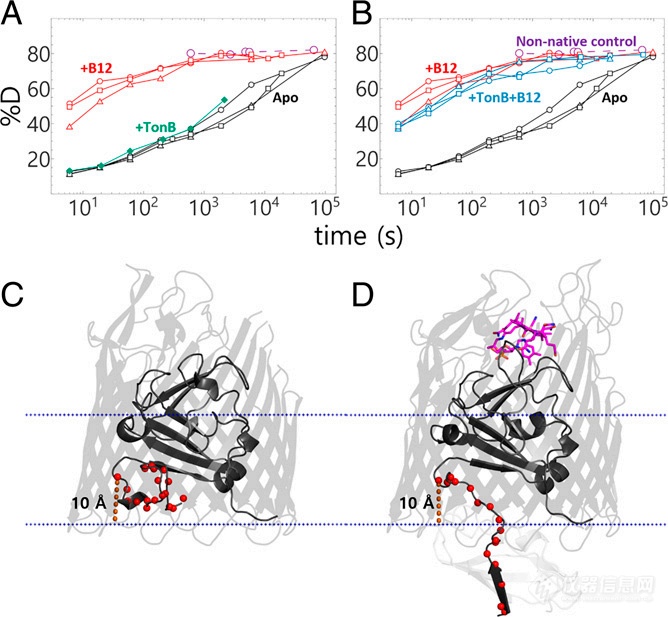
图4. 不同组别的IL区域的HDX氘代动力学图。
本文通过HDX-MS实验解决了大肠杆菌离子通道家族中一蛋白BtuB配体相关的动态调控机制,通过实验的方法验证了非力依赖机制假说。本文选取的体系及蛋白样品较为巧妙,实验设计合理,实验证据充分,行文逻辑严密,为离子通道的动态调控机制提供了见解,是HDX-MS方法优势的典型体现。
撰稿:罗宇翔
编辑:李惠琳
原文:HDX-MS performed on BtuB in E. coli outer membranes delineates the luminal domain’s allostery and unfolding upon B12 and TonB binding
李惠琳课题组网址:https://www.x-mol.com/groups/li_huilin
参考文献
1. Zmyslowski, A. M.; Baxa, M. C.; Gagnon, I. A.; Sosnick, T. R., HDX-MS performed on BtuB in E. coli outer membranes delineates the luminal domain's allostery and unfolding upon B12 and TonB binding. Proc. Natl. Acad. Sci. U. S. A. 2022, 119 (20).
[来源:仪器信息网] 未经授权不得转载

中山大学李惠琳:非变性质谱技术推动蛋白质结构研究,助力新药研发
2022.12.07

2024.08.23
2024.08.23

2024.08.23

“悟空”出马,PFAS无处遁形:Xevo MRT智斗污染妖魔
2024.08.22
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~