







电镜#新能源 ; 邮箱:yanglz@instrument.com.cn; 微信:yanglizhe2011


退火——在冶金学中很常见——将金属或合金加热到设定温度,保持该温度,然后将金属冷却到室温,以改善材料的物理性质,有时还改善材料的化学性质。退火材料倾向于采用同质状态并容易组装成三维 (3D) 或二维 (2D) 晶体。人们可以通过原子力显微镜 (AFM)、X 射线衍射 (XRD) 或电子显微镜 (EM) 轻松地观察到这种规则堆积。退火是否对生物大分子,尤其是蛋白质表现出类似的影响,是一个迷人的科学问题。
2022年2月22日,上海科技大学沈庆涛研究员团队等在PNAS发表题为Annealing synchronizes the 70S ribosome into a minimum-energy conformation的研究论文,将退火技术引入冷冻电镜解析蛋白质结构,在模拟退火中引入了一个类似的概念,以预测生物大分子的最小能量构象。通过实验验证,在自由能分析中,以快速冷却速率退火可以将 70 S核糖体同步到具有最小能量的非旋转状态。此结果不仅提供了一种简单而可靠的方法来稳定蛋白质以进行高分辨率结构分析,而且有助于理解蛋白质折叠和温度适应。

与金属和有机聚合物不同,蛋白质和蛋白质复合物通常是由化学上不同的亚基以不同的几何形状结合在一起的离散实体。这种显着的结构异质性阻碍了通过 AFM 或 XRD 直接确定结构。相比之下,cryo-EM 分辨率的最新进展为在单分子水平上获得高分辨率蛋白质结构提供了绝佳机会。通过使用冷冻电镜比较退火前后的详细结构,可以获得退火影响蛋白质构象的直接实验证据。
退火提高了局部分辨率
研究中,选择来自大肠杆菌的载脂蛋白状态 70 S核糖体作为模型,其中 30 S亚基经历热驱动的亚基间旋转并表现出显着的结构灵活性以及明显的自由能。在 0°C 下将纯化的脱基态 70 S核糖体培养 5 分钟,然后立即将核糖体快速冷冻以进行低温 EM 分析,这可能保留了与玻璃化之前相同的构象(描绘为未退火状态)。筛选了收集到的 70 S核糖体颗粒通过 2D 和 3D 分类丢弃明显的垃圾和拆卸的核糖体。根据金标准傅里叶壳相关性,从 200,000 个随机选择的粒子中重建得到最终分辨率为 2.6 Å 的结构。由于缺乏稳定因素,例如信使 (mRNA) 和转移 RNA (tRNA),对未退火的 70 S核糖体的局部分辨率估计表明,在 2.6 至 7.2 埃范围内的整个密度图上存在可变分辨率(图 1A )。相对于 50 S亚基,30 S亚基——尤其是它的头部结构域——没有得到很好的解析,这在其他脱辅基态核糖体中很常见。
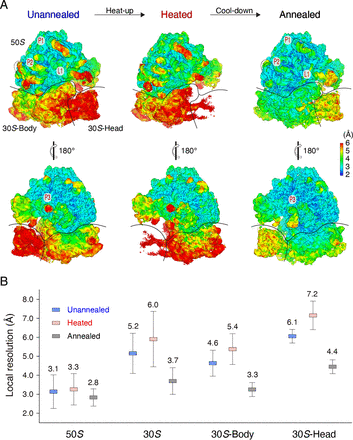
图1 退火提高了 70 S核糖体的局部分辨率
为了量化不同区域的分辨率变化,通过平均选定区域内的局部分辨率值来计算局部分辨率。分析表明,50 S亚基的平均局部分辨率为 3.1 Å,而 30 S亚基的分辨率要低得多——只有 5.2 Å。此外,30 S头域的分辨率更低——平均分辨率为 6.1 Å(图 1 B )。50 S和 30 S亚基之间的亚基间棘轮是分辨率差的主要原因;30 S的亚基内漩涡亚基是次要的,这会降低头部域的分辨率。为简单起见,使用 30 S亚基的局部分辨率作为标记来监测退火对 70 S核糖体的影响。
未退火的、加热的和退火的核糖体结构变化
退火使柔性区域稳定
退火诱导的分辨率改善在整个 70 S核糖体中并不均匀。相对于 30 S亚基的 1.5-Å 分辨率提高,良好分辨的 50 S亚基在退火后仅提高了 0.3 Å(即从 3.1 Å 值到 2.8 Å 值)(图 1 B ) . 因此,退火对具有更大结构灵活性的低分辨率区域特别有益。为了进一步验证这一推论,我们对未退火和退火 70 S之间相同子区域的平均局部分辨率进行了综合统计分析核糖体。例如,退火将不同区域的平均局部分辨率提高到 0.1、0.6、0.8、1.2 和 2.0 Å 的水平;未退火核糖体中相应区域的局部分辨率范围为 2.5 至 3.0、3.0 至 3.5、4.0 至 4.5、5.0 至 5.5 和 5.5 至 6.0 Å(图 2 A ) 。指数曲线与数据非常吻合,表明未退火的 70 S核糖体具有更大的灵活性,对应于退火后局部分辨率的更大提高。
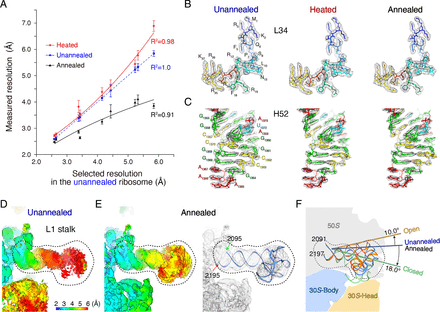
图 2 退火稳定了 70 S核糖体的柔性区域
讨论
不限于金属、合金或半导体,我们通过实验证明退火还可以使 70 S核糖体同步到具有窄构象分布的最小能量状态(图 3)。核糖体/核小体的结晶具有类似退火的处理,其中研究人员通常将核糖体/核小体加热到 37 °C 和 55 °C 之间,然后将它们降低到室温 (19 °C)。对 70 S核糖体进行严格退火以进行结晶将有助于探索退火对 70 S核糖体的物理和化学影响,如在冶金学中。除了 70 S核糖体,在其他生物大分子上退火,特别是那些具有动态结构的大分子,将有助于验证该方法的普遍性。
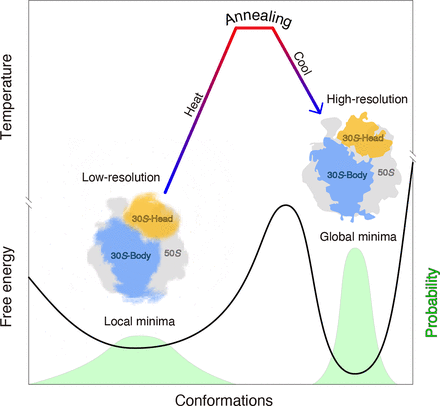
结构灵活性虽然对蛋白质功能至关重要,但阻碍了研究人员应用结构研究在分子水平上阐明功能的能力。持续的努力——例如关键残基的突变,引入额外的二硫键,添加抗体/结合蛋白 ,或在溶液中或甘油内交联/葡萄糖梯度——对于优化样品以提高结构稳定性很有用。然而,这样的努力耗时且缺乏明确的方向,最终的结构仅限于固定状态,有时甚至会在额外的操作后发生扭曲。退火——适当加热和冷却的组合——对蛋白质没有破坏性,是一种简便而可靠的高分辨率冷冻电镜方法。有趣的是,与通过戊二醛交联的 70 S核糖体相比,退火提高了 50 S和 30 S亚基的局部分辨率。
研究人员还尝试通过在低温 EM 图像处理期间对柔性区域进行局部细化来提高局部分辨率。我们对未退火和退火核糖体的灵活 30 S亚基进行了局部改进。在局部细化后,未退火核糖体的 30 S亚基的平均局部分辨率提高了 ~1 Å,达到 4.2 Å。与通过退火提高分辨率不同,局部细化本身仍然导致 30 S亚基头部域的平均分辨率不足 5.5 Å 。显然,退火和局部细化通过不同的机制提高了局部分辨率。退火可以将生物大分子驱动到最小能量状态,并且无论区域大小如何,都可以全局提高整个地图的分辨率。作为对照,局部细化在算法级别上起作用,并且仅适用于大小合理的区域。当我们对退火核糖体应用局部细化时,30 S亚基的主体和头部结构域分别提高到 2.9 和 3.9 Å。这表明退火与柔性区域的局部细化兼容,并且可以进一步优化局部分辨率以进行详细的结构分析。
可以使用退火将蛋白质同步到最低能量状态,这可能有利于许多单分子方法,例如光镊和单分子荧光共振能量转移 。人们还可以使用退火来研究温度适应和蛋白质折叠,并促进分子动力学模拟中的算法开发。因此,研究人员应彻底研究退火机制并进一步优化退火条件以提高分辨率。
本研究由国家重点研发计划项目2017YFA0504800(Q.-TS)、2021YFF1200403(Q.-TS)和2018YFC1406700(Q.-TS)和国家自然科学基金项目31870743(Q. .-TS)等支持。
论文链接:https://www.pnas.org/content/119/8/e2111231119#sec-6
[来源:仪器信息网译] 未经授权不得转载
2022.02.18

Nature子刊:孙飞/乔明强合作团队开发新型冷冻电镜支持膜技术
2021.12.21


2024.07.03
2024.03.13
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~