







自律,自由。


近日,罗氏发布其2019年半年报。
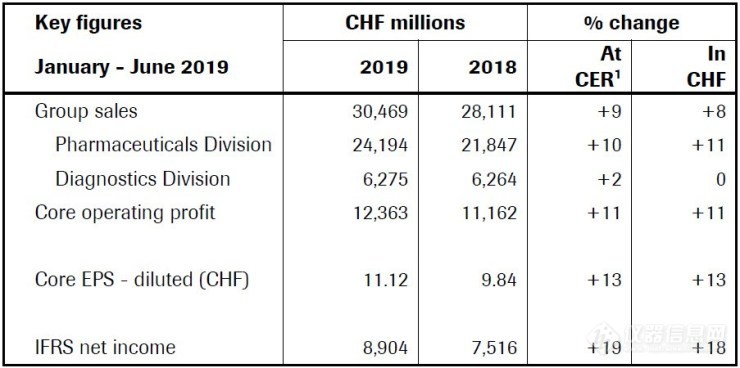
按固定汇率计算,集团销售额增长9%,按瑞士法郎计算增长8%;
制药部门销售额增长10%,主要受Ocrevus、Hemlibra、Tecentriq和Perjeta的推动;
诊断部门销售额增长2%,主要得益于其免疫诊断业务和第二季度整体强劲增长;
今年第二季度,美国FDA批准罗氏Polivy(以前称为polatuzumab),与利妥昔单抗和化疗苯达莫司汀联合应用,用于先前至少两次治疗失败的或复发的弥漫性大B细胞淋巴瘤患者;Kadcyla用于her2阳性早期乳腺癌的辅助治疗;Venclexta结合Gazyva以前未经治疗的慢性淋巴细胞白血病;在日本Rozlytrek用于治疗ntrk阳性肿瘤;
每股核心收益增长13%;
在国际财务报告准则的基础上,净收入增长19%。
在汇率不变的情况下,该公司将2019年的销售增长预期上调至中位数至高个位数。
在评价该集团的成果时,罗氏首席执行官Severin Schwan说:“今年上半年,由于对我们研发的新药的高需求,我们取得了非常强劲的业绩。我对卫生当局加快批准Polivy和Rozlytrek项目感到非常高兴。这些药物是癌症患者的重要治疗选择。基于今年上半年的表现,我们正在提高2019年全年的展望。”
集团成果
2019年上半年,集团销售额增长9%,至305亿瑞士法郎,核心每股收益增长13%,高于销售额。基础业务表现强劲,核心营业利润增长11%。国际财务报告准则净利润增长19%,主要因为核心业绩强劲,递延所得税头寸重新计量以及与收购相关的拨备发布所产生的一次性影响。
制药部门销售额增长10%,达到242亿瑞士法郎。主要的增长动力是多发性硬化症药物Ocrevus,新的血友病药物Hemlibra和癌症药物Tecentriq, Perjeta和Avastin。新引进药物的大量使用大大抵消了赫赛汀和马贝拉/利妥昔单抗销量下降的影响。
在美国,Ocrevus、Hemlibra、Tecentriq、Perjeta和Avastin的销量增长了14%。
在欧洲销量下降4%,赫赛汀(-45%)和MabThera/Rituxan(-36%)的生物仿制药竞争影响了销售。这种下降被Ocrevus、Perjeta、Tecentriq、Alecensa和Hemlibra的强劲增长逐渐抵消。
在日本,最近推出的Hemlibra、Tecentriq和Perjeta等产品的推动下,日本的销量增长了9%。日本的增长被MabThera/Rituxan的生物相似竞争部分抵消(-46%)。
国际市场销量增长17%,主要受中国市场的推动,中国市场表现优异与赫赛汀、阿伐斯汀、马贝拉/利妥昔单抗销量强劲,以及Alecensa和Perjeta上市有关。
诊断部门销售额增长2%,达到63亿瑞士法郎。POCT贡献最大,这与免疫诊断业务的增长有关。在区域方面,亚太地区增长5%,EMEA(欧洲、中东和非洲)地区增长3%,北美销量下降2%。
制药部门的核心营业利润增长了11%,诊断部门增长了4%。
重要里程碑
今年第二季度,卫生部门批准了罗氏药品的几项申请。美国食品和药物管理局(FDA)批准加速批准Polivy (polatuzumab vedotin-piiq)联合苯达莫司汀和利妥昔单抗治疗复发或难治性弥漫性大b细胞淋巴瘤,这些患者此前至少接受过两种治疗。
在日本,卫生、劳动和福利部(MHLW)批准Rozlytrek(恩曲替尼)用于治疗成人和儿童神经营养酪氨酸受体激酶(NTRK)融合阳性的晚期复发性实体肿瘤。Rozlytrek是日本批准的第一种针对NTRK基因融合的肿瘤诊断药物。NTRK基因融合已在一系列难以治疗的实体肿瘤类型中被发现,包括胰腺、甲状腺、唾液腺、乳腺、结肠直肠和肺。另外,MHLW批准了one CDx癌症基因组图谱作为Rozlytrek的辅助诊断。
Kadcyla获得FDA批准用于辅助治疗(手术后)her2阳性的早期乳腺癌患者,这些患者在新辅助治疗(手术前)紫杉烷和基于赫赛汀的治疗后存在残余侵袭性疾病。Kadcyla在FDA的实时肿瘤审查(RTOR)和评估援助试点项目下被审查和批准,在完成提交后的12周内获得批准。Kadcyla是罗氏在RTOR试点项目下批准的第一种药物,该项目正在探索更有效的审查流程,以确保患者尽早获得安全和有效的治疗。
FDA还批准 Venclexta/Venclyxto联合Gazyva/Gazyvaro治疗以前未经治疗的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤,这也是FDA新的RTOR和评估援助试点计划的一部分。批准是基于随机III期CLL14研究的结果,该研究评估了12个月固定疗程的文克列塔加加氯硝西汀治疗与加加氯硝西汀治疗的比较。结果显示,文克列塔和加齐瓦的联合用药,与加齐瓦和氯氨氯乙酯(目前的一种治疗标准)相比,可使疾病恶化或死亡的风险(独立审查委员会评估的无进展生存期[PFS])持续显著降低67%。
欧洲药物管理局人类用药委员会建议批准Tecentriq加化疗(Abraxane;nab-紫杉醇)用于治疗无法切除的局部晚期或转移性三阴性乳腺癌的成年患者,其肿瘤具有PD-L1表达(≥1%),且此前未接受转移性疾病的化疗。
2019年2月,罗氏宣布全面收购Spark Therapeutics,该交易目前预计将于2019年完成。Spark Therapeutics总部位于美国宾夕法尼亚州费城,是一家致力于发现、开发和提供基因疗法的综合性公司,用于治疗遗传性疾病,包括失明、血友病、溶酶体存储障碍和神经退行性疾病。
对2019年的展望
在汇率不变的情况下,目前预计销售额将实现中位数至高个位数的增长。在汇率不变的情况下,每股核心收益的增长目标将与销售额大体同步。罗氏预计将进一步提高以瑞士法郎计算的股息。
[来源:仪器信息网] 未经授权不得转载

2024.07.10

共5580人!中国博士后第17批特别资助与第75批面上资助名单公布
2024.07.10

学质谱来仪课通!企业人才培养的加速器-质谱不神秘课程火热上线
2024.07.10

预算485万采购类器官/活细胞共聚焦微孔板成像系统系统!苏州大学附属第一医院发布招标公告
2024.07.10

喜报!这家国产质谱中标广东省佛山生态环境监测站ICP-MS仪器采购大单!
2024.07.09

2024.07.09
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~