









3月以来,CFDA发了一连串关于一致性评价的公告。一致性评价的执行细则看起来越来越明朗,但是大多数企业却纷纷叫苦,认为一致性评价的门槛太高且难以执行。

中小企业伤不起
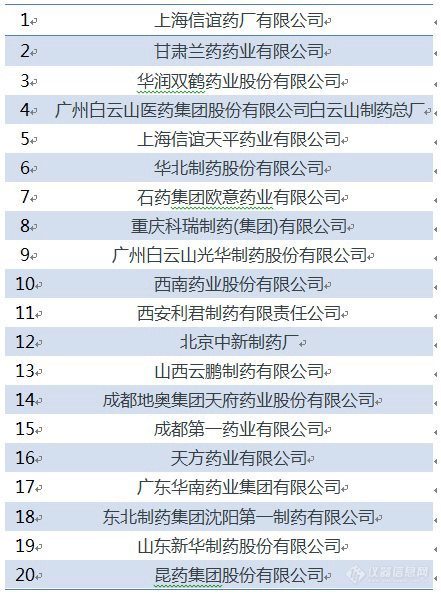
根据数据整理219个2018年前必须完成的基药口服药产品对应企业发现(见下表),上海信谊、华润双鹤、白云山、石药等企业压力比较大。2015年华润双鹤利润额为6.61亿元,若以500万元一个产品预算,可以做130个基药产品的一致性评价,基本可以完成华润双鹤所需要进行的一致性评价产品的数量。但是对于未上市的中小企业而言,一年利润达不到3000万元,1年的利润紧巴巴地能完成6个产品就不错了。而且,500万元的投入未必能够保证一定能通过一致性评价,于是中小企业对一致性评价的态度更偏向观望。
2018年前必须完成基药口服药产品一致性评价数TOP20企业
一致性评价执行的难度
1 .参比试剂的合法性
首先,参比试剂的原研厂家是哪家,有无在美国、欧盟和日本等国家上市,目前还能采购相关的原研药品吗,没有的话有无优质的仿制药仍在上市?以上信息的收集已难倒不少研发人员。其次,参比试剂的一次性进口的流程貌似仍在摸索中,也就是说就算知道哪个是目标研究对象了,国家还没准备好放行咧。最大的难度在于临床试验环节,需要提供原研药或国际认可的仿制药的质量标准。这大招据悉无人可破,或许企业还是先把CMC资料做好,说不定待能做BE临床了,原研地产化都完成一致性评价了,可以实行“拿来主义”了。
2. BE基地短缺
BE基地短缺且费用越来越贵是目前生产厂家与CRO公司比较烦恼的事情。对于基药这种难以为研究者带来论文收益的项目,研究者的合作意愿不那么高。而BE基地本来就有限,僧多粥少的情况下难免费用更加水涨船高。而且由于项目主动性在临床基地,临床基地提供的服务质量没有迹象在显著提高,那么CMC做好,工艺改好了,若栽在临床上,很难回溯究竟是哪方面没做好。
3. 研发外包困局
一致性评价还不等于以往的国内3.1类仿制药申报,目前国内大多数企业的研发团队并不能胜任,只有参与过美国、欧盟和日本的仿制药制剂申报并成功的研发团队相对经验比较丰富。这意味着大多数企业要选择外包,而外包的团队并不能保证项目的排他性,这对于国内企业而言,花钱仅仅是提高门槛,但是并不能保证在一致性的竞争中能够获得独家的地位。
[来源:新康界]
 全球最大规模医疗影像研究计划启动
全球最大规模医疗影像研究计划启动
2024.07.12

2024.07.12

2024.07.12

2024.07.12

2024.07.12

仪器信息网“食用油/矿物油安全检测知多少”系列活动火热开启!
2024.07.12
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~