清道夫受体在内毒素清除中的分子机制与功能研究
SR最初是指具有结合被修饰低密度脂蛋白能力的细胞表面糖蛋白。1979年,Brown和Goldstein在粥样斑内含脂质巨噬细胞形成的研究中首次提出“清道夫活性”。随后研究证实,这种“清道夫活性”为巨噬细胞膜上的带有胶原结构的三聚体膜蛋白,具有结合被修饰低密度脂蛋白等带阴电荷配体的活性,因而被命名为清道夫受体(scaven-ger receptor,SR)。
SR的早期研究主要是探讨其在动脉粥样硬化形成中的作用,研究证实,它通过摄取氧化型低密度脂蛋白,促进胆固醇沉积,从而介导动脉粥样硬化的发生。近年研究进一步发现,巨噬细胞表面SR还具有结合和清除细菌及其毒素的作用,是介导巨噬细胞防御功能的重要受体,在天然免疫中发挥重要的防御作用。
一、清道夫受体的分类及其特征
近20年来,先后在体内发现多种能与修饰低密度脂蛋白结合的受体,基于其分子结构,可将这些分子划分六类:即SR-A(SR-AⅠ、SR-AⅡ、SR-AⅢ和MARCO)、SR-B(CD36和SR-B1),SR-C(dSR-C1)、SR-D(CD68)、SR-E(LOX-1)和SR-F(SREC)。各类SR为多结构域跨膜蛋白,但没有一个结构域在各类SR中是相同的,提示这些一级结构不同的氨基酸序列可能构成相似的三级机构,因而他们具有相似的配体结合活性。与天然免疫有关的SR主要为SR-A和SR-B。

二、清道夫受体之SR-A
SR-A是第1组被克隆的SR,最早是从牛肺mRNA中克隆,由7.7万单体组成的三聚体糖蛋白,随后分别在小鼠、人和兔体内也发现SR-A。对不同来源的SR-A 的序列比较显示,他们为高度保守的分子,具有60%以上的同源性。体内大多数巨噬细胞均能表达SR-A,其中肠道中固有层巨噬细胞、肝枯否细胞和肺泡巨噬细胞表达的蛋白水平最高,但单核细胞﹑中性粒细胞不表达SR-A。
1990年由于牛肺巨噬细胞SR-A的克隆,人们开始从分子水平上认识SR。早期研究显示,体内SR-A有两种亚型,即SR-AⅠ和SR-AⅡ,他们由同一个基因编码,该基因在人类位于染色体8p22。亚型的产生是由于基因产物的交替剪接(alternative splicing)所致。最近又发现了SR-A基因的第3个剪切变异体(splice variant),即SR-A Ⅲ。此外,在部分巨噬细胞亚群还发现了另一种SR,即MARCO(Macrophage receptor withcollagenous structure)。MARCO基因在人类位于2号染色体上。由于结构上与SR-A非常相似,故也被归为A组SR。
SR-A和MARCO都为Ⅱ型聚体跨膜糖蛋白,含有6个不同的结构域:N-末端胞浆域、跨膜域和4个胞外结构域,耶间隔区(spacer)、绕线式α螺旋(α-helical coiledcoil),胶原区(collagenous domain)和C末端(C-terminal domain)(图7-1)。结构上,SR-AⅠ、Ⅱ和Ⅲ型妥体的唯一区别是C末端。SR-AⅠC末端较长,含有一个110个氨基酸组成的保守的SR半胱氨酸富含区(scavenger receptor cysteine-rich domain,SRCR),而SR-A和的C末端较短或无C末端。研究发现,SRCR结构域为参与天然免疫的各种蛋白分子中的高度保守的结构。SR-AⅠ和SR-AⅡ的功能无明显差异,两者的配体结合特性也几乎完全相同,说明C末端结构域不是配体-受体相互作用所必需的。SR-AⅢ位于内质网上,体外实验显示其无功能活性,它可能作为显性负异构体(dominant negative isoform),参与调节SR-AⅠ和Ⅱ的活性。
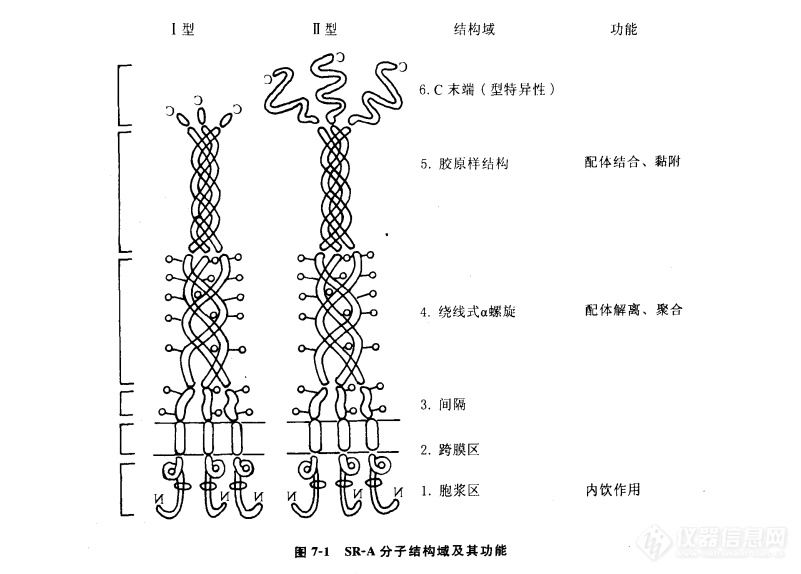
SR-A的胶原结构域为23个甘氨酸-X-Y三联体的重复结构组成,X、Y可代表任何两个不同的氨基酸,50%以上的Y为脯氨酸和赖氨酸。在生理pH时,这些重复结构带正电荷,为多价阴离子配体的结合部位。尤其是胶原结构域C末端上的4个赖氨酸残基簇(cluster)对于配体-受体复合物间的特异性结合以及随后内移(internalization)至关重要。生物信息学分析显示,含赖氨酸残基簇的配体结合域可在SR的表面形成一个带正电荷的沟(groove),这种三维结构对于众多的生物相关分子,包括微生物产物显示出高亲和力。这种结构是模式识别受体系统的共同特征。
缩短SR的胶原结构域可使受体结合配体的能力明显下降,进一步说明胶原结构域在配体-受体结合中发挥重要作用。虽然SR的胶原结构域在牛、人,兔和小鼠中高度保守,但特异性配体识别仍有一些种属差异。此外,配体上的负电荷及其密度﹑配体的构象特征等对于配体-受体间的静电作用也十分重要。
绕线式α螺旋区通过螺旋间的疏水残基介导有功能活性的三聚体SR的形成。点突变研究显示,该区域还与配体-受体在溶酶体内的解离密切相关,这种解离是由于溶酶体内低pH 值,致其构象改变所致。
N末端胞浆结构域虽不具有已知的内移结构域,但目前研究认为,它与细胞的摄粒作用和SR的再循环有关。此外,其氨基酸一级结构显示,胞浆结构域含有两个潜在的PKC磷酸化位点,受体能与Lyn激酶进行共免疫沉淀,提示受体可能具有信号转导作用。我们研究显示,SR不介导LPS的细胞激活作用。
MARCO是新近在体内部分巨噬细胞表面发现的糖蛋白,具有结合细菌和被修饰LDL的作用,其结构与SR-AⅠ极为相似,因而被划分为SR-A。MARCO结构上与SR-AⅠ的差异表现为MARCO含有较长的胶原结构域,但缺乏绕线式α螺旋区。MARCO的配体结合区为SRCR结构域,不是胶原结构域。这与SR-AⅠ和Ⅱ不同,后者的结合位点是胶原结构域。
MARCO的表达分布也与SR-AⅠ和Ⅱ有明显差异。正常情况下,MARCO表达仅限于部分巨噬细胞,最为明显的细胞是脾边缘区的巨噬细胞,其次为淋巴结髓索中的巨噬细胞,腹腔巨噬细胞也能表达,在其他组织内均未见表达。在BCG感染、细菌脓毒症、内毒素血症时组织巨噬细胞均有MARCO表达,体外细菌或LPS处理时也能诱导其表达。非感染刺激,如颗粒、关节炎和小鼠粥样斑块,也能上调MARCO表达。与SR-A Ⅰ和Ⅱ相似,MARCO能结合革兰阳性和革兰阴性细菌及其产物,如大肠杆菌和金黄色葡萄球菌。但有关MARCO在天然免疫中的作用尚报道较少。抗MARCO抗体并不能明显减缓活大肠杆菌或金黄色葡萄球菌的清除速率。
更多![]()
会议邀约 | 中国材料大会2024
厂商
2024.07.04
莱伯泰科:以专业和责任,筑起食用油安全防线
厂商
2024.07.10
小心空调送风的健康风险——嗜肺军团菌
厂商
2024.07.11
泰国连线∣泰林生物亮相2024 CPHI SEA制药原料展
厂商
2024.07.12











