果糖-1.6-二磷酸醛缩酶(FBA)活性检测试剂盒说明书
紫外分光光度法
规格:50T/48S
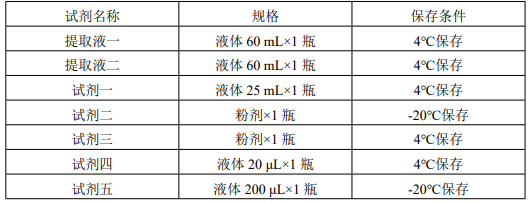
产品组成:使用前请认真核对试剂体积与瓶内体积是否一致
溶液的配制:
1、 试剂二:临用前加入 5 mL 蒸馏水充分溶解,用不完的试剂分装后-20℃保存,禁止反复冻融;
2、 试剂三:临用前加入 5 mL 蒸馏水充分溶解,用不完的试剂分装后-20℃保存,禁止反复冻融;
3、 试剂四:液体置于试剂瓶内 EP 管中。临用前加入 5 mL 蒸馏水充分溶解,用不完的试剂分装后-20℃保存,禁止反复冻融;
4、 试剂五:液体置于试剂瓶内 EP 管中。临用前加入 5 mL 蒸馏水充分溶解,用不完的试剂分装后-20℃保存,禁止反复冻融。
产品说明:
果糖 1,6-二磷酸醛缩酶(Fructose 1,6 bisphosphate aldolase,FBA)(EC4.1.2.13)是糖酵解、糖异生、磷酸戊糖途径及光合作用中参与 calvin 循环的重要酶,催化果糖 1,6-二磷酸可逆的裂解为磷酸二羟丙酮和 3-磷酸甘油醛,广泛存在于动植物及微生物体内,在各种逆境胁迫下表现不同的响应。果糖 1,6-二磷酸醛缩酶催化果糖 1,6-二磷酸生成 3-磷酸甘油醛和磷酸二羟丙酮,在磷酸丙糖异构酶和 α-磷酸甘油脱氢酶作用下催化 NADH 和磷酸二羟丙酮生成 NAD 和 α-磷酸甘油,340nm 处吸光值的变化可反映果糖 1,6-二磷酸醛缩酶活性的高低。
注意:实验之前建议选择 2-3 个预期差异大的样本做预实验。如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:
紫外分光光度计、分析天平、低温离心机、1mL 石英比色皿、可调式移液枪、研钵/匀浆器、漩涡震荡仪、超声破碎仪、冰。
操作步骤:
一、样本处理(可适当调整待测样本量,具体比例可以参考文献)
①总 FBA 酶:
组织:按照组织质量(g):提取液体积(mL)为 1:5~10 的比例(建议称取约 0.1g 组织,加入 1mL 提取液一)充分冰浴匀浆,然后 8000g,4℃,离心 10min,取上清置于冰上待测。
细菌或细胞:按照细菌或细胞数量(104 个):提取液体积(mL)为 500~1000:1 的比例(建议 500 万细胞加入 1mL 提取液一),冰浴超声波破碎细菌或细胞(功率 300w,超声 3 秒,间隔 7 秒,总时间 3min);然后 8000g,4℃,离心 10min,取上清置于冰上待测。
液体:直接检测。
②胞浆和叶绿体 FBA 酶的分离:
(1) 按照植物组织质量(g):提取液体积(mL)为 1:5-10 的比例(建议称取约 0.1g 样本,加入 1mL 提取液一),手工快速研磨或匀浆,之后于 4℃,200g 离心 5min;
(2) 弃沉淀,取上清在 4℃,8000g 离心 10min(离心时缓慢加速和降速);
(3) 取上清用于测定胞浆 FBA 酶活性,取沉淀加 1mL 提取液二,震荡溶解后超声破碎(冰浴,200W,破碎 3s,间歇 7s,总时间 1min),然后 4℃,8000g 离心 10min,上清即为叶绿体中 FBA 酶活性。
建议测定总FBA酶活性,按照步骤①提取粗酶液,若需要分别测定胞浆和叶绿体中的FBA,则按照步骤②提取粗酶液。
二、测定步骤
1、 分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、 样本测定:(在1mL石英比色皿中分别加入下列试剂)
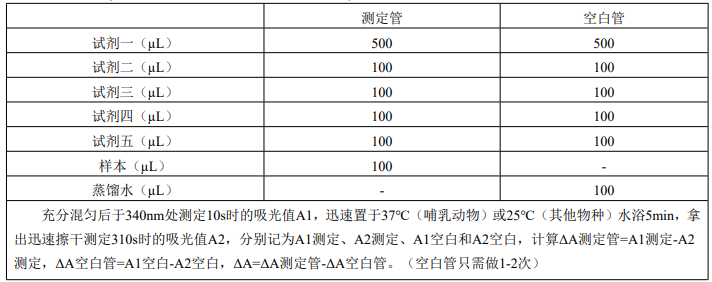
注意:如果检测样本量大,可以将试剂一、二、三、四、五按照5:1:1:1:1(V:V:V:V:V)的比例配成工作液待用(现配现用)。


注意事项:
1. 若 ΔA 大于 0.8 建议将样本用相应提取液进行适当的稀释再进行测定,并在计算公式中乘以稀释倍数。
2. 若是植物样本,建议在提取完成后 2h 内检测完,如果样本量过大,建议分批提取、检测。
3. 由于提取液一中含有一定浓度的蛋白(约 0.5mg/mL),所以在测定样品蛋白浓度是需要减去提取液本身的蛋
白含量。
实验实例:
1、 取0.1g小鼠肝脏加入1mL提取液进行匀浆研磨,取上清稀释8倍后按照测定步骤操作,测得计算ΔA测定管=A1测定-A2 测定=1.257-1.06=0.197,ΔA 空白管=A1 空白-A2 空白=1.164-1.16=0.004,ΔA=ΔA 测定管-ΔA 空白管=0.197-0.004=0.193,按样本质量计算酶活:
FBA 酶活(U/g 质量)=321.54×ΔA÷W×8(稀释倍数)= 321.54×0.193÷0.1×8(稀释倍数)=4964 U/g 质量。
2、 取 0.1g 绿萝加入 1mL 提取液进行匀浆研磨,取上清后按照测定步骤操作,测得计算 ΔA 测定管=A1 测定-A2测定=1.438-1.386=0.052,ΔA 空白管=A1 空白-A2 空白=1.164-1.16=0.004,ΔA=ΔA 测定管-ΔA 空白管=0.052-0.004=0.048,按样本质量计算酶活:
FBA 酶活(U/g 质量)=321.54×ΔA÷W= 321.54×0.048÷0.1=154.3392 U/g 质量。
特别提示:本公司的所有产品仅可用于科研实验,严禁用于临床医疗及其他非科研用途!
![]()
![]()