NIR-II 激发的抗淬灭苯硼酸改性共轭聚电解质利用细胞内过氧亚硝酸盐增强化学-光热
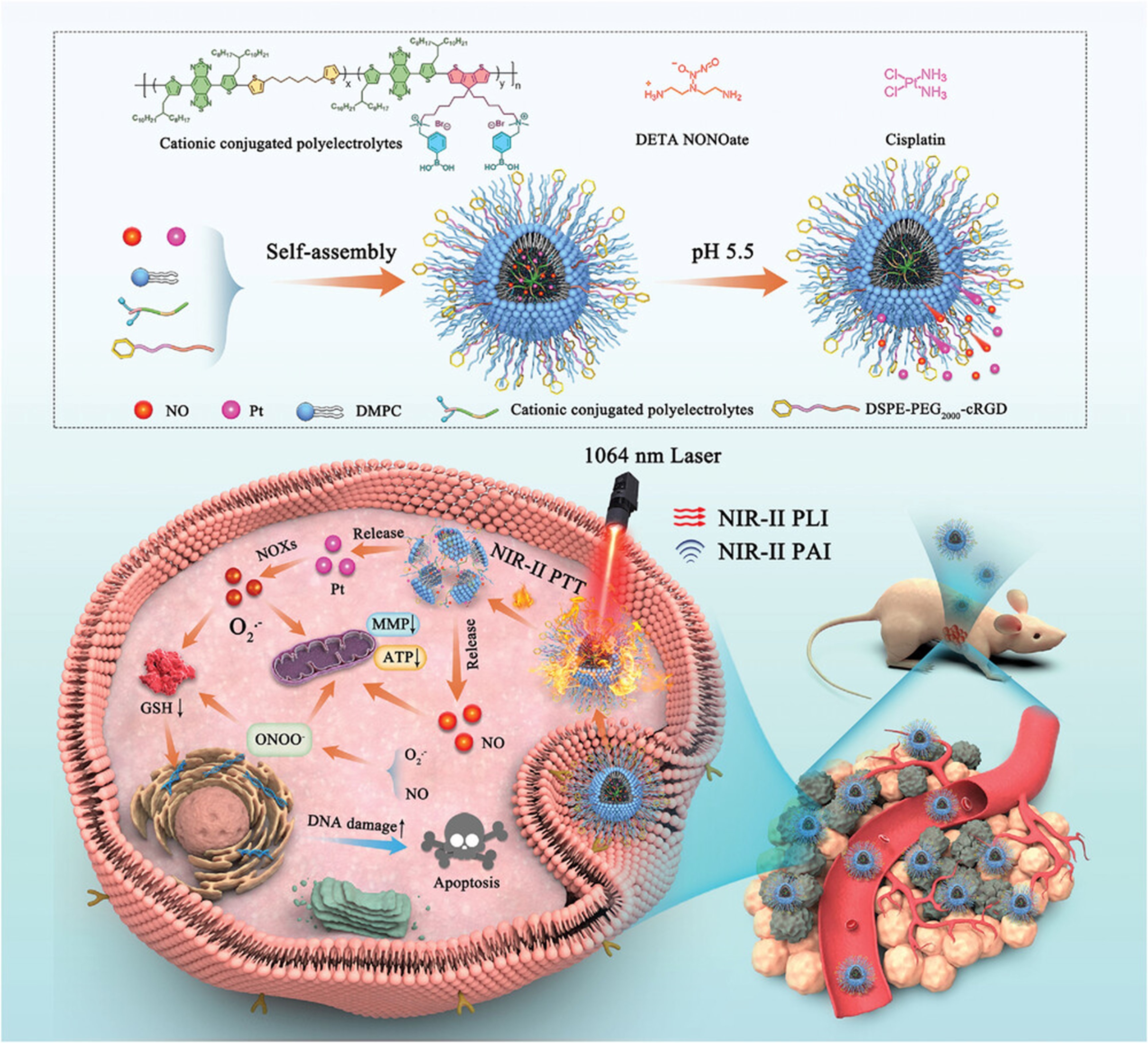
本文要点:本文报道了一种多功能过氧亚硝酸盐(ONOO—)纳米发生器(PBT/NO/Pt),用于NIR-II荧光(NIR-II FL)/NIR-II光声(NIR-II-PA)成像引导的化学/NIR-II PTT/ONOO—联合治疗。多功能纳米发生器是通过将pH敏感的一氧化氮供体(DETA NONOate)和烟酰胺腺嘌呤二核苷酸磷酸氧化酶触发超氧化物(O2•−)发生器化疗药物(CDDP)共同装载到NIR-II激发共轭聚电解质(PNC1BA)中而开发的。PNC11BA在聚合物骨架中具有非共轭烷基链段,在其侧链中具有丰富的带正电荷的苯基硼酸,这支持NIR-II FL的抗淬灭以及DETA-NONOTE和CDDP整合到PBT/NO/Pt中。在酸性肿瘤微环境中,CDDP和PNC11BA之间的配位键被切割,释放CDDP用于化疗活性。一氧化氮(NO)和O2•−的同时释放迅速导致原位产生更具细胞毒性的反应性生理氮物种ONOO−。体外和体内结果证明,PBT/NO/Pt通过下调细胞内谷胱甘肽和增加CDDP-DNA加合物,对SKOV3/DDP肿瘤表现出显著的ONOO−增强化学光热协同治疗作用。
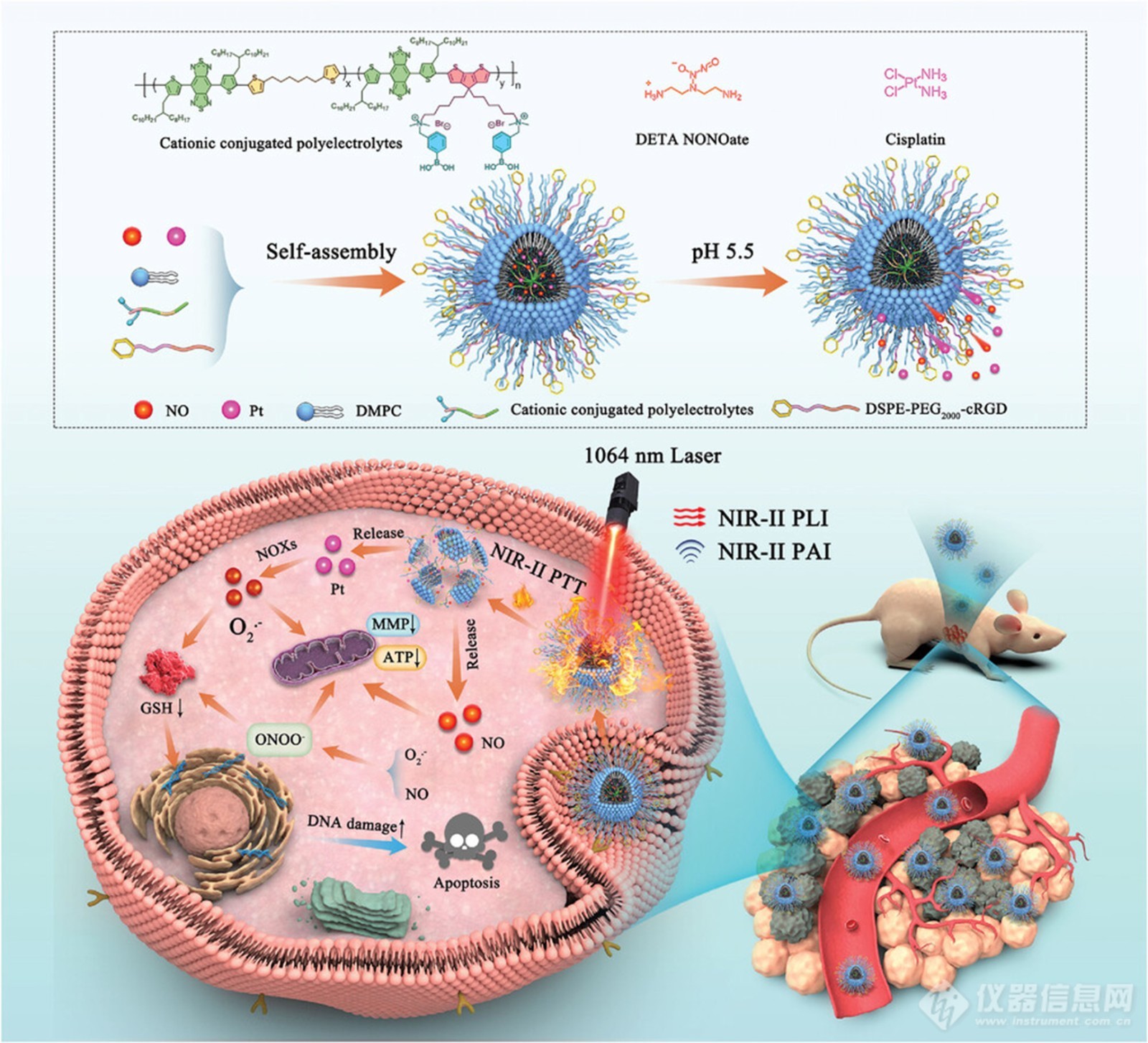
方案1. NIR-II光激发多功能ONOO−示意图纳米发生器 (PBT/NO/Pt) 用于 NIR-II FL/NIR-II PA 成像引导的协同 NIR-II PTT/化疗/过氧亚硝酸盐治疗
本文报道了一种NIR-II光激发多功能ONOO−纳米发生器(PBT/NO/Pt)用于NIR-II FL/NIR-II PA成像引导的协同NIR-II PTT/化疗/过氧亚硝酸盐治疗(方案1)。PBT/NO/Pt是通过整合苯硼酸修饰的NIR-II共轭聚电解质(PNC11BA)、pH敏感的NO供体(DETA NONOate)和NOX触发的O2•−产生化疗药物(顺铂、CDDP)构建的。首先,将强电子供体(CPDT)和非共轭链段(C6)掺入聚合物主链中,并将阳离子苯硼酸基团与侧链结合,以产生NIR-II聚合物PNC11BA。与以前的NIR-II共轭聚合物相比,本文制备PNC11BA具有三个显著优势。首先,共轭聚电解质PNC11BA在1064 nm处表现出峰吸收和高NIR-II光热转换效率(PCE)值(53.65%),这使得PBT/NO/Pt适用于NIR-II PA成像和NIR-II PTT。其次,PNC11BA聚合物主链中含有C6链段,可以通过减少非辐射衰变,同时实现强大的NIR-II吸收消光系数和NIR-II荧光。第三,阳离子侧链PBA可以显著减少水环境中的聚集诱导猝灭(ACQ),当DMPC和DSPE-PEG2000–cRGD携带PNC11BA时,可以产生具有优异NIR-II荧光亮度的PBT/NO/Pt。最后,PNC11BA侧链上的苯硼酸基团将通过供体-受体相互作用提高DETA NONOate和CDDP药物在PBT/NO/Pt中的负载效率。体外研究表明,制备的PBT/NO/Pt能在酸性和高的NOXs浓度环境中释放NO和O2•−,并产生 ONOO−。ONOO−的原位生成通过下调细胞内 GSH 和增加 CDDP-DNA 加合物的水平,使耐药肿瘤对 CDDP 敏感。PBT/NO/Pt 还展示了明亮的 NIR-II FL 和 NIR-II PA 成像用于体内肿瘤诊断,以及协同治疗 NIR-PTT/ONOO−用于体内抗癌应用。更重要的是,PBT/NO/Pt的显著NIR-II PTT和ONOO−增强的化疗赋予了它们对DDP耐药SKOV3肿瘤的良好抑制作用。
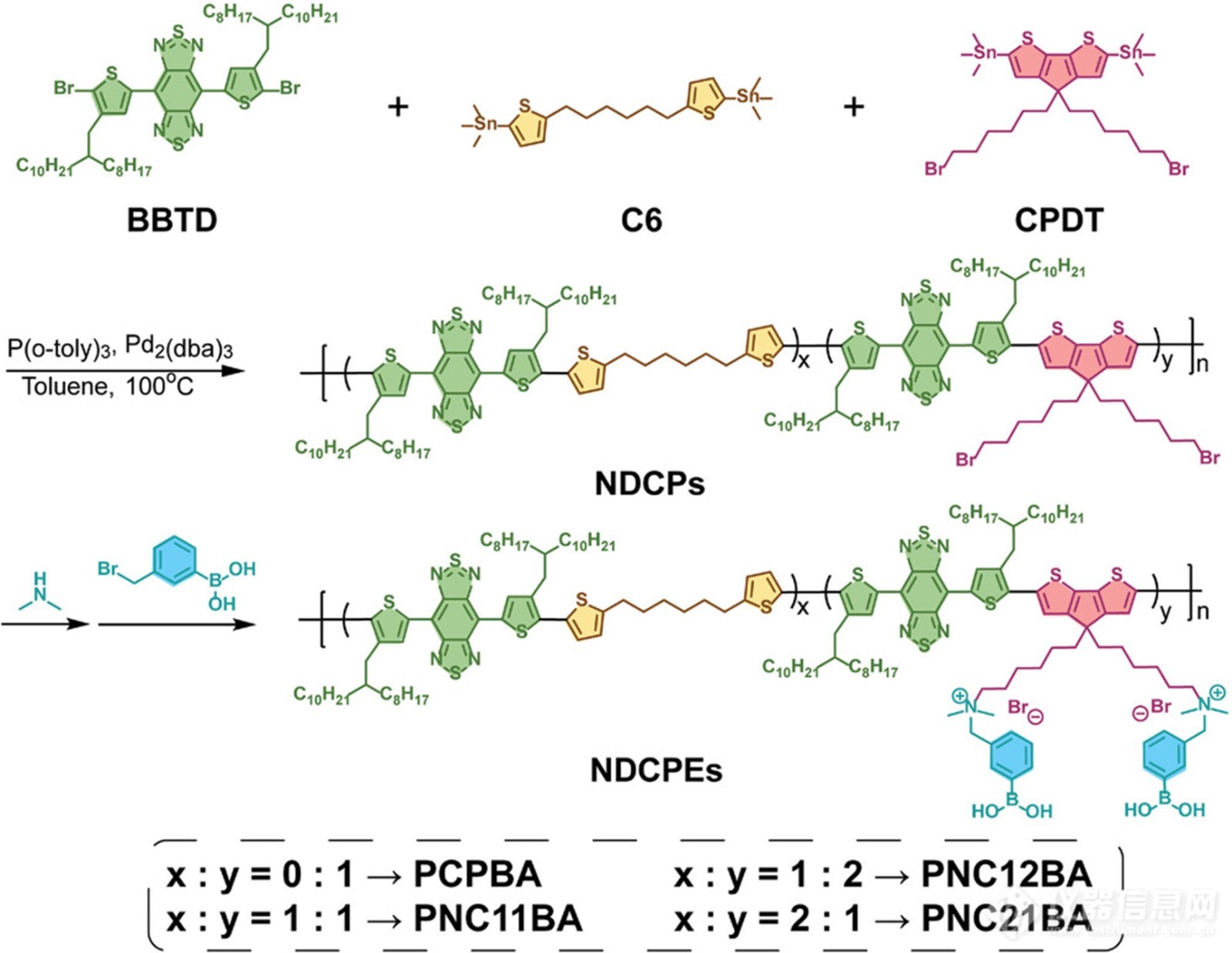
方案2. 苯硼酸修饰NDCPEs的合成路线
通过强电子受体(BBTD)、电子供体(CPDT)和非共轭单元(噻吩-己烷,C6)之间的Stille偶联聚合,合成了三种掺杂共轭聚合物(NDCP)的非共轭链段,其共轭链段密度不同(方案2)。这些共聚物分别以2:1、1:1和1:2的C6:CPDT摩尔比生产,分别命名为PNC21、PNC11和PNC12。这些聚合物中的电子供体CPDT也具有溴化侧链,以允许侧链后官能化。如方案2所示,NDCP(PNC21、PNC11和PNC12)通过与二甲胺和3-溴甲基苯基硼酸(PBA)的两步反应转化为苯基硼酸修饰的非共轭链段掺杂共轭聚电解质(NDCPE:PNC21BA、PNC1BA、PNC12BA)。还合成了传统的CP(PCP)和苯基硼酸改性的共轭聚电解质(PCPBA),其中BBTD作为电子受体,CPDT作为电子供体。
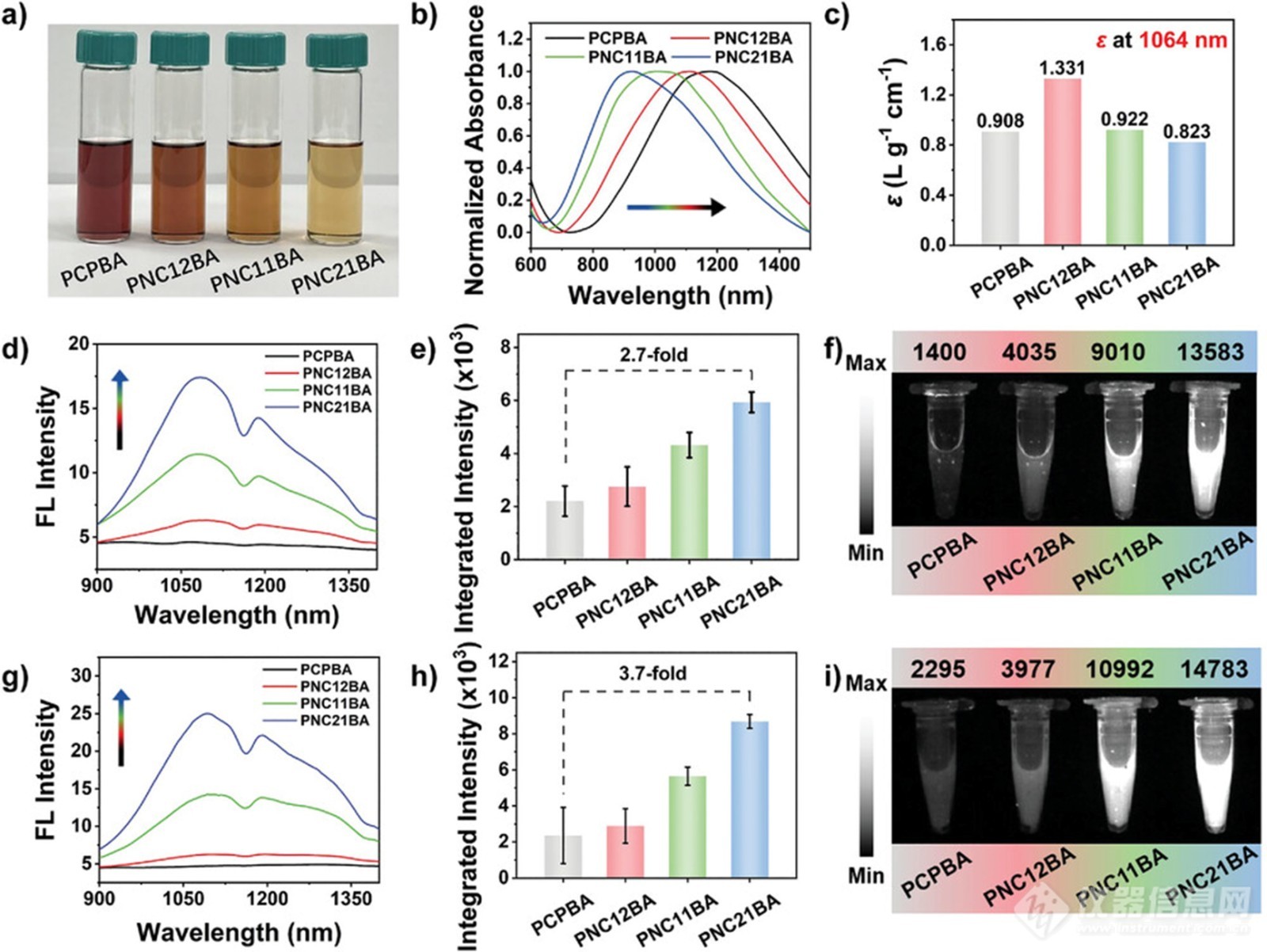
图1. DCM中NDCPEs(PCPBA、PNC12BA、PNC11BA和PNC21BA)的特征
如图1a所示,NDCPEs(PCPBA、PNC12BA、PNC11BA和PNC21BA)完全溶解在二氯甲烷(DCM)(1.0 mg mL−1)中。图1b显示了DCM(0.1 mg mL-1)中NDCPEs的紫外-可见-近红外吸收光谱。所有四种NDCPE在800-1200nm处均表现出宽而强的吸光度。由于聚合物链中共轭长度的减少,从PCPBA到PNC21BA的聚合物骨架中的非共轭密度增加,吸收峰从1177 nm蓝移到925 nm。NDCPEs的光谱特性与NDCPs的光谱特性相似。如图1c所示,PCPBA、PNC12BA、PNC11BA和PNC21BA在1064 nm处的消光系数分别为0.908、1.331、0.922和0.823 L g−1 cm−1。DCM中聚合物在相同浓度下的NIR-II荧光光谱如图1d所示,掺杂PNC12BA、PNC11BA和PNC21BA聚合物的非共轭链段显示出类似的NIR-III发射光谱,并在1092 nm处有一个发射峰。相比之下,PCPBA没有独特的NIR-II发射光谱。NIR-II发射强度随着聚合物链中非共轭C6密度的增加而增加,在相同浓度下,从PNC12BA到PNC21BA在1092nm处增加了2.7倍(图1e)。图1f中的NIR-II荧光成像结果显示,PNC21BA在相同浓度下发出的信号最强,是PCPBA的9.7倍。值得注意的是,当808 nm吸收强度归一化时,NDCPE的NIR-II荧光强度随着非共轭C6单元掺杂密度的增加而逐渐增加(图1 g)。PNC21BA的最大发射峰的NIR-II荧光强度和成像强度分别比PCPBA强约3.7倍和6.4倍(图1h,i)。这些发现表明,在共轭骨架中掺杂非共轭单体可以提高共轭聚合物的NIR-II发射。
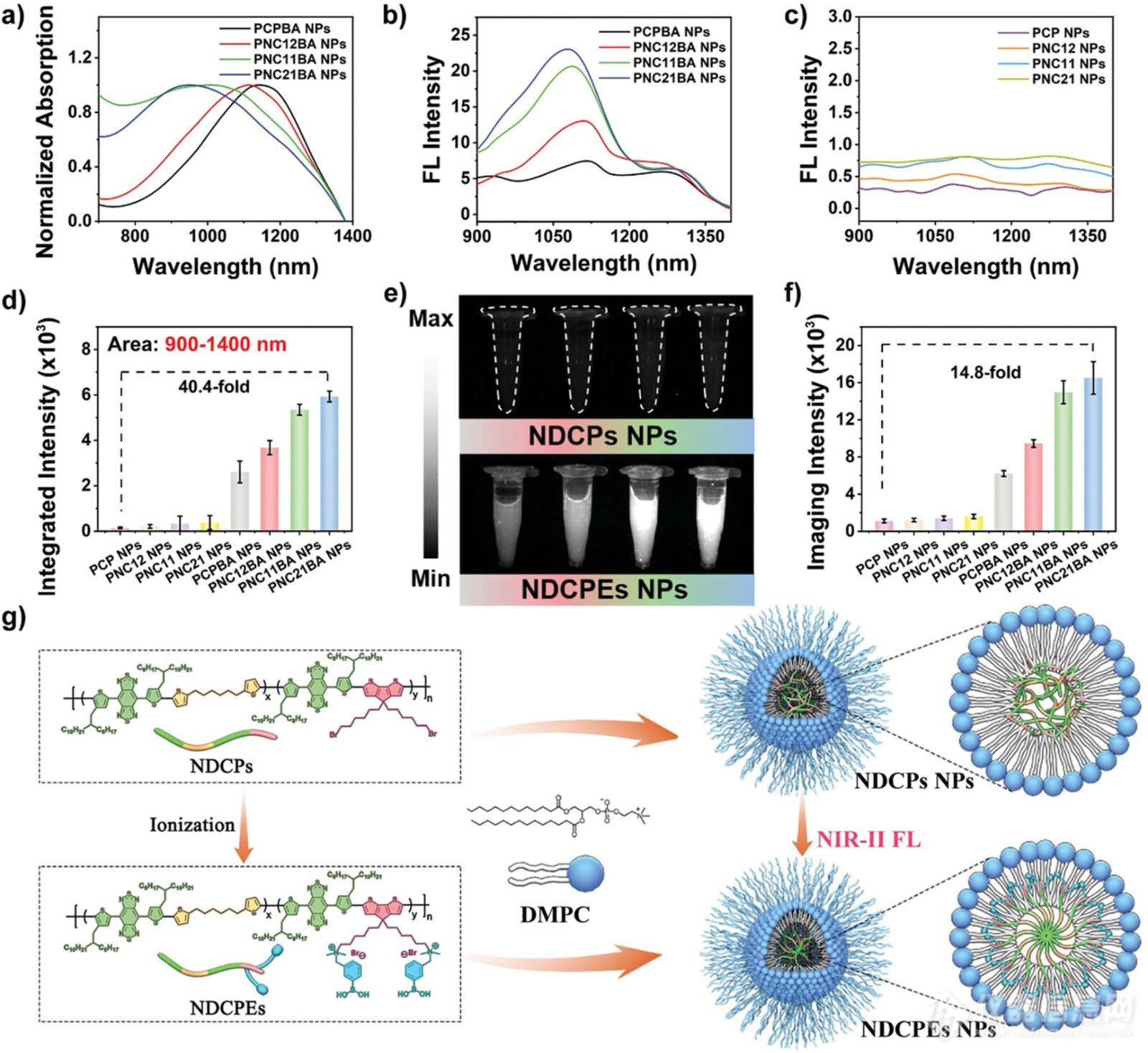
图2. NDCPEs NPs(PCPBA NPs、PNC12BA NP、PNC11BA NP和PNC21BA NP)的表征
先前报道的共轭聚合物表现出ACQ,并显著降低了NIR-II FL强度,使其难以用于生物医学成像应用。苯基硼酸修饰的NDCPE被包裹在两亲性脂质体(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱,DMPC)中,通过纳米沉淀形成水溶性纳米粒子(PCPBA NPs、PNC12BA NPs、PN 11BA NPs和PNC21BA NPs)。还使用类似的方法制备了四种NDCPs NPs(PCP NPs、PNC12 NPs、PNC11 NPs和PNC21 NPs)进行比较。在溶液中,这些水溶性纳米粒子表现出颜色。如图2a所示,这些纳米粒子都具有980至1350 nm的宽NIR-II吸收光谱。相比之下,与PCP NPs、PNC12 NPs、PNC11BA NsP和PNC21BA NPs相比,PCPBA NPs、PNC12BA NPs、PNC11NPs和PNC21NPs红移。此外,在八个纳米颗粒的NIR-II荧光光谱中观察到差异(图2b,c)。只有NDCPEs NP表现出明显的NIR-II荧光,这表明NDCPEs在脂质体纳米颗粒中的聚集曲线可能较低,NIR-II发射也有所改善。更重要的是,NDCPE中非共轭链段密度的增加导致水溶性纳米颗粒的NIR-II FL强度更高,PNC21BA NPs的NIR-III发射强度最强(比PCP NPs强40.4倍)(图2d)。图2e、f中的NIR-II FL成像结果表明,PNC21BA NPs在相同浓度下发出最强的信号,与PCP NP相比提高了14.8倍。同样,PNC21BA NPs在相同的808 nm吸光度下具有最强的NIR-II发射强度。比较了PCPBA NPs、PNC12BA NPs、PN 11BA NPs和PNC21BA NPs在水溶液中的NIR-II荧光强度与DCM中相同浓度的PCPBA、PNC12 BA、PNC11 BA和PNC21B A的NIR-III荧光强度,以测量淬灭程度。PCPBA NPs在水溶液中的NIR-II FL强度达到DCM中聚合物水平的60%,表明NDCPE的NIR-III荧光大部分保留在纳米颗粒中,只有适度的淬灭。PNC21BA NPs的荧光为105%,而PCPBA NPs为60%,这支持了聚合物骨架中的非共轭片段减少NIR-II荧光淬灭的假设。这些结果还表明,通过调节聚合物骨架中非共轭链段的密度,可以微调NDCPEs NPs的NIR-II发射特性。NIR-II光学性质的差异表明,NDCPEs侧链中的阳离子PBA修饰通过两亲性脂质体之间的离子相互作用抑制分子间聚集,对NIR-II荧光有显著影响(图2g)。
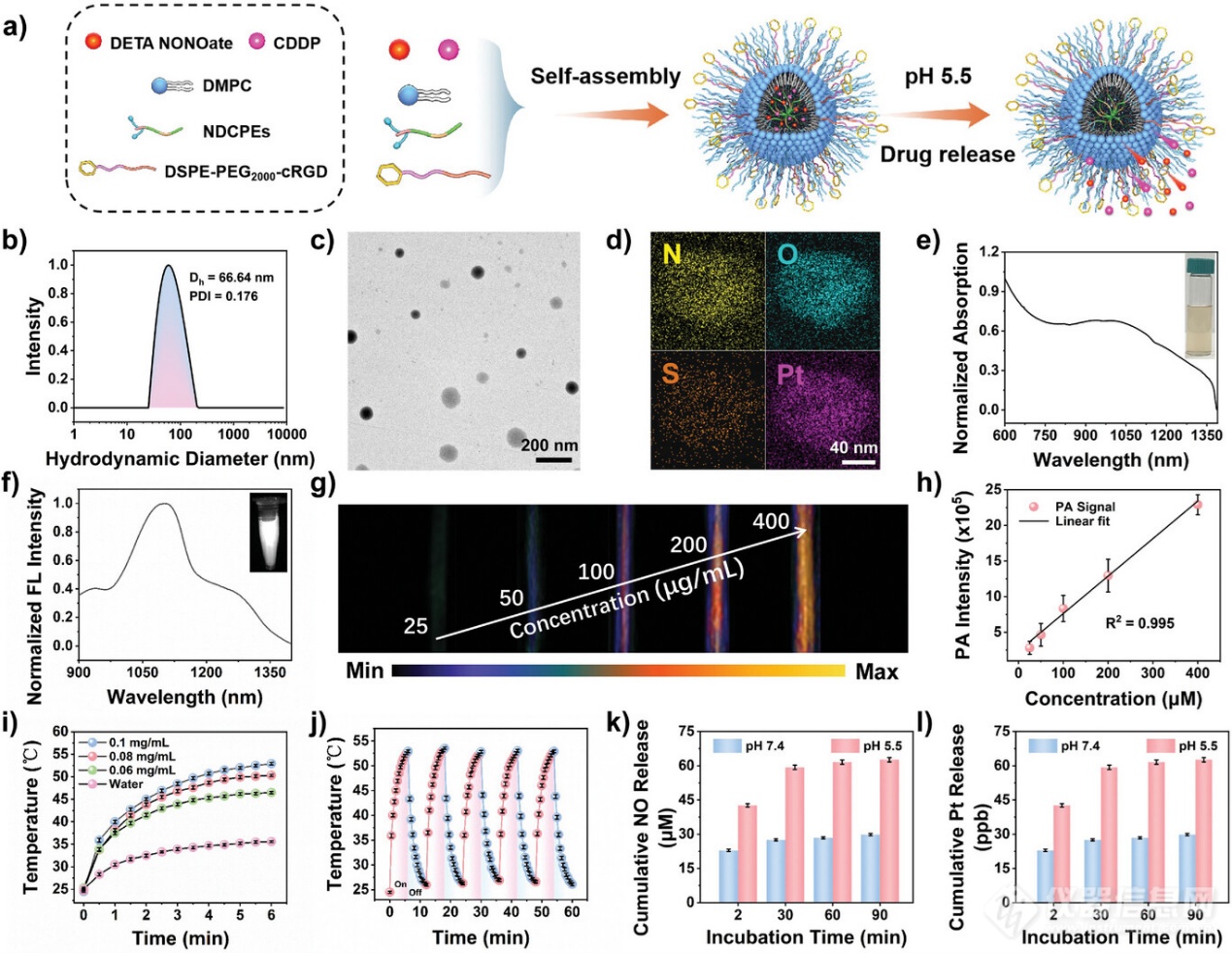
图3. PBT/NO/Pt在水溶液中的表征
鉴于 PNC11BA 出色的 1064 nm 消光系数和 PNC11BA NPs 明亮的 NIR-II 荧光,研究者利用它们制备光疗剂。PNC11BA 侧链上的 PBA 基团很容易通过供体-受体配位负载顺铂 (CDDP) 和 NO 供体(DETA NONOate)。如图 3a 所示,通过常规沉淀实现了 PNC11BA、CDDP、DETA NONOate、DMPC 和DSPE-PEG2000-cRGD 的自组装,得到了多功能光疗纳米粒子 (称为 PBT/NO/Pt)。CDDP 被负载在这些纳米粒子上作为化疗药物和 NOX 活性 O2•−发生器。DETA NONOate 被选为 pH 响应的 NO 供体。制备了仅负载DETA NONOate 或 CDDP 或不负载 DETA NONOate 和 CDDP 的 PNC11BA NPs 作为对照(表示为 PBT/NO、PBT/Pt 和 PBT)。动态光散射 (DLS) 表明 PBT/NO/Pt 的流体动力学直径 (Dh) 为 66.64 nm,PDI低至 0.176(图 3b)。所得 PBT/NO/Pt 具有球形纳米颗粒,通过透射电子显微镜 (TEM) 测量其直径为 80 nm(图 3c)。能量色散 X 射线元素映射 (EDS) 显示 Pt 元素在纳米粒子中分布良好,表明 CDDP 负载成功(图 3d)。根据微孔板读数仪和电感耦合等离子体质谱仪(ICP-MS)获得的不同浓度的标准曲线,计算出DETA NONOate 和 CDDP 在 PBT/NO/Pt 中的负载效率分别为 5.42% 和 3.18%。
如图 3e 所示,水溶液中的 PBT/NO/Pt 在 800-1350 nm 处表现出强烈的 NIR 吸收,在 1064 nm 处的消光系数为 1.195 L g-1 cm-1。在水溶液中 808 nm 光激发下,PBT/NO/Pt 显示出强烈的 NIR-II 荧光,中心位于 1101 nm,长尾延伸至 1350 nm(图 3f)。NIR-II FL 强度在 60 分钟内几乎保持恒定(808 nm,0.5 W cm-2),表明 PBT/NO/Pt 具有光稳定性。图 3g 显示了不同浓度下 PBT/NO/Pt 的 NIR-II PA 图像。NIR-II PA 信号与 NPs 浓度表现出良好的线性关系(图 3h)。在 1064 nm 激光辐照(1.0 W cm−2)下验证了 PBT/NO/Pt 的光热性能。如图 3i 所示,水溶液的温度随 PBT/NO/Pt 浓度的增加而升高。例如,在 0.1 mg mL−1 PBT/NO/Pt 下,温度在 6 分钟内升高到 53 °C,PCE 计算为53.65%。此外,还忠实证明了 PBT/NO/Pt 在光热作用下的稳定性,在五次光开/关照射循环中,PBT/NO/Pt 溶液的温度变化小于 2 °C(图 3j)。
接下来探索了 PBT/NO/Pt 中 DETA NONOate 和 CDDP 的酸响应释放曲线。使用典型的 Griess 测定法来量化 pH 7.4 和 pH 5.5 水溶液中 DETA NONOate 的释放。如图 3k 所示,在 pH 7.4 下,90 分钟后PBT/NO/Pt 中 NO 的生成量最小。相反,在 pH 5.5 下,90 分钟后 NO 释放量超过 60 µm,反映了 DETA NONOate 和 PBA 基团之间供体-受体配位相互作用在酸反应下解离以及 DETA NONOate 降解。在酸反应下从 PBT/NO/Pt 中释放 CDDP 是此设计中的关键步骤,因为 CDDP 只能在弱酸性细胞内环境中激活 NOX 产生 O2•−。通过 ICP-OES 评估了 PBT/NO/Pt 中 CDDP 的释放情况(图 3l),结果表明 pH 值为 7.4 时,90 分钟后 CDDP 释放量可忽略不计,而 pH 值为 5.5 时,由于氨基和 PBA 基团的加速解离,CDDP 释放量超过 60%。这些结果表明,PBT/NO/Pt 中不利的 DETA NONOate 和 CDDP 泄漏在血液循环过程中可能受到限制,从而支持 NO 和 CDDP 在酸性肿瘤组织和癌细胞中的靶向释放。
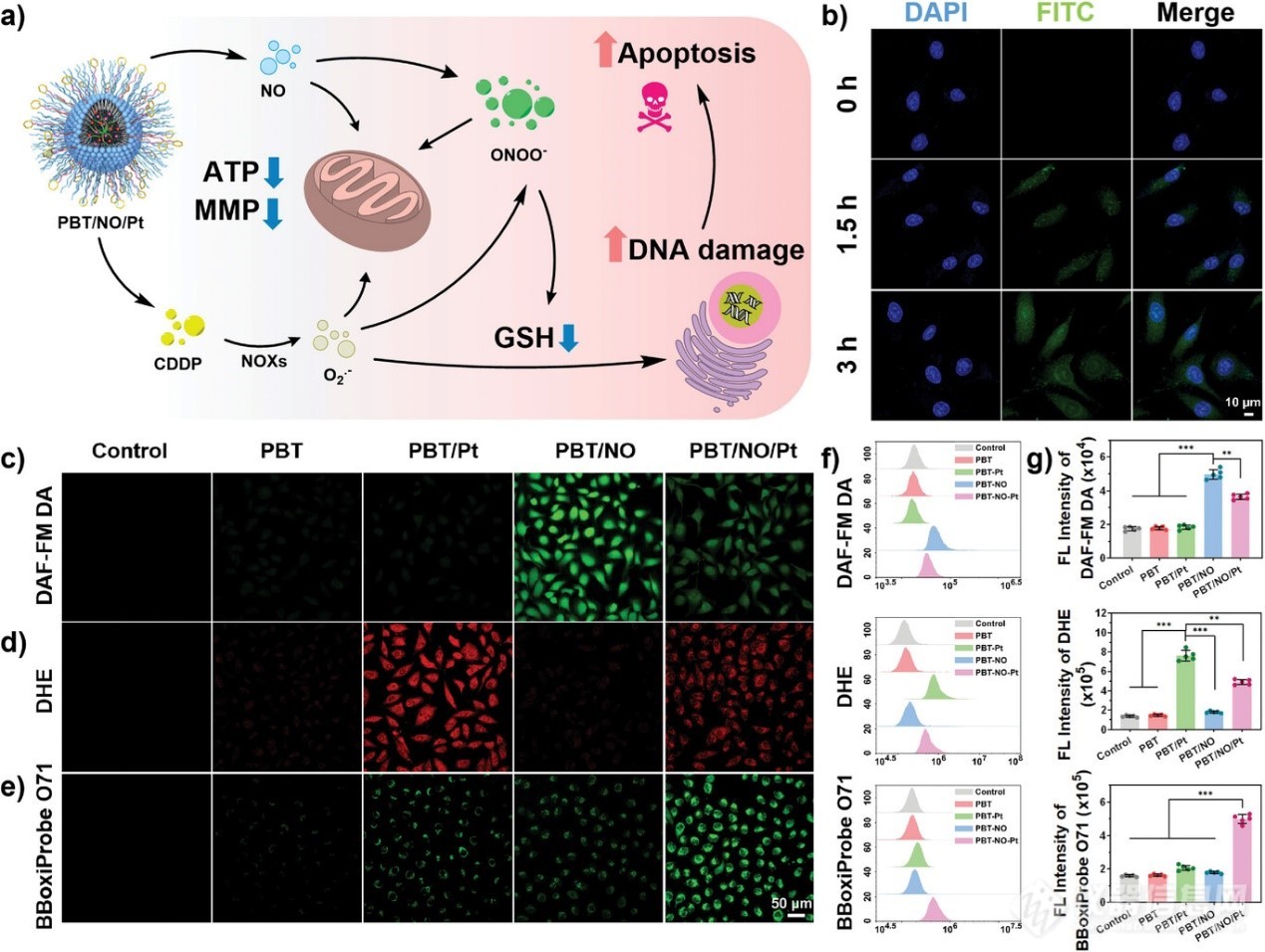
图4. 细胞内生成 NO、O2•− 和 ONOO−
图 4a 显示了细胞内 NO、O2•−和 ONOO−的产生方式。首先通过共聚焦激光扫描显微镜 (CLSM) 和流式细胞术检查 PBT/NO/Pt 的细胞摄取情况。与载有 FITC 染料的 PBT/NO/Pt 孵育 1.5 小时后,在 SKOV3/DDP 细胞中发现大量绿色荧光。孵育时间延长至 3 小时后观察到更强的绿色荧光,表明 PBT/NO/Pt 进入细胞(图 4b)。鉴于已证实酸触发的 NO 生成和 CDDP 释放,随后监测细胞内 NO、O2•−和原位 ONOO−形成。使用商用 NO 荧光探针(DAF-FM DA) 评估细胞内 NO 水平。如图 4c 所示,SKOV3/DDP 细胞与 PBT/NO/Pt 和 PBT/NO 孵育 3 小时后,由于DETA NONOate 在酸的作用下分解,观察到更强的绿色荧光。相比之下,PBT/Pt 和 PBT 处理的 SKOV3/DDP 细胞和对照表现出非常弱的荧光,表明这些纳米颗粒没有产生 NO。CDDP 在酸性细胞内环境中释放,然后催化 NOX s产生 O2−。作者使用O2•−探针二氢乙锭 (DHE) 监测了 SKOV3/DDP 细胞中的细胞内 O2•−水平。如图 4d 所示,在PBT/NO/Pt 和 PBT/Pt 处理的SKOV3/DDP 细胞中观察到明显的红色荧光 (O2•−),表明细胞内 O2•−生成效率高。然而,由于缺乏 CDDP,在 PBT/NO 和 PBT 处理的SKOV3/DDP 细胞和对照中未检测到红色荧光。NO 和 O2•−结合产生 ONOO−,因此,使用商业探针 BBoxiProbe O71 测量细胞内 ONOO−。如图 4e 所示,与 PBT/NO 和PBT/Pt 一起孵育的 SKOV3/DDP 细胞分别由于缺乏 O2•−和 NO 而未显示出明显的绿色荧光。正如预期的那样,在与 PBT/NO/Pt 一起孵育的 SKOV3/DDP 细胞中观察到了绿色荧光,表明通过原位产生 NO 和 O2•−产生了丰富的 ONOO−。通过流式细胞分析进一步定量统计研究了PBT、PBT/NO/Pt、PBT/NO和PBT/NO/Pt处理的SKOV3/DDP细胞内NO、O2•−和ONOO−的生成情况(图4f,g),这与上述CLSM成像结果一致。
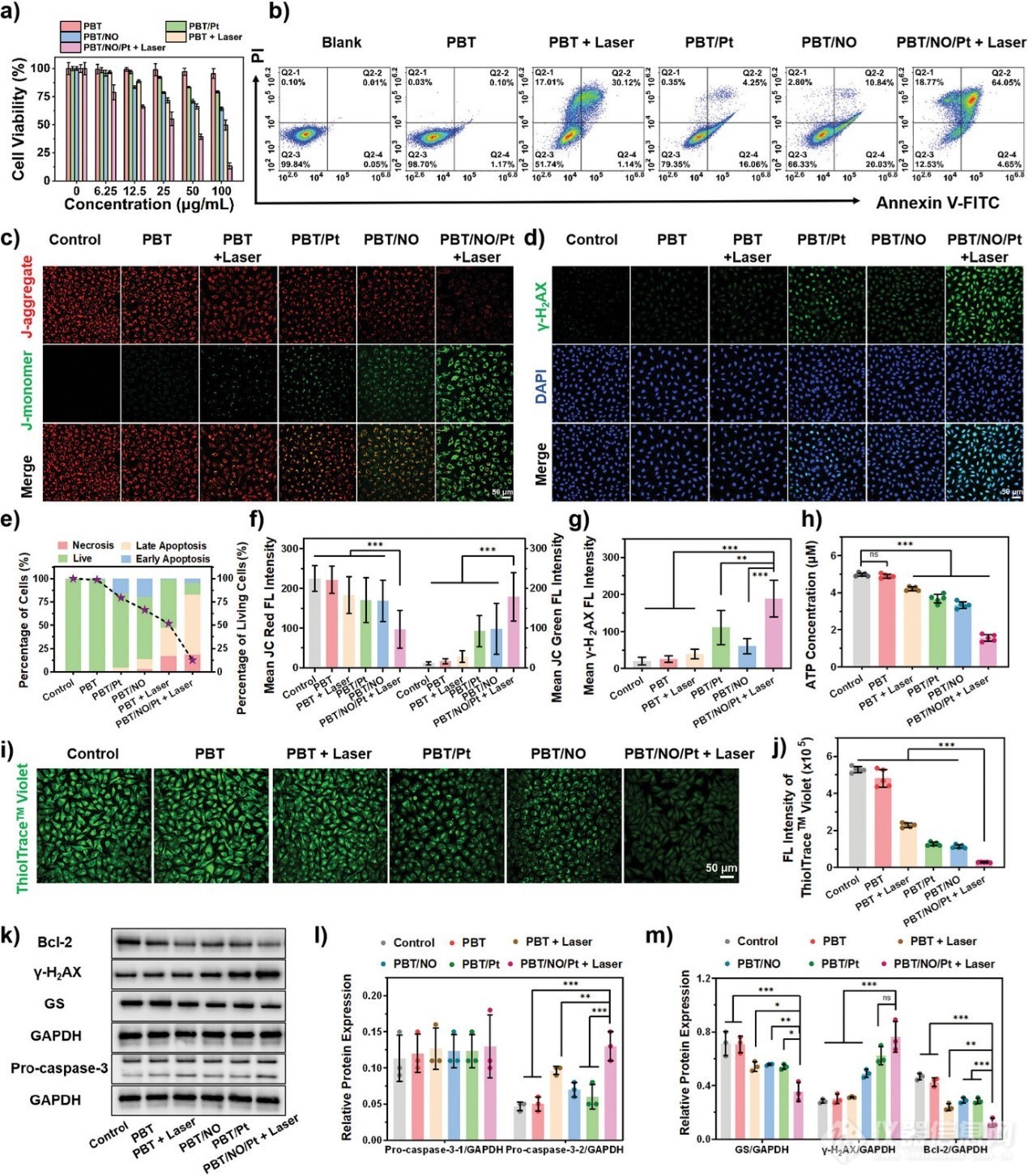
图5. 体外评价PBT/NO/Pt在SKOV3/DDP细胞中的抗癌活性及机制
PBT/NO/Pt 引发癌细胞中 NO、O2•−和 ONOO−的形成。通过甲基噻唑基四唑 (MTT) 测定法测试了 PBT/NO/Pt 在 SKOV3/DDP 细胞中的抗癌作用。如图 5a 所示,PBT 处理组的细胞存活率略有下降。相反,在 100 µg mL−1下,PBT/Pt、PBT/NO 和 PBT + 激光处理的 SKOV3/DDP 细胞中的存活率分别下降至 79.1%、64.3% 和 49.8%。在所有组中,1064 nm 激光(6 分钟,1.0 W cm−2)处理的 PBT/NO/Pt 组表现出最强的抑制作用(细胞存活率下降至 13.38%),证明了 PBT/NO/Pt 中 NIR-II PTT 和 ONOO−的优异协同作用。还通过流式细胞术分析了 PBT/NO/Pt 诱导的细胞凋亡和坏死(图 5b),结果表明 PBT/NO/Pt + 激光组的细胞毒性最大,凋亡率最高,约为 87%。相反,PBT/NO、PBT/Pt 和 PBT + 激光仅诱导中等程度的细胞凋亡。这些结果表明 PBT/NO/Pt 通过共递送 NO 和 CDDP 以及原位生成ONOO−在 SKOV3/DDP 细胞中具有有效的抗癌活性(图 5e)。
为了直观地了解 PBT/NO/Pt 的治疗效果,通过 JC-1 染色评估了线粒体损伤。共聚焦成像和定量分析显示,PBT/NO/Pt + 激光治疗组出现了最亮的绿色荧光,表明线粒体膜电位丧失;流式细胞术也获得了类似的结果(图 5c、f)。PBT/NO/Pt + 激光组的细胞内 ATP 水平下降(约 30%),可能是由于线粒体功能受到抑制(图 5h)。使用 γ-H2AX(DNA 双链断裂的常规标记物)评估 PBT/NO/Pt 造成的 DNA 损伤程度。在 PBT/NO/Pt + 激光细胞中观察到最亮的绿色荧光,表明 CDDP-DNA 加合物有效形成,ONOO−造成的 DNA 损伤更严重(图 5d、g)。随后,在SKOV3/DDP细胞中探究了PBT/NO/Pt的治疗机制。早先有报道称,CDDP可以形成Pt-GSH复合物并减少CDDP-DNA加合物的生成,从而诱导CDDP的解毒。用ThioTracker Violet测量了PBT/NO/Pt形成ONOO−对SKOV3/DDP细胞内GSH的影响。在图5i中,在空白对照和PBT、PBT/NO和PBT/Pt处理的SKOV3/DDP细胞中观察到明亮的绿色荧光。相比之下,PBT/NO/Pt+激光处理的SKOV3/DDP细胞显示出明显较少的绿色荧光,表明GSH含量损失。流式细胞术和定量分析也得到了类似的结果,表明PBT/NO/Pt+激光降低了细胞内GSH(图5j)。因此,ONOO−下调细胞内 GSH,从而改善 CDDP 与靶DNA 的结合并促进癌细胞凋亡。
通过蛋白质印迹法研究了相关蛋白(Pro-caspase-3、Bcl-2、γ-H2AX和 GS)的表达(图 5k、l、m)。在用 PBT/NO/Pt 和 1064 nm 光处理的 SKOV3/DDP 细胞中,裂解的 caspase-3 表达显著诱导,Bcl-2 下调,表明更多细胞开始凋亡(图 5k、l)。正如预期的那样,γ-H2AX和 GS 的表达与之前的结果一致,解释了为什么PBT/NO/Pt + 激光照射会造成更严重的 DNA 损伤。这些结果证实,原位 ONOO−生成下调了细胞内 GSH,增加了 CDDP–DNA 加合物和裂解的 caspase-3 的水平,从而促进了细胞凋亡。
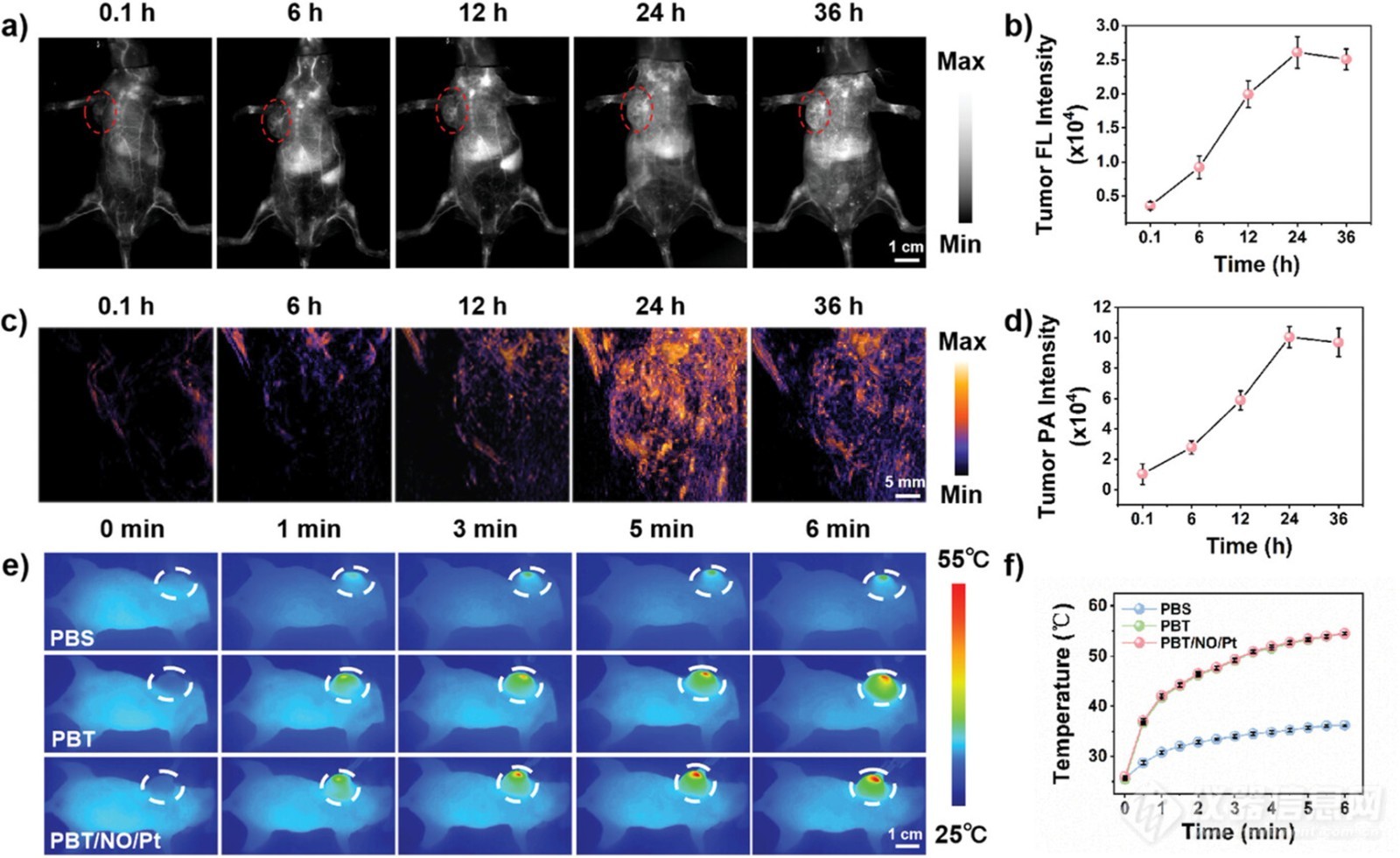
图6. SKOV3/DDP 荷瘤小鼠体内 NIR-II FL、NIR-II PA 和光热成像
研究了 PBT/NO/Pt 的体内抗癌效率。在体内实验之前,通过 NIR-II FL 和 NIR-II PA 成像系统可视化了肿瘤部位的 PBT/NO/Pt 积累。SKOV3/DDP 肿瘤异种移植小鼠接受静脉注射 PBT/NO/Pt(150 µL,2.0 mg mL−1),并在注射后 0.1、6、12、24 和 36 小时获取图像。如图 6a、c 所示,肿瘤部位的 NIR-II FL 和 NIR-II PA 信号在 6 小时时变亮,并在 24 小时时达到最大值。通过上述实验得出结论,NIR-II FL 和 NIR-II PA 成像可以为 1064 nm 激光治疗提供精确指导。图 6b、d 显示了肿瘤部位的定量成像分析,其中 NIR-II FL 和 NIR-II PA 中的成像强度分别比注射前高 7.3 倍和 9.4 倍,表明 PBT/NO/Pt 通过增强渗透性和保留 (EPR) 效应在肿瘤部位积累。注射后 24 小时,获得了肿瘤和主要器官的 NIR-II FL 和 NIR-II PA 图像。离体数据显示,肿瘤部位积累的 PBT/NO/Pt 比其他组织(包括代谢器官)更多。此外,在注射 PBT/NO/Pt 后 24 小时对肿瘤部位进行了典型的体内光热成像(图 6e、f)。1064 nm 激光照射(1.0 W cm−2)后肿瘤温度逐渐升高,并在约 6 分钟时达到峰值 53 °C。在用 PBS 治疗的肿瘤小鼠中,没有检测到明显的体温升高。
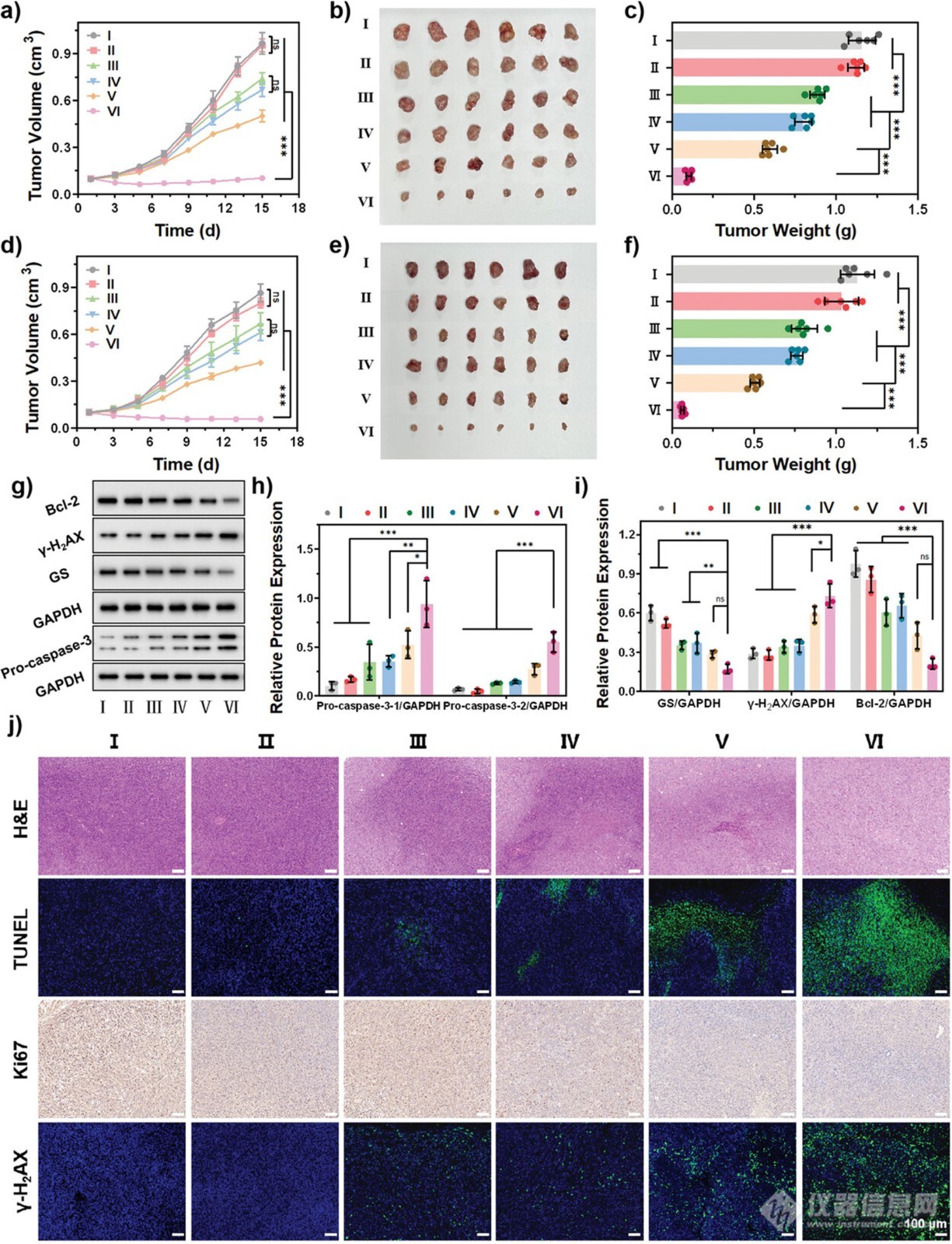
图7. 对SKOV3和SKOV3/DDP肿瘤小鼠的体内肿瘤抑制作用
在两种皮下肿瘤模型(SKOV3 和 SKOV3/DDP 异种移植裸鼠)中评估了 PBT/NO/Pt 的体内癌症抑制作用。荷瘤小鼠随机分为六组:(I)对照组、(II)PBT、(III)PBT/Pt、(IV)PBT/NO、(V)PBT + 激光和(VI)PBT/NO/Pt + 激光。静脉注射 PBS、PBT、PBT/Pt、PBT/NO 或 PBT/NO/Pt(150 µL,2.0 mg mL−1)后,每 2 天监测一次肿瘤大小。注射后 24 小时,PBT + 激光和 PBT/NO/Pt + 激光组的肿瘤部位暴露于 1064 nm 激光(1.0 W cm−2)照射 6 分钟。如图7a所示,15 天后,与对照组(肿瘤体积增加 10.2 倍)相比,PBT/Pt 表现出非常弱的抗癌效果(肿瘤体积增加 7.4 倍)。PBT/NO 和 PBT + 激光组的肿瘤体积分别增加了 7.0 倍和 5.2 倍,表明单一 NO 气体和 NIR-II PTT 疗法比 PBT/Pt 提供更好的肿瘤生长抑制效果。与此形成鲜明对比的是,由于 Pt、NO 和 NIR-II PTT 以及ONOO−爆发的协同作用,PBT/NO/Pt + 激光产生了最佳的肿瘤抑制能力。15 天后,从每组中切除肿瘤并成像(图 7b)。还记录了收集的肿瘤的重量和体积。对照组、PBT组、PBT/Pt组、PBT/NO组、PBT+激光组和PBT/NO/Pt+激光组的平均肿瘤重量分别为1.16、1.12、0.89、0.80、0.60和0.10 g,证明了1064 nm激光照射后PBT/NO/Pt具有显著的抑癌活性(图7c)。图7d-f说明了PBT/NO/Pt+激光对SKOV3/DDP荷瘤小鼠的突出癌症抑制作用。进一步检测到第15天分离的SKOV3肿瘤中凋亡相关蛋白(Pro-caspase-3、Bcl-2、γ-H2AX和GS)的表达(图7g、h、i)。与之前的结果一致,PBT/NO/Pt+激光下调了GSH,导致更严重的DNA损伤,并抑制了肿瘤的生长。
为了探索 PBT/NO/Pt 的肿瘤抑制能力,通过苏木精-伊红 (H&E) 染色、末端脱氧核苷酸转移酶 dUTP 缺口末端标记 (TUNEL) 染色、免疫组织化学 (Ki-67 抗体染色) 和 γ-H2AX 免疫荧光染色分析了组织切片。如图 7j 所示,PBT/NO/Pt + 激光诱导最强的凋亡反应、肿瘤抑制和 DNA 损伤,验证了 PBT/NO/Pt 的放大治疗效果。这些结果表明,PBT/NO/Pt 共同递送的 CDDP 和 DETA NONOate 通过产生 ONOO− 以及 Pt、NO 和 NIR-II PTT 的协同作用导致 DNA 损伤和细胞凋亡。
在这项工作中,开发了一个光疗平台 PBT/NO/Pt,并展示了临床应用潜力的几个优势。共轭聚合物 PNC11BA 具有内在的生物相容性,可以通过合理设计聚合物主链实现生物降解性。PBT/NO/Pt 对肿瘤微环境中表达的酸性和高 NOX 表现出优异的选择性和敏感性,有利于消除具有多药耐药性的癌症。 PBT/NO/Pt具有优异的光稳定性和胶体稳定性。
本文构建了一种 NIR-II 光触发多功能 ONOO− 纳米发生器 (PBT/NO/Pt),用于在 NIR-II FL/NIR-II PA 成像引导下进行协同 NIR-II PTT/化疗/过氧亚硝酸盐治疗。PBT/NO/Pt 在 1064 nm 激光辐照下表现出强 NIR-II 吸收、优异的 NIR-II 荧光发射、强烈的 NIR-II PA 信号和优异的 PCE (η = 53.65%)。此外,PBT/NO/Pt 到达肿瘤部位,肿瘤微环境中的酸性和高浓度 NOX 使 NO 和 O2•− 同时释放,随后原位形成 ONOO−。这种原位生成 ONOO− 通过下调细胞内 GSH 和增加 DNA 损伤对SKOV3/DDP 细胞具有显着的抗癌作用。体外和体内研究表明,在 ONOO− 和化疗增强的 NIR-II PTT 下,PBT/NO/Pt 具有显著的抗 SKOV3 和 SKOV3/DDP 肿瘤抑制作用。因此,开发的 NIR-II 光激发多功能 ONOO−纳米发生器是治疗耐药性肿瘤的一种有前途的策略。
参考文献
Sun P, Hu D, Chen P, et al. Anti‐Quenching NIR‐II Excitation Phenylboronic Acid Modified Conjugated Polyelectrolyte for Intracellular Peroxynitrite‐Enhanced Chemo–Photothermal Therapy[J]. Advanced Science, 2024: 2309446.
⭐️ ⭐️ ⭐️
动物活体荧光成像系统 - MARS
In Vivo Imaging System
有不同型号的样机可以测试,
请联系:021-61620699
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影医疗科技有限公司,被评为“国家高新技术企业”,荣获“科技部重大仪器专项立项项目”,上海市“科技创新行动计划”科学仪器领域立项单位。
恒光智影,致力于为生物医学、临床前和临床应用等相关领域的研究提供先进的、一体化的成像解决方案。
专注动物活体成像技术,成像范围覆盖 400-1700 nm,同时可整合CT, X-ray,超声,光声,光热成像等技术。
可为肿瘤药理、神经药理、心血管药理、大分子药代动力学等一系列学科的科研人员提供清晰的成像效果,为用户提供前沿的生物医药与科学仪器服务。
上海恒光智影医疗科技有限公司
地址:上海市浦东新区张江高科碧波路456号 B403-3室
网址:www.atmsii.com
邮箱:liupq@atmsii.com
电话:137 6102 1531 (同微信)
更多![]()
NIR-II激发的抗淬灭苯硼酸改性共轭聚电解质利用细胞内过氧亚硝酸盐增强化学-光热
厂商
2024.09.11
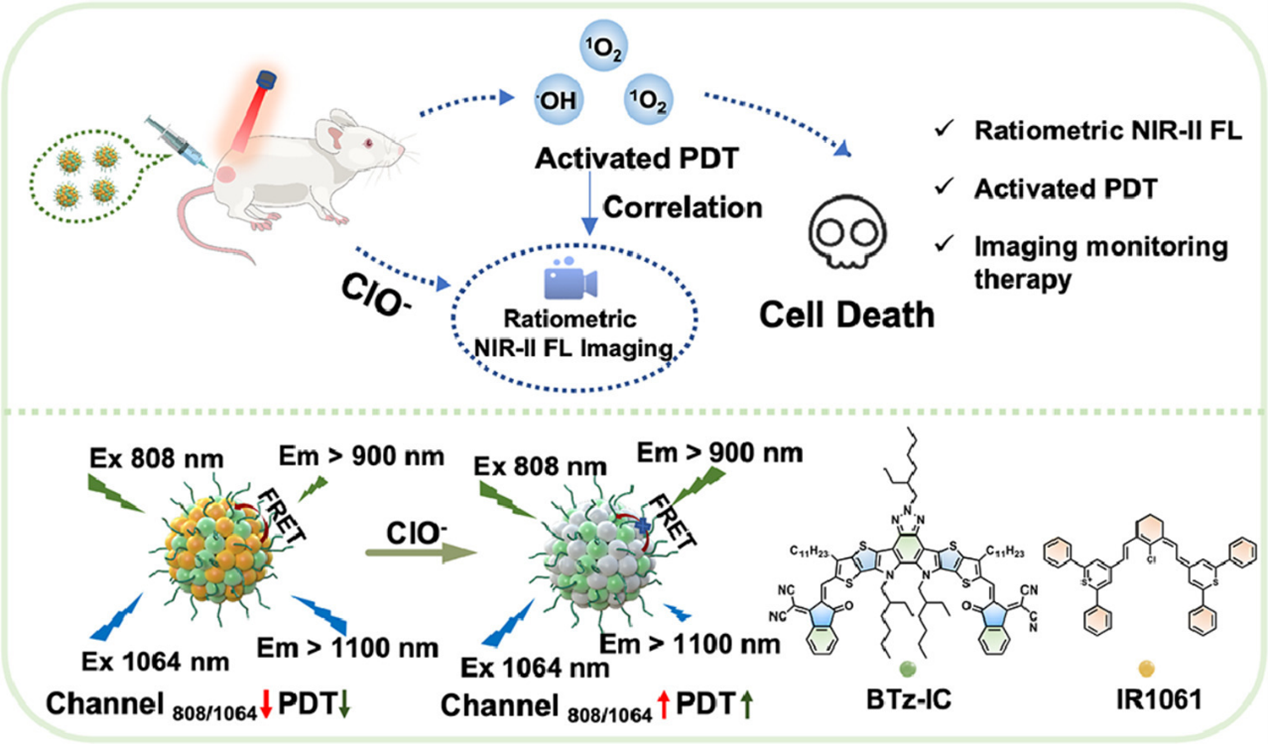
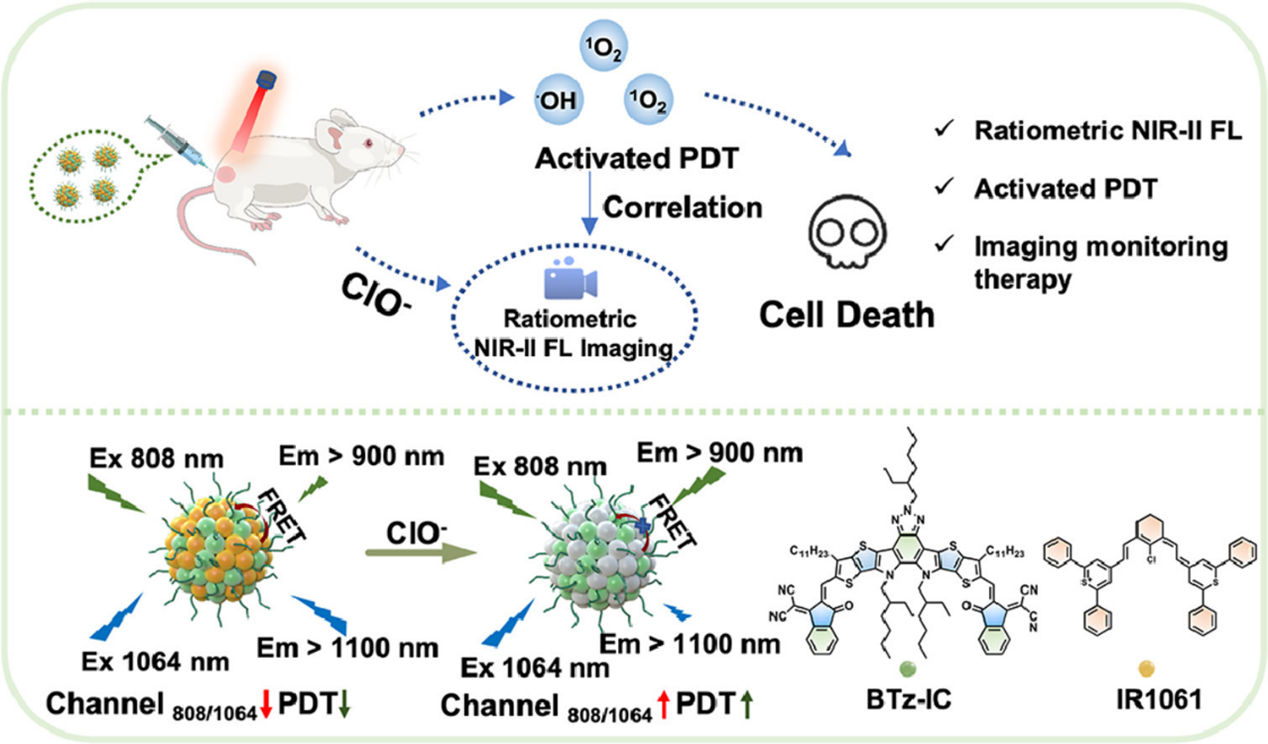
利用成像监测肿瘤激活光动力疗法的比例NIR-II荧光有机纳米探针
厂商
2024.09.04
利用成像监测肿瘤激活光动力疗法的比例NIR-II荧光有机纳米探针
厂商
2024.09.04
可变外周配体供体调节四硫富瓦烯四硫醇双自由基的电子结构和NIR-II发射
厂商
2024.08.27