选出您心目中的“中国学者研究奖”!
“使蛋白质分析更简单”是ProteinSimple一直以来的愿景。40多年来,Western Blot技术已成为实验室常规且经典的蛋白质表达定量分析技术。作为让科研人员又爱又恨的实验技术,却一直没有突破性的变革。 近年来,知名学者文章中WB图片的误用和造假风波,让科学群体对传统WB技术信心备受打击。ProteinSimple,我们决心改变传统WB窘境,推出全自动Digital Western Blot技术,让您从此享受Western! Digital Western Blot自上市以来,已被国内数百家领先实验室所采用,受到来自科研和工业界用户广泛的喜爱和认可。为了展示中国用户丰硕的研究成果,我们发起了2021年度中国学者研究奖评比活动。 本次活动,共收集到21份作品,进入网络投票环节。让我们走进他们的故事,投出您宝贵的一票!长按下方二维码,即可参与投票覆盖研究方向基于细胞/药物治疗的神经损伤修复、彩色獭兔毛色形成机制、中医药抗肿瘤药理、外泌体、肠道干细胞命运决定机制解析及营养干预、肠道炎症、天然产物抗肿瘤分子药理学、肿瘤发展及肿瘤微环境、类风湿关节炎发病机制、干细胞基础与临床研究、中医证候生物学基础、脂肪代谢疾病、生物工程遗传学、银屑病真皮间充质干细胞、白内障的病理机制、神经疾病及脑胶质瘤的发病机制......检测蛋白PI3K, p-PI3K, Akt, p-Akt, mTOR, p-mTOR, β-actin, p-p38 MAPK, MAPK, p-ERK1/2, ERK1/2, p-p65, p65, TNFR2, MITF-M, iNOS,COX2, JNK, ERK, NF-P65, NF-κBP65, p53, CD9, CD47, ALIX, TSG101, CCR6, IL-10, CTLA-4, aV, β-Tubulin, LCK, ZAP70, Lgr5, PCNA, KRT20, p-Nrf2, HO-1, NQO1, AMPK, pAMPK, NFkB. pNFkB, BAP31, Actin, Caspase3, Cleaved Caspase3, Caspase6, Cleaved Caspase6, Cyclin D1, Cyclin E1, Cyclin E2, Smad2, P-Smad2, Smad3, P-Smad3, SPTBN1, AIM2, TNF-ɑ, CD63, GPX4, PEBP1, VEGF, GLUT1, c-Myc, SCF, EGF, Pcaf, Acetyl-P53-K382, CREB, PP-1β, PP-2Aα, NCAM1, ICAM1......全自动Digital WB,为何自上市以来受到来自科研和工业界广泛的喜爱和认可?▪ 3ul样品量:解决稀缺样本蛋白质检测瓶颈,例如,干细胞,外泌体,激光显微切割样本,临床穿刺样本,分选细胞等等;▪ 高通量:单次可运行高达25个样本;▪ 全自动Western,无人为操作误差;▪ 快速检测,3小时出结果;▪ 覆盖2-440KD:小至2KD多肽、神经递质、细胞因子、激素等,大至440KD蛋白;▪ 多种检测模式:化学发光、双色荧光、总蛋白检测、总蛋白归一化。评比规则评比日期:2021年12月16日 - 2021年12月31日 12:00开奖日期:2022年1月1日评选规则:评比按照文章影响因子(IF)权重60%,网络投票评选权重40%;每个微信账户只能投1票长按下方二维码,即可参与投票每一份作品的背后,都凝集了科研工作者夜以继日的心血,对科学研究与卓越孜孜不倦的追求。快来为您喜欢的作品,投出宝贵的一票吧!参赛作品中影响因子(IF)基于Web of Science Journal Citation Reports 2020报告。
企业动态
2021.12.17
单细胞蛋白质分析技术Milo追踪定量不同iPSC-CM分化亚型
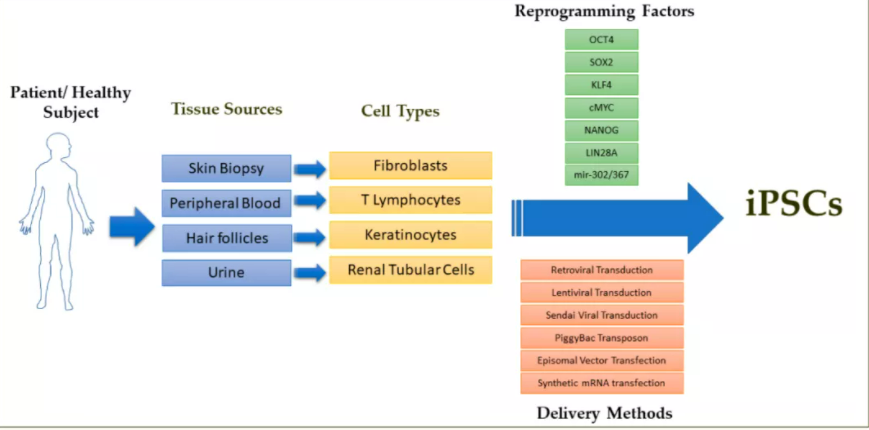
iPSC简介2006年Takahashi和Yamanaka突破性发现使终末分化、谱系受限的成体细胞:如皮肤活检来源的成纤维细胞、外周血来源的T淋巴细胞、毛囊细胞等,通过转录因子OCT4、SOX2、KLF、c-MYC、NANOG和LIN28的强制异位表达直接将其重编程为多能状态的细胞,这些细胞被称为诱导多能干细胞(induced pluripotent stem cells, iPSC)。iPSC与胚胎干细胞(Embryonic Stem Cells, ESC)有相似的基因表达、表观遗传谱和分化潜能,可产生任何类型的体细胞。并且避免了ESC基于使用胚胎来源细胞和可能导致异常发育的体外受精胚胎的伦理问题,因此iPSC在医疗领域里具有更好的应用和产业化发展前景。iPSC应用和挑战描述任何人类疾病和药物发现的病因学和病理生理学的主要关键组成部分是需要一个生理相关的疾病实验模型,无论是体外还是体内或两者,需要忠实地概括各自的病理生理学和临床表现。因此基于人类iPSC的疾病模型可以无限供应临床相关的表型细胞、以及它们具有的衍生潜力,可以加速阐明生物医学研究中疾病的病因机制,应用于新药发现、药物效价测试、预测药物安全性药理学/毒理学研究,以及基于iPSC的再生细胞疗法,有望治疗心脏病、帕金森、视网膜和角膜疾病、肝脏衰竭、糖尿病、脊髓损伤等疾病。然而将iPSC治疗方法真正有效转化为临床环境,保证患者安全,还需解决:临床级iPSC的衍生和通用细胞系的生物库建立;需要定义iPSC及其差异化治疗细胞产品可接受质量属性;致瘤性问题;免疫排斥反应;选择同种异体或自体 iPSC 以获得更有效的细胞治疗的难题;iPSC 谱系表型细胞和细胞系变异的异质性;基于iPSC的多基因、散发性和迟发性疾病的患病模型的挑战;需要大量的患者iPSC以实现更有效的病因学和临床转化;iPSC衍生的表型细胞缺乏成熟度;遗传的不稳定性等挑战。iPSC-CM研究和面临的问题心血管疾病(cardiovascular disease,CVD)作为全球主要的死因之一,每年会导致约1790万人死亡,所以迫切需要可以延缓疾病进展并且可以改善心脏功能和预防衰竭的治疗方法。而目前的药物、介入或手术方法可能会改善临床结果,但由于无法促进心脏组织修复和再生,因此使这种治疗方法的成功率得不到提升。人类诱导多能干细胞(hiPSC)技术的出现以及随后在培养物中分化和建立心肌细胞(cardiomyocytes,CMs)的能力,为实现人类心脏再生疗法创造了可能性。作为分化CMs的连续和生物学相关来源,hiPSC-CM是心血管研究界的宝贵工具,不仅可用于治疗CVD,还可用于模拟人类心脏发育和疾病、研究潜在机制以及筛选具有疗效和心脏毒性的新药。由于hiPSC-CM由不同的细胞亚群组成,这些细胞亚群是异质的、未成熟的、表达胎儿基因表达谱,并且与成人心肌细胞相比收缩力减少,因此hiPSC-CM疾病模型的准确性和实用性仍然有限。此外,随着hiPSC-CMs的成熟和蛋白质表达动态的波动,大量样品分析的分辨率变得不足。由于其异质性导致心室样、心房样和节点样亚群,需要严格表征hiPSC-CM,并应对其成熟度、身份和功能进行筛选。为此,需要进行单细胞分析模式以了解这种异质性。细胞异质性研究方法虽然单细胞测序技术在分析单细胞转录组学和基因组信息的通量和规模方面取得了进步,但由于任何一个细胞中存在的蛋白质含量非常低,因此难以满足对定量、单细胞蛋白质组学技术的需求。此外,蛋白质组的复杂性和广泛的浓度范围(fM到高nM)带来了额外的挑战。为了在单细胞水平上进行生化蛋白质表征分析,高灵敏度工具是必不可少的。来自ProteinSimple的单细胞蛋白质分子技术:Milo是一种基于微流体的芯片电泳技术。可以克服单细胞蛋白质组学方法面临的障碍。Milo操作流程将细胞悬浮液加载到Milo芯片上,这样单个细胞就可以安放在芯片上的各个微孔中。然后Milo裂解细胞,产生单细胞裂解物,通过分子量电泳分离每个单细胞裂解物中的蛋白质,然后使用紫外线在Milo芯片中捕获蛋白质。然后,对目标蛋白进行一级抗体和荧光二级抗体进行免疫荧光捕获。通过使用开放格式的微阵列扫描仪对芯片进行成像,并使用Scout™软件对图像进行分析,以进行定量的自动数据分析。Milo追踪定量不同iPSC-CM亚型与免疫荧光和流式细胞术等其他单细胞分析系统不同,单细胞Western Blot技术Milo可以提供分子量大小信息,以及在单细胞水平测量蛋白质表达时的免疫结合信息,赋予额外的特异性。这种分子量分级步骤可以分辨不同物种的不同蛋白质亚型或区分脱靶抗体结合。为了表征CMs亚型标志物,通过Milo检测了肌球蛋白调节轻链2心房亚型(MLC2A或MYL7)及其心室亚型(MLC2V或MYL2)的蛋白质表达。可以观察到Milo鉴定了三个亚群,这些亚群由MLC2A或MLC2V的单一表达或共表达组成。Milo检测到hiPSC-CM亚型特异性心室和心房标记物MLC2V和MLC2A,在45秒的电泳运行时间内,迁移到总泳道长度的60%(图A)。使用Milo-Scout™软件通过找到典型峰形与源自原始荧光图像的一维强度图的卷积的局部最大值来识别峰中心。检测到的MLC2A、MLC2V和GAPDH峰的峰中心位置也由泳道指数显示(图B),显示出单个Milo芯片上所有孔的峰迁移的均匀性。为了评估芯片位置(图C)是否影响峰面积量化,比较了空间不同块之间计算的峰面积方差:每个块区域之间的差异小于2.5%(图D)。应用优化的Milo的检测方法研究hiPSC-CM随时间的异质性,观察整个分化时间线中蛋白质表达的变化。在第17、23和30天从培养物中提取hiPSC-CM细胞,检测MLC2A和MLC2V蛋白质表达。结果显示,共表达MLC2A和MLC2V阳性细胞的比例在整个分化过程中增加,而仅表达MLC2A(MYL7+)的细胞比例随时间减少。且三个亚群中每个亚群中的细胞百分比在所有芯片中一致重现。为了了解在整个分化过程中每个标记物的表达水平在hiPSC-CM亚群中的变化,在hiPSC-CM分化的第17、23和30天对MLC2V和MLC2A的表达进行了量化。随着分化的进行,MLC2A的总水平略有增加。然而,MLC2V表达在第23天和第30天之间增加了近三倍(图C)。为了了解驱动MLC2V表达增加的细胞亚群,三个亚群(MLC2A+、MLC2V+和共表达MLC2A+和MLC2V+)被进一步分层(图D)。MLC2V的水平在共表达MLC2A+和MLC2V+亚群中显着增加,以及在单独的MLC2V+亚群中增加。为了进一步了解导致hiPSC-CM分化过程中MLC2V表达显着增加的机制,对先前从三个iPSC系产生的hiPSC-CM进行了Milo分析,其中转录因子NR2F2 (NR2F2GE)、TBX5 (TBX5GE) 的外显子)和HEY2 (HEY2GE) 被CRISPR/Cas9编辑删除。利用这些品系来验证NR2F2、HEY2或TBX5缺陷在单细胞蛋白质水平上对MLC2V表达的影响。结果显示,TBX5GE和HEY2GE hiPSC-CM中MLC2V的单细胞表达显着降低(图E)。此外,MLC2V表达的显着下降归因于共表达MLC2A和MLC2V亚群(图F)。鉴于共表达MLC2A和MLC2V的亚群增加了MLC2V的表达,推测单独表达MLC2A的未成熟hiPSC-CM会随着时间的推移共同表达MLC2V,从而变得更像心室。同时使用预测调节MLC2V(HEY2或TBX5)的转录因子缺陷的两种细胞系时,我们仅观察到MLC2V在共表达MLC2A和MLC2V亚群中表达降低。这可能表明单独表达的MLC2V群体代表了一个独特的细胞亚群,并且该亚群中MLC2V的表达受替代转录因子的调节。结论:随着在基础和转化心脏研究中的应用,hiPSC-CM正被用于心血管疾病和心脏发育研究。然而,由于hiPSC-CM由不同的细胞亚群组成,并且hiPSC-CM蛋白表达动力学随着成熟而波动,一些蛋白分析方法可能因为分辨率不足而无法检测单细胞蛋白异质性,因此hiPSC-CM的单细胞蛋白质组学可能受到依赖抗体结合检测而无法评估脱靶结合技术的限制。单细胞蛋白质分析技术Milo,通过靶点分子量差异和抗体识别特异性蛋白标记物,避免了抗体脱靶结合的现象,同时能够跟踪单细胞亚群蛋白表达随时间的变化,从而能够识别并量化hiPSC-CM中不同的异质性亚群,应用于疾病建模和再生医学治疗研究。参考文献:1 Current Challenges of iPSC-Based Disease Modeling and Therapeutic Implications.2 Human induced pluripotent stem cell-derived cardiomyocytes: insights into molecular, cellular, and functional phenotypes.3 Single-cell protein expression of hiPSC-derived cardiomyocytes using Single-Cell Westerns.
企业动态
2021.12.17
【技术速递】Maurice icIEF表征AAV完整和空壳衣壳
重组腺相关病毒(AAV)虽是基因治疗中极具潜力的明星载体,但在商业化进程中的可扩展性、可重现性和可比性有不少难点。以AAV载体的下游纯化工艺为例,行业内多采用可扩展的色谱纯化法,但这种方法只能富集完整衣壳,不能真正分离完整和空衣壳,而空衣壳的存在不仅增加了病毒载量,还因为其不携带目的基因可引发免疫原型。此外,部分完整衣壳内可能还包含截断的目的基因、宿主细胞DNA、质粒DNA或其他遗传物质。传统的分析方法包括透射电镜、分析性超离虽可表征完整衣壳/空衣壳/部分完整衣壳的差异,但在数据的重现性、通量和可扩展性上不能满足现有的需求。ProteinSimple:Maurice专利的成像毛细管等电聚焦技术(icIEF),能够帮助分析人员在天然和稳定的筛选条件下快速表征空/完整/部分完整的AAV衣壳,可加快下游工艺和制剂开发的进程。在紫外280nm 的照射下,DNA和蛋白质在都有一定的光吸收,蛋白质中的色氨酸、酪氨酸和苯丙氨酸同时还会发射出350nm左右的天然荧光。所以光吸收模式下,空衣壳相对于完整/部分完整的AAV衣壳,整体峰面积偏低(图1A,图2A);而在天然荧光模式下,三者的整体峰面积基本相当(图1B,图2B)。图1 空衣壳(Empty)、部分完整(Intermediate)和完整衣壳(Full)AAV8样品的紫外光吸收(A)和天然荧光(B)比较。图片由Ultragenyx Pharmaceutical 提供。图2 对图1中三种AAV8样品的紫外光吸收(A)和天然荧光(B)进行定量分析,数据以峰面积的形式展示。图片由Ultragenyx Pharmaceutical 提供。将空/部分完整/完整衣壳的紫外光吸收总面积以天然荧光的总面积进行数据归一化后,有助于分析样品之间的满度差异。图3展示了Maurice如何表征AAV9样品空衣壳和完整衣壳。图3 比较AAV9 空/完整衣壳的icIEF。(A)通过紫外光吸收(蓝色或橙色)和天然荧光(黑色)测定完整衣壳(91%满度)、空衣壳(7%满度)。(B)AAV9样品天然荧光(取对数)显示两个样品的各个峰面积相似。(C)以天然荧光的总峰面积归一化消除微小差异后,绘制两个样品的紫外光吸收图,确认Maurice可以检测空和完整AAV9衣壳。借助Maurice光吸收和天然荧光检测模式,可以准确且重现地对AAV衣壳含量进行评估,同时,这种检测方法易用、运行时间仅需10分钟,需要的样本量低至10μL。有了Maurice,我们能够快速开发出一种方法来表征和评估空/部分完整/完整的AAV衣壳,为安全、快速和有效的基因治疗开发提供了关键、高质量的解决方案。
企业动态
2021.12.17
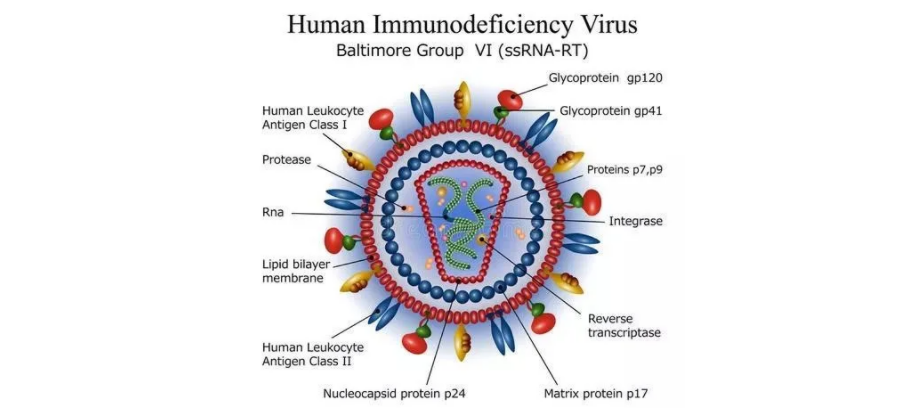
自动、快速、高重复性定量HIV-1 Gag p24 ——全自动微流控ELISA Ella用于细胞基因治疗领域
HIV-1简介慢病毒(Lentivirus)载体是一种单链RNA病毒,是以人类免疫缺陷型病毒(HIV)为基础发展起来的细胞基因治疗载体,能够感染分裂和非分裂细胞。由于其可以将外源片段随机插入细胞基因组,因此可以在体内较长期表达目的基因,且免疫原性低、安全性高,是重要的基因操作工具。HIV基因全长约9.8kb,其中三个最大的阅读框编码了三个最主要的结构蛋白:gag、pol和env。gag基因编码了HIV的核心蛋白,包含有基质蛋白MA(p17)、衣壳蛋白CA(p24)、核衣壳蛋白NC以及p6。其中 p24蛋白是慢病毒外壳中含量最大的标志性蛋白1。通过基于双抗夹心法的酶联免疫吸附实验(ELISA)检测p24抗原的含量是测量及计算慢病毒滴度的常用方法。图1. HIV病毒结构(图片来自网络)随着从HIV-1衍生的慢病毒载体在细胞和基因治疗中使用的日益增加,在整个细胞基因治疗相关的制造过程中精确计算病毒滴度的需求至关重要。因此需要慢病毒载体定量的可靠方法,来支持细胞基因治疗过程的开发,并实现载体和细胞生产的质量控制。在自动化免疫分析系统Ella p24分析可以快速量化慢病毒载体在细胞和载体生产的不同阶段表达的p24水平。Ella p24分析的自动化、稳定性和可重复性可以最大程度的减少用户的操作误差,并使其在过程标准化、方法转移和可扩展性等方面经得起考验,满足GMP要求(图1)。图2. 应用Ella HIV-1 Gag p24检测助力您的研发与生产过程Ella HIV-1 Gag p24检测优势内置标准曲线内置校准曲线具有宽动态范围和低皮克/毫升灵敏度的优点。Ella HIV-1 Gag p24检测的动态范围在3.93-15,000 pg/mL,检测限为0.67 pg/mL。工厂生成的内置校准曲线是通过多次检测中每个校准品的5个重复平均值来编制的,无需用户进行标准品检测及标准曲线绘制。5PL曲线拟合显示标准品浓度与信号强度(相对荧光单位,RFU)的函数关系。图3. Ella HIV-1 Gag p24校准曲线极佳的定量精确性批内精密度:每个质控品在一次分析中测试16次,CV小于10%。批间精密度:每个质控品由至少三名技术人员使用两个不同批次试剂,在多次分析中进行测试,CV小于15%。图4. Ella HIV-1 Gag p24精确性良好的回收率和稀释线性回收率:对四种样品类型(细胞上清、血清、EDTA血浆、肝素钠血浆)各三种不同加标浓度下的回收率进行评估分析,回收率在99%~118%之间。图5. Ella HIV-1 Gag p24回收率稀释线性:对四种样品类型(细胞上清、血清、EDTA血浆、肝素钠血浆)分别使用样品稀释液连续稀释含有和/或加入高浓度HIV-1 Gag p24的样品(2倍、4倍、8倍和16倍稀释),产生并分析在定量范围内的样品。稀释线性结果在83%~111%之间。图6. Ella HIV-1 Gag p24稀释线性英国伦敦大学学院与GSK研发部合作利用Ella HIV-1 Gag p24 试剂盒对慢病毒滴度进行分析近日,由英国伦敦大学学院与葛兰素史克(GSK)研发部合作利用Ella HIV-1 Gag p24 试剂盒在自动化免疫分析系统Ella上对慢病毒载体的滴度进行了分析,相关结果以预印本进行了发表2。首先通过预估慢病毒载体样本中p24浓度确定了样本稀释倍数,以保证检测结果在定量线性范围之内;然后用含有Triton X 的Lysis buffer裂解载体样本(37℃, 1h),进而用试剂盒的SD30稀释液进一步稀释样本。仅仅5~10分钟的加样时间及1个多小时的运行时间,即可自动获得p24浓度结果,并计算慢病毒载体的物理滴度和感染效率。图7. 英国伦敦大学学院与GSK研发部合作利用Ella HIV-1 Gag p24 试剂盒对慢病毒滴度进行分析总结全自动微流控ELISA Ella只需数分钟加样及1小时仪器运行,即可自动输出3个平行的浓度数据及均值。Ella内置标准曲线使用户无需配制标准品绘制标准曲线即可进行蛋白定量,并且可进行单因子和多因子检测灵活配置,具有极佳的重复性、稳定性、精确性和高灵敏度、宽动态范围。Ella HIV-1 Gag p24检测可以作为慢病毒载体定量的快速可靠方法,来支持细胞基因治疗过程的开发,并实现载体和细胞生产的质量控制。参考文献:1. Alan Engelman, Peter Cherepanov. The structural biology of HIV-1: mechanistic and therapeutic insights. Nat Rev Microbiol 10, 279–290 (2012).2. Hamza Patel, Peter Archibald, Cindy Jung, et al. Developing an effective scale-down model for a suspension adapted HEK293T-derived lentiviral vector stable producer cell line. Authorea. July 28, 2021.
企业动态
2021.11.30
免费获取全自动Digital Western Blot试剂盒,让您的数据不被质疑!
为什么Western Blot数据又被质疑?为什么文章又被撤稿?由于Western blot数据被修饰,修改,拼接,重复使用等问题,导致数据可信度经常遭到质疑,从而文章撤稿,基金撤回,成为科学家内心隐隐的痛。如何实现Western Blot数据规范化管理,以及数据长久保存,以便随时提取数据,回应审稿人的质疑,同行的质疑,成为科研界急需解决的问题。全自动Digital western blot系统,前瞻性的解决了这些问题!1.数据不可修改!全自动Digital Western Blot Compass软件,符合FDA 21 CFR part 11审计追踪法规要求,保障数据不可修改,全程实验及结果可溯源。2.全程自动化标准化!很多科学家重复使用Western Blot数据,是因为同一实验重复性差,万般无奈,只能将不同次实验拼接在一起。全自动Digital Western Blot全程自动化标准化,实现数据可重复,无需再拼接实验结果。3.全膜western Blot!为避免作者通过剪膜来修改western blot结果,现越来越多的杂志,需要作者提供全膜的原始结果。而全膜孵育抗体,将会大幅度提高传统western blot抗体消耗,增加成本。全自动Digital Western Blot所有实验均为全膜western,且通常只需消耗0.1-0.2ul抗体原液,大幅降低抗体成本消耗。。4.数据永久保存!所有数据被压缩保存在数据库格式文件中,可以永久使用Compass软件打开,在任何时候,都可以随时提取数据。如何免费获得全自动Digital Western Blot试剂盒?登录网站登录网站:https://bit.ly/ab-validation-submit提交表格上述表格提交注意事项其它信息须知:1. ProteinSimple抗体库登录:https://www.bio-techne.com/cn/resources/simple-western-antibody-database2. 数据提交后,后台审核通过后才有机会获得免费试剂盒:◆ 如果您提交的数据是ProteinSimple抗体库里没有的新靶点,则可获得一个免费的分离试剂盒(8×25 毛细管卡盒);◆ 如果您提交的数据是ProteinSimple抗体库里已有靶点,但抗体库里没有的新抗体,则可获得一个免费的检测试剂盒;◆ 如果您提交的数据是ProteinSimple抗体库里已有抗体,但用与抗体库中不同的分离模式(Size/Charge)检测,则可获得一个免费的检测试剂盒。以上活动解释权归ProteinSimple所有。详情请咨询ProteinSimple的销售或技术人员。
企业动态
2021.11.30
【Advanced NanoBiomed Research】全自动Digital WB系统助力神经退行性疾病药物递送系统研究
来自美国顶尖公立大学北卡罗来纳大学教堂山分校(University of North Carolina at Chapel Hill,简称:UNC)的科学家们,利用全自动Digital Western Blot系统,对不同细胞来源的细胞外囊泡(Extracellular Vesicles, EVs)进行蛋白表征,探索不同细胞来源的EVs作为治疗神经退行性疾病药物递送系统的可能性,相应结果发表在Advanced NanoBiomed Research (IF: 13.052)。1EVs简介EVs的命名和分类细胞外囊泡(Extracellular Vesicles, EVs)是由细胞释放的各种具有膜结构的囊泡结构统称。EVs根据其来源(细胞类型)、大小、形态和载荷分为:微泡(microvesicles)、外泌体(exosomes)、凋亡小体(apoptotic bodies)和癌小体(oncosomes)。目前作为药物递送系统研究最多是微泡和外泌体。EVs通过质膜出芽形成的称为微囊泡(microvesicles);多囊泡内体(Multivesicular Endosomes,MVEs)与质膜融合后,释放的腔内囊泡(Intraluminal vesicles,ILVs)称为外泌体(exosomes)。EVs作为药物递送系统的优势EVs具有:A)能够穿过各种生物屏障,包括组织屏障或质膜,并通过endosomal运送载荷;B)利用内源性细胞机制,在细胞核内生产或装配成相应的载荷物,然后装载到多泡体(Multivesicular Bodies,MVBs)或质膜,并最终以EVs形式释放到细胞外;C)在脾脏和肝脏中具有较低的毒性,并且具有较低的免疫原性。因此EVs已作为脂质体(Liposome)、纳米颗粒的生物替代品,进入了药物递送领域,用于治疗各种疾病,包括癌症、神经系统疾病(阿尔茨海默病、帕金森病、中风)、传染病(脑膜炎、人类免疫缺陷病毒(HIV)和HIV相关痴呆)、炎症性关节炎、以及自身免疫和心血管疾病(动脉粥样硬化和心脏病等)。受体细胞摄入EVs的过程和机制EVs可以通过多种途径被内化,内化会将外源性EVs靶向典型的内体通路,从而到达多囊泡内体(MVEs)。EVs停靠在MVEs的质膜上,通过膜融合将其内容物释放到受体细胞中。同时EVs也可以直接与受体细胞膜融合,将内容物释放到受体细胞中。EVs还可以通过细胞表面的整合素(Integrins)-细胞粘附分子(ICAM)的结合或抗原呈递等方式,对受体细胞进行细胞信号通路的调节或免疫调节。2研究内容细胞外囊泡(EVs)将纳米颗粒大小与跨越生物屏障的非凡能力、低免疫原性和毒性特征相结合,成为了一类有前途的药物递送系统。因此如何成功应用这种输送生物化合物的自然方式,需要深入了解EV从其母细胞继承的内在特性。因此本文评估了不同来源的细胞释放的EVs,利用其将药物输送到大脑,来治疗神经退行性疾病。本文通过一些检测方法对原代巨噬细胞(mEV)、神经元(nEV)和星形胶质细胞(aEV)分泌的EV的形态、大小、zeta电位、表面蛋白进行鉴定和分析。结果显示与nEVs和aEVs相比,mEVs显示出对炎性组织更高水平的粘附性和靶向性。同时,在帕金森病转基因小鼠模型中,mEVs的大脑积累水平明显高于nEVs和aEVs。因此,mEVs被认为是最有前途的将药物输送到大脑的纳米载体系统。全自动Digital WB表征EVs膜蛋白揭示mEVs高粘附和靶向炎症组织能力HP90(HSP90):热休克蛋白,EVs表面特异性marker;TSG101:四跨膜蛋白,EVs表面特异性marker;Integrin α:整合素α,EVs表面特异性marker;CD11b:属于Integrin β2家族,通常在白细胞(如巨噬细胞)表面表达;CD9:四跨膜蛋白,EVs表面特异性marker。研究结果:本文利用利用全自动Digital Western Blot技术,对不同来源的EVs膜蛋白进行表征,结果显示与nEVs和aEVs相比,mEVs显示出最高水平的四跨膜蛋白和整合素的表达,表明mEVs对炎性组织的粘附性和靶向性更高。在帕金森病转基因小鼠模型中也得到了相同结论。证实mEVs对比nEVs和aEVs而言,是能将药物递送到大脑的更有前途的一种纳米载体系统。其它神经方面的研究请见以下链接:【Science】单细胞蛋白分析技术揭示肠脑神经回路新机制全自动Digital Western Blot揭示多小脑回畸形发病新机制Ella全自动ELISA在神经领域上的应用Wes助力:中科院阎锡蕴课题组协同北大医院神经内科郝洪军主任 共同揭示血脑屏障损伤机制Milo单细胞Western blot开启神经生物学研究新纪元Ella 平台推出神经退行性疾病Biomarker: Nf-L超敏检测方法Wes:定量研究神经退行性病变关键蛋白参考文献:1. Extracellular Vesicles as Drug Delivery System for the Treatment of Neurodegenerative Disorders: Optimization of the Cell Source.2.Shedding light on the cell biology of extracellular vesicles.3.Extracellular Vesicles as Drug Delivery Vehicles to the Central Nervous System.4.Extracellular vesicles as drug delivery systems: Why and how?5.β2 integrins As Regulators of Dendritic Cell, Monocyte, and Macrophage Function.
企业动态
2021.11.19
【邀请函】ProteinSimple 邀您共赴Bio-ONE 2021第三届生物工艺产业年度峰会
Bio-ONE 2021第三届生物工艺产业年度峰会将设立四大平行专场论坛,分别从复杂抗体药上游开发、复杂抗体药下游开发、新型疗法CMC、制药工程与数字化转型等角度,旨在分享生物工艺研发、放大、质量和分析等方面的最新研究,共谋产业化发展之路,助力中国生物医药发展。会议时间 | 11月13-14日会议地点 | 上海 · 阿纳迪酒店LG1层主办单位 | 佰傲谷 BioValley、华东理工大学、上海市生物工程学会、上海市微生物学会ProteinSimple是美国纳斯达克上市公司Bio-Techne集团(NASDAQ:TECH)旗下行业领先的蛋白质分析品牌。我们致力于研发和生产更精准、更快速、更灵敏的创新性蛋白质分析工具,包括蛋白质电荷表征、蛋白质纯度分析、蛋白质翻译后修饰定量检测、蛋白质免疫实验如Western和ELISA定量检测蛋白质表达等技术,帮助生物制药、细胞治疗、基因治疗、生物医学和生命科学等领域科学家解决蛋白质分析问题,深度解析蛋白质和疾病相互关系。本次峰会,作为生物制药蛋白分析技术的领导者,ProteinSimple受邀出席,欢迎各位莅临48展台深入交流。
企业动态
2021.11.09
【Science】单细胞蛋白分析技术揭示肠脑神经回路新机制
为什么我们会感觉到饥饿?为什么进食之后会出现饱腹感?我们能感知到大脑与肠道的紧密联系,以往的研究认为这种感知与触觉、视觉、声音、气味和味觉通过受神经支配的上皮传感器细胞传递到大脑不同,肠道刺激的感知被认为涉及消化系统和中枢神经系统之间信号传递的肠道-大脑连接(gut-brain connection)是以激素转运为基础的,这种基于激素的信号传递大约需要10分钟。在肠道中,有一层上皮细胞将腔与下面的组织分开。分散在该层内的是称为肠内分泌细胞的可电兴奋细胞,它们感知摄入的营养物质和微生物代谢物。与味觉或嗅觉受体细胞一样,肠内分泌细胞在存在刺激时会激发动作电位。然而,与其他感觉上皮细胞不同,肠内分泌细胞和脑神经之间没有突触联系的描述。人们认为这些细胞仅通过激素(如胆囊收缩素)的缓慢内分泌作用间接作用于神经。尽管它在饱腹感中起作用,但胆囊收缩素的循环浓度仅在摄入食物后几分钟达到峰值,并且通常在用餐结束后。这种差异表明大脑通过更快的神经元信号感知肠道感觉线索。来自美国杜克大学医学院的科学家们,利用Milo,揭示迷走神经(vagus nerve)可直接连接着肠道与中枢神经系统。相关研究结果发表在Science期刊上,标题为“A gut-brain neural circuit for nutrient sensory transduction”。Milo单细胞Western Blot 验证肠分泌细胞存在神经突触相关蛋白本文使用与小肠类器官或纯化的肠内分泌细胞共培养的结节神经元,在体外重现了神经回路。并结合单细胞定量实时聚合酶链反应和单细胞Western Blot(Milo)共同对突触蛋白进行检测和评估。利用Milo在蛋白水平进行了进一步的验证:单细胞蛋白质印记结果显示83%肠内分泌细胞含有synapsin-1(分析的198 CckGFP细胞中的164个),与其他肠上皮细胞相比,纯化的CCK-肠内分泌细胞表达突触粘附基因Efnb2、Lrrtm2、Lrrc4 和 Nrxn2,表明这些上皮传感器具有形成突触的机制。为了确定与肠内分泌细胞接触的突触的神经元的来源,本文使用了一种改良后的狂犬病毒(DG-rabies-GFP,能感染神经元,但缺少跨突触传播所需的G糖蛋白),发现在肠道类器官中,狂犬病比其他上皮细胞更喜欢感染肠内分泌细胞。并且肠内分泌细胞与迷走神经元突触,通过使用谷氨酸作为神经递质,在几毫秒内转导肠腔信号。这些突触连接的肠内分泌细胞(神经足细胞)形成的神经上皮回路通过一个突触将肠腔与脑干连接起来,为大脑打开一条物理管道,以突触的时间精度和空间分辨率感知肠道刺激。也正是这些突触信号神经足细胞告诉大脑肠道中发生的事情,对我们吃的食物做出一定的反馈。
企业动态
2021.11.03
全自动Digital Western Blot揭示多小脑回畸形发病新机制
日本横滨市立大学医学研究生院的科学家,利用全自动Digital Western Blot,研究多小脑回畸形发病新机制,相应结果发表在Science Advances(IF:14.136):De novo ATP1A3 variants cause polymicrogyria.研究背景多小脑回畸形当神经母细胞增殖、分化、迁移或皮质组织在人类大脑发育过程中被中断时,就会发生皮质发育畸形。多小脑回是皮质发育畸形的一种常见形式,表现为存在许多异常小的脑回,产生不规则且融合的皮质表面。临床上,多小脑回导致各种神经系统症状,如癫痫、智力障碍和口运动功能受损。多小脑回畸形常见发病机制和临床特征编码α3-subunit的ATP1A3中的显性突变导致ATP1A3相关疾病的特征性功能性脑疾病,其至少具有三种不同的表型:儿童交替性偏瘫(AHC);快速发作性肌张力障碍帕金森综合征(RDP)和小脑性共济失调、反射消失、弓形足、视神经萎缩和感音神经性耳聋(CAPOS)。同时,ATP1A3的显性突变也会导致各种形式的发育性和癫痫性脑病,例如伴有或不伴有呼吸暂停的早期婴儿癫痫和脑病(EIEE)、伴有小脑共济失调的复发性脑病或发热引起的阵发性无力和脑病。研究内容日本横滨市大学医学院人类遗传学教研室的Satoko Miyatake等科学家,对124名患有多小脑回的患者进行了全外显子组测序,在8名患者中发现了de novo ATP1A3变体,且这8名患者没有表现出AHC、RDP或CAPOS的临床特征,而是出现了完全不同的表型:严重形式的多小脑回,伴有癫痫和发育迟缓。与AHC、RDP或CAPOS相关变体相比,检测到的变体在ATP1A3中具有不同的位置和不同的功能特性。在发育中的小鼠大脑皮层中,最严重患者过度表达ATP1A3变体的神经元中径向神经元迁移受损,表明该变体参与了皮质畸形的发病机制。全自动Digital Western Blot检测技术揭示ATP1A3损害Na+/K+ATPase亚基之间相互作用的分子机制利用全自动Digital Western Blot检测发现,与野生型相比,所有多小脑回相关变体的ATP1A3和成熟β1亚基的表达均降低,表明αβ-异二聚体的结合、折叠或运输受损。免疫共沉淀后,用全自动Digital Western Blot分析ATP1A3和ATP1B1(形成Na+/K+ATPase β亚基的蛋白之一)的结合。结果表明,多小脑回相关变体既影响了与β1-亚基的结合,也影响了αβ-异二聚体的正确折叠。最后用全自动Digital Western Blot检测了ATP1A3不同变体在细胞质、细胞器和质膜部分中ATP1A3和β1-亚基的相对表达,发现多小脑回相关变体在质膜组分中,ATP1A3和成熟的β1-亚基表达低。表明高尔基体中的两个亚基之间存在关联机制,以及它们随后向膜的异常运输。
企业动态
2021.11.03
Ella全自动ELISA在神经领域上的应用
研究背景神经丝(NF: Neurofilaments)是神经细胞主要的细胞骨架成分,对于保持轴突口径和形态的完整十分重要,影响着神经传输的速率和准确性。神经丝根据其大小分为神经丝轻链 (NFL)、神经丝中链 (NFM)和神经丝重链 (NFH)。NFL已成为诊断和监测各种神经疾病进展的生物标志物,例如亨廷顿病(HD)、肌萎缩侧索硬化 (ALS)、阿尔茨海默病(AD)和多发性硬化症(MS)。血液和脑脊液中高水平的 NFL 表明轴突损伤,这是上述神经退行性疾病的标志。从样本来源的角度来看,量化血液中 NFL 的含量比采集脑脊液样本的损伤性更小,这也增加了研究工作材料的可用性,从而增加了 NFL 作为生物标志物的效用。然而,血液衍生物(如血浆和血清)中的 NFL 水平通常低至每毫升皮克级别,远低于脑脊液中的水平1。因此,需要一种灵敏、稳健且可重复的检测方法来提供高质量的数据,以表征和监测神经退行性疾病的进展并有效地治疗。Ella简介Ella是一种基于微流控免疫检测技术的全自动超灵敏的ELISA系统,其创新性将特异性捕获抗体包被在微流体玻璃反应管(Glass Nano Reactor,GNR)中,再将GNR嵌入全自动微流体免疫检测管。每个检测通道都含有三个包被有捕获抗体的 GNR,因此每个样品都会自动输出三个读值。其采用双抗体夹心,并利用生物素-链霉亲和素进行信号放大,最后利用检测器获取640nm下的荧光信号。整个流程无需人工干扰,操作简单,70min即可出结果。ALS患者样本中NFL水平升高以ALS患者样本作为模型系统来量化NFL水平,评估区分正常和疾病状态样本的能力及作为脑病理学生物标志物的适用性。结果表明,与健康对照样本相比,血清和CSF中NFL水平升高(如图),这与已发表的文献一致2,3。Ella与其他平台测定NFL结果高度相关市售NFL免疫测定方法,例如Ella、基于bead、或者基于plate的 ELISA 试剂盒,采用的抗体对都来自于Uman Diagnostics 。因此分别利用Ella,bead-base assay,plate-based ELISA的检测方法,对比分析了健康和 ALS 患者的队列中的NFL水平。因血清血浆中的NFL比脑脊液中的NFL水平低很多,所以根据不同检测方法的灵敏度和检测范围来针对选择合适样本进行检测。例如一般bead-base assay用于检测NFL水平含量较低的血清和血浆样本;plate-based ELISA用于检测NFL水平含量较高的脑脊液样本。下图结果表明,Ella 和 bead-base assay测得的血浆和血清样品中NFL的相关系数R2为0.95;Ella和plate-based ELISA 测定脑脊液样品中NFL的相关系数R2为0.94。证明对于bead-base assay或plate-based ELISA检测技术而言,Ella无论是血清(或血浆)样本(NFL低水平)还是脑脊液样本(NFL高水平)都可以检测NFL。法国巴黎科学文学研究院Audrey等科学家也利用Ella和Simoa分别检测了203例多发性硬化(MS)患者和30例健康对照组血清中的NFL水平,并对这两个平台进行了充分的比较,证明二者结果高度相关。作者对Ella给予了高度评价:从数据上表明,Ella既可以检测健康人群的NFL水平,也可以检测病患的NFL水平,其灵敏度已同时满足NFL对于健康人和患者样本的检测水平。且Ella具有占地面积小、平台强大、价格便宜,更快更简单等优势,同时不影响结果准确性从而可以替代Simoa,用于临床NFL检测4。总结:NFL是一种很有前景的生物标志物,可用于诊断和监测各种神经系统疾病。Ella的NFL Assay具有测定血清、血浆和脑脊液样本类型中NFL所需的敏感性,具有高水平的重复性。Ella占地面积小,只需70分钟即可为您提供分析数据,在不牺牲时间和空间的情况下为您提供可操作的结果。这种检测性能、重现性和易用性的结合使Ella成为NFL研究实验室的完美选择。参考文献:1. Neurofilaments as biomarkers in neurological disorders, M Khalil, CE Teunissen, M Otto, F Piehl, MP Sormani, T Gattringer, C Barro, L Kappos, M Comabella, F Fazekas, A Petzold, K Blennow, H Zetterberg and J Kuhle, Nature Reviews Neurology, 2018; 14:577-589.2. Neurofilament levels as biomarkers in asymptomatic and symptomatic familial amyotrophic lateral sclerosis, P Weydt, P Oeckl, A Huss, K Müller, AE Volk, J Kuhle, A Knehr, PM Andersen, J Prudlo, P Steinacker, JH Weishaupt, AC Ludolph, M Otto, Annals of Neurology, 2016; 79:152-8.3. Neurofilament light chain: A prognostic biomarker in amyotrophic lateral sclerosis, CH Lu, C Macdonald-Wallis, E Gray, N Pearce, A Petzold, N Norgren, G Giovannoni, P Fratta, K Sidle, M Fish, R Orrell, R Howard, K Talbot, L Greensmith, J Kuhle, MR Turner, A Malaspina, Neurology, 2015; 84:2247-57.4. Comparison of SimoaTM and EllaTM to assess serum neurofilament‐light chain in multiple sclerosis, G Audrey, V Sébastien, P Magali, B Guillaume, C Romain, L Christine, LC Sabine, D Marc, E Gilles, V Sandra, LF Christine, DS Jérôme, AL David, C Giovanni, G Olivier, R Aurélie, M Thibault, C Olivier, C Pierre, B Eric, Z Hélène, TA Sophie, Ann Clin Transl Neurol, 2021; 8(5): 1141–1150.
企业动态
2021.11.03
ProteinSimple参会第二十一届中国生物制品年会(CBioPC2021)
由中国疫苗行业协会、中国药学会生物药品与质量研究专业委员会、中华预防医学会生物制品分会、中华预防医学会疫苗与免疫分会、中国医药生物技术协会疫苗专业委员会、中国微生物学会生物制品专业委员会共同主办的“第二十一届中国生物制品年会(CBioPC2021)”,10月15日-16日在南京成功举办。来自国内生物制品行业的权威专家、知名学者、科技精英,及行业协会等共赴此次盛会,共同交流生物制品新技术的前沿和经验,探讨生物制品行业的发展趋势。图片来源:CBioPC2021Bio-techne旗下ProteinSimple品牌,作为全球领先的生命科学仪器制造商和技术提供商,参与了本次盛会。创新型蛋白质分析技术品牌ProteinSimpleProteinSimple是美国纳斯达克上市公司Bio-techne集团(NASDAQ:TECH)旗下行业领先的蛋白质分析品牌。ProteinSimple致力于研发和生产更精准、更快速、更灵敏的创新性蛋白质分析工具,包括蛋白质电荷表征、蛋白质纯度分析、蛋白质翻译后修饰定量检测、蛋白质免疫实验如Western和ELISA定量检测蛋白质表达等技术,帮助疫苗行业、生物制药、细胞治疗、生物医学和生命科学等领域科学家解决蛋白质分析问题,深度解析蛋白质和疾病相互关系。作为创新型蛋白质分析技术品牌,ProteinSimple吸引了众多业内人士来到展台,共同交流和探讨,得到了更多关注和支持!
企业动态
2021.10.19
【邀请函】ProteinSimple 邀您共赴中国生物制品年会
一年一度的中国生物制品年会,将如期在南京举行。会议将聚焦疫苗研发与质量、重组治疗性生物制品、细胞与基因治疗、疫苗临床研究、血液制品、抗体药物产业化、狂犬病防控等热点话题。会议时间:2021年10月14 - 16日会议地点:江苏省南京市国际博览中心会议内容:本次会议将围绕生物医药前沿技术设置主会场并开设14个平行分论坛,邀请生物医药领域最权威专家进行学术报告交流,会议期间同时安排生物医药新技术与新成果展示主办单位:中国疫苗行业协会中国药学会生物药品与质量研究专业委员会中华预防医学会生物制品分会中华预防医学会疫苗与免疫分会中国医药生物技术协会疫苗专业委员会中国微生物学会生物制品专业委员会ProteinSimple是美国纳斯达克上市公司Bio-Techne集团(NASDAQ:TECH)旗下行业领先的蛋白质分析品牌。我们致力于研发和生产更精准、更快速、更灵敏的创新性蛋白质分析工具,包括蛋白质电荷表征、蛋白质纯度分析、蛋白质翻译后修饰定量检测、蛋白质免疫实验如Western和ELISA定量检测蛋白质表达等技术,帮助疫苗研发、生物制药、细胞治疗、基因治疗、生物医学和生命科学等领域科学家解决蛋白质分析问题,深度解析蛋白质和疾病相互关系。本次盛会,我们将展出电荷异质性检测金标准技术平台-Maurice,和全自动微流控ELISA技术平台-Ella样机。欢迎各位莅临R23展台深入交流。现场扫码抽奖,惊喜礼品等您来拿扫码通道将于10月14日开启,敬请关注!
企业动态
2021.10.13
「ProteinSimple」邀你一起披荆斩棘!
企业动态
2021.09.24
【邀请函】ProteinSimple 邀您共赴上海BIC 2021
BIC 2021第三届亚洲生物制药创新峰会,将聚焦细胞与基因治疗、生物制药连续生产和工艺创新、新型抗体疗法开发等生物制品热点领域。会议时间 | 9月28-29日会议地点 | 上海 · 浦东嘉里大酒店指导单位 | 上海市生物医药行业协会主办单位 | 触界科技支持单位 | 亚洲生物制药连续生产产业联盟ProteinSimple是美国纳斯达克上市公司Bio-Techne集团(NASDAQ:TECH)旗下行业领先的蛋白质分析品牌。我们致力于研发和生产更精准、更快速、更灵敏的创新性蛋白质分析工具,包括蛋白质电荷表征、蛋白质纯度分析、蛋白质翻译后修饰定量检测、蛋白质免疫实验如Western和ELISA定量检测蛋白质表达等技术,帮助生物制药、细胞治疗、基因治疗、生物医学和生命科学等领域科学家解决蛋白质分析问题,深度解析蛋白质和疾病相互关系。本次峰会,作为生物制药蛋白分析技术的领导者,ProteinSimple受邀出席,欢迎各位莅临D07展台深入交流。
企业动态
2021.09.17
「ProteinSimple」邀你一起披荆斩棘!
企业动态
2021.09.08
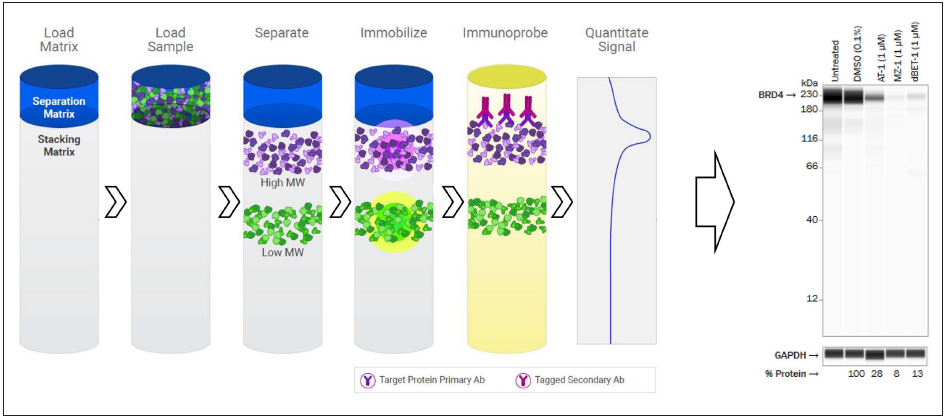
Digital Western Blot在领先靶向蛋白降解药物公司研发中应用
靶向蛋白质降解 蛋白表达和功能异常调控可极大地改变细胞生理学并导致许多病理生理状况如癌症、炎症性疾病和神经退行性疾病等。内源性蛋白质的稳态表达由从头合成和降解速率的平衡来控制。靶向蛋白质降解(Targeted Protein Degradation,TPD)以剂量和时间依赖性方式通过蛋白酶体对致病靶蛋白进行降解。从目前药物研发进展来看,靶向蛋白降解的概念提供了革命性的药物开发机会,预计将带来现代小分子药物研发的转变。 在靶向蛋白降解领域,蛋白质免疫印迹技术(Western Blot,WB)是观察细胞中浓度依赖性蛋白质降解的经典方法。然而,传统的蛋白质印迹非常耗费资源,需要多个洗涤步骤和长孵育时间才能产生高质量的印迹,导致技术操作复杂、通量低、定量不准和重复性差等劣势,难以推动选择性诱导、快速和可持续性的蛋白质降解疗法的快速发展。 根据药物研发需求,工业界迫切需要建立高效、灵敏、可量化和可重现的蛋白质降解技术平台,满足不同通量和不同研发阶段需求。目前全球领先的靶向蛋白质降解药物研发公司基本建立了高低通量结合、筛选和验证一体化的研发平台。下面文章一窥行业领先的药物公司平台建设思路。SLAS Discovery:C4 Tx团队总结加速靶向蛋白降解疗法开发和优化的高通量技术 本文总结了靶向蛋白降解领域最常采用的从低通量到高通量的几种不同方法。详细说明了传统Western blot、基于毛细管电泳技术的Digital Western Blot(ProteinSimple)、高通量流式细胞术(HTFC)、AlphaLISA SureFire技术、时间分辨荧光共振能量转移(TR-FRET)技术和Nano-Glo HiBiT技术。01 Digital Western Blot技术 Digital WB技术是传统WB实验系统的高效替代方案。使用该技术,可在同一根毛细管中完成样品分离、捕获、固定、免疫检测和定量分析,从而实现传统WB的所有实验步骤(包括蛋白质上样、分离、免疫印迹、洗涤、检测以及数据分析)自动化,有效提高蛋白质表达定量结果的精确性和重复性。全自动Digital WB技术显著地缩短了样本检测时间到3小时,直接采集化学发光或荧光信号值,利用数字化信号峰面积来表征蛋白含量,短时间内实现了目的蛋白的可视化精准定量分析。ProteinSimple旗下具有系列的Digital WB系统,从25到96个样本通量,可满足靶向蛋白降解药物研发过程中对中低通量检测需求。 本技术可相对和绝对定量检测目的蛋白丰度,适用于内源性的或未修饰靶蛋白分析,如果抗体表位不受干扰,也可检测修饰的标记过的蛋白质。与传统WB相比,Digital WB可实现高分子量蛋白质可靠捕获和定量分析如BRD4案例。同时,需要样本量少,只需要3 μL上样量,特别适用于细胞或降解剂有限的条件下,96孔板中收集处理过的细胞可满足检测需求。除了自动化和标准化之外,批次数据差异CV值较低,重复性好。软件符合21 CFR Part11,数据全程可记录。这些优势使其成为工业领域蛋白表达检测平台的标准配置。02高通量流式细胞术(HTFC)和In-Cell Western (ICW) 流式细胞技术可分析细胞表面和细胞内蛋白质表达水平,技术进步已使流式可作为中高通量筛选方法来辅助药物发现。紧凑型流式细胞仪可检测96孔板中细胞配体或蛋白质的不同荧光强度。本质上,高通量流式细胞术一次检测单个细胞,提供单个细胞信号。而ICW对孔内所有细胞进行批量读取。两种方法使用比率荧光读数来提高重现性和降低标准偏差,进而提高整体数据质量。与传统流式比,这两种技术方案需要更少的样本体积和检测抗体可有效降低成本。但无法根据蛋白质分子量参数来区分特异性和非特异性信号。03AlphaLISA SureFire技术 AlphaScreen是一种多功能的基于微珠相互靠近实验技术,基于生物分子的相互作用,可测定各种分析物包括标记的或内源性蛋白。本技术提高了检测灵活性,微珠种类被设计识别各种不同的工程化蛋白质标签,或AlphaLISA每个微珠能包被针对目标蛋白不同表位的特异性抗体。当与同一蛋白质结合时,Alpha供体和受体微珠会靠近,采用680nm近红外光激发,供体微珠导致单线态氧分子释放。单线态氧的产生本身不足以产生信号,但当受体微珠靠近时,会引发能量转移反应,进而产生放大的荧光信号。AlphaLISA SureFire技术采用改进光谱特性的微珠,只能进行终点分析,需要细胞裂解来观察感兴趣蛋白质信号。对于时效性降解曲线,可通过多个高通量筛选细胞培养板在不同时间点裂解来实现。该技术优势是有助于更快地优化、自动化和小型化,适用于化合物常规和高通量筛选。可减少实际操作时间和信号读取需要的总时间,加速药物发现。具有飞克级灵敏度和 4-5 log 宽动态范围,使其适合于细胞内、分泌或膜结合蛋白检测。 对于靶向蛋白质降解的细胞学实验,384孔板可显著缩短实验时间。使用合适的抗体,通过使用针对靶蛋白翻译后修饰的抗体来区分靶标蛋白。例如使用特异性识别磷酸化蛋白的抗体直接评估具有自磷酸化活性激酶的化合物BiDAC抑制和降解影响,可与总蛋白(磷酸化和未磷酸化)测量值进行比较。获得这两个数据可能会提高降解剂与抑制剂前体区分机制的理解,进一步了解目标蛋白调节对表型影响。 尽管有这些优点,该技术有一些局限性。Alpha 微珠价格昂贵且对环境光高度敏感,需要在暗室环境添加实验试剂,上机前孵育期间尽可能避免在光线下长时间暴露。此外,读板机温度会影响单线态氧的生成和扩散速率,每摄氏度可高达10%。为了最大限度地减少批次间差异,实验微孔板和读板机应保持在温度良好可控环境中。最后需要注意过渡金属可导致单线态氧猝灭效应。04时间分辨荧光共振能量转移(TR-FRET)实验 TR-FRET实验可用于检测细胞内蛋白质水平变化,有助于高效快速的靶向蛋白质降解领域的药物发现。与AlphaLISA SureFire 技术类似,TR-FRET 是一种直接的均质混合和读取夹心免疫分析方法,信号检测前不需多次洗涤步骤。通过量化两种荧光团标记的抗体之间的比率信号来确定蛋白降解水平,这些抗体结合同一蛋白质上的两个不同表位,采用供体和受体荧光团标记。 TR-FRET是终点实验,需要细胞裂解来观察检测感兴趣蛋白质的信号。如蛋白降解动力学曲线,必须使用多个高通量筛选细胞板并行设计TR-FRET实验,以便裂解细胞并在每个时间点后添加检测抗体。将这些数据叠加可提供DC50、Emax偏移以及时效曲线。对于生物标志物分析,重要的是两种抗体使用不同表位与同一蛋白质结合,以启用 FRET 信号,同时将背景信号降至最低。与Alpha 技术一样,该方法可用于测量目标蛋白质翻译后的抑制,从而可对通路抑制以及总蛋白质水平进行定量。也可区别癌症样本突变体和正常组织中相同蛋白质野生型具有选择性的降解剂。本技术需要购买高质量特异性抗体,长期药物发现工作时,TR-FRET 分析每个数据点成本可能是该技术的最大缺点,尽管成本可通过批量定制标记抗体降低。TR-FRET实验的灵活性、适应性和可转移性具有优势。一旦针对某个细胞系靶蛋白的 HTRF方法建立,通常很容易转移到表达相同蛋白质的其他细胞系中。HTRF技术具有宽动态范围和信号稳定,而无需担心环境光的猝灭效应。05Nano-Glo HiBiT技术 Nano-Glo HiBiT技术是一种高通量靶向蛋白质降解药物筛选系统。本技术基于分成两部分互补NanoLuc荧光素酶系统,11个氨基酸的HiBiT标签和 17.6 kD LgBiT多肽。采用 CRISPR基因编辑技术将11个氨基酸的 HiBiT标签引入到编码目标蛋白基因内,或设计为可通过质粒转染或慢病毒感染的重组DNA表达载体,两种方式都可实现将标签与感兴趣目的蛋白相连。加入特有的裂解检测试剂,HiBiT会自发的与检测试剂中与HiBiT互补的多肽LgBiT结合,二者结合后可形成有催化功能的NanoLuc 荧光素酶,可催化底物产生明亮的发光信号。该信号强度与细胞裂解物中的 HiBiT 标记蛋白含量成正比。 本技术检测蛋白质浓度线性范围有几个数量级,产生的发光信号可稳定数小时,因此适用于蛋白质降解剂药物发现阶段的高通量筛选。将HiBiT标签基因编辑敲入到感兴趣的蛋白质序列中,并生成稳定表达 HiBiT 标签目的蛋白的细胞系,整个实验开发时间至少需要3-4周。如需要挑取高表达HiBiT信号的单细胞克隆,则这个系统开发时间额外增加2-3周。与不需要基因编辑开发表达HiBiT细胞系技术相比,开发时间长是这种方法的一个缺点。然而,一旦产生稳定表达的具有足够信号的细胞克隆或细胞群,操作只需加样、直接均匀混合和读取检测,比较简单。 HiBiT 技术也可进行实时动力学蛋白降解检测。LgBiT蛋白通过慢病毒转染到已经表达HiBiT标记的目标蛋白细胞中,同时表达HiBiT和LgBiT标签,整个实验过程中重组发光NanoBiT酶都存在,通过与特定底物作用来检测信号随时间变化值。作为单一的非裂解试剂添加步骤,持续几分钟到几小时到几天时间内实时测量目的蛋白质降解,所以这种方法检测板和HiBiT试剂成本方面更具成本效益,但长时间实验需要配置自动化系统。靶向蛋白质降解平台建设策略 纵观目前市面上几种不同通量的靶向蛋白质检测技术,每种技术都各自优势和相关局限性。如何构建高效的靶向蛋白质降解技术平台来推动药物发现计划,需要注意整体策略选择,综合考虑成本、时间和可行性等多种因素。根据具体研发目标,选择最可能受益技术方案。针对某些靶标蛋白可能需要采用分层筛选漏斗原理,根据C4团队的经验,这种分层方法可最大限度地提高数据收集效率,以推动BiDAC降解剂早期发现和优化工作。各种策略前提是针对目标蛋白的抗体,及所有检测方法和试剂都必须在化合物筛选前完整验证。如有Nano-Glo HiBiT技术平台,可作为快速优化降解剂效力的高通量筛选的首选方法,它适用于终点法和连续读取方法,以与TR-FRET相当的成本,但提供更多的数据类型和检测灵活性。如有针对目的靶标高度特异性且经过验证的抗体,同时有相关即用型试剂盒,TR-FRET是一种合适的高通量药物发现工作的替代方案。TR-FRET可为表达相同目标蛋白的不同细胞系后续筛选提供有吸引力的选择。具体那种方案作为高通量筛选阶段优先选择,取决于研发阶段和目标。 本团队建议高通量筛选平台需与其他技术平台配合使用,才能更充分表征异双功能蛋白降解剂。如采用Digital WB确认内源性蛋白质降解,以确保与初步筛选实验中利用HiBiT高通量技术获得一致性实验结果,防止初级筛选试验中数据结果被错误解读。不管首选策略是什么,随着未来几年靶向蛋白降解领域的研究不断加强,利用更高通量技术和更自动化平台来加速药物发现是一项有价值的投资。SLAS Discovery:C4 Tx团队开发一种小分子诱导泛素化动力学检测方法 目前大多数靶向蛋白降解化合物借助最常见的E3泛素连接酶,主要是Cullin环连接酶CRBN或VHL。化合物在E3连接酶和靶蛋白之间形成三元复合物,并促进E3连接酶催化靶蛋白泛素化,多泛素化靶蛋白随后被细胞蛋白酶体降解。BiDACs以催化方式驱动靶蛋白泛素化,时间依赖性的诱导靶蛋白持续降解。作为新兴的治疗策略,理解蛋白质降解的催化基础对于靶向蛋白质降解表征和效用至关重要。 依赖CRBN双功能蛋白降解化合物(BiDAC)的催化速率是药物发现过程中需要考虑的重要参数。C4基于毛细管的全自动数字化WB技术,开发了一种无细胞裂解物泛素化的体外系统来检测BRD4溴结构域1(BD1)泛素化的动力学。采用全自动Digital WB来进行BD1和BRD4泛素化水平,研究发现 BiDAC 在泛素化速率、亲和力和协同性方面存在显着差异,并遵循快速平衡模式。此外,量化发现不同化合物之间泛素化模式有所不同。本研究提供一个框架来优化BiDAC,进而提高三元复合物形成亲和力和泛素化率。只有在形成稳定的靶蛋白-BiDAC-E3泛素连接酶三元复合物时才能高效特异性泛素化靶蛋白,但三元复合物形成不一定决定泛素化率。通过检测无细胞裂解物中BD1结构域泛素化初始速率,来了解相同化学系列BiDAC是否在催化效率方面和热力学参数方面差异。 下图A中 3个化合物CFT-0251,CFT-0743和CFT-0660在不同浓度下,90min时BD1泛素化免疫印迹条带。下图B中用 DMSO或300nM CFT-0251处理样品,不同时间点的BD1和 BD1_Ub代表性化学发光定量峰图。通过Digital Western检测在4个时间点,根据每个时间点获得的曲线下峰面积AUC测量BD1转化为泛素化偶联BD1的量。90分钟时间内DMSO对照显示很低背景泛素化水平。相比之下,CFT-0251在300nM浓度时泛素化水平最高,BD1在整个实验过程中发生明显的泛素化,进而导致蛋白降解。 BiDAC诱导的BD1泛素化水平在不同泛素化位点可变的。下面A图 BD1泛素化模式量化10个化合物对BD1结构域无赖氨酸泛素数量。随着时间变化,最大活性浓度下测试各种BiDAC,只有CFT-0743结果双泛素化比单泛素化更多。 了解泛素化率有助于深入了解BiDAC系列化学过程,可优化E3连接酶降解目标蛋白质过程。特别是对于挑战性的目标蛋白,其中泛素化率可能被证明是需要优化的关键参数。需要开发定量描述热力学和降解动力学的方法工具,来全面了解BiDAC诱导的蛋白质降解过程以及循环的每一步对整体降解速率的影响。降解标签(dTAG)技术验证蛋白质降解靶标 常规的靶标确认策略包括RNAi或 CRISPR/Cas9破坏基因表达,从而导致细胞总蛋白水平降低 ,或使用小分子拮抗剂抑制蛋白功能。小分子药理学方法较单纯的基因方法具有许多优势,包括剂量依赖性效应以及快速且可逆的作用。相比之下,基因方法提供的动态控制较少、无法确定有效剂量且通常完全不可逆。dTAG 靶标确认技术结合了基因和药理学策略的技术优势,可快速提供细胞总目的蛋白丰度的剂量依赖性效应,且在降解剂洗脱方面,这种效应是可逆的。靶向蛋白降解剂会敲低整个蛋白质,影响蛋白功能。因此,新的降解剂开发需要评估潜在靶点,靶点验证是一项重要工作。dTAG降解技术提供了一种可复制推广的策略,原则上可降解任何细胞内感兴趣的蛋白质(POI)。它主要优点是不依赖于蛋白配体或PROTAC的预先存在,具有广泛地适用性,使其成为蛋白靶标发现和确证的有效策略。dTAG 的作用机理 通过CRISPR/Cas9 介导的基因座特异性敲入或慢病毒转基因表达,靶蛋白表达为一种具有 FKBP12F36V 突变体的嵌合体。dTAG-13等 dTAG 化合物由一个高选择FKBP12F36V 配体与 E3 连接酶配体连接组成,该配体在融合蛋白和 E3 连接酶之间形成一个三元复合体,从而引起靶蛋白多聚泛素化和降解,dTAG-13 已被用来检测和验证癌症新靶点。 下图利用dTAG降解剂处理表达FKBP12F36V 融合蛋白,评估探索剂量依赖性降解反应。利用Digital WB检测蛋白降解水平,最高剂量500nM下观察到最大降解。在这种情况下,与 5nM dTAG-13 处理相比,用相应的阴性对照 (dTAG-13-NEG) 处理似乎略微降低了目标蛋白水平。A图CRBN募集dTAG降解剂dTAG-13,B图是VHL募集的dTAG降解剂dTAGV-1。与 dTAG-13处理一样,观察到剂量依赖性降解,最高测试剂量 (500 nM) 下观察到最大降解。右图条带图和峰面积图定量数据显示两个dTAG降解剂之间的灵敏度差异。与 dTAG-13相比,用dTAGV-1处理后的降解更敏感,在这种情况下,dTAGV-1将用于后续实验的首选降解剂。 采用dTAGV-1处理野生型FKBP12和FKBP12F36V 靶标2细胞,Digital WB可直接反应融合蛋白与野生型分子量变化,同时准确检测dTAGV-1剂量依赖性降解反应。 通过以上案例,可知传统免疫印迹方法重复性较差、定量不准确和操作时间长等技术限制,很难满足蛋白泛素化水平检测和靶标验证的精准定量需求。Digital WB技术是基于毛细管电泳的快速定量免疫学检测方法,可检测靶蛋白和泛素化蛋白表达水平,进而准确反应靶向蛋白降解研究过程量效关系和时效关系。Digital WB技术可灵敏地、快速地、可重复性确认内源性蛋白降解,以确保与初步筛选实验中高通量技术获得一致性实验结果,是RPOTAC技术平台构建的必备技术。已被GSK、Pfizer、Arvinas、Kymera therapeutics、C4 therapeutics,药明康德和康龙化成等领先RPOTAC药物研发和服务公司采用。PROTAC 是 Arvinas, Inc. 的注册商标,BiDAC是C4 therapeutics的注册商标。其他商标和注册商标是其各自所有者的财产,本文引自如下文献:1. Jeffrey R. Simard, Linda Lee etc. (2021). High-Throughput Quantitative Assay Technologies for Accelerating the Discovery and Optimization of Targeted Protein Degradation Therapeutics. SLAS Discovery. Vol. 26(4) 503–5172. Ellen F. Vieux, Roman V. Agafonov etc. (2021). A Method for Determining the Kinetics of Small-Molecule-Induced Ubiquitination. SLAS Discovery. Vol. 26(4) 547–559
企业动态
2021.09.03
ProteinSimple 2021中国学者研究奖正式启动!
企业动态
2021.09.01
《Cell Stem Cell》:全自动Digital Western助力阿尔兹海默症干细胞研究
2021年6月7日,FDA宣布加速审批渤健生物(Biogen)单抗药物Aduhelm(Aducanumab:靶向β淀粉样蛋白单抗)上市,用于治疗阿尔兹海默症(Alzheimer’s disease, AD)源性轻度认知障碍(Mild cognitive impairment, MCI)及轻度阿尔兹海默症。这是自2003年以来,FDA批准的首个阿尔兹海默症治疗新药,也是首个能阻止AD疾病进展的药物。在此之前FDA批准针对AD的药物都属于症状缓解类药物,不会改变病程或潜在的神经变性。因此Aduhelm获得批准上市后,受到了全球各界人士的关注与争论。当然也为无数研究AD疾病的科学家带来了曙光和鼓舞。来自美国和奥地利等地的科学家,将阿尔兹海默症患者的成纤维细胞直接诱导神经元(Induced neurons, iNs),此神经元模型保留了人类衰老的重要表征,相应结果发表在Cell Stem Cell(IF:20.860)。研究背景研究AD疾病机理或者药效学的科学家往往利用一种模拟AD患者的病理生理学的模型系统。例如可以从AD患者的成纤维细胞生成诱导性多能干细胞(Induced pluripotent stem cell, iPSC),再由iPSC诱导生成神经元,这些神经元在分化的早期阶段,通常会表现出AD的相关表型,例如Aβ生成升高等。但是重新编程为的iPSC衍生的神经元几乎没有其供体年龄的痕迹,因此iPSC相关的细胞再生在尝试模拟年龄依赖性疾病时是一项重大挑战,这意味着用iPSC诱导产生的神经元作为研究年龄依赖性的阿尔兹海默症的模型仍然会有很多不足。研究内容来自美国和奥地利等地的科学家,使用AD患者的成纤维细胞直接转化诱导神经元(iNs),从而生成了一个与年龄等效的神经元模型:AD患者来源的iNs表现出强大的神经元转录组特征,即具有成熟神经元特性的下调、未成熟神经元特性和祖细胞样信号通路的上调。纵向神经元分化轨迹数据表明AD iNs具有一种应激、细胞周期和去分化为特征的未成熟神经元特性。表观遗传分析揭示了AD iNs存在一种潜在的异常神经元状态,它与恶性转化和年龄依赖性表观遗传损伤有相似之处。而由AD iPSC衍生的神经元,这些神经元没有显示出显著的疾病相关转录组特征,表明成纤维细胞衍生的iNs更接近地反映老年人大脑阶段。进而验证了AD相关的神经元变化是一种年龄依赖型的神经元损伤。全自动Digital Western检测iNs中Tau蛋白Total Tau(TG5):总Tau蛋白P-Tau Ser396/404:Ser396/404位点磷酸化的Tau蛋白P-Tau Thr212/214:Thr212/214位点磷酸化的Tau蛋白Misfolded Tau:错误折叠的Tau蛋白利用全自动Digital Western技术检测iNs中的不同类型Tau蛋白水平,结果显示了iNs中Tau蛋白不同的异构体分布情况以及不同磷酸化修饰和错误折叠的Tau的表达情况。对不同Tau蛋白的化学信号图谱做进一步分析,发现带有相同颜色的信号峰可以作为总Tau不同来源峰的鉴定。正因为全自动Digital Western是化学发光信号的图谱直接进行峰面积定量,定量后的数值再拟合为Western泳道图,所以真正体现了Western的数字化,及Digital Western!
企业动态
2021.08.17
Delta来袭 | Nature:一剂起效新冠病毒候选减毒活疫苗
全球新冠疫情受Delta变异株席卷,各个国家关于加强针的讨论十分激烈。Delta变种的传染率前所未有,对比新冠病毒原始毒株高出43%以上。科兴灭活疫苗三针加强数据近日首次披露,疫苗接种6个月后,需要第三剂强化。接种第三剂后,28天中和抗体滴度比第二剂后28天中和抗体滴度显著增加3-5倍。目前,大部分疫苗需要接种两针。莫德纳(Moderna)CEO Stephane Bancel指出,Moderna的mRNA疫苗由于不会提供永久保护,可能需要补打第三针。我国智飞生物曾发布公告,其重组蛋白疫苗需要接种三剂。晕针的小伙伴们听闻此消息不禁胳膊一紧。是否有接种一剂,就起到终身防护作用的疫苗呢?是否有接种一剂,就能起到多种传染病免疫保护的疫苗呢?比利时鲁汶大学Rega研究所的病毒学家率先在仓鼠上实验成功,接种一剂基于黄热病毒YF17D载体的新冠病毒候选减毒疫苗(YF-S0)即可保护仓鼠免受新冠病毒和黄热病的感染。本项研究发表在Nature(IF:43)杂志上。研究结论候选疫苗YF-S0具有良好的安全性,可诱导仓鼠、小鼠和猕猴产生高水平SARS-CoV-2中和抗体,并同时产生具有抗黄热病的保护性免疫;体液免疫由小鼠中Th1细胞介导的免疫反应补充;在仓鼠和非人类灵长类动物模型中,YF-S0可预防SARS-CoV-2感染;单剂量注射即可在10天内保护大多数接种过疫苗的动物免受肺部疾病侵袭;为何选择黄热病毒减毒株YF17D为疫苗载体?黄热病毒减毒株YF17D疫苗载体,可快速诱导广泛的多功能先天免疫、体液免疫和细胞介导的免疫反应。YF17D作为疫苗载体,安全吗?YF17D做为载体,已有两个获批许可上市的人类疫苗:日本脑炎(Imojev® )和登革热病毒(Dengvaxia®)。试验动物模型及免疫流程?仓鼠、小鼠和猕猴研究展望该项研究基于临床前动物实验,单剂接种后可快速产生高质量保护性免疫反应,需要正式的临床试验数据加以证明。不过小编和大家一样真心期待,一剂就起效的疫苗尽早上市!要疫苗,不要疫苗苗苗。ProteinSimple全自动Digital Western贡献&亮点不同YF-S候选疫苗转导BHK-21细胞后,SARS-CoV-2刺突蛋白(S1/2, S0和S1) 表达免疫印迹分析。分析前,细胞裂解液经PNGase F(肽-N-糖苷酶F)处理后,去除其N-连接寡聚糖或者未经处理(黑箭头:糖基化形式的S蛋白;白箭头:无N-连接寡聚糖的去糖基化蛋白)。对同一试验进行两次重复,得到相似结果。研究人员利用ProteinSimple全自动Digital Western Blot系统,检测候选减毒疫苗(YF-S0)抗原 S 蛋白(糖基化和去糖基化的 S1/2, S0,S1)的表达情况。分子量高达440 KDa的糖基化S1/2和S0蛋白,可轻松检出。对于小分子量蛋白(细胞因子、趋化因子、神经递质,等等),全自动Digital Western Blot系统的检测下限为2 KDa。从该组图片中,不难感受到突破传统Western Blot的极佳重复性。参考文献:A single-dose live-attenuated YF17D-vectored SARS-CoV-2 vaccine candidate[J]. Nature,2021.
企业动态
2021.08.10
疫苗专题 · MFI在疫苗开发中的应用
图片来源于新华社2021注定又是不平凡的一年,河南同胞们刚刚历经了特大暴雨的浩劫,Delta变种病毒在全球多个国家和地区横行肆虐。疫情中,奥运健儿们排除万难,为全球观众带来一场又一场的精彩比拼。第32届奥林匹克运动会于2021年7月23日在日本东京拉开了帷幕,本应于2020年举行的运动盛会,由于“不速之客”新冠疫情而推迟了一年。全员佩戴口罩也成了本届奥运会的“亮点”之一。法规要求自新冠肺炎爆发以来,疫情的“防”和“治”是全球的焦点,而疫苗一直被认为是病毒防控最有效、最实用的措施。这场席卷全球的新冠肺炎,也随着多个新冠疫苗的问世,得到了一定的控制。然而,我们都知道向世界偏远地区分发疫苗会面临非常多的挑战,因为在整个过程中,不可避免地会受到许多压力的挑战,如温度、光线和震荡。这些因素都可能导致疫苗失去效力。因此,疫苗配方开发的主要目标之一就是确保免疫原性成分,能够克服制造、储存和分发过程中的诸多挑战和压力。生物制品的聚集对生物技术产业造成了许多威胁。此外,它的影响在产品生命周期的任何阶段都是有害的,包括蛋白质重新折叠、产品纯化、灭菌、运输和储存。虽然,聚集通常与蛋白质的物理不稳定性有关,但是,疫苗中的其他成份,例如,无机物佐剂盐、佐剂乳剂、基于脂类的免疫刺激剂或整个减毒微生物也能导致聚集。由于可见和不可见的蛋白质聚集物,可能会表现出不可预测的免疫反应,因此,监管机构对此有明确规定。法规要求:中华人民共和国药典研究方法疫苗研发及生产人员一般会使用多种方法对聚集体进行表征,以及对颗粒大小进行检测。众所周知,聚集体可能会导致潜在的不良反应,如免疫反应的变化可能会影响药物疗效。为了控制和全面表征颗粒,会使用一系列的分析技术。但遗憾的是,目前没有一个单一的分析方法可以涵盖整个颗粒大小范围。因此,不同的技术方法被用来表征从纳米、微米到可见颗粒。建议使用各种正交方法,对结果进行全面的分析比较。用来检测颗粒数目和大小分布的方法主要包括(但不限于):动态光散射,纳米颗粒追踪分析仪,光阻法,分析型超速离心、库尔特颗粒计数仪、激光衍射和微流成像(MFI(Micro FLow Imaging),ProteinSimple )。MFI原理微流成像技术,因其高灵敏性,以及可以对高度透明的颗粒进行表征和计数,在疫苗行业中被广泛使用。MFI的检测原理:样本在流经样本检测池(Flow Cell)的过程中,在固定的检测窗口处,由高频成像检测器动态连续检测样品本中的颗粒物,获取一系列的数据照片,最终通过软件对所获取的颗粒照片进行归类和计数分析的自动化系统。MFI应用01重组蛋白疫苗:铝佐剂制剂开发近一个世纪以来,佐剂的免疫原性已为人所知。如今,铝盐被广泛用作佐剂,以增强T细胞对纯白蛋白和亚单位疫苗的反应。来自辉瑞公司药物研发部的科学家们考察了制剂配方条件对含铝佐剂疫苗可再悬浮性的影响。他们使用了MFI对颗粒粒径进行分析来表征悬浮性能。离子强度、pH和抗原浓度会显著影响颗粒大小和再分散。MFI结果显示,无抗原的磷酸铝佐剂内的颗粒粒径和pH值相关。与pH=4和pH=6相比,当pH=5时,≥2μm的颗粒浓度有明显增加,是因为磷酸铝颗粒的相互作用增强,进而导致≥2μm的颗粒数的增加。02重组蛋白疫苗:抗原制剂开发来自堪萨斯州大学药物化学系疫苗分析与配方中心的科学家们致力于使用非复制型轮状病毒(NRRV)重组疫苗的开发。他们认为,虽然疫苗的有效性主要取决于其成分(如抗原和佐剂),研制稳定疫苗的配方同样重要,以确保在疫苗生产、长期储存、运输和使用期间的安全性和有效性。研究发现,NRRV抗原(P[4]、P[6]和P[8])对震动压力很敏感,Shaking 6小时之后,P8抗原聚集形成的颗粒明显增加。Shaking 6小时后,使用MFI分别检测三种抗原样品内2-100μm的颗粒浓度MFI采用的微流成像技术,可以对样品内的颗粒进行成像。从MFI的检测结果图片发现,每种抗原内的颗粒形态均为不透明的纤维状。由于NRRV抗原经过Shaking,很容易形成聚集体,他们筛选了35种制药行业常用的赋形剂对P[8]抗原形成聚集体进行改善。研究结果发现,许多赋形剂,如Triton X-100,Pluronic F-68, Brij-35, PS-20和 PS-80都能改善P[8]抗原颗粒聚集体的形成;2-OH propyl β-CD和PS-80能改善P[4]抗原颗粒聚集体的形成。该项研究中,科学家们也对不同浓度的赋形剂效果进行了研究,发现PS-80在浓度为0.025%时效果最明显。在文章最后,他们还进行了多种赋形剂联用效果的研究。参考文献:Langford A , Horwitz T , Adu-Gyamfi E , et al. Impact of Formulation and Suspension Properties on Redispersion of Aluminum-Adjuvanted Vaccines[J]. Journal of Pharmaceutical Sciences, 2020, 109( 4):1460-1466.Bansal R , Gupta S , Rathore A S . Analytical Platform for Monitoring Aggregation of Monoclonal Antibody Therapeutics[J]. Pharmaceutical Research, 2019, 36(11).Agarwal S , Sahni N , Hickey J M , et al. Characterizing and Minimizing Aggregation and Particle Formation of Three Recombinant Fusion-Protein Bulk Antigens for Use in a Candidate Trivalent Rotavirus Vaccine[J]. Journal of Pharmaceutical Sciences, 2019, 109(1).Hasija M , Li L , Rahman N , et al. Forced degradation studies: an essential tool for the formulation development of vaccines[J]. Vaccine Development & Therapy, 2013:11-33.可覆盖检测1 - 300μm的亚可见颗粒全自动轻松检出半透明&高透明亚可见聚集颗粒准确检测高浓度或高粘度溶液中颗粒粒径并计数,符合21 CFR Part 11可有效区分不同颗粒来源(内源性&外源性):蛋白聚集、硅油、气泡、纤维等
企业动态
2021.08.09
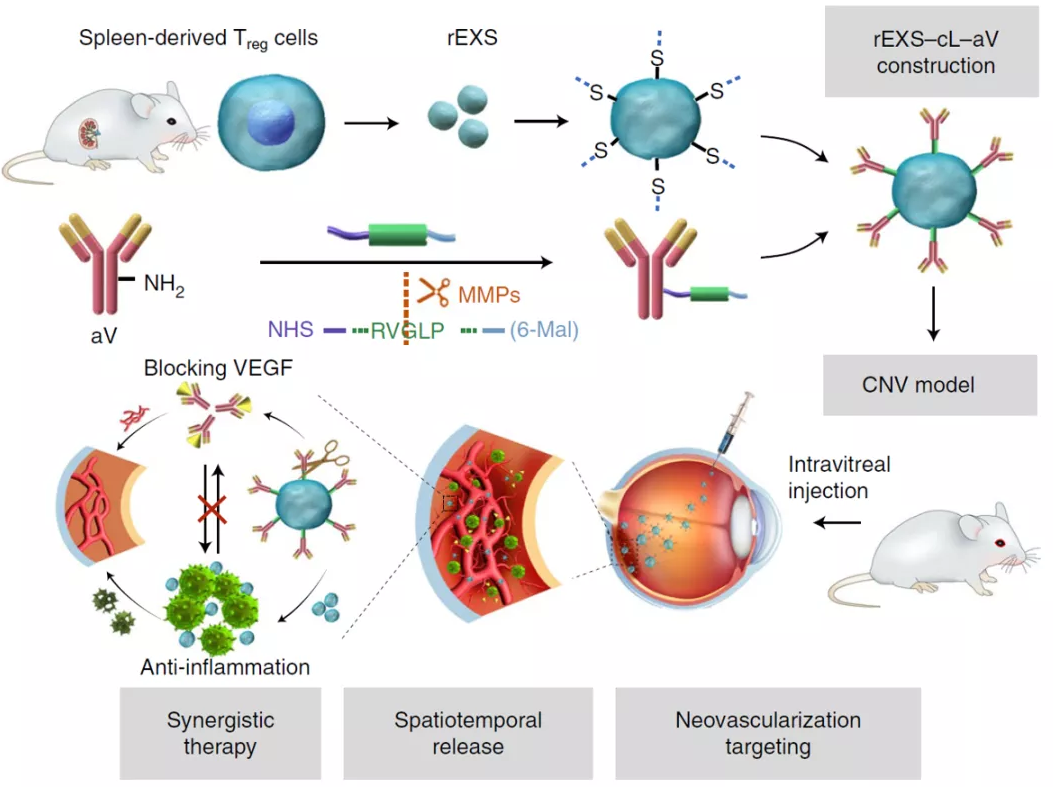
捷报:全自动毛细管Western助力外泌体智能递送药物研究再发Nature子刊
捷报:7月26日,中国科学院过程工程研究所生化工程国家重点实验室与北京朝阳医院、澳大利亚昆士兰大学合作,利用全自动毛细管Western技术,研究调节性T细胞外泌体智能递送VEGF抗体用于眼底新生血管性疾病联合治疗发表在Nature Biomedical Engineering(IF:18.952)。研究背景年龄相关性黄斑变性和糖尿病性视网膜病变诱发的新生血管的形成是导致失明的两个主要原因,通常的治疗方案是使用靶向血管内皮生长因子(VEGF)的抗体(anti-VEGF antibodies (aV))进行治疗。尽管治疗的早期阶段aV具有更高的有效性,但仍有50%–67.4%的aV治疗的老年性黄斑变性患者,在治疗2年后有视力恢复不佳等情况发生。在糖尿病视网膜病变中的患者中,对aV治疗的抵抗率(持续性黄斑增厚)也约为40%。这意味着aV在眼部新生血管病变中的药效不是很理想,或者还有其它致病因素如炎症等因素需要考量。有研究报道,与接受白内障手术的没有其它眼部病变的患者相比,脉络膜新生血管(CNV)或视网膜新生血管(RNV)的患者的房水中炎性细胞因子水平升高,且这些炎症标志物与眼部新生血管疾病中VEGF产生的增加呈正相关。因而,炎症不一定是新血管形成的结果,也有可能是驱动眼部新生血管形成的主要致病因素之一。而原有使用激素疗法来抗炎的案例又有不良反应发生,因此急需一种新型的联合给药方式(抗VEGF+抗炎)出现。研究内容中国科学院过程工程研究所生化工程国家重点实验室与北京朝阳医院等地的科学家,基于VEGF和炎症的协同活性促进眼部新生血管形成的机制,开发了一种针对抗VEGF和抗炎症的联合疗法。利用体内具有天然抗炎活性的Treg来源的外泌体(rEXS)为载体,通过基质金属蛋白酶(MMP)敏感肽段(cL)连接VEGF抗体(aV),创建了rEXS-cL-aV体系。当玻璃体腔注射后,利用rEXS向炎症部位的趋化性,携带aV富集于眼底新生血管病灶,随后利用病灶部位高表达的MMP酶解敏感肽段cL并释放aV。在上述时空耦合递送的基础上,分别利用rEXS的抑制炎症作用和aV的抑制血管生成作用实现协同增效。全自动毛细管Western技术鉴定调节性T细胞外泌体VEGF抗体递送系统(rEXS-cL-aV)CD9, CD47, ALIX, TSG101: 外泌体marker(鉴定外泌体)CCR6:趋化因子受体(通过炎症趋化因子的梯度增强纳米药物在新生血管病变中的积累)IL-10,CTLA-4:Treg免疫抑制蛋白(鉴定此外泌体是Treg来源)aV:VEGF(鉴定递送药物VEGF抗体)β-Tubulin:内参(蛋白定量归一化)此研究中鉴定调节性T细胞外泌体VEGF抗体递送系统(rEXS-cL-aV),利用了全自动毛细管Western技术。因常规制备方法获取外泌体样本效率不高,因此用传统Western技术会常常面临样本量不足,无蛋白表达的困境。全自动毛细管Western技术,只需3μL样本,不到3小时直接获得24个样本定量结果。且此过程除手动加样+试剂后,无需任何手动操作,数据稳定重现性佳,是微量或珍稀样本蛋白定量的不二之选。
企业动态
2021.07.30
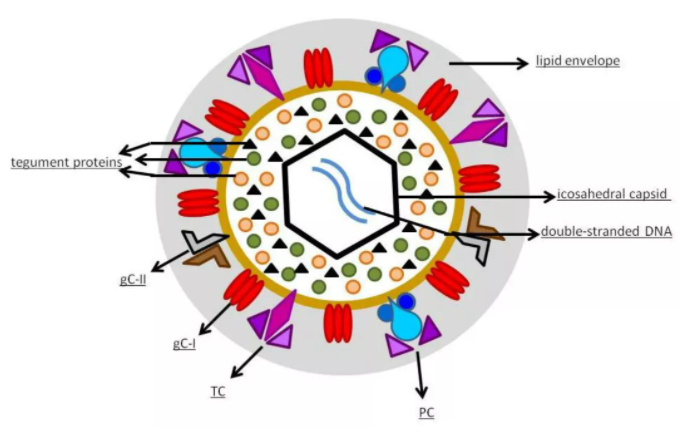
人类巨细胞病毒疫苗全球临床实验新进展|全自动毛细管Western技术再次助力Merck公司疫苗研究
继全自动毛细管Western Blot助力Merck公司全球首个预防埃博拉病毒病的商品化疫苗ERVEBO®上市后,近日,Merck公司疫苗分析研究进展与疫苗工艺开发部门再发文章:利用还原全自动毛细管Western Blot技术,定量人巨细胞病毒疫苗多种抗原水平,同时利用非还原的方法表征抗原蛋白额外二硫键和MW信息(多聚体抗原水平)。同时Merck公司还利用此方法确定了一些HCMV病毒中以前未知的生化特征:非还原条件中,病毒表面蛋白的三重gH峰,这可能会为HCMV病毒抗原的特异性测试提供一种新的策略。1人类巨细胞病毒人类巨细胞病毒(Human Cytomegalovirus, HCMV),属于β疱疹病毒亚科。根据地域的不同,世界上50%到90%的成年人口曾感染过HCMV。尽管感染HCMV很少会在健康成人中引起症状,但它却是引起移植受者器官衰竭的主要原因。同时感染HCMV会对人类整个生命周期的健康造成威胁:对先天性感染的儿童造成神经系统异常;对免疫抑制患者(移植病患或者免疫缺陷疾病AIDS患者)出现较高的发病率和死亡率;同时还会增加老年人死亡率、心血管疾病和癌症的风险。2人类巨细胞病毒结构HCMV具有一个二十面体衣壳,其中包含双链DNA,编码165种蛋白质。衣壳被蛋白质包膜包围,外部被一个脂质包膜包围,其糖蛋白通过与细胞膜融合进入宿主细胞。融合后,DNA和被膜蛋白被释放到细胞中。该病毒包含不同类型的糖蛋白复合物(glycoprotein complexes, gC),用于感染宿主细胞:gC-I是由糖蛋白B(glycoprotein B, gB)的同源三聚体组成的复合物,糖蛋白B(gB)是一种泛疱疹病毒科保守的糖蛋白,介导膜融合过程:即介导病毒进入细胞期间从融合前的构象重新排列为融合后的构象;gC-II是含量最丰富的gC,由糖蛋白M(glycoprotein M, gM)和N(glycoprotein N, gN)组成,有助于与细胞膜的初始结合,并在病毒复制中起作用;gC-III,现在称为三聚体复合物(Trimer complex, TC),是一种异源三聚体复合物,其中糖蛋白H(glycoprotein H, gH)、L(glycoprotein L, gL)和O(glycoprotein O, gO)连接在一起,gH和gL参与激活gB的融合活性,gO作为共同受体。还有一种五聚体复合物(Pentameric complex, PC)由gH/gL与UL128、UL130和UL131蛋白(pUL128–pUL131)组成,主要感染上皮细胞和内皮细胞,有研究发现这种五聚体复合物(PC)对于引发保护性体液免疫反应很重要,在自然感染中占>85%的中和活性。3全球HCMV疫苗临床实验进展4全自动毛细管Western Blot定量HCMV减毒活疫苗抗原全自动毛细管Western Blot:基于毛细管电泳的免疫学检测方法,只需3μL样本,一次性加好样本和反应试剂(blocking液、一抗、二抗、显色液、洗液),开始上机实验,仪器自动上胶、加样、跑胶、紫外交联蛋白、一抗二抗孵育、显色定量,CCD相机直接获取化学信号,不出3小时直接获得24个样本定量结果。此过程除手动加样后,无需任何手动操作,数据稳定重现性佳(Merck结果CV全自动毛细管Western Blot助力全球首款埃博拉疫苗ERVEBO®上市)。Merck公司正在进行的减毒活病毒HCMV疫苗(V160)的II期临床试验中,在减毒活AD169病毒株表面恢复了五聚体复合物。因此重建的HCMV病毒含有多种表面糖蛋白:五聚体gH/gL/gUL128-131复合物、三聚体gH/gL/gO复合物、gB糖蛋白和gM/gN异二聚体复合物。因此Merck公司利用全自动毛细管Western Blot定量的方法,监测在疫苗开发过程中的多种病毒表面抗原。还原毛细管Western Blot法鉴定9种抗原蛋白在无(-)和有(+)PNG-F酶处理的情况下,还原毛细管Western Blot法鉴定HCMV中的9种糖蛋白:gH、gL、UL128、UL130、UL131、gO、gB、gM和gN。原始峰形图(PNG-F酶处理前为蓝色峰,PNG-F酶处理后绿色峰)显示,PNG-F处理后的MW shift 取决于每个糖蛋白上有多少N-连接的聚糖位点。N-连接的聚糖位点越多,偏移越大。例如有18个N-连接的聚糖位点的gO(偏移很大)和不含N-聚糖位点UL128(两峰趋近一致)。非还原毛细管Western Blot法鉴定不同聚体复合物毛细管Western Blot可以提供特定病毒抗原的额外二硫键和MW信息。例如用非还原毛细管Western Blot检测发现,用抗gH抗体观察到~90kDa、~120kDa和~205kDa的三重峰。当使用抗gL抗体时,仅观察到120kDa和205kDa处的两个峰。当用抗UL128和抗gO抗体探测时,分别检测到120 kDa和205kDa处的峰。这些数据明确表明,120kDa处的峰分配是由于gH-gL-UL128复合物,它是五聚体复合物(gH-gL-UL128-UL130-UL131)的一部分,其中UL130和UL131是非共价结合的。在205kDa处观察到的峰被确认为gH-gL-gO三聚体复合物。在原始峰形图上观察到的三联体的gH峰,并不是HCMV疫苗病毒(V160)独有的,因为两个临床分离株的HCMV也显示了三联体的gH峰。因为AD169病毒株没有五聚体复合物(gH-gL-UL128-UL130-UL131),所以不显示~120kDa的峰。同时结果也表明V160中gH单体(~90 kDa)和gH-gL-gO三聚体复合物(~205 kDa)的相对ratio与亲本病毒AD169相当。用抗gM和gN抗体检测到,在~138kDa 和236kDa处具有相同的两个峰:138kDa峰可能是实际的gM/gN复合物,而236kDa为二聚体(gM/gN)2。毛细管Western Blot监测疫苗发酵工艺利用特异性的三重gH峰面积可用于评估发酵过程中对五聚gH复合物的潜在影响。对九个开发批次的V160中,对五聚体gH复合物百分比进行了比较。第1至第4批是在工艺优化之前生产的,与工艺优化后生产的第5至第9批相比,其gH-gL-UL128(五聚体复合物)含量较低。同时毛细管Western Blot结果表明,五聚体的产量在感染后11-13天开始趋于稳定。此外与生物反应器3和4相比,生物反应器1和2提供了更好的五聚体表达。这一观察结果与微流式细胞仪测量的病毒颗粒浓度相吻合。毛细管Western Blot绝对定量五聚体抗原毛细管Western Blot绝对定量法的线性、R2、精密度、准确度如图所示,揭示了毛细管Western Blot绝对定量法可以用于定量HCMV的糖蛋白。用重组五聚体蛋白作为标准品,利用毛细管Western Blot绝对定量法绘制标准曲线(图A-C),用此方法定量疫苗样本中的五聚体抗原(图D)。与Elisa法定量疫苗样本中的五聚体抗原相关性R2=0.9941.结论:利用毛细管Western Blot方法检测抗原蛋白,不需要纯化样品,因此该方法适用于分析多种样品类型中的目标蛋白,例如来自感染细胞培养物的上清液、纯化中间体、浓缩液和最终疫苗产品。同时此方法不只可以定量抗原蛋白,还可以利用非还原的方法表征抗原蛋白额外二硫键和MW信息。在此方法中还确定了一些HCMV病毒中以前未知的生化特征:非还原条件中,病毒表面蛋白的三重gH峰,这可能会为HCMV病毒抗原的特异性测试提供一种新的策略。参考文献:1. Characterization of gH/gL/pUL128-131 pentameric complex, gH/gL/gO trimeric complex, gB and gM/gN glycoproteins in a human cytomegalovirus using automated capillary western blots, Vaccine. 2021 Jul 3.2. Cytomegalovirus as an immunomodulator across the lifespan, Curr Opin Virol. 2020 Oct.3. Development of a Vaccine against Human Cytomegalovirus: Advances, Barriers, and Implications for the Clinical Practice, Vaccines (Basel). 2021 May 25.
企业动态
2021.07.29
BioNtech和Moderna mRNA疫苗研究新技术 | ProteinSimple Ella 全自动微流控ELISA
随着中国复星医药引进德国BioNtech mRNA新冠疫苗脚步加快,特别是近期国家药监局已完成专家评审,正在进行行政审批阶段,上市已经指日可待。鉴于中国大陆目前广泛接种了灭活病毒疫苗和腺病毒疫苗,此mRNA疫苗一旦获批,面对多款不同技术路径疫苗,如何施打? 是需要进一步研究和探讨的课题,是否可作为加强针与中国现有的疫苗混打?这些课题需要参考国际上相关研究成果和经验。本文重点综述mRNA疫苗研究中Ella全自动微流控ELISA技术应用案例,包括疫苗混打研究中相关指标检测。Ella全自动微流控ELISA技术是ProteinSimple研发和生产,作为创新型循环系统蛋白质标志物检测平台,已被广泛用于新冠病毒研究和mRNA疫苗开发中。01柳叶刀:BioNtech和阿斯利康疫苗混打研究本研究(CombiVacS)旨在评估第一针接种ChAdOx1-S疫苗(Vaxzevria, AstraZeneca, Oxford, UK)人群,第二针接种BNT162b2 (Comirnaty, BioNTech, Mainz, Germany)作为加强针的免疫原性和反应原性。本研究是西班牙五所大学附属医学院进行的一项多中心、开放标签、随机对照的临床II期实验研究。采用假病毒中和试验来评估抗体功能,并采用干扰素-γ(IFN- γ) 免疫试验来评估细胞免疫反应。血浆中细胞因子IFN- γ浓度采用Ella全自动微流控ELISA定量评估。作为新一代免疫学检测技术Ella以全自动化、标准化和高精度等技术优点受到了专家们认可,适合进行多中心临床实验数据检测和对比统计分析。本研究结果发现,对照组在第0天和14天IFN- γ浓度值无明显变化,而混打疫苗干预组,14天IFN- γ浓度(521.22 pg/mL)比第0天IFN- γ浓度(129.63 pg/mL)有显著增加。采用Ella检测IFN- γ水平,已成为评价疫苗细胞免疫效果的重要和快速技术手段。图1. 干预组与对照组在混合接种疫苗D0和D14天 IFN-γ释放值对比02bioRxiv:感染过新冠病人可能无需注射第二针疫苗针对COVID-19 mRNA疫苗开发和部署加速了全球疫苗接种计划,目前德国BioNtech疫苗BNT162b2已被证明在未感染个体可提供95%的效力,但第二针疫苗对先前感染新冠康复个体的影响一直受到质疑。该研究是西班牙La Paz医院、美国纽约西奈山伊坎医学院和杜克-新加坡国立大学医学院等多个单位合作,作者通过比较未感染和先前感染个体接种BNT162b2疫苗的体液免疫和细胞免疫指标,发现对第二剂可提高未感染个体的体液免疫和细胞免疫,而与之相反,第二剂疫苗导致COVID-19康复个体细胞免疫力降低。图2结果表明,注射第一剂疫苗10天后,与未感染个体相比(110.4 pg/mL, N=20),先前感染COVID-19康复个体(520 pg/mL,N=21)具有更强的IFN-γ反应。20天时,新冠康复个体维持T细胞免疫反应,而未感染个体IFN-γ反应迅速下降。令人预想不到的是,接种第二针后10天,COVID-19康复个体的IFN-γ产生浓度显著下降,这些发现表明,康复个体似乎没有从第二针接种中受益。图2. 不同时间截点,采用Ella平台检测和评估IFN-γ浓度03bioRxiv:快速检测新冠T细胞免疫应答宽动态范围方法2021年6月,杜克-新加坡国立大学Antonio Bertoletti教授团队,发表题为“Rapid determination of the wide dynamic range of SARS‐CoV‐2 Spike 1 T cell responses in whole blood of vaccinated and naturally infected”文章。该研究详细描述一种简单快速实验方案,可高效评估接种新冠疫苗和自然感染者全血中T细胞免疫应答。目前,主要采用ELISPOT和基于流式细胞技术活化诱导细胞标志物方法,这些传统方法的复杂性限制了病毒特异性细胞毒性T细胞应答检测能力。作者开发了一种基于Ella微流控ELISA技术的全血细胞因子释放测定 (CRA) 实验,可快速、简单和准确的对大量人群中的新冠T 细胞进行常规测量。现有研究表明,血清中和抗体的数量无法预测个体中相应的Spike特异性T细胞反应,基于Ella平台全血细胞因子释放实验可更精确地评估T细胞在感染或疫苗接种后的保护能力,可与抗体检测互补,有助于确定当前疫苗策略。图3. 工作流程对比示意图04Moderna:mRNA化学和制造工艺对先天免疫激活的影响先天免疫是人体免疫系统的第一道防线,可通过模式识别受体(PPR)识别入侵抗原的病原体相关模式分子(PAMP),启动级联反应进行免疫应答。mRNA作为外源核酸物质,进入体内可激活先天免疫应答,可阻止mRNA表达并降解mRNA。在体外RNA合成过程中会产生双链RNA(dsRNA),也会通过I型干扰素介导的免疫反应阻止mRNA翻译和降解mRNA。从这些方面看,mRNA本身和制造过程中杂质都可诱导先天免疫激活反应,导致对产品本身影响,需要尿嘧啶化学修饰和生产工艺调整,防止细胞先天免疫激活和随之而来的蛋白质表达减少。Moderna公司科学家通过设计多种细胞和体内模型,比较了编码人类促红细胞生成素(hEPO)mRNA经过经典尿嘧啶或N1-甲基假尿嘧啶(1mΨ)修饰,还有合成过程杂质dsRNA对免疫激活的影响。研究发现,尿嘧啶修饰和减少dsRNA杂质对于控制治疗性mRNA的免疫激活是必要和充分的。本研究采用Ella微流控ELISA检测细胞培养上清液和小鼠血清中hEPO和INF-β。图4. hEPO和INF-β检测结果Ella全自动微流控ELISA系统已成为国际领先的mRNA疫苗研发生物技术手段,并被众多临床机构所采用。同时,Ella平台也被用于新冠病毒病人细胞因子风暴CRS临床监测。Ella,以技术先进性、高灵敏度、高精度和高度自动化标准化,成为欧美细胞因子等蛋白标志物检测主流技术平台。参考文献:1. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet. Published Online June 25, 2021. S0140-6736(21)01420-32. Camara C, Lozano-Ojalvo D, Lopez-Granados E, Paz-Artal E, Pion M, Correa-Rocha R, et al. Differential effects of the second SARS-CoV-2 mRNA vaccine dose on T cell immunity in naïve and COVID-19 recovered individuals. bioRxiv. 2021:2021.03.22.436441. 3. Le Bert N, Clapham HE, Tan AT, Chia WN, Tham CYL, Lim JM, et al. Highly functional virus-specific cellular immune response in asymptomatic SARS-CoV-2 infection. J Exp Med. 2021;218(5). 4. Anthony Tan, Joey Ming Er Lim, et.al. Rapid determination of the wide dynamic range of SARS‐CoV‐2 Spike 1 T cell responses in whole blood of vaccinated and naturally infected. bioRxiv preprint, this version posted June 29, 2021. 5. Impact of mRNA chemistry and manufacturing process on innate immune activation. Nelson et al., Sci. Adv. 2020
企业动态
2021.07.21
全自动毛细管Western Blot助力全球首款埃博拉疫苗ERVEBO®上市
当国内抗击新型冠状病毒已经取得阶段性胜利,各地方政府推出各种积极鼓励政策,普及全民免费接种新冠病毒疫苗的时候,当地时间2021年5月3日,刚果(金)卫生部宣布,该国第12轮埃博拉疫情结束......“国民男神”张文宏医生曾与樊登对话时指出:“如果今年新冠的死亡率、病死率,是像埃博拉一样的,其实这个病还是比较容易控制的。”埃博拉病毒,一个既熟悉又陌生的名字。埃博拉病毒(EBOV)是一种膜包被的负单链RNA病毒,属于Filoviridae家族,编码7种结构蛋白。该病毒在人类和非人类灵长类动物中可引起严重的出血性发热、腹泻、呕吐、肌痛、肝肾功能损伤等临床症状。迄今为止,已确定6种埃博拉病毒,包括扎伊尔型埃博拉病毒(ZEBOV),该病毒对人类的致死率最高,死亡率为60% ~ 90%。2014年至2016年,西非国家利比亚、几内亚和塞拉利昂曾爆发了最大规模的埃博拉病毒,导致超过28000人感染,11000人死亡。这次史无前例的爆发主要是由扎伊尔型埃博拉病毒所引起,世界卫生组织(WHO)宣布进入国际关注的公共卫生紧急状态。2021年2月至5月,刚果(金)民主共和国北基伍省共发现确诊病例12例,其中死亡6例。埃博拉疫情能被一次又一次得到有效控制,死亡率降低,感染人数减少,不得不说,很大一部分原因是得益于埃博拉疫苗的普及。全球首个上市预防埃博拉病毒病的商品化疫苗ERVEBO®,即rVSV∆G-ZEBOV-GP疫苗,2019年已获得欧盟EMEA和美国FDA批准使用。此疫苗由全球领先的Merck公司研发生产,采用多种创新性的技术。其疫苗分析研究进展与疫苗工艺开发和商业化部门于2020年8月发表题为Characterization of rVSV∆G-ZEBOV-GP glycoproteins using automated capillary western blotting的文章, 披露了利用全自动毛细管Western Blot技术平台表征rVSV∆G-ZEBOV-GP糖蛋白的详细技术细节。研究背景EBOV主要通过由病毒糖蛋白(GP)介导的相互作用来感染宿主细胞。EBOV基因组由于转录停顿可产生三种不同的包膜GP变体。未编辑的RNA转录编码一个非结构分泌型GP(sGP)蛋白。开放阅读框(ORF)的+1转变,可产生一个结构上重要的病毒膜结合型GP蛋白。最后,ORF的+2转变,可产生一个非结构小型分泌型GP(ssGP)。每种蛋白在致病机制方面的作用先前已经描述。EBOV GP合成为一个多肽,被一种类似呋喃的蛋白酶裂解,生成一个异质二聚体,由GP1和GP2亚基组成,通过一个二硫键连接在一起。ZEBOV包膜GP蛋白的表面含有17个N-连接糖和许多糖基化位点。GP1负责与细胞受体的结合,有三个结构域,包括一个受体结合域、一个糖帽和一个非结构性的重度O型糖基化区域(粘蛋白样结构域)。GP2有一个跨膜结构域,负责与病毒的融合。GP2∆,发现于脱落GP蛋白,是TNF-a转换酶(TACE)对GP2进行酶切的结果。EBOV的细胞进入机制,是由组织蛋白酶的半胱氨酸蛋白酶介导的,它裂解完整的EBOV GP1,去除糖帽和粘液蛋白结构域,暴露出增加受体结合和病毒感染性的氨基酸残基。该项研究阐述了在整个rVSV∆G-ZEBOV-GP疫苗生产过程中,使用全自动定量毛细管Western Blot检测平台,研究和表征ZEBOV糖蛋白。自动化Western Blot与传统手工Western Blot技术平台相比有诸多优点:线性范围增加更高的通量因自动化而增强的重复性由于该技术的高特异性,毛细管Western Blot技术已被应用于疫苗产品和治疗性蛋白质的表征。该项目中,研究人员还进行了方法学对比,对比了传统手动Western Blot技术与全自动毛细管Western Blot检测技术。研究结论我们已开发和应用基于全自动毛细管Western Blot检测方法,去开发及生产ERVEBO®疫苗。使用该方法表征在疫苗生产的过程中,GP变体的类型和数量。毛细管Western Blot技术提供了与传统手动Western Blot系统相似的GP结果。但是,具有更好的重复性,更准确的定量,并更简单易用。该方法有助于表征疫苗生产中酶促反应步骤,评估下游纯化步骤中的变化,并确认多批次间的工艺稳定性。实验表明,使用VSV载体产生的GP、sGP和ssGP的相对数量与天然埃博拉病毒中观察到的不同。GP蛋白是在感染期间产生的,只有病毒粒子膜结合的GP包含在rVSVΔG-ZEBOV-GP疫苗最后的DP中。毛细管Westerns表明,ERVEBO®生产过程中的每个步骤都有独特的电泳图,该方法可以作为一个有利的工具,去评估生产过程的不同阶段。方法学对比根据工序,rVSV∆G-ZEBOV-GP使用1x样品缓冲液中稀释至7倍。初步稀释后,将样品在2个混合物(含样品缓冲液、二硫苏糖醇和荧光标准品)中稀释2倍,在70℃下加热10分钟。随后,样品经短暂涡旋去除气泡后,加载到12-230 kDa的样品板上。一抗(兔抗ZEBOV-GP)母液被加载到样品板前,用抗体稀释液(终浓度为2μg/mL)稀释1000倍。毛细管Western Blot仪器采购于ProteinSimple公司(Santa Clara, CA, USA)。仪器设置定义如下:分离时间设置为30分钟,一抗体孵育时间为30至60分钟,二抗体孵育时间为30至60分钟。使用仪器的化学发光检测通道在不同的曝光长度下进行检测。除非另有规定,曝光时间为2s。所有未指定的设置均采用供应商的默认选项。Merck早在2012年就曾发表文章指出,对比传统手动WB (罗氏于2005年发表:CV > 35%),ProteinSimple全自动Western Blot检测平台的数据CV值可以控制在10%以内。结果展示图1. 基于毛细管法获得的工艺步骤电泳图谱(A) 收获病毒液(HVF:Harvested virus fluid)为工艺流程中最早的步骤,即病毒转染后收获。包含:GP1(260 kDa)、未知(190 kDa)、可溶性GP(95 kDa)和GP2 + GP2∆(40 kDa);(B) 澄清病毒液(CVH:Clarified viral harvest)为工艺流程中的第二步,过死端过滤以去除细胞碎片和样品。包含:GP1(260 kDa)、可溶性GP(95 kDa)和GP2 + GP2∆(40 kDa),未知的190 kDa峰被去除;(C) 反应后病毒收获(RVH:Reacted viral harvest ),在纯化过程的酶解步骤之后。包含:由胰蛋白酶处理的GP1、可溶性GP(95 kDa)、GP2 + GP2∆(40 kDa)和较低分子量的蛋白质((D) 超滤产品(UFP:Ultrafiltration product),样品被超滤后。包含:GP1(95 kDa)和GP2(40 kDa),所有可溶性GP和脱落的GP被去除;(E) 药物产品(DP: Drug product),通过加入Tris和rHSA (recombinant Human Serum Albumin:重组人血清白蛋白)稀释DS(Drug substance:原药)至目标浓度。包含:GP1(95 kDa)和GP2(40 kDa),由于rHSA与一抗的交叉反应,DP中观察到一个约60 kDa的rHSA峰,DP浓度比UFP中低约2-logs。原药电泳图(补充信息图.1S)与UFP相似,因为其浓度与UFP相似,尽管含有rHSA作为稳定剂。图片中的峰高经过调整,以最好地呈现出每个样品。图2. 胰蛋白酶处理步骤的过程表征(A) 胰蛋白酶处理CVH样品时间过程电泳图,GP1峰在10分钟内从260 kDa转移到95 kDa,随着时间的推移,峰面积持续减少;(B) 加入胰蛋白酶抑制剂后结果,RVH样品在室温下进行Hold Time Study。在168小时内,GP1峰值持续缓慢下降。图3. 批间工艺一致性评价:通过峰面积评估四个不同批次的GP变体的百分比,以确保工艺一致性(A) 四个不同批次的CVH中GP和可溶性GP的峰面积百分比;(B) 其中一个批次的CVH的电泳图,显示峰值积分和分配;(C) 四个不同批次的UFP样品,显示峰面积分布;(D) UFP样品的电泳图,显示峰值积分整合和分配。四个批次CVH样品中,GP(包括GP1和GP2+GP2Δ)占总峰面积的78%,可溶性GP平均占22%。全自动毛细管Western Blot技术平台展望后疫情时代,我们依然需要居安思危,对科学与自然保持敬畏之心。潜心开发传统疫苗、亚单位疫苗、联合疫苗、核酸疫苗和治疗性疫苗,惠及人民。作为地球人,疾病无国界,先进技术无国界,爱与帮助也同样无国界。国外成熟的疫苗研发与生产技术路线,值得我们学习和借鉴。ProteinSimple全自动毛细管Western Blot技术平台,已被众多科研工作者使用,从事人用和兽用疫苗相关研发、生产和质控,包括埃博拉病毒疫苗,狂犬病病毒疫苗,肺结核病病毒疫苗,新型人乳头瘤病毒疫苗,SARS-CoV-2疫苗等等。正如ERVEBO®生产整个过程中,全自动毛细管Western Blot技术平台可呈现出独特的电泳图,去评估疫苗生产过程的不同阶段。其高质量高重复性数据(CV 代表文献 1. A single-dose live-attenuated YF17D-vectored SARS-CoV-2 vaccine candidate, L. Sanchez-Felipe, T. Vercruysse, S. Sharma, J. Ma, V. Lemmens, D. Van Looveren, M. Javarappa, R. Boudewijns, B. Malengier-Devlies, L. Liesenborghs, S. Kaptein, C. De Keyzer, L. Bervoets, S. Debaveye, M. Rasulova, et al., Nature, 2021; 590: 320–325.2. OvHV-2 glycoprotein B delivered by a recombinant BoHV-4 is immunogenic and induces partial protection against sheepassociated malignant catarrhal fever in a rabbit model, S. Shringi, D. O’Toole, E. Cole, K. Baker, S. White, G. Donofrio, H. Li and C. Cunha, Vaccines, 2021; 9:90.3. Analysis of the antigenic properties of membrane proteins of Mycobacterium tuberculosis, H. Li, L. Liu, W. Zhang, X. Zhang, J. Zheng, L. Li, X. Zhu, Q. Yang, M. Zhang, H. Liu, X. Chen and Q. Jin, Scientific Reports, 2019; 9:3042.4. Inactivated rabies virus-vectored immunocontraceptive vaccine in a thermo-responsive hydrogel induces high and persistent antibodies against rabies, but insufficient antibodies against gonadotropin-releasing hormone for contraception, X. Wu, Y. Yang, C. Kling, L. Seigler, N. Gallardo-Romero, B. Martin, T. Smith and V. Olson, Vaccines, 2019; 7: 73.5. Quantitation of CRM197 using imaged capillary isoelectric focusing with fluorescence detection and capillary Western, J. Loughney, S. Ha and R. Rustandi, Analytical Biochemistry, 2017; 534:19–23.6. Neutralization of diverse human cytomegalovirus strains conferred by antibodies targeting viral gH/gL/pUL128-131 pentameric complex, S. Ha, F. Li, M. Troutman, D. Freed, A. Tang, J. Loughney, D. Wang, I. Wang, J. Vlasak, D. Nickle, R. Rustandi, M. Hamm, P. DePhillips, N. Zhang, J. McLellan, et al., Journal of Virology, 2017; 91:e02033-16.7. Applications of an automated and quantitative CE-based size and charge western blot for therapeutic proteins and vaccines, R. Rustandi, M. Hamm, C. Lancaster and J. Loughney, Methods in Molecular Biology, 2016; 1466:197–217. 参考文献 1. Characterization of rVSVΔG-ZEBOV-GP glycoproteins using automated capillary western blotting, K. Minsker, R. Rustandi, S. Ha and J. Loughney, Vaccine, 2020; 38(45):7166–7174.2. Qualitative and quantitative evaluation of SimonTM, a new CE-based automated Western blot system as applied to vaccine development, R. Rustandi, J. Loughney, M. Hamm, C. Hamm, C. Lancaster, A. Mach and S. Ha, Electrophoresis, 2012; 33:2790–2797.3. Precision and variance components in quantitative gel electrophoresis, Koller, A. and H. Watzig, Electrophoresis, 2005; 26(12):2470-2475.
企业动态
2021.07.20
肿瘤生物标志物创新性检测方法及案例分享
肿瘤生物标志物是反映肿瘤存在的生化物质,涵盖了核酸、蛋白质、糖、小代谢物、细胞遗传学和细胞动力学参数,以及体液中发现的整个肿瘤细胞。这些生物标志物可用于风险评估、诊断、预后以及预测癌症的治疗效果,毒性和复发,特别是早期发现肿瘤可大大降低癌症死亡率并挽救生命。如何快速检测到这些标志物,结合基因组学、蛋白组学和代谢组学等技术手段,是目前生物医药研究的重点。近年来,随着蛋白检测技术的发展,越来越多的蛋白标志物研究成为肿瘤研究中新型生物标志物以及药物靶点的开发方向。肿瘤标志物常常存在于血清、体液、尿液、细胞或组织中,针对不同样本来源和蛋白分子特点,ProteinSimple开发了多种快速、高灵敏的创新性蛋白检测技术,致力于加快蛋白标志物基础研究和临床转化。全自动循环生物标志物定量检测技术:Ella人体血液、尿液和唾液中蛋白质已广泛用于临床检测,特别是癌症的筛查和诊断。针对这些样本来源标志物检测技术,目前主要以化学发光免疫分析、电化学发光、荧光免疫分析和酶联免疫分析方法(ELISA)等技术为主。但目前传统的免疫分析方法如ELISA检测某些样本还有局限,灵敏度不够高,导致静息状态下低丰度细胞因子比如IL-6,IL-5等无法准确定量。ProteinSimple开发的全自动高灵敏微流控ELISA系统Ella,已被耶鲁大学,纽约西奈山伊坎医学院等全球知名研究机构采用,为高灵敏、高重复性、自动化程度高的快速ELISA系统,可解决目前传统ELISA系统对循环蛋白生物标志物的检测需求。案例一:预测早期卵巢癌肿瘤标志物耶鲁大学医学院利用Ella平台研究卵巢癌病人样本,研究发现CA125, HE4, E-CAD和IL-6构成的4因子组合可作为预测早期卵巢癌的肿瘤标志物,比单因子CA125、单因子HE4、或者2因子CA125 + HE4更有优势。案例二:人类腹主动脉瘤预测评估生物标志物牛津大学科学家通过Ella检测人体腹主动脉瘤的蛋白质标志物(circulating proteins):CXCL10, IL6,IL8,Thrombospondin, RAGE, MIP1a, MIP1b, leptin和ICAM1,并结合生理指标(FMD, AAA size),可对人体腹主动脉瘤的生长情况做预测评估。全自动蛋白标志物定量筛选检测技术:Jess & Peggy Sue对于肿瘤标志物筛选的早期研究阶段,经常面临没有商品化ELISA试剂盒或自行包被ELISA试剂盒时缺少抗体对(只有一个抗体)的情况,从而给研究人员带来很大困扰。ProteinSimple公司开发的全自动Western Blot定量系统,只需要特异性的一抗,采用3-5μL 上样量,同时进行高达96个样本通量,快速定量检测蛋白标志物,是肿瘤生物标志物早期定量筛选的有力工具。案例一:多发性骨髓瘤病人样本分选CD138阳性细胞生物标志物定量筛选多发性骨髓瘤患者的骨髓样本,经过CD138+细胞分选后,一般情况下会面临:样本量少和浓度低的限制,而无法做蛋白质浓度的检测。西班牙萨拉曼卡癌症研究中心-IBMCC科学家利用ProteinSimple全自动Western Blot系统,建立了多发性骨髓瘤患者生物标志物的绝对定量检测模型,评估了12种潜在肿瘤蛋白质生物标志物的生物学和临床价值。建立了一种快速、高效、准确定量的药物靶点发现方法。案例二:检测肝癌外泌体生物标志物HMGB1是一种进化保守的DNA结合核蛋白,也是癌症、关节炎和败血症等多种疾病状态的损伤分子模式(DAMP)蛋白。HMGB1可在肿瘤来源的外泌体膜上表达,被肿瘤细胞释放到局部微环境中,可影响肿瘤细胞存活,扩增和转移。中山大学附属第三医院肝外科和肝移植中心科学家利用ProteinSimple全自动Western Blot系统,鉴定了不同肝癌细胞系外泌体蛋白标志物以及外泌体中肿瘤标志物HMGB1的表达情况,并与后续的实验结合,共同揭示了肿瘤外泌体HMGB1通过促进TIM-1+ Breg细胞增殖来促进人肝细胞癌(Human HepatocellularHarcinoma, HCC)逃避免疫识别,为利用外泌体预防和治疗HCC的免疫耐受性提供概念验证。肿瘤单细胞蛋白标志物定量检测技术:Milo肿瘤细胞异质性是恶性肿瘤的标志之一,也是恶性肿瘤耐药的细胞学基础。研究肿瘤细胞的异质性,已成为肿瘤治疗必须解决的问题。肿瘤单细胞之间信号通路失调和变化已成为研究癌症发生发展的方向。单细胞核酸检测可进行细胞异质性研究,但不能直接测量蛋白质介导的信号传导包括蛋白翻译后修饰,蛋白质定位和蛋白质-蛋白质相互作用。而大多数癌症疗法以蛋白质为目标来研究肿瘤异质性以及药物反应和耐药性。ProteinSimple公司开发的单细胞Western Blot系统Milo,是全球研究单细胞异质性的重要工具。案例一:肿瘤活检样本细胞异质性研究美国加州大学伯克利分校及斯坦福大学医学院肿瘤学系科学家共同利用Milo,对HER2阳性乳腺癌穿刺组织,检测HER2表达异质性,以及HER2信号通路蛋白:mTOR,ERK,elf4E,β-Tub(内参),从而进行蛋白表达异质性分析。案例二:循环肿瘤细胞(CTC)蛋白标志物分析加利福尼亚大学伯克利分校生物工程系和斯坦福大学医学院科学家,通过利用Milo检测单个循环肿瘤细胞(CTC)多种蛋白标志物,为液体活检提供更准确的诊断标志物。翻译后修饰的蛋白标志物定量检测技术:NanoPro1000当蛋白质发生磷酸化、泛素化、乙酰化、SUMO化等修饰后,通常在一些炎症、慢性疾病和癌症中起到了关键调控作用。ProteinSimple公司开发的蛋白质翻译后修饰及信号转导通路研究系统NanoPro1000,可通过研究蛋白翻译后修饰的变化作为肿瘤生物标志物,来进行肿瘤精准分型和靶向治疗。案例一:多蛋白复合物epichaperome作为肿瘤治疗精准分型标志物多蛋白复合物(epichaperome),是伴侣蛋白组(chaperome)在应激状态下形成的紧密且稳定的蛋白复合物,由肿瘤研究机构斯隆·凯特琳癌症研究所科学家发现并命名。这个团队利用了NanoPro1000对HSP90大蛋白复合体进行深入研究,并结合PET-CT对肿瘤进行分子分型。结果显示当HSP90的PI>4.98时,进行HSP90抑制剂的治疗具有良好效果,相关成果发表在Nature上。案例二:蛋白磷酸化修饰作为肿瘤标志物目前蛋白质检测方法对于检测癌症蛋白激活中的细微变化不敏感,而这些细微变化是关键的癌症信号转导过程的研究基础。同时现有检测方法需要大量样本,无法进行连续的肿瘤取样以评估对治疗药物的反应。美国斯坦福大学科学家利用NanoPro 1000,评估临床肿瘤标本中蛋白质组学变化。结果显示当给予atorvastatin前后,pSTAT5和pSTAT3磷酸化水平有大幅降低,所以,pSTAT5和pSTAT3磷酸化水平可作为药物治疗标志物。参考文献:1.Cancer biomarker detection: recent achievementsand challenges, Chem Soc Rev. 2015 May 21;44(10):2963-97.2.A novel multiple biomarker panel for theearly detection of high-grade serous ovarian carcinoma, Gynecol Oncol. 2018Jun;149(3):585-591.3.Integrated Physiological and BiochemicalAssessments for the Prediction of Growth of Abdominal Aortic Aneurysms inHumans, Ann Surg. 2019 Jul;270(1):e1-e3.4.A novel nano-immunoassay method forquantification of proteins from CD138-purified myeloma cells: biological andclinical utility, Haematologica. 2018 May;103(5):880-889.5.Tumor-derived exosomal HMGB1 fostershepatocellular carcinoma immune evasion by promoting TIM-1 + regulatory B cellexpansion, J Immunother Cancer. 2018 Dec 10;6(1):145.6.Hydrogel Pore-Size Modulation forEnhanced Single-Cell Western Blotting, Adv Mater. 2016 Jan 13;28(2):327-334.7.Profiling protein expression incirculating tumour cells using microfluidic western blotting, Nat Commun. 2017Mar 23;8:14622.8.The epichaperome is an integratedchaperome network that facilitates tumour survival, Nature. 2016 Oct20;538(7625):397-401.9.Nanofluidic proteomic assay for serialanalysis of oncoprotein activation in clinical specimens, Nat Med. 2009May;15(5):566-71.ProteinSimple总部位于美国硅谷,是专业的生命科学仪器制造商,专注于蛋白质研究分析领域。作为Bio-techne(NASDAQ:TECH)旗下的专业公司之一,ProteinSimple致力于发展先进的蛋白质分析技术。在蛋白质分离、定量、成像、聚集和分析领域建立了一整套独特的解决方案。地址:上海市长宁区长宁路1193号长宁来福士广场3号办公楼19号楼1901室电话:021-60276091传真:021-60276092热线:4000-863-973邮箱:PS-Marketing.CN@bio-techne.com网址:www.proteinsimple.com
应用实例
2021.03.19
ProteinSimple参展Bio-ONE第二届生物医药工艺高峰论坛得到热烈反响
?2020年12月5号,由佰傲谷BioValley和华东理工大学生物工程学院等主办,多家单位单位协助的Bio-ONE 2020第二届生物医药新型工艺技术及应用高峰论坛于上海圆满落幕。本次论坛,40余位行业大咖、20余位顶尖生物药企总裁及权威专家共襄盛举,千余行业同仁鼎力参与。ProteinSimple(PS)作为会议的重点赞助合作伙伴,呈现了生物制药工艺开发过程中多种蛋白检测技术方案,受到了与会嘉宾的重点关注。?? 参会嘉宾光临ProteinSimple展台技术交流和合作洽谈ProteinSimple第三代成像毛细管等电聚焦电泳Maurice一如既往的收到了参会嘉宾的重点关注,作为中国2020版药典推荐电荷变异体检测技术平台,Maurice是电荷变异体和等电点检测行业金标准,是全球第一款采用即插即用卡盒的CE系统。中国大部分生物制药客户都已采用Maurice进行抗体蛋白药物的表征,用户纷纷反馈,系统操作简单,稳定性高,各个公司将此平台作为未来标准技术,在行业内已经逐渐代替传统的毛细管电泳系统。蛋白类药物聚集颗粒分析就选MFI,中国NMPA和美国FDA等各国药监机构推荐使用MFI微流成像系统进行颗粒计数分类,尤其是易引起异常免疫反应的2-10μm亚可见颗粒(Subvisible),生物大分子和疫苗制剂研发中,已经逐渐建立了以MFI为基础的亚可见颗粒的分析方法。药明生物制剂开发平台已经建立了综合性技术能力,MFI作为制剂颗粒分析代表已入选。PS与Cygnus合作推出基于Ella系统的第三代宿主残留蛋白HCP全自动快速解决方案,加快对CHO HCP杂质检测的速度。Ella软件符合工业cGMP环境下对检测技术要求, 整个流程只需75分钟,可加速药品的批量放行。将作为重组治疗性蛋白质、重组疫苗及重组抗体药物工艺过程中产生的宿主细胞蛋白质及其修饰体检测的新一代标准。全自动CE-based western blot系统Jess,将毛细管电泳技术和免疫学技术结合,半小时样品准备,3小时可以完成25个样本Western实验,已被全球各大药厂用于克隆筛选,上游工艺优化,下游纯化工艺,工艺杂质残留,稳定性考察等。 ?
企业动态
2020.12.08
ProteinSimple2020江苏省用户交流会(南京站)盛大召开
11月6日,Bio-techne旗下品牌ProteinSimple,在南京喜马拉雅假日酒店举办了江苏省用户交流会。近40家科研单位,百余位用户参加了此次盛会,数位科研领域的专家进行了精彩的主题报告。开场篇ProteinSimple大中华区总经理韩爱明先生致开场辞:感谢各位江苏省用户的莅临和指导!ProteinSimple作为一个年轻的品牌,有着一系列与时俱进,创新型的蛋白质分析技术。本着“Simple Your Protein Analysis”的宗旨,ProteinSimple在新的一年,将不断推出新的蛋白质检测技术,为中国本土的生物医学研究提供更多优质的服务和技术支持!客户分享扬州大学动物科学与技术学院胡帅帅博士分享了利用Wes研究黑色素细胞参与獭兔不同毛色形成的作用机制研究。常州市第一人民医院综合实验室主管技师张俊老师分享了实验研究新技术Wes的解析与探讨。浙江中医药大学中医药科学院的高级实验师、硕士生导师李美芽老师报告了Wes在科研公共平台中的应用分享。复旦大学附属眼耳鼻喉科医院眼眶病眼肿瘤学科博士及副教授马睿琦老师分享了抽丝剥茧,拨云见日——浅谈如何寻找科研思路,并且分享了Wes的实验结果。所有老师的分享均体现了全自动Western---Wes的优势:自动化平台,减少人为误差,结果重现性更高;操作简便,实验周期短,加快结果产出速度;节省样本,样本消耗量少;节省抗体,人为误差少,数据得率更高,无需重复验证;数据可溯源,避免修稿的麻烦。技术交流大会主持人ProteinSimple市场部的苏倩博士,为莅临的江苏省客户,详细介绍了ProteinSimple用于医学研究的蛋白分析的整体解决方案。ProteinSimple应用技术支持经理杜颖颖博士,进行了精彩的主题报告:磨刀不误砍柴工——Simple Western Size的优化方法,为在座的用户详细和全面的介绍了Simple Western Size的方法优化。ProteinSimple工程师姜国泉工程师介绍了Wes/Jess硬件和维护。来自晶檀生物科技(上海)有限公司的技术支持仇艳红报告了:探寻更广阔的科研视角——Simple Western Size的文献分享。利用充分的素材和内容介绍了Wes/Jess在不同科研领域中的研究进展。会议现场精彩纷呈,反响热烈。
企业动态
2020.11.12
ProteinSimple参会第三届抗体药产业发展大会(10月24-25日 上海)
2020年10月24-25日,由生物制品圈、抗体圈共同主办的第三届抗体药产业发展大会在上海召开。来自国内外知名抗体药物企业家、权威专家、知名学者、科技精英,行业协会和组织代表等共赴此次盛会,共同交流生物制药前沿技术和经验,探讨行业发展趋势。ProteinSimple作为全球生命科学仪器制造商和技术提供商,参加了本次盛会。ProteinSimple市场部苏倩博士在会上做了精彩报告:“生物大分子药物质量控制的创新技术”。更多产品信息或索取PPT原版请联系ProteinSimple。
企业动态
2020.10.27
全自动Western COVID-19多抗原血清学检测试剂盒已上市!!
对SARS-CoV-2患者免疫反应的表征,是了解COVID-19疾病进展或者疫苗功效的关键。SARS-CoV-2抗原例如刺突蛋白(Spike Protein),S1和S2亚基,S1受体结合域(S1 RBD)以及病毒核衣壳蛋白(Nucleocapsid Protein)均可以刺激机体产生体液免疫应答,产生相应抗体。因此,不同抗原的反应性可能揭示了疾病进展的不同阶段。例如,与核衣壳的反应性可能是病毒早期感染的敏感性指标,而与S1 RBD和刺突蛋白的其他部分的反应性可能与病毒的中和有关。血清学免疫检测的常见方法是酶联免疫吸附测定(ELISA)法。但这种方法会面临:每个孔只检测一个抗原,所以提供针对SARS-CoV-2的复杂免疫学信息受限;因为抗原信息提供有限,容易产生假阳性;手动操作时间长,数据重现性较差。为了克服这些局限,全自动Western多抗原血清学检测试剂盒已上市!!全自动Western多抗原血清学检测试剂盒的特点:一份样品可检测5个抗原血清反应性指标:刺突蛋白(Spike Protein)、S1亚基、S2亚基、S1受体结合域(S1 RBD)、病毒核衣壳蛋白(Nucleocapsid Protein);提供5个抗原的分子量信息,且不影响灵敏度;通过相对峰面积定量抗原反应性,提供SARS-CoV-2病人的复杂免疫学反应信息;血清样品量可低至1μl;全自动Western,无人为操作误差;检测速度快,3小时出结果。检测原理:应用举例:一份样品提供多种抗原信息为了测试血清样品对这些抗原的反应性,对聚合酶链反应(PCR)确认为COVID-19阳性的4位患者的血清样品以及2份阴性样品进行全自动Western的血清学检测。结果显示,PCR阳性血清样品与试剂盒中包含的抗原具有高度反应性,PCR阴性血清样品没有反应性发生。其中PCR阳性3号样品中,可以显示出该血清样本对5个抗原(刺突蛋白(Spike Protein)、S1亚基、S2亚基、S1受体结合域(S1 RBD)、病毒核衣壳蛋白(Nucleocapsid Protein))均有反应性。一份样本提供多种体液免疫学表征当对相对峰面积进行定量时,结果显示了与患者血清样品中的5种抗原中的每一种的IgG反应性的高度可变性。例如,患者4的血清样本与核衣壳的反应性高(占总峰面积的68%)。而患者1、2、3的血清样本与核衣壳的反应性低得多(分别为7%,3%和34%),但与Spike蛋白反应性增加。这预示着患者4血清样本中显示其对早期感染的指标敏感,而患者1、2和3的血清样本中可能已产生与靶向刺突蛋白上的表位相结合的中和抗体。良好的稀释线性对PCR阳性血清样品从1:40到1:138240进行稀释系列,一式两份,并使用SARS-CoV-2多抗原血清学检测模块进行分析。结果显示,信号随着血清样品浓度的降低而降低(图A-C),并且该测定法显示出良好的线性,在3.5 log滴定系列中,五个抗原中的四个抗原的R2≥0.99,第五个抗原的R2≥98%(图D)。高重复性超过检测极限或≥1:69120的血清稀释液的CV小于15%,这表明该方法在重复测量中具有极好的可重复性。结论:随着SARS-CoV-2入侵机体的发展,可能会出现几种不同的抗原,这些抗原会导致体液免疫反应异常,而针对这些抗原的抗体的出现可能表明了疾病进展和病毒中和的不同阶段。因此,传统ELISA检测仅用一种抗原包被的蛋白只能捕获非常有限的免疫学反应信息。但借助适用于全自动Western(Jess/Wes)的SARS-CoV-2多抗原血清学检测试剂盒,可以同时分析COVID-19中常见的多达5种不同抗原在人血清或血浆样品中的IgG反应性。这使得能够对体液反应进行更深入的分析,并且揭示了血清反应性之间的差异,而这种差异是传统ELISA试剂盒无法获取的。参考文献:1. Sensitivity in detection of antibodies to nucleocapsid and spike proteins of severe acute respiratory syndrome coronavirus 2 in patients with coronavirus disease 2019, P Burbelo, F Riedo, C Morishima, S Rawlings, D Smith, S Das, J Strich, D Chertow, R Davey and J Cohen, The Journal of Infection Diseases, 2020; 222:206-213.2. Isolation of potent SARS-CoV-2 neutralizing antibodies and protection from disease in a small animal model, T Rogers, F Zhao, D Huang, N Beutler, A Burns, W He, O Limbo, C Smith, G Song, J Woehl, L Yang, R Abbott, S Callaghan, E Garcia, J Hurtado, et al., Science, 2020; 369(6506):956–963.3. A panel of human neutralizing mAbs targeting SARS-CoV-2 spike at multiple epitopes, T Noy-Porat, E Makdasi, R Alcalay, A Mechaly, Y Levy, A Bercovich-Kinori, A Zauberman, H Tamir, Y Yahalom-Ronen, M Israeli, E Epstein, H Achdout, S Melamed, T Chitlaru, S Weiss, et al., Nature Communications, 2020; 11(1):1–7.更多信息请咨询ProteinSimple销售或技术人员。
新品
2020.10.21
Milo助力急性B淋巴细胞白血病(B-ALL)新型抗癌机制研究结果发Nature!!
近日,由希望之城综合癌症中心系统生物学系、波士顿达纳法伯癌症研究所、哈佛医学院、加州大学旧金山分校检验医学系、剑桥大学血液学系、匹兹堡大学药物发现研究所及东芬兰大学分子科学研究所等多中心研究所,利用Milo,探讨治疗急性B淋巴细胞白血病(B-ALL)的新型抑癌机制,并在Nature(IF:42.778)上发表:Signalling input from divergent pathways subverts B cell transformation, Nature. 2020 Jul;583(7818):845-851.--研究内容--细胞的恶性转化通常涉及一些基因的病变,其综合活性会导致癌症。本研究分析了1,148例患者来源的急性B淋巴细胞白血病(B-ALL)的样本,发现单个基因的突变不会促进白血病的发生,除非它们在表征B细胞分化阶段的单一致癌途径。与主要致癌驱动因子不一致的突变则会激活不同的信号通路,从而直接破坏B细胞的转化。B-ALL中的致癌病变通常模仿前B细胞阶段的细胞因子受体(通过激活信号转导蛋白STAT5)或更成熟细胞中的前B细胞受体中(通过激活蛋白激酶ERK)的信号传导。STAT5和ERK激活性病变很常见,但二者仅在约3%的病例中同时发生。单细胞突变和磷酸化蛋白分析显示致癌的STAT5和ERK激活与竞争性克隆分离。STAT5和ERK参与相反的生化和转录过程,且分别由转录因子MYC和BCL6调控。当不同的信号通路被重激活时,主要致癌驱动因子受到抑制,从而逆转了B细胞转化。相反,不同途径组分的缺失会加速白细胞生成。因此,不同信号通路的持久性成为了B细胞转化的强大障碍,而在一个主要驱动因素上的趋同则促使了白血病发作。不同信号通路的药理学重激活,可以与抑制主要致癌驱动因子产生协同作用。因此,差异信号通路的重新激活可以作为先前未被认可的策略来增强B-ALL治疗反应。--Milo实验方法--实验目的:为了测试在同一细胞中是否同时发生STAT5和ERK双通路激活的罕见情况实验条件:细胞密度: 25万个细胞/ml试剂盒: K500多细胞落空率沉降时间: 7-10 min裂解时间: 10s电泳分离时间: 60s检测靶点: STAT5 phosphorylation (Y694) and ERK phosphorylation (T202/Y204),同一荧光通道,不同分子量大小进行区分一抗孵育条件:1:15, 4度过夜二抗孵育条件: 1:20,室温1hr定义“阳性孔”的方法: 内参Histone H3和TOTO DNA staining--实验结论--Milo检测结果发现,STAT5和ERK双通路激活的概率为2%,与双细胞落空率相当,故在同一个细胞中发生双通路激活几乎不可能,STAT5和ERK激活信号通路互不兼容。结论:未转化的B细胞不断与周围的环境交换信息,这取决于参与几种不同的信号途径(例如细胞因子受体和BCR途径)。因此,多种多样的信号输入反映了正常细胞与其环境的相互作用,而在一个中心途径上的融合则是B细胞转化的标志。与主要致癌驱动因子不一致的趋异途径的失活是B细胞转化过程中的关键步骤。分歧和潜在冲突的信号通路的重新激活是B细胞恶性转化的强大障碍。因此,从治疗的角度来看,有针对性的重新激活发散途径以干扰主要的致癌驱动因子可能是扩大治疗反应的一种有前途的策略。
厂商
2020.09.08