罗氏Q1财报逆势而上 同比增长2%
近日,罗氏发布2020年第一季度财报,虽然有疫情影响,但罗氏还是迎来了本年度的开门红:集团全球营收151.43亿瑞郎(156.28亿美元),同比增长2%。其中制药营收122.62亿瑞郎(126.54亿美元),同比增长3%,占总营收81%;诊断营收28.81亿瑞郎(29.73亿美元),同比减少1%,占总营收19%。 *罗氏年报中,所有增长率均为固定汇率(CER),实时汇率:1瑞士法郎=1.032美元制药整体营收 2020年第一季度,罗氏制药营收122.62亿瑞郎,同比增长3%,占罗氏集团总营收的81%,占比增长1%。主要的增长因素是多发性硬化症药物Ocrevus(增长67%)和癌症药物Perjeta(增长1%)、PD-L1药物Tecentriq(增长135%)以及新的血友病药物Hemlibra(增长146%)的销售额增长。诊断整体营收与制药部门形成鲜明对比的是,罗氏诊断在2020年Q1营收28.81亿瑞郎,同比减少1%,在总营收中占比19%,占比下滑1个百分点。在2020年Q1,罗氏诊断单个业务部门的销售出现波动,部分原因是受新冠疫情带来的经济衰退影响。中心实验室和POC诊断事业部:营收15.72亿瑞郎,营收同比减少6%,在诊断总营收中占比55%,占比下滑3%。主要是一直以来表现强势的免疫诊断同比减少4%,临床化学同比减少1%。分子诊断业务:营收6.14亿瑞郎,营收同比增长22%,占比诊断业务总营收21%,占比增加4%,这也是罗氏诊断业务Q1唯一增长的诊断业务。据了解,新冠病毒爆发期间,罗氏诊断6周研发的冠状病毒的cobas SARS-CoV-2检测试剂被FDA在3月12日紧急授权上市,销售瞬间爆增10倍;而在病毒学领域,包括乙型肝炎病毒和丙肝病毒在内的常规检测由于这一转变而减少。糖尿病管理业务:营收4.25亿瑞郎,同比减少9%,是诊断领域下滑最严重的业务,占诊断业务营收15%,主要是由于欧洲、中东、非洲、中东和非洲地区血糖监测产品的价格压力,以及COVID-19在中国的影响。组织诊断业务:营收2.7亿瑞郎,占比最低,仅9%,营收同比增长8%。高级染色业务和仪器销售2019年下半年由于发货延迟问题解决后带来恢复增长,北美地区(增长2%)和欧洲、中东和非洲地区(增长9%)引领了销售额的增长。诊断业务区域营收从区域表现上来看,亚太表现不佳,成为下滑最严重的一次;北美、日本成为增长的主力军。欧洲、中东、非洲:罗氏诊断最大的市场,营收12.15亿瑞郎,与去年基本持平,在诊断营收中占比42%,北美:第二大市场,营收8.35亿瑞郎,同比增长9%,占诊断营收29%,占比增长3%,市场进一步扩大。亚太地区:营收5.45亿瑞郎,同比减少16%,是唯一下滑的地区,营收占比19%,占比同比减少3%。主要受中国新冠疫情爆发影响较大,这也是自2019年罗氏诊断中国区出现首次业绩的下滑后,下降最严重的一次。拉丁美洲:营收1.81亿瑞郎,同比增长1%,占比6%,与去年持平。日本:占比4%,营收1.02亿瑞郎,同比增张12%。
媒体关注
2020.04.23
WHO关于2019新型冠状病毒实时荧光PCR检测方法报道
2019年12月以来,湖北省武汉市发现多起病毒性肺炎病例,经相关病毒分型检测,2020年1月7日,实验室检出一种新型冠状病毒,1月10日完成了病原核酸序列检测,1月12日,世界卫生组织正式将造成武汉肺炎疫情的新型冠状病毒命名为“2019新型冠状病毒(2019-nCoV)”。截至1月20日18时,境内累计报告新型冠状病毒感染的肺炎病例224例,其中确诊病例217例(武汉市198例,北京市5例,广东省14例);疑似病例7例(四川省2例,云南省1例,上海市2例,广西壮族自治区1例,山东省1例)。日本通报确诊病例1例,泰国通报确诊病例2例,韩国通报确诊病例1例。01 世界卫生组织世界卫生组织于2020年1月12日发布了针对新型冠状病毒感染造成严重急性呼吸道感染的临床处置指南;并于在同一页面中列明了可使用的实时荧光PCR法检测方案。值得一提的是,在由欧洲的大型综合医院 -- 位于德国柏林的夏利特医院病毒研究所为首公布的检测方案中使用到了罗氏的:MagNA Pure 96 全自动核酸提取设备,检测中使用的引物探针由罗氏诊断全球合作伙伴TIB Molbiol提供,从数据结果展示图中可以看出是罗氏诊断的 LightCycler 480 II荧光定量PCR设备。02 罗氏诊断生命科学2019新型冠状病毒全流程解决方案筛查及确认(实时荧光定量PCR方案)从MagNA Pure全自动核酸提取系统或High Pure系列手动提取试剂盒上呼吸道各类标本的核酸提取,结合罗氏诊断LightCycler家族实时荧光PCR仪进行病毒核酸定量,整个过程最快在2小时内即可完成。复核(测序全流程解决方案)罗氏诊断提供病毒测序全流程解决方案,包括核酸抽提之后上机测序之前的DNA与RNA建库产品。KAPA RiboErase (HRM) rRNA 去除试剂盒显著去除宿主rRNA,提高检测灵敏性,KAPA HiFi HotStart高效均一扩增微量病毒样本,超能KAPA Hyperplus 酶切法建库试剂盒提供均一稳定的基因组覆盖。罗氏新一代测序建库产品系列以高兼容测序平台为特性,可以兼容illumina,华大MGI和ion torrent在内的主流测序平台,具有丰富的文献支撑和客户使用案例,同时,罗氏中国团队针对客户特别的应用需求可以提供针对性的技术支持与多年实验流程的优化经验。罗氏致力于为全球人类的健康服务并提供可靠的产品。新型冠状病毒来袭,罗氏产品为人类健康保驾护航!
媒体关注
2020.01.29
罗氏公司推出VENTANA PD-L1(SP142)检测,依托BenchMark IHC / ISH系列仪器
罗氏公司在CE市场推出VENTANA PD-L1(SP142)检测,作为确定有资格接受Tecentriq治疗的三阴性乳腺癌患者的首选伴随诊断。此次发布是罗氏个性化医疗保健战略中的重要一步,旨在为能够从特定药物中获益最多的患者提供治疗。每年全世界有300,000名患者被诊断患有三阴性乳腺癌,这是一种治疗选择有限的侵袭性疾病。VENTANA PD-L1(SP142)检测有助于识别最有可能从Tecentriq化疗治疗中获益的三阴性乳腺癌患者。罗氏近日宣布扩大使用VENTANA PD-L1(SP142)Assay3,4治疗三阴性乳腺癌(TNBC),用于生活在CE(ConformitéEuropéene)市场的患者罗氏癌症免疫治疗药物Tecentriq®获得批准。这是第一个帮助鉴定符合Tecentriq(atezolizumab)5加化疗(nab-paclitaxel)治疗的三阴性乳腺癌患者的诊断.6使用该检测评估肿瘤浸润性免疫细胞的PD-L1生物标志物状态对于确定最有可能从治疗中获益的患者至关重要。近日的公告是在美国食品和药物管理局于2019年3月批准该试验之后发布的,作为鉴定符合Tecentriq组合的三阴性乳腺癌患者的第一个伴随诊断。三阴性乳腺癌的诊断意味着与乳腺癌生长相关的三种最常见的蛋白质 - 雌激素受体,孕酮受体和HER2 / neu - 在肿瘤上不表达。“直到最近,转移性三阴性乳腺癌患者的唯一治疗选择是化疗,”罗氏诊断公司负责人Thomas Schinecker说。 “凭借我们不断扩展的配套诊断和靶向癌症免疫疗法菜单,罗氏自豪地继续履行我们的使命,使个性化医疗成为全球现实,确保在适当的时间为正确的患者提供正确的治疗。”开发了VENTANA PD-L1(SP142)测定法以增强肿瘤浸润性免疫细胞染色的视觉对比度。在三阴性乳腺癌中,PD-L1主要在肿瘤浸润性免疫细胞而非肿瘤细胞本身表达VENTANA PD-L1(SP142)测定于2016年推出,是Tecentriq临床开发计划中的主要诊断测定,用于在Tecentriq临床试验中对患者进行登记和分层。这是IMpassion130试验中使用的登记试验,这是三阴性乳腺癌的第一个阳性III期免疫治疗方案研究。该试验首次使用免疫细胞染色和肿瘤微环境评分来评估患者PD-L1生物标志物状态关于VENTANA PD-L1(SP142)分析VENTANA PD-L1(SP142)检测可在全自动BenchMark IHC / ISH系列仪器上使用,并使用OptiView DAB IHC检测试剂盒和OptiView扩增试剂盒。 VENTANA PD-L1(SP142)分析对肿瘤细胞和免疫细胞进行特异性染色。该试验先前已被FDA批准并且CE标记用作尿路上皮癌(UC)5中的伴随诊断,并且用于具有Tecentriq的非小细胞肺癌(NSCLC)中的预测性测定。有关各种癌症适应症治疗指导中PD-L1表达水平的更多信息,请参阅Tecentriq产品标签。关于TecentriqTecentriq是一种单克隆抗体,设计用于与称为PD-L1的蛋白质结合,该蛋白质在肿瘤细胞和肿瘤浸润性免疫细胞上表达,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,Tecentriq可以激活T细胞。 Tecentriq是一种癌症免疫疗法,有可能被用作其他免疫疗法,靶向药物和各种癌症的各种化学疗法的基础组合伙伴。 Tecentriq及其临床计划的发展基于我们对免疫系统如何与肿瘤相互作用以及如何利用人体免疫系统更有效地对抗癌症的理解。
媒体关注
2019.09.03
罗氏2019半年报出炉 销售额达305亿法郎 中国市场表现强劲
近日,罗氏发布其2019年半年报。 按固定汇率计算,集团销售额增长9%,按瑞士法郎计算增长8%; 制药部门销售额增长10%,主要受Ocrevus、Hemlibra、Tecentriq和Perjeta的推动; 诊断部门销售额增长2%,主要得益于其免疫诊断业务和第二季度整体强劲增长; 今年第二季度,美国FDA批准罗氏Polivy(以前称为polatuzumab),与利妥昔单抗和化疗苯达莫司汀联合应用,用于先前至少两次治疗失败的或复发的弥漫性大B细胞淋巴瘤患者;Kadcyla用于her2阳性早期乳腺癌的辅助治疗;Venclexta结合Gazyva以前未经治疗的慢性淋巴细胞白血病;在日本Rozlytrek用于治疗ntrk阳性肿瘤; 每股核心收益增长13%; 在国际财务报告准则的基础上,净收入增长19%。 在汇率不变的情况下,该公司将2019年的销售增长预期上调至中位数至高个位数。 在评价该集团的成果时,罗氏首席执行官Severin Schwan说:“今年上半年,由于对我们研发的新药的高需求,我们取得了非常强劲的业绩。我对卫生当局加快批准Polivy和Rozlytrek项目感到非常高兴。这些药物是癌症患者的重要治疗选择。基于今年上半年的表现,我们正在提高2019年全年的展望。” 集团成果 2019年上半年,集团销售额增长9%,至305亿瑞士法郎,核心每股收益增长13%,高于销售额。基础业务表现强劲,核心营业利润增长11%。国际财务报告准则净利润增长19%,主要因为核心业绩强劲,递延所得税头寸重新计量以及与收购相关的拨备发布所产生的一次性影响。 制药部门销售额增长10%,达到242亿瑞士法郎。主要的增长动力是多发性硬化症药物Ocrevus,新的血友病药物Hemlibra和癌症药物Tecentriq, Perjeta和Avastin。新引进药物的大量使用大大抵消了赫赛汀和马贝拉/利妥昔单抗销量下降的影响。 在美国,Ocrevus、Hemlibra、Tecentriq、Perjeta和Avastin的销量增长了14%。 在欧洲销量下降4%,赫赛汀(-45%)和MabThera/Rituxan(-36%)的生物仿制药竞争影响了销售。这种下降被Ocrevus、Perjeta、Tecentriq、Alecensa和Hemlibra的强劲增长逐渐抵消。 在日本,最近推出的Hemlibra、Tecentriq和Perjeta等产品的推动下,日本的销量增长了9%。日本的增长被MabThera/Rituxan的生物相似竞争部分抵消(-46%)。 国际市场销量增长17%,主要受中国市场的推动,中国市场表现优异与赫赛汀、阿伐斯汀、马贝拉/利妥昔单抗销量强劲,以及Alecensa和Perjeta上市有关。 诊断部门销售额增长2%,达到63亿瑞士法郎。POCT贡献最大,这与免疫诊断业务的增长有关。在区域方面,亚太地区增长5%,EMEA(欧洲、中东和非洲)地区增长3%,北美销量下降2%。 制药部门的核心营业利润增长了11%,诊断部门增长了4%。 重要里程碑 今年第二季度,卫生部门批准了罗氏药品的几项申请。美国食品和药物管理局(FDA)批准加速批准Polivy (polatuzumab vedotin-piiq)联合苯达莫司汀和利妥昔单抗治疗复发或难治性弥漫性大b细胞淋巴瘤,这些患者此前至少接受过两种治疗。 在日本,卫生、劳动和福利部(MHLW)批准Rozlytrek(恩曲替尼)用于治疗成人和儿童神经营养酪氨酸受体激酶(NTRK)融合阳性的晚期复发性实体肿瘤。Rozlytrek是日本批准的第一种针对NTRK基因融合的肿瘤诊断药物。NTRK基因融合已在一系列难以治疗的实体肿瘤类型中被发现,包括胰腺、甲状腺、唾液腺、乳腺、结肠直肠和肺。另外,MHLW批准了one CDx癌症基因组图谱作为Rozlytrek的辅助诊断。 Kadcyla获得FDA批准用于辅助治疗(手术后)her2阳性的早期乳腺癌患者,这些患者在新辅助治疗(手术前)紫杉烷和基于赫赛汀的治疗后存在残余侵袭性疾病。Kadcyla在FDA的实时肿瘤审查(RTOR)和评估援助试点项目下被审查和批准,在完成提交后的12周内获得批准。Kadcyla是罗氏在RTOR试点项目下批准的第一种药物,该项目正在探索更有效的审查流程,以确保患者尽早获得安全和有效的治疗。 FDA还批准 Venclexta/Venclyxto联合Gazyva/Gazyvaro治疗以前未经治疗的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤,这也是FDA新的RTOR和评估援助试点计划的一部分。批准是基于随机III期CLL14研究的结果,该研究评估了12个月固定疗程的文克列塔加加氯硝西汀治疗与加加氯硝西汀治疗的比较。结果显示,文克列塔和加齐瓦的联合用药,与加齐瓦和氯氨氯乙酯(目前的一种治疗标准)相比,可使疾病恶化或死亡的风险(独立审查委员会评估的无进展生存期[PFS])持续显著降低67%。 欧洲药物管理局人类用药委员会建议批准Tecentriq加化疗(Abraxane;nab-紫杉醇)用于治疗无法切除的局部晚期或转移性三阴性乳腺癌的成年患者,其肿瘤具有PD-L1表达(≥1%),且此前未接受转移性疾病的化疗。 2019年2月,罗氏宣布全面收购Spark Therapeutics,该交易目前预计将于2019年完成。Spark Therapeutics总部位于美国宾夕法尼亚州费城,是一家致力于发现、开发和提供基因疗法的综合性公司,用于治疗遗传性疾病,包括失明、血友病、溶酶体存储障碍和神经退行性疾病。 对2019年的展望 在汇率不变的情况下,目前预计销售额将实现中位数至高个位数的增长。在汇率不变的情况下,每股核心收益的增长目标将与销售额大体同步。罗氏预计将进一步提高以瑞士法郎计算的股息。
媒体关注
2019.08.29
罗氏(Roche)公布2019年上半年业绩
罗氏(Roche)公布2019年上半年业绩。当期集团销售额304.69亿瑞士法郎,上年同期为281.11亿瑞士法郎。其中,制药业务销售额241.94亿瑞士法郎,诊断业务销售额62.75亿瑞士法郎。上半年营业利润123.63亿瑞士法郎,上年同期为111.62亿瑞士法郎。当期净利润89.04亿瑞士法郎,上年同期为75.16亿瑞士法郎。扫码关注【3i生仪社】查看更多行业资讯
媒体关注
2019.08.01
罗氏近50亿美元将收购Spark基因治疗 罗氏并购的公司一览
2月24日,华尔街日报报道,瑞士生物制药公司罗氏(Roche)正在收购美国的基因公司,Spark Theraputics,这笔交易可能会在周一宣布。这个收购将估值Spark公司近50亿美元,而纳斯达克上市的Spark疗法公司的周五收盘价是51美元,公司市值只有20亿美元。 Spark是一家基因治疗公司,专注于血友病和神经退行性疾病的领域。Spark等公司开创的新兴治疗类别——用健康的基因替代缺陷基因的疗法,是近年来医药领域的热点。 如果Spark基因疗法成功,罗氏收购Spark后可以在血友病治疗市场上更具竞争力。血友病作为罗氏的新兴类别,将会成为增长其市场推动力的最佳助力。 2014年,辉瑞就已与Spark Therapeutics合作,共同开发血友病基因疗法。此前,在欧洲血液学协会年会上,Pfizer与Spark Therapeutics宣布,双方合作开发的一款B型血友病基因疗法SPK-9001,临床结果良好。 而罗氏也可能将成为继诺华,辉瑞和百时美施贵宝之后,又一家大手笔出手基因公司的大药企。被罗氏并购的公司一览1963年,收购香水公司Givaudan1964年,收购香水公司RoureBertrand Dupont1960s,收购农化公司Dr.R. Maag AG1980年,收购药企La Quinoleineet ses Derives1982年,收购临床医疗公司BiomedicalReference Lab1982年,收购临床医疗公司ConsolidatedBiomedical Lab1982年,收购Colborn Dawes Group1984年,收购AmericanDiagnostics公司1985年,收购Productor KaspeS.A1989年,收购Dr. Andreu S.A.,Barcelona1989年,收购Eupharma GmbH,Wiesbaden1989年,收购Priorin AG, St.Gall1989年,收购Institut VironAG, Ruschlikon1989年,收购Roche LipidTechnologies Ltd., Hull1989年,收购Riedel - aromGmbH, Dortmund1989年,收购Societe ABX S.A.,Montpellier 90%股权1989年,收购Laboratoires ACS60%股权1990年,收购Societe ABX S.A1990年,收购Genentech 60%股权1991年,收购OTC保健公司Nicholas1993年,约1.5亿美元收购OTC保健公司Fisonsplc1994年,53亿美元收购制药公司Syntex集团1995年,收购Soekami Lefrancq1996年,收购Proctor &Gamble 50%股权1998年,110亿美元收购诊断巨头BoehringerMannheim及Corange2001年,约15亿美元收购中外制药50.1%股份,2008年增持到62%2001年,4.75亿美元收购血糖监测公司AmiraMedical2005年,1.86亿美元收购GlycArt公司,获得单抗药物Gazyva2007年,1.7亿美元收购诊断公司454life science2007年,0.57亿美元收购TherapeuticHuman Polyclonals2007年,6亿美元收购诊断公司BioVeris,增强诊断业务2008年,1.9亿美元收购基因芯片公司NimbleGen2008年,1.3亿美元收购MirusBio Corporation,加强诊断部门2008年,1.87亿美元收购研发公司ARIUSResearch2008年,1.75亿美元收购Piramed,获得抗肿瘤药物Capanlisib2008年,34亿美元收购诊断巨头Ventana2009年,468亿美元全资收购Genentech2009年,0.45亿美元收购Memory90%股权,获得R3487、R4996等药物2009年,2.9亿美元收购LonzaBiologics Singapore,增加生物制品的产能2010年,1亿美元收购BioImagene,加强诊断治疗管线2010年,1.6亿美元收购胰岛素泵生产商Medingo2010年,约1亿美元收购PVTProbenverteiltechnik,加强诊断管线2010年,2.9亿美元收购Marcadia,获得糖尿病产品GLP-1/GIP的开发权2011年,约2亿美元收购MTMlaboratories,加强诊断管线2011年,2.3亿美元收购Anadys,获得丙肝在研药物Setrobuvir2013年,2.2亿美元收购ConstitutionMedical,加强诊断管线2014年,4.5亿美元收购Santaris,获得反义疗法研发管线2014年,4.5亿美元收购IQuum,加强诊断管线2014年,3.5亿美元收购基因测序公司GeniaTech,加强诊断管线2014年,2.94亿美元收购DutalysGmbH2014年,83亿美元InterMune,获得吡非尼酮等药物2014年,1.19亿美元收购基因测序公司Bina2014年,5.65亿美元收购诊断公司AriosaDiagnostics2014年,0.3亿美元收购诊断公司SignatureDiagnostics2014年,17.25亿美元收购Seragon,获得乳腺癌研发管线2015年,约5亿美元收购Trophos,加强诊断管线2015年,4.3亿美元收购GeneWEAVE,加强诊断管线.2015年,0.96亿美元收购CAPPMedical, Inc2015年,4.45亿美元收购基因测序公司KapaBiosystems2015年,5.8亿美元收购Adheron,获得在研药物SDP0512015年,10.4亿美元收购癌症诊断公司Foundationmedicine 56%的股份2016年,5.3亿美元收购Tensha,获得BET抑制剂药物TEN-0102016年,收购眼科载药技术公司ForSightVISION4,价格未知2017年,0.7亿美元收购糖尿病健康管理平台mySugr2017年,0.8亿美元收购实验室软件开发公司Viewics2017年,17亿美元收购Ignyta,获得抗肿瘤药entrectinib2018年,19亿美元收购大数据公司FlatironHealth2018年,24亿美元收购Foundationmedicine剩余股份(文本信息部分来源于 MedTrend医趋势、药事纵横)
媒体关注
2019.02.25
主动召回 防患于未然才是折射企业责任心的最好体现
主动召回,防患于未然 随着2017年5月1日《医疗器械召回管理办法》的正式实施,我国医疗器械产品召回案例增多,政策实施力度越来越强。作为国际惯例的医疗器械召回行动的执行,无疑对保障公众用械安全起到重要作用。医疗器械生产企业应当主动对缺陷产品实施召回,这是《医疗器械召回管理办法》中明确的企业义务,而公众特别是媒体对于“召回”一词依然存在些许误解。 什么是医疗器械召回? 所以,召回并不总是意味着必须立即停止使用该器械,或将该器械退回到制造商。有时仅仅表示一个医疗器械需要进行检查、调试或修理,甚至有时只是修改并完善说明书。罗氏诊断的产品召回行动中较多的是上述召回行为中的“警示”,即通知相关受影响单位知晓生产企业发现的产品缺陷,并采取相关措施以避免潜在的风险。 召回原因及相关风险 造成医疗器械召回的原因主要有: 产品设计缺陷 生产过程控制缺陷 标签标示错误等 按照法规要求,医疗器械生产企业应当按照规定建立健全医疗器械质量管理体系和医疗器械不良事件监测系统,收集、记录医疗器械的质量投诉信息和医疗器械不良事件信息,对收集的信息进行分析,并对可能存在的缺陷进行调查和评估。 罗氏诊断生产企业通过其质量管理体系和产品投诉、不良事件监测系统对已上市产品持续进行监测,当经过分析、调查和评估发现上市后的某产品存在潜在风险时,就会通知罗氏诊断在各个国家/地区的当地机构,发起全球召回。根据中国相关法规要求及生产企业的指示,罗氏诊断会立即执行主动召回并向监管部门报告。而召回产品的相关风险,通常都是发生概率很低,有时仅为百万或千万分之几,但仍无法完全排除其相关医疗风险,从而通过召回行动来规避其潜在风险。 召回级别 《医疗器械召回管理办法》中第十三条,根据医疗器械缺陷的严重程度,医疗器械召回分为:一级召回、二级召回、三级召回。级别数字越小,严重程度越高。 一级召回:使用该医疗器械可能或者已经引起严重健康危害的; 二级召回:使用该医疗器械可能或者已经引起暂时的或者可逆的健康危害的; 三级召回:使用该医疗器械引起危害的可能性较小但仍需要召回的。 罗氏诊断是通过生产企业的风险评估报告,按照上述法规的要求进行评定召回级别的。 召回信息的公布途径 总结 医疗器械“主动召回”是国际上成熟的管理存在隐患的医疗器械的有效模式。主动召回是企业对产品负责、对用户负责的体现。医疗器械种类多、跨度大,设备等级、类型、使用年限和管理方式等均有不同,差异巨大,安全生产和安全使用都在一定程度上存在着困难,有时候召回真的是不可避免的。如果发现产品可能存在着安全隐患,就应该主动采取召回措施,将潜在发生伤害的可能性降到最低。 召回≠劣势,防患于未然,才是折射企业责任心的最好体现。
媒体关注
2019.02.14
罗氏加入世界血友病联盟人道主义援助计划
罗氏近期宣布加入世界血友病联盟(WFH)人道主义援助计划,该计划是一项具有里程碑意义的计划,致力于改变遗传患者获得护理和治疗的机会。发展中国家的出血性疾病。与罗氏集团成员Chugai和Genentech一起,罗氏对WFH计划的承诺包括捐赠Hemlibra®(emicizumab),A型血友病的预防性治疗,以及资助WFH计划的综合护理发展培训,以确保当地的基础设施和医疗专业知识可用于优化和适当使用捐赠的Hemlibra。 该捐赠将在五年内为发展中国家多达1000名患有A型血友病的人提供Hemlibra预防性治疗,重点关注高需求患者,例如所有年龄段因素VIII抑制剂患者和无儿童患者因子VIII抑制剂。在发展中国家,获得预防性治疗 - 预防A型血友病以防止出血的标准 - 在紧急情况和急性出血中保留的资源有限。 WFH人道主义援助计划目前为约1,500名患有A型血友病的人提供预防性治疗。 “感谢罗氏的捐赠,更多患有血友病的人将能够通过WFH人道主义援助计划接受预防。重要的是,捐赠还将为患有血友病A的人提供治疗选择,因为他们以前治疗非常有限或没有治疗,“WFH总裁Alain Weill说。 “越来越多的预防性治疗方法可以在血友病A未被诊断和未治疗的国家产生深远的影响。” 发展中国家大多数患有血友病的人没有接受或不充分的治疗,这严重影响了他们的健康,生活质量和预期寿命。在无法获得治疗的国家,患有严重血友病的儿童往往无法生存至成年期。 罗氏制药公司首席执行官比尔安德森说:“我们很自豪能加入WFH人道主义援助计划,这是一项具有里程碑意义的举措,旨在改变发展中国家遗传性出血性疾病患者无法获得护理和治疗的机会。” “我们与WFH的合作反映了我们对血友病社区的承诺,并支持全球血友病患者快速,广泛和可持续地使用Hemlibra,这些患者可能从这一重要的治疗方案中受益。” Hemlibra是唯一可以皮下注射的预防性药物,可提供有效的出血控制,每四周一次,剂量选择不常见。Hemlibra已经在具有和不具有因子VIII抑制剂的A型血友病患者中进行了最大的关键临床试验计划之一的研究,包括四项III期研究(HAVEN 1,HAVEN 2,HAVEN 3和HAVEN 4)。 Hemlibra已被批准用于常规预防,以预防或减少全球50多个国家A型血友病患者出血事件的频率。 2018年10月4日,Hemlibra被美国食品和药物管理局(FDA)批准用于常规预防,以预防或减少成人和儿童,新生儿和老年人出血的频率,其中A型血友病患者不含因子VIII抑制剂。2019年2月1日,欧盟人用药品委员会(CHMP)对Hemlibra(emicizumab)采取了积极意见,用于常规预防成人和患有严重A型血友病且无因子VIII抑制剂的儿童的出血事件。世界各地其他监管机构的提交和批准正在进行中。
媒体关注
2019.02.13
罗氏终止crenezumab研究!又一个阿尔茨海默病新药死在III期
1月30日,罗氏宣布终止crenezumab 治疗早期阿尔茨海默病患者(前驱或轻度AD患者)的两项III期CREAD I和CREAD 2临床研究。 1月30日,罗氏宣布终止crenezumab 治疗早期阿尔茨海默病患者(前驱或轻度AD患者)的两项III期CREAD I和CREAD 2临床研究。罗氏做此决定主要是独立数据监测委员会的期中分析一线结果显示crenezumab 可能无法到达改善患者的临床痴呆综合汇总评定量表评分(CDR-SB评分)的主要终点。目前并未在III期研究中观察到与此前研究不一致的安全性事件。CREAD I和CREAD 2研究的数据将会在不久后的学术会议上公布。 罗氏全球产品研发负责人及首席医学官Sandra Horning博士表示:尽管crenezumab的临床结果令人失望,但是对于我们加深对阿尔茨海默病的理解还是有意义的。感谢CERAD项目的所有参与者,我们会继续开展gantenerumab的III期GRADUATE研究以及靶向tau的抗体药物RG6100的II期研究,也包括我们为AD开发的基于成像和液体检测的新诊断方案。 罗氏在公开消息中并没有直接宣布放弃开发crenezumab,包括CREAD项目中还有针对认知功能正常但伴有常染色体显性突变有可能进展成家族性AD的哥伦比亚亚组人群的预防性研究正在进行。这个研究为期5年,由罗氏跟班纳老年痴呆症研究所合作进行,得到了美国抗衰老协会的资助。但是相比这种带有公益性质的研究,罗氏早早终止crenezumab的III期商业化开发,显然是内心打定主意放弃crenezumab了,这让其合作伙伴AC Immune无法淡定,股价一夜之间从10.73美元跌到了3.65美元,暴跌66%。Biogen股价盘中的最大跌幅也超过3%。crenezumab是罗氏早在2006年就与AC Immune达成合作开发协议的一款anti-Aβ单抗药物,在2014年的一项II 期研究中遭遇过失败,相比安慰剂不能明显延缓轻中度阿尔茨海默病患者的认知及功能减退,没有达到该研究的两项主要终点。 但是2015年3月,百健公布了令业内振奋的Ib期临床数据,其在研药物aducanumab能够降低前驱期或轻微阿尔茨海默病患者的淀粉样蛋白斑,还可以延缓认知功能的下降,让大家重拾了对Aβ这个靶点的信心。礼来、罗氏等巨头也重新杀回战场,选择使用更高剂量候选药物或者更早期的AD患者开始大规模III期研究。 罗氏也是在此之后陆续启动了gantenerumab和crenezumab的III期研究项目。其中,CREAD 1 和CREAD 2是为期2年的随机、双盲、安慰剂对照、平行组设计III期研究,将入组1500例早期AD患者,使用了高出II期研究4倍的剂量。CREAD 1研究在2016年初启动,CREAD 2研究在2017年年中启动。
媒体关注
2019.02.01
罗氏2018年营收增长7%,2019将推出13款诊断学重磅产品
罗氏公司昨日发布2018财报,报告称,由于免疫诊断解决方案的高需求驱动,其中心实验室和POC诊断业务下的免疫诊断板块在2018年的销售额增长了7%。 罗氏诊断业务分为4大板块,分别是中心实验室和POC诊断(Centralised and Point of Care Solutions,之前称为专业诊断),糖尿病管理(Diabetes Care),分子诊断(Molecular Diagnostics)和组织诊断(Tissue Diagnostics)。 总体而言,罗氏今年的营收为568.5亿法郎(合572.1亿美元),较2017年的533亿法郎增长7%。 2018年Q4业绩 第四季度,诊断产品销售额为35亿法郎,比2017年第四季度的32.8亿法郎增长了10%。制药部门2018年的收入为439.7亿法郎,较2017年的412.2亿法郎增长了7%。 在公司收益电话会议上,罗氏新任首席执行官Michael Heuer表示,2018年“可能是我们在此部门度过的最好的一年之一”。 在诊断学领域,分子诊断收入从2017年第四季度的5.32亿法郎增长到2018年第四季度的5.51亿法郎,增幅为6%。第二季度,中心实验室和POC诊断业务增长12%,即从去年同期的19.7亿法郎增至21.4亿法郎。糖尿病管理业务销售额从4.96亿法郎增长了5%,达到5.01亿法郎。组织诊断业务收入从2017年第四季度的2.8亿法郎增长至3.11亿法郎,增长率为13%。 2018全年业绩 罗氏在2018年的销售额为128.8亿法郎,比2017年的120.8亿法郎增长了7%。2018年全年,分子诊断学收入从2017年的19.2亿法郎增长至20.2亿法郎,增长率为5%,提供了诊断学业务16%的贡献率。值得注意的是POC诊断业务增长率达162%。由于艾滋病毒监测的增长带动,病毒学销售增长了4%。血液筛查增加了9%,人类乳头瘤病毒(HPV)筛查增加了8%,而生化试剂、qPCR和核酸纯化系统收益减少了1%。此外,罗氏还发现,在其POCT系统Cobas Liat上运行的测试需求很高。 2018年,中心实验室和POC诊断业务营收从2017年的71.8亿法郎增加到77.7亿法郎,增长率为8%,占诊断总收入的60%。这部分的主要增长动力是血清工作解决方案,包括免疫诊断和临床化学,增长率分别为11%和7%。Heuer指出,尽管“主要竞争对手”去年推出了自己的新平台,但罗氏免疫诊断业务依然表现良好。 2018年,糖尿病护理产品的销售额增长了1%(按恒定汇率为2%折算),从2017年的19.7亿法郎增至19.8亿法郎,对诊断产品的销售额贡献率为16%。血糖监测增长了2%,胰岛素输送系统销量下降了6%。Accu-Chek血糖仪和Accu-Chek即时血糖监测系统是该业务生长的主要驱动因素。罗氏表示,该公司已在试点市场推出新的Accu-Chek Solo微泵,反响很不错。Heuer表示,糖尿病护理部门在过去表现不佳后,已达到“一定程度的稳定”。 组织诊断学收入从2017年的10.2亿法郎增加到去年的11.1亿法郎,增长了10%,并为诊断学销售贡献了8%。其中,高级染色仪业务增长了10%,主要染色仪组合增长了13%,辅助诊断增长了9%。 2018年诊断部门的研发支出增长7%,达到14.6亿法郎。 罗氏2018年的净利润从2017年的88.3亿法郎(合每股15.34欧元)增至108.7亿法郎,合每股18.14法郎。 新品发布 2018年首次在美国推出的POC PCR系统在流感检测方面表现非常好。 罗氏推出的Cobas e 801 化学发光分析仪“非常成功”,在2018年投放了1000台,到目前为止总计投放了2000台。罗氏去年也在中国这个“我们主要的市场”推出了这款产品。Cobas e 801 罗氏还在2018年12月推出了Cobas pro,Heuer表示,这款产品“对我们来说是一款主要产品”,目标客户将是中大型实验室。他补充说,该公司已经在市场上拥有15,000 Cobas 6000和5,000 Cobas 8000仪器。Cobas pro“是我们的稳固根基市场的利器,同时也会为罗氏赢得新客户。” 来年预计 截至2018年12月31日,罗氏总计拥有现金或现金等价物66.8亿法郎。 罗氏公司正在投资各种新系统和新技术,对为实验室提供完整的产品组合尤其感兴趣。罗氏计划在2019年推出13个诊断领域的“关键产品”,包括用于支持Cobas 6800/8800的预分析平台Cobas、四个新的化验和五个软件解决方案,包括几个导航肿瘤学软件产品。 该公司预计2019年的销售增幅将在低至中位数之间,核心每股收益的增幅将“大致与销售持平”。
媒体关注
2019.02.01
FDA接受罗氏公司对新sBLA的申请,用于初步治疗NSCLC
当地(巴塞尔)时间1月17日,罗氏(Roche)宣布美国食品与药品监督管理总局(FDA)接受了公司对Tecentriq加化疗(Abraxane和卡铂)的补充生物制剂许可申请(sBLA),用于没有EGFR或ALK基因组肿瘤畸变、转移性非鳞状非小细胞肺癌(NSCLC)患者的初始(一线)治疗。 预计FDA将在2019年9月2日之前做出批准决定。 “我们期待与FDA合作,以便尽快将这种基于Tecentriq的组合物用于非鳞状非小细胞肺癌患者,”罗氏首席医疗官兼全球产品开发负责人Sandra Horning博士说,“肺癌是一种具有挑战性的疾病,这一审查使我们更接近于提供一种新的治疗方案,该方案在治疗这类疾病方面显示出临床意义上的生存益处。” 该sBLA基于III期IMpower130研究的结果,该研究符合其在转移性NSCLC患者初始治疗中的总生存期(OS)和无进展生存期(PFS)的共同主要终点。 FDA最近批准Tecentriq与Avastin,紫杉醇和卡铂(化疗)联合用于初始治疗转移性非鳞状NSCLC且无EGFR或ALK基因组肿瘤畸变的患者。 Tecentriq也被FDA批准用于治疗在含铂化疗期间或之后患有疾病进展的转移性NSCLC患者。 患有EGFR或ALK基因组肿瘤畸变的患者在接受Tecentriq之前,应该通过FDA批准的治疗包含这些畸变的NSCLC的疾病进展。 关于NSCLC 肺癌可大致分为两大类:NSCLC和小细胞肺癌。 NSCLC是最常见的类型,约占所有病例的85%。NSCLC包括非鳞状和鳞状细胞肺癌,其鳞状形式的特征是在显微镜下观察时覆盖气道表面的扁平细胞。 关于Tecentriq Tecentriq是一种单克隆抗体,设计用于与肿瘤细胞和肿瘤浸润性免疫细胞上表达的PD-L1蛋白结合,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,Tecentriq可以激活T细胞。 Tecentriq有可能成为癌症免疫疗法,靶向药物和各种癌症的各种化学疗法的基础组合伙伴。 目前,罗氏进行了9项III期肺癌研究,单独评估Tecentriq或与其他药物联合使用。 Tecentriq已经在欧盟,美国和超过85个国家被批准用于先前治疗过的转移性NSCLC和某些类型的未治疗或先前治疗的转移性尿路上皮癌(mUC)。 Tecentriq最近也在美国被批准用于初始治疗转移性非鳞状NSCLC且没有EGFR或ALK基因组肿瘤畸变的人。
媒体关注
2019.01.17
美国FDA已接受罗氏PD-L1单抗补充生物制剂许可申请(sBLA)
12月6日罗氏旗下基因泰克(Genentech)宣布美国FDA已接受Tecentriq(PD-L1抗体药物)补充生物制剂许可申请(sBLA),该药物用于与化疗相结合的广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。预计将在2019年3月18日之前做出批准决定。罗氏旗下基因泰克(Genentech) 罗氏首席医疗官Sandra Horning博士表示,20年来还没有治疗广泛期小细胞肺癌(ES-SCLC)的新一线疗法能够带来具有临床意义生存益处。Tecentriq在该公司的第三阶段IMpower-133试验中表明,该疗法可使患者的生命平均延长12.3个月 - 比单独化疗长两个月。在意向治疗患者群中,显着提高患者的总生存期(OS为12.3个月,对照组为10.3个月;HR=0.70, 95% CI: 0.54-0.91; p=0.0069)。Tecentriq加化疗的组合疗法同时显着减少患者疾病进展和死亡的风险。患者无进展生存期(PFS)为5.2个月,对照组为4.3个月(HR=0.77; 95% CI: 0.62-0.96; p=0.017)。据估计,罗氏在这个领域内目前还没有竞争对手,可见申请成功后会为罗氏带来巨大市场机遇。
媒体关注
2018.12.10
罗氏诊断与先声诊断达成战略合作,共同推进新一代测序产业发展
2018年11月16日,中国南京——罗氏诊断产品(上海)有限公司(以下简称“罗氏诊断”)与先声药业旗下江苏先声医学诊断有限公司(以下简称“先声诊断”)宣布达成战略合作。双方将致力于新一代测序产品开发与应用,为更多的终端用户提供高品质的检测结果,满足转化医学精准治疗的细致需求。 战略合作协议签署仪式合影:先声诊断董事长任用先生(左)与罗氏诊断测序产品全球业务负责人 Luke Dannenberg先生(右) 商务合作协议签署合影:先声诊断常务副总裁崔欢喜先生(左)与罗氏诊断生命科学与组织诊断事业部总监苏忠美女士(右)罗氏诊断分子解决方案 - 生命科学与组织诊断事业部总监苏忠美女士先声诊断董事长兼首席执行官任用先生 取长补短,拓展NGS临床应用 罗氏诊断表示,公司始终致力于推动基因组学和测序领域的发展,凭借半个多世纪在生命科学研究领域的经验与贡献,整合日新月异的生命科学先进技术,为分子生物基础研究、临床诊断、疫情监测、食品安全、药物研发和工业生产流程控制等领域提供优质高效的原料产品、个性化研究方案和医学检验实验室自建检测方法(LDT)领域的技术方案,已成为生命科学在相关科研、政府、工业和转化医学等领域的领导者。 而先声药业作为中国一线制药企业,于2017年2月依托国家科技部“转化医学与创新药物国家重点实验室”的平台成立先声诊断,致力于在人类健康的重大挑战领域开发和提供精准、高效、可信赖及技术领先的诊断产品和服务,专注于开拓药物基因组学、肿瘤等领域的检测服务市场,并开发伴随诊断试剂盒以支持药物研发管线。先声药业在诊断层面的布局,在国内率先形成“药业+诊断”的业务模式。这与罗氏“诊疗一体化”的业务模式具有相通之处,也成为双方合作的基础和契机。 对于本次合作,罗氏诊断将借助先声诊断丰富的临床服务经验及市场开拓能力,进一步拓展其NGS产品的临床应用,积累更多实际应用经验,为产品的完善和升级换代提供基础。先声诊断也将籍此完善其分子诊断产品线,同时借助罗氏诊断强大的产品开发能力,为临床诊断提供更加符合未来发展的解决方案,以此推动精准预防、精准诊断和精准治疗。 双方表示,本次下一代测序产品研发和应用领域的战略合作,将帮助双方互相取长补短,共同进步,推出更加符合临床需求的产品和服务,必将推动中国分子诊断市场的发展。 罗氏诊断NGS产品线动态: 优化全流程方案,新型测序仪进入研发后期 随着测序技术的纵深发展,靶向测序越来越受到转化科学和临床研究的重视。通过在测序之前特异性富集目标区域,靶向测序能够有效降低测序成本,提高测序深度,帮助研究者更为经济高效地研究基因组特定区域的各种变异,可用于识别和研究复杂疾病,如癌症、糖尿病、肥胖症等的致病基因和易感基因,在基础科研、临床研究和药物开发方面有着巨大的应用潜力。依托高品质的探针设计和超高密度探针合成技术,罗氏诊断已成为靶向富集领域的一家高品质供应商。罗氏诊断SeqCap系列靶向富集体系提供人类基因组DNA、RNA和甲基化热点区域的目录化靶向富集产品,为多维度深入了解生命本质提供了有利工具。 罗氏诊断SeqCap系列 除了靶向捕获SeqCap产品之外,在测序样本制备领域,罗氏诊断于2015年完成了对建库领域的明星品牌KAPA的收购,进一步完善了在测序产业链的布局。KAPA通过“酶的定向进化”这个刚获得2018年诺贝尔化学奖的核心技术,在实验室模拟和加速野生酶的自然进化过程,进而获得一系列性能优良的工程酶,并以此为基础不断搭建及优化了NGS样品制备的全线流程和产品组合,包括样品质控、核酸片段化、文库制备、文库扩增及文库定量等解决方案。通过在产品性能及流程体验上的不断“定向进化”,KAPA已然成为NGS前端工作流程的重要工具,为科研人员获得高质量测序数据奠定了坚实的基础。罗氏诊断KAPA系列产品 据悉,罗氏诊断目前正在完善二代测序上游从样本保存到核酸抽提、建库以及靶向捕获的全流程方案,并针对遗传样本,肿瘤应用提供针对性的优化流程。此外,一直被外界所密切关注的罗氏新一代测序仪也进入了研发后期过程。 相信,随着双方合作的不断深入和扩大,罗氏诊断的优质产品以及先声诊断的研发实力和优质服务,将为更多的终端用户提供高品质的检测结果,满足转化医学精准治疗的细致需求。 关于罗氏诊断 作为全球体外诊断行业的领军企业,罗氏诊断始终秉承“先患者之需而行”的理念,不断创新,致力于开发和提供贯穿疾病的早期发现、预防、诊断、监测等环节的诊断技术和解决方案,从而帮助医务人员提高患者的治疗效果、改善生活质量、并减少社会医疗成本。罗氏诊断分子解决方案-生命科学与组织诊断部作为罗氏诊断的创新引擎,致力于提供最领先的分子生物学技术的全自动 PCR、高通量测序和病理衔接流程,引领科研,创建医学价值,助力转化医学造福人类。 关于先声诊断 先声诊断是中国领先的制药企业先声药业旗下精准医疗解决方案提供商。先声诊断致力于在人类健康的重大挑战领域创造精准、全面、快捷、可及的诊断产品和服务体系。通过整合多种领先的分子检测平台和生物信息学分析能力,先声诊断在肿瘤、中枢神经系统、感染、药物基因组学、自身免疫疾病等治疗领域为医务工作者和医疗机构提供精准医疗的决策基础。我们也提供直接面向消费者的医学检验服务,以创新的服务模式提升公共医疗的质量、效率和体验。
媒体关注
2018.11.19
罗氏公布数字PCR仪最新研究进展 卓越性能或将匹敌伯乐QX200!
近期,在美国召开的分子病理学协会年会上,罗氏报告了一款正在研发的数字PCR仪。罗氏方面表示,公司计划使该系统通过欧盟 CE/IVD 的认证,在临床进行商业化推广,并计划在美国获得上市前申请(510k)豁免认证,以进行销售。 报告中,罗氏首席科学家和qPCR系统研发部经理Nick Newton介绍了这款新的数字PCR系统。该系统正处于原型研发阶段,共包含两部分仪器:一个小型桌面分区仪和一个较大的台式分析仪。整套系统还包括分析软件,可以在本地笔记本电脑或台式电脑上运行。从组成上来看,该系统与Bio-Rad 的QX200极度相似。 Newton表示,该系统需人工添加样本,每个PCR板上都有8条通道。毛细管作用会牵引样本沿着通道沉降到不同反应单元。将PCR板放置到分区仪上,仪器会向其添加硅油密封胶加速样本沉降,并密封反应单元,确保单个PCR反应的进行。分区仪将配置触摸屏装置,每个PCR板的分区约花费2分钟。基于该数字PCR系统,罗氏计划针对不同应用提供3种类型的芯片:含有3万个反应单元的通用芯片;含有2万个反应单元、可最大限度地增加上样量的高灵敏度芯片;含有10万个反应单元、减少上样量的高分辨率芯片。相比之下,Bio-Rad平台的芯片是将20 µL样品分成2万个反应单元。 此外,罗氏的数字PCR分析仪将全面整合热循环和分区成像的密封纳米板,可放置12块96孔板。研究人员还介绍,该系统最大的特点在于其更适合进行多靶点的混合检测(target multiplexing)。基因位点的扩增或缺失与多种遗传病相关,多通道检测技术将帮助研究人员检测更多靶点和多个参考基因。 对于罗氏研发的新数字PCR仪,相关人士认为,对比市面上现有的数字PCR平台和Bio-Rad的ddPCR平台,研究者们更希望能进行更大容量样本的分析,因为这样可以提高检测的灵敏度。另一种方法是将样本划分为10万个反应单元,这种方法在罕见突变和需要克隆扩增的混合靶点检测中非常具有吸引力。罗氏新款PCR仪或将代表数字PCR革新向前推进了一大步。 也有人指出,罗氏数字PCR仪的另一个潜在优势是可以使用通用的逆转录酶和混合反应体系,能够更好地优化针对基因变异的检测。此外,一款数字PCR仪最重要的是重复性,不仅是分析结果的重复性,还包括从样本制备到数据分析整个过程的重复性。Bio-Rad成功开发了一款稳定的分析流程,能够提供非常高的实验室间可重复性,这对诊断的可靠性非常重要。但罗氏的PCR仪是否能够匹敌QX200的卓越性能还有待考察。 业内人士认为,罗氏本次研发的新数字PCR仪将与Bio-Rad的QX200液滴数字PCR仪形成直接的竞争关系。多年以来,数字PCR领域主要有两个竞争者:Bio-Rad和RainDance Technologies。自2017年Bio-Rad收购RainDance之后,Bio-Rad则被公认为数字PCR领域的领导者。此外,也有多家国内外测序设备公司在数字PCR研发领域不懈努力。Fluidigm是最早投入芯片型数字PCR系统研发的公司,但其开发设计的芯片却限制了高度分区数字PCR检测的能力。Thermo Fisher Scientific公司通过价格低廉的QuantStudio 3D系统成功打开了市场。不少新公司也在寻找立足点,例如法国Stilla Technologies公司、波士顿Formulatrix公司和新加坡JN MedSys公司等。 与此同时,国内也有多家公司在数字PCR系统研发中取得了不俗的成绩。仅在2018年,领航基因研发的iScanner24生物芯片阅读仪获得浙江省食品药品监督管理局医疗器械产品注册证;新羿生物展示了国内第一套完全自主知识产权的数字PCR系统;卡尤迪发布了自主研发的数字PCR产品;臻准生物也发布了拥有自主知识产权的芯片式数字PCR系统AccuOne™。2017年,顺德永诺发布了拥有自主知识产权的微滴式数字PCR仪MiniDrop™。 由于定量的精确性和可靠性,数字PCR技术正成为撬动精准医学发展的新支点。随着临床对检测要求的不断提升,数字PCR作为新一代检测手段也将迎来新发展和新增长,在肿瘤治疗、液体活检等前沿生命科学研究、临床医学检验等领域实现突破性应用。
媒体关注
2018.11.12
ctDNA检测让肿瘤无处遁形
基因突变是肿瘤产生和发展的重要原因。随着细胞分离技术和基因测序技术的发展,液体活检在肿瘤精准医疗中的价值日益凸显。通过采集患者血液、尿液等体液标本中的肿瘤相关产物,包括血液中游离的循环肿瘤细胞(CTC)、循环肿瘤DNA(ctDNA)和外泌体等,液体活检可以实现对肿瘤基因图谱的非侵袭性检测,从而对肿瘤疾病进行诊断和辅助治疗。相较于通过手术、组织活检获取肿瘤标本的传统方式,液体活检技术能很好地克服肿瘤时空异质性,重复检测方便,可用来发现及追踪分子水平的变化,具有广阔的临床应用前景。中山大学附属肿瘤医院肿瘤内科副主任医师蔡修宇博士 日前,在第四届全国检验医学技术与应用学术会议暨‘一带一路’检验高峰论坛期间,中山大学附属肿瘤医院肿瘤内科副主任医师蔡修宇博士在“2018 智.创未来——中欧医学检验论坛”上,分享了液体活检特别是ctDNA检测在肿瘤临床诊疗上的应用现状及前景,为肿瘤治疗方案的制定提供了很多新思路。 蔡修宇博士表示:“ctDNA检测作为液体活检主流方向,凭一管液体就可以进行肿瘤诊断、疗效评估、实时监控、个体化用药、预测复发等,在精准医疗大趋势下,既具有极高的科研价值,又具备推进精准医疗临床实践的巨大潜能,为实现肿瘤临床治疗的全流程管理提供强有力的支持。” NGS+ctDNA精准跟踪抗性突变,优化治疗策略 ctDNA是体液中全部游离循环DNA(cfDNA)的一种,是仅有肿瘤细胞释放的携带有肿瘤特异性遗传学改变的自由基因组片段[1],能够揭示肿瘤综合性的遗传信息,更准确反映肿瘤组织的异质性及肿瘤负荷[2],并可在同一患者身上反复进行,具有潜在的纵向监测能力。 随着科学发展,ctDNA检测已成为当前肿瘤领域的诊疗新热点。其主要检测方法包括微滴式数字 PCR(ddPCR),扩增阻滞突变PCR(ARMS PCR) 和二代测序(NGS)等。其中,NGS可实现对多基因核酸片段进行高通量平行深度测序,能够同步检测多个基因、不同形式及未知突变,在预后和疗效判断的时候,多基因的参与可能对预后效果产生非常大的影响。 蔡修宇博士指出:“以肺癌为例,检测难点就是检验组织的获取,NGS用测序多个位点代替单个位点检测,不需要通过手术获取大量组织送往不同实验室进行检测。因此,NGS在诊断、分期、治疗和预后等方面,对于肿瘤个体化治疗和全程管理具有巨大优势。”图 1:NGS+液体活检扩大总体优势[3] 癌症患者在接受靶向治疗受益一段时间后,往往会因为基因的二次突变出现耐药机制。间变性淋巴瘤激酶(ALK)重排是非小细胞肺癌(NSCLC)中较为少见的一类分型,ALK阳性患者在经过ALK抑制剂(TKI)治疗后反应良好,患者生存期和生存质量都得到了很大提高,但获得性耐药问题依旧不可避免。研究发现,不同ALK TKI耐药机制不同,对获得性耐药突变敏感性差异很大[4],这就说明了对于ALK TKI获益的患者耐药后再次活检的重要性。 一项纳入 49 例既往接受过克唑替尼(crizotinib)治疗的局限进展或转移性NSCLC 患者的 II 期研究中,采用 AVENIO ctDNA检测经阿雷替尼(alectinib)治疗前后的 cfDNA 样本。结果显示,26/49例患者中检测到ALK基因融合。Alectinib治疗后,耐药性突变显著增加,而敏感性突变减少。“通过对ctDNA检测可以鉴定药物治疗过程中产生的耐药突变,追踪药物响应,指导临床及时采取进一步措施。AVENIO ctDNA检测可应用于监测治疗中ALK TKI耐药突变出现的可能性,从而有助于局部转移或晚期NSCLC患者治疗策略的制定。”蔡修宇博士指出。图 2:肺癌中 NGS+ctDNA 目前和未来的应用领域[5] 有效评估疗效及预测复发,指导临床个性化诊疗 ctDNA用于肿瘤疗效评估和预后监测的优势也在很多临床实验中得到了证实。在癌症疗效评估时,ctDNA基线水平较低和ctDNA水平持续应答者可获更好预后[6],诱导前后肿瘤异质性(以MATH计)升高预示较差临床结局[7]。 一项采用AVENIO ctDNA监测试剂盒对145例II/III期R0切除术后结直肠癌(CRC)患者的微小残留病灶(MRD)进行定性检测,根据术后血浆中ctDNA检测结果将患者分为ctDNA阳性和ctDNA阴性。研究发现,术后ctDNA阳性患者在复发时间、无复发生存期及总生存率上均显著短于ctDNA阴性患者(如图3),证明MRD检测可识别II/III期CRC高复发风险人群。[8]对于高复发风险的患者可考虑更为积极的辅助治疗,并增加随访,以期改善预后。 图3:MRD检测可识别II/III期CRC高复发风险人群 在另一项共入组40例Ib-III期局限性肺癌患者的复发预测研究中,治疗结束后4个月内首次(MRD 界标点)进行血浆ctDNA分析,之后每3-6个月动态监测ctDNA水平。研究结果显示,ctDNA检测可早于72%的影像学诊断的肿瘤复发,中位提前时间为5.2个月[9]。证明ctDNA检测的灵敏度及特异性较高,且显著早于影像学可诊断的微小复发灶,可用于MRD的早期诊断,并以此指导这部分患者的早期干预和个体化的辅助治疗。 在对大b细胞淋巴瘤(DLBCL)患者进行预测复发管理中,平行使用癌症个体化深度测序分析方法(CAPP-Seq)与IgHTS检测ctDNA水平监测肿瘤负荷。在112天与224天时,ctDNA水平已超出IgHTS检测下限,因此出现假阴性;首次检测到ctDNA阳性到复发平均为188天,73%患者在疾病进展前检测到ctDNA阳性。[10]研究证实治疗后ctDNA阳性的患者在随访周期内的复发率远远高于ctDNA阴性的患者,ctDNA 检测MRD可预测DLBCL进展风险。 蔡修宇博士表示:“基因测序作为精准医疗的重要一环,是未来癌症个体化诊疗的主要发展方向。ctDNA检测在微小残留病灶和复发预警中具有潜在临床应用价值,能够帮助我们更好地管理癌症,让更多患者从中获益。” 罗氏诊断AVENIO ctDNA 检测技术在不同临床研究中已有应用。该技术能帮助解决许多液体活检研究中遇到的挑战,在不同实验室间均能保持良好的稳定性和可重复性。AVENIO ctDNA分析试剂盒包含所有NGS实验室进行ctDNA检测时所需的试剂及生物信息学分析软件。AVENIO ctDNA靶向试剂盒包含17个全癌基因检测位点,用于鉴定美国国立综合癌症网络(NCCN)指南相关生物标志物;扩展试剂盒包含77个全癌基因检测位点,包含NCCN指南相关及临床研究中常用突变位点的生物标记;监测试剂盒包含197个基因检测位点,纵向监测肺癌及结直肠癌等多种肿瘤负荷,检测微小残留灶,评估并监测复发、进展风险。 [1] Nature.2014 Jul 31;511(7511):524-6 [2] Jianjun Zhang et al. Science 346, 256 (2014); Intratumor heterogeneity in localized lung adenocarcinomas elineated by multiregion sequencing. Siravegna et al., Nature Reviews Clinical Oncology 2017 [3] Zhang YC, et al. J Hematol Oncol. 2017. [4] Justin F. Gainor, et al. Cancer Discovery. 2016 [5] Zhang YC, et al. J Hematol Oncol. 2017. [6] 2018 ASCO Abstract 12077 &12088 [7] 2018 ASCO Abstract 3545 [8] 2017 ASCO Abstract 3591 [9] Chaudhuri A A, , et al.. Cancer discovery, 2017 [10] Scherer F, et al. Science translational medicine, 2016
媒体关注
2018.08.17
罗氏-普恩个性化分子诊断创新实验室揭牌仪式隆重举行
近日,罗氏诊断分子解决方案-生命科学和组织诊断携手国内医学检验新锐——上海普恩海汇医学检验所,在上海松江临港科技绿洲举办了主题为“More Than Just a Lab”的罗氏-普恩个性化分子诊断创新实验室揭牌仪式,标志着以罗氏诊断先进医学检测技术为基础的创新研究孵化平台正式成立。复旦大学附属中山医院肝外科副主任、复旦大学肝癌研究所办公室主任 史颖泓教授 普恩检验是一家提供以分子及病理诊断为主的第三方独立医学实验室。普恩检验以国际化、多学科的科研团队为核心,采用国际最前沿的检测技术,依托与顶尖综合性医院共建的转化研究平台,将检验、病理与各临床科研平台有机结合,致力于为肿瘤、代谢病及传染病领域的精准医疗提供先进、准确、完整的医学检验和实用型项目研发服务。 罗氏诊断作为全球体外诊断的领导者,将基因测序业务的发展作为战略重点与增长引擎。2017年,罗氏诊断在全球范围内强势推出AVENIO肿瘤基因检测产品,吹响了罗氏诊断进军肿瘤基因检测市场的号角。历经数年潜心研发,AVENIO肿瘤基因测序系列产品凝聚了包括Panel设计、生信算法在内的多项专利创新技术,以超高的灵敏度实现了对ctDNA的动态监测;同时,为了确保研究数据的可靠性和准确性,AVENIO系列产品通过了严苛的实验室与临床研究的反复验证,体现了罗氏诊断一贯遵循的严谨与稳健。正是基于AVENIO系列产品的技术革新与卓越表现,普恩检验毅然决定牵手罗氏诊断作为基因检测技术的合作伙伴,共建创新医学解决方案的孵化平台。罗氏诊断分子解决方案-生命科学和组织诊断事业部总监苏忠美女士 罗氏-普恩个性化分子诊断创新实验室的成立得到了上海临港松江科技城投资发展有限公司的大力支持,公司董事长丁桂康先生对于行业内巨头罗氏诊断与医疗诊断界新锐普恩检验的此次合作寄予了极高的评价及厚望;作为罗氏诊断AVENIO ctDNA检测项目科研合作医院的负责人之一,复旦大学附属中山医院肝外科副主任、复旦大学肝癌研究所办公室主任史颖泓教授应邀出席揭牌仪式,并代表临床医生和患者道出了对于临床诊断先进理念和最新检测技术的迫切需求;罗氏诊断分子解决方案-生命科学和组织诊断事业部总监苏忠美女士则表达了罗氏诊断持续引领行业步伐,致力于推进AVENIO肿瘤基因检测创新项目本土化的决心和信心;最后,普恩检验母公司——顿慧医疗的创始人兼总经理温冬女士总结道:“今天,罗氏-普恩个性化分子诊断创新实验室的成立仅仅是一个起点,‘More Than Just a Lab’将无时无刻不提醒着我们这项事业所承载的人类健康的梦想和使命。”顿慧医疗创始人兼总经理 温冬女士 展望未来,普恩检验将依托罗氏诊断作为业界诊断标准,坚持规范化实验室标准与流程的理念,打造业界领先、可靠的分子诊断医学检验研究平台,从而为个性化分子诊断创新医学解决方案的研发提供孵化环境。此外,普恩检验作为顿慧医疗旗下子公司,凭借在高新医学检验产品研发、实验室自建项目应用及医疗器械注册方面的成功经验与实力,也为加速罗氏诊断前沿产品的本土化进程提供了合作可能。正如本次典礼的主题所倡导的,此次罗氏诊断分子解决方案-生命科学和组织诊断与上海普恩海汇医学检验所的强强联手,所碰撞出的火花不仅仅是“一座实验室”,更是为“医、研、产”模式下多组学联合、提高临床研究效率并使临床研究转化为实际应用提供了更规范的通道,从而助力精准医学的发展,最终造福人类健康。上海临港松江科技城投资发展有限公司董事长 丁桂康先生
媒体关注
2018.06.25
罗氏24亿美元并购癌症基因检测公司Foundation Medicine
2018年6月19日,瑞士制药巨头罗氏(Roche)公布,与癌症基因检测公司Foundation Medicine达成并购协议,将以24亿美元收购余下的Foundation全部在外流通股份。 收购价每股137美元,较Foundation周一收盘价溢价29%,对Foundation的估值为53亿美元。 罗氏表示,预计交易将于今年下半年完成。
媒体关注
2018.06.19
会议日程公布,标记免疫分析专委会2018学术峰会月底在宜兴召开
为了促进我国标记免疫分析领域协同发展,促进标记免疫分析新技术、新方法在临床实验室的转化和应用,中国分析测试协会标记免疫分析专业委员会将于2018 年6 月29 日-7 月1 日在江苏省宜兴市举办2018 学术峰会。会议由中国分析测试协会标记免疫分析专业委员会主办,中国人民解放军总医院医学检验中心生化科承办,江苏省医学会检验学分会、中国生物医学工程学会临床医学工程分会、仪器信息网协办。会议将围绕“跨界融合创新转化,精准高效自主智能”主题,邀请相关领域院士、专家作精彩大会报告,共同探讨标记免疫分析技术最新进展、人工智能和质谱检测在临床检验中的优势与前景等热点问题,为参会者建立跨行业、跨领域合作交流平台,更好地推广标记免疫新技术、行业优秀新产品,推动学科、技术的进步与发展。会议期间还将举办企业卫星会、开展优秀青年论文评选,为企业、青年科技人才提供展示技术交流平台和机会。会议信息: 会议时间:2018 年6 月29 日-7 月1 日 报到时间:2018 年6 月29 日8:00-21:00 会议地点:中国 江苏 宜兴 王子湾酒店以下为具体会议流程:具体参会信息详见中国分析测试协会标记免疫分析专业委员会2018 学术峰会会议手册。附:会议日程-标记免疫分析专业委员会2018学术峰会 .pdf
媒体关注
2018.06.01
“新时代,赢未来”——罗氏诊断中国分子诊断解决方案生命科学新实验室隆重落成
近日,“新时代,赢未来”罗氏诊断中国分子诊断解决方案生命科学新实验室落成典礼在上海漕河泾开发区隆重举行,标志着罗氏诊断新一代智能化生命科学实验室正式投入使用。 新生命科学实验室的前身是罗氏诊断亚太培训中心,经过2017年硬件及软件的全面升级换代,目前已发展成为兼容实验、培训、演示、会议、参观等多功能于一体的最先进的智能型生命科学实验室,可同时为罗氏外部用户和内部员工提供全方位服务,是罗氏诊断中国分子诊断解决方案生命科学部的又一创举,充分体现了罗氏诊断一贯秉承的“先患者之需而行”的宗旨和“服务常在,关爱有加”的服务理念。 在新生命科学实验室里举办的实验人员进阶训练班,将深入结合理论知识和实际操作,最大化实现培训的转化效果;对于从未尝试过的应用方向,罗氏用户可以在第一时间享受到度身定制的Demo实验设计之旅;同时,全新投入使用的实验室亦可作为“样板实验室”,在仪器空间配置、实验样本试剂传递窗设计、空气压力等安全防护打造、数据库管理等各方面为客户提供优选参考,copy不走样。 罗氏诊断中国分子诊断解决方案生命科学事业部总监苏忠美女士、罗氏诊断中国客户服务部资深培训支持经理黄占锋先生出席了落成典礼,并对新生命科学实验室的正式启用表示热烈祝贺。苏忠美女士表示,罗氏诊断中国分子诊断解决方案生命科学部“因势而谋、顺势而为”,在生命科学领域“蓄势待发”,正凭借多项世界领先的技术和产品组合,鼎力支持并推动着生命科学和人类健康技术的更快发展。黄占锋先生也指出,罗氏诊断中国分子诊断解决方案生命科学新实验室与罗氏诊断中国培训中心实验室遥相呼应、各展所长,全方位满足客户多样化的需求,充分体现罗氏诊断“服务常在,关爱有加”的服务理念。 在热烈祝贺此次新实验室落成典礼圆满成功的同时,苏忠美女士也衷心祝愿新实验室能使“引领科研创建医学价值,助力转化医学而造福人类”的梦想成真,为生命科学事业的发展做出更大贡献! 罗氏诊断中国合作服务商“晶能生物”、“顿慧”、“易必恩”等,“探针生物”、“普凯瑞”、“导科医药”等经销商伙伴,以及中科院神经所、交大精神卫生中心等重要用户也作为特邀嘉宾一同出席了落成典礼,共同见证了这历史性的一幕。
媒体关注
2018.04.11
19亿美元!罗氏完成对肿瘤公司Flatiron Health收购
2018年4月6日,罗氏完成了19亿美元的对Flatiron Health收购,Flatiron Health是一家专注于肿瘤学的电子健康记录软件提供商。 Flatiron策划和开展癌症的循证学研究。 罗氏表示,Flatiron Health在美国各地拥有社区肿瘤学实践网络和学术医疗中心,并设计了一个技术平台,使癌症研究人员和护理人员能够从每位患者的经验中学习。 它指出,Flatiron与265多个社区癌症诊所,6个主要学术研究中心和14个治疗性肿瘤公司合作。 罗氏表示,Flatiron将继续作为一个独立的法律实体运营,并保留目前的商业模式,合作伙伴网络和总体目标。它还将保持分离的患者保护健康信息的完整性,并保留专门的销售和营销,面向提供者和生命科学业务活动。 Roche表示,此次收购使两家公司都能加速朝癌症数据驱动的个性化医疗行业迈进。在收购之前,罗氏持有该公司近13%的股份。
媒体关注
2018.04.10
又一里程碑!罗氏19亿美金收购 Flatiron Health,有望建立肿瘤药物研发的全新行业标准
瑞士罗氏集团和 Flatiron Health 近日宣布,双方已签署最终协议,罗氏将在目前持股 12.6% 的基础上,以 19 亿美金收购 Flatiron Health 的全部股份,交易有望于 2018 年上半年完成。 这一收购将使双方通过快速发展的健康数据和分析领域,帮助改善肿瘤患者的生活。 双方将利用各自的专业知识,共同促进真实证据的使用,为肿瘤药物研发建立全新的行业标准。 Flatiron Health 将继续独立运营。 总部位于纽约的 Flatiron Health,是一家私人持股的医疗健康技术和服务公司,在肿瘤领域电子健康档案(HER)软件和真实世界证据(real world evidence)管理方面均是市场领先者。 目前,Flatiron Health 已和超过 265 家社区肿瘤诊所、6 个大型学术医学中心,以及前 15 大肿瘤药企中的 14 家达成合作。藉此庞大网络,Flatiron Health 打造出专门的技术平台,对个体患者的健康档案进行分析、汲取洞见。Flatiron Health 也在与行业领导者和监管机构合作,探索真实世界证据应用于监管决策的新方式,包括新临床试验终点的设计与验证。 罗氏制药首席执行官 Daniel O’Day 表示: 这是罗氏个体化医疗战略的重要一步,因为我们相信,要加速创新肿瘤治疗方案的开发与可及,监管级水准的真实世界证据是一个关键因素。作为肿瘤领域的领先技术公司,Flatiron Health 能够为罗氏乃至整个行业的肿瘤药物研发提供所需的技术和数据分析能力。要做到这点,一个关键原则是让 Flatiron 保持自主,让他们有能力继续为现在和未来的合作伙伴提供服务。 Flatiron Health 的合作创始人兼首席执行官 Nat Turner 表示: 罗氏已和我们合作两年,是我们重要的合作伙伴。我们和罗氏拥有共同的愿景,即在肿瘤领域打造一个学习型健康平台,帮助改善癌症患者的生活。这一收购协议是一项重要的里程碑,将使我们加大对技术和服务平台以及证据生成平台的投资,这些平台未来仍将能为整个医疗健康行业所用。
媒体关注
2018.02.22
罗氏2017财年营收533亿瑞士法郎 增长5%
2月1日,在制药和诊断领域世界领先的罗氏(Roche)公布了2017年财报:全年总收入为533.0亿瑞士法郎,相比2016年的505.8亿瑞士法郎增长了5%。其中,制药业务的销售收入412.2亿瑞士法郎;诊断业务销售收入120.8亿瑞士法郎。2017年整体营收2017年,罗氏制药部门收入为412.2亿瑞士法郎,高于2016年同期的391亿瑞士法郎,增长了5%。诊断部门收入为120.8亿瑞士法郎(约129.3亿美元),高于2016年同期的114.7亿瑞士法郎。罗氏诊断业务主要包括中心实验室和POC诊断(免疫生化等)业务、糖尿病管理业务、分子诊断业务、组织诊断业务。以下为各部分诊断业务的详细营收:中心实验室和POC诊断(免疫生化等)业务,收入为71.8亿瑞士法郎,高于2016年同期,增长了7%。糖尿病管理业务,收入为19.7亿瑞士法郎,低于2016同期的20.2亿瑞士法郎,下滑了3%。分子诊断业务,收入为19.2亿瑞士法郎,高于2016年同期的15.8亿瑞士法郎,增长了4%。组织诊断业务,收入为10.2亿瑞士法郎,高于2016年同期的9.14亿瑞士法郎,增长了11%。区域方面从区域上看,亚太地区的销售额增长了15%,而中国的诊断部门销售额增长了21%。欧洲、中东、非洲(EMEA)和拉丁美洲的销售额分别增长了3%和12%,北美地区销售额持平。罗氏诊断公司(Roche Diagnostics)首席执行官Roland Diggelmann在报告中表示,2017年是诊断部门销售总额超过120亿瑞士法郎的第一年。公司的临床诊断业务实现了“高于市场”的增长率,同比增长7%。2018年预计罗氏表示, 2018年的核心收入将从美国税收立法的变化中受益。预计整体销售额将以持平到个位数增长,而核心每股收益将以高位数增长。参考资料Roche Diagnostics 2017 Revenues Rise 5 Percent Boosted by Immunodiagnostics, Tissue Dx Growth
媒体关注
2018.02.05
罗氏诊断2017收入增长5% 免疫诊断业务大幅增长
2018年2月1日,罗氏(Roche)宣布,其2017年诊断产品销售收入同比增长5%,这得益于其集中式和即时健康解决方案业务中免疫诊断产品销售的实力增长。 截至12月31日罗氏诊断部门的财年收入为120.8亿瑞士法郎(合129.3亿美元),高于去年同期的114.7亿瑞士法郎。诊断部门报告第四季度营收为32.8亿瑞士法郎,比2016年第四季度的31.1亿瑞士法郎上涨4%。 罗氏公司在2017年的总收入为533.0亿瑞士法郎,比2016年的505.8亿瑞士法郎上涨了5%。 罗氏公司首席执行官Severin Schwan在一份声明中表示:“在2017年,我们取得了重大进展,新推出的药品和测试带动了这两个部门的良好增长。” 在罗氏诊断公司内部,集中式和护理业务点解决方案的收入从去年同期的67亿欧元增长了7%至71.8亿瑞士法郎。综合血清学工作解决方案推动增长,免疫诊断收入增长13%,临床化学收入增长3%。 罗氏公司表示,2017年,在其集中式和护理点解决方案业务范围内,最终确定了Cobas e 801的血清学筛查组合,使实验室能够覆盖全自动仪器的全方位血清学测试。该公司表示,自推出以来,已有900套Cobas e 801模块投放市场。 罗氏公司的分子诊断产品收入从2016年的18.5亿瑞士法郎增长4%至19.2亿瑞士法郎。人乳头瘤病毒筛选收入增长15%,血液筛查收入同比增长1%。在病毒学产品中,罗氏的分子诊断业务也是其中的一部分,销售额增长持平,艾滋病毒病毒学检测的强劲增长弥补了2016年HCV销售下滑的业务。 该公司的组织诊断收入比2016年的9.14亿瑞士法郎增长了11%,达到10.2亿瑞士法郎,这主要得益于先进染色法(收入增长了11%)和原色染色法(收入增长了12%)。在组织诊断业务中,伴随诊断业务收入增长了13%。 罗氏表示,其糖尿病护理收入比去年同期下滑3%至19.7亿瑞士法郎,相比2016年的20.2亿瑞士法郎下滑,反映了市场条件的挑战,尤其是在北美地区。 在地区方面,亚太地区的销售总体增长了15%,诊断部门的中国销售额增长了21%。欧洲,中东和非洲地区的销售额增长了3%,拉丁美洲的销售额增长了12%,但北美地区销售额持平 Roche Diagnostics首席执行官罗兰·迪格尔曼(Roland Diggelmann)在公司财报的网络广播中表示,2017年是诊断部门销售总额超过120亿瑞士法郎的第一年。他说,该公司的临床诊断业务实现了“高于市场”的同比增长7%。 Diggelmann表示,罗氏诊断公司在糖尿病检测业务方面继续面临报销和定价的压力,2016年美国医疗保险和医疗补助服务中心的报销削减正在扩展到私人支付市场,影响业绩。 尽管2017年病毒学检测销售额呈现平稳增长,但2016年直接抗病毒类似物的出现推动了Roche大量的HCV检测,因此,该公司预计2017年将成为有类似形势出现。 总体而言,罗氏报告的净收入为88.3亿瑞士法郎,较2016年的97.3亿瑞士法郎下降9%,原因是品牌价值和无形资产减值。核心每股收益为15.34瑞士法郎,比2016年的14.53瑞士法郎上涨了6%。 2017年,罗氏制药部门收入从391亿瑞士法郎增长5%至412.2亿瑞士法郎。 该公司表示,预计到2018年,整体销售额将回归到个位数增长,预计核心每股收益将以高位数增长。该公司预计,排除美国税收立法变化的影响,核心每股收益将大体上与销售额一致。
媒体关注
2018.02.02
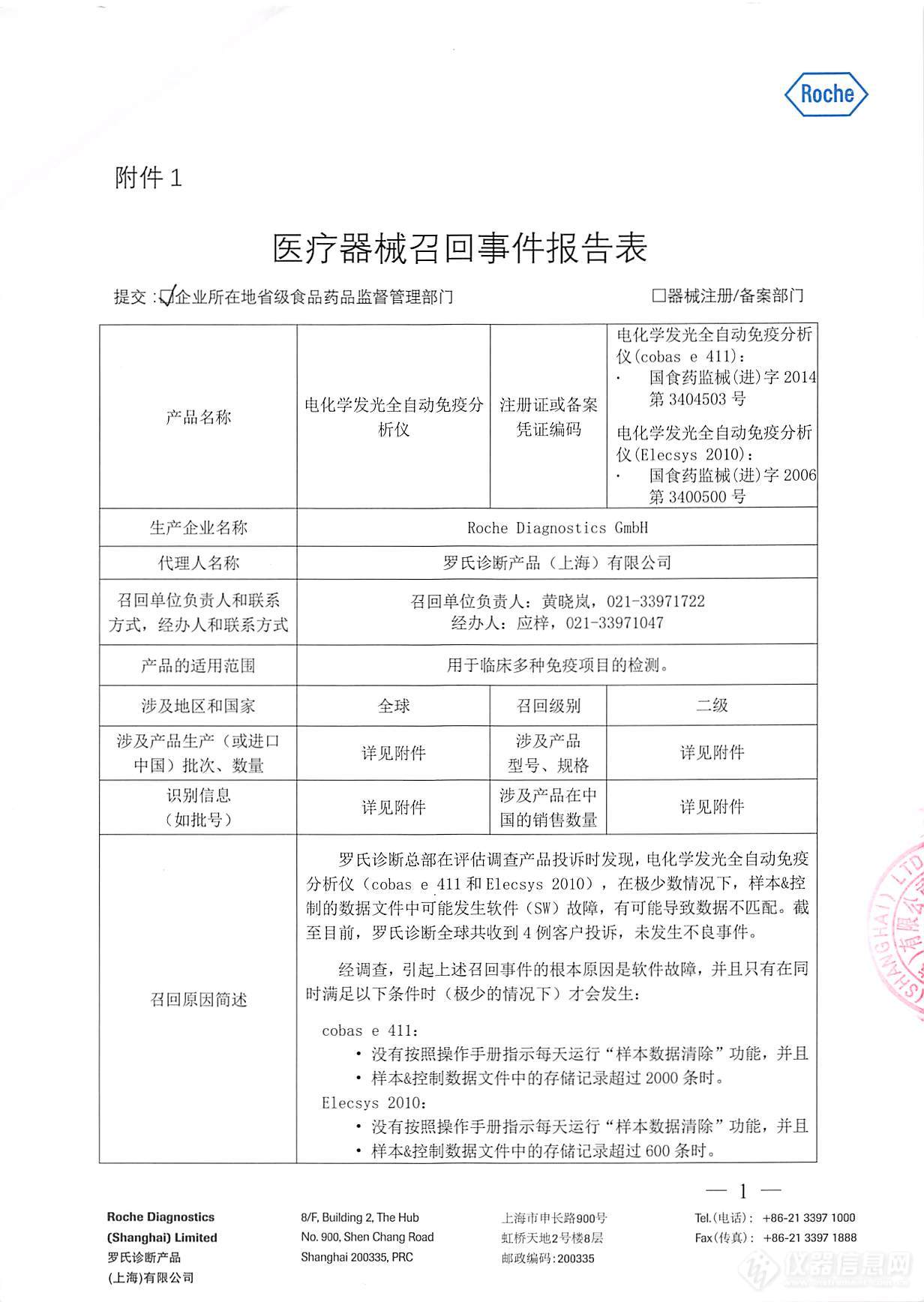
罗氏诊断主动召回电化学发光全自动免疫分析仪
仪器信息网讯 2017年12月15日,罗氏诊断产品(上海)有限公司对电化学发光全自动免疫分析仪(注册证号:国食药监械(进)字2014第3404503号、国食药监械(进)字2006第3400500号)主动召回。 据悉,罗氏诊断在评估调查产品投诉时发现,电化学发光全自动免疫分析仪(cobas e 411和Eleysys 2010)在极少数情况下,样本&控制数据文件中可能发生软件(SW)故障,有可能导致数据不匹配。截止至目前,罗氏诊断全球共收到4例客户投诉,未发生不良事件。 经调查,引起上述召回事件的根本原因是软件故障,并且只有在同时满足以下条件时(极少的情况下)才会发生: cobas e 411: 1、没有按照操作手册指示每天运行“样本数据清除“功能;2、样本&控制数据文件中的存储记录>2000条时。 Elecsys 2010: 1、没有按照操作手册指示每天运行“样本数据清除“功能;2、样本&控制数据文件中的存储记录超过600条时。 该软件故障已经确认。对于电化学发光全自动免疫分析仪(cobas e 411)将会在新版本的软件中修复这个故障;对于电化学发光全自动免疫分析仪(Elecsys 2010),由于产品已于2014年底退市,将不再发布新版本软件。 针对上述情况,罗氏诊断采取以下纠正措施: 1.向所有使用受影响产品电化学发光全自动免疫分析仪(cobas e 411和Elecsys 2010)的客户发告知信,告知其相关信息及需要采取的措施。 2.对使用受影响产品电化学发光全自动免疫分析仪(cobas e 411)的客户,在收到制造商发布的更新软件后,将为其安装升级软件。 (无需停用相关检测仪器,受影响产品无需从客户处撤回) 这次召回级别为二级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。 附件:医疗器械召回事件报告表
媒体关注
2018.01.05
梅毒防控重在检测策略,电化学发光法成主流
日前,在“2017中国医师协会检验医师年会暨第十二届全国检验与临床学术会议”上,四川大学华西医院实验医学科陶传敏教授分享了国际权威梅毒管理指南及国内外大型研究对于梅毒实验室检测方法和标准检测流程的临床应用评估及推荐,就梅毒感染的实验室检测策略及不同流程的应用进行了深入分析与探讨。梅毒感染实验室检测首选特异性检测方法 梅毒实验室检测方法主要分成三大类:病原体检测、核酸检测和血清学检测。病原体检测主要是用暗视野显微镜和镀银染色,方法繁琐不适合实验室常规检测;核酸方法和病原体检测都受病原体在局部的影响,容易发生漏检。因此,血清学检测是实验室诊断梅毒的主要手段。 血清学检测包括非梅毒螺旋体抗原试验(NTT)和梅毒螺旋体抗原试验(TT)。前者属于非特异性抗体检测,这可能会在自身免疫性疾病患者或孕妇中呈假阳性以及在晚期患者中呈假阴性。后者属于特异性检测,这类方法检测的是梅毒螺旋体特异性抗体,特异性及敏感度均较高。 梅毒实验室检测流程主要包括传统检测流程和反向检测流程,两者的区别在于采用哪一种方法作为初筛的检测手段。传统检测流程是先进行NTT,结果阳性的患者再进行TT,结果阳性确认新感染或曾经治疗过;反向检测流程反之,对于TT结果阳性的患者进行NTT,若结果阴性再进行第二种TT检测,结果阳性则表示近期再次感染或曾经治疗过。现在还有一种是欧洲疾病预防控制中心(ECDC)流程,这是一个更简化的反向流程,先进行TT,结果阳性的患者直接再进行第二种TT检测。 目前,对于梅毒的实验室筛查与诊断流程,越来越多地倾向于用反向检测流程。美国疾病控制中心发布的《2015性传播疾病治疗指南》提出反向流程对患者诊断更为全面,能够检测出既往治疗过、未治疗或不完全治疗的梅毒患者,以及低感染率人群的假阳性情况。《2014欧洲梅毒管理指南》推荐TT作为单独的初筛方法,并应采用全自动EIA/CIA,NTT只能检测到现症梅毒,相比TT会漏检早期的梅毒感染。《2015英国梅毒管理指南》也推荐EIA/CLIA作为初筛方法,同时检测免疫球蛋白M(IgM)和免疫球蛋白G(IgG),并特别提到初筛阳性后再用另一种TT方法进行确认。 陶传敏教授指出:“我国现在绝大部分实验室和血站主要是用反向检测流程,用特异性抗体首先开始进行筛查,对于筛查阳性的患者建议做非特异性检测,同时结合临床表现和流行病学史进行诊断。对性病门诊患者没有必要区分反向流程和传统流程,应该建议患者同时做这两类不同的实验室检测,这样可以节约时间。”电化学发光检测方法有效提高梅毒检测质量 梅毒螺旋体抗原极不稳定,试剂性能的优异取决于更高的设计标准。对于免疫试剂的设计,抗原的筛选和制备工艺需要非常考究。罗氏诊断对抗原组合进行严格筛选和评估,最终选取了最有优势的抗原成分进行重组;同时优化了抗原序列,以实现试剂的稳定性和特异性,并采用了易大规模生产的高可溶性抗原,配合罗氏专有的解决方案,即抗原伴侣的应用,与天然抗原极度接近的表位的表达,实现只与抗原伴侣结合,不和特异性抗体结合,从而降低假阳性率。罗氏诊断ElecsysR Syphilis梅毒螺旋体抗原特异性抗体电化学发光检测试剂盒于 2014 年 8 月正式在中国获批上市。该技术使用双抗原夹心法(DAGS)检测梅毒螺旋体总抗体,血清样本仅需10μL,在18分钟时间内即可完成整个检测过程,是目前可靠、高效的梅毒特异性检测方法。 2015年,Clinical and Vaccine Immunology杂志发表了一项由全球6个国家8家研究中心参与的梅毒检测国际多中心研究结果,四川大学华西医院是8家研究中心之一,且国内只有此中心提供相应数据,参加了欧洲同步的性能评估。结果显示:与其它方法学梅毒检测试剂相比,罗氏诊断ElecsysR Syphilis梅毒螺旋体抗体检测在灵敏度、特异性、临床样本敏感性等综合性能表现最佳,并且可100%检测出不同分期梅毒感染样本。 2016年,微生物学领域经典期刊Journal of Clinical Microbiology杂志发表了一项对六种自动化梅毒螺旋体抗体检测方法的比较研究结果,对比其它方法学梅毒检测试剂,ElecsysRSyphilis梅毒螺旋体抗体检测的敏感性、特异性和一致性表现优异,其中,敏感性达到99.4%,特异性达到100%,一致性是99.8%,无一例假阳性结果和漏检情况发生。 陶教授指出:“临床上有一些潜在因素,如合并其它传染病、自身免疫性疾病、肿瘤、妊娠等,可能会干扰到梅毒的实验室检测结果,因此,选择抗干扰能力强的检测方法对于检测结果的准确性至关重要。”ElecsysR Syphilis梅毒螺旋体抗体检测采用抗干扰模式,可有效避免交叉反应,针对干扰样本的评估研究显示,具有很好的特异性与灵敏度,对人类免疫缺陷病毒感染、EB病毒(EBV)感染和莱姆病(Lyme)的特异性均达到100%。 为提供更具参考性的中国证据及使用经验,四川大学华西医院联合全国其它14家医院共同开展了“罗氏诊断新一代ElecsysR Syphilis梅毒螺旋体抗体检测试剂性能比对多中心研究”,旨在自然条件下比较ElecsysR Syphilis检测试剂与已在国内上市的其它四种梅毒检测试剂的灵敏性与特异性。共纳入13,767例常规随机样本,是全球样本最多的试验之一。该研究结果表明,ElecsysR Syphilis在所有比对组常规随机样本中的敏感度均达到100%,特异性也更优异;ElecsysR Syphilis在所有比对组“临界”样本中的假阳性和假阴性结果更少。
媒体关注
2017.08.04
罗氏诊断全新一代CCM正式在国内上市 开启实验室自动化2.0时代
全球体外诊断领导者罗氏诊断日前宣布,全新一代CCM(cobas connection modules)实验室自动化整体解决方案(以下简称“全新一代CCM”)正式在中国上市。通过对功能和性能的全面升级,结合智能化信息管理系统,进一步提升检测效率,优化检测流程。全新一代CCM将开启实验室自动化2.0时代,满足临床、检验和患者对更高质、更高效医疗服务的需求,助推我国“大健康”体系的建设与发展。 目前我国大多数实验室自动化水平仍比较低,从样本前处理(签收、离心、开盖、分杯、分类、样本分配),到样本检测,最后到样本归档的数十个流程中,有许多环节需要手工操作完成,耗时占整个检验报告时间的70%以上,严重影响了样本周转时间(TAT),无法确保在最短时间内提供检验结果,而检验人员与标本大量接触的过程中也存在一定的生物安全风险。 罗氏诊断于2013年在中国推出第一代CCM实验室自动化系统,通过轨道将样本前处理系统、各工作站分析仪、样本后处理系统相连接,结合智能IT系统,提高了检测效率,确保检测结果的可靠性。截至目前,全国已有近300多家医疗机构引进了罗氏诊断实验室自动化系统。 为从长远发展的角度出发,进一步优化实验室全流程自动化管理,满足未来临床及患者对检验的更高要求,为患者提供更优质的医疗服务,罗氏诊断全新一代CCM在原有基础上实现了全程样本自动化升级,从样本签收到归档整个流程都无需手工干预,同时可自由配置单向、双向轨道,轨道速度提升了2倍,离心速度提升1.3倍,后处理速度提升2.3倍,每小时可整线综合处理样本2800个,整体处理能力及效率大幅提高,进一步打破了实验室建设与发展中的瓶颈,预示着实验室自动化2.0时代的来临。
媒体关注
2017.06.14
CCM在中国生化检测平台中的最高配置——罗氏诊断CCM实验室自动化解决方案
为应对医院日益增长的门诊量,满足医院检测量呈“井喷”式增长的需求,安徽医科大学第一附属医院近日引进了国际领先的罗氏诊断CCM实验室自动化解决方案,并实现了CCM在中国生化检测平台中的最高配置。 该医院检验科主任徐元宏指出,“检验科所提供的每一份患者检测报告,都将成为临床诊疗的重要参考依据。不管检测样本量多大,检验科所提供的检验结果都必须做到高质与高效‘兼得’。” 转至《中国科学报》
媒体关注
2017.05.26
展望2022年10大医疗器械领域及公司
著名咨询公司Evaluate旗下的EvaluateMedTech近日发布了一项对2016年医疗器械行业的总结以及对2022年的展望,报告称2015-2022年医疗器械市场的年复合增长率预计约为5.2%,2022年全球医疗器械市场总容量将达到5298亿美元。 十大领域 在医疗器械销售领域方面,体外诊断仍将是最大的一块,预测到2022年市场份额将达708亿美元,占据医疗器械总市场的13%。其中,罗氏仍然将是体外诊断领域的领导者,其2022年的销售额将达到128亿美元。而仅次于体外诊断的是心血管方面,预测2022年全球市场将超过600亿美元。这方面无可争议的老大是美敦力,其销售额将达到141亿美元。内镜检查方面的器材市场增长较快,预测未来几年的复合增长率达到6.8%。 十大公司 而在公司方面,美敦力仍将保持全球医疗器械销售额的头名,而且优势越来越大,其未来几年的复合增长率接近5%,到2022年销售额将达到399亿美元,强生紧随其后,销售额也将超过300亿美元,强生不愧为全球最大的医药公司,在EvaluatePharma发布的全球处方药销售额中强生以398亿美元位列第5位。而另外一家在制药和医疗器械方面都堪称巨头的公司是罗氏,其医疗器械2022年销售额预测将约为148亿美元,制药方面优势则更为明显,罗氏最近几年药物销售额增长较快,到2022年或将成为全球处方药销售首位。
媒体关注
2016.11.28
罗氏获得寨卡病毒(Zika) PCR检测的FDA紧急使用授权
罗氏 (SIX:RO, ROG; OTCQX:RHHBY) 发表声明,美国食品药品管理局(FDA)对LightMix® Zika RT-PCR检测批准了紧急使用授权(EUA)。该产品适用于达到CDC寨卡病毒临床标准 和/或CDC寨卡病毒流行病学标准的患者。使用罗氏LightCycler® 480 II PCR仪或cobas z 480 分析仪,检测EDTA血浆或血清样本中的寨卡病毒。 “LightMix寨卡检测是一项易于操作的分子诊断检测,使得医疗专家能够快速检测到病毒,”罗氏分子诊断首席Uwe Oberlaender如是说道。“作为诊断领域的领导者,罗氏致力于为世界上最具挑战性的医疗紧急情况提供检测解决方案。FDA的此项EUA许可,加强了我们致力于帮助医疗专家打败该重大疾病的信心。” 关于LightMix® 寨卡病毒rRT-PCR检测TIB MOLBIOL GmbH制造,由罗氏独家发布,LightMix® 寨卡病毒rRT-PCR检测是一项定量检测寨卡病毒RNA的检测方法,实现RNA的全程控制,监测从样本提取到PCR结果过程中的所有步骤。使用罗氏MagNA Pure Compact Instrument全自动快速核酸纯化系统 (及分离试剂盒I-大容量),或者对于实验室对大量样本的需求,使用MagNA Pure 96系统(及DNA和病毒NA大容量试剂盒)实现高通量自动化提取。该检测用于LightCycler® 480 Instrument II或cobas z 480分析仪, 允许使用通用的仪器安装底座。仅在2.5小时内,就可以完成对最大达96份的样本进行从样本制备到结果的端-到-端自动化过程。关于紧急使用授权状态LightMix® 寨卡rRT-PCR检测目前尚未获得FDA注册或批准。已通过FDA发布的EUA许可,适用于由根据临床实验室改进法案(CLIA,1988年颁布), 42 U.S.C.§ 263a, 执行高复杂度检测所鉴定的实验室, 或由经过相似鉴定的非美国实验室进行检测。该检测的许可,仅为检测寨卡病毒RNA和诊断寨卡病毒感染,不可用于其他病毒或病原物。许可中关于使用时期的声明,仅对于法规564(b)(1), 21 U.S.C.§360bbb-3(b)(1)指定的紧急情况下的体外诊断检测寨卡病毒,除非该许可提前终止或撤销。 关于罗氏公司罗氏是制药和诊断领域的全球先驱,专注于推动科技发展,改善人类生活。 作为全球领先的著名生物技术公司,罗氏在肿瘤学、免疫学、感染性疾病、眼科学和中枢神经系统疾病领域拥有切实有效的差异化药品。罗氏公司在体外诊断和基于组织的癌症诊断领域也是处于全球领先地位,是糖尿病管理领域的领跑者。集制药和诊断于一身的优势使罗氏成为个体化医疗领域的领导者,作为一种策略,个体化医疗的目的是以最好的方式为每个患者提供适当的治疗。 自1896年成立以来,罗氏公司始终致力于寻找更好的方法来预防、诊断和治疗疾病,为社会做出持续的贡献。罗氏开发的29种药物都包含在世界卫生组织基本药物标准清单中,其中包括可救命的抗生素、抗疟药物和癌症药物。罗氏公司已连续七年被道琼斯可持续发展指数评选为制药、生物技术和生命科学行业的可持续发展领导者。罗氏集团总部位于瑞士巴塞尔,业务遍及100多个国家,2015年全球雇员超过91700人。2015年,罗氏的研发投入高达93亿瑞士法郎,销售额481亿瑞士法郎。位于美国的 Genentech 公司是罗氏集团全资所有的子公司。罗氏公司是日本 Chugai 制药公司的大股东。欲了解更多信息,请登录www.roche.com。 关于TIB MOLBIOL, GmbH自1990年来, TIB MOLBIOL公司提供了高质量的生命科学、医学诊断、产品质量评定和环境分析领域的产品。TIB Molbiol公司总部位于德国柏林,在美国、意大利、西班牙和波兰都设有办事处和生产厂。公司在一些国家设置机构,能促进其与客户相互支持与合作的关系,以及对严重生物威胁如埃博拉、SARs、炭疽、H5N1禽流感和H1N1新型流感的迅速反应。欲了解更多信息,请登录www.tib-molbiol.com。 本通告中使用或提到的所有商标均受法律保护。 关于媒体垂询,请联系:Bob Purcell,罗氏分子诊断部 888-545-2443*以上内容翻译自罗氏总部公告《Roche receives FDA Emergency Use Authorization for Zika PCR test》
厂商
2016.09.06
从罗氏、雅培与九强的合作中我们学到了什么
IVD领域的并购拆分合作一直在如火如荼的进行中,细分领域中的生化诊断市场也是如此。近期国内的生化试剂厂家九强生物向国际顶尖的IVD公司雅培诊断输出技术,这一并不多见合作案例受到许多业内人士的关注,也引起了一些讨论。未来随着中国生化市场竞争的白热化,尤其是对中低端市场的争夺,相信这样的合作会越来越多。 目前中国的体外诊断行业中,市场最大的是免疫诊断和生化诊断,二者占了超过60%的比例。其中免疫诊断里占比最大的化学发光,国外的厂家一直是这方面的市场领导者,约占60%的市场份额。POCT和分子诊断领域也是国外的厂家独大,主要在于技术壁垒,国外的生物技术发展快,技术转化率高,一直引领全球的诊断技术革新。中国的POCT市场中,国外厂家的市场份额同样超过60%,分子诊断市场国外品牌则更是占到80%以上。 目前国内企业表现最好的应该是生化细分市场,而生化诊断市场又分为生化仪器和生化试剂市场,仪器市场还是外资品牌占有率更高,生化诊断试剂领域自上世纪八十年代以来,由于改革开放带来了外资和国外先进技术的大量涌入,国内的生化产业开始了产业化进程,经过了八十年代到九十年代的快速发展期、九十年代到2000年的行业整合期,从2000年至今的行业黄金发展期,市场集中度不断提高,市场竞争逐渐稳定有序,技术更新加快。目前国内生化产业的各类生化检测项目及对应的试剂品种已相当齐全,生化分析仪技术也相当成熟,很多技术已经达到了国际先进水平。主流国产品牌的试剂质量与进口试剂差别不大但有价格优势,更易于被医院接受,目前国内品牌的市场占有率达60%以上。 作为医疗检测的基本组成部分,生化诊断凭借其成本低、速度快的优势,仍保持着较大的市场份额,在相当长一段时间内很难被取代。未来,由于国内老龄化带来的医疗卫生总体需求的增长,由于技术进步带来的新检测项目的应用以及由于分级诊疗逐步实施后基层医疗市场的迅速扩张,我国生化诊断市场将继续保持快速稳定的增长趋势。 早在2013年12月,雅培与九强生物签署生化试剂中国项目战略合作协议,雅培的生化仪开始在中国和九强的生化试剂开始联动销售模式,2015年两家公司又顺理成章的签署了技术转让协议。实际上,除雅培之外,其他的国外大厂也一直在进行着类似的本土化战略。 罗氏投资4.5亿瑞士法郎(约30亿人民币)在苏州工业园区建立亚太的首个罗氏诊断生产基地,产品主要包括免疫和生化的检测产品,到2018年将全面投入运营。2016年3月,罗氏和九强就生化进行合作,九强生物按照罗氏诊断的要求,为其供应适用于cobas c701/702、cobasc 501/502、cobasc 311、Modular P等仪器的生化试剂以在中国进行销售,首批合作项目为21种产品。罗氏诊断一直通过寻求本土化来进一步降低成本以获取价格优势,进一步增强市场竞争力。与此同时,罗氏诊断中国也不断地进行强化终端服务的服务营销战略,通过包括销售支持、应用支持、维修服务、试剂配送等方面不断的实践和完善其服务体系。 除此以外,贝克曼的苏州仪器工厂也于2015年10月开业,而早在2014年,贝克曼就和利德曼进行战略合作,由利德曼生产贝克曼专供试剂。通过这些IVD巨头的动作我们不难看出,他们也在采取各种策略试图进一步扩大生化试剂的市场份额。那么,国内生化企业应该采取什么应对措施呢? 第一, 领先的产品和技术。 如何才能研发出具有市场领先力的产品始终是优秀企业的一大课题,也是国内厂商面临的问题。市场上中高端的生化仪器基本是进口厂商的天下。比如日立、贝克曼、罗氏三家几乎占了生化仪器60%的市场份额。由于国内的研发和工业基础薄弱,这方面确实需要更多的时间来追赶。如果产品暂时达不到领先,那就通过合作、兼并、海外收购等手段来达到获得优质产品的目的,罗氏的生化仪器就是和日立合作,由日立代工。必须明确的是,体外诊断是临床诊治中不可分割的重要一环,对产品本身的要求一定是排在最核心的位置。 第二,价格。 价格是企业重要的竞争力之一。国外大厂的生化试剂价格相对国内企业而言缺乏竞争力。为了弥补这一差距,国外IVD巨头一直积极的实施本土化战略。比如上文提到的雅培、罗氏和九强的合作,其实罗氏和雅培在全球各地和很多当地的小试剂公司进行合作,看重的就是当地的低成本制造。 国内企业应该借助价格上的相对优势,紧跟政策导向,快速抢占中低端市场。通过抢占市场份额,以及兼并收购等资本运作做大,通过扩大生产规模和高效管理来提高生产效率,进一步降低生产成本。此外还应该通过发展上下游产业来进一步降低成本,扩大价格优势。上游主要是原料的研发和生产,下游则主要是第三方检验中心、独立实验室、体检中心等等。 第三, 终端把控力。 一般的生产企业往往是通过代理商渠道到终端,而对终端的维护和服务往往也是通过代理商。国内生化市场品牌众多,竞争激烈,代理商往往忠诚度不够。企业如果丧失终端把控力,往往会被代理商牵着鼻子走,因此对终端客户的服务营销至关重要。在这一点上,国外厂家做的更好。比如罗氏诊断,通过对终端客户进行分类,大客户有重点服务甚至建立专门的团队直接维护,中小客户通过销售部门、市场部门、应用支持部门、维修部门等进行全方位及时的服务和价值传递,提升终端用户的满意度。服务好终端,得到终端客户的品牌忠诚度才是王道。 第四、创新的销售模式和促销政策。 值得一提的是,随着国家医改的深入,分级诊疗的实施,国家大力扶持国产医疗设备,在这一阶段,迅速响应号召紧跟政策步伐,进而快速抢占市场先机也尤为重要。目前国内的生化产品同质化严重,有时候通过创新的销售模式和良好的执行力,能够快速的扩大市场份额,享占政策红利。目前市场上的销售模式多种多样,检验科托管、仪器投放、仪器租赁、仪器试剂联动销售、跨品牌合作销售等等,甚至出现一些与金融公司的合作,为各方参与者提供风险担保和资金支持等等。总之,这个特殊的历史阶段,围绕着终端和渠道需求,创新出不同的销售模式也有助于提升竞争力,增加市场份额。 私以为,以上四项核心竞争力中,只要拥有一项突出的能力,就能在市场上占有一席之地,能够拥有两项突出的能力,就能在一方市场上独领风骚,若能有三项以上的能力,则称得上是一家顶尖的企业了。
媒体关注
2016.04.13