搜全站
搜展位
使用表面带电杂化(CSH)C18色谱柱提高反相肽分离的峰容量
使用表面带电杂化(CSH)C18色谱柱提高反相肽分离的峰容量
Matthew A. Lauber, Stephan M. Koza, 和 Kenneth J. Fountain
沃特世公司(美国马萨诸塞州米尔福德)
应用优势
1、反相肽分离的峰容量更高
2、与甲酸流动相兼容
3、有应用于UPLC®和HPLC的两种颗粒
4、CSH130 C18 使用细胞色素c 的胰蛋白酶消化液进行QC检验
沃特世解决方案
ACQUITY UPLC® H-Class Bio系统
Xevo® G2 QTof质谱仪
ACQUITY UPLC CSH130 C18,1.7 μm色谱柱
XSelect™ CSH130 C18 XP,2.5 μm色谱柱
MassPREP™肽混合物
经LCGC认证的内插管透明玻璃样品瓶
引言
在本研究中,我们评估了CSH130 C18的肽分离特性,期望能够在色谱性方面得到相似的改善,因为在常用的酸性条件下,大部分肽都带有正电荷。针对肽所做的研究表明,与肽分析中先进的固定相相比,这种新型的固定相能够具有更大的峰容量、独一无二的选择性,并且对MS信号的依赖性更低。
质谱条件

结果与讨论
肽分离
关键词
反相、肽、三氟乙酸(TFA)、甲酸(FA)、离子对、表面带电杂化(CSH)、峰容量
引言
无论是通过自上而下的蛋白质组学对蛋白质进行研究1还是运用肽图表征生物药物2,肽分离技术都极其重要。这些分析中所遇到的混合物均具有内在的复杂性。因反相(RP)色谱法具有较高的分辨率,并且能够轻松地与质谱法(MS)衔接,它已成为首选的分离方法。与梯度反相色谱关系最紧密的性能指标是峰容量,或在梯度时间内的最大峰数量3。有趣的是,除使用较小的填料颗粒外,对固定相进行化学修饰也可以对峰容量产生显著的影响。例如,表面带电杂化(CSHTM)C18色谱柱的化学特性是对亚乙基桥杂化(BEH)C18固定相的改进4,因为除了C18键合相外,其表面经修饰后还带有低水平的正电荷5。业已表明,这种修饰能够改善离子化小分子的峰形、载量行为和峰容量5-10。
在本研究中,我们评估了CSH130 C18的肽分离特性,期望能够在色谱性方面得到相似的改善,因为在常用的酸性条件下,大部分肽都带有正电荷。针对肽所做的研究表明,与肽分析中先进的固定相相比,这种新型的固定相能够具有更大的峰容量、独一无二的选择性,并且对MS信号的依赖性更低。
LC条件
实验
系统:Waters® ACQUITY UPLC H-Class Bio系统,配有一个20 cm或30 cm的柱温箱(150 mm色谱柱采用20 cm柱温箱;250 mm色谱柱采用30 cm柱温箱)
检测:配备500 nL分析流通池的ACQUITY UPLC TUV检测器;Xevo G2 QTof质谱仪
波长: 214 nm
扫描速率 : 10 Hz
扫描速率 : 10 Hz
色谱柱:
ACQUITY UPLC BEH130 C18,2.1 x 150 mm,1.7μm,多孔型,130 Å(部件编号186003556)
ACQUITY UPLC BEH130 C18,2.1 x 150 mm,1.7μm,多孔型,130 Å(部件编号186003556)
ACQUITY UPLC BEH130 C182.1 x 150 mm,1.7 μm,多孔型,130 Å (部件编号186006938)
XSelect CSH130 C18 XP,2.1 x 150 mm,2.5 μm,多孔型,130 Å (部件编号186006943)
C18,2.1 x 250 mm,5μm,多孔型,300 Å(竞争厂家产品)
C18,2.1 x 150 mm,1.7μm,表面多孔型(核心1.25μm,外壳0.22μm)100 Å(竞争厂家产品)
柱温: 40 °C
样品温度: 10℃
进样量: 10 μL
流速: 0.3 mL/min
流动相: A:0.1%FA(v/v)水溶液 B:0.1%FA(v/v)的乙腈(ACN)溶液
C:0.1%三氟乙酸(TFA)(v/v)水溶液 D:0.1%TFA(v/v)的乙腈溶液
样品瓶: 经LCGC认证的透明玻璃瓶12 x 32 mm螺纹口样品瓶(部分编号186001126C)
梯度: 2% ACN维持1分钟,然后增加至50% ACN,维持60 分钟(酸组分由定量配比的流动相A/B和C/D控制)。
质谱条件
质谱仪: Xevo G2 Qtof
电离模式: ESI+
分析仪模式: 分离度
毛细管电压: 3.00 Kv
锥孔电压: 25 V
离子源温度: 120 ℃
脱溶剂温度: 350℃
锥孔气体流速: 0.0 L/h
脱溶剂气体流速:800 L/h
校正: NaI 2 μg/μL,50 ~ 2000 m/z
采集: 50 ~ 1990 m/z,10 Hz 扫描速率
数据管理: MassLynx®软件
样品描述
如表1所示,MassPREP肽混合物(部件编号186002337)使用0.1%FA水溶液重新溶解,使总肽浓度大约为0.6 mg/mL。


结果与讨论
肽分离
MassPREP肽混合物含有9种不同的肽,氨基酸组成、质量、长度和极性各有不同。肽序列如表1所示。由于该混合物由这样一组多样的肽组成,所以对于评价质谱性能和色谱性能是很有用的。鉴于此,相对于其他常用于肽分析的固定相,肽混合物被用作检测CSH130 C18的分离性能。本研究还包括用于高效分离混合物中大孔径肽(100 Å ~ 300 Å)的固定相,这些肽的分子量均低于 3kDa。另一个单独的应用纪要对使用130 Å孔径的CSH130 C18分离更大的多肽进行了讨论。11为了研究相关性,使混合物中每种肽的上样量与抗体肽图所用的常用条件接近,其中20 ~ 50 μg的Lys-C消化液或胰蛋白酶消化液一般在内径为2.0 mm或2.1 mm的色谱柱上进行分析。2,12-13同样,分离使用含有强离子对试剂TFA、较弱的离子对试剂FA或两者结合的流动相完成。肽反相分离通常与质谱联用,在各种条件下得到的性能颇引人注意。在这些应用中,因为甲酸能够提供灵敏度更高的检测,所以选用甲酸而非三氟乙酸作为流动相添加剂。14-15
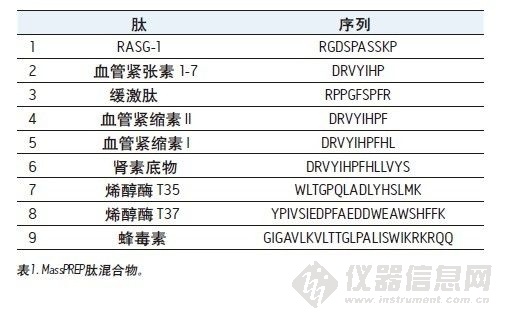
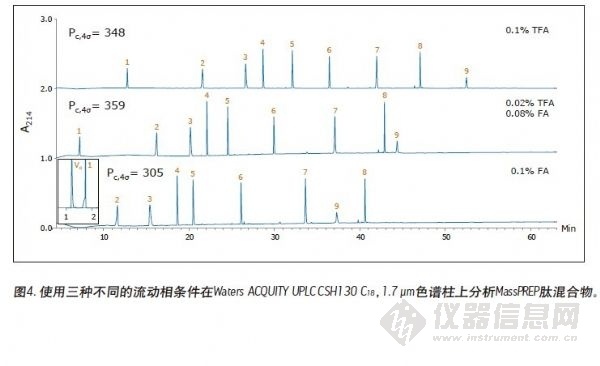
图1是在不同的流动相条件下使用一根5 μm硅胶C18色谱柱得到的三张MassPREP的色谱图。使用TFA进行分离得到的色谱峰一般都是对称的。大部分色谱峰并未出现过度的峰展宽或拖尾的现象。但是,使用含有甲酸的流动相得到的峰形极不理想。此外,混合物中最大的肽——蜂毒素并未被检测出来,原因可能是峰过宽或根本没洗脱出来。对于使用HPLC进行的肽分离,这样的结果是很常见的。

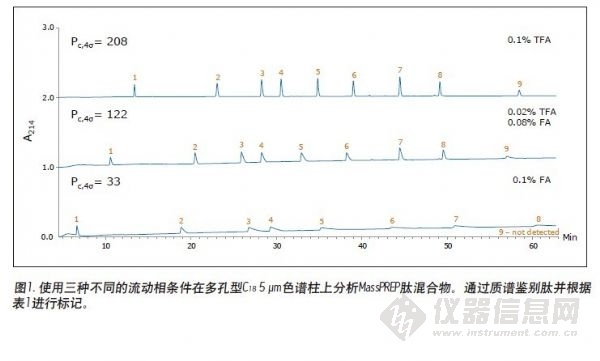
使用亚2 μm颗粒可让肽分离的性能更加优越。在两种均以1.7 μm颗粒填充的色谱柱上得到的色谱图见图2和图3。特别是图2中的色谱图,它们使用表面多孔型C18色谱柱得到。在流动相中加入TFA时,得到的色谱峰是对称的,并且一般比使用5 μm多孔型C18色谱柱得到的色谱峰更窄,如图1所示。在流动相中加入极少量TFA或者不加TFA时,色谱峰变宽并出现明显拖尾。在所有测试条件下,全多孔BEH130 C18色谱柱分离的效果与表面多孔型C18色谱柱相当,如图3所示。



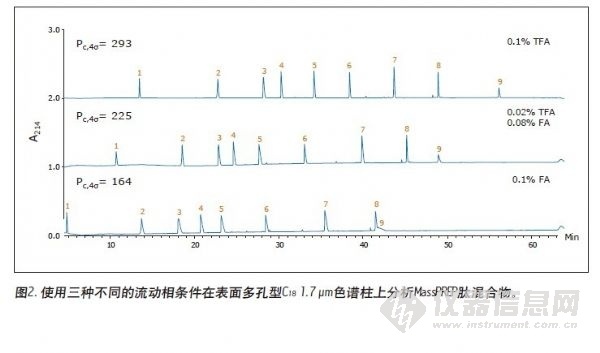
图1至图3表示的分离用于检测CSH130 C18,1.7 μm色谱柱肽分析的性能。对应的色谱图如图4所示。图1至图4的对比清楚表明,无论是使用含有TFA还是FA的流动相,与其他色谱柱不同的是,CSH130 C18都能够提供最佳的峰形。此外,可以明显看到,CSH130 C18 表现出独一无二的选择性——尤其使用不含TFA的流动相情况下。例如,在流动相中仅加入0.1%的甲酸,在本研究所用的其他任何色谱柱上(CSH130 C18除外),肽8和肽9均未得到很好的分离。而使用CSH130 C18时,这两种洗脱是峰形对称并在3分钟以上的时间内分实现分离。另外,这些色谱柱之间也存在保留能力的差异。最值得注意的是,CSH130 C18色谱柱的保留能力稍弱于本研究涵盖的其他色谱柱。这正好印证了CSH130 C18是唯一一种表面带有少量正电荷吸附剂的事实。带正电荷的肽与CSH130 C18表面之间的库仑斥力很可能是CSH130 C18保留能力较低的原因。图4的插图显示了在CSH130 C18色谱柱上使用0.1%FA梯度时的最早洗脱部分。在这些条件下,亲水性最强的肽RASG-1(肽1)在孔隙体积标记附近出峰。与BEH130 C18色谱柱相比,一般使用CSH130 C18洗脱肽时所使用的ACN的量要少2% ~ 4%。 使用0.1%TFA时,保留能力的差异最小,而使用0.1%FA时,保留能力差异最大。分析极性很大的肽时,CSH130 C18的初始梯度条件可能需要作相应的调整。
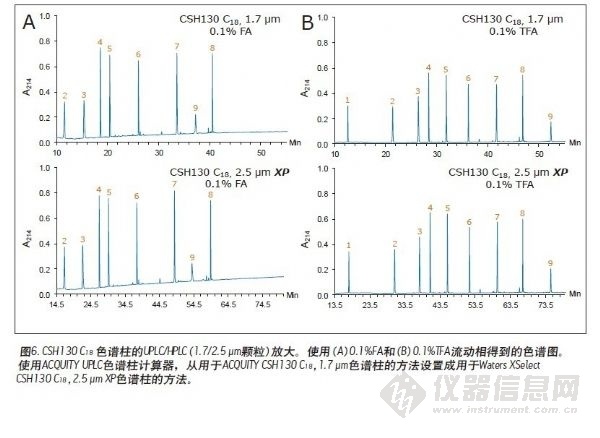
粒径和UPLC/HPLC的放大性
结论
峰容量和质谱信号
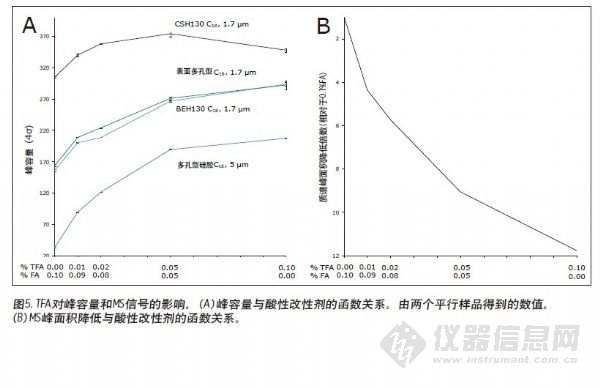
对这些定性分离的比较表明CSH130 C18比其他色谱柱具有性能上的优势。但是,定量更引人注目。在每个分离中观察到的峰容量按照实验部分的方法计算。图5A显示了在每种色谱柱上酸性改进剂组成与峰容量之间的关系。图5A的左部分是仅使用FA而不使用TFA离子对试剂得到的峰容量值。沿X轴向右是与FA浓度降低、TFA浓度升高时对应的峰容量值。CSH130 C18色谱柱的性能优势很容易显现出来。使用0.1%TFA时,CSH130 C18色谱柱的峰容量比其他1.7 μm C18色谱柱大20%。但是,如果使用含有0.1%甲酸的流动相,CSH130 C18色谱柱的峰容量比其他
对这些定性分离的比较表明CSH130 C18比其他色谱柱具有性能上的优势。但是,定量更引人注目。在每个分离中观察到的峰容量按照实验部分的方法计算。图5A显示了在每种色谱柱上酸性改进剂组成与峰容量之间的关系。图5A的左部分是仅使用FA而不使用TFA离子对试剂得到的峰容量值。沿X轴向右是与FA浓度降低、TFA浓度升高时对应的峰容量值。CSH130 C18色谱柱的性能优势很容易显现出来。使用0.1%TFA时,CSH130 C18色谱柱的峰容量比其他1.7 μm C18色谱柱大20%。但是,如果使用含有0.1%甲酸的流动相,CSH130 C18色谱柱的峰容量比其他
1.7 μm色谱柱大90%。因此,CSH130 C18不仅比其他色谱柱具有更大的峰容量,而且其性能对三氟乙酸的依赖性很小。由此带来的最明显效果是CSH130 C18色谱柱与质谱具有很高的兼容性。在这些分析中,三氟乙酸对肽质谱检测的影响见图5B。我们知道,在电喷雾离子化过程中,TFA会引起严重的离子抑制16-17。因此,使用TFA而不使用FA时,质谱信号降低12倍。CSH130 C18色谱柱并不需要太多TFA(如果有)来获得最佳峰容量,因此成为需要高灵敏度LC/MS应用的理想选择。

粒径和UPLC/HPLC的放大性
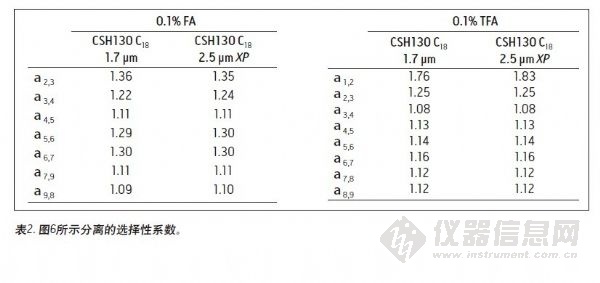
许多肽分离操作仍在传统的HPLC仪器上进行。因其背压过高,使用亚2 μm填充的色谱柱通常不适合与HPLC系统联用。而2.5 μm色谱柱因其背压较低可以在任何LC仪器上使用。为确定CSH130 C18,1.7μm色谱柱得到的峰容量是否可以成功转移到CSH130 C18 XP,2.5 μm色谱柱上,针对2.5 μm XP色谱柱设置了一种从一根1.7μm色谱柱转移出来的HPLC兼容的方法。这种转移如下所述:按照ACQUITY UPLC色谱柱计算器的建议18,将流速降低,增加梯度时间,降低和增加的系数均为1.5。图6显示,使用1.7 μm色谱柱进行的分离成功地转移到了2.5μm XP色谱柱上。选择性系数的一致性强调了这一观察结果,如表2所示。与1.7颗粒的色谱柱相比,使用2.5μm XP颗粒进行分离时背压出现极大地降低(~3000psi比 ~8000 psi),从而表明了CSH技术可以轻松应用于UPLC或HPLC进行的高峰容量肽分离中。


结论
由于创新性的施加了低水平的正电荷,CSH 130 C18色谱柱已经被证明是一种能够实现肽分离的技术。根据对9种肽混合物进行分析,我们发现,与非表面带电的C18色谱柱相比,CSH 130 C18显示出更高的峰容量和独一无二的选择性。经过观察,CSH 130 C18色谱柱的性能对强离子对试剂(例如TFA,可以抑制电喷雾离子化)的依赖性显著降低。此外,在背压较小的HPLC条件下,使用CSH 130 C18,1.7 μm色谱柱得到的分离结果可以转移到CSH 130 C18,2.5 μm XP色谱柱上——尽管以牺牲分析时间为代价。CSH 130 C18可以使用不同的粒径,便于采用UPLC作为常规使用(以往这些实验室的日常使用被限制在HPLC仪器上),也可以拓展到压力上限为9000~12000psi的
UHPLC上。
参考文献
参考文献
1. Yates JR, Ruse CI, Nakorchevsky A. Proteomics by mass spectrometry: approaches,
advances, and applications. Annu Rev Biomed Eng. 2009; 11: 49-79.
2. Richardson J, Shah B, Xiao G, Bondarenko PV, Zhang Z. Automated in-solution
protein digestion using a commonly available high-performance liquid
chromatography autosampler. Anal Biochem. 2011; 411(2): 284-91.
3. Neue UD. Theory of peak capacity in gradient elution. J Chromatogr A. 2005;
1079(1-2): 153-61.
4. Wyndham KD, O’Gara JE, Walter TH, Glose KH, Lawrence NL, Alden BA, Izzo GS,
Hudalla CJ, Iraneta PC. Characterization and evaluation of C18 HPLC stationary
phases based on ethyl-bridged hybrid organic/inorganic particles. Anal Chem.
2003; 75(24): 6781-8.
5. Iraneta PC, Wyndham KD, McCabe DR, Walter TH. Charged Surface Hybrid
(CSH) Technology and Its Use in Liquid Chromatography. Waters White Paper
720003929EN. 2011.
6. Berthelette KD, Summers M, Fountain KJ. Modernization of the USP Assay for
Clarithromycin Using eXtended Performance (XP) Column Technology. Waters
Application Note 720004461EN. 2012.
7. Fountain KJ, Hewitson HB, Iraneta PC, Morrison D. Practical Applications
of Charged Surface Hybrid (CSH) Technology. Waters Application Note
720003720EN. 2010.
8. Summers M, Fountain KJ. A Quality by Design (QbD) Based Method
Development for the Determination of Impurities in a Peroxide Degraded
Sample of Ziprasidone. Waters Application Note 720004072EN. 2011.
9. Summers M, Fountain KJ. Rapid Method Development through Proper Column
Selection. Waters Application Note 720004353EN. 2012.
10. ACQUITY UPLC CSH Columns. Waters Applications Notebook
720003537EN. 2010.
11. Lauber MA, Koza SM, Fountain KJ. Peptide Mapping and Small Protein
Separations with Charged Surface Hybrid (CSH) C18 and TFA-Free Mobile
Phases. Waters Application Note. 720004571EN. 2013.
12. Yan B, Yates Z, Balland A, Kleemann GR. Human IgG1 hinge fragmentation as
the result of H2O2-mediated radical cleavage. J Biol Chem. 2009; 284(51):
35390-402.
13. Yu XC, Joe K, Zhang Y, Adriano A, Wang Y, Gazzano-Santoro H, Keck RG,
Deperalta G, Ling V. Accurate determination of succinimide degradation products
using high fidelity trypsin digestion peptide map analysis. Anal Chem. 2011;
83(15):5912-9.
14. Annesley TM. Ion suppression in mass spectrometry. Clin Chem. 2003; 49(7):
1041-4.
15. Temesi D, Law B. LC-GC Int. 1999;17: 626-32.
16. Apffel A, Fischer S, Goldberg G, Goodley PC, Kuhlmann FE. Enhanced
sensitivity for peptide mapping with electrospray liquid chromatography-mass
spectrometry in the presence of signal suppression due to trifluoroacetic
acid-containing mobile phases. J Chromatogr A. 1995;712(1): 177-90.
17. Kuhlmann FE, Apffel A, Fischer S, Goldberg G, Goodley PC. J Am Soc Mass
Spectrom. 1995; 6 (12): 1221-1225.
18. Jones M D, Alden P, Fountain KJ, Aubin A. Waters Application Note
720003721EN. 2010.
最新动态
更多![]()
Xevo MRT新应用 | 火眼金睛,让PFAS无处遁形
厂商
2024.08.26
Arc GPC体验:PEO/PEG的SEC分析
厂商
2024.08.26
UPLC二十周年大咖说 | UPLC技术应用于复杂组分的分离分析
厂商
2024.08.26
“悟空”出马,PFAS无处遁形:Xevo MRT智斗污染妖魔
百态
2024.08.22
推荐产品
供应产品










