本文已被燃料化学学报录用,并要求翻译成英文在Sciencedirect 上发表,敬请关注!
余 剑1,朱剑虹1,2,岳君容1,许光文1
(1. 中国科学院过程工程研究所 多相复杂系统国家重点实验室,北京100190;2. 湘潭大学化工学院,湖南 湘潭 411105;)
摘 要:本文利用微型流化床反应分析仪(MFBRA)研究了生物质在氩气氛中的热解反应,通过在线反应物供给和生成气组成变化监测,实现了设定温度下生物质热解反应速率的测试、动力学参数的求算和反应机理的分析。应用该仪器测定的生物质在800℃的热解时间为10s,远小于传统文献报道值。测试的气体释放顺序与反应动力学参数初步证实了生成的不同气体间存在耦合反应,且各气体生成难易程度存在差异。本文测试的反应级数为1.62,以整体挥发分为基准的活化能与指前因子分别是11.77kJ·mol-1和1.45s-1,远小于常规热重方法的测试值。
关键词:微型流化床;反应动力学;生物质热解
中图分类号:TQ 056.1 文献标志码: A
Reaction kinetics and mechanism of biomass pylolysis
in a micro-fludized bed reactor
YU Jian1,ZHU Jian-hong1,2, YUE Jun-rong1,XU Guang-wen1
(1. State Key Laboratory of Multi-phase Complex System,Institute of Process Engineering, Chinese Academy of Science,Beijing 100190,China;2. Chemical Engineering Institute of Xiangtan University,
Xiangtan 411105,Hunan,China)
Abstract:A Micro Fluidized Bed Reaction Analyzer (MFBRA) was used to study the pyrolysis of biomass in argon. Through on-line pulse feeding of reactant and continuously monitoring the composition changes of gas product, the MFBRA enables the measurement of reaction rates at arbitrary temperatures, deduction of kinetic parameters and analysis of reaction mechanism. The application to biomass pyrolysis in this article resulted in a time of about 10s to finish reaction, which was much shorter than the literature values in larger fluidized bed reactors and very close to the theoretically anticipated values. The detected evolving sequences of different gas species and the deduced kinetic parameters demonstrated further that the reactions between/among the formed different gas species prevail to certain degree during pyrolysis and there were different pathways for forming different gas species. The activation energy and pre-exponential factor derived by viewing the pyrolysis gas as a single product were 11.77kJ/mol and 1.45s-1, much lower than the literature values measured in thermogravimetric analyzer.
Key words: Micro-fluidized bed;Reaction kinetics;Biomass pyrolysis
生物质热解不仅是未来最有前景的生物质利用方式之一,而且是生物质燃烧与气化过程必须发生的反应,通过对生物质的热解动力学研究,可以获得热解反应动力学参数,对于判断热解反应机理和影响因素以及优化反应条件具有重要意义。生物质热解过程涉及传热、传质及复杂的化学反应,通常采用一级反应动力学模型分析利用热重仪器在给定升温速率下测得的样品重量及系统热量随时间或温度的变化而推导反应动力学参数[1~4],或在较大尺寸的流化床反应器中通过测定气体、半焦及焦油在不同温度下的产率求算动力学函数或推导反应机理[[5~6]。
热重分析仪升温速率可调,能实现生物质中木质素、纤维素及半纤维素热解反应的分离,分别求算其动力学参数,因此TG可作为生物质热解动力学研究的一个基本工具。但热重分析受仪器结构及原理的限制,载气流速小使反应易受气体扩散的抑制,而不能反映本征过程。且热重升温速率慢,无法实现等温条件下(快速升温)的热解反应。同时,热重分析仅记录物料样品重量与反应过程热量的变化,难以体现复杂反应的反应机理。在传统流化床反应器中物料不易在短时间内达到均匀混合,没有标准化的反应器尺寸与测试方法,致使不同研究者的测试结果差异较大,而且由于反应器大,测试热解等快速反应的反应速度准确度低。
中国科学院过程工程研究所将微型流化床反应器应用于反应动力学速度测试及参数求算,利用微型流化床实现微分反应特征,并首次将其仪器化,研制了微型流化床反应分析仪(MFBRA:Micro Fluidized Bed Reaction Analyzer)[7~9]。该分析仪能实现设定温度下固体物料的瞬时进样,通过在线过程质谱对关键气体组分进行定性与定量分析,根据气体浓度变化求算反应动力学参数并推测反应历程。
本文首次利用MFBRA测定氩气气氛中生物质快速热解反应特性,根据其释放特性初步探讨生物质在微型流化床中的热解反应历程,同时应用热解反应缩核动力学模型求算了针对单组分及整体挥发分的动力学参数,并与文献结果进行比较。
1 仪器装置与实验过程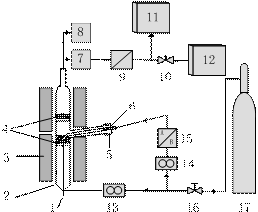
1-Thermocouple;2-Quartz tubular reactor;
3-Furnace Electric resistance;4-Fludizing agent Quartz sand;5-Sample container;6-Sample;7-Flow sensor;8-Pressure sensor;9-Gas filter;10-Needle vavle; 11-Gas chromatography; 12-Process mass;
13、14-Mass flowmeter;15-Conpressed gas controller; 16-Gas vavle;17-Steel bottle
图 1 微型流化床反应分析仪流程示意图
Figure 1 Schematic diagram of MFBRA
图1为MFBRA的流程示意图,由脉冲进样系统、流化床反应器、温度与压力传感器、气体检测器以及数据采集与分析系统构成。通过对微型流化床流化特性的前期研究[10],仪器选用了直径20 mm的石英流化床和250 μm的硅砂颗粒为流化介质,以有效控制节涌和沟流。为防止细微颗粒逃逸、使物料充分反应,MFBRA使用了双层分散板结构。反应器高100 mm,流化反应段高40 mm,二段流化区高度60 mm,进样管内径4 mm,通常装10-50 mg样品,通过磨口与反应器相连。反应器温度、气体流量、供样脉冲与检测器均通过计算机控制。
MFBRA的操作流程如下:在微型流化床反应器两反应段中分别装入3 g流化介质,并用天平称取(5-50 mg)固体反应物放入进样石英管末端中,固定好连接,通入足以流化所装填颗粒的流化气体并同时开始加热。当反应器温度达到设计值时,开启脉冲阀,使冷态物料瞬时供入流化的高温石英砂中,反应的气体产物经过压力传感器、流量传感器、气体净化器后进入质谱仪进行检测。同时在生成气出口装有电磁阀,可通过程序控制在反应时间内采集气体样品(利用气袋采样),利用气相色谱分析各样品的组分特性和外标法定量。
生物质热解的实验条件是:利用氩气作为流化和进样气体,流量均为300 mL·min-1;流化颗粒65-80目(0.20-0.25 mm),是盐酸浸洗和高温焙烧处理的石英砂;利用酒糟作为所研究的生物质样品(燕京啤酒厂),其工业分析与元素分析结果如表1所示,样品质量控制在20-25 mg;粒径为120-200目(0.075-0.125 mm),以忽略内扩散对动力学参数的影响;反应温度400-900 ℃;生成气体的H2,CH4,CO,CO2浓度由质谱检测,采用外标法定量气体浓度。
表 1 酒糟工业分析和元素分析结果
Table 1 Properties of the experimental material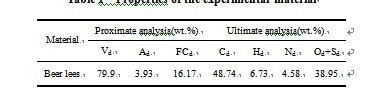
2 结果与讨论
2.1 反应温度与气体释放的关系
图2(a)表示酒糟在500 ℃下快速热解生成的气体组分的浓度变化,主要气体组分开始释放的顺序是CO2,CO,CH4和H2。优先生成CO2表明生物质化学结构支链上的羧酸基团脱羧反应较其他反应易发生[11~12]。各种气体具有的不同释放时间表明其生成的难易程度各不相同。图2(b)为800 ℃条件下气体释放曲线图,与500 ℃相比,气体的释放序列的差别明显减小,CO、CH4和H2几乎在同一时间生成,表明在高温条件下,生物质的升温速率增加,使得各种物质的热解难易程度的差别消失;整个反应时间为10 s,远文献报道的小于小型流化床中的热解时间45 s [13],说明在MFBRA中具有更高的反应速率。
图3为不同温度下采用气袋收集产物气体并用气相色谱定量主要气体组分的产率随反应温度的变化:随反应温度的增高,热解程度加深,气体生成物增多。在低温反应区,气体产率增加主要由CO生成所致,而在高温区则主要归因于H2的贡献,同时CO2产率随反应温度的变化小于其他气体组分。同时,图3中相应温度下气体各组分的产率\总量的差别进一步证实了图2中气体各组分浓度的变化趋势。图3中气体产率变化规律表明[11]CO2的生成在较低温度下即可完成,主要由一次反应产生。CO与CH4的产率在温度增加过程均出现最大值,分别在600 ℃与700 ℃。CO主要源于含氧杂环与酮类化合物的二次裂解[14],温度越高二次裂解反应越显著。同时,升温速率随温度升高而增大,导致酮类化合物更易发生脱氢缩聚反应,降低CO生成、同时增加H2产率。而且,高温条件下反应器中气速大,一次产物停留时间缩短,二次裂解程度降低。这些过程的综合作用导致CO产率先增加后减少[15]。
CH4变化趋势与碳化过程中的-OCH3基团在不同温度下的形成有关[16~17]。低温段主要来自热裂解初期碳化过程中芳香族的甲氧基团的断裂,而高温区内二次反应中碳骨架重整炭化过程更易发生,析出CH4,但CH4高温裂解生成氢气的概率也同时增加,二者的竞争作用导致CH4产率随温度升高先增加后降低。生成气中H2产率随温度升高而明显增加,除与高温导致热解效率增加外,还与前述在高温段CO生成机理及CH4裂解的有关。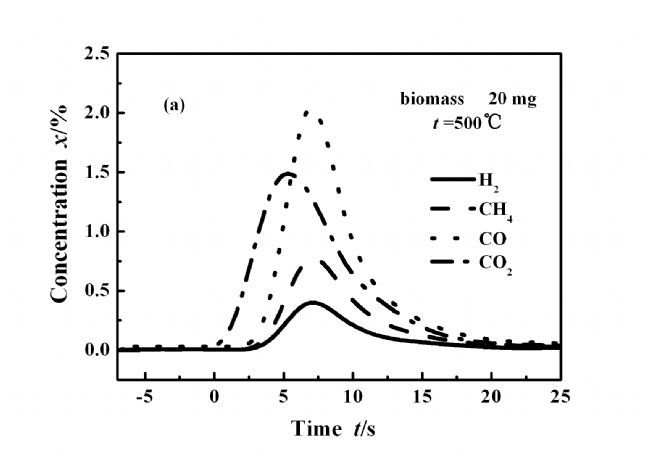
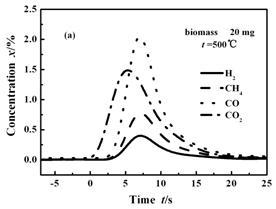
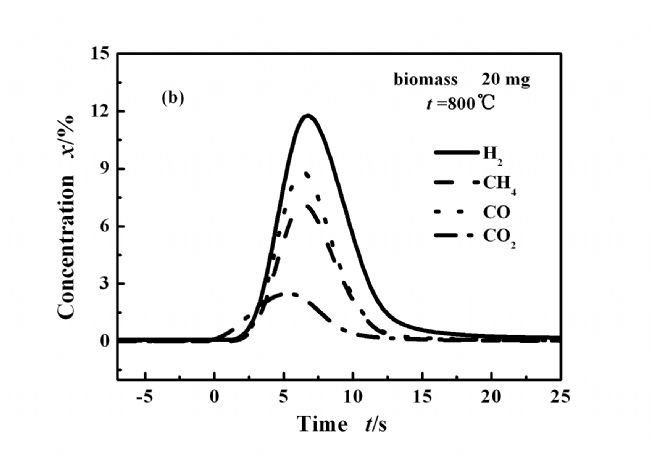
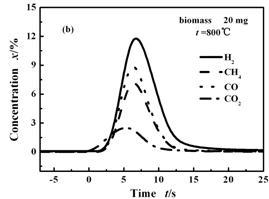
图 2 主要气体释放顺序及其浓度随时间的变化
Figure 2 Evolved major gases and their release sequences during pyrolysis.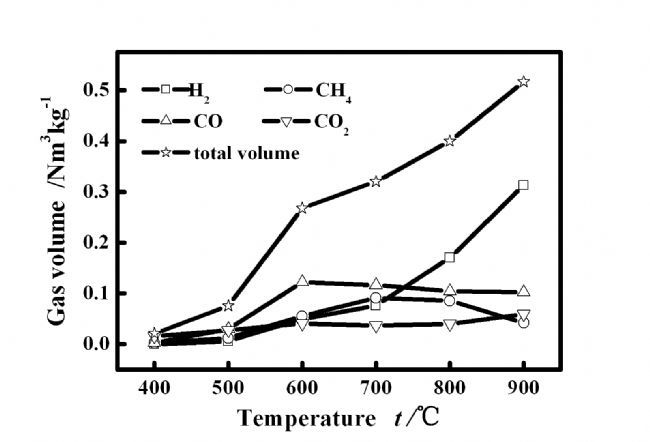
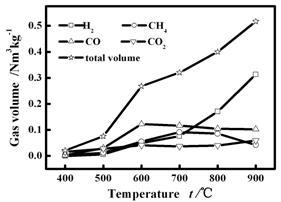
图 3 主要气体组分及混合气产率随温度的变化
Figure 3 Yields of major gas components and the mixture at different reaction temperatures
2.2 气速对热解反应的影响
反应中考察了反应温度在800 ℃条件下,气体流量对反应速率的影响。从图(4)中可以看出,气速增加反应速率增加,热解时间缩短。当载气流量增加至300 NmL/min(0.058 m/s)时,反应速率(曲线斜率)增加不再明显。表明在该条件下,外扩散对热解反应的抑制作用可以忽略。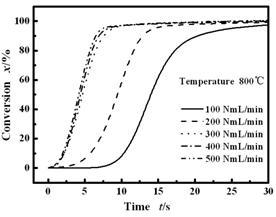
图 4 反应温度800℃下气体流量对整体反应速率的影响
Figure 4 Total gas conversion vs reaction time in MFBR at different flow rates
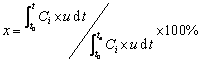 (1)
(1)
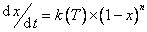 (2)
(2)
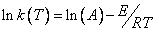 (3)
(3)
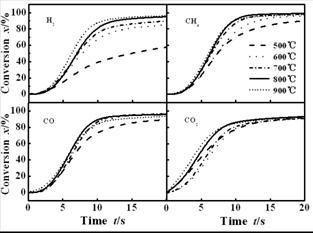
图 5 不同温度下各气体产物相对转化率随时间的变化
Figure 5 Relative conversion of major gas components varying with reaction time at different temperatures
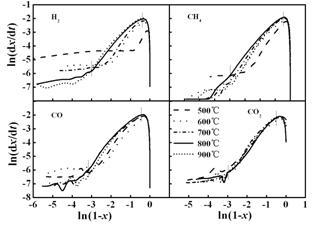
图 6 不同温度下主要气体产物生成的ln(dx/dt)
与ln(1-x)的关系
Figure 6 Correlation of ln(dx/dt) withln(1-x) for major gas components at different temperatures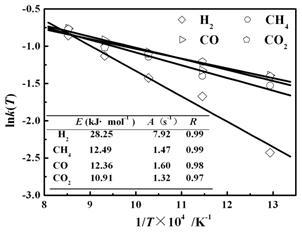
图7 主要气体组分的ln k(T)-1/T线性拟合
Figure 7 Linear fitting of ln k(T) and 1/T for gas components
表 2 主要气体组分生成及整体反应的动力学参数
Table 2 Kinetic parameters for the formations of major gas components and the release of pyrolysis gas
Formed gas | t /℃ | ln k(T) | n | R |
H2 | 500 | -2.43 | 2.42 | 0.99 |
600 | -1.67 | 1.59 | 0.98 | |
700 | -1.43 | 1.65 | 0.99 | |
800 | -1.13 | 1.53 | 0.99 | |
900 | -0.86 | 1.60 | 0.99 | |
CH4 | 500 | -1.53 | 1.54 | 1.00 |
600 | -1.40 | 1.33 | 0.99 | |
700 | -1.14 | 1.34 | 0.99 | |
800 | -1.01 | 1.26 | 0.99 | |
900 | -0.89 | 1.46 | 0.99 | |
CO | 500 | -1.39 | 1.56 | 0.99 |
600 | -1.32 | 1.75 | 0.99 | |
700 | -1.08 | 1.52 | 0.99 | |
800 | -0.91 | 1.65 | 0.99 | |
900 | -0.76 | 1.71 | 0.99 | |
CO2 | 500 | -2.01 | 1.71 | 1.00 |
600 | -1.40 | 1.53 | 0.99 | |
700 | -1.21 | 1.72 | 0.99 | |
800 | -1.10 | 1.71 | 0.99 | |
900 | -1.01 | 1.85 | 1.00 | |
Pyrolysis gas mixture | 500 | -1.47 | 1.86 | 1.00 |
600 | -1.22 | 1.62 | 0.99 | |
700 | -1.07 | 1.62 | 0.99 | |
800 | -0.98 | 1.52 | 0.99 | |
900 | -0.82 | 1.62 | 0.99 |
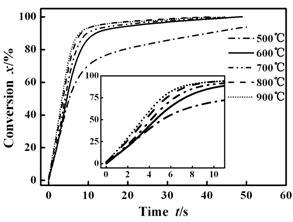
图 8 热解混合气体的相对转化率随时间的变化
Figure 8 Relative conversion based on pyrolysis gas mixture
versus reaction time at different temperatures
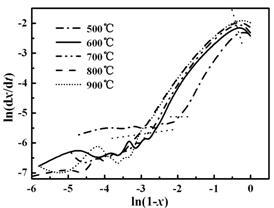
图 9 混合气体形成的ln(dx/dt)与ln(1-x)关联
Figure 9 Correlation of ln(dx/dt) and ln(1-x) for the formation of pyrolysis gas mixture
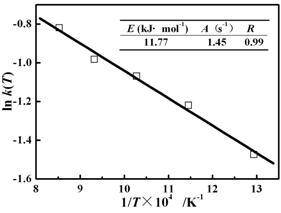
图 10 热解气混合物生成反应的ln k(T) versus 1/T
igure 10 Linear fitting ofln k(T) and1/T for for formation of pyrolysis gas mixture.