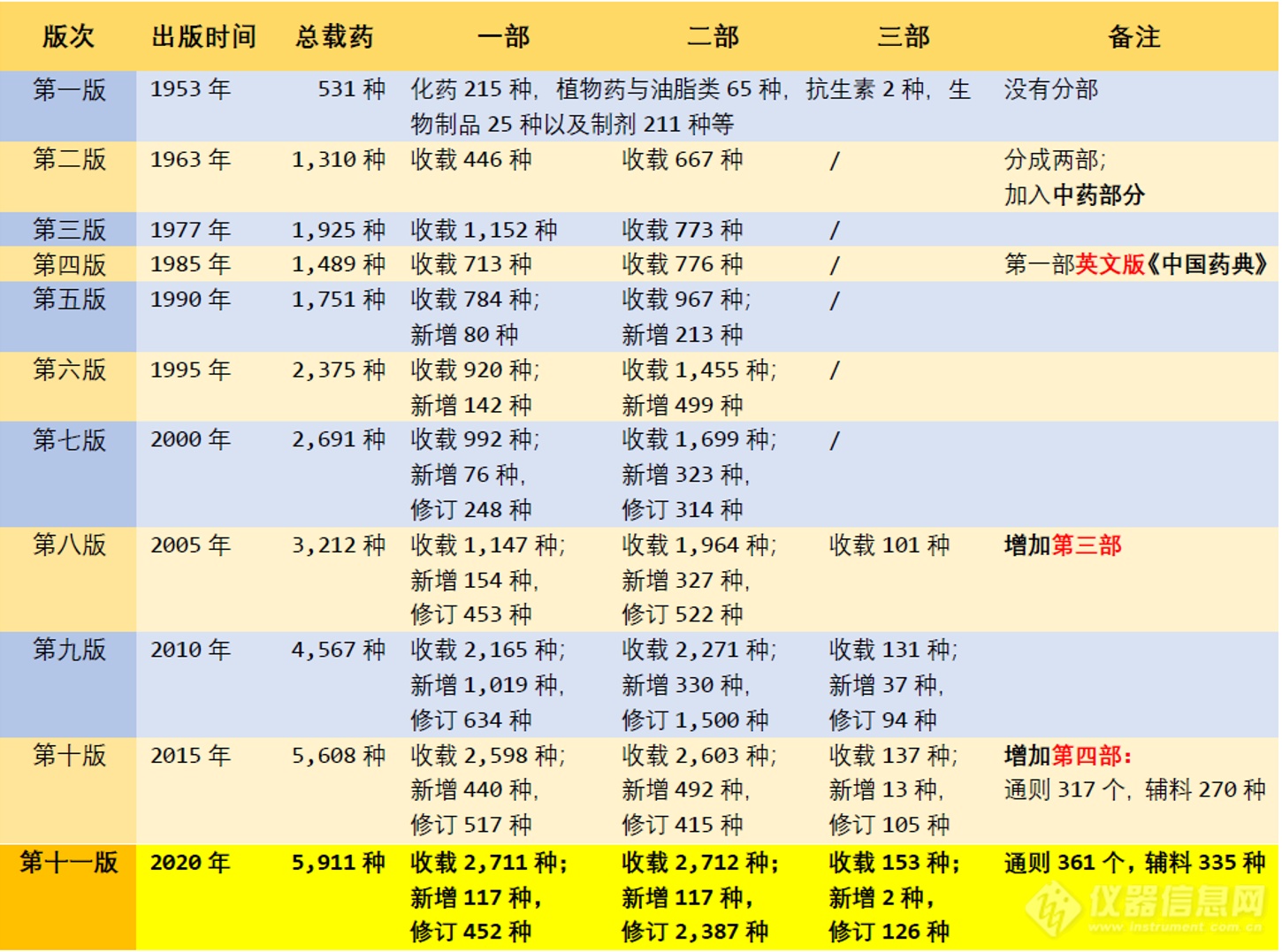
2020年7月2日,新版《中国药典》正式颁布。第一版《中国药典》于1953年颁布,至今国家已经颁布11版药典。新版药典不仅在收录的药物和方法上有变化,其中检测仪器和相关的指导原则也有相应的更新。《中国药典》是国家药品标准的重要组成部分,是国家药品标准体系的核心。新版药典的颁布实施必将对保障药品质量、维护公众健康、促进医药产业高质量发展发挥重要作用。
为了帮助制药领域用户学习、了解新版药典的相关内容,仪器信息网特别策划了“2020年版《中国药典》变化盘点”系列报道。
《药典》是国家为保证药品质量可控、确保人民用药安全有效而依法制定的药品法典,是药品研制、生产、经营、使用和管理都必须严格遵守的法定依据,国家药品标准体系的核心。
第一部《中国药典》1953年
1949年,中华人民共和国成立后,在党和政府的关怀下,卫生部召集在京医药专家研讨编纂药典。药学专家孟目的教授负责组建中国药典编纂委员会并筹划编制药典。首版药典收载了化学药、植物药与油脂类、动物药、抗生素、生物制品以及各类制剂。
第二部《中国药典》1963年
1955年,卫生部成立第二届药典委员会,这届委员会因故未能工作。
1957年成立第三届药典委员会,指出第一版中国药典没有收载广大人民习用的中药,一致认为应把中药收载到药典。1965年1月26日,1963年版药典颁布。
第三版《中国药典》1977年
1966年,由于“文革”动乱影响,药典委员会工作陷于停顿。1972年4月28日国务院批复卫生部“同意恢复药典委员会”。1977年版药典:一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及一些单味药材制剂等,成方制剂(包括少数民族药成方);二部收载化学药品、生物制品等。
第四版《中国药典》1985年
1979年,卫生部聘请112人组建第四届药典委员会,钱信忠担任主任委员。1985年9月出版,1986年4月1日起执行:一部收载中药材、植物油脂及单味制剂,中药成方;二部化学药品、生物制品等。
第五版《中国药典》1990年
1986年,卫生部聘请150人组建第五届药典委员会。1990年12月3日卫生部颁布,1991年7月1日起执行。
1988年10月,第一部英文版《中国药典》1985年版正式出版。另组织编著《临床用药须知》以指导临床用药。部分药物的红外光吸收图谱收入《药品红外光谱集》另行出版。
第六版《中国药典》1995年
1991年,卫生部聘请168人成立第六届药典委员会,陈敏章部长兼任主任委员。1996年4月1日执行,一部收载中药材、植物油脂,中药成方及单味制剂;二部收载化学药、抗生素、生化药、放射性药品、生物制品及辅料等。《药品红外光谱集》第一卷(1995年版)、《中药彩色图集》、《中药薄层色谱彩色图集》以及《中国药品通用名称》等标准配套书同时出版。
第七版《中国药典》2000年
1998年9月,卫生部药典委员会更名为国家药典委员会。2000年1月出版发行,2000年7月1日起正式执行。
二部附录中收载了药品标准分析方法验证要求等六项指导原则; 现代分析技术在这版药典中得到进一步扩大应用。为加强国际合作与交流,第七届药典委员会还决定 《中国药典》2000年版英文版与中文版同步出版。
第八版《中国药典》2005年
2002年10月,第八届药典委员会成立,由国家食品药品监督管理局聘请312位委员组成。《中国生物制品规程》并入药典,成为《中国药典》三部; 并编制首部中成药《临床用药须知》。收载药物有较大增加,2005年7月1日起正式执行。
第九版《中国药典》2010年
第十版《中国药典》2015年
2010年3月第十届药典委员会组建成立,2015版药典收载品种涵盖了基本药物、医疗保险目录品种和临床常用药品,更加适合于临床用药的需求。2015年12月1日起正式实施。一部至三部的附录整合,增设为药典四部。
第十一版《中国药典》2020年
2020年7月2日,国家药品监督管理局、国家卫生健康委发布公告,正式颁布2020年版《中国药典》,将于12月起正式实施。