滴定法是最常用的化学分析方法。在滴定中,只要被测组分、滴定剂或反应生成物中的任何一个在紫外光区有特征吸收,并遵守朗伯-比尔定律,就可通过滴定体系的吸光度的变化来指示滴定过程和滴定终点,这就是紫外分光光度滴定法。分光光度滴定法不仅适用紫外光区,也适用可见光区和红外光区。在滴定后,以滴定剂的用量为横坐标,以滴定体系的吸光度为纵坐标,绘制分光光度滴定曲线。滴定曲线中两条直线的交点就是滴定终点。由滴点终点所示的滴定剂体积和浓度,就可计算样品溶液中待测组分的含量或浓度。 分光光度滴定法准确、灵敏和精密度高(相对误差可0.1%),且有适用范围广和可实现自动滴定等特点。有人用这个做过吗
什么是滴定法,滴定法准确度高不高? 滴定法是将已知浓度的标准溶液均匀缓慢地滴入试祥溶液中,使标准液与试样溶液中的被测组分进行化学反应。用指示剂或其他电测手段判断反应的终点。根据滴定的标准溶液数量,计算出试样溶液中待测组分的含量。在环境监测中,COD、各种形态的氮、卤素离子、亚硫酸离子、氰基离子等许多项目,都用滴定法测定。有时判断仪器分析值是否准确也常用滴定法校验。滴定法使用的计量器具有容量瓶、移液管、滴定管、量筒等。 滴定法与其他方法相比具有方法简单、器具较少、准确可靠等优点。当试样溶液中被测组分浓度较高时,其准确度较[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法、分光光度法、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法等高得多。所以,尽管仪器分析方法比较普遍,仍不能完全取代滴定法。但是,滴定法不适用于微量分析。当被溯组分浓度很低时,许多仪器分析比滴定法灵敏度高。而且,滴定法容易受分析者的操作经验和熟练程度所左右。经验多、较熟练的分析人员所得到的分析结果比经验少、不熟练者准确可靠。因此,在滴定法操作中,一方面要求配制的标准溶液准确无误,另一方面要求滴定时观察的液面与眼睛高度严格保持一致。同时还要注意以下事项: (1)不要加热带有刻度的计量容器; (2)各类计量容器必须充分洗净方可使用; (3)取20mL的溶液时,应当用20mL的移液管取一次,一般不用10mL移液管取两次; (4)不要用嘴把溶液吸入移液管,要用吸耳球。
请问分光光度法和电导滴定法测定酒花α-酸哪个准??分光光度法是否比滴定法测的低?一般低多少??谢谢!
目前一般实验室滴定分析采用的是人工滴定法,它是根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果。自动电位滴定法是通过电位的变化,由仪器自动判断终点。为了比较仪器和人工滴定方法的测定结果,我们选用了酸价和过氧化值两个指标,分别用自动电位滴定法和人工滴定法进行样品分析。 1 实验部分 1.1 自动电位滴定法的实验仪器 瑞士万通(METROHM)751GPD自动电位滴定仪 727磁力搅拌滴定台 10ml交换单元 6.0431.100Pt电极 6.0133.100pH玻璃电极 6.0729.100Ag/AgCl参比电极 6.0331.0Pt辅助电极 1.2 人工滴定法 按照GB/T5009.37—1996的方法测定样品中的酸价和过氧化值。 2 实验结果与讨论 2.1 两种滴定方法的测定结果对照 自动电位滴定法和人工滴定法测定植物油的酸价和过氧化值结果无显著性差异,表明自动电位滴定仪测定植物油酸价和过氧化值,与现行的国家卫生标准滴定方法结果相近。 2.2 两种滴定方法的精密度比较 选用酸价值较高的样品,分别用自动电位滴定法和人工滴定法平行测定5次,自动电位滴定法测定的相对标准偏差1.1%,人工滴定法为1.6% 平行测定酸价值较低的样品5次,自动电位滴定法测定的相对偏差为2.1%,而人工滴定法的相对标准偏差高达11.4%,表明自动电位滴定法的精密度优于人工滴定法。综上所述,自动电位滴定法测定结果与国标法无异,精密度达到检验要求。由于自动电位滴定法是根据滴定曲线的一阶导数确定终点,等当点与终点的误差非常小,准确度高,避免了人工滴定法由于要加指示剂可能因加入量、指示终点与等当量间、操作者对颜色判断等的误差 电动定位滴定法无须使用指示剂,故对有色溶液、浑浊度以及没有适合指示剂的溶液均可测定 Metrohm自动电位滴定仪可判断多达9个等当点,可以连续滴定溶液中的多个成分,如连续滴定水样中Ca2+、Mg2+,滴定混合酸。自动电位滴定仪还能对滴定分析的各种测定参数,例如测定日期、仪器型号、滴定用标准溶液的消耗量、滴定曲线作自动记录,并自动计算打印出测定结果作为原始记录保存,减少了分析者原始记录数据处理的工作量和运算差错,提高了实验室间分析结果的可比性,有利于实验室管理,因此适于理化分析实验室用作代替人工操作的分析仪器。
电位滴定法和永停滴定法有何联系和区别?两者的使用范围有何不同呢?哪种方法更为实用呢?
我想用光度滴定法来检测硫酸根,不知有没有这方面的资料?
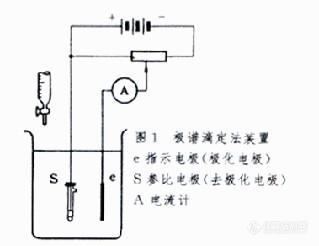
利用电解池中电流的变化指示滴定终点的电滴定分析方法。分为一个极化电极的安培滴定法和两个极化电极的安培滴定法。用滴汞电极为极化电极的一个极化电极的安培滴定法称为极谱滴定法。两个极化电极的安培滴定法称为死停终点法或双安培滴定法。 极谱滴定法是基于极谱法的原理在一定外加电压下滴加标准溶液,藉观察滴定过程中扩散电流的改变以确定滴定终点的容量滴定法。极谱滴定法装置就是一台简易极谱仪加一支滴定管( 图1 )。溶液中被测离子于一定的外加电压下在滴汞电极上还原(或氧化),此时由于浓差极化产生扩散电流。随着被测离子与滴定剂反应浓度越来越低,在滴汞电极上还原(或氧化)而产生的扩散电流越来越小,达到滴定终点时,扩散电流降至零。若将滴定剂体积与每加一次滴定剂后相应的电流读数作图,可得一直线。过滴定终点之后再将滴定剂体积与加滴定剂后的相应电流作图,又得一直线。将所得两条直线延长相交,交点所对应的滴定剂体积即为滴定终点。此法的优点是:①适用范围广,可用于沉淀反应、络合反应和氧化还原反应 ;② 适用浓度范围宽 , 测量范围为0.1~10-4摩尔/升(mol/L)。缺点是 :① 选择性差,易受其他物质干扰;②操作麻烦。 双安培滴定法的装置和图1相似, 两个电极都是铂电极,串联一个电流计指示电流。外加电压一般为几十毫伏。当滴定至电流发生突变时,表示滴定终点到达。滴定曲线的形状取决于滴定体系的可逆性程度( 图2 )。双安培滴定法可用于沉淀反应、络合反应和氧化还原反应。在双安培滴定法中,应用较广的是碘滴定法 ,此外 ,在铈量法测定As3+和Sb3+离子 ,银量法测定卤素离子和CN- 离子也常用此法指示终点 , 此外,也常用来指示库仑滴定法的终点。双安培滴定法的特点是装置简单,准确快速。[img]http://ng1.17img.cn/bbsfiles/images/2010/04/201004221500_213989_1604460_3.jpg[/img]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=94642]电位滴定法与手工滴定法比较[/url]
电位滴定法与永停滴定法电位滴定法与永停滴定法是容量分析中用以确定终点或选择核对指示剂变色域的方法。选用适当的电极系统可以作氧化还原法、中和法(水溶液或非水溶液)、沉淀法、重氮化法或水分测定法等的终点指示。 电位滴定法选用2支不同的电极。1支为指示电极,其电极电势随溶液中被分析成分的离子浓度的变化而变化;另1支为参比电极,其电极电势固定不变。在到达滴定终点时,因被分析成分的离子浓度急剧变化而引起指示电极的电势突减或突增,此转折点称为突跃点。 永停滴定法采用2支相同的铂电极,当在电极间加一低电压(例如50mV)时,若电极在溶液中极化,则在未到滴定终点前,仅有很小或无电流通过;但当到达终点时,滴定液略有过剩,使电极去极化,溶液中即有电流通过,电流计指针突然偏转,不再回复。反之,若电极由去极化变为极化,则电流计指针从有偏转回到零点,也不再变动。仪器装置 电位滴定可用电位滴定仪、酸度计或电位差计,永停滴定可用永停滴定仪或按图示装置。 电流计的灵敏度除另有规定外,测定水分时用10A/格,重氮化法用10A/格。所用电极可按下表选择。 ────────┬──────────┬────────────── 方 法 │ 电 极 系 统 │ 说 明 ────────┼──────────┼────────────── 水溶液氧化还原法│ 铂-饱和甘汞 │铂电极用加有少量三氯化铁的硝 │ │酸或用铬酸清洁液浸洗 ────────┼──────────┼────────────── 水溶液中和法 │玻璃-饱和甘汞 │ ────────┼──────────┼────────────── 非水溶液中和法 │玻璃-饱和甘汞 │饱和甘汞电极套管内装氯化钾的 │ │饱和无水甲醇溶液。玻璃电极用 │ │过后应即清洗并浸在水中保存 ────────┼──────────┼────────────── 水溶液银量法 │ 银-玻璃 │银电极可用稀硝酸迅速浸洗 ├──────────┼────────────── │银-硝酸钾盐桥-饱和甘│ │汞 │ ────────┼──────────┼────────────── -C≡CH中氢置换法│玻璃-硝酸钾盐桥-饱和│ │甘汞 │ ────────┼──────────┼────────────── 硝酸汞电位滴定法│铂-汞-硫酸亚汞 │铂电极可用10%(g/ml)硫代硫酸 │ │钠溶液浸泡后用水清洗。汞-硫 │ │酸亚汞电极可用稀硝酸浸泡后用 │ │水清洗。────────┼──────────┼──────────────永停法 │铂-铂 │铂电极用加有少量三氯化铁的硝 │ │酸或用铬酸清洁液浸洗 ────────┴──────────┴──────────────滴定法 (1)电位滴定法 将盛有供试品溶液的烧杯置电磁搅拌器上,浸入电极,搅拌,并自滴定管中分次滴加滴定液;开始时可每次加入较多的量,搅拌,记录电位;至将近终点前,则应每次加入少量,搅拌,记录电位;至突跃点已过,仍应继续滴加几次滴定液,并记录电位。 滴定终点的确定 用坐标纸以电位(E)为纵坐标,以滴定液体积(V)为横坐标,绘制E-V曲线,以此曲线的陡然上升或下降部分的中心为滴定终点。或以△E/△V(即相邻两次的电位差和加入滴定液的体积差之比)为纵坐标,以滴定液体积(V)为横坐标,绘制(△E/△V)-V曲线,与△E/△V的极大值对应的体积即为滴定终点。也可采用二阶导数确定终点。根据求得的△E/△V值,计算相邻数值间的差值,即为△E/△V,绘制(△E/△V)-V曲线,曲线过零时的体积即为滴定终点。 如系供指示剂变色域的选择核对,滴定前加入指示剂,观察终点前至终点后的颜色变化,以选定该品种终点时的指示剂颜色。 (2)永停滴定法 用作重氮化法的终点指示时,调节R使加于电极上的电压约为50mV。取供试品适量,精密称定,置烧杯中,除另有规定外,可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌器上,搅拌使溶解,再加溴化钾2g,插入铂-铂电极后,将滴定管的尖端插入液面下约2/3处,用亚硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随搅拌,至近终点时,将滴定管的尖端提出液面,用少量水淋洗尖端,洗液并入溶液中,继续缓缓滴定,至电流计指针突然偏转,并不再回复,即为滴定终点。用作水分测定的终点指示时,可调节R使电流计的初始电流为5~10μA,待滴定到电流突增至50~150μA,并持续数分钟不退回,即为滴定终点。
本章教学目的:1、掌握氧化还原滴定法分类及各种方法的反应实质。2、了解氧化还原滴定法和酸碱滴定法的异同点。从而明确严格控制反应测定结果的关键。3、熟练掌握碘量法的分析原理、指示剂变色原理及误差来源。教学重点与难点:氧化还原滴定法中各种不同方法的反应实质。教学内容: 一、方法简介1、氧化还原滴定法的分类:氧化还原滴定法:以氧化还原反应为基础的滴定分析方法。标准溶液:氧化剂——测定还原性物质含量。 还原剂——测定氧化性物质含量。氧化还原滴定法: 高锰酸钾法 重铬酸钾法 碘量法 溴酸钾法氧化还原滴定法的特点及与酸碱滴定法的比较:①酸碱滴定法是离子互换反应,反应历程简单、快速。②氧化还原滴定法是电子转移反应,反应复杂、反应速度快慢不一、受外界条件影响较大。比较结果:氧化还原滴定法需要控制反应条件,使其符合滴定分析的要求2、氧化还原滴定法滴定终点的确定①标准溶液自身做指示剂2MnO4- + 5C2O42-ˉ + 16H+ == 2Mn2+ + 10CO2↑ + 8H2O高锰酸钾为紫色,极稀溶液中呈无色。过量的半滴KMnO4,溶液变粉色。②专属指示剂I2 + 2Na2S2O3 == 2NaI + Na2S4O6稍过量的碘标准溶液与溶液中的淀粉指示剂形成浅蓝色。
沉淀滴定法 : 是 以沉淀反应为基础的一种滴定分析方法。 沉淀滴定法必须满足的条件: 1. S 小,且能定量完成; 2. 反应速度大; 3. 有适当指示剂指示终点; 4. 吸附现象不影响终点观察。 目前,应用较广泛的是: 生成难溶性银盐的沉淀滴定法 银量法 沉淀反应: Ag + +沉淀滴定法:是 以沉淀反应为基础的一种滴定分析方法。 沉淀滴定法必须满足的条件: 1. S 小,且能定量完成; 2. 反应速度大; 3. 有适当指示剂指示终点; 4. 吸附现象不影响终点观察。 目前,应用较广泛的是:生成难溶性银盐的沉淀滴定法——银量法 沉淀反应: Ag+ +X- ⇌ AgX↓ Ag+ + SCN- ⇌ AgSCN ↓应用:Cl-、Br-、I-、Ag+、SCN-以及能定量地产生这些离子的有机化合物。
近日论坛上看有一个帖子是关于GB 5009.3-2016的滴定法检测限的讨论,实际上标准关于检测限(检出限)的描述有很多,这不我举一些例子: 1、DZ/T 0279.26-2016《区域地球化学样品分析方法第26部分:碳量测定燃烧—非水滴定法》 本标准方法检出限:0.02%。测定范围:0.05%~10%。2、GB/T 6436-2018《饲料中钙的测定》 本标准方法的检出限为0.015%,定量限为0.05%。3、GB/T 9695.13-2009《肉与肉制品 钙含量测定》 本标准滴定法的检出限:5.0 mg/kg。4、GB/T 14671-1993《水质 钡的测定 电位滴定法》 本标准方法的测量范围为47.1~1180 mg,最低检出限为28 mg。5、GB/T 35950-2018《化妆品中限用物质无机亚硫酸盐类和亚硫酸氢盐类的测定》 本标准对于亚硫酸盐类和亚硫酸氢盐类含量的滴定法定量限为50 mg/kg。6、HJ 485-2009《水质 铜的测定 二乙基二硫代氨基甲酸钠分光光度法》 本标准的检出限(以Cl[sub]2[/sub])为 0.02 mg/L,测定范围(以Cl[sub]2[/sub])为 0.08~5.00 mg/L 。7、HJ 658-2013《土壤 有机碳的测定 燃烧氧化-滴定法》 当样品量为0.50g时,本标准的方法检出限为0.004%,测定下限为0.016%,测定上限为4.00%。样品中有机碳含里较高时,可减少取样量,但最低不能低于0.050g。8、SN/T 4375-2015《塑料树脂过氧化值的测定》 检出限为0.50 mmol/kg。 从上不难发现,单位不统一,给定的检测范围描述不一致。对于检测方法标准来讲,统一原则是必须要求的,所以希望在这一方面,标准管理部门应该给出规范的格式要求。 各位大虾的意见呢? 期待~~~
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=155583]峭酸银滴定法与硫氰酸汞分光光度法[/url]
教学目的:1、掌握沉淀滴定法对反应的要求。2、掌握银量法确定理论终点的方法原理。3、明确分级沉淀及沉淀转化的概念。4、理解测定氯化物的条件。教学重点与难点:莫尔法(铬酸钾作指示剂)作为教学重点。教学内容: 一、方法简介沉淀滴定法(precipitation titration):也称容量分析法(volumetric precipitation method),以沉淀反应为基础的滴定分析方法。用作沉淀滴定的沉淀反应必须满足以下条件:(1)反应速度快,生成沉淀的溶解度小;(2)反应按一定的化学式定量进行;(3)有准确确定理论终点的方法。应用范围:含量在1%以上的卤素化合物和硫氰化物的测定。解释:沉淀反应很多,但能用于沉淀滴定的沉淀反应并不多,因为很多沉淀的组成不恒定,或溶解度较大,或形成过饱和溶液,或达到平衡速度慢,或共沉淀现象严重等。目前比较有实际意义的是生成微溶性银盐的沉淀反应。Ag+ + Cl- = AgCl↓Ag+ + SCN- =AgSCN↓以这类反应为基础的沉淀滴定法称为银量法。主要测定Cl-、Br-、I-、Ag+ 及SCN-等。如有一些沉淀HgS、PbSO4、BaSO4等也可用于沉淀滴定法,但重要性不及银量法。
ISO 3704-1976 工业用硫磺。酸度的测定。滴定法ISO 3705-1976 工业用硫磺。砷含量的测定。二乙基二硫代氨基甲酸银光度法有的朋友请帮帮忙.
请问滴定法是采用比色滴定好,还是电极滴定好?
25 、以直接滴定法,测定固体试样中某组合量时,用同一标准溶液滴定,一次在10℃进行,另一次在30℃进行,其它条件相同,测得的结果是:A :与温度无关 B :30℃时较高 C :10℃时较高
滴定法的方法验证,按照hj168标准,检出限的计算是按照附录A1.3滴定法公式计算?还是可以按照A1.1的公式计算?
电位滴定法和人工滴定法二者有什么优缺点?那位老师知道?
请问下各位大神,制药中枸橼酸钠抗凝剂用HPLC法和滴定法如何比较?液相法是测的枸橼酸,而滴定法测的是枸橼酸钠,没有共同的一个标准品来对比?谢谢各位啦
如何用电位滴定法测染发剂中的氧化物?
各位大侠,三氯化钛滴定法使用范围实用性怎样
用于配位滴定法的反应不一定必备的条件是( )。(A)生成的配合物要足够稳定 (B)反应速度要快(C)生成的配合物的组成必须固定 (D)必须以指示剂确定滴定终点
咨询一下水质铝的电位滴定法,大家用的是哪一款电位滴定仪,用到的电极式“四苯硼酸根离子电极”和“217型双液接参比电极”
甲醛滴定法为什么不能准确测定含有多种氨基酸的样品中的氨基氮?
甲醛滴定法为什么不能准确测定含有多种氨基酸的样品中的氨基氮?
复杂样品中可能有磷酸根,滴定法该如何测定呢?请高手指点迷津。
请问下各位大神,药典中枸橼酸钠抗凝剂用HPLC法和滴定法如何比较?液相法是测的枸橼酸,而滴定法测的是枸橼酸钠,没有共同的一个标准品来对比?谢谢各位啦
配位滴定法
在GB210中,电位滴定法滴定氯化物时,空白如何滴定,请举例说明。