碱性药物(非衍生化)色谱柱/前处理小柱:DM-5 30m x 0.25mm x 0.25um色谱条件柱温:100 oC - 325 oC, 4℃/min ( 10 min )载气:He, 30 cm/sec, 100 ℃进样方式:分流, 50:1, 250 ℃样品:碱性药物样品, 1.0 μL, 1000ng/μL检测:FID, 1.28 x 10-10 AFS, 320 ℃ http://www.dikma.com.cn/Public/Uploads/images/CPR00236(2).png 1. 烟碱;2. 苯佐卡因;3. 可替宁;4. 度冷丁;5. 咖啡因;6. 苄非他明;7. 氯胺酮;8. 苯海拉明;9. 利多卡因;10. 苯托沙敏;11. 扑敏宁;12. 吩噻嗪;13. 右甲吗南;14. 美沙酮;15. 阿米替林;16. 曲米帕明;17. 丁卡因;18. 美吡拉敏;19. 去氧安定;20. 布比卡因;21. 天仙子碱;22. 可卡因;23. 吗啡;24. 安定;25. 氯丙嗪;26. 替马西泮;27. 氟硝安定;28. 溴西泮;29. 普拉西泮;30. 乙酰丙嗪;31. 氟西泮;32. 罂粟碱;33. 氯硝西泮;34. 氟哌啶醇;35. 阿普唑仑;36. 三唑仑;37. 硫利达嗪;38. 曲唑酮
碱性手性药物为什么要在酸性介质中拆分?
碱性手性药物为什么要在酸性介质中拆分?[em31]
[color=#444444]目前在做一个大极性药物,要分离它和它的代谢物,液相的条件要用到戊烷磺酸钠,但质谱又不能进,有什么好方法吗?[/color]
各位大侠: 我现在做的一个的低极性药物的血浆蛋白结合率,经过二十四个小时的平衡后,用液液萃取的方法进行萃取后,发现萃取回收率很低.肉眼可见药物跟蛋白一块沉淀了下来,请问有什么方法可提高此药物的萃取回收率吗?谢谢~~~
求助!!!不溶于水的脂溶性药物,查到它的pka是8.13呈现碱性,用MCX小柱过柱,5%氨化甲醇洗脱,备用液为了提高极性是80%甲醇水复溶(每100毫升含有50微升甲酸),结果柱回收率只有70左右,要怎么提高啊?或者有没有简便的看甲醇水里面的甲酸含量能不能使药物完全离子化的方法啊?
需要一种强极性药物来做实验,不是学药的,不了解有哪些是水溶性药物,最好是抗生素,请各位帮帮忙
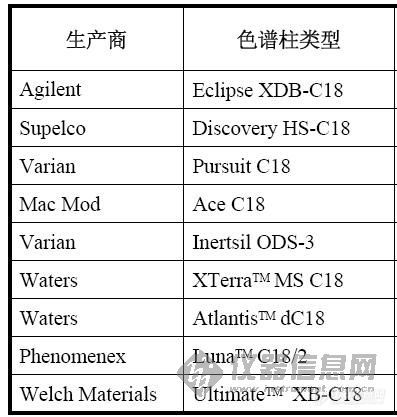
[img]http://ng1.17img.cn/bbsfiles/images/2009/05/200905301109_152613_1644182_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/05/200905301109_152614_1644182_3.jpg[/img][color=#DC143C][size=4]waters XTerra C18 与Thermo ODS C18比较,对于药物的保留对差别很大吗,如果某个药物在Thermo ODS C18上不保留,会不会出现在XTerra C18 保留的这种可能(指的是在相同的流动相条件下),有人做过实际的比较么[em09508][/size][/color]不同厂家的C18在对于极性药物保留问题上区别大不大呢???
我的课题方向是电泳分离手性药物,想问一下手性药物最多出几个峰?一个手性中心的分子
手性药物分离时,是不是类似的手性中心基本上用类似的条件就可以分离啊?
纳米技术改善难溶性药物吸收前景光明 近日,由中国药学会和美国药学科学家协会主办、沈阳药科大学和辽宁省药学会承办的“第二届亚洲阿登制药技术研讨会暨中国药学会药剂专业委员会2010年学术年会”在沈阳召开,会议主题为“难溶药物的剂型策略”。在为期3天的研讨中,与会专家表示,改善难溶性药物的溶解度,促进药物的吸收,提高药物的生物利用度是药剂学领域亟待攻克的难题,而纳米技术这一助推器有助于加速该难题的解决,我国学者应加强相关研究。 溶解度成为制约瓶颈 药物的溶解性是影响药物生物利用度的重要因素之一,难溶性药物因在水中的溶解度小,难以被机体吸收,导致生物利用度较差。随着组合化学、基因技术、高通量筛选技术等在药物研发中的广泛应用,大量具有活性的候选药物被发现。但是,沈阳药科大学崔福德教授表示,由于存在水溶性差的缺陷,四成左右的侯选药物不能上市而限制了其在临床充分发挥疗效。据估计,全球每年约有650亿美元的药品因生物利用度差而造成治疗费用与疗效比例的严重失调。而实际上,许多难溶性药物有着很强的生物活性,在治疗肿瘤、心血管疾病等领域有着良好疗效。因此,如何提高药物的溶解度和吸收率,成为药剂学研究的热点与难点,迫切需要发展新的制剂技术和剂型来解决这一问题。 崔福德介绍,当前,在药剂学研究中提高难溶性药物的溶解度和溶解速率有多种方法,如加入助溶剂、增溶剂和亲水性介质(适用于液体制剂);制成固体分散体和包含物(适用于固体制剂);制成微粒分散系统(适用于液体和固体制剂);还可以采取减少粒径的措施,比如做成药物的纳米结晶(适用于各种剂型)。 “但是这些方法都有一定的局限性。”中国药学会药剂专业委员会主任委员、北京大学药学院张强教授具体分析说,比如成盐类的方法就只适用于一些难溶性弱酸或弱碱类药物,而不适用于所有分子结构的药物;加入助溶剂和亲水性物质的方法,可供选择的溶剂等也是有限的;增溶剂主要是表面活性剂,毒性问题也限制了其使用;包合物同样存在可供选择的品种较少和毒性问题;固体分散体也有老化现象和需要使用大量赋型剂的缺陷;而费用较高和稳定性问题又限制了微粒化方法的使用。 新技术助力难题解决 解决上述问题,纳米技术的应用优势日益显现:纳米化使药物的粒度大大减小,表面积大大增加,水溶性差的药物在纳米载体中可形成较高的局部浓度;药物的黏附性增强,在吸收部位的滞留时间延长;纳米载药系统可以提高药物的透膜能力和稳定性,也有利于提高药物的生物利用度,特别是对于生物药剂学分类体系(BCS)Ⅱ类(低溶解度、高通透性)和Ⅳ类(低溶解度、低通透性)的药物,这一技术越来越受到国内外一些研究机构、制药公司的青睐。 在药剂学领域,一般将制剂中纳米粒子的尺寸界定在1~1000纳米范围,主要包括纳米载体与纳米药物两个方面。纳米载体是指溶解或分散有药物的各种纳米粒,如纳米乳、聚合物纳米粒(纳米囊或纳米球)、脂质纳米粒等;纳米药物则是指直接将原料药物加工成的纳米粒,实质上是微粉化技术、超细粉技术的发展。 张强介绍,纳米乳/微乳是一种由水、油、表面活性剂和一些复合表面活性剂自组装成的粒径小于100纳米的半透明溶液,其易于制备、相对稳定,而且可使大多数水不溶性药物的生物利用度提高显著。自1943年被报道以来,纳米乳/微乳已经得到了广泛的研究,但上市的产品却不多,1995年诺华公司上市了环孢素A的微乳产品,在临床迅速得以推广。现在上市的同类品种还有雷帕霉素自微乳化给药系统。 纳米粒(纳米球或纳米囊)一般是指由天然或合成的高分子材料制成的、粒径在纳米级的固态胶体微粒,可用于包裹亲水性药物,也可包裹疏水性药物,具有在胃肠道中稳定、药物不易被破坏,以及能够调整药物的理化性质、释放和生物学行为等优点。自1976年Birrenbach等人首先提出了纳米粒和纳米囊的概念后,目前以合成高分子材料为聚合物的纳米粒研究得最为广泛。但张强遗憾地表示:“30多年来,这个研究领域没有取得实质性的突破,无论是口服制剂还是注射制剂都没有产品上市。”而天然聚合物的纳米粒所使用的材料包括壳多糖、白蛋白、右旋糖苷、明胶等,其中以口服壳聚糖纳米粒的研究最为广泛。值得一提的是,白蛋白结合紫杉醇纳米粒注射混悬液2005年上市,成为制剂领域的一个重大突破;但口服给药方面仍没有产品面市。 脂质纳米粒是以生物相容性良好的脂质材料为载体,将药物溶解、包裹于脂质核或是吸附于纳米粒表面的新型载药系统。第一代脂质纳米粒是固体脂质纳米粒(SLN),其性质稳定、制备较简便,具有一定的缓释作用,主要适合于难溶性药物的包裹;随后又发展了第二代纳米结构脂质载体(NCL),解决了第一代脂质纳米粒载药量不佳的问题,稳定性也更好。张强谈到,近年来,对脂质纳米粒的研究也相当广泛,特别是第二代脂质纳米粒自1999年开始研究以来,在外用领域如化妆品领域进展很快,开发程度好于脂质体,但至今还没有用于临床的产品。 在表面活性剂和水等附加剂存在下直接将药物粉碎加工成纳米微粒,可以提高药物的吸收或靶向性,特别适合于大剂量的难溶性药物的口服吸收和注射给药,能增加溶出度,提高生物利用度,增加稳定性。此外,它无需载体材料,只有少量的表面活性剂,安全性更高。此类技术分为纳米混悬剂和纳米结晶制备技术。其中,纳米结晶制备技术发展较快,目前已有5种产品利用这种技术生产并在美国上市,包括惠氏公司的Rapamune(西罗莫司)、默克公司的Emend(阿瑞吡坦)、雅培公司的Tricor(非诺贝特)以及Par公司的Megace ES(甲地孕酮)等。
在动物性食品中,需要检测的不仅有农药残留污染物,还有兽药以及其他添加物。而动物性食品的主要基质干扰来自于蛋白质、多肽、氨基酸和脂肪等。样品萃取净化的主要困难来自于极性药物与强水溶性基质(蛋白质、氨基酸)的分离和弱极性药物与亲脂性基质的分离。由于兽药的化学性质差异很大,使多残留同时检测具有非常大的难度。样品预处理:肝脏组织1 g与3 mL水混合匀浆,取0.4 mL(等于100 mg肝脏组织)中加入1 mL去离子水,并在超声波水浴中振荡5 min后6000 g离心10 min。上清液A供萃取酸性及中性药物。样品离心后得到的沉淀物中加入枯草杆菌蛋白酶的Tris溶液,混合均匀后(pH 10.5),60℃水解1 h。水解完成后,将样品冷却至室温,用10%(体积分数)磷酸将样品的pH调节至6~7,并在6000 g离心10 min。所得到的上清液(B)用于萃取碱性药物。固相萃取柱:Bond E1ut Certify非极性/阳离子交换混合柱,130mg/3 mL,Varian公司。柱预处理:2 mL甲醇,2 mL磷酸缓冲溶液。样品过柱:0.4 mL上清液A过柱。柱洗涤:1 mL水,0.5 mI,磷酸缓冲溶液(pH 4.0)。柱干燥:50μL甲醇,空气。目标物洗脱:4 mL丙酮/氯仿(1:1,体积比),洗脱酸陛和中性药物(馏分A)。柱预处理:2 mL磷酸缓冲溶液(使用上述同一根萃取柱)。样品过柱:上述上清液B过柱。柱洗涤:1 mL 1 mol/L醋酸(pH 2.4),2 mL丙酮/氯仿(1:1,体积比。柱干燥:50μL甲醇,空气。目标物洗脱:2 mL 2%(体积分数)氨化乙酸乙酯,洗脱碱性药物(馏分B)。浓缩/分析:分别将丙酮/氯仿洗脱馏分及氨化乙酸乙酯洗脱馏分在氮气氛40℃浓缩至约100μL,然后进行GC分析。
手性药物药学研究的基本要求如下:在原料药制备工艺研究时应根据手性中心的引入方式,采取有效的过程控制手段,严格控制产品的光学纯度;在结构确证时,需结合其制备工艺、结构确证用对照品及文献数据等已有的研究基础,选择合适的方式来证明该药物的立体构型;制剂的处方与工艺研究过程中应注意保证手性药物立体构型的稳定;质量研究时应结合工艺确定需研究控制的立体异构体杂质,并注意验证各手性分析方法的立体专属性,在制订质量标准时从各个方面控制产品的光学特性与光学纯度;在稳定性研究时,应设立灵敏的光学纯度质控指标,以监测立体构型的稳定性。 药物的研发一般分为三个不同的专业:药学、药理毒理及临床,在研究的过程中,这三个专业之间是紧密联系、相互印证的。即使在药学专业内部的各项研究间也是如此,在各项研究的过程中需要随时参考其它研究的结果,才能使我们的研究工作更为全面与准确。下面分别论述各药学研究间的关系:
最近在C18色谱柱上做手性药物的质量标准,因为左旋不是有效成分,所以被归为杂质。在定位时发现杂质左旋与有效成分右旋药物的峰是重叠的。但是中国药典和欧洲药典是用C18柱做此药物的含量测定,这样会不会测出的是左旋和右旋的总含量啊,那还准确吗~~http://simg.instrument.com.cn/bbs/images/brow/em09511.gif
液相色谱法分离手性药物[~95262~]
大家好!有没有在做手性药物分析的阿?由于试验所用样品量很少,购买少量比较麻烦,如果有人在做,我们可以合作购买或者交换分析,我这有十几种手性药物,有意者速与我联系,回帖或发邮件qianwei1108@163.com
自然 界存在各种各样的手性现象,比如蛋白质、氨基酸、多糖、核酸、酶等生命活动重要基础物质,都是手性的。据,在研发的1200种新药中,有820种是手性的,占世界新药开发的68%以上。美国 FDA 在1992年发布了手性药物指导原则,该原则要求各医药 企业 今后在新药研发上,必须明确量化每一对映异构体的药效作用和毒理作用,并且当两种异构体有明显不同作用时,必须以光学纯的药品形式上市。随后欧共体和日本也采取了相应的措施。此项措施大大促进了手性药物拆分技术的 ,手性药物的研究与开发,已经成为当今世界新药发展的重要方向和领域。当前大多数药物是以外消旋体的形式出现,即药物里含有等量的左右两种对映体。但是近年来单一对映体药物市场每年以20%以上的速度增长。1993年全球100个热销药中,光学纯的药物仅仅占20%;然而到了1997年,100个中就有50个是以单一对映体形式存在,手性药物已占到世界医药市场的半壁江山。在1993年,手性药物的全球销售额只有330亿美元;到了1996年,手性药物世界市场已经增长到730亿美元;2002年总销售额更是达到1720亿美元,2010年可望超过2500亿美元。广阔的应用前景和巨大的市场需求触发了更多的医药企业和学者探索更新更高效地获得单一手性化合物的方法。 目前获得单一手性化合物的方法有3种:①手性源合成法:以手性物质为原料合成其他手性化合物。②不对称催化合成法:是在催化剂或酶的作用下合成得到单一对映体化合物的方法。③外消旋体拆分法:是在拆分剂的作用下,利用物理化学或生物方法将外消旋体拆分成两个对映体。外消旋体拆分法作为一种经典的分离方法,在此显示出其 省时的优势,在工业生产上得到广泛的应用。目前,外消旋体拆分法可分为结晶拆分、化学拆分、生物拆分、色谱拆分、膜拆分和手性萃取拆分等方法。本文作者根据国内外相关 文献 报道,对外消旋体的几种拆分方法进行了综述。 1 经典结晶法 用结晶的方式进行外消旋体的分离,是手性化合物拆分中最常用也是最主要的方法。传统的拆分法过于繁琐,而结晶法实际上是机械分离法的改进。经典的接种结晶法是在一个热的外消旋体混合物的饱和溶液中,加入适量的某一对映体的晶种进行诱晶,适当冷却,这一对映体由于过饱和从外消旋混合物中析出,分别加入两种对映体晶种,就可以得到两种对映异构体。如 L-甲基多巴的生产即采用此法。对于不生成外消旋混合物的化合物,可通过手性酸、碱等拆分试剂将其转化成非对映异构体盐后,再进行反复结晶。如 D-苯基甘氨酸的 Amdeno 制备法即是用樟脑磺酸盐作拆分剂进行结晶,年产量上千吨。接种结晶法工艺简单,经济又方便,但通常只能间歇生产,一次收率较低。 2 化学拆分法 化学拆分法是广泛使用的一种方法。根据手性试剂与外消旋体反应所得生成物不同可分为以下几种。 2.1 经典拆分法 如果外消旋体分子含有如羧基、氨基、羟基或者双键等活性基团,可让其与某一光学活性试剂(拆分剂)进行反应,生成两种非对映异构体的盐或其它复合物,再利用它们物理性质(如溶解度)和化学性质的不同将两者分开,最后把拆分剂从中分离出去,便可得到单一对映体。拆分成功的关键是选择合适的拆分剂。适用于这类光学拆分方法的外消旋体有酸、碱、醇、酚、醛、酮、酰胺及氨基酸等。其过程如下式(1)所示: (DL)-A+(D)-B→(D)-A·(D)-B+(L)-A·(D)-B(1) 这种经典的方法运用广泛,但其也有明显的局限性,比如拆分剂和溶剂的选择较为盲目;拆分剂价格昂贵;收率和e.e.值不高等。近年来,随着主-客体化学的深入研究,开发出了包结拆分和组合拆分等新型手性拆分技术,在一定程度上弥补了经典成盐拆分法的不足。 2.2 组合拆分 组合拆分(combinatorial resolution) 是近年来报道的一种新方法,它的原理是采用一组同一结构类型的手性衍生物拆分剂家族(resolving agent family) 代替单一的手性拆分剂进行外消旋化合物的拆分。这些拆分剂家族往往是以常用的手性拆分剂为原料,经结构修饰得到的衍生物。也可以是含有不同取代基的某一类结构类型的化合物。Wynberg 设计了一系列芳香环取代的衍生物组成不同的拆分剂家族,首次将该方法应用于化学拆分中。经过实验验证,酒石酸类衍生物的拆分剂家族 T 和TA(1),可用于碱性化合物的拆分,α-苯乙胺类拆分剂家族PE-I,PE-II 和PE-III(图2),通常用于酸性化合物的拆分。 实际操作时将拆分底物与拆分剂家族以 1∶1 的形式,于同一溶剂中进行拆分。这种组合拆分方法和前述的经典拆分方法比较,具有结晶速度快,收率高,纯度高等特点。 2.3 包结拆分 包结拆分是由日本化学家 Toda 教授发明的,其原理是利用非共价键体系,如氢键和分子间的次级作用,使外消旋体的一个对映异构体与手性拆分剂发生包结,形成稳定的超分子配合物,再通过结晶方法将两个对映体分开。由于主体和客体分子不发生化学反应,只存在分子间作用力,所以很容易通过柱层析、溶剂交换和逐级蒸馏等与客体分离,然后再循环利用。因此,包结拆分具有操作简单、成本低廉、易于规模生产,具有很高的工业价值。Toda 等还采用氯化 N-苄基辛可尼定作为包结主体,在甲醇中首次成功地拆分了外消旋的联二萘酚,光学纯度(e.e.值)达到100%。邓金根等用光学纯联二萘酚类化合物和酒石酸衍生物等手性化合物作为包结主体,选择性地与某种构型的奥美拉唑形成包结络合物,并以结晶形式出现,而另一种对映体则留在溶剂中,然后用层析的方法将包结主体和奥美拉唑分离,可制得两种对映体。其中具有药效作用的 S-奥美拉唑总收率可达88%,e.e.值为100%。过程如图3所示。 2.4 动力学拆 分经典动力学拆分的原理在于两个对映体与某一手性试剂的作用, 中间体是一对非对映异构体,反应速度一般存在差异。利用它们反应的动力学差异,从而达到拆分的目的。通过经典动力学得到的光学纯产物的最大产率为50%,多数情况下,有一个异构体是没用的,这将浪费一半的原料。因此,为了克服以上缺点,人们开始采用动态动力学拆分方法,就是在拆分过程中伴随着底物的现场消旋化,从而使那一半没用的对映体转化为消旋体继续拆分。理论上产率可达到100%,这在工业应用上将具有重大的意义。 3 生物拆分法 酶的活性中心是一个不对称结构,这种结构有利于识别消旋体。在一定条件下,酶只能催化消旋体中的一个对映体发生反应而成为不同的化合物,从而使两个对映体分开。反应产物的e.e.值可达100%。随着酶固定化、多相反应器等新技术的日趋成熟,越来越多的酶已用于外消旋体的拆分。徐刚等通过对不同来源酶的筛选,找到了 Novozym 435和 Alcaligenes sp两种选择性较好的酶,有效拆分制备了(S)-2-氯-1-(2-噻吩)-乙醇,产率为48.6%,e.e.值为98.5%。酶催化立体选择性强、反应条件温和、操作简便、副反应少、产率高、成本低,且不会造成污染,这些都使得用酶拆分外消旋体成为理想的选择。酶法拆分外消旋体在实验室制备和工业生产中都已取得长足的进步,但是仍然有其局限性。比如菌种筛选困难、酶制剂不易保存、产物后处理量大,以及通常只能得到一种对映体等缺点。尽管如此,利用微生物进行手性药物的合成及对映体的拆分仍是当前研究热点。 4 色谱拆分法 色谱法是目前手性药物分析和分离中应用最广最有效的方法之一。主要应用分为两类:分析级水平和制备级水平。用于分析领域的色谱拆分法包括气相色谱(GC)、高效液相色谱(HPLC)、超临界流体色谱(supercritical fluid chromatography,SFC)、毛细管电泳(CE)等。在制备领域中,高效液相色谱的应用较为广泛。另外,在工业化生产中比较成熟、比较前沿的是模拟移动床(simulated moving bed,SMB)技术。 4.1 高效液相色谱 高效液相色谱法在手性药物拆分中的应用是最广泛的,是药物质量控制、立体选择性的药 和毒理学研究的重要手段。 HPLC 分离药物对映体的方法可分为间接法和直接法。前者又称为手性试剂衍生化法,后者又可分为手性固定相法(CSP)和手性流动相添加剂法(CMPA)。间接法是利用手性药物对映体混合物在预处理中进行柱前衍生化,形成一对非对映异构体,根据其理化性质上的差异,使用非手性柱得以分离。该法分离效果好,分离条件简便,一般的非手性柱可满足要求,但需要高纯度的衍生试剂,操作比较麻烦。直接拆分法中的 CMPA 法是在流动相中加入手性添加剂,利用非手性固定相 HPLC 进行拆分;而 CSP法发展异常迅速,目前已开发的商品化手性固定相有多糖类、蛋白类、环湖精类、冠醚类等,其中多糖类衍生物手性识别能力强,方法也较成熟。直接法可用 Dalglsh 于1952年提出的着名的“三点作用原理”来解释:药物一个对映体先与手性固定相或流动相的添加剂间发生分子间的三点作用,同时另一对映体则发生二点作用,前者形成的分子复合物较后者稳定,用 HPLC 法依次使其对映体分离。郭娜等采用羟丙基-β-环糊精为手性流动相添加剂,拆分了奥昔布宁对映体,分离度为 1.54,检测限为 1.0 ng。HPLC 法用于对映体药物的拆分,具有多种途径,各具特色,可
药物含量及相关物质测定http://www.dikma.com.cn/Public/Uploads/images/yaowu3(3).jpg迪马科技推出的Diamonsil、Spursil、Platisil系列反相HPLC色谱柱(包括C18和C8)具有广泛的通用性,能够满足大多数药物分析项目,并能得到对称的峰形、较好的分离度和超高的柱效,成为药物分析工作者的首选产品。Diamonsil 2(钻石二代)系列反相HPLC色谱柱键合工艺领先,键合密度和碳载量为同类产品中最高者较高的碳载量使Diamonsil 2系列色谱柱具有优异的选择性和分离度,分析时间却未延长粒径均匀、表面光滑的硅胶基质使Diamonsil 2系列色谱柱具有超高柱效(N/100,000 /m)采用了最新的封端技术,固定相表面残余的硅羟基被抑制,碱性化合物也能得到完美峰形Diamonsil 2系列色谱柱能够耐受1.5 - 9.0的pH值,应用领域更加广阔Spursil(思博尔)系列反相HPLC色谱柱科学家们将极性基团键合到反相固定相中,得到了全新的Spursil色谱柱,使极性药物分析变的简单Spursil色谱柱上可观的极性基团与极性化合物间存在较强作用力,增强了对极性药物的保留能力Spursil色谱柱的碳载量为24%,仍高与普通C18柱,对弱极性、非极性化合物同样具有较好的分离能力因极性基团和非极性基团的同时存在,Spursil在100%水相~100%有机相范围内均具有卓越表现Spursil色谱柱在峰形对称性和pH值(1.5~10)耐受性方面表现优秀Platisil(铂金)系列反相HPLC色谱柱另一款极性改性的反相色谱柱,对极性化合物具有较强保留能力在1-11的pH范围内具有稳定的表现由于键合技术独特,不易发生固定相塌陷,可在纯水相下长时间操作固定相表面的硅羟基最大程度去活,化合物峰形对称性极好为了方便分析工作者选择色谱柱,我们按照2010版中国药典提供的分析条件,对多个药品品种的含量和相关物质进行了测试,并汇编成谱图集,分析工作者可根据自己的分析项目迅速找出合适的色谱柱。
随着食品安全曝光出的问题 药品的安全问题国家也开始重视了 其中手性药物最容易钻空子 下面的资料有助于大家对手性药物分离有所了解 由于药物对映体之间在药理、毒理及吸收等方面存在较大差异,因此,建立分离和测定对映体化合物的方法十分重要。HPLC法在分离和测定药物对映体的常用方法,包括手性衍生化试剂、手性流动相和手性固定相在药物对映体分离测定中的应用。对对映体化合物的分析鉴定有指导意义。 手性化合物的拆分是当前分析化学中最为活跃的领域之一,自然界中的许多化合物都是有旋光性的,而合成手性药物中大多(88%)是外消旋体,许多手性药物的对映体在生理过程中显示了不同生理活性。据研究反应停的致畸作用主要是由于其(S)-(-)异构体所致。因此,建立高专属性、高灵敏度、高分离度的对映体拆分和测定方法,对提高药物的活性、减小副作用,深入研究药物的作用机理等具有重要的理论和实际意义。 对映体化合物之间除对偏振光的偏转方向不同外,具有完全相同的理化性质,因而其分离比较困难。传统的拆分方法有分步结晶、微生物和酶消化法等,或者用手性衍生化试剂将其转化成非对映体,然后根据其物理性质不同进行分离,但这些方法难于进行微量的分离和测定。80年代以来,随着快速、准确、微量的光学异构体的HPLC拆分及测定方法的建立和发展,使HPLC迅速成为药物对映体分离和测定最为广泛应用的方法。 手性HPLC拆分法是以现代HPLC技术为基础,引入手性环境使对映异构体间呈现物理特征的差异而进行分离。通常分间接法和直接法,前者是对映体混合物以手性试剂作柱前衍生,形成一非对映体,然后以常规(偶也见手性)固定相分离。后者是直接以手性流动相(CMP)或手性固定相(CSP)直接进行分离。 1、手性衍生化试剂法 手性衍生化试剂(CDR)法是在分子间引入手性中心,其产物为非对映异构体(diastereomer,DSTM),从而进行分离。 下列情况通常选用CDR法进行拆分:(1)不宜直接拆分。添加某些基团,以增加色谱系统的选择性。如游离胺类在CSP上往往是颇弱的色谱性质,生成中性化合物后则获显著改善。(2)提高紫外或荧光检测的效果。刘雁鸣等用NBD-(L)-APY荧光试剂柱前衍生化测定布洛芬对映体,提高了检测灵敏度。对CDR的要求通常为:溶质分子至少有一个(多个时其性质各不相同)功能团供衍生(多为-NH2,-OH或-COOH)。光学活性试剂必需是手性高纯度;反应条件必须温和、简便;宜附有发色或荧光基团。 目前,已有许多商品化的CDR可供选用,常见的CDR可分为以下几类:(1)异硫氰酸酯和异氰酸酯类此类试剂易与大多数醇类及胺类化合物反应进而被分离,如麻黄素类,肾上腺素类,肾上腺素拮抗剂,儿茶酚胺类等。王亚芹等采用S( )-1-(1-苯基)乙基异氰酸酯为衍生化试剂分析了血浆中普罗帕酮的对应体,并研究了其在健康人体内的药代动力学。邱宗荫等用乙酰葡萄糖异硫氰酸酯(GITC)为柱前CDR,以反相HPLC法测定血浆中地佐西平对映体的血药浓度,线性范围为5~200μg.L-1。陈冰等用GITC为柱前CDR,用反相HPLC法测定血浆中普罗帕酮对映体的血药浓度,适合用于临床药动药效学研究。(2)萘衍生物类由于此类化合物有利于提高立体选择性和检测灵敏度,因此萘的各种衍生物用作手性试剂十分普遍。Wainer等选用萘甲醛(NDH)为手性试剂,与其缩合成恶唑烷衍生物,成功地分离了麻黄碱、4-甲氧基麻黄碱、伪麻黄碱。Bhatti等用S-( )-1-(1-萘基)-乙基异氰酸酯为CDR,用HPLC法测定了人血浆中美托洛尔对映体浓度。(3)酰氯与磺酰氯类此类试剂可与化合物直接缩合,或与样品反应后,再引入其它基团,合成更有利于拆分与检测的衍生物。Sallustio等以SOCl2与芳丙酸类消炎镇痛药如2-苯丙酸、酮洛芬及非诺洛芬的血浆样品提取物反应,然后再与R-2-苯乙胺成酰胺衍生物,产物以NP(Sil,乙腈∶二氯甲烷,5∶95)分离,异构体均可完全拆分。(4)光学活性氨基酸类为最早采用的色谱手性试剂,为提高反应活性和定量回收率,常将羧基转化成酰氯、酸酐等。此类试剂广泛用于胺、羧酸及醇类药物,尤其是氨基酸类,其衍生化法多基于肽合成原理。 本类方法要求手性药物具有活泼反应基团,同时两个对映体的衍生化速度应相同,否则会引起非对映体与原对映体的组成产生差异,另外要求手性衍生化试剂光学纯度高,反应要迅速、彻底,因此应用受到一定限制。 2、直接方法 直接方法是在分子间引入手性环境,即采用手性流动相或手性固定相不经柱前衍生化直接分离药物对映体的方法,该法近年发展迅速。 2.1 手性流动相拆分法向流动相中加入一手性试剂,它与溶质常以氢键、离子键或金属离子的配位健生成非对映体缔合物,从而以常规HPLC固定相分离。分离机理为:(1)在流动相中形成立体选择性复合物;(2)手性流动相添加剂(CMPA)与固定相之间发生作用,形成动态的CSP,该法可通过改变CMPA的种类、浓度及流动相的组成而优化分离条件。 常用的CMPA主要有:(1)环糊精类主要是α-、β-和γ-环糊精及其衍生物。Eto等用β-环糊精测定了数种巴比妥类和乙内酰脲类药物在生物体液中的对映体浓度。谢剑炜等用β-环糊精手性流动相添加剂,用反相HPLC法首次抗胆碱能药物盐酸戊乙奎醚、盐酸苯环壬酯和盐酸卡马特灵,3个手性药物4对对映体完全达到基线分离。(2)手性离子对试剂,karlsso等以N-苯甲酰甘氨酰脯氨酸作为CMPA,分离测定了血浆中(R)-和(S)-普萘洛尔。与HPLC中的离子对法的差别主要在于前者是手性离子对试剂,由于CMPA价格昂贵,其体系稳定性差等原因,应用受到一定的限制。范柏等用L-苯丙氨酸为配合剂,Cu2 为配合离子,用简便的手性配合交换反相HPLC法成功拆分了氧氟沙星对映体,手性流动相为6mmol.L-1L(D)-苯丙氨酸,3mmol.L-1硫酸铜-甲醇(83∶17)。 2.2 手性固定相拆分法由于CSP技术的飞速发展,采用CSP分离对映体化合物的方法应用越来越广泛。目前,商品化的手性柱已有数十种,却无一具有类似ODS柱那样普遍的适应性,且价格昂贵。随着手性识别机理的深入研究,新方法、新理论不断提出,预计将会有价廉、适应性广的CSP面世。(1)环糊精键合相α-、β-和γ-环糊精(CD)是分别由6~8个葡萄糖单位通过α-(1、4)连接构成的环状低聚糖,CD-CSP通过共价键将CD分子键合到硅胶上,形成对水稳定的键合相。β-CD键合相的立体选择性较好,应用最多。β-CD柱上分离较好的化合物通常其手性中心为分子中环状结构的一部分,或至少与两个SP2杂化碳原子相连。Berthod等采用商品的β-CD柱(CydobondⅠ)和γ-CD柱(CydobondⅡ)拆分了25种不同类型的手性药物,其中对映体之间达基线分离的有11种。(2)吸附络合物形成相要想实现手性识别,手性化合物与CSP之间至少应存在三种相互作用,称为三点识别模式。这些作用可以是氢键、静电作用、疏水作用、π-π作用、偶极-偶极作用或空间作用,一般通过将某些氨基酸,如(R)-或(S)-苯基甘氨酸等分子中的α-氨基与3,5-二硝基苯甲酰氯反应后,离子或共价键合到氨丙基硅胶上而制得。该类固定相通常按正相方式操作,其在药物分析中应用较少,后来,RUSTUM等发现也可使用反相分离系统,从而扩展了其应用范围。(3)手性聚合物相用不同方法将纤维素衍生物涂复于大孔硅胶上而制得,在此类固定相上得到成功分离的化合物大都含有苯基、羰基、腈基、磺酰基或羟基等。目前,纤维素—三(3.5一二甲基苯基氨基甲酸酯)手性固定相应用较多。例如,用三(3,5-二甲苯基氨基甲酸酯)纤维素衍生物为CSP对血浆中普萘洛尔对映体的测定。Shibukawa等人采用3,5-二甲苯基氨基甲酸酯衍生化的直链淀粉手性固定相(AD-CSP)分离了维拉帕米及其代谢产物去甲维拉帕米的对映体,方法的线性范围为2.5~100μg.L-1。(4)蛋白质键合相以离子键(或共价键)和蛋白交联作用将蛋白质固定于硅胶上,利用蛋白质分子与手性化合物分子间的立体选择性作用,进行药物对映体分离,其机理一般有氢键、静电作用、疏水作用、离子对和离子交换作用。将α1-酸性糖蛋白(α1-AGP)固定到硅胶上而制得AGP柱可直接分离许多碱性、酸性及中性药物对映体。钟大放等用CHIRAL-AGP柱,选择不同流动相分别拆分了SFZ-47、KMBZ-009和地丙苯酮3种药物的4对对映体,并研究了SFZ-47在家犬体内的药代动力学。Schmidt等人以α1-酸性糖蛋白为CSP测定人体血浆中美沙酮对映体的含量。Orn等以α1-酸性糖蛋白为CS
[size=3][font=Times New Roman] [/font][font=宋体]组织细胞内的受体浓度一般很低,约在[/font][font=Times New Roman]10[sup]4[/sup]-10[sup]5[/sup][/font][font=宋体]个[/font][font=Times New Roman]/[/font][font=宋体]细胞。如果细胞受体结合位点为[/font][font=Times New Roman]10[sup]4[/sup]-10[sup]5[/sup][/font][font=宋体]个[/font][font=Times New Roman]/[/font][font=宋体]细胞,标记的正电子放射性药物比活度为([/font][font=Times New Roman]3.7-7.4)X10[sup]11[/sup]Bq(10-20Ci)/mmol[/font][font=宋体],他的最大结合容量大约每[/font][font=Times New Roman]10[sup]6[/sup][/font][font=宋体]个细胞也只有几百个[/font][font=Times New Roman]cpm[/font][font=宋体],故一般要求放射性药物的比活度至少[/font][font=Times New Roman]3.7X10[sup]11[/sup]Bq(10Ci)/mmol[/font][font=宋体]。对于受体显像研究中,获得正电子放射性药物的比活度是非常重要。以下是计算正电子药物比活度的方法,仅供参考:[/font][/size][size=3][font=Times New Roman] 1[/font][font=宋体]、采用正电子放射性药物的标准品在[/font][font=Times New Roman]HPLC[/font][font=宋体]中确定[/font][font=Times New Roman]UV[/font][font=宋体]分布的位置;[/font][/size][size=3][font=Times New Roman] 2[/font][font=宋体]、将自己标记获得正电子放射性药物与标准品相同条件下在[/font][font=Times New Roman]HPLC[/font][font=宋体]中获得[/font][font=Times New Roman]UV[/font][font=宋体]、放射性分布的图形,获得产物化学量,并转化成[/font][font=Times New Roman]mmol,[/font][font=宋体]获得产物的放射性计数;[/font][/size][size=3][font=Times New Roman] 3[/font][font=宋体]、计算比活度:放射性计数([/font][font=Times New Roman]Bq)/mmol[/font][font=宋体];[/font][/size]
各位高手,我用毛细管电泳拆分手性药物,所用的样品溶度是一样的,为什么当拆分开始的双峰的峰面积都比单峰的峰面积大了一半以上.
最近在做氨基酸及手性药物分离,分出来的峰峰高不等,但有人说峰高应该是 等高的,尤其是氨基酸!有谁知道是为什么吗?
【WEBINAR】开讲啦!8月21日周五下午14:00“手性药物合成、纯化和表征技术进展“主题网络会议[b]手性药物[/b]([b]Chiral drug[/b])是指药物分子结构中引入手性中心后,得到的一对互为实物与镜像的对映异构体。分子式相同,但是每一对化学纯的对映异构体的理化性质有所不同。如我们熟悉的“反应停”事件,具有手性的一对药物的药理作用可能天壤之别。低于50个原子组成的有机小分子药物,很大一部分具有手性。其药理作用是通过与体内大分子之间严格手性匹配与分子识别后实现。含手性因素的化学药物的对映体在人体内的药理活性、代谢过程及毒性存在显著的差异。当前,手性药物研究已成为新药研究的重要方向之一。因此,有必要开展围绕手性药物合成与分析检测相关技术与发展开展相关的技术交流。为广大从事[color=#ff0000][b]药物合成与分析检测相关[/b][/color]的工作者提供学术、技术交流的平台,仪器信息网将于[color=#ff0000][b]2020年8月21日[/b][/color]举办“[b]手性药物合成、纯化及表征技术进展[/b]”主题网络研讨会。【专家预览】【1】许家喜(北京化工大学 教授)【2】胡伟(Anton Paar 安东帕)【3】杨金囤(赛莱默)【4】王玉记(首都医科大学药学院 教授)参会地址:[url=https://www.instrument.com.cn/webinar/meetings/chiraldrug2020/]点击打开链接[/url]欢迎报名参加!
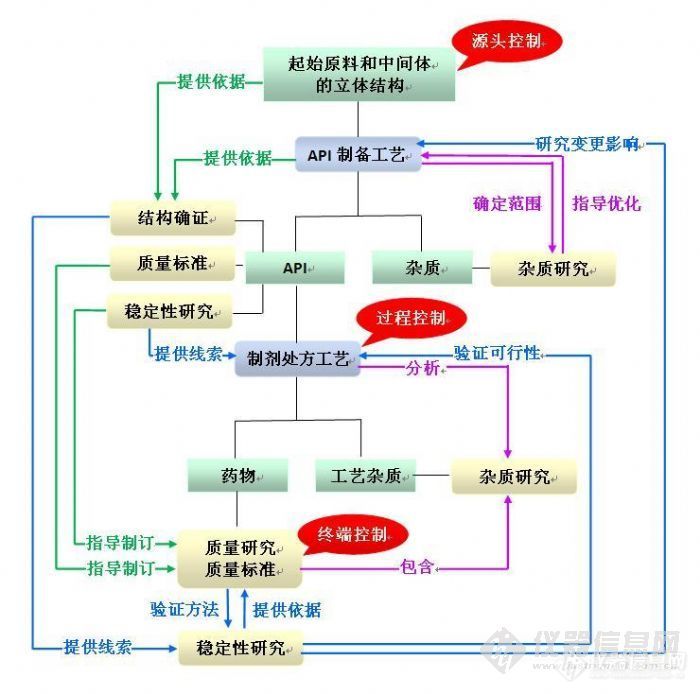
看过这篇电子刊物之后,觉得不光是对手性药物,对认识其他化学药物的药学研究也很有帮助,所以做了一份图解。既为加深理解,也为与大家分享。欢迎批评指正。声明:本人发贴的目的是分享和讨论,不是为赚取积分或奖品,因此会在仪器信息网、丁香园和SFDAIED论坛同时发,不参加原创大赛。转载的朋友就不必在以上论坛转载了,谢谢。http://ng1.17img.cn/bbsfiles/images/2011/12/201112080052_336496_1612179_3.jpg
紧急求助:FDA及ICH等国外发布的手性药物方面的指导原则,急求,非常感谢!
在手性药物分析中,怎样判断出的两个峰是肩峰还是真正的左右旋体...??因为第二个峰离第一个峰很近.而且比较小...
手性是自然界的一种基本属性,组成生物体的很多基本结构单元都具有手性,在本指导原则中所指的手性药物主要是指含手性中心的药物,其它类型的手性药物也可参考本指导原则的基本要求。该文件从国家食品药品监督管理局下载,希望有用。
[font=&]【WEBINAR】开讲啦!8月21日周五下午14:00“手性药物合成、纯化和表征技术进展“主题网络会议[/font][b]手性药物[/b][font=&]([/font][b]Chiral drug[/b][font=&])是指药物分子结构中引入手性中心后,得到的一对互为实物与镜像的对映异构体。分子式相同,但是每一对化学纯的对映异构体的理化性质有所不同。如我们熟悉的“反应停”事件,具有手性的一对药物的药理作用可能天壤之别。低于50个原子组成的有机小分子药物,很大一部分具有手性。其药理作用是通过与体内大分子之间严格手性匹配与分子识别后实现。含手性因素的化学药物的对映体在人体内的药理活性、代谢过程及毒性存在显著的差异。[/font][font=&]当前,手性药物研究已成为新药研究的重要方向之一。因此,有必要开展围绕手性药物合成与分析检测相关技术与发展开展相关的技术交流。[/font][font=&]为广大从事[/font][font=&][color=#ff0000][b]药物合成与分析检测相关[/b][/color][/font][font=&]的工作者提供学术、技术交流的平台,仪器信息网将于[/font][font=&][color=#ff0000][b]2020年8月21日[/b][/color][/font][font=&]举办“[/font][b]手性药物合成、纯化及表征技术进展[/b][font=&]”主题网络研讨会。[/font][font=&]【专家预览】[/font][font=&]【1】许家喜(北京化工大学 教授)[/font][font=&]【2】胡伟(Anton Paar 安东帕)[/font][font=&]【3】杨金囤(赛莱默)[/font][font=&]【4】王玉记(首都医科大学药学院 教授)[/font][font=&]参会地址:[/font][font=&][url=https://www.instrument.com.cn/webinar/meetings/chiraldrug2020/]点击打开链接[/url][/font][font=&]欢迎报名参加![/font]
毛细管电色谱用于手性药物分离的研究魏霞蔚(浙江大学药学院 杭州 310058)摘要:毛细管电色谱(CEC)是一种新型的微分离技术,结合了高效液相色谱(HPLC)和高效毛细管电泳(HPCE)两者的优势。本文主要以色谱柱的类型对CEC分类,一方面介绍了为了使手性药物更好地分离,人们在各类毛细管电色谱柱的优化中所做的一些工作;另一方面,对近几年开管柱-CEC、填充柱-CEC和整体柱-CEC在手性药物分离中的具体应用实例进行了总结。关键字:毛细管电色谱 对映体 手性拆分 药物分析下载链接:http://www.instrument.com.cn/download/shtml/155613.shtml
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=16265]液相色谱法分离手性药物[/url]