中山大学李惠琳:非变性质谱技术推动蛋白质结构研究,助力新药研发
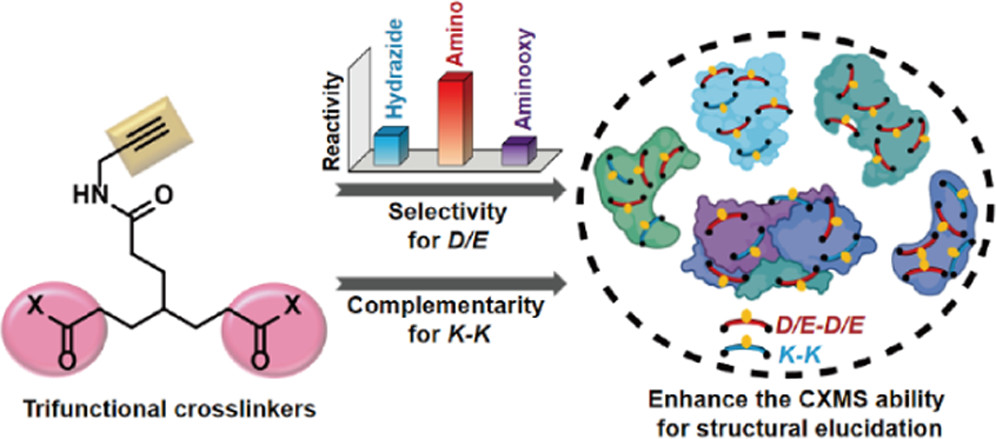
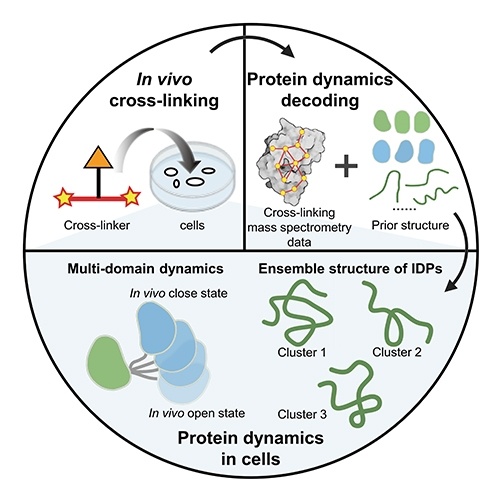
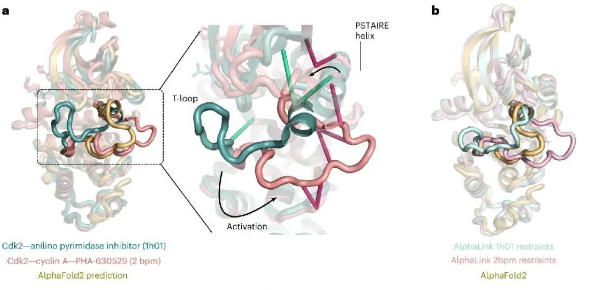
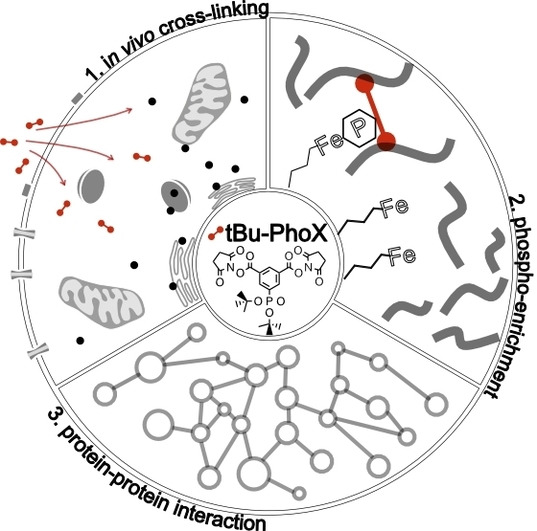
蛋白质是生命的物质基础,通过与不同生物分子间的相互作用在生物体内执行着各项重要工作,其功能与结构直接相关。因此,解析蛋白质及其复合物高阶结构对于深入理解蛋白质功能、生理现象及药物研发具有重要意义。过去的60余年,随着X-射线晶体衍射(X-ray)、核磁共振(NMR)以及冷冻电镜(cryoEM)等技术的出现和不断发展,蛋白质结构解析取得了长足发展。然而,如何在分析蛋白质时使其保持近似自然生理环境的非变性状态,对其动态、异质性、相互作用等属性的研究是结构生物学领域的热点和难点。 质谱技术的不断发展使其在蛋白质结构表征领域发挥了越来越重要的作用。非变性质谱(native MS)兴起于20世纪90年代,是一种可以分析蛋白高阶结构的生物质谱方法。与传统的破坏蛋白质立体结构和弱相互作用力的方法不同,非变性质谱采用质谱兼容的近生理pH值的溶液体系(主要为醋酸铵)和更温和的电离方式,使生物大分子在气相中能够最大程度地保持自然折叠状态、非共价相互作用和相关的生物学功能。因此,非变性质谱可以提供分子质量、寡聚态、构象(折叠vs 去折叠)、异质性、配体结合、靶蛋白-小分子亲和力以及复合物中蛋白亚基的相互作用网络关系等更具生物学意义的重要信息,为蛋白质“序列-结构-功能”关系提供分子基础,已成为结构生物学不可或缺的互补工具,在生物制药、蛋白一配体、蛋白一蛋白复合物结构分析等诸多领域具有广泛应用。 近年来,蛋白质结构研究领域经历着剧烈的技术迭代。2021年人工智能(AI) AlphaFol2横空出世,将蛋白质3D结构预测的精度从60%提升到90%以上,在给传统结构解析技术带来冲击的同时,也为结构质谱的发展提供了契机。 未来,非变性质谱技术的发展需要简化样品处理,提升仪器的灵敏度、分析通量和鲁棒性,实现内源性蛋白复合物样本的直接或原位分析,推动其在生物医药表征、蛋白多聚态等领域的更广泛应用。非变性质谱技术与离子消度(MS)、自上而下串联解离(top-down)、电荷检测质谱(CDMsS)等创新联用技术和方法的不断开发及完善,将极大地提升结构信息的广度、丰富度及精确度,补充生物物理学方法缺失的结构信息。同时,非变性质谱与cryoEM1、氢完交换质谱(HDX-MS)、交联质谱等技术联用将更加常态化,这些实验数据与AI结构预测算法的进一步整合将有效解决蛋白及蛋白复合物结构预测存在的精度问题,推动结构生物学发展,助力新药研发。 此外,非变性质谱技术的应用发展将更加关注:1)蛋白复合物结构一功能关系的研究,通过与计算机模拟(MD)、HDX-Ms、cryoEM等技术联用,揭示标志物蛋白在人类疾病发展过程中的作用,推动靶向药物设计和精淮医疗 2)通过研究小分子与靶蛋白的相互作用获取二者结合的亲和力信息,加速靶向药物筛选 3)翻译后修饰(PTMS)、突变等因素导致的蛋白高度异质性及其对蛋白或亚基折叠动力学、构象及构象变化、结合计量比等造成的结构和功能影响 4)蛋白与其他生物分子(配体、DNAA/RNA、金属离子等)之间的相互作用。 李惠琳,中山大学药学院教授,博士生导师。主要从事生物大分子质谱新技术的开发及应用,其研究主要侧重于1)开发整合结构质谱技术,并对蛋白质机器结构、功能和动态变化及靶向药物作用分子机制进行深入研究2)开发middle-down/top-down蛋白质组学技术,探索蛋白翻译后修饰在生命过程中的调控机制。承担国家自然科学基金项目3项,荣获美国质谱学会颁发的Postdoctoral Career Development Award (2014) ,入选珠江人才计划(青年拔尖人才,2019),其研究成果发表在Nature Chemistry, Analytical Chemistry, J. Am.Soc.Mass Spectrom.等杂志。 "非变性质谱技术研究与应用"专栏共收录7篇论文,既介绍了非变性质谱技术的样品制备、离子源、质量分析器、联用技术等基础内容,也涵括了样品提取、样品引入、离子化及电荷操控等方式,以及在蛋白结构及构象解析、蛋白・蛋白相互作用等领域的应用,代表了国内非变性质谱技术的发展现状。希望本专栏能成为《质谱学报》广大读者颇有价值的科技文献,同时也希望更多的学者加入到非变性质谱研究领域,推动我国结构质谱技术的创新发展。