我们有一个塑料薄膜,材料是PPS的,厚度在2微米左右,表面镀了一层镍,我们一般是用一个金属盘采用不同的张紧力把它张紧,使它产生不同的频率,我们想了解一下在不同张紧力的作用下薄膜内部组织结构是否有变化,有什么差异,不知道用什么方式可以实现,上周我们去一个大学用扫描电镜看了一下,但是扫描电镜只能看到样品表面形貌的变化,看不到样品内部的组织结构。

TCA循环的几个物质,一直衍生不出来,今天看到一个文献标明了所有物质衍生后的结构,也是用的MTBSTFA衍生,对比后发现我的TIC图里面也有这个质谱图但是NIST谱库没有把他标为目标物,然后上网查了一下才知道原来衍生后的物质结构真的稍微有所变化,网上搜NIST里面有目标物的结构,但是[url=https://insevent.instrument.com.cn/t/Mp]gc[/url] MS的NIST库里没有,这个不是重点,重点是,衍生怎么会发生结构变化呢?这三个物质分别是pyruvic acid, oxaloacetate,ketoglutarate,其中pyruvic acid变化最大也最不能让我理解,有没有大神解释一下?[img=,690,437]http://ng1.17img.cn/bbsfiles/images/2017/07/201707171950_02_3147589_3.png[/img][img=,690,368]http://ng1.17img.cn/bbsfiles/images/2017/07/201707171950_01_3147589_3.png[/img]图有点不好看,请体谅一下。。。。
请各位大侠帮下忙,我做出了XRD图谱,和标准图谱对照也对,但就是不知道怎样分析结构变化,请帮忙指教,谢谢!
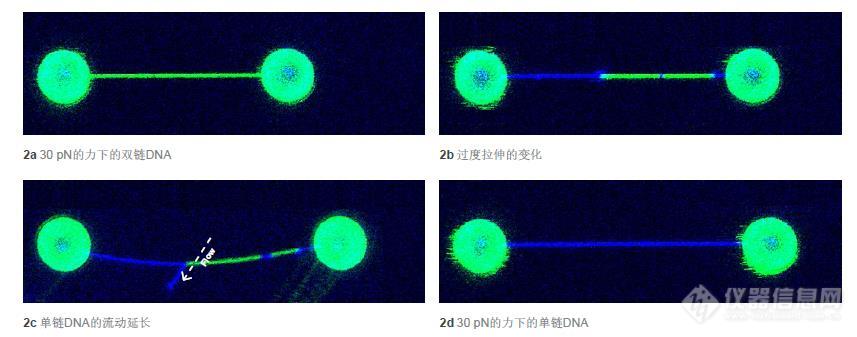
[b]研究DNA过度拉伸时的结构变化[/b]单分子力谱(SMFS)仪器被广泛用于研究DNA过度拉伸时的结构变化。然而,很多仪器仅仅能够给出大体的信息,然而结构变化的作用机制仍然不明。将SMFS与可视化相结合可以解决这个问题。我们将讨论LUMICKS的C-Trap技术如何将高分辨率的光镊与荧光共聚焦显微结合来检测机械力作用下双链DNA至单链DNA的转变过程。之前的研究表明,裸露的双链DNA在大约65 pN的力下发生转变。在施加恒定力的转变过程中,DNA的伸直长度增加了70%。接下来DNA的B型至S型转变中,包括若干因终端或缺口被剥开或因融解泡形成而融解的区域。由于DNA的这种行为在65 pN力作用下可以再现,因而可以测量不同的连接配体或不同的缓冲液产生的力导致的过度拉伸时的变化,揭示DNA与连接配体的相互作用如何影响DNA的结构与稳定性。[img=,500,117]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021122131167_3965_981_3.jpg!w690x162.jpg[/img]1 DNA过度拉伸的图示。DNA连接两个被光阱捕获而分开的微球,诱导了两端双链解旋分离。我们使用高分辨率光镊操控DNA分子引发转变,同时检测力(亚pN级)和距离(亚nm级)随时间发生的变化。我们使用荧光标记来区分已经融解的单链DNA和双链DNA,并用高精度的(误差在15 nm以下)多通道单光子检测来确定融解的位置。使用层流微流控和自动装载功能,可用两个被光阱捕获的微球体来拴住双链DNA(图1)。接下来这个整体被输送至含有浓度为2nM的特异性结合双链DNA的Sytox橙和3 nM的荧光标记的特异性结合单链DNA的复制蛋白A(RPA)的通道中。[img=,500,196]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021120598814_3829_981_3.jpg!w690x271.jpg[/img]2 双链DNA转变至单链DNA的不同阶段的双色二维荧光共聚焦图像。绿色表示特异结合双链DNA的Sytox橙的荧光,蓝色表示特异结合单链DNA的RPA的荧光。第一个实验中拍摄了不同声力下的荧光共聚焦图像以演示系统的双通道检测功能。首先我们用30 pN的力使双链DNA可见(图2a),碱基对的距离使得Sytox分子可以充分结合并完全包被双链DNA。第二个实验中,施加逐渐上升的声力直到过度拉伸,双链DNA从两端开始剥离。实验中观察到了一个非常明显的与RPA结合到单链DNA的区域(图2,蓝色区域)。除了两端以外的RPA结合的DNA区域显示了从DNA缺口处开始的剥离现象的存在。接下来用C-Trap微流控系统验证了DNA融解区域的存在,并对DNA施以缓慢的垂直流动缓冲液来延长剥下的单链DNA(图2C)。最后,双链DNA被声力完全融解,形成完全被RPA包被的单链DNA(图2D)。[img=,446,462]http://ng1.17img.cn/bbsfiles/images/2018/08/201808021121089923_7525_981_3.jpg!w446x462.jpg[/img]3 单个双链DNA分子以140 nm/s的速度拉伸与收缩的双色荧光波动曲线。将距离(灰色)与力(红色)的数据与荧光图像进行叠加得到数据的真实相关。为使荧光显微结果与定量力谱数据相符,将单个双链DNA分子以140 nm/s的恒定速度进行拉伸并记录力、距离和荧光(图3)。灰色的线显示了DNA两端距离随时间的变化,红色的线显示了施加的力随时间的变化。将所有的数据叠加,获得了每一条荧光显微的线的力和距离的值。因此,可以得出Sytox橙最低在25 pN的力下开始结合双链DNA。还有,和裸露的双链DNA不同,直到力达到90 pN才观察到了过度拉伸导致的变化。这样的现象可能是因为Sytox橙结合双链DNA稳定了结构,使其更加难于融解。当过度拉伸导致变化时产生了蓝色荧光,显示出双链DNA到单链DNA的结构变化。而且又一次观察到DNA的剥离不仅从两侧而且从缺口处开始的现象。双链DNA开始融解,RPA开始结合单链DNA时,力的大小开始下降,表示包被了RPA的融解DNA已经稳定,不能再次退火形成双链DNA。最后,力的大小降至20 pN,Sytox橙分离,RPA依然保持结合。在理解了小分子配体存在时的DNA的结构变化和如何通过分子水平的机械操纵来研究这些相互作用可以引导生物学和生物物理学产生突破性的发现。使用C-Trap光镊-荧光技术可以实时观察并检测结构变化。单分子的张力和拉伸的数据对研究生物分子和生物聚合物有重大意义。
如何通过质谱检测的质荷比推断药物在体内代谢时结构的变化
探讨,单斜的晶体在电子束的照射下,会不会发生结构变化,变成立方结构,原因又是什么
利用核磁是否可以观察到蛋白质、核酸等二级结构的动态变化过程?
衍射谱出现diffuse说明正空间晶体结构出现什么变化?
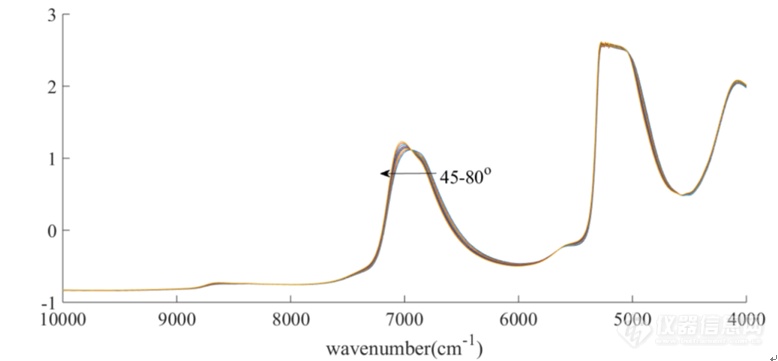
[align=center][b][color=windowtext][/color][/b][/align][align=center][b][color=windowtext]NIR[/color][color=windowtext]用于不同温度下[/color][color=windowtext]HSA[/color][color=windowtext]与[/color][color=windowtext]IgG[/color][color=windowtext]结构变化研究[/color][/b][/align][color=windowtext]加热作为药物蛋白生产过程、研究药物蛋白新型复合物等过程中必需的操作,能够导致蛋白质分子变性、分解或聚集,从而影响蛋白质的活性与功能[/color][sup][color=windowtext][/color][/sup][color=windowtext]。因此,研究温度对蛋白质结构变化的影响具有较大的意义。[/color][color=windowtext]本课题实验选取[/color][color=windowtext]HSA[/color][color=windowtext]与[/color][color=windowtext]IgG[/color][color=windowtext]两种蛋白质为研究对象,采集不同温度下两种蛋白质的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url],并对所得的光谱进行处理与分析。利用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]对不同温度下蛋白质结构的变化进行研究。[/color][b][color=windowtext]2.1[/color][color=windowtext]实验仪器与试剂[/color][color=windowtext]2.1.1 [/color][color=windowtext]实验[/color][color=windowtext]仪器[/color][color=windowtext]与软件[/color][/b][align=center][color=windowtext]表2-1 实验仪器与软件[/color][/align] [table=568][tr][td] [align=center][color=windowtext]仪器[/color][color=windowtext]/[/color][color=windowtext]软件[/color][/align] [/td][td] [align=center][color=windowtext]规格与型号[/color][/align] [/td][td] [align=center][color=windowtext]生产厂家[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]电子分析天平[/color][/align] [/td][td] [align=center][color=windowtext]ME54E[/color][/align] [/td][td] [align=center][color=windowtext]梅特勒[/color][color=windowtext]-[/color][color=windowtext]托利多仪器股份有限公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url][/color][/align] [/td][td] [align=center][color=windowtext]1000 μL[/color][color=windowtext]、[/color][color=windowtext]100 μL[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Thermo Fisher[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]Antaris II[/color][color=windowtext]傅里叶变换近红外([/color][color=windowtext]Fourier TransformNear Infrared, FT-NIR[/color][color=windowtext])光谱仪[/color][/align] [/td][td] [align=center][color=windowtext]Antaris II[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Thermo Fisher Scientific[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]大容量吸光比色皿[/color][/align] [/td][td] [align=center][color=windowtext]光程[/color][color=windowtext]1mm[/color][/align] [/td][td] [align=center][color=windowtext]德国[/color][color=windowtext]Hellma[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]MATLAB[/color][color=windowtext]数据处理软件[/color][/align] [/td][td] [align=center][color=windowtext]2015a[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Mathworks[/color][color=windowtext]公司[/color][/align] [/td][/tr][/table][color=windowtext] [/color][b][color=windowtext]2.1.2 [/color][color=windowtext]实验材料与[/color][color=windowtext]试剂[/color][/b][align=center][color=windowtext]表[/color][color=windowtext]2-2 [/color][color=windowtext]实验材料与试剂[/color][/align] [table=568][tr][td] [align=center][color=windowtext]试剂[/color][color=windowtext]/[/color][color=windowtext]材料[/color][/align] [/td][td] [align=center][color=windowtext]规格[/color][color=windowtext]/[/color][color=windowtext]批号[/color][/align] [/td][td] [align=center][color=windowtext]生产厂家[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]人血[/color][color=windowtext]清[/color][color=windowtext]白蛋白[/color][color=windowtext]([/color][color=windowtext]Albumin human[/color][color=windowtext])[/color][/align] [/td][td] [align=center][color=windowtext]A9731-5G[/color][/align] [/td][td] [align=center]Sigma-Aldrich公司[/align] [align=center][color=windowtext] [/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]免疫球蛋白[/color][color=windowtext]G[/color][color=windowtext]([/color][color=windowtext]IgG from human serum[/color][color=windowtext])[/color][/align] [/td][td] [align=center][color=windowtext]I4506-50MG[/color][/align] [/td][td] [align=center]Sigma-Aldrich公司[/align] [align=center][color=windowtext] [/color][/align] [/td][/tr][/table][b][color=windowtext]2.2 [/color][color=windowtext]NIR[/color][color=windowtext]用于不同温度下[/color][color=windowtext]HSA[/color][color=windowtext]结构变化研究[/color][color=windowtext]2.2.1 [/color][color=windowtext]实验方法[/color][color=windowtext]2.2.1.1[/color][color=windowtext]样品的配制与光谱的采集[/color][/b][color=windowtext]配[/color][color=windowtext]制[/color][color=windowtext]60mg/m[/color][color=windowtext]L[/color][color=windowtext]的[/color][color=windowtext]HSA[/color][color=windowtext]水溶液[/color][color=windowtext],[/color][color=windowtext]进行升温处理:温度范围为[/color][color=windowtext]4[/color][color=windowtext]5[/color][color=windowtext]℃[/color][color=windowtext]-[/color][color=windowtext]8[/color][color=windowtext]0[/color][color=windowtext]℃[/color][color=windowtext]([/color][color=windowtext]45℃[/color][color=windowtext]、[/color][color=windowtext]50℃[/color][color=windowtext]、[/color][color=windowtext]55℃[/color][color=windowtext]、[/color][color=windowtext]58[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]60℃[/color][color=windowtext]、[/color][color=windowtext]62[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]65℃[/color][color=windowtext]、[/color][color=windowtext]70℃[/color][color=windowtext]、[/color][color=windowtext]75℃[/color][color=windowtext]、[/color][color=windowtext]80℃[/color][color=windowtext]),采集[/color][color=windowtext]NIR[/color][color=windowtext]光谱,波长范围[/color][color=windowtext]10000-4000cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext],[/color][color=windowtext]2cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]分辨率,[/color][color=windowtext]64[/color][color=windowtext]次扫描,在各个温度下,光程长[/color][color=windowtext]1mm[/color][color=windowtext],以[/color][color=windowtext]空比色皿[/color][color=windowtext]为背景进行扫描,同时在实验前扫描双蒸水的升温[/color][color=windowtext]NIR[/color][color=windowtext]光谱,供背景扣除用。每张光谱采集[/color][color=windowtext]10[/color][color=windowtext]次[/color][color=windowtext],[/color][color=windowtext]最后进行[/color][color=windowtext]平均[/color][color=windowtext]处理[/color][color=windowtext]。[/color][b][color=windowtext]2.2.1.2[/color][color=windowtext]光谱的处理方法[/color][/b][color=windowtext](1)[/color][color=windowtext]连续小波变换[/color][color=windowtext]([/color][color=windowtext]c[/color][color=windowtext]ontinuouswavelet transform[/color][color=windowtext],[/color][color=windowtext]CWT[/color][color=windowtext])[/color][color=windowtext]连续小波变换是一种积分变换,它具有两个参数,分别是尺度和平移。在小波基下将任意空间中的函数展开,展开后的积分变换即为连续小波变换。它具有叠加性、时移不变性、伸缩共変性、内积性、自相关性等性质。[/color][color=windowtext]在本实验中,[/color][color=windowtext]为了增强光谱的分辨率,使用[/color][color=windowtext]CWT[/color][color=windowtext]处理原始[/color][color=windowtext]光谱[/color][color=windowtext]解析谱图中的重叠信号[/color][color=windowtext],[/color][color=windowtext]采用[/color][color=windowtext]“[/color][color=windowtext]Sym2[/color][color=windowtext]”小波基和[/color][color=windowtext]20[/color][color=windowtext]小波尺度获得平滑效果[/color][color=windowtext]。[/color][color=windowtext](2)[/color][color=windowtext]主成分[/color][color=windowtext]分析[/color][color=windowtext]([/color][color=windowtext]p[/color][color=windowtext]rincipal [/color][color=windowtext]c[/color][color=windowtext]omponent [/color][color=windowtext]a[/color][color=windowtext]nalysis[/color][color=windowtext],[/color][color=windowtext]PCA[/color][color=windowtext])[/color][color=windowtext]在对数据进行处理及分析时,如果变量过多,计算过程将会十分繁琐并且计算难度大幅度提高,实验结果的获得也就十分困难,这时就需要一种数据处理方法来尽可能减少变量。主成分分析就是将多个变量中联系密切的变量通过一个新变量表现出来,将原先的变量通过尽可能少而互不相关的几个综合变量表示出来,是一种常用的多变量分析方法。[/color][color=windowtext]使用[/color][color=windowtext]PCA[/color][color=windowtext]的中心目的是将实验的数据降维,能够将光谱矩阵分解为几个向量的外积之和。本实验分别选取[/color][color=windowtext]CWT[/color][color=windowtext]处理后的光谱[/color][color=windowtext]4900-4200 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]段[/color][color=windowtext]、[/color][color=windowtext]8000-5500 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]段,进行[/color][color=windowtext]PCA[/color][color=windowtext]分析,进行结果分析。[/color][b][color=windowtext]2.2.2[/color][color=windowtext]结果与讨论[/color][/b][color=windowtext]([/color][color=windowtext]1[/color][color=windowtext])[/color][color=windowtext]60 mg/mLHSA [/color][color=windowtext]水溶液的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]原始图[/color][color=windowtext]样品升温[/color][color=windowtext]原始[/color][color=windowtext]光谱图[/color][align=center][img=,690,320]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131645350976_6132_3237657_3.png!w690x320.jpg[/img][/align][align=center][color=windowtext]图[/color][color=windowtext]2-1[/color][color=windowtext]在[/color][color=windowtext]45-80℃[/color][color=windowtext]范围内测定的[/color][color=windowtext]60 mg/mL HSA [/color][color=windowtext]水溶液的近红外原始光谱图[/color][/align][color=windowtext]图[/color][color=windowtext]2-1[/color][color=windowtext]为在[/color][color=windowtext]45-80℃[/color][color=windowtext]下测定的[/color][color=windowtext]60 mg[/color][color=windowtext]/[/color][color=windowtext]mLHSA[/color][color=windowtext]水溶液的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url][/color][color=windowtext]原始图[/color][color=windowtext],波数范围为[/color][color=windowtext]10000-4000 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]。位于[/color][color=windowtext]5100 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]O-H[/color][color=windowtext]基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]的检测上限,因此[/color][color=windowtext]5100cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]附近信号在[/color][color=windowtext]本章中[/color][color=windowtext]弃去。本[/color][color=windowtext]章[/color][color=windowtext]主要分析[/color][color=windowtext]8000-5500cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]和[/color][color=windowtext]4900-4200 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]范围内的吸收峰。从图中可以看出随着温度升高,[/color][color=windowtext]7000 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]处的吸收峰发生蓝移,并且在[/color][color=windowtext]6943 cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]处存在一个等吸收点。[/color][color=windowtext]该结果说明[/color][color=windowtext],[/color][color=windowtext]随着[/color][color=windowtext]温度[/color][color=windowtext]的[/color][color=windowtext]升高[/color][color=windowtext],[/color][color=windowtext]不同结构水分子[/color][color=windowtext]的含量也发生了相应的改变[/color][color=windowtext]。然而,由于水分子在此波段范围内有较强的吸收,无法获得蛋白质的光谱信息。因此,为了分析[/color][color=windowtext]HSA[/color][color=windowtext]的结构随温度的变化,增强光谱的分辨率来获得潜在的关于[/color][color=windowtext]HSA[/color][color=windowtext]的光谱信息[/color][color=windowtext]是[/color][color=windowtext]有必要[/color][color=windowtext]的[/color][color=windowtext]。[/color](2)利用连续小波变换对原始光谱进行解析为了增强光谱的分辨率,使用CWT处理原始光谱解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。处理结果如图2-2所示。[align=center][img=,690,349]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131645494430_703_3237657_3.png!w690x349.jpg[/img][/align][align=center]图2-2 60 mg/mL HSA水溶液在45-80℃的CWT图[/align][img=,690,174]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131646042045_860_3237657_3.png!w690x174.jpg[/img][align=center]图2-3 60 mg/mL HSA水溶液在45-80℃的CWT放大图,左图为4900-4200 cm[sup]-1[/sup]范围内放大图,右图为8000-5500 cm[sup]-1[/sup]范围内放大图[/align]经过小波变换之后,可以看到光谱信息得到放大,在7000cm[sup]-1[/sup]左右的羟基吸收峰处,出现随着温度升高,吸光度强度明显发生变化的情况;在4900-4200cm[sup]-1[/sup]酰胺吸收区域,可以明显看到4844cm[sup]-1[/sup](可归属为酰胺A/Ⅱ结构)、4597 cm[sup]-1[/sup](可归属为酰胺B/Ⅱ结构),4416 cm[sup]-1[/sup](可归属为β-折叠结构),4513 cm[sup]-1[/sup](可归属为β-折叠结构),4351cm[sup]-1[/sup](可归属为α-螺旋结构)处蛋白质的吸收峰,由此可以看出CWT处理提高了[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的分辨率,可以提取出关于HSA结构的丰富信息。在羟基吸收区域,在7070cm[sup]-1[/sup]和6827cm[sup]-1[/sup]处也有明显的吸收峰,并在6953cm[sup]-1[/sup]和6712cm[sup]-1[/sup]处有两个肩峰。(3)4900-4200 cm[sup]-1[/sup]段进行主成分分析的结果与讨论[align=center][img=,690,288]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131646248536_1487_3237657_3.png!w690x288.jpg[/img][/align][align=center]图2-4 4900-4200cm[sup]-1[/sup]波段第一主成分与第二主成分得分散点图[/align]首先对4900-4200 cm[sup]-1[/sup]段谱图进行CWT处理,然后进行PCA,图2-4为第一主成分和第二主成分得分的散点图,从图中可以明显看出,在第一主成分中,1-10号样品,即45-80℃的HSA溶液的得分随着温度升高而下降;在第二主成分中,1-5号样品的得分大致呈现下降的趋势,6-10号样品呈现大致上升的趋势,并且在5-6号样品之间,即从60-62℃,得分发生明显的转折,这说明蛋白质HSA肽链骨架的构象在该温度附近发生显著的变化,而骨架构象的改变将导致二级结构的转变,进而导致蛋白质三维结构的更改,最终引起蛋白质生物活性的降低甚至是丧失。所以,从60 ℃开始,HSA结构开始发生了变化。第一主成分数、第二主成分数、第三主成分数的累积贡献率分别是80.43%,15.90%和3.20%,总共代表了99.52%的光谱信息。如图2-5所示,a1、a2、a3为三个主成分的载荷图,b1、b2、b3为三个主成分的得分图。[align=center][img=,690,376]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131646409648_856_3237657_3.png!w690x376.jpg[/img][/align][align=center]图2-5 4900-4200 cm[sup]-1[/sup]段第一、第二、第三主成分的载荷图和得分图,左边a1、a2、a3为三个主成分的载荷图,右边b1、b2、b3为三个主成分的得分图[/align]第一主成分得分与温度之间的相关系数为0.9841,第一主成分更多代表的是来自温度的影响,从散点图中的明显转折,也说明第一主成分可能包含蛋白质的信息,从第一主成分载荷图中可以看到有明显的三个吸收峰分别为4578cm[sup]-1[/sup]、4443cm[sup]-1[/sup]、4366cm[sup]-1[/sup],与第二主成分的吸收峰一致。从4900-4200 cm[sup]-1[/sup]段第二主成分得分图中可以看出,第二主成分所提取的光谱信息在62℃发生明显转折。此外,第二主成分还可以得到4767cm[sup]-1[/sup]、4273cm[sup]-1[/sup]两处吸收峰,应当对应第二主成分得分趋势的转折,这两个峰可以分别归属为酰胺A/II结构与[i]α[/i]-螺旋结构。[align=center][img=,690,344]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131647344075_6093_3237657_3.png!w690x344.jpg[/img][/align][align=center]图2-6 不同温度下吸光度波数变化图,分别是4767cm[sup]-1[/sup]、4578cm[sup]-1[/sup]、4443cm[sup]-1[/sup]、4366cm[sup]-1[/sup]、4273cm[sup]-1[/sup][/align]除4273cm[sup]-1[/sup]外,其他四个波数在60℃温度左右均发生明显的吸光度的变化,这说明蛋白质肽链骨架的构象在该温度附近发生显著的改变,进一步证实了 60℃是蛋白质结构开始发生较大改变的温度这一推论的合理性。(4)8000-5500 cm[sup]-1[/sup]羟基吸收区域进行PCA处理的结果与讨论在HSA水溶液中,HSA的结构变化可能影响周围水分子的结构,水分子也可能在HSA的结构变化中扮演着重要角色。因此,研究溶液中水分子的结构随温度的变化非常必要。先对谱图进行CWT处理再进行PCA分析,图2-7为第一主成分和第二主成分得分的散点图,与4900-4200 cm[sup]-1[/sup]范围内得到的主成分得分散点图非常相似,即在60-62℃第一主成分得分出现明显的转折点,从而可以确定水参与了HSA的热变性过程,并且在60-62℃期间,发生了水物种的变化。[align=center][img=,690,293]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131647550492_7594_3237657_3.png!w690x293.jpg[/img][/align][align=center]图2-78000-5500 cm[sup]-1[/sup]第一主成分与第二主成分的得分散点图[/align][align=center][img=,690,372]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131648071168_9189_3237657_3.png!w690x372.jpg[/img][/align][align=center]图2-8第一、第二、第三主成分的载荷图和得分图,a1、a2、a3分别为三个主成分的载荷图,b1、b2、b3分别为三个主成分的得分图[/align]如图2-8所示为三个主成分的载荷图和得分图,第一、第二、第三主成分数的累计贡献率分别为92.41%,4.59%和1.44%,总共代表了98.44%的光谱信息。从图中可以看出第二主成分所提取的光谱信息在62℃发生明显转折,第三主成分所提取的光谱信息在60-62 ℃发生明显的转折,而在7000-6500cm[sup]-1[/sup]范围内主要是水的氢键结构的吸收,因此说明在60-62 ℃的温度范围内左右水发生了结构的变化。[b][color=windowtext]2.3[/color][color=windowtext]NIR[/color][color=windowtext]用于不同温度下[/color][color=windowtext]IgG[/color][color=windowtext]结构变化的研究[/color][color=windowtext]2.3.1[/color][color=windowtext]实验方法[/color][/b][color=windowtext]配[/color][color=windowtext]制[/color][color=windowtext]5[/color][color=windowtext]mg/m[/color][color=windowtext]L[/color][color=windowtext]的[/color][color=windowtext]IgG[/color][color=windowtext]水溶液[/color][color=windowtext],[/color][color=windowtext]进行升温处理:温度范围为[/color][color=windowtext]4[/color][color=windowtext]5[/color][color=windowtext]℃[/color][color=windowtext]-[/color][color=windowtext]85℃[/color][color=windowtext]([/color][color=windowtext]45℃[/color][color=windowtext]、[/color][color=windowtext]47[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]49[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]51[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]53[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]55[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]57[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]59[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]61[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]63[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]6[/color][color=windowtext]5℃[/color][color=windowtext]、[/color][color=windowtext]67[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]69[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]71[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]73[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]75[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]77[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]79[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]81[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]83[/color][color=windowtext]℃[/color][color=windowtext]、[/color][color=windowtext]85[/color][color=windowtext]℃[/color][color=windowtext]),采集[/color][color=windowtext]NIR[/color][color=windowtext]光谱,波长范围[/color][color=windowtext]10000-4000cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext],[/color][color=windowtext]2cm[/color][sup][color=windowtext]-1[/color][/sup][color=windowtext]分辨率,[/color][color=windowtext]64[/color][color=windowtext]次扫描,在各个温度下,光程长[/color][color=windowtext]1mm[/color][color=windowtext],以[/color][color=windowtext]空比色皿[/color][color=windowtext]为背景进行扫描,同时在实验前扫描双蒸水的升温[/color][color=windowtext]NIR[/color][color=windowtext]光谱,供背景扣除用。每张光谱采集[/color][color=windowtext]3[/color][color=windowtext]次[/color][color=windowtext],[/color][color=windowtext]进行[/color][color=windowtext]平均[/color][color=windowtext]处理[/color][color=windowtext]。[/color][b][color=windowtext]2.3.2[/color][color=windowtext]结果与讨论[/color][/b][align=center][img=,690,292]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131648205608_4873_3237657_3.png!w690x292.jpg[/img][/align][align=center]图2-9 在45-85℃范围内5mg/mLIgG水溶液的近红外原始光谱图[/align][align=center][img=,690,289]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131648326500_4907_3237657_3.png!w690x289.jpg[/img][/align][align=center]图 2-10 在45-85℃范围内5mg/mLIgG水溶液的平均光谱[/align][align=center][img=,690,304]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131648435024_3909_3237657_3.png!w690x304.jpg[/img][/align][align=center]图2-11 在45-85℃范围内5mg/mLIgG水溶液平均光谱进行SNV处理后的光谱[/align][align=center][img=,690,411]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131648563297_1624_3237657_3.png!w690x411.jpg[/img][/align][align=center]图2-12 在45-85℃范围内5mg/mLIgG水溶液平均光谱进行SNV处理后8000-6000cm-1放大光谱图[/align]图2-9为在45-85℃下测定的5mgmL[sup]-1[/sup]IgG水溶液的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url],波数范围为10000-4000 cm[sup]-1[/sup]。图2-10为平均后的光谱。图2-11是对光谱进行标准正态变换处理(SNV)后,去除基线漂移后的图谱。位于5100 cm[sup]-1[/sup]O-H基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]的检测上限,因此5100cm[sup]-1[/sup]附近信号弃去。本章中主要分析8000-5500cm[sup]-1[/sup]和4900-4200 cm[sup]-1[/sup]范围内的吸收峰。前者可归属为O-H基团对称和反对称伸缩的组合频和N-H基团伸缩振动的一级倍频;后者是N-H、C-N和C-H基团伸缩或弯曲振动的组合频或一级倍频产生的重叠峰。从图2-11、图2-12中可以看出随着温度升高,7000cm[sup]-1[/sup]处的吸收峰发生蓝移,并且在6945 cm[sup]-1[/sup]处存在一个等吸收点。这表明,温度升高对体系中的水分子产生了一定的影响。然而,由于水分子在此波段范围内有较强的吸收,无法获得蛋白质的光谱信息。因此,为了分析IgG的结构随温度的变化,有必要增强光谱的分辨率来获得潜在的关于IgG的光谱信息。为了增强光谱的分辨率,使用CWT解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。[align=center] [/align][align=center][img=,690,336]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131649089676_7135_3237657_3.png!w690x336.jpg[/img][/align][align=center]图2-13 IgG水溶液在45-85℃的CWT图[/align][align=center][img=,690,324]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131649431014_4654_3237657_3.png!w690x324.jpg[/img][/align][align=center]图2-14 IgG水溶液在45-85℃的7500-6500cm-1放大CWT图[/align][align=center][img=,690,340]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131649566374_6651_3237657_3.png!w690x340.jpg[/img][/align][align=center]图2-15 IgG水溶液在45-85℃的5200-4900cm-1放大CWT图[/align]经过小波变化之后,可以看到光谱信息得到放大,在7000cm[sup]-1[/sup]左右的羟基吸收峰处,出现随着温度升高,吸光度经小波变换后的强度发生了不同的变化,在4900-4200cm[sup]-1[/sup]酰胺吸收区域,可以明显看到4900 cm[sup]-1[/sup]、4650 cm[sup]-1[/sup],4520 cm[sup]-1[/sup],4380 cm[sup]-1[/sup],4300cm[sup]-1[/sup]蛋白的吸收峰,可以看出CWT对[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的分辨率进行了提高,可以提取出关于IgG结构的丰富信息。(1)4900-4200cm[sup]-1[/sup]段进行PCA的结果与讨论首先对4900-4200cm[sup]-1[/sup]段的光谱进行CWT处理,然后进行PCA分析。[align=center][img=,690,335]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131650150903_4762_3237657_3.png!w690x335.jpg[/img][/align][align=center]图2-16 IgG水溶液在4900-4200cm[sup]-1[/sup]的第一主成分和第二主成分得分的散点图.其中,1-21号样品分别对应温度为:45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85℃[/align]图2-16所示为IgG水溶液在4900-4200cm[sup]-1[/sup]第一主成分和第二主成分得分的散点图。由图可知,在第一主成分中,1-21号样品的IgG溶液随着温度升高,得分的绝对值大致呈现下降的趋势。而对于第二主成分,1-9号,即45-61℃样品得分呈现下降趋势,经过9号处转折,9-21号,即61-85℃样品得分大致呈现上升趋势。并且,实验过程中,在65℃样品状态发生改变,即产生肉眼可见的白色浑浊,随温度上升,样品浑浊程度变大。综上,这说明蛋白质肽链骨架的构象在61℃附近发生结构上的变化,但是在65℃发生了显著的变化—该变化导致蛋白质发生沉淀。所以,61 °C可能预示着蛋白质IgG变性的开始,而65℃即蛋白质IgG在水溶液中发生沉淀的温度。图2-17所示为IgG水溶液在4900-4200cm[sup]-1[/sup]第一主成分的载荷图,从第一主成分的载荷图中可以看出4760-4600cm[sup]-1[/sup]处、4540-4450cm[sup]-1[/sup]、4400-4360cm[sup]-1[/sup]、4330-4260cm[sup]-1[/sup]处的峰包含有更多关于蛋白质结构更多的信息,在蛋白质结构中,C-H基团,其第一组合频大约在5000-4160cm[sup]-1[/sup],在该谱带间,谱带的信号较强,因此,该段谱带的主成分分析对于蛋白质结构变化的研究具有较大的意义。图2-18 为IgG水溶液在4900-4200 cm[sup]-1[/sup]第一主成分的得分图,从图2-18中,可以看出,第一主成分的得分与温度呈现较好的线性关系,对其进行线性回归计算可得如图2-19的回归线,R[sup]2[/sup]=0.9956,故可以认为第一主成分与温度具有很好的相关性,因此可以利用第一主成分来预测温度。[align=center][img=,690,323]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131650277735_6859_3237657_3.png!w690x323.jpg[/img][/align][align=center]图2-17 IgG水溶液在4900-4200cm[sup]-1[/sup]第一主成分的载荷图[/align][align=center][img=,690,341]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131650405801_3154_3237657_3.png!w690x341.jpg[/img][/align][align=center]图2-18 IgG水溶液在4900-4200cm[sup]-1[/sup]第一主成分的得分图[/align][align=center][img=,690,374]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131650544465_3552_3237657_3.png!w690x374.jpg[/img][/align][align=center]图2-19 IgG水溶液在4900-4200cm[sup]-1[/sup]第一主成分的得分图的线性回归曲线[/align][align=center][img=,690,359]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131651063527_3202_3237657_3.png!w690x359.jpg[/img][/align][align=center]图 2-20IgG水溶液在4900-4200cm[sup]-1[/sup]第二主成分的载荷图[/align][align=center][img=,690,302]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131651369214_3530_3237657_3.png!w690x302.jpg[/img][/align][align=center]图 2-21 IgG水溶液在4900-4200cm[sup]-1[/sup]第二主成分的得分图[/align] 1-21号分别对应45-85℃样品,从第二主成分得分图中可以看出,8-10号样品,即59℃、61℃、63℃得分发生了明显的转折,即主成分二所提取的光谱信息在61℃发生明显转折。在4900-4200cm[sup]-1[/sup]酰胺吸收区域,包含有蛋白质的酰胺A/Ⅱ结构、酰胺B/Ⅱ结构,β-折叠结构与α-螺旋结构,该波段范围内蛋白质的相应结构的吸收峰随温度的改变发生了明显的变化,这表明蛋白质的结构在该温度附近发生了改变。(2)8000-5500cm[sup]-1[/sup]羟基吸收区域PCA的结果与讨论IgG的结构变化对周围水分子的结构有一定的影响作用,从该段谱图主要分析水分子的结构变化,通过水分子结构随温度的变化来推断蛋白质的结构变化。首先对8000-5500cm[sup]-1[/sup]羟基吸收区域进行CWT处理后再进行PCA分析,图2-22为第一主成分和第二主成分得分的散点图,与4900-4200cm[sup]-1[/sup]范围得到的主成分得分散点图的得分正负及趋势上具有一些不同之处。在第一主成分中:1-21号样品的得分大致呈现上升的趋势;在第二主成分中,1-6号样品,即45-55℃样品的得分大致呈现较好的上升趋势,而在57℃明显下降,而在4900-4200cm[sup]-1[/sup]的第一主成分及第二主成分散点图中57℃并非为异常点,推测其原因是由于在57℃时,水的O-H键结构发生了较大的改变;在61℃时,得分发生了较小程度的下降,亦可以推测在61℃蛋白质结构发生了改变,而在65℃时,得分发生了较大程度的下降,且在65℃时,样品产生了较为明显的白色浑浊,因此,第二主成分的得分也可以较为直接的表明蛋白质结构和蛋白质状态的变化。[align=center][img=,690,352]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131651561424_6598_3237657_3.png!w690x352.jpg[/img][/align][align=center]图2-22 IgG水溶液在8000-5500cm[sup]-1[/sup]的第一主成分和第二主成分得分的散点图.其中,1-21号样品分别对应温度为:45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85℃[/align][align=center][img=,690,329]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131652075338_4325_3237657_3.png!w690x329.jpg[/img][/align][align=center]图2-23 IgG水溶液在8000-5500cm[sup]-1[/sup]第一主成分的载荷图[/align]从图2-23中可以看出,在7000-6550 cm[sup]-1[/sup]、6000-5950 cm[sup]-1[/sup]、5940-5800 cm[sup]-1[/sup]、5750-5600 cm[sup]-1[/sup]内水的结构变化与温度的改变具有一定的关系,因此,提取8000-5500 cm[sup]-1[/sup]范围内进行分析具有意义。并且从图2-24可以看出,IgG水溶液在8000-5500cm[sup]-1[/sup]的第一主成分的得分与温度呈现较好的线性关系,因此利用第一主成分预测温度较为合理。[align=center][img=,690,350]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131652225253_264_3237657_3.png!w690x350.jpg[/img][/align][align=center]图2-24IgG水溶液在8000-5500cm[sup]-1[/sup]第一主成分的得分图[/align][b]2.4结论[/b][color=windowtext]本文应用了[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术在蛋白质分子结构中检测的快速、高灵敏性、无损性等特点,研究了[/color][color=windowtext]HSA[/color][color=windowtext]与[/color][color=windowtext]IgG[/color][color=windowtext]在[/color][color=windowtext]温度的变化条件下的结构变化[/color][color=windowtext]。[/color][color=windowtext]从[/color][color=windowtext]近[/color][color=windowtext]红外光谱中探究微观的分子结构的变化,温度升高[/color][color=windowtext]对溶液体系中水分子的结构产生了一定的影响[/color][color=windowtext],[/color][color=windowtext]改变了蛋白质的结构[/color][color=windowtext],[/color][color=windowtext]在水溶液中,[/color][color=windowtext]60 mg/mL HSA[/color][color=windowtext]的结构[/color][color=windowtext]在[/color][color=windowtext]60℃[/color][color=windowtext]左右[/color][color=windowtext]发生显著的变化[/color][color=windowtext]。[/color][color=windowtext]5 mg/mLIgG[/color][color=windowtext]水溶液中的[/color][color=windowtext]IgG[/color][color=windowtext]在[/color][color=windowtext]61 [/color][color=windowtext]℃[/color][color=windowtext]左右[/color][color=windowtext]发生[/color][color=windowtext]结构上的变化,并且在[/color][color=windowtext]65 [/color][color=windowtext]℃[/color][color=windowtext]产生了沉淀,在[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]上有所体现。说明[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]能够表征蛋白质细微的结构变化,在生产工艺流程中,能够为追踪蛋白质的活性变化提供一定的帮助。[/color][align=center]参考文献[/align] 桂萍,罗永康,冯力更.加热温度对混合肉肌原纤维蛋白质结构的影响.中国农业大学学报,2018,23(05):93-101.[color=windowtext][/color]
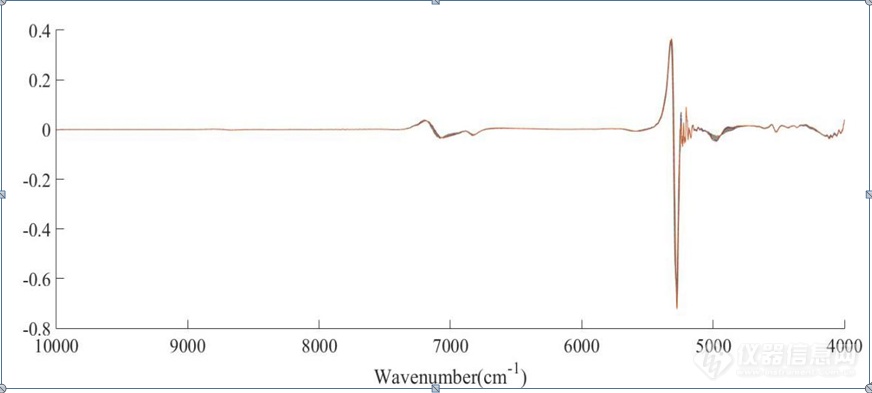
[align=center][b][color=windowtext]NIR[/color][color=windowtext]用于不同[/color][color=windowtext]NaCl[/color][color=windowtext]浓度下[/color][color=windowtext]HSA[/color][color=windowtext]与[/color][color=windowtext]IgG[/color][color=windowtext]结构变化的研究[/color][/b][/align][color=windowtext] [/color][color=windowtext]蛋白质的分子内及分子间存在氢键相互作用、离子键相互作用以及分子的疏水作用力[/color][sup][color=windowtext][/color][/sup][color=windowtext]等,溶解于不同的介质溶液中,蛋白质的溶解性及其结构不同。在蛋白质的提取分离纯化等过程中,多数蛋白质水溶液中含有[/color][color=windowtext]NaCl[/color][color=windowtext],[/color][color=windowtext]在蛋白质[/color][url=https://baike.so.com/doc/6007054-6220039.html][color=windowtext]水溶液[/color][/url][color=windowtext]中,[/color][color=windowtext]由于蛋白质颗粒表面多为亲水基团[/color][sup][color=windowtext][/color][/sup][color=windowtext],[/color][color=windowtext]NaCl[/color][color=windowtext]溶解在水中会导致水的结构发生改变,从而导致蛋白质结构发生改变,在[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]上会有所体现。[/color][color=windowtext]本章讨论[/color][color=windowtext]不同浓度[/color][color=windowtext]NaCl[/color][color=windowtext]对蛋白质结构的影响,原因可能是由于水溶液中[/color][color=windowtext]NaCl[/color][color=windowtext]浓度的变化导致离子强度不同从而产生影响;[/color][color=windowtext]Na[sup]+[/sup][/color][color=windowtext]在水溶液中与水分子形成络合物[/color][sup][color=windowtext][/color][/sup][color=windowtext],进而导致蛋白质结构的改变。[/color][color=windowtext]利用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术探究蛋白质在不同浓度的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液中所发生的结构变化,为蛋白质的提取、分离、纯化等工艺过程提供更有利的条件。[/color][b][color=windowtext]3.1 [/color][color=windowtext]实验仪器与试剂[/color][color=windowtext]3.[/color][color=windowtext]1.[/color][color=windowtext]1[/color][color=windowtext]实验[/color][color=windowtext]仪器[/color][color=windowtext]与软件[/color][/b][align=center][color=windowtext]表[/color][color=windowtext]3-1 [/color][color=windowtext]实验仪器与软件[/color][/align] [table=568][tr][td] [align=center][color=windowtext]仪器[/color][color=windowtext]/[/color][color=windowtext]软件[/color][/align] [/td][td] [align=center][color=windowtext]规格与型号[/color][/align] [/td][td] [align=center][color=windowtext]生产厂家[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]电子分析天平[/color][/align] [/td][td] [align=center][color=windowtext]ME54E[/color][/align] [/td][td] [align=center][color=windowtext]梅特勒[/color][color=windowtext]-[/color][color=windowtext]托利多仪器股份有限公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url][/color][/align] [/td][td] [align=center][color=windowtext]1000μL[/color][color=windowtext]、[/color][color=windowtext]100μL[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Thermo Fisher[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]傅里叶变换近红外([/color][color=windowtext]Fourier Transform Near Infrared, FT-NIR[/color][color=windowtext])光谱仪[/color][/align] [/td][td] [align=center][color=windowtext]Antaris II[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Thermo Fisher Scientific[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]大容量吸光比色皿[/color][/align] [/td][td] [align=center][color=windowtext]光程[/color][color=windowtext]1mm[/color][/align] [/td][td] [align=center][color=windowtext]德国[/color][color=windowtext]Hellma[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]MATLAB [/color][color=windowtext]数据处理软件[/color][/align] [/td][td] [align=center][color=windowtext]2015a[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Mathworks[/color][color=windowtext]公司[/color][/align] [/td][/tr][/table][color=windowtext] [/color][b][color=windowtext]3.1.2[/color][color=windowtext]实验材料与[/color][color=windowtext]试剂[/color][/b][align=center][color=windowtext]表[/color][color=windowtext]3-2 [/color][color=windowtext]实验材料与试剂[/color][/align] [table=568][tr][td] [align=center][color=windowtext]试剂[/color][color=windowtext]/[/color][color=windowtext]材料[/color][/align] [/td][td] [align=center][color=windowtext]规格[/color][color=windowtext]/[/color][color=windowtext]批号[/color][/align] [/td][td] [align=center][color=windowtext]生产厂家[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]人血[/color][color=windowtext]清[/color][color=windowtext]白蛋白[/color][color=windowtext]([/color][color=windowtext]Albumin human[/color][color=windowtext])[/color][/align] [/td][td] [align=center][color=windowtext]A9731-5G[/color][/align] [/td][td] [align=center][color=windowtext]S[/color][color=windowtext]igma[/color][color=windowtext]-A[/color][color=windowtext]ldrich[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]免疫球蛋白[/color][color=windowtext]G[/color][color=windowtext]([/color][color=windowtext]IgG from human serum[/color][color=windowtext])[/color][/align] [/td][td] [align=center][color=windowtext]I4506-50MG[/color][/align] [/td][td] [align=center][color=windowtext]S[/color][color=windowtext]igma[/color][color=windowtext]-A[/color][color=windowtext]ldrich[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]氯化钠[/color][/align] [/td][td] [align=center][color=windowtext]分析纯[/color][/align] [/td][td] [align=center][color=windowtext]国药集团化学试剂有限公司[/color][/align] [/td][/tr][/table][b][color=windowtext]3.2 NIR[/color][color=windowtext]用于不同[/color][color=windowtext]NaCl[/color][color=windowtext]浓度下[/color][color=windowtext]HSA[/color][color=windowtext]结构变化的研究[/color][color=windowtext]3.2.1[/color][color=windowtext]实验[/color][color=windowtext]方法[/color][/b]NaCl水溶液二元体系的配制:配制NaCl水溶液,浓度范围为0-3.2 mol/L,0.4mol/L为一个梯度,即0 mol/L、0.4 mol/L、0.8 mol/L、1.2 mol/L、1.6 mol/L、2.0 mol/L、2.4 mol/L、2.8 mol/L、3.2 mol/L。[color=windowtext]HSA[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext]三元体系的配制:[/color][color=windowtext]配制[/color][color=windowtext]含有蛋白质[/color][color=windowtext]HSA[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext],[/color][color=windowtext]称取[/color][color=windowtext]0[/color][color=windowtext].[/color][color=windowtext]3000g HSA[/color][color=windowtext]溶于[/color][color=windowtext]2mL[/color][color=windowtext]水中[/color][color=windowtext],[/color][color=windowtext]维持每一个样品[/color][color=windowtext]HSA[/color][color=windowtext]的浓度为[/color][color=windowtext]30mg/mL[/color][color=windowtext],配制[/color][color=windowtext]HSA[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液,[/color][color=windowtext]NaCl[/color][color=windowtext]的浓度范围为[/color][color=windowtext]0-3.2mol/L[/color][color=windowtext],[/color][color=windowtext]0.4mol/L[/color][color=windowtext]为一个梯度。[/color][color=windowtext]采集[/color][color=windowtext]二元体系与三元体系的[/color][color=windowtext]NIR[/color][color=windowtext]光谱,[/color][color=windowtext]温度为[/color][color=windowtext]35℃[/color][color=windowtext],[/color][color=windowtext]波长范[/color][color=windowtext]围为[/color][color=windowtext]10000-4000cm[sup]-1[/sup][/color][color=windowtext],[/color][color=windowtext]2cm[sup]-1[/sup][/color][color=windowtext]分辨率,[/color][color=windowtext]64[/color][color=windowtext]次扫描,光程长[/color][color=windowtext]1mm[/color][color=windowtext],以[/color][color=windowtext]空比色皿[/color][color=windowtext]为背景进行扫描。每张光谱采集[/color][color=windowtext]3[/color][color=windowtext]次[/color][color=windowtext],[/color][color=windowtext]最后进行[/color][color=windowtext]平均[/color][color=windowtext]处理[/color][color=windowtext]。[/color][b][color=windowtext]3.2.2 [/color][color=windowtext]光谱处理[/color][color=windowtext]方法[/color][/b][color=windowtext]在本实验中,将[/color][color=windowtext]IgG[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液三元体系与[/color][color=windowtext]IgG[/color][color=windowtext]的水溶液二元体系进行差谱处理,通过差谱寻找某些波段范围内光谱的变化,探究其对应结构的变化。[/color][color=windowtext]为了增强光谱的分辨率,使用[/color][color=windowtext]CWT[/color][color=windowtext]处理原[/color][color=windowtext]始光谱[/color][color=windowtext]解析谱图中的重叠信号[/color][color=windowtext],[/color][color=windowtext]采用[/color][color=windowtext]“[/color][color=windowtext]Sym2[/color][color=windowtext]”小波基和[/color][color=windowtext]20[/color][color=windowtext]小波尺度获得平滑效果[/color][color=windowtext]。[/color]使用PCA的中心目的是将本次实验的数据降维,能够将光谱矩阵分解为几个向量的外积之和。分别选取CWT处理后的光谱4900-4200 cm[sup]-1[/sup]段、8000-5500 cm[sup]-1[/sup]段,进行PCA分析,进行结果分析。[b][color=windowtext]3.2.3 [/color][color=windowtext]结果与讨论[/color][/b][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext]二元体系(下面简称二元体系)原始[/color][color=windowtext]光谱图如[/color][color=windowtext]图[/color][color=windowtext]3-1[/color][color=windowtext],[/color][color=windowtext]HSA[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext]三元体系(下面简称三元体系)原始光谱如图[/color][color=windowtext]3-2[/color][color=windowtext],[/color][color=windowtext]波数范围为[/color][color=windowtext]10000-4000cm[sup]-1[/sup][/color][color=windowtext]。位于[/color][color=windowtext]5100cm[sup]-1[/sup]O-H[/color][color=windowtext]基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]的检测上限,因此[/color][color=windowtext]5100cm[sup]-1[/sup][/color][color=windowtext]附近信号在[/color][color=windowtext]本章中[/color][color=windowtext]弃去。本[/color][color=windowtext]章[/color][color=windowtext]主要分析[/color][color=windowtext]8000-5500cm[sup]-1[/sup][/color][color=windowtext]和[/color][color=windowtext]4900-4200 cm[sup]-1[/sup][/color][color=windowtext]范围内的吸收峰。[/color][color=windowtext]两个体系的原始光谱中,[/color][color=windowtext]6944 cm[sup]-1[/sup][/color][color=windowtext]左右的峰主要是水分子中[/color][color=windowtext]O-H[/color][color=windowtext]键的特征吸收峰,可以归属为[/color][color=windowtext]O-H[/color][color=windowtext]键伸缩振动的一级倍频。[/color][color=windowtext]在图[/color][color=windowtext]3-1[/color][color=windowtext]、图[/color][color=windowtext]3-2[/color][color=windowtext]中,随着[/color][color=windowtext]NaCl[/color][color=windowtext]浓度的升高,[/color][color=windowtext]6944 cm[sup]-1 [/sup][/color][color=windowtext]左右的峰高呈现依次增强且发生移动的规律性变化,分析其主要原因是[/color][color=windowtext]NaCl[/color][color=windowtext]浓度升高,[/color][color=windowtext]Na[sup]+[/sup][/color][color=windowtext]、[/color][color=windowtext]Cl[sup]-[/sup][/color][color=windowtext]、一些水分子会结合形成配位化合物,从而破坏了水分子的氢键[/color][sup][color=windowtext][/color][/sup][color=windowtext]。根据[/color][color=windowtext]Buijs[/color][color=windowtext]和[/color][color=windowtext]Choppin[/color][color=windowtext]的理论[/color][sup][color=windowtext][/color][/sup][color=windowtext],[/color][color=windowtext]NaCl[/color][color=windowtext]会导致水分子间氢键发生断裂,且随着[/color][color=windowtext]NaCl[/color][color=windowtext]浓度的增大,溶液中离子的浓度增大,从而会导致吸收峰增强并向高波数方向移动。但是,也可以清晰看出,由于仪器响应、样品状态等原因,某些光谱产生了漂移或光谱的不重复,因此有必要对原始光谱进行预处理。[/color][align=center][img=,690,274]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131558063307_3867_3237657_3.png!w690x274.jpg[/img][/align][align=center]图3-1 0-3.2mol/LNaCl水溶液原始光谱[/align][align=center][img=,675,271]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131558399909_4386_3237657_3.png!w675x271.jpg[/img][/align][align=center]图3-2 HSA在0-3.2mol/L 的NaCl水溶液原始光谱,HSA的浓度为30mg/mL[/align]分别对二元体系、三元体系的原始光谱进行SNV处理,去除基线漂移,如图3-3、图3-4所示,6944 cm[sup]-1[/sup]左右、4900-4200cm[sup]-1[/sup]范围内的光谱随NaCl浓度的变化呈现一定的规律性变化。[align=center][img=,690,271]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131559308692_6470_3237657_3.png!w690x271.jpg[/img][/align][align=center]图3-3 NaCl水溶液原始光谱SNV处理后光谱[/align][align=center] [/align][align=center][img=,690,279]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131600012732_9921_3237657_3.png!w690x279.jpg[/img][/align][align=center]图3-4 HSA的NaCl水溶液原始光谱SNV处理后光谱[/align]从二元体系与三元体系的近红外原始光谱中,很难提取出两者有效的光谱信息,为了研究NaCl对蛋白质HSA的结构影响,得到蛋白质对应信号的位置,将三元体系、二元体系的SNV处理后的光谱进行差谱处理。如图3-5所示:在7000 cm[sup]-1[/sup]的差谱图附近呈现一系列峰的变化,该附近主要是水的吸收。从图中可以看出,在加入蛋白质HSA后,由于蛋白质与水形成新的氢键以及占据单纯的NaCl水溶液二元体系中水所占的百分比等,该波段左右的峰呈规律性的变化,分析其原因是由于NaCl水溶液的浓度不同,从而导致对水结构的影响大小不同,因此二元与三元体系的差谱会有一定的变化。在6000-5800cm[sup]-1 [/sup]左右、5000-4200cm[sup]-1[/sup]该处二元与三元体系的差谱呈现一定的规律性变化,在这两段波段附近,主要存在着蛋白质酰胺A/Ⅱ结构、酰胺B/Ⅱ结构、β-折叠结构、α-螺旋结构等结构的吸收峰,在三元体系中,不同浓度的NaCl对蛋白质的结构会产生一定的影响,因此,在差谱图中呈现一定的规律性变化。[align=center][img=,690,274]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131600466848_2947_3237657_3.png!w690x274.jpg[/img][/align][align=center]图3-5 三元体系与二元体系SNV处理后光谱的差谱[/align]本章主要分析8000-5500 cm[sup]-1[/sup]和4900-4200 cm[sup]-1[/sup]范围内的吸收峰。前者可归属为O-H基团对称和反对称伸缩的组合频和N-H基团伸缩振动的一级倍频;后者是N-H、C-N和C-H基团伸缩或弯曲振动的组合频或一级倍频产生的重叠峰。为了分析NaCl对HSA的结构变化的影响,有必要增强光谱的分辨率来获得潜在的关于HSA的光谱信息。为了增强光谱的分辨率,使用CWT解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。处理结果如图3-6所示。[align=center][img=,690,310]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131601152530_4622_3237657_3.png!w690x310.jpg[/img][/align][align=center]图3-6 HSA的NaCl水溶液三元体系CWT图[/align][align=center] [/align][align=center][img=,690,281]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131601349000_5540_3237657_3.png!w690x281.jpg[/img][/align][align=center]图3-7HSA的NaCl水溶液三元体系4900-4200 cm[sup]-1[/sup]放大CWT图[/align][align=center][img=,690,304]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131602292850_6383_3237657_3.png!w690x304.jpg[/img][/align][align=center]图3-8 HSA的NaCl水溶液三元体系8000-5500 cm[sup]-1 [/sup]放大CWT图[/align]如图3-7、图3-8所示,分别为三元体系在4900-4200cm[sup]-1[/sup]、8000-5500cm[sup]-1[/sup] CWT图的放大图,经过小波变化之后,可以看到光谱信息得到放大,在7000 cm[sup]-1[/sup]左右的羟基吸收峰处,出现随着NaCl浓度的升高,吸光度强度发生了不同的变化,大致上呈现强度减小的趋势,在4900-4200cm[sup]-1[/sup]酰胺吸收区域,可以明显看到4820cm[sup]-1[/sup]、4690cm[sup]-1[/sup]、4650cm[sup]-1[/sup]、4548cm[sup]-1[/sup]、4476cm[sup]-1[/sup]、4290cm[sup]-1[/sup]处蛋白质的吸收峰,说明CWT对[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的分辨率进行了提高,可以提取出关于HSA结构的丰富信息。在羟基吸收区域,有两个明显的7150cm[sup]-1[/sup]和6848cm[sup]-1[/sup]处吸收峰。(1)对酰胺吸收的4900-4200 cm[sup]-1[/sup]段进行PCA分析首先对4900-4200cm[sup]-1[/sup]的光谱进行CWT处理,然后进行PCA分析。[align=center][img=,690,312]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131603103760_454_3237657_3.png!w690x312.jpg[/img][/align][align=center]图3-9 三元体系4900-4200 cm[sup]-1[/sup]第一主成分与第二主成分得分图,1-9号为30 mg/mL HSA 分别溶解于对应浓度为0、0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2 mol/L的NaCl溶液的样品[/align]如图3-9所示,从第一主成分与第二主成分得分图中可以看出,1-9号样品的第一主成分的得分呈现依次下降的趋势;而1-9号样品的第二主成分的得分没有明显的上升或者是下降的趋势,但是3号样品,即0.8 mol/L NaCl溶液,8号样品,即2.8 mol/L NaCl溶液,这两个浓度的样品第二主成分的得分明显上升,分析其原因可能是在该浓度下,NaCl 对蛋白质产生了较大的影响,从而引起蛋白质结构的改变。因为NaCl的加入,引入了Na [sup]+[/sup]和Cl[sup] -[/sup],而离子的亲水性较强,所以这两种离子能够破坏蛋白质的水化膜[sup] [/sup],使蛋白质结构发生改变。图3-10为三元体系4900-4200 cm[sup]-1[/sup]第一主成分载荷图,图3-11 三元体系4900-4200 cm[sup]-1[/sup]第一主成分得分图:[align=center][img=,690,302]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131603478849_6677_3237657_3.png!w690x302.jpg[/img][/align][align=center]图3-10HSA的NaCl水溶液三元体系4900-4200 cm[sup]-1[/sup]第一主成分载荷图[/align]在第一主成分载荷图中可以看出,4700-4380cm[sup]-1[/sup]、4360-4320cm[sup]-1[/sup]波数范围内的峰对NaCl 水溶液的浓度较为敏感,该波段范围内主要存在蛋白质酰胺结构的吸收,从图中可以看出随着NaCl 水溶液的浓度的改变,引起了蛋白质结构的改变,这说明能够在第一主成分图中可以提取出蛋白质结构变化的信息。[align=center][img=,690,302]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131604246750_971_3237657_3.png!w690x302.jpg[/img][/align][align=center]图3-11 HSA的NaCl水溶液三元体系4900-4200 cm[sup]-1[/sup]第一主成分得分图[/align][align=center][img=,650,355]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131604464740_222_3237657_3.png!w650x355.jpg[/img][/align][align=center]图3-12HSA的NaCl水溶液三元体系4900-4200 cm[sup]-1[/sup]第一主成分得分图的线性回归图[/align]将三元体系4900-4200 cm[sup]-1[/sup]第一主成分得分图进行线性回归处理,如图3-12所示。R[sup]2[/sup]=0.9976,说明该波段第一主成分的得分与NaCl 水溶液的浓度呈现较好的线性关系,因此可以用第一主成分来预测NaCl 水溶液的浓度。(2)对8000-5500cm[sup]-1[/sup]羟基吸收区域进行PCA分析在HSA水溶液中,存在着水分子和HSA的相互作用。HSA的结构变化可能影响周围水分子的结构,水分子也可能在HSA的结构变化中扮演着重要的角色,在HSA的NaCl水溶液中,Na[sup]+[/sup]、Cl[sup]-[/sup]是亲水性离子,会影响水分子的结构及分布,在光谱中对应的波数范围内会有所体现,因此研究水的光谱具有一定的意义。首先进行CWT处理后进行PCA分析,图3-13为三元体系8000-5500 cm[sup]-1[/sup]第一主成分与第二主成分得分图。从图中可以看出,1-9号样品的第一主成分的得分呈现依次上升的趋势 而1-9号样品的第二主成分的得分没有明显的上升或者是下降的趋势,1号样品,不含NaCl,其得分明显高于其他样品的得分,当加入NaCl后,其第二主成分的得分明显下降,因此可知[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]能够体现水结构发生了改变,在较低浓度时,随着NaCl浓度的增大,第二主成分的得分大致呈现下降的趋势,但当NaCl浓度大于2.0mol/L得分几乎不变,3.2mol/L样品的得分有所升高,可知第二主成分的得分并不呈现明显的规律性变化。[align=center][img=,690,276]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131605461857_8699_3237657_3.png!w690x276.jpg[/img][/align][align=center]图3-13三元体系8000-5500 cm[sup]-1[/sup]第一主成分与第二主成分得分图,1-9号为30mg/mL HSA 分别溶解于对应浓度为0、0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2mol/L的NaCl溶液的样品[/align][align=center][img=,690,301]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131613499315_1180_3237657_3.png!w690x301.jpg[/img][/align][align=center]图3-14三元体系8000-5500 cm[sup]-1[/sup]第一主成分载荷图[/align]在三元体系8000-5500 cm[sup]-1[/sup]第一主成分载荷图中可以看出,8000-7300cm[sup]-1[/sup]波段范围内,信号较为嘈杂,因此无法提取有效信息。7050-7200cm[sup]-1[/sup]左右、4360-4320cm[sup]-1 [/sup]波束范围内的峰对NaCl 水溶液的浓度较为敏感,说明NaCl 水溶液的浓度的改变,对蛋白质结构产生了一定的影响,因此可以在第一主成分图中可以提取出蛋白质结构变化的信息。[align=center][img=,690,334]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131614224128_2979_3237657_3.png!w690x334.jpg[/img][/align][align=center]图3-15三元体系8000-5500 cm[sup]-1[/sup]第一主成分得分图[/align]将HSA的NaCl水溶液三元体系8000-5500 cm[sup]-1[/sup]第一主成分得分图进行线性回归处理,如图3-16所示。R[sup]2[/sup]=0.9989,说明该波段第一主成分的得分与NaCl 水溶液的浓度呈现较好的线性关系,因此可以用第一主成分来预测NaCl 水溶液的浓度。[align=center][img=,593,358]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131614409846_5258_3237657_3.png!w593x358.jpg[/img][/align][align=center]图3-16三元体系8000-5500 cm[sup]-1[/sup]第一主成分得分图的线性回归图[/align][b][color=windowtext]3.3NIR[/color][color=windowtext]用于不同[/color][color=windowtext]NaCl[/color][color=windowtext]浓度下[/color][/b][color=windowtext]IgG[/color][b][color=windowtext]结构变化的研究[/color][color=windowtext]3.3.1 [/color][color=windowtext]实验方法[/color][/b]NaCl水溶液二元体系的配制:配制NaCl水溶液,浓度范围为0-2.4 mol/L,0.2 mol/L为一个梯度,即0 mol/L、0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L、1.2 mol/L、1.4 mol/L、1.6 mol/L、1.8 mol/L、2.0 mol/L、2.2 mol/L、2.4 mol/L。[color=windowtext]IgG[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext]三元体系的配制:[/color][color=windowtext]配制[/color][color=windowtext]含有蛋白质[/color][color=windowtext]IgG[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext],[/color][color=windowtext]维持每一个样品[/color][color=windowtext]IgG[/color][color=windowtext]的浓度为[/color][color=windowtext]5 mg/mL[/color][color=windowtext],[/color][color=windowtext] NaCl[/color][color=windowtext]的浓度范围为[/color][color=windowtext]0-2.4 mol/L[/color][color=windowtext],[/color][color=windowtext]每[/color][color=windowtext]0.2mol/L[/color][color=windowtext]为一个梯度。[/color][color=windowtext]采集[/color][color=windowtext]二元体系与三元体系的[/color][color=windowtext]NIR[/color][color=windowtext]光谱,[/color][color=windowtext]温度为[/color][color=windowtext]35℃[/color][color=windowtext],[/color][color=windowtext]波长范[/color][color=windowtext]围[/color][color=windowtext]10000-4000cm[sup]-1[/sup][/color][color=windowtext],[/color][color=windowtext]2cm[sup]-1[/sup][/color][color=windowtext]分辨率,[/color][color=windowtext]64[/color][color=windowtext]次扫描,光程长[/color][color=windowtext]1mm[/color][color=windowtext],以[/color][color=windowtext]空比色皿[/color][color=windowtext]为背景进行扫描。每张光谱采集[/color][color=windowtext]3[/color][color=windowtext]次[/color][color=windowtext],[/color][color=windowtext]最后进行[/color][color=windowtext]平均[/color][color=windowtext]处理[/color][color=windowtext]。[/color][b][color=windowtext]3.3.2[/color][color=windowtext]结果与讨论[/color][/b][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext]二元体系(下面简称二元体系)原始[/color][color=windowtext]光谱图如[/color][color=windowtext]图[/color][color=windowtext]3-17[/color][color=windowtext],[/color][color=windowtext]IgG[/color][color=windowtext]的[/color][color=windowtext]NaCl[/color][color=windowtext]水溶液[/color][color=windowtext]三元体系(下面简称三元体系)原始光谱如图[/color][color=windowtext]3-18[/color][color=windowtext],[/color][color=windowtext]波数范围为[/color][color=windowtext]10000-4000cm[sup]-1[/sup][/color][color=windowtext]。位于[/color][color=windowtext]5100 cm[sup]-1[/sup]O-H[/color][color=windowtext]基团反对称伸缩和弯曲振动的组合频的吸收峰强度太大,已经超过了[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]的检测上限,因此[/color][color=windowtext]5100cm[sup]-1[/sup][/color][color=windowtext]附近信号在[/color][color=windowtext]本章中[/color][color=windowtext]弃去。本[/color][color=windowtext]章[/color][color=windowtext]主要分析[/color][color=windowtext]8000-5500cm[sup]-1[/sup][/color][color=windowtext]和[/color][color=windowtext]4900-4200 cm[sup]-1[/sup][/color][color=windowtext]范围内的吸收峰。[/color][color=windowtext]两个体系的原始光谱中,[/color][color=windowtext]6944 cm[sup]-1[/sup][/color][color=windowtext]左右的峰主要是水分子中[/color][color=windowtext]O-H[/color][color=windowtext]键的特征吸收峰,可以归属为[/color][color=windowtext]O-H[/color][color=windowtext]键伸缩振动的一级倍频。图[/color][color=windowtext]3-17[/color][color=windowtext]、图[/color][color=windowtext]3-18[/color][color=windowtext]中随着[/color][color=windowtext]NaCl[/color][color=windowtext]浓度的升高,该波段的峰高呈现依次下降的规律性变化,但是,也可以清晰看出,由于仪器响应、样品状态等原因,某些光谱产生了漂移或光谱的不重复,因此有必要对原始光谱进行一些预处理。[/color][align=center][img=,690,303]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131615050911_6556_3237657_3.png!w690x303.jpg[/img][/align][align=center]图3-17 NaCl水溶液二元体系原始光谱图[/align][align=center][img=,690,298]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131615387490_6917_3237657_3.png!w690x298.jpg[/img][/align][align=center]图3-18 IgG的NaCl水溶液三元体系的原始光谱图[/align]分别对二元体系、三元体系的原始光谱进行SNV处理,去除基线漂移,如图3-19、图3-20所示,6943 cm[sup]-1[/sup]左右、4900-4200 cm[sup]-1[/sup]范围内的光谱随NaCl浓度的变化呈现一定的规律性变化。[align=center][img=,690,308]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131621466898_4160_3237657_3.png!w690x308.jpg[/img][/align][align=center]图3-19 NaCl水溶液二元体系原始光谱SNV处理后光谱[/align][align=center][img=,690,303]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131626267350_5522_3237657_3.png!w690x303.jpg[/img][/align][align=center]图3-20 IgG的NaCl水溶液三元体系原始光谱SNV处理后光谱[/align]从二元体系与三元体系的近红外原始光谱中,很难提取出两者有效的光谱信息,为了研究NaCl对蛋白质IgG的结构影响,得到蛋白质对应信号的位置,将三元体系、二元体系的SNV处理后的光谱进行差谱处理。如图3-21所示,在7000 cm[sup]-1[/sup]附近呈现一系列峰的变化,该附近主要是水O-H的吸收,在加入蛋白质IgG后,由于蛋白质与水形成新的氢键以及占据单纯的NaCl水溶液二元体系中水所占的百分比等,从图中可以看出,该波段左右的峰呈规律性的变化,分析其原因是由于NaCl的浓度不同,从而导致对蛋白质的影响大小不同,因此二元与三元体系的差谱会有一定的变化。在5000-4200cm[sup]-1[/sup]范围内的二元与三元体系的差谱呈现一定的变化,在该段波段附近,主要存在着蛋白质酰胺A/Ⅱ结构、酰胺B/Ⅱ结构、β-折叠结构、α-螺旋结构等结构的吸收峰,在三元体系中,NaCl对蛋白质的结构会产生一定的影响,因此,在差谱图中呈现一定的趋势性变化。[align=center][img=,690,299]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131626513112_5137_3237657_3.png!w690x299.jpg[/img][/align][align=center]图3-21 IgG的NaCl水溶液三元体系与NaCl水溶液二元体系SNV处理后光谱的差谱[/align]本章主要分析8000-5500 cm[sup]-1[/sup]和4900-4200 cm[sup]-1[/sup]范围内的吸收峰。前者可归属为O-H基团对称和反对称伸缩的组合频和N-H基团伸缩振动的一级倍频;后者是N-H、C-N和C-H基团伸缩或弯曲振动的组合频或一级倍频产生的重叠峰。为了分析NaCl对IgG结构变化的影响,非常有必要增强光谱的分辨率来获得潜在的关于IgG的光谱信息。为了增强光谱的分辨率,使用CWT解析谱图中的重叠信号,采用“Sym2”小波基和20小波尺度获得平滑效果。处理结果如图3-22所示。[align=center][img=,690,287]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131627039705_8638_3237657_3.png!w690x287.jpg[/img][/align][align=center]图3-22 IgG的NaCl水溶液三元体系CWT图[/align][align=center][img=,690,258]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131627179729_4020_3237657_3.png!w690x258.jpg[/img][/align][align=center]图3-23 IgG的NaCl水溶液三元体系4900-4200 cm[sup]-1[/sup]放大CWT图[/align][align=center][img=,690,259]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131627461320_3276_3237657_3.png!w690x259.jpg[/img][/align][align=center]图3-24 IgG的NaCl水溶液三元体系8000-5500 cm[sup]-1[/sup]放大CWT图[/align]如图3-23、图3-24所示,分别为IgG的NaCl水溶液三元体系在4900-4200 cm[sup]-1[/sup]、8000-5500 cm[sup]-1[/sup]CWT图的放大图,经过小波变化之后,可以看到光谱信息得到放大,在7000cm[sup]-1[/sup]左右的羟基吸收峰处,出现随着NaCl浓度的升高,吸光度强度发生了不同的变化,在4900-4200cm[sup]-1[/sup]酰胺吸收区域,可以明显看到4550cm[sup]-1[/sup]、4460cm[sup]-1[/sup]处蛋白质的吸收峰,说明CWT处理对[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]的分辨率进行了提高,可以提取出关于IgG结构的丰富信息。并且在羟基吸收区域,有两个明显的7180cm[sup]-1[/sup]和6900cm[sup]-1[/sup]处吸收峰。对CWT处理后的4900-4200 cm[sup]-1[/sup]的光谱进行PCA分析,如图3-25所示,从第一主成分与第二主成分得分图中可以看出,1-13号样品的第一主成分的得分呈现依次下降的趋势。而在第二主成分中,1-13号样品的得分没有明显的上升或者是下降的趋势,但是3号样品,即IgG 0.4 mol/LNaCl溶液,11号样品,即2.2 mol/L NaCl溶液,其第二主成分的得分明显上升,分析其原因可能是在这两个浓度下,NaCl 对蛋白质结构产生了较大的影响,从而引起蛋白质结构的改变,可以推测在IgG0.4 mol/L NaCl溶液中,低浓度的NaCl促进了蛋白质结构的疏水作用[sup][/sup],而随NaCl浓度升高,离子强度增大,破坏了蛋白质水化膜的结构,从而改变了蛋白质的分子构象。[align=center][img=,690,264]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131628000740_3209_3237657_3.png!w690x264.jpg[/img][/align][align=center]图3-25IgG的NaCl水溶液三元体系4900-4200 cm[sup]-1[/sup]第一主成分与第二主成分得分图,1-13号为4 mg/mL IgG分别溶解于对应浓度为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4 mol/L的NaCl溶液的样品[/align]图3-26为三元体系8000-5500cm[sup]-1[/sup]第一主成分与第二主成分得分图,可以从图中看出,在第一主成分中,1-13号样品的得分大致呈现下降的趋势,在第二主成分中,7号样品得分明显增高,即可以推测 IgG的1.2 mol/L的NaCl溶液,推测在1.2 mol/L左右,NaCl引起了水的结构较大的变化。[align=center][img=,690,250]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131628162867_5195_3237657_3.png!w690x250.jpg[/img][/align][align=center]图3-26三元体系8000-5500cm[sup]-1[/sup]第一主成分与第二主成分得分图,1-13号为4 mg/mL IgG分别溶解于对应浓度为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4 mol/L的NaCl溶液的样品[/align][b]3.4 结论[/b]NaCl和蛋白质水溶液的所组成的体系中,含有Na[sup]+[/sup]、Cl[sup]-[/sup],NaCl通过破坏蛋白质的周围水分子的结构,使蛋白质溶解度降低,导致蛋白质分子被从溶液中解离出来;NaCl的浓度改变,即溶液离子强度发生改变,可以破坏疏水作用力 ,以及改变蛋白质的分子构象,在光谱中水吸收的波段呈现一定的变化,在PCA处理的得分散点图中,能够得到一定的信息,但是若要进一步对各种结构的变化进行归属、分析,还需更完善的实验方案。通过本章的研究可以知道,NaCl在蛋白质的水溶液中,对蛋白质与水的结构均具有一定的影响,但是与NaCl的浓度并不完全呈现一定的规律性。在较低离子浓度时,可能会促进蛋白质的溶解,而在离子浓度增加时,可能会破坏蛋白质的水化膜结构,从而导致蛋白质结构发生变化。[align=center]参考文献[/align] 胡小玲,郭小青,管萍,钱立伟.在离子液体中蛋白质溶解性和稳定性的研究进展.功能材料,2013,44(12):1679-1685. 查锡良, 药立波. 生物化学与分子生物学. 8版. 北京:人民卫生出版社,2013. [i]Lin Jie[/i],[i]Zhou Jing[/i],[i]Chris W Beown.A[/i]pplied Spectroscopy,1996,50(4):444. . [align=left][/align]
不同的色谱柱条件下,666和DDT的几种结构的出峰顺序是否有变化呢?没有单标定性,只有混标可是混标各组分的浓度还不一样,不知道出峰顺序是否一致?HP-1和DB-5出峰顺序一样不??敬请专家指教!谢谢
各位,小弟菜鸟,刚接触IR,测得图谱不知怎么分析,哪位高手帮忙看看,或者教我怎么读图,在此谢过各位热心人了。(从图1到图2能看出结构上发生了什么变化?图1 主要是有乙烯基,想问一下是否图2的物质中羟基减少很多,以及形成Si-O-SI键)
我国苯乙烯供应结构悄然变化 从2005年开始,国产苯乙烯供应增长速度,超过国内需求的增长速度,进口量下降,近两年维持了这一趋势。 产业发展重心应由扩能转向提高竞争力 国内苯乙烯市场受国际原油和纯苯价格波动影响较大。2007年国际油价一直高位徘徊,为苯乙烯价格提供有力支撑。同时,下游ABS等增长依然强劲,对苯乙烯市场起到拉动作用。 由于2007年我国苯乙烯新增产能仅为16万吨,且新增产能尚未有效释放,因此产量基本与2006年持平。同年上海高桥20万吨/年ABS装置、扬子石化金浦橡胶有限公司10万吨/年SBR装置、台湾台塑石化公司20万吨/年PS装置等几套苯乙烯下游装置投产,使我国苯乙烯供应紧张的形势加剧。2007年我国苯乙烯市场仍以卖方市场为主导,高位行情成主流。同时,供应紧张也使我国2007年苯乙烯的进口量在近年逐年下降的趋势下又创新高,达310万吨。 苯乙烯是苯用量最大的衍生物,也是最基本的芳烃化学品。苯乙烯主要用于生产聚苯乙烯(占其需求量约2/3),也可用于制取苯乙烯—丁二烯(丁苯)橡胶(SBR)、ABS和苯乙烯—丙烯腈(SAN)树脂、不饱和聚酯等,此外,苯乙烯也是生产涂料、染料、合成医药的重要原料。 供应结构已发生变化 长期以来,我国苯乙烯产不足需,缺口较大,每年需大量进口,并呈逐年增加趋势。1995年我国苯乙烯的进口量只有30.58万吨,进口量从1996年~1997年40万吨/年上升到1999年103万吨、2000年116万吨、2001年150万吨、2002年179.8万吨,2003年进口量达266.06万吨,2004年和2005年进口量分别达到288.90万吨和281.2万吨。进口/表观消费量比例由2002年66.92%增加到2003年73.85%、2004年74.70%,2005年进口依存度开始下降至69.44%,产量仍满足不了国内对苯乙烯的需求。1999年~2005年进口年均增长率达到23%。在苯乙烯大量进口的同时,还有较多的苯乙烯下游产品进口,对国内市场冲击较大。 近年来,随着一批大型苯乙烯装置的投产,我国苯乙烯供应紧张的形势有所缓解。进入2006年后,我国苯乙烯进口量继续减少,而且下降幅度越来越大,全年进口量为234.3万吨,比2005年同期下降16.7%,这表明我国苯乙烯供应格局已经悄然发生变化,即从2005年开始我国自身的苯乙烯供应增长速度首次超过需求的增长速度,进口出现下降,并维持了这一发展趋势。预计未来几年,随着我国一些大型苯乙烯新扩建装置的陆续建成投产,进口量还会逐渐减少。 近期内扩能趋势 2007~2010年仍是我国苯乙烯产能的大规模增长期,一些新建和扩建项目仍将陆续进行。预计到2008年我国苯乙烯总生产能力将达到约400万吨/年,2010年将达到约600万吨/年,届时我国苯乙烯市场供需矛盾将得到根本缓解。 苯乙烯需求的持续强劲增长,是我国苯乙烯生产不断扩能的原动力。2007年~2008年是我国苯乙烯产能的大规模增长期,而经过新一轮扩能高峰后,预计到2010年,我国苯乙烯市场供需矛盾将得到根本缓解,供需将基本平衡或略有缺口。 将重心由扩能转向提高竞争力 世界苯乙烯的生产能力已经出现过剩的态势。按照目前我国的扩能计划,2010年供需矛盾将得到根本缓解,因此,目前我国苯乙烯产业应该开始将重心由扩能转向提高竞争力。 一是要实现规模化生产,降低成本。我国现已建成上海赛科50万吨/年和惠州中海壳牌56万吨/年规模化装置,但我国大多数苯乙烯装置能力仍偏小,未达到规模生产的要求,加上有些装置生产技术相对落后,生产成本高,经济效益差,缺乏竞争力。 二是应尽快采用先进技术对现有装置进行技术改造,逐步提高装置的生产规模和工艺技术水平,增加产量,降低生产成本,进一步增强我国苯乙烯产品在国内外市场的竞争力。
[font=黑体]41、[/font][font=黑体] [/font][font=黑体]检验检测机构在其组织和管理结构发生变化后,其组织结构、岗位职责、任职要求在[/font][font=黑体] [/font][font=黑体]体系文件中未作清晰描述。[/font]
[align=center][b][/b][/align][align=center][b]二维相关分析用于pH引起的人血清白蛋白二级结构变化的研究[/b][/align]采用二维/衰减全发射红外光谱的分析技术对HSA在不同pH的缓冲体系下二级结构变化的研究,根据吸收峰发生变化的顺序的不同,解释蛋白质的变化过程。通过配制不同pH的缓冲溶液,与HSA混合得HSA-缓冲溶液的体系,利用中红外光谱分析技术对以缓冲溶液为背景,HSA-缓冲溶液体系为样品进行光谱的采集,并对HSA的结构的动态变化进行分析处理。[b][color=windowtext]4.1[/color][color=windowtext]实验仪器与试剂[/color][color=windowtext]4.[/color][color=windowtext]1.[/color][color=windowtext]1[/color][color=windowtext]实验[/color][color=windowtext]仪器[/color][color=windowtext]与软件[/color][/b][align=center][color=windowtext]表[/color][color=windowtext]4-1 [/color][color=windowtext]实验仪器与软件[/color][/align] [table=568][tr][td] [align=center][color=windowtext]仪器[/color][color=windowtext]/[/color][color=windowtext]软件[/color][/align] [/td][td] [align=center][color=windowtext]规格与型号[/color][/align] [/td][td] [align=center][color=windowtext]生产厂家[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]电子分析天平[/color][/align] [/td][td] [align=center][color=windowtext]ME54E[/color][/align] [/td][td] [align=center][color=windowtext]梅特勒[/color][color=windowtext]-[/color][color=windowtext]托利多仪器股份有限公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]磁力搅拌器[/color][/align] [/td][td] [align=center][color=windowtext]温控型[/color][/align] [/td][td] [align=center][color=windowtext]巩义市予华仪器有限责任公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]pH[/color][color=windowtext]计[/color][/align] [/td][td] [align=center][color=windowtext]FE20[/color][color=windowtext]型[/color][/align] [/td][td] [align=center][color=windowtext]梅特勒[/color][color=windowtext]-[/color][color=windowtext]托利多仪器(上海)有限公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url][/color][/align] [/td][td] [align=center][color=windowtext]1000μL[/color][color=windowtext]、[/color][color=windowtext]100μL[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Thermo Fisher[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]容量瓶[/color][/align] [/td][td] [align=center][color=windowtext]500mL[/color][/align] [/td][td] [align=center][color=windowtext]四川蜀牛玻璃仪器厂[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]烧杯[/color][/align] [/td][td] [align=center][color=windowtext]500mL[/color][color=windowtext]、[/color][color=windowtext]50mL[/color][/align] [/td][td] [align=center][color=windowtext]四川蜀牛玻璃仪器厂[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]傅里叶变换红外[/color][color=windowtext]/[/color][color=windowtext]拉曼联用光谱仪[/color][/align] [/td][td] [align=center][color=windowtext]NXR FT-RAMAN[/color][color=windowtext]型[/color][color=windowtext]6700FT-TR[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Nicolet[/color][color=windowtext]公司[/color][/align] [/td][/tr][tr][td] [align=center][color=windowtext]MATLAB[/color][color=windowtext]数据处理软件[/color][/align] [/td][td] [align=center][color=windowtext]2015a[/color][/align] [/td][td] [align=center][color=windowtext]美国[/color][color=windowtext]Mathworks[/color][color=windowtext]公司[/color][/align] [/td][/tr][/table][b][color=windowtext]4.[/color][color=windowtext]1.[/color][color=windowtext]2[/color][color=windowtext]实验材料与[/color][color=windowtext]试剂[/color][/b][align=center][color=windowtext]表[/color][color=windowtext]4-2 [/color][color=windowtext]实验材料与试剂[/color][/align] [table=568][tr][td][color=windowtext]试剂[/color][color=windowtext]/[/color][color=windowtext]材料[/color][/td][td][color=windowtext]规格[/color][color=windowtext]/[/color][color=windowtext]批号[/color][/td][td][color=windowtext]生产厂家[/color][/td][/tr][tr][td][color=windowtext]人血[/color][color=windowtext]清[/color][color=windowtext]白蛋白[/color][color=windowtext]([/color][color=windowtext]Albumin human[/color][color=windowtext])[/color][/td][td][color=windowtext]A9731-5G[/color][/td][td][color=windowtext]S[/color][color=windowtext]igma[/color][color=windowtext]-A[/color][color=windowtext]ldrich[/color][color=windowtext]公司[/color][/td][/tr][tr][td][color=windowtext]二水合[/color][color=windowtext]磷酸二氢钠[/color][/td][td][color=windowtext]分析纯[/color][/td][td][color=windowtext]国药集团化学试剂有限公司[/color][/td][/tr][tr][td][color=windowtext]十二水合[/color][color=windowtext]磷酸氢二钠[/color][/td][td][color=windowtext]分析纯[/color][/td][td][color=windowtext]国药集团化学试剂有限公司[/color][/td][/tr][tr][td][color=windowtext]磷酸[/color][/td][td][color=windowtext]分析纯[/color][/td][td][color=windowtext]国药集团化学试剂有限公司[/color][/td][/tr][/table][b][color=windowtext]4.2 [/color][color=windowtext]实验[/color][color=windowtext]内容[/color][color=windowtext]4.[/color][color=windowtext]2[/color][color=windowtext].[/color][color=windowtext]1 [/color][color=windowtext]样品的[/color][color=windowtext]配制[/color][/b](1)不同pH缓冲液的配制用磷酸配制0.2mol/L磷酸溶液作为A液,用十二水合磷酸氢二钠配制0.2mol/L磷酸氢二钠溶液作为B液。pH计测得A液pH为1.34,B液pH为9.07。利用上述的A液和 B液配制不同pH的缓冲液,配制pH为3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0、5.2、 5.4、5.6、 5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.2的22个不同pH的缓冲溶液,放入到EP管中备用。(2)样品的配制磷酸盐溶液二元体系:取以上22个不同pH的缓冲液中800μL于EP管中,再加入200μL的双蒸水,充分混匀。HSA的磷酸盐溶液三元体系:依次用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]吸取上述22个混合样品800 μL分别加入到不同的EP管中,称取HSA 0.450 g充分溶解后,再分别向各管加入200μL的HSA溶液,充分混匀,所得三元体系HSA的浓度为30mg/mL。[b]4.2.2光谱的采集与处理[/b](1)中红外光谱谱图采集利用仪器傅里叶变换红外/拉曼联用光谱仪(NXRFT-RAMAN型,6700FT-TR,美国Nicolet公司)、金刚石ATR采样附件(Golden Gate ATR),采集中红外光谱,4000-500cm[sup]-1[/sup],2cm[sup]-1[/sup]分辨率,64次扫描,温度为室温(26℃),以空气为背景进行扫描,作为背景光谱,采集不同pH条件下HSA溶液的中红外光谱。(2)二维相关分析利用傅里叶变换红外/拉曼联用光谱仪测得的中红外光谱用MATLAB 2015a软件进行处理得到与pH相关的动态图谱—二维等高图,对所得的二维等高图进行二维相关的处理,计算出二维同步与异步矩阵,并得到二维同步谱图与二维异步谱图。分析二维同步谱图,谱图为主对角线对称图,相关峰出现在对角线上,为正值;交叉峰则出现在非对角线区域,可正可负。[b][color=windowtext]4.3 [/color][color=windowtext]实验结果与讨论[/color][/b][color=windowtext]([/color][color=windowtext]1[/color][color=windowtext])[/color][color=windowtext]H[/color][color=windowtext]SA [/color][color=windowtext]磷酸盐[/color][color=windowtext]溶液[/color][color=windowtext]中红外光谱图预处理结果与分析[/color][color=windowtext]图[/color][color=windowtext]4-1[/color][color=windowtext]为[/color][color=windowtext]pH 3.0[/color][color=windowtext]-[/color][color=windowtext]7.2[/color][color=windowtext]的[/color][color=windowtext]HSA [/color][color=windowtext]磷酸盐[/color][color=windowtext]溶液的经过[/color][color=windowtext]SNV[/color][color=windowtext]处理之后的光谱图[/color][color=windowtext],[/color][color=windowtext]SNV[/color][color=windowtext]与标准化算法计算公式相同,但不同之处是标准化算法是对一组光谱进行处理,而[/color][color=windowtext]SNV[/color][color=windowtext]是对一条光谱进行处理[/color][color=windowtext]。[/color][color=windowtext]进行[/color][color=windowtext]SNV[/color][color=windowtext]处理的主要目的是消除光谱的基线漂移的影响。[/color][align=center][img=,690,339]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131726099980_5308_3237657_3.png!w690x339.jpg[/img][/align][align=center][color=windowtext]图[/color][color=windowtext]4-1pH 3.0[/color][color=windowtext]-[/color][color=windowtext]7.2[/color][color=windowtext]的[/color][color=windowtext]HSA [/color][color=windowtext]磷酸盐[/color][color=windowtext]溶液的经过[/color][color=windowtext]SNV[/color][color=windowtext]处理之后的光谱图[/color][/align]在本章的研究中,主要考察HSA酰胺I区和酰胺II区结构的光谱变化,即1750-1580cm[sup]-1[/sup],图4-2所示从上到下依次为pH7.0、pH4.8、pH4.0和pH3.0的HSA的原始光谱减去对应pH缓冲液的光谱后得到的差谱图,进行差谱的主要目的是扣除水与缓冲盐对光谱的影响。从图中可以看到在酰胺I段在1653cm[sup]-1[/sup]具有明显的吸收峰,这个吸收峰可以归属为α-螺旋的吸收峰,并且在pH下降到3.0时,α-螺旋的特征峰变化较为明显,与pH7.0、pH4.8、pH4.0的光谱图在1653cm[sup]-1[/sup]不一样,吸收峰有所下降,形状也有一定程度的变化。推测在较低的pH条件下,HSA的α-螺旋结构遭到了破坏,因此发生了一定的结构变化。[align=center][img=,690,334]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131726229783_6130_3237657_3.png!w690x334.jpg[/img][/align][align=center]图4-2 HSA 磷酸盐溶液在波长为1750-1580cm[sup]-1[/sup]段的差谱图[/align]图4-3所示为 pH7.0-3.0范围的的HSA的连续小波变换(CWT)光谱,连续小波变化的目的是提高光谱分辨率。CWT应用的关键是选择合适的小波基与小波尺度,参数设置合理时,CWT在扣除无用信息的同时,可以提取出光谱中的有效信息。本章中使用了“Sym2”小波基和20小波尺度获得平滑效果以得到更高的分辨率。可以看出经过小波变换之后,光谱信息得到进一步的分辨,pH7.0下HSA可以保持天然结构,随着pH的降低,可以明显看大部分结构都发生了变化,某些吸收峰甚至消失。[align=center][img=,690,404]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131726350596_917_3237657_3.png!w690x404.jpg[/img][/align][align=center]图4-3 pH7.0-3.0范围的的HSA的连续小波变换光谱[/align]如表4-3所示,是在中红外光谱中,对蛋白质HSA分辨出的一些主要吸收峰进行了结构归属,可以辅助研究不同pH对蛋白质HSA的结构变化的影响。[align=center]表4-3 HSA的分辨出主要吸收峰[/align] [table=568][tr][td] [align=center]峰的波数(cm-1)[/align] [/td][td] [align=center]归属情况[/align] [/td][/tr][tr][td] [align=center] 1745[/align] [/td][td] [align=center]自由COOH基团[/align] [/td][/tr][tr][td] [align=center]1732/1722[/align] [/td][td] [align=center]半氢键结合的COOH基团[/align] [/td][/tr][tr][td] [align=center]1711[/align] [/td][td] [align=center]弱氢键结合的COOH基团[/align] [/td][/tr][tr][td] [align=center]1702[/align] [/td][td] [align=center]中等强度氢键结合的COOH基团[/align] [/td][/tr][tr][td] [align=center]1695[/align] [/td][td] [align=center]强氢键结合的COOH基团[/align] [/td][/tr][tr][td] [align=center]1680[/align] [/td][td] [align=center]β-转角[/align] [/td][/tr][tr][td] [align=center]1667[/align] [/td][td] [align=center]β-转角[/align] [/td][/tr][tr][td] [align=center]1653[/align] [/td][td] [align=center]α-螺旋[/align] [/td][/tr][tr][td] [align=center]1625[/align] [/td][td] [align=center]β-折叠链[/align] [/td][/tr][tr][td] [align=center]1613[/align] [/td][td] [align=center]Side chains[/align] [/td][/tr][tr][td] [align=center]1598[/align] [/td][td] [align=center]COO[sup]-[/sup][/align] [/td][/tr][/table][color=windowtext]([/color][color=windowtext]2[/color][color=windowtext])[/color][color=windowtext]pH 7[/color][color=windowtext].[/color][color=windowtext]2-5[/color][color=windowtext].[/color][color=windowtext]0[/color][color=windowtext]范围内[/color][color=windowtext]HSA[/color][color=windowtext]磷酸盐溶液[/color][color=windowtext]中红外[/color][color=windowtext]光谱的二维相关[/color][color=windowtext]分析[/color]由于在酰胺I区和酰胺II区能代表蛋白质HSA二级结构的吸收峰有重叠,在图4-1、图4-2、图4-3中能表示HSA的二级结构的信息不够详细,又因为二维红外光谱分析能提高图谱的分辨率,所以对不同pH下HSA磷酸盐溶液与磷酸盐溶液的差谱进行二维红外光谱分析。图4-4为pH 7.2-5.0范围内HSA磷酸盐溶液对应的二维相关同步谱(左)和异步谱(右),其中虚线部分为负相关,实线现部分为正相关。从图中可以看出,各吸收峰之间在HSA的质子化过程中具有高度的协同性。[align=center][img=,690,327]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131726485419_7489_3237657_3.png!w690x327.jpg[/img][/align][align=center]图4-4 pH 7.2-5.0范围内HSA磷酸盐溶液的二维相关同步谱(左)和异步谱(右),横、纵坐标均为波数Wavenumber(cm[sup]-1[/sup])[/align]在图4-4的同步谱中,除以上表4-4中得到的特征吸收峰外,另外可以辨识出的峰还包括1637cm[sup]-1[/sup],可以归属为β-strand。HSA中包括98个酸性侧链,包括36个天冬氨酸残基和62个谷氨酸残基和100个含有24个精氨酸、59个赖氨酸和17个组氨酸的侧链结构。在pH= 4.3的溶液中,大约有一半的天冬氨酸和谷氨酸酸性侧链基团发生质子化,因此推测,在pH从7.0到5.0过程中,羧基基团逐渐经历质子活化过程,将1732cm[sup]-1[/sup]和1722cm[sup]-1[/sup]归属为介于自由羧基和弱氢键结合的羧基之间的的半氢键结合状态的羧基基团。Noda规则为一段波长范围内出现异步相关光谱,说明该区域有重叠峰,但在同步谱中该位置没有明显的同步交叉峰,此时同步谱图中同步交叉相关的强度变化是越靠近峰位置中心其相关强度越小,表明峰强度变化方向是反向,而强度一个是增加的情况,另一个则是减小的情况。表4-2为根据Noda规则,已分辨出的吸收峰的变化顺序。[align=center]表4-4 根据同步谱/异步谱得到的交叉峰信息及根据Noda原则得出的pH7.2-5.0的范围内可以分辨的吸收峰的变化顺序[/align] [table=568][tr][td] [align=center]峰(cm[sup]-1[/sup])[/align] [/td][td] [align=center]Ф[/align] [/td][td] [align=center]ψ[/align] [/td][td] [align=center]变化顺序[/align] [/td][/tr][tr][td] [align=center]1739,1628[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1628>1739[/align] [/td][/tr][tr][td] [align=center]1716,1628[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]—[/align] [/td][/tr][tr][td] [align=center]1739, 1682[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1739>1682[/align] [/td][/tr][tr][td] [align=center]1682,1671[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1682>1671[/align] [/td][/tr][tr][td] [align=center]1671,1653[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1653>1671[/align] [/td][/tr][tr][td] [align=center]1682,1653[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1653>1682[/align] [/td][/tr][tr][td] [align=center]1739,1653[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1739>1653[/align] [/td][/tr][tr][td] [align=center]1716,1653[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1716>1653[/align] [/td][/tr][tr][td] [align=center]1727,1653[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1727>1653[/align] [/td][/tr][tr][td] [align=center]1700,1653[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1700>1653[/align] [/td][/tr][tr][td] [align=center]1671,1609[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1609>1671[/align] [/td][/tr][tr][td] [align=center]1637,1609[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1609>1637[/align] [/td][/tr][tr][td] [align=center]1682,1609[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1682>1609[/align] [/td][/tr][tr][td] [align=center]1671,1624[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1624>1671[/align] [/td][/tr][tr][td] [align=center]1624,1609[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1609>1624[/align] [/td][/tr][tr][td] [align=center]1671,1594[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1594>1671[/align] [/td][/tr][tr][td] [align=center]1682,1594[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1682>1594[/align] [/td][/tr][tr][td] [align=center]1609,1594[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1609>1594[/align] [/td][/tr][tr][td] [align=center]1624,1594[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1594>1624[/align] [/td][/tr][tr][td] [align=center]1653,1594[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1653>1594[/align] [/td][/tr][tr][td] [align=center]1653,1637[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1653>1637[/align] [/td][/tr][tr][td] [align=center]1637,1609[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1609>1637[/align] [/td][/tr][tr][td] [align=center]1637,1594[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1594>1637[/align] [/td][/tr][tr][td] [align=center]1637,1624[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1624>1637[/align] [/td][/tr][tr][td] [align=center]1671,1637[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1637>1671[/align] [/td][/tr][/table]由表4-4可得: 1739cm[sup]-1[/sup](自由COOH基团)、1727cm[sup]-1[/sup](半氢键结合的COOH基团)、1716cm[sup]-1[/sup](弱氢键结合的COOH基团)>1653cm[sup]-1[/sup](α-螺旋)>1682cm[sup]-1[/sup](β-转角)>1609cm[sup]-1[/sup](Side chains)>1594cm[sup]-1[/sup](COO[sup]-[/sup])>1624cm[sup]-1[/sup](β-折叠链)>1637cm[sup]-1[/sup](β-strand)>1671cm[sup]-1[/sup](β-转角)。因此除1653cm[sup]-1[/sup]目前在文献中其余的均无归属,此处因峰强度较小可以忽略;异步谱交叉峰峰强度很弱,因此,HSA的异步光谱表明羧基组的氢键的变化先于二级结构变化,二级结构的变化顺序为;先是α-螺旋,其次是高波长β-转角、酪氨酸侧链、β-折叠链、β-股、低波长β-转角。所以,pH(7.2-5.0)在较高情况下,COOH对pH的敏感性要高于α-螺旋结构的敏感性。(3)pH 5.2-4.4范围内HSA磷酸盐溶液中红外光谱的二维相关分析图4-7为pH5.2-4.4范围内的二维相关同步谱(左)和异步谱(右),其中虚线部分为负相关,实线部分为正相关。从图中可以看出,各吸收峰之间在HSA的质子化过程中具有高度的协同性。[align=center][img=,690,321]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131727525262_7281_3237657_3.png!w690x321.jpg[/img][/align][align=center]图4-5 pH5.2-4.4范围内的二维相关同步谱(左)和异步谱(右),横、纵坐标均为波数Wavenumber(cm[sup]-1[/sup])[/align][align=center]表4-5 根据同步谱/异步谱得到的交叉峰信息及根据Noda原则得出的pH5.2-4.4的范围内可以分辨的吸收峰的变化顺序[/align] [table=568][tr][td] [align=center]峰的波数(cm[sup]-1[/sup])[/align] [/td][td] [align=center]Ф[/align] [/td][td] [align=center]ψ[/align] [/td][td] [align=center]变化顺序[/align] [/td][/tr][tr][td] [align=center]1733,1720[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]—[/align] [/td][/tr][tr][td] [align=center]1720,1653[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1720>1653[/align] [/td][/tr][tr][td] [align=center]1697,1653[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1697>1653[/align] [/td][/tr][tr][td] [align=center]1653,1607[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1653>1607[/align] [/td][/tr][tr][td] [align=center]1607,1591[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1591>1607[/align] [/td][/tr][tr][td] [align=center]1653,1591[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1591>1653[/align] [/td][/tr][tr][td] [align=center]1697,1591[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1697>1591[/align] [/td][/tr][tr][td] [align=center]1626,1607[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1607>1626[/align] [/td][/tr][tr][td] [align=center]1636,1626[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1636>1626[/align] [/td][/tr][tr][td] [align=center]1607,1636[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1636>1607[/align] [/td][/tr][tr][td] [align=center]1636,1626[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1636>1626[/align] [/td][/tr][tr][td] [align=center]1653,1636[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1653>1636[/align] [/td][/tr][tr][td] [align=center]1671,1626[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1671>1626[/align] [/td][/tr][tr][td] [align=center]1671,1653[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1671>1653[/align] [/td][/tr][tr][td] [align=center]1671,1591[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1591>1671[/align] [/td][/tr][/table]由表4-5得:1733cm[sup]-1[/sup](半氢键结合的COOH基团)、1720cm[sup]-1[/sup](半氢键结合的COOH基团)、1715cm[sup]-1[/sup](弱氢键结合的COOH基团)>1697cm[sup]-1[/sup](强氢键结合的COOH基团)>1591cm[sup]-1[/sup](COO[sup]-[/sup])>1671cm[sup]-1[/sup](β-转角)>1653cm[sup]-1[/sup](α-螺旋)>1636cm[sup]-1[/sup](β-折叠链)>1626cm[sup]-1[/sup](β-折叠链)>1607cm[sup]-1[/sup](Side chains)>1626cm[sup]-1[/sup]、1671cm[sup]-1[/sup](β-转角)。因此pH 为5.2-4.4时,HSA的异步光谱表明羧基组的氢键的变化先于二级结构变化,即在该pH范围内,羧基对pH 变化的敏感性要高于α-螺旋的敏感性。(4)pH4.6-3.8范围内HSA磷酸盐溶液中红外光谱的二维相关分析图4-6为pH4.6-3.8范围内的二维相关同步谱(左)和异步谱(右)其中虚线部分为负相关,实线部分为正相关。从图中可以看出,各吸收峰之间在HSA的质子化过程中具有高度的协同性。[align=center][img=,690,315]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131728232083_9380_3237657_3.png!w690x315.jpg[/img][/align][align=center]图4-6pH4.6-3.8范围内的二维相关同步谱(左)和异步谱(右),横、纵坐标均为波数Wavenumber(cm[sup]-1[/sup])[/align][align=center]表4-6 根据同步谱/异步谱得到的交叉峰信息及根据Noda原则得出的pH4.6-3.8的范围内可以分辨的吸收峰的变化顺序[/align] [table=568][tr][td] [align=center]峰的波数(cm[sup]-1[/sup])[/align] [/td][td] [align=center]Ф[/align] [/td][td] [align=center]ψ[/align] [/td][td] [align=center]变化顺序[/align] [/td][/tr][tr][td] [align=center]1697,1677[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1697>1677[/align] [/td][/tr][tr][td] [align=center]1677,1668[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1677>1668[/align] [/td][/tr][tr][td] [align=center]1668,1648[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1648>1668[/align] [/td][/tr][tr][td] [align=center]1677,1648[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1677>1648[/align] [/td][/tr][tr][td] [align=center]1668,1636[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1636>1668[/align] [/td][/tr][tr][td] [align=center]1648,1636[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1648>1636[/align] [/td][/tr][tr][td] [align=center]1668,1636[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1636>1668[/align] [/td][/tr][tr][td] [align=center]1668,1682[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1668>1682[/align] [/td][/tr][tr][td] [align=center]1682,1611[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1611>1682[/align] [/td][/tr][tr][td] [align=center]1668,1611[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]—[/align] [/td][/tr][tr][td] [align=center]1636,1611[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1636>1611[/align] [/td][/tr][tr][td] [align=center]1611,1682[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1682>1611[/align] [/td][/tr][tr][td] [align=center]1682,1636[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1636>1682[/align] [/td][/tr][tr][td] [align=center]1611,1604[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]可能来自于同一基团[/align] [/td][/tr][/table]由表4-6得:1738cm[sup]-1[/sup](半氢键结合的COOH基团)、1729cm[sup]-1[/sup](半氢键结合的COOH基团)、1718cm[sup]-1[/sup](弱氢键结合的COOH基团)、1697cm[sup]-1[/sup](强氢键结合的COOH基团]>1677cm[sup]-1[/sup](β-转角)>1648cm[sup]-1[/sup](random coil)>1636cm[sup]-1[/sup](β-strand)>1682cm[sup]-1[/sup](β-转角)>1668cm[sup]-1[/sup](β-转角)、1611cm[sup]-1[/sup](Side chains)、1604cm[sup]-1 [/sup](COO[sup]-[/sup])。由上顺序得,HSA的异步光谱表明羧基组的氢键的变化先于二级结构变化,二级结构的变化顺序为:中波长β-转角、无卷曲构象、β-strand、高波长β-转角、低波长β-转角、酪氨酸残基。因此,pH在4.6-3.8范围内羧基组的氢键对pH的敏感性要高于无卷曲构象、β-strand,但羧基对pH的敏感性要低于无卷曲构象、β-strand。又因异步谱交叉峰峰强度很弱,所以1738cm[sup]-1[/sup]、1729cm[sup]-1[/sup]、1718cm[sup]-1[/sup]、1697cm[sup]-1[/sup]的顺序相当,1668cm[sup]-1[/sup]、1611cm[sup]-1[/sup]、1604cm[sup]-1[/sup]的顺序相当。(5)pH3.8-3.0范围内HSA磷酸盐溶液中红外光谱的二维相关分析[align=center][img=,690,308]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131729083359_5528_3237657_3.png!w690x308.jpg[/img][/align][align=center]图4-7 pH3.8-3.0范围内的二维相关同步谱(左)和异步谱(右),横、纵坐标均为波数Wavenumber(cm[sup]-1[/sup])[/align]图4-7为pH3.8-3.0范围内的二维相关同步谱(左)和异步谱(谱),其中虚线部分为负相关,实现部分为正相关,在异步谱中,仍可分辨出部分的吸收峰,包括1743cm[sup]-1[/sup],1730cm[sup]-1[/sup],1706cm[sup]-1[/sup],1699cm[sup]-1[/sup].与整个的酰胺I和酰胺II区分别形成强的正相关和负相关和正相关和负相关,说明在强酸环境中,羧基组的氢键形成要比其他pH条件范围快得多。[align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131729231532_818_3237657_3.png!w690x365.jpg[/img][/align][align=center]图4-8 pH3.8-3.0范围内的同步谱的透射图,x、y轴均为波数Wavenumber(cm[sup]-1[/sup]),z轴为相对强度)[/align][align=center][img=,690,322]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131729358095_7590_3237657_3.png!w690x322.jpg[/img][/align][align=center]图4-9pH3.8-3.0范围内的异步谱的透射图,x、y轴均为波数Wavenumber(cm[sup]-1[/sup]),z轴为相对强度[/align]在图4-8pH3.8-3.0范围内的同步谱的透射图、图4-9pH3.8-3.0范围内的异步谱的透射图中可以看到,1618cm[sup]-1[/sup]出现强的自动峰,而其他峰因为1618cm[sup]-1[/sup]信号较强而被掩盖掉。1618cm[sup]-1[/sup]可归属为蛋白侧链基团。可以得知,占HSA67%的α-螺旋结构在强酸环境中遭到破坏,吸收峰基本消失。[align=center]表4-7 根据同步谱/异步谱得到的交叉峰信息及根据Noda原则得出的pH3.8-3.0的范围内可以分辨的吸收峰的变化顺序[/align] [table=568][tr][td] [align=center]峰的波数(cm-1)[/align] [/td][td] [align=center]Ф[/align] [/td][td] [align=center]ψ[/align] [/td][td] [align=center]变化顺序[/align] [/td][/tr][tr][td] [align=center]1656,1648[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1656>1648[/align] [/td][/tr][tr][td] [align=center]1648,1640[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1640>1648[/align] [/td][/tr][tr][td] [align=center]1656,1640[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]0[/align] [/td][td] [align=center]—[/align] [/td][/tr][tr][td] [align=center]1648,1633[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1633>1648[/align] [/td][/tr][tr][td] [align=center]1656,1633[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1656>1633[/align] [/td][/tr][tr][td] [align=center]1648,1614[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1614>1648[/align] [/td][/tr][tr][td] [align=center]1633,1614[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1614>1633[/align] [/td][/tr][tr][td] [align=center]1656,1614[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1614>1656[/align] [/td][/tr][tr][td] [align=center]1648,1602[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1602>1648[/align] [/td][/tr][tr][td] [align=center]1656,1602[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1656>1602[/align] [/td][/tr][tr][td] [align=center]1633,1602[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]1602>1633[/align] [/td][/tr][tr][td] [align=center]1656,1589[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1589>1656[/align] [/td][/tr][tr][td] [align=center]1614,1589[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1589>1614[/align] [/td][/tr][tr][td] [align=center]1656,1648[/align] [/td][td] [align=center]+[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]1633>1648[/align] [/td][/tr][/table]由表4-7可知1691cm[sup]-1[/sup]、1648cm[sup]-1[/sup]、1669cm[sup]-1[/sup]、1656cm[sup]-1[/sup]、1648cm[sup]-1[/sup]、1640cm[sup]-1[/sup]、1633cm[sup]-1[/sup]、1614cm[sup]-1[/sup]、1602cm[sup]-1[/sup]、1589cm[sup]-1[/sup]、1743cm[sup]-1[/sup](自由COOH基团)、1730cm[sup]-1[/sup](半氢键结合的COOH基团)、1706cm[sup]-1[/sup](中等强度氢键结合的COOH基团)、1699cm[sup]-1[/sup](中等强度氢键结合的COOH基团)>1589cm[sup]-1[/sup](COO[sup]-[/sup])>1614cm[sup]-1[/sup](Side chains)> 1656cm[sup]-1[/sup](α-螺旋)、1640cm[sup]-1[/sup](α-螺旋)>1602cm[sup]-1[/sup](Side chains)>1633cm[sup]-1[/sup](β-折叠链)>1648cm[sup]-1[/sup](random coil)。pH为3.8-3.0时,HSA的异步光谱表明羧基组的氢键的变化先于二级结构的变化,首先是α-螺旋,其次是酪氨酸残基,β-折叠链等。因此,在pH 3.8-3.0的范围内,羧基对pH的敏感性要高于α-螺旋的敏感性。[align=center][img=,690,335]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131729514171_7621_3237657_3.png!w690x335.jpg[/img][/align][align=center]图4-10不同pH段的二维相关同步谱的能量谱,a、b、c、d四个谱图依次为pH7.2-5.0,5.2-4.4,4.6-3.8,3.8-3.0范围二维相关同步能量谱图[/align]从图4-10中可以看出在这四个pH段的光谱特征具有明显的区别,这些差异意味着在不同的pH条件下HSA的结构发生了明显不同的改变。从图4-11中可以明显看出在不同的pH中蛋白结构发生明显的变化。[align=center][img=,690,492]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131730224583_14_3237657_3.png!w690x492.jpg[/img][/align][align=center]图4-11对异步谱中的1653cm[sup]-1[/sup]的异步谱进行提取的图谱,从上到下依次为pH7.2-5.0、5.2-4.4、4.6-3.8、3.8-3.0范围对异步谱中的1653cm[sup]-1[/sup]的异步谱进行提取图谱[/align][b]4.4结论[/b]本章内容通过广义二维相关红外光谱探究了HSA在酸性条件下解折叠的过程,同步谱和异步相关谱提供了详细的光谱变化。二维相关光谱不仅提供了二级结构的变化信息,并且也能表征羧基基团和侧链结构的变化。在分析中可以看出有至少四种不同氢键结合程度的羧基基团参与了结构变化过程中,在不同的pH范围,均是由羧基结构先发生变化,因此推测在酸性环境中羧基基团的质子化可能是诱发蛋白结构发生变化的重要原因。且在不同pH范围内HSA的二级结构发生变化的过程中,吸收峰发生变化的顺序有所不同。二维相关技术的应用有助于解释蛋白质的变化过程,具有独特的优势。此外,异步谱的应用,可以提供更多的蛋白结构变化信息。虽然分析中得到了谱图相关强度,但是因为有些信号较弱,且差谱之后噪音的存在,这些峰变化的先后的准确性仍需要进一步的确定。此外,应用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]分析技术结合中红外光谱分析技术对pH引起的体系变化仍需要进一步探索,以相互补充和印证。
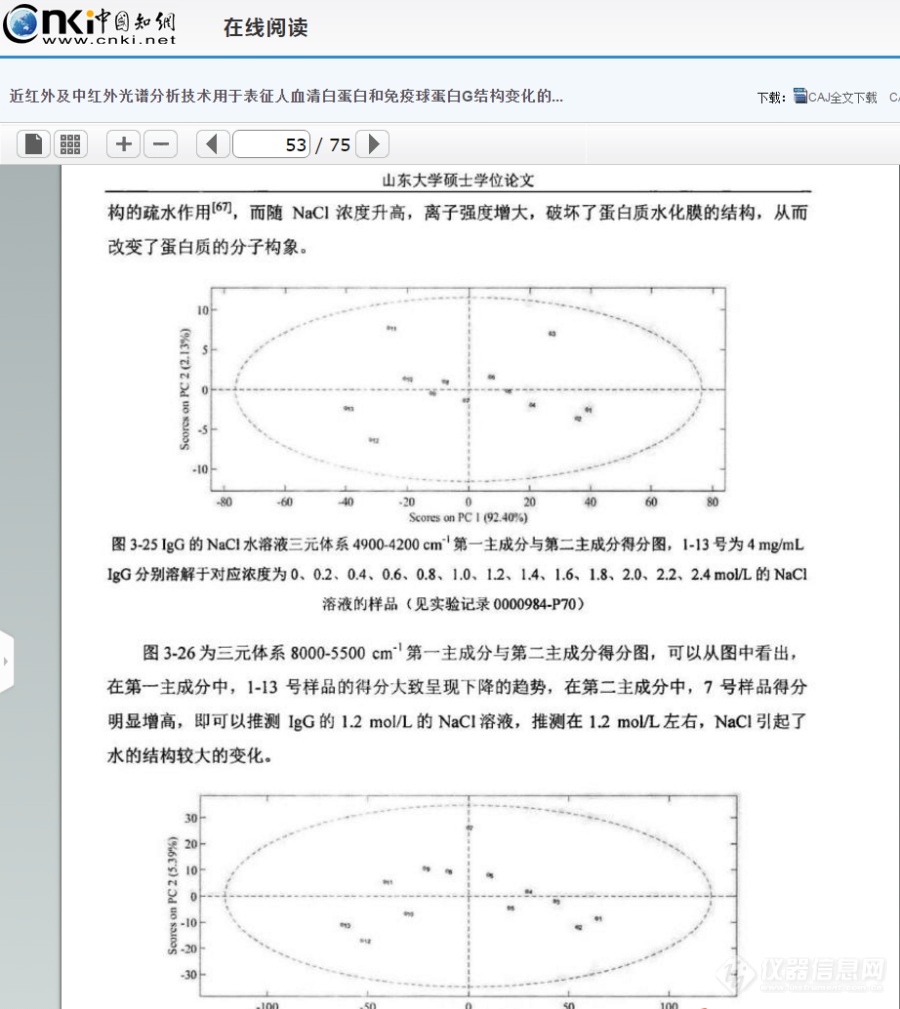
被举报贴链接:https://bbs.instrument.com.cn/topic/7288275。原文链接:http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201901&filename=1019008793.nh&uid=WEEvREdxOWJmbC9oM1NjYkZCbDdrdVdEWGlFakhvQjlCWXJackV1UTlvMUY=$R1yZ0H6jyaa0en3RxVUd8df-oHi7XMMDo7mtKT6mSmEvTuk11l2gFA!!&v=MDkxMjhGdGJGckpFYlBJUjhlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTE9mYitScEZ5emxVcnJJVkYyNkY3TzQ=。[color=#333333]王燕波. 近红外及中红外光谱分析技术用于表征人血清白蛋白和免疫球蛋白G结构变化的研究.山东大学,2018。[/color][color=#333333]硕士论文第三章,完全一样[/color][color=#333333][img=,690,773]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261516354096_5802_2204387_3.png!w690x773.jpg[/img][/color]

被举报贴链接:https://bbs.instrument.com.cn/topic/7288258。原文链接:http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201901&filename=1019008793.nh&uid=WEEvREdxOWJmbC9oM1NjYkZCbDdrdVdEWGlFakhvQjlCWXJackV1UTlvMUY=$R1yZ0H6jyaa0en3RxVUd8df-oHi7XMMDo7mtKT6mSmEvTuk11l2gFA!!&v=MDkxMjhGdGJGckpFYlBJUjhlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTE9mYitScEZ5emxVcnJJVkYyNkY3TzQ=。[color=#333333]王燕波. 近红外及中红外光谱分析技术用于表征人血清白蛋白和免疫球蛋白G结构变化的研究.山东大学,2018。[/color][color=#333333]硕士论文第二章,完全一样[/color][color=#333333][img=,690,770]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261520073606_5918_2204387_3.png!w690x770.jpg[/img][/color]
rt就是结构因子,是随厚度振荡的吗?JEMs里面是否可以做这个计算(不过我没找到)谢谢!
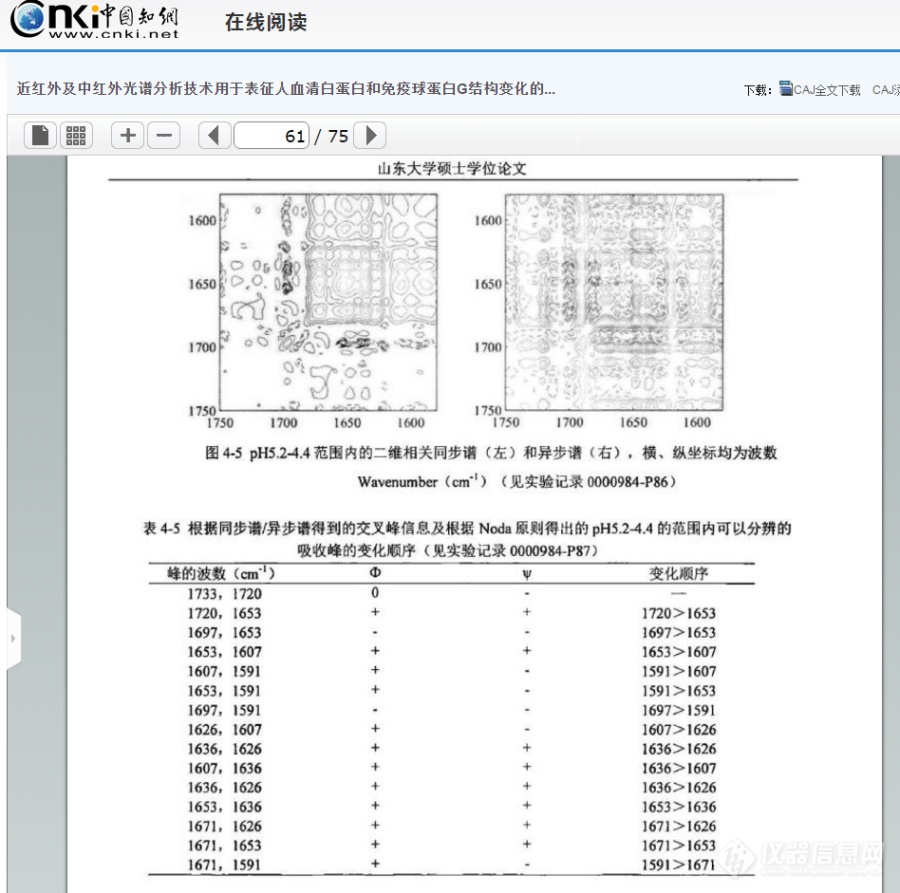
被举报贴链接:https://bbs.instrument.com.cn/topic/7288287。原文链接:http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201901&filename=1019008793.nh&uid=WEEvREdxOWJmbC9oM1NjYkZCbDdrdVdEWGlFakhvQjlCWXJackV1UTlvMUY=$R1yZ0H6jyaa0en3RxVUd8df-oHi7XMMDo7mtKT6mSmEvTuk11l2gFA!!&v=MDkxMjhGdGJGckpFYlBJUjhlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTE9mYitScEZ5emxVcnJJVkYyNkY3TzQ=[color=#333333]王燕波. 近红外及中红外光谱分析技术用于表征人血清白蛋白和免疫球蛋白G结构变化的研究.山东大学,2018[/color][color=#333333]硕士论文第四章,完全一样[/color][color=#333333][img=,690,684]https://ng1.17img.cn/bbsfiles/images/2019/08/201908261510581138_2462_2204387_3.png!w690x684.jpg[/img][/color]
主要想知道酰胺一喝酰胺二的变化情况?
化学变化和化学性质的区别,如蜡烛燃饶是化学变化;蜡烛燃烧时呈现的现象是它的化学性质。物质的化学性质由它的结构决定,而物质的结构又可以通过它的化学性质反映出来。物质的用途由它的性质决定。物质的化学性质与化学变化,变化时都生成了其它的物质,这种变化叫做化学变化,又叫化学反应。化学性质是物质在化学变化中表现出来的性质。如所属物质类别的化学通性:酸性、碱性、氧化性、还原性、热稳定性及一些其它特性。
首先谢谢大家的帮助!我想检测一羟基化合物的降解产物,或者说这个化合物经过了哪些结构变化,不知核磁能不能满足我的要求?如果可以,我应该如何制备样品,需要做哪些核磁才有可能确定出结构变化?
从给出的化合物结构(无相关性的各种无文献支持的结构),能否立马选择合适的溶剂溶澄清,选择出合适的梯度,体系和色谱柱。并能从结构推断出在某些体系中会发生变化,能从结构的角度,解释出原因。或者,从我们实际得到的分析结果(只有一个结果,无其他数据支持),根据结构来阐述清楚原因。
从给出的化合物结构(无相关性的各种无文献支持的结构),能否立马选择合适的溶剂溶澄清,选择出合适的梯度,体系和色谱柱。并能从结构推断出在某些体系中会发生变化,能从结构的角度,解释出原因。或者,从我们实际得到的分析结果(只有一个结果,无其他数据支持),根据结构来阐述清楚原因。
从给出的化合物结构(无相关性的各种无文献支持的结构),能否立马选择合适的溶剂溶澄清,选择出合适的梯度,体系和色谱柱。并能从结构推断出在某些体系中会发生变化,能从结构的角度,解释出原因。或者,从我们实际得到的分析结果(只有一个结果,无其他数据支持),根据结构来阐述清楚原因。
我是做蛋白结构解析的。蛋白与配体具有强亲和性结合,那么每个氨基酸化学位移的变化是否能用化学位移滴定法跟踪,为何?这个问题困扰我的实验,求解……谢谢帮助!
[b]真空烧结炉[/b]的各个结构是相互配合运行的, 任何一个结构出现故障或者使用方式不合理, 都会影响到烧结炉的运行。 我们将针对真空烧结炉的不同结构展开探讨, 优化各结构的内部系统, 以达到能够为设备运行使用减少能源损耗, 达到更理想的燃烧效果。 一、 加热室加热室的作用顾名思义就是在使用阶段能够向炉内提供热量, 只有在热量达到一定的标准设备才能正常运行, 从而使各个结构在系统内发生配合, 从而达到真空烧结的目的。加热器的温度提升变动性比较大, 为了能够在短时间内实现更高效的使用, 通常是由三层温度变化组成的, 可以根据产品的不同类型和要求对系统内部进行调节, 使温度能够与需求的标准保持一致。二、 隔热屏该结构是以圆板和圆筒形状出现的, 能够将热量与外部环境相隔离, 这样既能保障使用阶段的安全性, 同时也能避免能源损耗。 该结构在系统中处于封闭的状态, 并且由多层结构组成, 投入使用后的隔热效果也更理想。 圆板和圆筒一起组成隔热屏, 形成封闭并且呈现真空状态, 当温度由在隔热屏中向周边散发时, 真空部分也能起到保护作用, 达到更理想的使用效果。三、 低温冷阱阱广泛用于超高真空( 或高真空)系统,作用类似于挡板,一般真空烧结炉为提升燃烧的效率, 并节省时间, 会采用低温冷阱的形式来降炉内的空气抽离, 这样能够确保在真空的环境下运行使用, 才能避免出现使用不稳定现象, 并达到设备的安全控制标准。四、 真空测量真空测量是针对炉内运行使用状态来进行的。 测量是定期进行的, 达到间隔时间后, 测量模块能够自动导通。 由于烧结炉的规模比较大, 使用期间检测得到的参数中存在很大的变化因素, 因此误差是不可以避免的。 虽然目前的技术理念已经十分成熟, 但在使用时仍然需要对现场设备采取全面监控的方法, 以确保燃烧效率能够达到预期标准。
冷热冲击试验箱又名高低温冲击试验箱,冷热冲击试验机具有试验空间大的特点,为材料研究及工业生产厂家的批量或者电子電器零部件﹑自動化零部件、半成品﹑金属、化學材料、通訊元件、國防工業、航太、兵工業、bga、pcb基扳電子晶片,测试其在瞬间经高温、低温的连续温度变化环境下所能忍受的程度,试验其在急遽变化的温差条件下热胀冷缩所引起的化学变化和物理伤害。冷热冲击试验箱之所以能实现急遽变化温差是因其有以下4个特性所支持。 1.产品外形美观、结构合理、工艺先进、选材考究,具有简单便利的操作性能和可靠的设备性能。 2.二箱吊篮式结构,上部为高温箱,下部为低温箱,衝擊方式採用高溫箱,低溫箱靜止,试料部件通过上下移动之吊拦快速移动到高、低溫箱内,从而實現冷熱衝擊測試目的. 3.採用采用最先进的计测装置,控制器采用大型人機觸控對話式lcd人機介面控制器,,中英文液晶显示画面,可进行各种复杂的程序设定,程序设定采用人机对话方式;操作簡單,學習容易,穩定可靠. 4先进科学的空气流通循环设计,使室内温度均匀,避免任何死角;完备的安全保护装置,避免了任何可能发生安全隐患,保证设备的长期可靠性;
以下几种水果在冷藏后甜度变化相对较小: [color=initial]一、苹果[/color] [list=1][*] 耐储存特性 [list][*]苹果通常具有较厚的果皮,这在一定程度上起到了保护作用,减少了外界环境对果实内部的影响。果皮可以阻挡水分流失和氧气进入,减缓果实的呼吸作用和新陈代谢。[*]例如,富士苹果在冷藏条件下可以储存较长时间,其甜度变化相对较小。这是因为苹果在采摘后,内部的淀粉会逐渐转化为糖分,这个过程在冷藏条件下虽然会变慢,但仍在持续进行,使得苹果在冷藏后甜度不会明显降低。[/list][*] 适宜的冷藏温度 [list][*]苹果适宜的冷藏温度一般在 0-4℃之间。在这个温度范围内,苹果的呼吸作用和代谢活动受到抑制,但不会完全停止。苹果中的糖分和有机酸等物质的变化相对较小,从而保持了较为稳定的甜度。[*]例如,将新鲜采摘的苹果放入冰箱的冷藏室中,在适宜的温度下储存一段时间后,苹果的口感和甜度仍然较好。[/list][/list] [color=initial]二、梨[/color] [list=1][*] 高糖含量和耐储性 [list][*]梨的果实中含有较高的糖分,如葡萄糖、果糖和蔗糖等。这些糖分在冷藏条件下相对稳定,不易发生快速的分解或转化。同时,梨也具有一定的耐储存性,其果皮较厚,能够保护果实内部的组织和成分。[*]例如,库尔勒香梨在冷藏后,其甜度变化不大。这是因为库尔勒香梨本身糖分含量高,而且果实结构较为紧密,冷藏过程中能够较好地保持其甜度和口感。[/list][*] 对低温的适应性 [list][*]梨对低温有一定的适应性,在适当的冷藏温度下,梨的生理活动减缓,但不会对果实的品质产生显著影响。冷藏可以延长梨的保鲜期,同时保持其甜度和风味。[*]例如,将鸭梨放入冰箱冷藏,在一段时间内,鸭梨的甜度和口感基本保持不变。这是因为梨在冷藏过程中,其内部的代谢活动受到抑制,糖分的消耗较少,从而甜度变化较小。[/list][/list] [color=initial]三、葡萄[/color] [list=1][*] 果皮保护作用 [list][*]葡萄的果皮具有一定的保护作用,可以减少果实内部与外界环境的接触,从而减缓水分流失和氧化反应。在冷藏条件下,果皮能够帮助葡萄保持相对稳定的内部环境,减少甜度的变化。[*]例如,巨峰葡萄在冷藏后,其甜度变化较小。这是因为巨峰葡萄的果皮较厚,能够在一定程度上保护果实内部的糖分和其他成分,使其在冷藏过程中不易发生明显的变化。[/list][*] 适宜的冷藏条件 [list][*]葡萄适宜的冷藏温度一般在 0-5℃之间。在这个温度范围内,葡萄的呼吸作用和代谢活动受到抑制,能够较好地保持其新鲜度和甜度。同时,冷藏还可以延缓葡萄的成熟和衰老过程,延长其保鲜期。[*]例如,将新鲜的葡萄放入冰箱的冷藏室中,在适宜的温度和湿度条件下储存,可以保持葡萄的甜度和口感较长时间。[/list][/list] [color=initial]四、橙子[/color] [list=1][*] 丰富的糖分和有机酸 [list][*]橙子中含有丰富的糖分,如蔗糖、葡萄糖和果糖等,同时还含有一定量的有机酸,如柠檬酸、苹果酸等。这些成分在冷藏条件下相对稳定,能够保持橙子的酸甜口感。[*]例如,赣南脐橙在冷藏后,其甜度变化较小。这是因为赣南脐橙本身糖分含量高,而且有机酸的含量也适中,冷藏过程中能够较好地保持其酸甜平衡,从而使甜度变化不明显。[/list][*] 较厚的果皮和紧实的果肉 [list][*]橙子的果皮较厚,能够起到一定的保护作用,减少外界环境对果实内部的影响。同时,橙子的果肉较为紧实,细胞结构紧密,能够在一定程度上保持果实内部的水分和糖分,使其在冷藏过程中不易流失。[*]例如,将新鲜的橙子放入冰箱冷藏,在一段时间内,橙子的口感和甜度仍然较好。这是因为橙子的果皮和果肉结构能够在冷藏过程中保护果实内部的成分,使其甜度变化较小。[/list][/list]
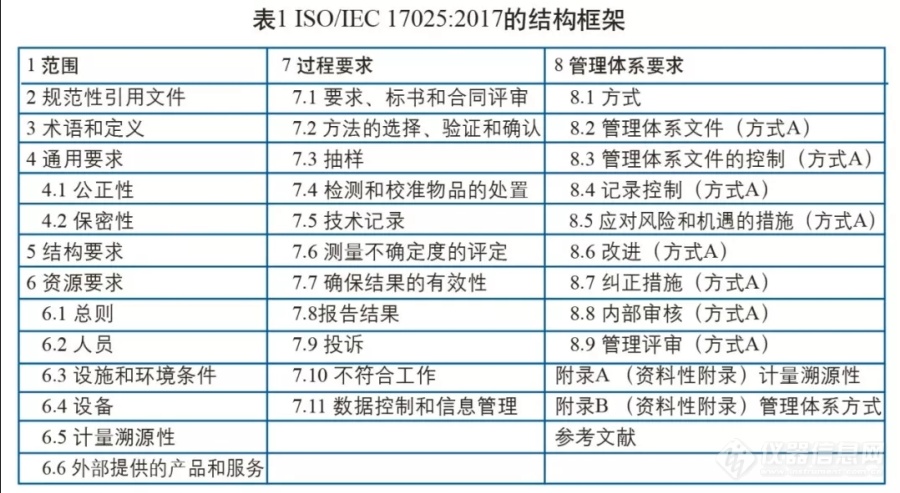
[color=#ff0000]此篇文章是认可委张明霞主任的文章,对实验室了解新版标准有很好的借鉴意义。故分享给大家!以下正文[/color][align=center]=======================================================================[/align]ISO/IEC 17025:2017与ISO/IEC 17025:2005的主要变化文/张明霞 富巍 贺甬【摘要】此次ISO/IEC 17025修订在结构框架和公共要素上与CASCO的要求相统一,管理要求上与ISO 9001:2015相协调,采用新版的术语标准,引入了风险管理、判定规则、免责声明和信息管理系统等内容,在人员、设备、计量溯源性、结果报告、内部审核和管理评审等方面都有重要变化。一、结构框架和公共要素的统一按照ISO/CASCO的要求,新版ISO/IEC 17025的结构框架必须满足“CASCO决议12/2002”的规定,相关表述必须满足CASCO内部文件QS-CAS-PROC/33《ISO/CASCO标准中的公共要素》的要求。修订后的ISO/IEC 17025结构框架见表1。[img=,690,378]http://ng1.17img.cn/bbsfiles/images/2018/02/201802091748010826_2495_1619176_3.jpg!w690x378.jpg[/img]