[b]职位名称:[/b]北大事业编招聘-双束(FIB/SEM)/冷冻电子断层扫描(cryo-ET)技术主管[b]职位描述/要求:[/b]【岗位职责】1、负责平台Cryo-FIB/SEM双束显微镜和冷冻光学显微镜的日常运行及维护;2、培训、协助用户使用Cryo-FIB/SEM双束显微镜和冷冻光学显微镜制备样品;3、辅助相关课题组合作开展光电联用及冷冻电子断层扫描技术路线的研发、优化;4、协助平台管理其他电镜及附属设备。【岗位要求】1、政治立场坚定,具有良好的职业道德,诚实守信,爱岗敬业,工作细心踏实,服务意识和责任心强;2、能够熟练掌握双束显微镜(FIB/SEM)使用,专业不限;3、具有Cryo-FIB冷冻生物样品制备或者电子断层扫描经验者优先;4、具有博士学位,具备较强的语言表达能力,英语水平较好,学术论文写作能力较强 5、热爱仪器管理工作,新技术研发工作,工作积极主动、认真负责,具备良好的团队协作能力。【薪酬福利】此岗位属北京大学事业编人员,可申请副高级职称,可协助申请学校、国家技术创新类基金,可申请学校政策性住房,子女可入学北大附属幼儿园、小学、中学就读,薪资可面议。特别优秀者(比如受过良好的科研训练、有较高的英语或计算机水平)可提供有竞争力的薪酬。[b]公司介绍:[/b] 作为北京大学双一流重点建设项目,北京大学于2015年启动了学校冷冻电镜平台和学科的建设,2017年平台正式运行。平台目前拥有总价值约1.1亿元的电镜和各类样品制备仪器,其中包括2台高端300 kV Titan Krios G3冷冻透射电子显微镜(K2 Gif 相机、相位板)、一台200 kV Talos Arctica(K2相机)冷冻透射电子显微镜。2020年将购置冷冻双束扫描电镜和光电关联显微镜...[url=https://www.instrument.com.cn/job/user/job/position/70076]查看全部[/url]
我主要是想观察一下纳米颗粒在高分子树脂体系里的分布状态,还有加入纳米颗粒前后分子间氢键变化的情况!谁知道国内哪家单位有“冷冻电子显微镜”???最好是能够对外单位开放的,先在这里谢过了!!!问题:冷冻电子显微镜与扫描电镜的区别在何处? 答:冷冻电镜是透射电镜,看物体内的具体结构;而扫描电镜是利用探针扫描,对大分子不能扫到分子内部,而是表面形貌,不可能是分子内部的结构。如果是研究原子水平,没有问题。但一旦涉及到大分子,就要出现问题了。

结构生物学是用物理学方法在原子水平阐明生物大分子的三维结构,进而诠释生物大分子的生物学功能及其分子机制的科学。近几年,冷冻电镜在生物物理,特别是结构生物学领域掀起了一轮新的革命。冷冻电镜技术包括单颗粒技术和原位冷冻电镜技术,2017年单颗粒技术已获得诺贝尔奖,放眼未来,冷冻电镜更多的是要应用于获取细胞和组织样品的原位信息,尤其是利用冷冻电镜电子断层扫描成像技术(Cryo-ET)获得三维图像,将细胞内的生命过程可视化,在原位对生物大分子的结构进行解析,并进一步分析其与所处周围环境之间的相互作用关系,进而阐明其发挥功能的分子机制。蛋白质聚集是许多神经退行性疾病的典型症状,包括帕金森病(Parkinson’sdisease)、亨廷顿病(Huntington’sdisease)、以及肌萎缩侧索硬化症(amyotrophiclateral sclerosis)等,至今为止还没有针对这类疾病的有效治疗方案,因此了解这类疾病的致病机理尤为重要。在细胞内表达这些疾病相关的蛋白会导致细胞毒性以及形成大的胞内包涵体,然而这些包涵体的具体致病机理还不清楚,而且这些包涵体的组成以及其精细的细胞原位结构信息也无人知晓。为了回答这一科学问题,德国马克斯普朗克生物化学研究所Baumeister教授组的研究人员利用先进的冷冻电镜光电关联技术(Cryo-CLEM)、冷冻聚焦离子束切割技术(Cryo-FIB)、以及冷冻电子断层扫描三维重构技术(Cryo-ET),在小鼠原代神经细胞原位解析了亨廷顿基因1号外显子中衍生的多聚谷氨酰胺(polyQ)所形成的包涵体及其微环境的原位精细结构,相关结果发表在2017年9月的Cell杂志。他们发现polyQ包涵体是由淀粉样肽的纤维构成,与细胞的内膜系统特别是内质网相互作用,使内质网膜发生形变并扰乱其组成,还改变了包涵体周围的内质网膜的动态性。该研究结果暗示淀粉样肽的纤维和内质网的异常相互作用导致了蛋白质聚集物所产生的细胞毒性。[align=center][img=,690,424]https://ng1.17img.cn/bbsfiles/images/2018/11/201811271518599236_8463_3224499_3.jpg!w690x424.jpg[/img][/align]2018年3月,该研究组在PNAS杂志发表在酵母系统内的polyQ原位分子的结构解析,他们发现在酵母细胞内polyQ蛋白聚集体形成了无定形的包涵体以及少量的纤维丝,并使线粒体和脂滴的形态发生变形。对比这两种不同的机体系统下的差异,我们可以看到同样的polyQ蛋白聚集体在不同的环境中采用了不同的构像并利用特定的机制来靶向不同的细胞结构,从而产生细胞毒性。[align=center][img=,690,770]https://ng1.17img.cn/bbsfiles/images/2018/11/201811271519325828_4209_3224499_3.jpg!w690x770.jpg[/img][/align]另外,2018年2月的Cell杂志报道了该研究组在大鼠神经细胞原位解析了一种重复短肽(poly-GA)蛋白聚集体及其微环境的结构,不同于polyQ形成的纤维状结构,poly-GA聚集体是由平面扭曲的长短不一的丝带状结构组成。poly-GA聚集体大量募集了26S蛋白酶体复合物,而其他生物大分子如核糖体或分子伴侣却被排除在聚集体外部。与poly-GA的直接相互作用使蛋白酶体处于失活状态,虽然在整体水平上细胞内的蛋白酶体表达量没有变化,但有功能的蛋白酶体的数量大幅减少,揭示了蛋白质聚集物所产生细胞毒性的另一原因。[align=center][img=,690,378]https://ng1.17img.cn/bbsfiles/images/2018/11/201811271519469883_8555_3224499_3.jpg!w690x378.jpg[/img][/align]Baumeister教授组是Cryo-CLEM、Cryo-FIB以及Cryo-ET等关键技术方法发展的开拓者和领航者。Cryo-CLEM-FIB-ET即是在整个细胞内定位荧光标记的特定目标分子,观察其动态变化并在感兴趣的时刻进行快速冷冻,然后转移到冷冻扫描电镜利用冷冻聚焦离子束进行光电关联匹配,精确定位目标分子位置并进行聚焦离子束切割产生一层100-200nm厚的切片,最后利用冷冻电子断层扫描成像从原子分辨率上解析其未被破坏的天然原位结构信息。目前冷冻光电关联的一大瓶颈是光镜的分辨率较低,虽然超分辨光电关联技术在飞速发展,但是其缺点如高强度激光照射可能使样品升温,成像速度慢等还需要一一克服。超分辨光电关联令人振奋的一大潜在应用是来精确指导冷冻聚焦离子束切割,使得大的细胞样品中的任何感兴趣目标分子都能被精确定位切割,进而进行高分辨率数据收集。另外,随着技术进一步发展,用高电子密度标签来标记目标分子并在电镜下直接成像也将会成为可能。结构生物学的终极目标是了解细胞生命过程中每一个分子的结构、功能以及它们之间的相互作用,Cryo-CLEM-FIB-ET则是在结构生物学与细胞生物学之间架起的一座桥梁,让细胞内的微观生命动态过程可视化![b]参考文献[/b]1. Bauerlein,F. J. B., et al. 2017. In Situ Architecture and Cellular Interactions of PolyQInclusions. Cell 171(1): 179-187.2. Guo, Q., etal. 2018. In Situ Structure of Neuronal C9orf72 Poly-GA Aggregates RevealsProteasome Recruitment. Cell 172(4): 696-705.3. Gruber, A.,et al. 2018. Molecular and structural architecture of polyQ aggregates inyeast. Proc Natl Acad Sci U S A. .4. Wolff, G.,et al. 2016. Towards correlative super-resolution fluorescence and electroncryo-microscopy. Biol Cell 108(9): 245-258.Oikonomou, C. M. 2017. Cellular ElectronCryotomography: Toward Structural Biology In Situ. Annu Rev Biochem 20(86):873-896.来源:【生物成像中心】
5月29日,清华大学生命科学院博士生张森森的蛋白样品9时准时在液氮环境下进入冷冻电镜。几天后,埃(10-10)级精度的蛋白质“高清3D彩照”将出炉。研究人员可以“直视”单个蛋白质的分子结构,并解出生命运转机理。 这期间,冷冻电镜中的电子枪将持续发射电子,每次看一个小单元。为了解释这个“小单元”,张森森为科技日报记者示意了一个“镊子尖”大小的小金片,“金片上约有200个左右的均匀小孔,每个小孔中再分150个小孔,电子束一次只‘看’其中一个小孔。”金片类似蛋白质的“载玻片”,与光学显微镜不同的是,载玻片透光,小金片要透电子,容许电子束透过样品时受到散射。散射信号被捕捉记录下来,计算后可呈现分子结构。 透射式电镜的生产能力是冷冻电镜制造能力的基础之一。“国内没有一家企业生产透射式电镜。”赛默飞公司技术支持陈宝庆说得不假思索,他毕业于北京大学地球物理专业,对行业非常了解,他介绍,“之前还有几个企业制造,比如原江南光学仪器厂现在就不造了。”[align=center][img=,450,324]http://img1.17img.cn/17img/images/201806/insimg/5bbc5225-5cff-4593-b15c-7a70f246a589.jpg[/img][/align][align=center][color=#00b0f0]透射式电镜[/color][/align] [b]能做到单电子束控制的灯丝,只有进口[/b] “理论上说,只要施加足够强的电场,电子就会从材料中‘游’出来。”陈宝庆说。但“游”的状态与可以使用的电子状态相距甚远。 什么样的电子才能为蛋白质拍摄高清3D彩照呢?东南大学材料科学与工程学院万克树教授描述了理想的状态:速度完全一样的电子,从“源头”的一个点上、非常多地发射出来。 “这些要求是相互矛盾的。”万克树解释,电子从材料表面溢出,要发射电子多,面积就要大,但是面积大了就难以满足一致性要求。 如果把电子枪想象成一把枪,它必须以“狙击”的精度完成机枪的扫射,“子弹”的角度、速度完全一致。 “电子的能量要做到高度一致,虽还达不到激光的程度,但也必须是很窄的分布。”陈宝庆解释,电子“子弹”一致性是提高图像分辨率的前提。 为此,电子枪的核心构造其实是一根极细的“陀螺针”,形似陀螺,尖端却比针还细。电子从尖端出发,在真空的环境下,前去与大分子“相撞”,进而反映出分子构象。 “之前的技术路线是通过加热让电子枪发射电子,发射源(俗称“灯丝”)用钨丝或六硼化镧,需要2500℃左右,高温促使电子发射,但也使电子异常活跃、难以控制,因此热发射电子枪的电镜精度低。”万克树说。 “场发射是通过高压电场,把电子从‘灯丝’里拉出来,室温下可完成。”万克树说,“所用灯丝国内没有生产,全部依赖进口,每根上万美元左右。” 他提到的常温场发射枪(肖特基电子枪)是将氧化锆沉积在单晶钨的晶体的特定面上。FEI公司后来在电子枪生产上又有了新的突破,将热和场结合起来,稳定性进一步提升。在清华大学冷冻电镜实验室的仪器介绍中可以看到,一台2013年购买、2015年到货的最新型号电镜在电子枪一栏标明“X-FEG”,有中文翻译为超稳定高亮度电子枪。“所用灯丝在材质上与之前的一致,工艺不同能够使亮度更强。”陈宝庆介绍。 [b] 上了邮票的科研成就,被中断[/b] 场发射的另一个关键部分是牵拉出电子的外加电场,电场电压高达300千伏。“在这样的高压下保持电压稳定,才能‘拉’出稳定一致的电子,专业上称为‘单色性好’。”万克树说。 据题为《中国透射式电子显微镜发展的历程》的文章记载,1963年,我国就开始了高压100kV电子枪稳定因素探讨的实验,1965年完成样机,中国自主研制透射式电镜于1979年达到当时的国际先进水平,还专门为国产的电子显微镜发行过纪念邮票。 该领域的研发却由于种种原因一度中断。“直到几年前,中国也试图重启这方面的公司,也曾立项想要完成场发射透射电镜的自主研发。”陈宝庆回忆,曾经有相关的科研人员,辗转找到他询问,为什么FEI公司没有相关专利。 “他们想到的捷径之一是把生产厂商的专利拿来参考,但是其中很多生产工艺是秘方级别的,根本不会外传。”陈宝庆说。 [b]从“看人影”到“辨雀斑”,中国研发没使上劲[/b] “如今,中国只有一家企业生产扫描电镜,透射电镜完全不生产了。”陈宝庆说,德国蔡司公司也停止了透射电镜的生产,目前世界上生产透射电镜的厂商只有3家,分别是日本电子、日立、FEI(2016年被赛默飞公司以42亿美元收购。) 没有市场是设备巨头纷纷放弃透射电镜的原因。“透射电镜之前的清晰度,使得冷冻电镜在科学研发上基本没有实际作用。”陈宝庆说。可以理解为,以前只能看清楚个人影,现在却能辨认清楚脸上的雀斑。 除了电子枪的原理变化,冷冻电镜上其他的技术精进,例如三维重建算法的实现、样品制作机器人的研发成功等,使得冷冻电镜的分辨率大规模提升,成为生命科学研究的利器。 在冷冻电镜从“看人影”到“辨雀斑”的发展历程中,中国没有使上劲。在冷冻电镜实验室中,从耗材到配件都必须进口。“加样台10万元一个、小金片50元一个、外托150元一个??”张森森说,所有匹配冷冻电镜使用的工具都需要原装,根本不存在“山寨版”。零件坏了找不到人修理,只能等待零件邮寄到货后进行更换。对于中国的冷冻电镜使用者们来说,这样的体验可能还要持续不短的时间。

云昏无复影,冰合不闻湍:冷冻固定术冰封一向是有效的保存手段,古今中外,概莫能外:曹操筑铜雀三台之冰井台,设计以储存冰块食物等;传媒大亨默多克冷冻精子,使随后降生的女儿获得数亿资产继承权;就连赛柏坦星人威震天都在冰里呆了9000多年。水结冰后会阻碍原先在溶液状态下快速的物质交换与扩散,低温使得化学过程速率降低:绝大多数代谢过程变得非常非常慢以至于我们难以察觉,这个技术叫做冷冻固定术(Cryo-fixation)。应用冷冻固定术,在低温下使用透射电子显微镜观察样品的显微技术,就叫做冷冻电镜(CryoEM)。冷冻电镜是重要的结构生物学研究方法,与之地位相当的另两种技术是X射线晶体学(X-ray crystallography)和核磁共振(NMR),这些方法都是为了获得生物大分子的结构以了解其功能。冷冻电镜,就是把样品冻起来然后保持低温放进显微镜里面,高度相干的电子作为光源从上面照下来,透过样品和附近的冰层,受到散射。我们再利用探测器和透镜系统把散射信号成像记录下来,最后进行信号处理,得到样品的结构。听起来很简单?在过去的一年半的时间里,冷冻电镜技术完成了自上世纪70年代以来最大的技术飞跃,很多结构生物学组集体转向冷冻电镜,不再吭哧吭哧的结晶了。就在上周,Nature上线了几乎是诺奖级别的冷冻断层成像论文,按照老板的话说:“任何放进显微镜的东西都成了金子,我这辈子从来都没有见过这样的景象。冷冻电镜的黄金时代真的来临了。”http://ng1.17img.cn/bbsfiles/images/2017/10/2015051314515917_01_2086240_3.jpg图一:冷冻电镜工作原理,得到的照片信噪比较低松迥月光先照鹤,寺寒沟水忽生冰:快速玻璃化有些人可能读过雪中僵卧不须悲:液氮中的来生 - 随手干货解救战火知乎 - 知乎专栏 是关于如何冷冻生物并且使之不变性的。简单的把样品冻起来只会让它在水结冰的过程中变形扭曲:冻过的肉味道可不怎么样。我们需要让水结成固体,但不是晶体的冰。在变成固体的过程中不能有大的形变。这种条件非常苛刻:谁能冻一罐未开封的可乐,易拉罐最后还不形变的?大实验室都采用冷冻机器人,能够控制点样时的湿度和温度,保证用特制滤纸擦过样品之后,残留的部分保持恒定,不会太厚也不会干掉,然后在封闭环境中以高速扎进用液氮冷却的液态乙烷中。这种方式的冷却速度如此之快,使得水分子还来不及转向就被固定在了原处,在数毫秒之内就完全冻好了。以这种方式制得的冰不是晶体,而是无定形态,在电镜下是透明的:玻璃也处于无定形态,玻璃化的名称由此而来。样品就镶嵌在无定形冰中,定在真实的一瞬。http://ng1.17img.cn/bbsfiles/images/2017/10/2015051314522943_01_2086240_3.jpg图二:GroEL镶嵌在冰中洛阳亲友如相问,一片冰心在玉壶:高性能显微镜材料齐了,有个金刚钻是十分重要的。你知道一台最好的可以做冷冻电镜的透射电子显微镜需要多少钱吗?现在得450万美元。你还别嫌贵,这还只包括显微镜,不含什么电子探测器啦,球差矫正器啦,能量过滤器啦,相位板啦……全加起来保守估计600万美元,另加上每年数十万美元的仪器维护费:只有真的土豪才能负担的起。我们有全球第二台,中科院生物物理所有一台,清华有三台……土豪我们做朋友。显微镜贵,体现在以下几处优点:第一是加速电压高,电子能穿透厚样品。加速电压高导致显微镜巨大,我们必须挖开天花板,并且在地下最底层往下挖才勉强把它放进去。第二是透镜多,各种矫正,光线各种平行,球差各种小,相干度各种好。第三就是样品台稳定,其他组的破镜子每照一张之前需要10分钟稳定样品台(就是干等着),最好的20秒就足够,效率至少是30倍。第四就是全自动,自动换液氮,自动换样品,自动维持清洁,我在家里就能把砖搬了。听说最近国内一些地方准备花大价钱买,世界各处也在招人,希望等我毕业的时候还有些坑留着。http://ng1.17img.cn/bbsfiles/images/2017/10/2015051314525772_01_2086240_3.jpg图三,房顶得被挖开。心同野鹤与尘远,诗似冰壶见底清:高效率探测器终于要到正题了,为什么过去一年半会有如此大的进展了:关键在于显微镜底部的电子探测器。目前常用的高级电子显微镜是300kV加速电压的,在300keV的电子的轰击下,大部分器件都会被打烂。在最新一代的电子探测器出现之前,我们使用电荷耦合器件(CCD),就是电子照下来要先打在荧光层上变成光信号,然后CCD再把光信号转成电信号生成图像。多余的一次光转换降低了效率。在冷冻电镜中,样品对电子剂量非常敏感,同一个地方看的时间长了就会被电子打爆,所以每个电子都非常的珍贵。最新的技术能够直接把电子抓下来,并且利用和超分辨荧光显微镜类似的技术来数电子,甚至可以对单个电子进行局部定位,把对比度提到了只在梦里才能想见的地步。因为这个探测器,许多以前不起作用的算法都能用了,看不见的蛋白质可以找到了,不用再一张一张的扫底片了。想买新的直接电子探测器?准备好100万美元,然后砍砍价。虽说是电子产品,但我觉得摩尔定律在这里不适用。间关莺语花底滑,幽咽泉流冰下难:漂移矫正一般来说,在拍摄某一样品的过程中,我们假设样品是不会自己动的:你拿相机拍运动的东西,曝光时间一长就会糊掉。冷冻电镜也有这个问题:电子束哗哗的穿过样品,这些无定形冰就会变软,变形,带着样品移动。因为无定形冰不是晶体,所以在外部强能流的影响下就会展现出些水的性质:这种流动虽然慢,却在电子显微镜下被万倍的放大,成为限制数据质量的大问题。有了高效探测器,我们可以把之前的1次曝光分解成30多次并且保证总电子量不变,由拍照片变成了拍电影,再把这些电影合并成一张近乎于完美的照片。就这样,冷冻电镜的拍摄技术达到了前所未有的高度。http://ng1.17img.cn/bbsfiles/images/2015/05/201505131453_545889_2086240_3.jpg图四:组里很久之前的结构,病毒相对好做。目前一般的蛋白,甚至是膜蛋白都能做到类似的程度。这种技术有多疯狂?老板经常拿他的朋友Yifan举例,2013年一年可以发4篇nature正刊,一篇nature method,一篇cell,手下博士后直接去Harvard开始tenure track,北大生命科学院前院长饶教授发博文说是诺贝尔奖级别的工作。我们自己组里也有Cell, Nature, Science,大多是投了就中,很少被拒。实验室几个师兄开心的找教职,各大制药公司各种招会冷冻电镜的来测试新药可靠性,工作一点儿问题都没。不要黑生科,我们是学物理和信号处理的。作者:Hydro Ding,无各种良好嗜好 看到好文忍不住想分享,如有冒犯,实在抱歉,可发站内信给我删除此文。(来自互联网)
2018年11月19日,南方科技大学冷冻电镜中心揭牌仪式在南科大生物楼举行。2017年诺贝尔化学奖获得者、冷冻电镜技术开创者之一Richard Hendersen,深圳市发改委副主任蔡羽,南方科技大学校长陈十一,中国科学院院士隋森芳等出席仪式。[align=center][img=1.png]https://img1.17img.cn/17img/images/201811/uepic/b83644de-356d-4e5f-9341-72a1a5e4725a.jpg[/img][/align][align=center]揭牌仪式现场[/align]南科大冷冻电镜中心是深圳市政府出资、我校牵头建设的重大基础科学设施平台,旨在支撑深圳市、粤港澳大湾区及中国南方在生物医药、精准医学、新能源新材料方面的科学研究及产业升级。南科大冷冻电镜实验室拟安装300千伏冷冻电镜6台,200千伏冷冻电镜2台,120千伏电镜2台,共计10台冷冻透射电子显微镜及其它71台/套相关辅助仪器和样品制备设备,全部建成后,将是我国配套最齐全、最先进的冷冻电镜实验室。经过一年多的前期准备工作,目前项目一期的2台300kv冷冻电子显微镜已经完成安装调试,投入使用。冷冻电镜技术改变了许多生物领域的研究方式,使得诸多研究能够快速取得重大突破。冷冻电镜技术已成为结构生物学研究的利器,这项技术克服了生物分子结构解析中的许多难点,被诺贝尔奖官方称为“使得生物化学进入一个新时代”。[align=center][img=2.jpg]https://img1.17img.cn/17img/images/201811/uepic/7a1b61e0-a88d-4542-9e00-fb3cdc96a122.jpg[/img][/align][align=center]陈十一致辞[/align]陈十一在仪式上致辞,他代表南科大对与会嘉宾的到来表示欢迎,对深圳市委市政府对南方科技大学冷冻电镜中心的支持表示感谢,同时也对冷冻电镜中心负责人王培毅和工作人员前期的辛勤工作表示肯定。他表示,未来几年,冷冻电镜中心将致力于把基础知识和药物开发结合起来,在深圳的工业发展中扮演重要角色。南科大将以此为契机,秉承和发扬“敢闯敢试、求真务实、改革创新、追求卓越”的创校精神,为深圳市社会和经济的发展继续贡献力量。[align=center][img=3.jpg]https://img1.17img.cn/17img/images/201811/uepic/17b55b90-20aa-4b77-85b2-0fddf9d79466.jpg[/img][/align][align=center]Richard Henderson致辞[/align]Richard Henderson在致辞中对南科大冷冻电镜中心的落成表示祝贺,并表示为这个优秀的冷冻电镜中心的建立感到由衷高兴。他指出,南科大冷冻电镜中心落成之后,将会成为全球最大的三个冷冻电镜中心之一,另外两个分别在美国和英国。目前,世界上大概有100个类似的研究机构,南科大冷冻电镜中心落成之后,其研究能力将会达到全球的前5%,对相关科研领域的研究产生更大的影响。[align=center][img=4.jpg]https://img1.17img.cn/17img/images/201811/uepic/524b4e7f-e049-43a5-8cb4-e08283ee6ed4.jpg[/img][/align][align=center]蔡羽致辞[/align]蔡羽表示,南科大冷冻电镜中心是生命科学、新材料、新能源领域基础性、关键性的重大科研设施,填补了深圳市、广东省、中国南方地区在该领域的空白,为我市及地区相关领域内的科学研究及产业升级转型提供了支撑平台,希望冷冻电镜中心为深圳市、粤港澳大湾区的产业升级及进一步经济社会全面发展提供新的动力源泉。随后,冷冻电镜中心负责人王培毅、Richard Henderson、蔡羽、隋森芳共同为南方科技大学冷冻电镜中心揭牌。Thermofisher Scientific亚太区材料与科学事业部总经理Marc Peeters、Thermofisher Scientific公司代表Jonathan Jing、中国航天科工深圳航天工业技术研究院董事长崔玉平、中国国际金融集团董事总经理陈十游也在仪式上致辞。南方科技大学第二附属医院、深圳市第三人民医院院长刘磊,加州大学洛杉矶分校教授周正洪,加州大学旧金山分校教授程亦凡,牛津大学教授章佩君等参加了揭牌仪式。冷冻电镜发展国际研讨会也于同日在南科大图书馆111报告厅举行。
“It is very easy to answer many fundamental biological questions you just look at the thing!”——1965年诺贝尔物理学奖得主理查德费曼教授正如费曼教授所言,结构生物学的核心正在于“看清事物”。只要分辨率足够高,能看清诸多生物分子在原子层面上的细节,它们的工作方式也就不言自明了。也正是由于这个原因,从历史上看,结构生物学领域做出的发现,带来了许多生物学突破,也推动了不少创新疗法的开发。[align=center][img=1.png]https://img1.17img.cn/17img/images/201809/uepic/627d0364-d802-4ff4-aedb-9ab7041c7ce9.jpg[/img][/align]在诸多让人类“高清看世界”的技术里,X射线晶体学是生物学家们使用最多的技术之一,也让人类获得了大量生物大分子的结构。但这种方法需要事先获取这种大分子的晶体。尽管许多蛋白质和一些稳定的复合体能产生质量足够高的晶体,但对于膜蛋白或动态的复合体来说,获取晶体就不是那么容易。我们能不依赖于晶体获取,直接“观察”这些大分子吗?自上世纪70年代起,许多先驱尝试使用基于电子显微镜的方法来解决这个问题。最初,它的分辨率并不尽如人意。但经历了40年的发展,冷冻电镜技术取得了突破,一跃成为了结构生物学的主流工具之一,与X射线晶体学形成了完美的互补。单粒子冷冻电镜的诞生事实上,想通过电子显微镜来看清生物大分子,并不是一件容易的事。首先,和通常的照片一样,电子显微镜获取的图像是二维的,而生物大分子的结构是三维的。这一问题通过一个巧妙的方法得到了解决:对于同一个生物大分子,我们可以从不同的角度获取它的二维图片。将这些图片整合到一起,就可以重建出三维的结构。而电子显微镜遇到的另一个问题,曾一度被认为是它的致命硬伤——为了达到最佳效果,电子束必须处于真空环境之中。于是,这些样本也必须位于同样的真空里。对于生物大分子来说,这就造成了严重问题:真空导致的脱水会对样本的结构完整性带来破坏性的影响。从机制上看,用电子显微镜来观察生物大分子就好像是个不可能完成的任务。[align=center][img=2.jpg]https://img1.17img.cn/17img/images/201809/uepic/6c051d14-a901-4d11-af98-b62ce330a6df.jpg[/img][/align]▲将样品“冻起来”,可以保留生物大分子的完整性(图片来源:By Vossman , from Wikimedia Commons)1974年发表在《科学》杂志上的一项研究彰显了人类的智慧。在加州大学伯克利分校,还是在读研究生的Kenneth Taylor与其导师Robert Glaeser教授表明,生物大分子的结构完整性,可以通过将它们“冻起来”而得到保留。这一发现在上世纪80年代被Jacques Dubochet教授及其同事们发扬光大,基于这一发现开发的样本制备技术时至今日都没有出现很大的改动。研究人员们也指出了电子显微镜的第三个问题——高能电子束带来的辐射可能会对生物学样本造成破坏,从而限制了电子束的强度。而电子束较弱的结果,便是过低的信噪比。Richard Henderson教授等人提出的一个解决方案,将晶体学中的技术应用到电子显微镜成像过程中。利用电子晶体学(electron crystallography)技术,人们取得了一系列进展,解析出的结构分辨率最高达1.9 埃。[align=center][img=3.jpg]https://img1.17img.cn/17img/images/201809/uepic/6ff80f52-36a4-48ec-8bdf-d85e7527975f.jpg[/img][/align]▲三位在冷冻电镜领域做出开拓性贡献的科学家共享了2017年的诺贝尔化学奖(图片来源:The Nobel Prize in Chemistry 2017. NobelPrize.org. Nobel Media AB 2018. Wed. 12 Sep 2018.)而Joachim Frank教授则希望能够规避结晶这一手段来确认蛋白质的结构。他提出,通过对同一种蛋白粒子进行大量的独立拍摄,再通过计算机来整合这些图片,有望能获得高清的结构。这一创新的想法与样本的冷冻制备相结合,成为了如今我们熟悉的“单粒子冷冻电镜”(single-particle cryo-EM)。Frank教授、Dubochet教授、以及Henderson教授三人也共享了2017年的诺贝尔化学奖。[b]结构生物学的新纪元[/b]单粒子冷冻电镜技术为结构生物学带来了新的突破,使其迈入了新纪元。原本难以结晶的目标,其结构也能展现在人类面前,膜蛋白就是这样的例子。在这篇综述中,加州大学旧金山分校的程亦凡教授介绍了冷冻电镜如何协助我们获得了瞬态受体电位(TRP)离子通道的结构。[align=center][img=4.jpg]https://img1.17img.cn/17img/images/201809/uepic/b4af6e2b-a106-47b7-bc95-779b43e3ee4a.jpg[/img][/align]▲本篇《科学》综述的作者程亦凡教授(图片来源:程亦凡教授实验室官网)TRP通道超家族分为7大类,在人类中总共有27个成员,每一个通道都有着特定的生理功能,其中一些也有望成为治疗人类疾病的靶点。但除了这些通道里的少数小型结构域外,人们对这些通道的结晶尝试往往以失败而告终,这也限制了对这些靶点的进一步开发。2013年,这一困境迎来了终结。当年,《自然》上的两篇论文利用单粒子冷冻电镜技术,获取了TRPV1离子通道位于三种不同状态下的结构,让我们更好地理解了其“感受热量,激活疼痛通路”的作用。TRPV1结构的获得再次强调了冷冻电镜的巨大潜力——当“获取晶体”这一限速步骤被移除后,我们能够以极快的速度获得膜蛋白的原子结构。据统计,在不到5年的时间里,每一类TRP通道,均有至少1个成员的结构得到了解析。对于大型的动态复合体来说,冷冻电镜更是让原本无法通过结晶获取的结构呈现在了人类面前,剪接体就是极佳的例子。过去,人们要么只能获得其中片段的原子结构,要么只能获得分辨率较低的整体结构。而在单粒子冷冻电镜的协助下,在几年里,我们就获得了剪接体在不同工作状态下的结构,从而拼接出了它工作的完整画面。这在过去是难以想象的。冷冻电镜领域前所未有的发展速度,也吸引了诸多医药企业的关注。它们期望能够应用这一技术,优化药物的发现过程。[b]医药企业的尝试[/b]在去年11月的一篇《Nature Reviews Drug Discovery》综述中,作者Mark Peplow博士为我们盘点了药企在冷冻电镜领域的布局与尝试。对于大型药企来说,在公司内部的建立冷冻电镜能力是其布局的主要方向——基因泰克在组建内部的冷冻电镜团队;辉瑞斥资500万英镑使用新款的冷冻电镜;诺华通过与Friedrich Miescher研究所的合作也构建了自己的冷冻电镜中心。诺华生物医药研究所(NIBR)的蛋白质科学负责人Christian Wiesmann说,他们的冷冻电镜中心已经初见成效。利用冷冻电镜技术,他们获得了一款蛋白与一种小分子结合时的结构,这能指导药物化学的开发。对于另一些药企或生物技术公司来说,他们决定组成联盟,共同使用冷冻电镜工具。这一方面是出于成本的考量,但更重要的是,这种联盟能够促进经验的交流。在英国,剑桥医药冷冻电镜联盟(Cambridge Pharmaceutical Cryo-EM Consortium)就是这样的例子——在5家药企的合作下,这一联盟获得了超过300万英镑的资金,于2016年正式启动。[align=center][img=5.jpg]https://img1.17img.cn/17img/images/201809/uepic/5e19607c-c0eb-4bf4-98ae-c487fb8216b8.jpg[/img][/align]去年5月,该联盟的成员之一阿斯利康发表了一篇论文,揭示了人类突变ATM蛋白的结构。ATM蛋白是一类大型激酶,与DNA的修复有关,在癌症发病中有潜在的作用。而研究人员们获得的结构,其分辨率为4.4埃,足以看清其两个构象,其中一个处于“打开”状态,可以结合底物;另一个则处于“关闭”状态。这些发现带来了该蛋白的首个高清结构,也表明它作为分子开关的重要作用。该联盟的另一个成员Heptares则在探索GPCR的结构。作为一类膜蛋白,它们通常会因为分离过程而失去正常的结构与活性,因此难以通过常规的结晶手段制备样本。但冷冻电镜技术则没有这样的困扰。目前,我们获得的GPCR结构已能让我们看清它们与大型多肽相结合时的结构。它们与小分子结合时的高清结构,会是研究人员们未来的研究方向。[b]冷冻电镜的未来[/b]冷冻电镜领域在过去40年里发生了重大的改变,而这一技术还有不少可以提高的空间。其中的一大关键在于进一步提高分辨率,达到2埃左右,另一大关键在于提高使用的效率。如果我们能够快速获得大批样品的高清结构,无疑将加速这项革命性技术在医药领域的应用。此外,硬件与软件的升级,也将提升冷冻电镜的能力。更好的光学系统、更好的检测器、更好的算法软件,都能让冷冻电镜在现有的基础上如虎添翼。正如一些业内资深人士指出的那样,要实现这样的功能迭代,让冷冻电镜成为新药发现的常规工具,或许还需要5到10年的时间。但对于诸多医药与生物技术公司而言,目前或许是将这一工具整合至研发系统中的最佳时机。
朱平,中国科学院生物物理所研究员,长期从事冷冻电镜三维重构研究。 他是金属材料专业出身,却缘何远涉重洋从事病毒结构研究? 他如何与冷冻电镜结缘,并取得相关研究领域数项世界领先的研究成果:在世界上首次利用冷冻电镜的CCD图像获得的生物大分子复合体的全原子模型;世界上首次利用冷冻电镜三维重构技术解析30nm染色质左手双螺旋高清晰三维结构…… 对于冷冻电镜技术的应用与发展,他有着怎样的理解? 带着这些疑问,日前仪器信息网编辑特别采访了朱平研究员,请参阅: 冷冻电镜:结构生物学研究的利器——访中国科学院生物物理所朱平研究员
近日,清华大学施一公研究组通过单颗粒冷冻电子显微技术(冷冻电镜)解析了酵母剪接体近原子分辨率的三维结构,并在此结构的基础上进行了详细分析,相关文章发表在《科学》周刊上。这一重要研究成果再次让冷冻电镜技术进入了大家的视野。 施一公表示,如果没有冷冻电镜,就完全不可能得到剪接体近原子水平的分辨率。而早在2007年清华大学采购冷冻电镜时,也没想到冷冻电镜会出现飞跃性的进展。 确实自从2013年以来,随着单电子计数探测相机的问世,以及图像处理算法的发展,冷冻电镜技术在结构生物学研究中的应用越来越多,其重要性也日益凸显,吸引了许多以前从事X射线晶体学研究的研究人员关注。那么冷冻电镜技术未来的发展前景如何呢? 2015年4月,单电子计数探测相机的研发人员之一华人学者程亦凡(Yifan Cheng) 在Cell杂志刊登了《Single-Particle Cryo-EM at Crystallographic Resolution》,其中有一个部分专门介绍了单颗粒冷冻电镜技术未来的发展。现将原文翻译如下,与版友们共享。~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 毫无疑问,单颗粒冷冻电镜(single-particle cryo-EM)不再是‘‘blobology’’,而是一种可与X射线晶体学方法分辨率相媲美的新方法。然而,与X射线晶体学不同的是,单颗粒冷冻电镜总是产生一些信息(尽管并不都是原子分辨率级别的信息),甚至对分辨率并不是很高的图像进行重构,也能够获得如何改进样品制备的信息,以及宝贵的生物学见解。因此,在大分子研究方面,单颗粒冷冻电镜技术比X射线晶体学更具吸引力。 然而,单颗粒冷冻电镜技术还远非完美,而且技术发展仍然非常快。目前单颗粒冷冻电镜技术的分辨率水平,依然无法满足许多方面的应用要求。例如,如果分辨率能够突破3埃,这样就能清楚的看到离子的位置,同时不仅能观察到小分子,还能观察到小分子配体与目标蛋白是如何结合在一起的,这一点对于制药公司来说颇具吸引力,因为它能够为基于结构的药物设计和优化提供便利。 最近有一篇综述文章详细探讨了单颗粒冷冻电镜技术的局限性,尤其是在获取更高的分辨率方面,并介绍了可能的解决方法(Agard et al., 2014))。由于分辨率不足,建立新模型和精修所花费的时间常常远远超过了三维重构本身。尽管许多X射线晶体学工具可以被应用在冷冻电镜密度图模型的建立和精修,它也需要显著的改进(Amunts et al., 2014; Brown et al., 2015)。此外,X射线晶体学传统的验证准则,例如自由R-因子,对于建立冷冻电镜密度图的模型并不适用。因此,对于单颗粒冷冻电镜技术来说,建立、精修和验证有效的模型的工具和方法都需要进一步的发展。 除了提高技术本身,还有其他一些因素限制单颗粒冷冻电镜技术的广泛应用。首先,单颗粒冷冻电镜技术并不是一个“交钥匙”方法。即使有自动数据采集技术和流程化数据处理、图像采集和加工处理等,它依然是一个十分复杂的技术,对于一个新手来说,很难通过短时间的培训或使用说明书就能学会操作。其次,必要的基础设施需要价值不菲的投资,包括功能齐全的冷冻电镜设备,用于数据处理和存储的计算机资源等。另外,除了最初的投资,目前高端冷冻电镜设施运行所需要的投资也是巨大的。第三,目前几乎没有类似同步辐射光源向社会大众开放的、致力于高通量数据采集的冷冻电镜设施。 这些限制使得进入冷冻电镜领域的门槛太高,要想有所改变,将需要多方面的努力。 因此,使得冷冻电镜技术更加可靠耐用,并且相对容易掌握,降低设备和运行成本,提供现成的设备及专家,也是促使冷冻电镜技术能够像X射线晶体学技术广泛应用的重要步骤。尽管,单颗粒冷冻电镜技术的未来是光明的,但是需要科学界以及政府投资机构的大力支持,才能使得单颗粒冷冻电镜技术能够像X射线晶体学技术一样受欢迎。
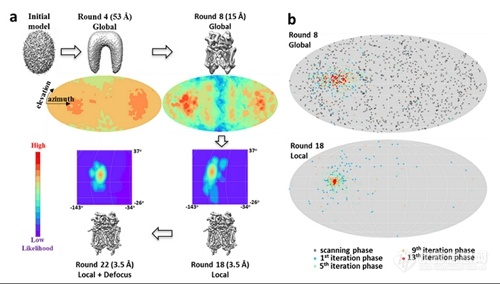
蛋白质是生命体的最主要组成元素,作为一种生物大分子机器,蛋白质功能的实现高度依赖于其复杂的三维原子结构。了解蛋白质的结构及其与功能的关系对探索生命的基本原理,理解疾病的分子机制以及药物的研发具有重要的意义。[align=center][img=,500,284]https://ng1.17img.cn/bbsfiles/images/2018/12/201812131109255316_9391_3224499_3.jpg!w500x284.jpg[/img][/align][align=center]基于粒子滤波的三维重构算法示意图。[/align]冷冻电子显微镜,简称冷冻电镜,使用电子束作为光源,是一种能在原子分辨率水平上观察并测定蛋白质分子结构的有力工具。伴随着最近几年的技术突破,冷冻电镜三维重构技术成为测定蛋白质及其复合物结构的关键技术。冷冻电镜三维重构的基本方法是,首先利用冷冻电镜对冷冻于液氮温度的生物大分子颗粒进行成像,以获得数万到数百万张生物大分子照片,然后通过一定的算法来整合这些图像,计算出生物大分子的三维结构。这其中三维重构算法是核心内容,用于测定出每一张照片的诸多参数,例如空间取向,然后才能将二维的照片整合重构出三维的结构。因为照片的数量巨大,且图像信号极其微弱,如何精确计算测定每张照片的参数,以达到超过0.4甚至0.2纳米的分辨率,一直以来都是冷冻电镜技术研究的重点和难点。来自清华大学生命科学学院的研究人员发表了题为“A particle-filter framework for robust cryoEM 3D reconstruction”的文章,介绍了一种基于粒子滤波的鲁棒的冷冻电镜三维重构算法框架,这种方法通过将电子工程应用中的粒子滤波算法引入到冷冻电镜三维重构中,大幅提高了对系统参数的搜索能力和对系统误差的容忍度;通过进一步融合高性能计算的方法,最终实现了对生物大分子结构高效高精度的三维重构。这一发现公布在11月30日的Nature Methods杂志上,由清华大学生命科学学院李雪明研究组,电子工程系沈渊研究组和计算机系杨广文研究组合作完成。第一作者为胡名旭,余洪坤和顾凯。同期他们开发的THUNDER冷冻电镜三维重构软件系统集成了这些新算法和新特性,为未来冷冻电镜海量图像数据的实时分析,以及大规模的自动化应用提供了一个可靠的算法和软件基础;同时,也为解析接近原子分辨率的生物结构提供了一套鲁棒、快速的解决方案,显著降低了对用户经验的要求,益于冷冻电镜技术的广泛普及,助力在原子尺度上对生命活动进行观察。为了获得一个更有效的算法和计算系统以满足未来高分辨率和大规模应用的需求,李雪明研究组联合电子系沈渊和计算机系杨广文研究组,利用清华大学生物学科和信息学科交叉的优势,将电子工程领域的粒子滤波算法引入到冷冻电镜的图像重构参数搜索中去,发展出一套比现有算法更完善、更有效的贝叶斯统计推断算法。这套新算法对高维参数的搜索具有更好的鲁棒性,可以自适应地进行参数的自动调整,以及通过引入一套新的权重机制大幅提高了对系统误差的容忍度。这些优势的整合,使整个系统具有很好的鲁棒性,更适用于未来自动化的运行工作模式。同时,在算法的实现过程中,深度融合了大规模并行计算的思路和方法,从而使整个系统具有极高的运算效率,和近乎理想的并行计算性能。未来该系统将能够高效运行于小到一个工作站,大到“太湖之光”这样的超大规模计算系统,适应生命科学研究和药物设计的大量结构测定需求。这项工作是三个不同学科研究组交叉研究的阶段性成果,团队正在利用新型的统计推断和机器学习算法将这一工作扩展到对细胞或者细胞器结构的原子分辨率三维重构上去。未来的冷冻电镜技术将使人们不必再借助于复杂的生物化学手段来提取蛋白质,而是利用冷冻电镜直接在细胞中对包括蛋白质在内的生物大分子的原子结构和动态变化进行观察和分析,探索生命活动的本质原理,设计能够治愈疾病的药物,造福人类健康。
[b]职位名称:[/b]浙江大学冷冻电镜中心-冷冻电镜研究教授[b]职位描述/要求:[/b]研究教授聘为浙江大学教授或研究员, 能结合所属领域的发展方向和动态,以冷冻电镜为主要研究技术手段,带领团队在所属领域从事高水平的学术研究和技术支持工作。应聘者应具备相关领域的博士学位并在冷冻电镜或细胞电镜领域相关技术上有丰富的经验和技术特长。有意者请将申请函,、较详细的个人简历包括研究经历介绍发给邮箱。请在申请材料上注明"申请冷冻电镜中心研究教授"。 浙江大学竭力为引进人才创造良好的工作环境和生活条件,对引进的中心负责人和研究教授提供富有竞争力的薪酬和住房条件、充足的科研启动经费和优良的实验室设施。为所有聘用人员申请人才类项目和培训项目经费支持的机会 同时按相关规定和政策,享有其他福利待遇。 [b]公司介绍:[/b] 仪器信息网仪器直聘栏目针对高校科研院所的免费职位发布平台,汇集了全国数十所高校科研院所的招聘信息。发布信息请联系010-51654077...[url=https://www.instrument.com.cn/job/user/job/position/60994]查看全部[/url]
国家蛋白质科学中心-上海(筹)招聘冷冻电镜管理人员 国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心(上海)(筹),负责设施的运行管理。具体介绍请参考如下面网页(http://www.sibcb-ncpss.org/index.action?lang=cn) 中心位于浦东新区张江高科技园区中区西部(上海市海科路333号) 。中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。 国家蛋白质科学研究上海设施/国家蛋白质科学中心·上海(筹)现因工作扩展的需要,面向社会公开招聘冷冻电镜管理人员。受聘者将有机会接受此技术的全面培训,有事业单位编制。一、招聘岗位名称及人数:冷冻电镜系统管理人员1-2名二、岗位职责:负责用户项目的合作及服务研究。可以独立应用TITAN Krios及TF20电镜,进行cryo-EM single particle及cryo-ET的数据收集、处理和结构分析,或可独立开展高压冷冻、超薄切片服务等。参与中心电镜(包括300 kV TITAN Krios,200 kV TF20及120kV T12)的日常管理,用户培训、技术支持等。三、任职条件:1.应聘者有3年或以上冷冻透射电镜使用经验,具有独立完成cryo-EM single particle及cryo-ET的数据收集、处理和结构分析的能力和经验;或者可以独立开展高压冷冻、超薄切片服务等;2. 具有生物物理学或相关专业的硕士或以上学位(博士学位优先考虑),有SCI第一作者论文;具有良好的中英文口头表达和写作能力;3.有工作热情,乐于学习新技术,有较强的动手能力;4.为人诚实、乐于助人,具有良好的沟通能力和团队协作精神;5. 身体健康,能长期稳定工作。四、招聘方式及程序1、应聘材料:(1)《http://www.sibcb.ac.cn/HXEditor/sysimage/file/doc.gif附件:应聘人员登记表.doc》(见附件);(2)应聘函,包括对应聘岗位的理解、认识及工作设想等;(3)个人简历(包括联系电话、电子邮箱);(4)2封推荐信;(5)有关材料:身份证复印件、学历及学位证书复印件、相关资格证书复印件、获奖证书复印件等;2、资格审查对应聘者进行资格审查,通过初审者,将另行通知面试时间和地点。3、请将上述材料的电子版或扫描件发至hr.ncpss@sibcb.ac.cn,hr@sibcb-ncpss.org.(请在应聘材料和邮件主题栏注明应聘岗位和姓名,按如下格式:“姓名—应聘部门—应聘岗位”),本岗位招满前有效。4、谢绝来电来访,应聘材料恕不退还,招聘单位将予以保密。5、上述岗位按照公开报名、资格审查、面试、决定聘任的程序和方法进行。
11月份,高端冷冻电镜招中标项目扎堆涌现,招中标项目数量与金额都很抢眼。据不完全统计,11月内,高端冷冻电镜出现招标6套,预算金额达3.78亿元,中标方面,赛默飞中标了青岛海洋科学与技术国家实验室发展中心的2套。 [b]具体中标信息如下:[/b][align=center] [color=#00b0f0]11月高端冷冻电镜中标信息表[/color][/align][table][tr][td=1,1,32][align=center][b]中标时间[/b][/align][/td][td=1,1,68][align=center][b]采购单位[/b][/align][/td][td=1,1,94][align=center][b]中标标的名称[/b][/align][/td][td=1,1,58][align=center][b]数量[/b][/align][/td][td=1,1,72][align=center][b]中标金额/人民币[/b][/align][/td][td=1,1,90][align=center][b]中标制造商[/b][/align][/td][/tr][tr][td=1,2,32][align=center]11月28日[/align][/td][td=1,2,68][align=center]青岛海洋科学与技术国家实验室发展中心[/align][/td][td=1,1,94]300KV冷冻透射电镜[/td][td=1,1,58]1套[/td][td=1,1,72][align=center]-[/align][/td][td=1,1,90][align=center]赛默飞[/align][/td][/tr][tr][td=1,1,94]200KV冷冻透射电镜[/td][td=1,1,58]1套[/td][td=1,1,72][align=center]-[/align][/td][td=1,1,90][align=center]赛默飞[/align][/td][/tr][/table] [b]招标信息如下表:[/b][align=center] [color=#00b0f0] 11月高端冷冻电镜招标信息表[/color][/align][table][tr][td=1,1,32][b]招标时间[/b][/td][td=1,1,78][b]招标单位[/b][/td][td=1,1,111][b]相关招标名称[/b][/td][td=1,1,52][b]数量[/b][/td][td=1,1,57][b]预算金额[/b][/td][td=1,1,118][b]开标时间[/b][/td][td=1,1,114][align=center][b]联系方式[/b][/align][/td][/tr][tr][td=1,1,32][align=center]11月16日[/align][/td][td=1,1,78][align=center]清华大学[/align][/td][td=1,1,111][align=center]高端冷冻电镜系统[/align][/td][td=1,1,52][align=center]1套[/align][/td][td=1,1,57][align=center]8352万元[/align][/td][td=1,1,118][align=center]12月7日[/align][/td][td=1,1,114]项目联系人:王慧项目联系电话:62785713[/td][/tr][tr][td=1,1,32][align=center]11月22日[/align][/td][td=1,1,78][align=center]上海交通大学[/align][/td][td=1,1,111][align=center]冷冻电镜系统[/align][/td][td=1,1,52][align=center]1套[/align][/td][td=1,1,57][align=center]7665万元[/align][/td][td=1,1,118][align=center]12月13日[/align][/td][td=1,1,114][align=center]联系方式:陆老师 86-21-54744366[/align][/td][/tr][tr][td=1,1,32][align=center]11月22日[/align][/td][td=1,1,78][align=center]南方科技大学[/align][/td][td=1,1,111][align=center]300 kV冷冻电子显微镜,直接电子探测器, 相位板,生物样品能量损失谱仪[/align][/td][td=1,1,52][align=center]1套[/align][/td][td=1,1,57][align=center]4700万元[/align][/td][td=2,4,232][align=center]-[/align][/td][/tr][tr][td=1,1,32] [/td][td=1,1,78] [/td][td=1,1,111][align=center]300kV冷冻电子显微镜,直接电子探测器, 相位板,能量损失过滤器[/align][/td][td=1,1,52]1套[/td][td=1,1,57][align=center]4700万元[/align][/td][/tr][tr][td=1,1,32] [/td][td=1,1,78] [/td][td=1,1,111][align=center]300kV冷冻电子显微镜,直接电子探测器, 相位板,球差校正器,能量损失谱仪[/align][/td][td=1,1,52]1套[/td][td=1,1,57][align=center]5200万元[/align][/td][/tr][tr][td=1,1,32] [/td][td=1,1,78] [/td][td=1,1,111][align=center]300kV冷冻电子显微镜,直接电子探测器, 相位板,球差校正器, 色差校正器,能量损失过滤器[/align][/td][td=1,1,52]1套[/td][td=1,1,57][align=center]7208万元[/align][/td][/tr][/table][b]【有奖调研时间】[/b]电子显微镜市场有奖调研正式开启:[color=#ff0000][b]1分钟赢300份话费![/b][/color]仪器信息网特针对电镜相关用户开展有奖调研活动,并将结合调研结果,推出电镜专题盘点分析以飨读者。问卷调研活动期间([b][color=#00b0f0]2018年11月13日-2018年12月15日[/color][/b]),认真完成问卷,并经审核确定为有效问卷的用户,将获得10元话费奖励,奖励将于10个工作日送达,总共300 份,数量有限,先到先得![color=#7030a0]点击进入调研链接参与[/color]:【[url=https://www.wjx.cn/jq/30621349.aspx]问卷链接[/url]】

[img=,640,570]https://ng1.17img.cn/bbsfiles/images/2019/01/201901251125013494_802_3221097_3.jpg!w640x570.jpg[/img][color=#5e5353]2017年诺贝尔化学奖奖颁给了雅克杜波谢(Jacques Dubochet), 约阿希姆弗兰克 (Joachim Frank) 和 理查德亨德森(Richard Henderson),以表彰他们对于冷冻电子显微镜技术的研究发展所作出的贡献,三位科学家同时还简化和改进了生物分子的成像。这项技术使得生物化学迈向了新的时代。我们很有可能在近期内获得原子级别分辨率下的生命复杂机械的详细图像。[/color][img=,640,424]https://ng1.17img.cn/bbsfiles/images/2019/01/201901251125136496_4010_3221097_3.jpg!w640x424.jpg[/img][color=#888888]因为冷冻电子显微镜技术的出现,我们能看到的微观世界从图片左侧的样子,变成了右侧这样。图片来源:The Royal Swedish Academy of Sciences | 制图:Martin Hö gborn[/color][color=#5e5353]听到导师约阿基姆弗兰克(Joachim Frank)得奖的消息后,我的心情有些激动。[/color][color=#5e5353]近几年,冷冻电镜在生物物理,特别是结构生物学领域掀起了一轮新的风暴。尤其在近三四年来,依靠冷冻电镜技术,很多具有非常重要生物学功能的生物大分子复合物的三维结构得到解析。所以说冷冻电镜技术彻底改变了结构生物学的研究方式。[/color][color=#5e5353][/color][color=#5e5353]冷冻电镜的重要性,在我看来就是它彻底地“消灭”了结构生物学。这句话是什么意思呢?就是说冷冻电镜技术在这两年的突破,使得解析生物大分子复合物的三维结构变得越来越容易、越来越常规。所以这个发展趋势,就是以电镜为主的技术越来越平台化,入门的门槛越来越低,会更多地普及生物研究的方方面面。[/color][color=#5e5353][/color][color=#5e5353]冷冻电镜近年来取得了一系列重大突破,这一系列突破让以前很多不能做的研究变成了可能。而这一切最新的突破所用的方法,主要就是这三位科学家建立的,所以他们得奖是实至名归的事。[/color][color=#5e5353]目前冷冻电镜技术逐渐成熟,未来的发展将包括数据计算的算法等一系列更加友好界面软件的开发等等(以前主要是硬件的发展)。通过冷冻电镜,可以对以前不了解的重要的蛋白质复合物进行研究,可以看到某些蛋白质具有怎样的生物学功能。这方面的研究将来还是很发展前景的。[/color][color=#5e5353][/color][color=#5e5353]中国的清华大学冷冻电镜中心近年来发表了很多具有重要的影响的工作,比如施一公教授的剪切体,我所做的呼吸链复合物等。这些工作在以前都是很难做成的,正是冷冻电镜发展起来之后,才使得我们能在短期内就取得了这一系列的重大突破。[/color][color=#5e5353]目前来说,中国冷冻电镜的应用的发展远远超过世界上其他国家,未来的发展重点将是一系列具有重要生物学功能的蛋白质复合物,以及这些蛋白质复合物的生命科学中的应用等。想信在未来还会持续成为生命科学研究领域的热门手段。冷冻电镜的重要发展就是使得解析像呼吸链复合物这样重要蛋白的结构成为了可能。按照X射线晶体学发展的轨迹,首先诺奖先建立方法学的人,然后就很可能是一系列重要生物学功能的蛋白复合物的了。他们在介绍他们三位为啥会获得诺奖的时候能把我们的研究结果放在第一个图,这对我们来说是一个激励和鼓励。[/color][color=#5e5353] [/color][color=#5e5353][/color][color=#5e5353]冷冻单分子电镜技术获得诺贝尔奖实至名归。这是结构生物学上面的一个巨大的突破,尤其是对生物大分子复合物的结构分析超越了以前基于X光衍射和核磁共振的传统方法。[/color][color=#5e5353][/color][color=#5e5353]而今天获奖的三位科学家在冷冻单分子电镜技术的发展中起到了关键性的作用。就像我们经常说的,这是天赋和天才的区别,有天赋的人,能够击中别人都击不中的目标,而天才呢,则能够击中别人甚至都看不到的目标。在二三十年以前,大家都认为晶体衍射可能会是解决生物大分子最主要、最有效的技术,而只有他们看到了电镜技术的潜力,发展了巨大的技术突破,获得了众多梦寐以求的分子结构。[/color][color=#5e5353]在短短的几年时间里面,冷冻单分子电镜技术已经成为了结构生物学里发展最快的一个领域。在全世界各个主要的研究机构里面,冷冻单分子电镜技术都是着重发展的领域。而我们中国,尤其是我们清华大学,在这个领域走在世界的前面。我们中国的学者包括施一公教授、颜宁教授、杨茂君教授、王宏伟教授以及华裔的程亦凡教授等等,在这个领域都做出了突出的贡献。[/color][color=#5e5353][/color][color=#5e5353]而在我们国内所做出原创性工作,对于理解mRNA修饰,阿尔兹海默症的发病机制等重要的生物学问题都起到了突出的贡献。在下面的几年里面,我认为我们会在电镜技术有原理性的突破。[/color][color=#5e5353]最后,本次诺贝尔奖也再次证明了化学作为一个中心学科,它和物理学、生物学的交叉,起到了互相补充、互相支持的作用。而冷冻电镜技术和其他的潜在候选者来比较,可能是作为一个成熟的、已经在科研中起到直接贡献的技术受到了委员会的青睐。[/color][color=#5e5353]通过快速冷冻溶液,使生物样品维持原来形态,在纳米尺度的电子显微镜技术的帮助下获得原汁原味的,原子分辨率的三维空间结构:这是物理成像与化学需求的结合,巧妙的概念,精致的实验手段。[/color][color=#5e5353][b][/b][/color][color=#5e5353]冷冻电子显微技术,是指通过将生物样品快速降温使其固定在玻璃态的冰中,继而用透射电子显微镜成像的技术。电子显微技术已经获得过多次诺贝尔奖,本次再次授予化学奖实际是对其在结构生物学,尤其是单颗粒重构技术的肯定。[/color][color=#5e5353][/color][color=#5e5353]本次获奖的三位科学家,Jacques Dubochet的工作集中在“冷冻”这个词上,他成功实现了将蛋白样品固定在玻璃态的冰中,使得在电子显微镜的高真空环境观察接近生理状态下的蛋白成为可能。Joachim Frank 和Richard Henderson则是在提供了单颗粒重构结构的理论依据和技术路线。在这三位科学家工作的基础上,随着硬件水平的不断提高,冷冻电镜目前已经真正成为结构生物学的常规技术手段。与晶体学相比,冷冻电镜可以用于解析更大的,具有结构柔性的复合物的结构。[/color][color=#5e5353][/color][color=#5e5353]说到我国在这方面的研究,早在八十年代初从事材料学研究的郭可信教授等就发现电子显微镜在生物领域的潜力,培养并鼓励一批物理背景的学者进入生物领域,他们不少目前已经成为行业中坚,以郭可信先生名字命名的冷冻电镜会议也是行业非常高水准的重要会议。[/color][color=#5e5353][/color][color=#5e5353]清华大学也在09年起就大力发展冷冻电镜的研究,其电镜平台(国家蛋白平台)也一度是全球最大的冷冻电镜中心(不仅规模大,而且非常非常高产)。[/color][color=#5e5353][/color][img=,640,462]https://ng1.17img.cn/bbsfiles/images/2019/01/201901251125363454_1832_3221097_3.jpg!w640x462.jpg[/img][color=#888888]中国电镜家谱图。图片来源:参考文献1[/color][img=,640,521]https://ng1.17img.cn/bbsfiles/images/2019/01/201901251125482544_7761_3221097_3.jpg!w640x521.jpg[/img][color=#888888]中国电镜平台分布。图片来源:参考文献1[/color]
请推荐侧重冷冻电镜的操作与维护的书
问一下各位大神 目前为止,python用于处理冷冻电镜图像及其三维重建的第三方库哪个好用一些啊,之前找了好几个,发现版本都很老了
国内除了山大和生物物理所以外,还有哪些地方可以做低温冷冻电镜?我有一个微乳液样品想做,最好能留下联系方式。谢谢

冷冻电镜,是用于电镜的超低温冷冻制样及传输技术(Cryo-EM),可实现直接观察液体、半液体及对电子束敏感的样品,如生物、高分子材料等。冷冻电镜技术改变了许多生物领域的研究方式,使得诸多研究能够快速取得重大突破。冷冻电镜技术已成为结构生物学研究的利器,这项技术克服了生物分子结构解析中的许多难点,被诺贝尔奖官方称为“使得生物化学进入一个新时代”。通俗点说,就是给生物大分子拍高清照片,以得到它们的三维结构。[img]https://simg.instrument.com.cn/bbs/images/default/em09502.gif[/img]冷冻电镜有多牛呢?[img]https://simg.instrument.com.cn/bbs/images/default/em09511.gif[/img]2017年诺贝尔化学奖授予了三位科学家,以奖励他们在“冷冻电镜”(cryo-electron microscopy)领域做的杰出贡献。这三位学者为:[color=#191919]哥伦比亚大学教授约阿基姆[/color][color=#191919][/color][color=#191919]弗兰克([/color][color=#191919]JoachimFrank[/color][color=#191919]),苏格兰分子生物学家和生物物理学家理查德[/color][color=#191919][/color][color=#191919]亨德森([/color][color=#191919]Richard Henderson[/color][color=#191919])以及瑞士洛桑大学生物物理学荣誉教授雅克[/color][color=#191919][/color][color=#191919]迪波什([/color][color=#191919]JacquesDubochet[/color][color=#191919])。[/color]国内冷冻电镜应用领域的领军人物,中国科学院院士、结构生物学家、西湖大学校长施一公也曾表示,冷冻电镜的发展像是一场猛烈的革命。“就目前发展前景来看,冷冻电镜技术是可与测序技术、质谱技术相提并论的第三大技术!”且施一公教授的研究团队依靠冷冻电镜技术在《Nature》,《Cell》,《Science》等杂志上发表了一系列突破性成果。冷冻电镜长什么样呢?[align=center][img]http://images.ofweek.com/Upload/News/2017-12/28/findus/1514456286122033720.jpg[/img][/align][align=center]FEI Titan Kiros 300kV 冷冻电镜[/align]冷冻电镜技术在最近短短几年里迅猛发展,不断带来令人惊叹的发现。为了促进这方面的学术交流和成果传播,为大家提供一个专门的技术交流平台,仪器论坛特开设“冷冻电镜(Cryo-EM)”版面,欢迎冷冻电镜从业者前来分享互动!同时,“冷冻电镜(Cryo-EM)”版面的版主专家正在招募中,欢迎自荐或推荐合适人选![color=red]【申请条件】[/color]1. 熟悉冷冻电镜的操作或样品制备等,具有一定的专业技术水平;2. 乐于分享经验并解答版友求助问题。[color=red]【版主专家职责】[/color]1. 活跃论坛,规范版面秩序;2. 发起话题,组织活动,引导讨论;3. 积极解答版友的求助帖;4. 发现推荐新版主、专家。[color=red]【版主专家福利】[/color]1. 仪器信息网科学仪器发展年会ACCSI(科学仪器行业年度盛会)针对版主、专家定向邀请,免费参会;2. 仪器论坛协助版主、专家发展论坛个人品牌,塑造个人形象,提升版主、专家在科学仪器行业声望;3. 仪器论坛每季度会进行优秀版主、专家评选,不仅有现金奖励,更会提供专属证书,为版主、专家证明荣誉;4. 仪器信息每年举办的[b]小蜜蜂奖励金[/b]评选(科学仪器行业内,对实验员名利双收的奖励),会着力关注用户在论坛中的表现,仪器论坛优先举荐合格的版主、专家。[b][color=red]【[/color][/b][color=red]申请方法】[/color][b]方法一:[/b]加微信xyz4077(小叶子)[img=,200,200]https://ng1.17img.cn/bbsfiles/images/2018/11/201811231410001436_9289_3224499_3.jpg!w200x200.jpg[/img][b]方法二:[/b]填写表单——[url=http://lengdong.mikecrm.com/RSZCB8x][b][color=#cc0000]仪器信息网论坛冷冻电镜版面版主专家招募[/color][/b][/url]
求助,冷冻电镜电镜可以做能谱分析吗/因为样品含水,所以不能用常规电镜观察,但是样品中含有多个组分,所以希望可以在保持样品形态情况下,做eds分析,推断成分分布,望大神赐教,虽然没有什么积分金币报答,但如果可以有效解决问题,必会感谢。
欢迎[url=https://www.instrument.com.cn/bbs/user.asp?username=v3224499]v3224499[/url]担任电子显微镜-冷冻电镜(Cryo-EM)版主!我们希望有更多的热心用户能加入到版主队伍中来,也希望在职的版主能在版面中发现有能力的热心用户推荐给我们。论坛正在招募版主,有兴趣的用户请参见这个帖子:[url=https://www.instrument.com.cn/bbs/shtml/20071101/1042199/]https://www.instrument.com.cn/bbs/shtml/20071101/1042199/[/url]
上海药物所冷冻电镜中心于2018年8月正式建成启用,现招聘相关工作人员详情请见http://www.simm.ac.cn/rcjy/rczp/201809/t20180927_5102584.html
1月11日,美国国家科学院院刊(PNAS)在线发表了中科院生物物理研究所朱平研究组及其合作伙伴利用冷冻电镜技术解析的一个质型多角体病毒原子分辨率结构模型的研究论文。这是我国首次利用冷冻电镜技术解析的生物大分子原子结构模型,也是目前已报道的国内最高分辨率的冷冻电镜三维重构结果。同时,这是世界上首次利用冷冻电镜的CCD图像(电荷耦合器件图像传感器)获得的生物大分子复合体的全原子模型。据生物物理所有关专家介绍,本工作完全基于生物物理所生物成像技术实验室去年4月建成并试运行的TitanKrios电镜及其附属设备完成,用单颗粒图像处理技术获得了呼肠孤病毒科的质型多角体病毒近原子分辨率的三维结构(3.9埃),并独立构建了全原子模型。呼肠孤病毒科病毒是一类重要的双链核糖核酸(RNA)病毒,其感染宿主包括植物、无脊椎动物、脊椎动物和人类,其中的质型多角体病毒是其两个亚科之一。该研究解析了呼肠孤病毒科质型多角体病毒的近原子分辨率三维结构并构建了完整原子模型,确认了该病毒新生信使RNA的流出通道,对研究双链RNA病毒的RNA加帽机制,新生信使RNA的释放过程,以及呼肠孤病毒的蛋白衣壳的稳定性和进化具有重要意义。
[b]职位名称:[/b]浙江大学冷冻电镜中心-中心负责人[b]职位描述/要求:[/b]中心负责人聘为浙江大学教授或特聘教授,。全面负责整个冷冻电镜系统的建设, 对平台整体运行进行管理, 以及指导技术开发及应用等工作。应聘者应具有物理、材料或生物专业的博士学位,并具有国外博士后经历, 在冷冻电镜或电子显微学领域内至少有10年的科研经历并有突出的业绩,以及良好的管理能力。有意者请将申请函,较详细的个人简历发邮箱。请在申请材料上注明"申请冷冻电镜中心技术负责人"。 浙江大学竭力为引进人才创造良好的工作环境和生活条件,对引进的中心负责人和研究教授提供富有竞争力的薪酬和住房条件、充足的科研启动经费和优良的实验室设施。为所有聘用人员申请人才类项目和培训项目经费支持的机会 同时按相关规定和政策,享有其他福利待遇。 [b]公司介绍:[/b] 仪器信息网仪器直聘栏目针对高校科研院所的免费职位发布平台,汇集了全国数十所高校科研院所的招聘信息。发布信息请联系010-51654077...[url=https://www.instrument.com.cn/job/user/job/position/60993]查看全部[/url]
国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心・上海(筹),负责设施的运行管理。具体介绍请参考如下面网页(http://www.sibcb-ncpss.org/index.action?lang=cn) 中心位于浦东新区张江高科技园区中区西部(上海市海科路333号)。 中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。国家蛋白质科学研究上海设施/国家蛋白质科学中心・上海(筹)现因工作扩展的需要,面向社会公开招聘冷冻电镜管理人员。受聘者将有机会接受此技术的全面培训。一、招聘岗位名称及人数:冷冻电镜系统管理人员2名二、岗位1:岗位职责:负责电镜负染及冷冻样品制样,样品检测、用户服务。参与中心电镜(包括200 kV TF20及120kV T12)的日常管理,用户培训、技术支持等。任职条件:1. 具有生物、医学或物理等相关专业的本科或以上学位,有电镜操作或生物电镜样品制样经验者优先考虑;2.有工作热情,乐于学习新技术,有较强的动手能力;3.为人诚实、乐于助人,具有良好的沟通能力、服务精神和团队协作精神;4. 具有良好的中英文口头表达和写作能力;5. 身体健康,能长期稳定工作。岗位2:岗位职责:负责用户项目的合作及服务研究。可以独立应用TITAN Krios及TF20电镜,进行cryo-EM single particle及cryo-ET的数据收集、处理和结构分析,或可独立开展高压冷冻、超薄切片服务等。参与中心电镜(包括300 kV TITAN Krios,200 kV TF20及120kV T12)的日常管理,用户培训、技术支持等。 任职条件:1.应聘者有3年或以上冷冻透射电镜使用经验,具有独立完成cryo-EM single particle及cryo-ET的数据收集、处理和结构分析的能力和经验;或者可以独立开展高压冷冻、超薄切片服务等;2. 具有生物物理学或相关专业的硕士或以上学位,有SCI第一作者论文;具有良好的中英文口头表达和写作能力;3.有工作热情,乐于学习新技术,有较强的动手能力;4.为人诚实、乐于助人,具有良好的沟通能力和团队协作精神;5. 身体健康,能长期稳定工作。三、招聘方式及程序1、应聘材料:(1)《应聘人员登记表》(见附件);(2)应聘函,包括对应聘岗位的理解、认识及工作设想等;(3)个人简历(包括联系电话、电子邮箱);(4)2封推荐信;(5)有关材料:身份证复印件、学历及学位证书复印件、相关资格证书复印件、获奖证书复印件等;2、资格审查对应聘者进行资格审查,通过初审者,将另行通知面试时间和地点。3、请将上述材料的电子版或扫描件发至hr.ncpss@sibcb.ac.cn,hr@sibcb-ncpss.org.(请在应聘材料和邮件主题栏注明应聘岗位和姓名,按如下格式:“姓名—应聘部门—应聘岗位”),本岗位招满前有效。4、谢绝来电来访,应聘材料恕不退还,招聘单位将予以保密。5、上述岗位按照公开报名、资格审查、面试、决定聘任的程序和方法进行。
国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心・上海(筹),负责设施的运行管理。具体介绍请参考如下面网页(http://www.sibcb-ncpss.org/index.action?lang=cn) 中心位于浦东新区张江高科技园区中区西部(上海市海科路333号)。 中心定位于:支撑国家蛋白质上海设施建设的建设,衔接该设施的运行;聚集培养生命科学与生物技术特别是蛋白质研究的人才,提升国家蛋白质研究能力;进而促进我国蛋白质基础研究的飞跃发展。中心将立足于国家生命科学与生物技术及相关研究领域雄厚的研究基础和创新实力,成为兼具蛋白质科学研究、技术及成果的转化、集成和应用平台的国家级的重要科学研究单元。 国家蛋白质科学研究上海设施/国家蛋白质科学中心・上海(筹)现因工作扩展的需要,面向社会公开招聘冷冻电镜管理人员。受聘者将有机会接受此技术的全面培训。一、招聘岗位名称及人数:冷冻电镜系统管理人员2名二、岗位1:岗位职责:负责电镜负染及冷冻样品制样,样品检测、用户服务。参与中心电镜(包括200 kV TF20及120kV T12)的日常管理,用户培训、技术支持等。任职条件:1. 具有生物、医学或物理等相关专业的本科或以上学位,有电镜操作或生物电镜样品制样经验者优先考虑;2.有工作热情,乐于学习新技术,有较强的动手能力;3.为人诚实、乐于助人,具有良好的沟通能力、服务精神和团队协作精神;4. 具有良好的中英文口头表达和写作能力;5. 身体健康,能长期稳定工作。岗位2:岗位职责:负责用户项目的合作及服务研究。可以独立应用TITAN Krios及TF20电镜,进行cryo-EM single particle及cryo-ET的数据收集、处理和结构分析,或可独立开展高压冷冻、超薄切片服务等。参与中心电镜(包括300 kV TITAN Krios,200 kV TF20及120kV T12)的日常管理,用户培训、技术支持等。 任职条件:1.应聘者有3年或以上冷冻透射电镜使用经验,具有独立完成cryo-EM single particle及cryo-ET的数据收集、处理和结构分析的能力和经验;或者可以独立开展高压冷冻、超薄切片服务等;2. 具有生物物理学或相关专业的硕士或以上学位,有SCI第一作者论文;具有良好的中英文口头表达和写作能力;3.有工作热情,乐于学习新技术,有较强的动手能力;4.为人诚实、乐于助人,具有良好的沟通能力和团队协作精神;5. 身体健康,能长期稳定工作。三、招聘方式及程序1、应聘材料:(1)《应聘人员登记表》(见附件);(2)应聘函,包括对应聘岗位的理解、认识及工作设想等;(3)个人简历(包括联系电话、电子邮箱);(4)2封推荐信;(5)有关材料:身份证复印件、学历及学位证书复印件、相关资格证书复印件、获奖证书复印件等;2、资格审查对应聘者进行资格审查,通过初审者,将另行通知面试时间和地点。3、请将上述材料的电子版或扫描件发至hr.ncpss@sibcb.ac.cn,hr@sibcb-ncpss.org.(请在应聘材料和邮件主题栏注明应聘岗位和姓名,按如下格式:“姓名—应聘部门—应聘岗位”),本岗位招满前有效。4、谢绝来电来访,应聘材料恕不退还,招聘单位将予以保密。5、上述岗位按照公开报名、资格审查、面试、决定聘任的程序和方法进行。
Hi~, 我们是来自加州大学Irvine分校(UCI)的DeepEM实验室。Deep取自深度学习,EM则代表先进的电子显微技术。我们致力于研究先进的纳米材料表征技术,并将其和深度学习结合,实现人工智能在材料分析中的应用。今天小编为大家介绍实验室重点研究领域之二:[b]冷冻电镜与低剂量技术在软材料界面/自组装中的应用。[/b][align=center][b][color=red]一、软材料的结构研究[/color][/b][/align][align=center][img=,690,263]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050950117211_9350_3224499_3.jpg!w690x263.jpg[/img][/align][align=center][b][color=#333333]图一:DNA大分子链(左),锂金属树突(右)[/color][/b][/align]不同于上一篇讲的晶体材料,软物质材料一般由大分子或基团组成,包括聚合物、胶体、颗粒物质、生命体系物质(如DNA、蛋白质)等,在自然界、生命体中广泛存在。然而长久以来,软材料的研究都局限于光谱,质谱等观察,由于温度及电子敏感等特性,无法通过传统的透射电镜技术实现结构的观察。近年来随着冷冻电镜(cryo-TEM)和低电子剂量(low-dose)技术的发展,这些敏感性材料也得以深入的研究。2017年,斯坦福Yi Cui课题组和UCSD的Shirley Meng课题组同期通过cryo-TEM技术研究了锂离子电池界面以及锂金属/固态电解质界面的反应机制;类似的,后续在2018年,康奈尔的Lena Kourkoutis和Lynden Archer课题组通过cryo-STEM技术研究了锂金属电池液固界面,这一系列重磅文章激起了材料界对原位表征界面和易损伤材料的重视,也足以说明目前cryo-EM和cryo-STEM对于材料界面研究的重要性。[color=#3da742](Science 27 Oct 2017 : 506-510;Nano Lett. 2017, 17, 12, 7606-7612;Nature, 2018, 560(7718): 345.)[/color][align=center][b][color=red]二、低剂量技术测试生物矿物材料[/color][/b][/align]其实早在2009年,Xin课题组就提出并实现STEM技术研究软硬物质界面,通过低剂量电子束(low dose)结合3D重构,清楚的实现了有机纤维/无机晶体界面的描绘以及深入的研究。这项工作开创性的利用了低剂量TEM手段,揭示了生物矿物内部结构,以及有机/无机界面的研究。[align=center][img=,690,401]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050950417647_7125_3224499_3.jpg!w690x401.jpg[/img][/align][b][/b][align=center][b][color=#333333]图二:有机纤维/碳酸钙晶体界面[/color][/b][/align][color=#3da742][b]代表作:[/b][/color][color=#3da742][b]Science, 2009, 326(5957): 1244-1247.[/b][/color][align=center][b][color=red]三、Cryo-(S)TEM[/color][color=red]在软材料自组装的应用[/color][/b][/align][b]在2015~2016年期间,Xin课题组非常前瞻性的将cryo-EM和cryo-STEM的技术引入到软材料(聚合物,DNA等)及软硬材料自组装的领域,这也一定程度上为后续cryo技术在能源材料里的应用奠定了基础[/b]。2015年,Xin Group和石溪大学Li Group合作利用cryoEM研究了利用DNA和Au颗粒自组装得到的八面体3D中尺度团簇。利用重构技术将这种自组装结构清楚的展示出来,从而深入的研究了其自组装机理,对于精确控制3D中尺度自组装材料提供了基础。[align=center][img=,690,495]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050951502851_1607_3224499_3.jpg!w690x495.jpg[/img][/align][align=center][img=,588,685]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050952185427_9283_3224499_3.jpg!w588x685.jpg[/img][/align][b][/b][align=center][b][color=#333333]图三:cryoEM八面体结构的DNA框架与重构[/color][/b][/align][color=#3da742][b]代表作:[/b][/color][color=#3da742][b]Nature nanotechnology,2015, 10(7): 637.[/b][/color][i][/i]在2016年,Xin利用cryo-STEM相关技术,实现了众多软材料自组装过程,机理的分析。通过调控DNA链和Au颗粒自组装,得到了四面体结构的Au-DNA单元,而进一步的组装更是得到了大尺度的,具有Diamond,fcc,以及ZB结构的超晶体。cryo-EM手段的使用确认了这种四面体单元的结构。[align=center][img=,440,344]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050952404627_9880_3224499_3.jpg!w440x344.jpg[/img][/align][b][/b][align=center][b][color=#333333]图四:四面体DNA/Au团簇单元与重构[/color][/b][/align]接着,Xin利用cryo-STEM对超晶格进行研究,确认了这些超晶格的组装结构。[align=center][img=,690,577]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050952564667_8850_3224499_3.jpg!w690x577.jpg[/img][/align][color=#b2b2b2][/color][align=center][b][color=#333333]图五:封在冰里的FCC, Diamond, Zinc Blende DNA自主装结构的超晶格(标尺自左向右 500nm,50nm, 0.5 nm)[/color][/b][/align][color=#3da742][b]代表作:[/b][/color][color=#3da742][b]Science, 2016, 351(6273): 582-586.[/b][/color]更进一步的,作者通过调节合成不同的DNA框架/纳米颗粒团簇,从而可控的合成了具有不同晶格结构的大尺度自组装晶体,并且通过cryo-STEM对其冰封超晶格进行观察。[align=center][img=,690,233]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050953178787_2774_3224499_3.jpg!w690x233.jpg[/img][/align][color=#b2b2b2][/color][align=center][b][color=#333333]图六:cryo-STEM下不同结构的DNA/NPs超晶格[/color][/b][/align][color=#333333][/color][align=center][b][i][color=#333333]Nature materials, 2016,15(6): 654.[/color][/i][/b][/align]通过cryo electron tomography技术实现了纳米颗粒表面聚合物图案化的观测,作者通过调控纳米颗粒以及配合聚合物,在纳米颗粒表面复合了不同的聚合物图案。[align=center][img=,690,337]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050953465081_1692_3224499_3.jpg!w690x337.jpg[/img][/align][color=#b2b2b2][/color][align=center][b][color=#333333]图七:金颗粒表面自组装聚合物图案[/color][/b][/align][color=#333333][/color][align=center][b][i][color=#333333]Nature, 2016, 538(7623):79.[/color][/i][/b][/align][align=center][b][color=red]四、利用cryo-STEM研究超厚生物材料[/color][/b][/align]利用cryo-STEM的独特优势,Xin课题组研究了超厚的DNA-self assembly样品,在~5微米的厚度下,通过STEM进行成像,在不需破坏超晶格的条件下,得到了清楚的晶格结构,而这是传统包埋切片法无法做到的,对于研究大尺度自组装结构非常重要。而通常情况下,这种厚度的样品由于很高的色差,很难用cryo-TEM进行观测。[align=center][img=,690,296]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050954056881_5347_3224499_3.jpg!w690x296.jpg[/img][/align][b][/b][align=center][b][color=#333333]图八:厚样品的cryo-(S)TEM图像对比以及超晶格的三维重构[/color][/b][/align]Note:TEM模式无法测试这么厚的样品(~5μm),原因是TEM依靠样品下面的物镜成像,而厚样品会引入很强的电子能量损失,从而产生很高的色差,极大的降低了分辨率;除此之外,冷冻有机样品中的冰不可避免的产生结晶,这样产生的衍射会极大的干扰材料本身信号,而且所需的超薄冷冻切片不仅费时费力,更没有办法保持生物材料原本的形貌。Cryo-STEM通过高角散射探测器接收信号,探针不会受到样品或着物镜的影响,此外,如果结合BF-STEM相衬度,会更适合较厚生物材料和整个细胞的三维表征。[align=center][b][color=red]导师介绍[/color][/b][/align][align=center][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2018/12/201812050954269597_4419_3224499_3.jpg!w690x517.jpg[/img][/align][color=#ff2941][b]忻获麟 教授[/b][/color],本科毕业于北京大学,博士就读于康奈尔大学,后在美国劳伦斯伯克利实验室进行博士后研究。2013年到2018年间,他在布鲁克海文实验室建立了三维原位表征课题组。2018年夏,转职于美国加州大学尓湾分校物理系并建立了以深度学习为基础的人工智能电镜研究组DeepEM Lab。忻获麟教授是电子显微学领域国际上的知名专家,是电镜行业顶级年会Microscopyand Microanalysis 2020的大会主席以及2019年的大会副主席,是布鲁克海文国家实验室的功能纳米材料中心和劳伦斯伯克利国家实验室提案审查委员会成员,是微束分析学会、美国显微学会、美国纳米学会和Sigma Xi学会的会员,是Nat. Mats, Nat. Energy, Nat. Nanotechnology, Nat. Commun., Science Advances, Joule, Nano Lett., AM 等众多期刊的审稿人。他从事人工智能电镜和深度学习、原子级扫描透射电镜以及能谱相关的理论和技术、高能电子隧道理论以及三维重构理论等方向的研究。除了理论和方法学的研究,他应用三维电子断层扫描术对锂电池、软硬物质界面、金属催化剂等多方面进行了深入的研究。其课题组发表文章超过150篇,其中在Science,Nat. Mater., Nat. Nanotechnol., Nat. Energy, Nature Commun.这几个顶级期刊上发表文章22篇,(其中七篇作为通讯发表)。他在表征和清洁能源方面的研究受到政府和大型企业的关注,2018年一年他作为项目带头人(Lead PI)得到能源部和企业界超过两百万美元的资助用于其课题组在绿色储能和热催化材料方向的研究。他的课题组(DeepEMLab.com)欢迎致力于研究和拓展电子显微学以及储能、催化、纳米制备、规模生产方向的学生学者加入和访问。转载于:【DeepEM实验室】
现在急需测试,样品为油水混合乳液,含有多种组分,各组分有特征元素,现在想测元素分布,求提供信息,不管扫描还是投射,只要能打能谱就ok,带冷冻台的环境扫描电镜也可以,望有知道哪里可以测试的大大提供帮助,价钱都好商量,只要才能做。有的话可以直接联系我:13641502924新人发帖,若有违规请版主通知修改。
国家蛋白质科学研究上海设施/国家蛋白质科学中心(上海)(筹)公开招聘 低温冷冻电镜管理 人员 国家蛋白质科学研究上海设施是国家重大科技基础设施,是国家级蛋白质科学研究平台;在设施建设基础上,依托中国科学院上海生命科学研究院,委托生物化学与细胞生物学研究所(简称SIBCB)负责筹建成立并管理国家蛋白质科学中心(上海)(筹), 负责设施的运行管理。地点位于浦东新区张江高科技园区中区西部(上海市海科路333号)。 国家蛋白质科学研究上海设施/国家蛋白质科学中心(上海)电镜系统现配有300kV Titan Krios,200 kV TF20及120kV Tecnai T12冷冻透射电镜,以及先进的冷冻制样设备。现因工作扩展的需要,面向社会公开招聘低温冷冻电镜管理人员。受聘者将有正式人员编制、有机会接受此技术的全面培训。一、招聘岗位名称及人数:低温冷冻电镜管理人员1-2名二、岗位职责:参与国家蛋白质科学中心(上海)(筹)低温冷冻电镜(200 kV TF20及120kV Tecnai T12系统)的管理、维护、用户培训、技术支持,及相关配件的维护,冷冻电镜制样等。三、任职条件:1. 应聘者有3年或以上透射电子显微镜的使用和维护经验,具有材料、生物、电子、物理等相关专业的本科或以上学位(具有硕士及博士学位者欢迎申请,将根据个人实际经验定岗、定酬);2. 乐于学习新技术,有较强的动手能力;具有良好的沟通能力和团队协作精神;3. 为人诚实,工作努力,作风踏实;4. 具有良好的中英文口头表达和写作能力;身体健康,能长期稳定工作。四、招聘方式及程序1、应聘材料:(1)《http://www.sibcb.ac.cn/HXEditor/sysimage/file/doc.gif蛋白质中心应聘人员登记表.doc》(具体招聘细节请点击此链接 http://www.sibcb.ac.cn/cp9-1-001.asp?id=525)(2)应聘函,包括对应聘岗位的理解、认识及工作设想等;(3)个人简历(包括联系电话、电子邮箱);(4)有关材料:身份证复印件、学历及学位证书复印件、相关资格证书复印件、获奖证书复印件等;(5)其他应聘者认为重要的书面材料。2、资格审查对应聘者进行资格审查,通过初审者,将另行通知面试时间和地点。3、请将上述材料的电子版或扫描件发至hr.ncpss@sibcb.ac.cn(请在应聘材料和邮件主题栏注明应聘岗位和姓名,按如下格式:“姓名—应聘部门—应聘岗位”),本岗位招满前有效。4、谢绝来电来访,应聘材料恕不退还,招聘单位将予以保密。5、上述岗位按照公开报名、资格审查、面试、决定聘任的程序和方法进行。
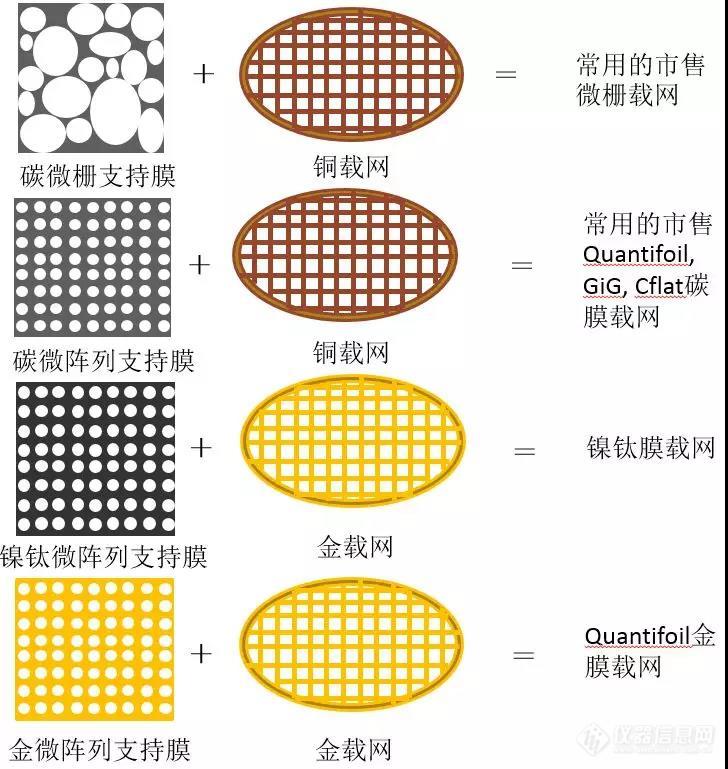
冷冻电镜技术是现今结构生物学里最常用的解析生物大分子三维结构的技术之一。虽然其样品制备过程比另一种同样非常常用的技术——X射线晶体学简便,但成功制备出一个适合进行高分辨数据收集的样品仍然是经验、运气、努力与创新相结合的结果。为了承载样品,使其能送入透射电镜进行观察,样品需要与带支持膜的载网接触并冷冻固定在一起。目前,可供选用的载网支持膜大体分两种:一种是有孔支持膜,包括常用的微栅碳支持膜、碳微阵列支持膜(如Quantifoil,GiG,Cflat等)、金属微阵列支持膜(如Quantifoil金膜,镍钛膜等)等,可直接购买使用。另一种是在有孔支持膜上再加一层连续超薄支持膜,添加的超薄支持膜常用的为超薄碳膜,近期又出现了氧化石墨烯膜等基于石墨烯的超薄膜类型。这种通常需要使用者对市售的有孔支持膜再加工,在其表面多加一层超薄支持膜。无论使用哪种膜,由于提供支撑的有孔膜较厚引入的噪音很高,数据收集都发生在孔内。[align=center][img=,690,728]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260954438579_6129_3224499_3.jpg!w690x728.jpg[/img][/align][align=center]图1.常用有孔支持膜类型[/align][align=center][img=,690,550]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260954588204_7034_3224499_3.jpg!w690x550.jpg[/img][/align][align=center]图2.有孔支持膜加连续超薄支持膜类型[/align]适合单颗粒技术数据收集的冷冻电镜样品需符合以下要求:①生物大分子群体主要为同种分子或者组分相同的复合体,且它们稳定在一种或有限的几种彼此能被计算机图像处理分类技术区分的构象;②样品颗粒彼此分离,同时分布密度又能满足在一次数据采集区域内获得足够的颗粒数量;③样品颗粒的空间取向随机分布。[align=center][img=,690,262]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260955256336_8129_3224499_3.jpg!w690x262.jpg[/img][/align][align=center]图3.理想化的样品颗粒在冰层中的分布示意图[/align]这些要求看似与载网支持膜的选用无太大关联,但实践经验告诉我们,有时同一个样品使用不同的载网支持膜进行样品制备,其数据收集质量有区别。导致这种差别的原因之一是支持膜表面性质的不同对进孔样品分布密度的影响。使用有孔碳支持膜常见的一个问题是样品大部分粘附在支持膜上,而在孔内的样品数量很少。根据经验,碳支持膜对部分样品的吸附性能相当强,溶液中的样品会优先吸附到碳膜上,以至于游离的样品颗粒浓度大大降低,而分布在支持膜孔内的样品来源于游离的样品颗粒群体。使用添加了连续超薄膜的载网则少有这个问题,毕竟孔内孔外都有碳膜,同时由于碳膜对样品的吸附在一定程度上具有样品富集效应,还可降低制样时所需样品浓度。此外,使用金属材质的有孔支持膜(如金膜,镍钛膜等)能缓解这种情况,因为金属支持膜表面性质与碳支持膜有区别,其对样品的吸附也可能有差异。[align=center][img=,690,263]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260955370487_1473_3224499_3.jpg!w690x263.jpg[/img][/align][align=center]图4.连续碳膜上的样品颗粒在冰层中的分布示意图[/align]导致这种差别的原因之二是冷冻样品制备时气液界面对样品的影响。由于电子能穿透的样品厚度很有限,样品被冻住前必须先进行减薄。目前最简单也最通用的减薄法是使用滤纸移除大部分液体而仅剩厚度在几十至上百纳米范围的水膜。根据现今通用的制样方式,从水膜的形成到它被快速冷冻成非晶态冰膜的时长在秒的量级。水膜的上下两层气液界面之间的距离如此短,水膜中样品被冷冻固定前的时间如此长,以至于样品颗粒有成千上万次机会与气液界面接触。每次接触样品颗粒都机率变性,或变成无定形的多肽链,或解体成更小的亚基组合。最终我们看到的样品颗粒或是被“已牺牲”的变性样品所保护而未能接触气液界面,或是幸运地多次接触气液界面而仍未变性。更多关于气液界面对样品影响的介绍,可参考孙飞(2018)以及Glaeser 和Han (2017)发表的综述。[align=center][img=,690,285]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260955485024_3909_3224499_3.jpg!w690x285.jpg[/img][/align][align=center]图5.现实的样品颗粒在冰层中的分布示意图[/align]使用有孔支持膜无可避免地会受到来自上下两层气液界面的影响,某些样品会因此而在冷冻后无法观察到完整颗粒。而使用连续超薄支持膜一面由气液界面转换为固液界面,另一面由于支持膜对样品的吸附而远离气液界面,有效地降低了气液界面对它的影响。既然添加连续超薄支持膜的载网有这么多好处,为什么很多样品仍然使用有孔支持膜呢?原因之一是长期使用的超薄碳支持膜对于小蛋白(特别是分子量小于500kDa)仍然太厚,引入的噪音太多,导致小蛋白数据取向搜索结果不够精确,影响重构分辨率提升。而石墨烯类超薄支持膜理论上为单分子层,比超薄碳膜更薄,在这方面可以帮上忙。但石墨烯类支持膜添加到载网上的方法仍在发展中,目前使用上仍不及有孔支持膜便利。[align=center][img=,690,541]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260956026943_9251_3224499_3.jpg!w690x541.jpg[/img][/align][align=center]图6.样品直径与碳膜厚度的选择(感谢友情出镜的大蛋黄颜值担当评审嘉宾)[/align]原因之二是添加超薄支持膜更大机率引起样品的取向优势,导致某些取向数据采集量远远不足,同样影响重构分辨率提升。[align=center][img=,690,396]https://ng1.17img.cn/bbsfiles/images/2018/11/201811260956143795_3302_3224499_3.jpg!w690x396.jpg[/img][/align][align=center]图7.样品颗粒取向优势示意(感谢友情出镜的大蛋黄实力客串样品颗粒)[/align]纯有孔支持膜与添加超薄支持膜两种方案可谓各有优缺。有孔支持膜的缺点很明显,在于受气液界面的两面夹击。如果有一种方法能缩短样品减薄到冷冻固定的时长至毫秒级别,那么样品颗粒将没有足够的时间多次接触气液界面,同时也减少与支持膜本身的接触,从而使用有孔支持膜的各种问题将可能迎刃而解。Bridget Carragher实验室研发了一种特殊的载网,命名为纳米线载网(nanowire grids)。这种载网具有自减薄功能,即载网孔内多余的液体会被固定在载网梁上的纳米线所吸走,留在载网孔内的液体厚度自然下降。当然纳米线吸附液体体积是有上限的,需要配合他们实验室研发的微量加样设备(Spotiton robot)加注皮升级别的样品量。虽然目前还未得到普及,但这种设置可以实现将减薄步骤的时长降低到百毫秒级别的水平。目前该文章未正式发表。推荐阅读文献:Fei Sun. Orienting the future of bio-macromolecular electronmicroscopy. Chin. Phys. B. 2018, 27(6): 063601Glaeser RM, Han BG. Opinion: hazards faced by macromolecules whenconfined to thin aqueous films. Biophys Rep. 2017, 3(1):1-7Noble AJ, Wei H, Dandey VP, Zhang Z, Potter CS, Carragher B.Reducing effects of particle adsorption to the air-water interface in cryoEM.doi: https://doi.org/10.1101/288340Palovcak E, Wang F, Zheng SQ, Yu Z, Li S, Bulkley D, Agard DA, ChengY. A simple and robust procedure for preparing graphene-oxide cryo-EM grids.doi: http://dx.doi.org/10.1101/290197Russo CJ, Passmore LA. Electron microscopy: Ultrastable goldsubstrates for electron cryomicroscopy. Science. 2014, 346(6215):1377-80.Sader K, Stopps M, Calder LJ, Rosenthal PB. Cryomicroscopy ofradiation sensitive specimens on unmodified graphene sheets: reduction ofelectron-optical effects of charging. J Struct Biol. 2013, 183(3):531-536来源:【生物成像中心】欢迎大家分享讨论使用过的载网支持膜[img]https://simg.instrument.com.cn/bbs/images/default/em09505.gif[/img]
[size=16px][color=#ff0000][b][url=https://www.instrument.com.cn/job/position-86169.html]立即投递该职位[/url][/b][/color][/size][b]职位名称:[/b]【厦门大学】国家工程中心冷冻电镜平台 技术人员-厦门市[b]职位描述/要求:[/b]1. 岗位职责:◆配合平台负责人,全面负责平台的运行和维护工作;◆制定仪器操作、人员培训和设备共享的细则和系列规章制度; ◆负责120 kV Tecnai Spirit电镜的日常维护和运行管理工作; ◆负责120 kV Tecnai Spirit电镜机时安排、统计、上样、培训及技术支撑工作; ◆协助完成300 kV Titan Krios冷冻电镜的数据收集工作; ◆参与开展平台安排的技术创新研究工作; ◆平台交办的其他工作。2. 任职要求:◆政治立场坚定,严格遵守各项法规制度,服从平台工作安排; ◆本科、硕士及以上学历(特别优秀者学历不限),具有电镜相关技术操作、使用和研究经验者或具有冷冻电镜数据处理经验者优先考虑; ◆热爱冷冻电镜平台工作,乐于学习,有创新性思维,动手能力强; ◆工作积极主动,细心踏实,吃苦耐劳,服务意识和责任心强; ◆有一定的英语听说读写能力; ◆有强烈的事业心,良好的沟通能力和团队合作能力; ◆身心健康,愿意长期稳定工作。3. 福利介绍:◆此岗位为劳动合同制。提供同等岗位有竞争力的薪酬,具体面议;◆五险一金、工作餐补贴、生日礼品、结婚礼金、生育礼金、防暑降温补贴,以及各类员工活动;◆年终奖、绩效奖金、项目奖金、每年调薪;◆ 可申请厦门大学教工卡,可享受厦门大学工会福利;◆厦门市政府重点支持行业,符合条件员工可优先享受人才购/租房补贴及厦门市购房补贴(租房500-1200元/月);◆ 符合条件员工鼓励申请厦门市新引进人才生活补贴——硕士3万、博士5万◆普通教育本科及以上可迁入厦门户口(公司集体户)[b]公司介绍:[/b] 为更精准的帮用户选择高校,科研院所相关就业机会,特发布此职位专区,便于求职者第一时间锁定优质的就业机会。...[url=https://www.instrument.com.cn/job/position-86169.html]查看全部[/url][align=center][img=,178,176]https://ng1.17img.cn/bbsfiles/images/2021/08/202108160948175602_3528_5026484_3.png!w178x176.jpg[/img][/align][align=center]扫描二维码,关注[b][color=#ff0000]“仪职派”[/color][/b]公众号[/align][align=center][b]即可获取高薪职位[/b][/align]