最近中西药复方制剂很热,那么中西药复方制剂是利大于弊还是弊大于利呢?参与奖励....
制剂中聚山梨酯 80检测,有做过的朋友分享一下你们的检测过程好吗?
为什么要测定制剂的粒径和ZETA电位?其真正的目的何在?
在众多给药剂型中,喷雾剂是比较常见的剂型,仅通过雾化装置借助压缩空气产生的动力使药液雾化并喷出,由于其不含抛射剂,不使用耐压容器,目前应用越来越广泛。在鼻喷剂研究过程中,对于鼻喷剂粒度分布大小有两个因素影响至关重要,即药物配方和喷射装置,下面我们就通过一些模拟实验来看看激光衍射技术如何来体现这些影响因素。 (太多图片及数据图懒得贴了,大家可以点击看到更详细的文字信息!!) 约稿:激光衍射技术在吸入制剂研究中的应用 http://simg.instrument.com.cn/bbs/images/default/em09511.gifhttp://simg.instrument.com.cn/bbs/images/default/em09511.gifhttp://simg.instrument.com.cn/bbs/images/default/em09511.gifhttp://simg.instrument.com.cn/bbs/images/default/em09511.gifhttp://simg.instrument.com.cn/bbs/images/default/em09511.gifhttp://simg.instrument.com.cn/bbs/images/default/em09511.gif 现在吸入制剂越来越受到大家的重视,不论是气雾、液雾还是粉雾,不论何种形式,粒度检测毫无疑问都是体外检测中不可或缺的一环。当前医药研发的过程实际上就是跟时间赛跑的一个过程,因此在研发期间如何能够快速对大量配方、喷射装置以及测试条件进行筛选和甄别就显得非常关键。而激光衍射技术恰恰具有快速无损的特性,同时其结果比对性又非常强,能够快速提供大量粒径检测的相关数据,为吸入制剂的研发和生产提供坚实的保障。
[size=10.5pt][font=微软雅黑] 农药原药加工成各种制剂时,粒度和粒度分布经常是一个重要控制参数,影响其制品的许多理化性质(例如溶解性、化学反应速度、吸附性等)、 贮藏稳定性、流变行为、生物活性等。 农药被分散的程度,是衡量制剂质量和喷洒质量的主要指标,与农药的储存性能,药效,环保特性等息息相关。准确、全面地测定农药药剂特征粒径和粒度分布对于农药剂型研发、加工至关重要。[/font][/size][size=10.5pt][font=微软雅黑]悬浮剂中悬浮液通常呈现胶体状态,符合胶体稳定性理论。一般情况下,胶体中悬浮粒子粒径越小,具有的稳定性越好,沉降速度慢、低温稳定性也相对较好;胶体粒子在储存过程中有随时间聚集长大的趋势,胶体粒子粒径越大,胶体分散系的稳定性会逐渐变差。因此胶体粒子的聚集与否,是稳定性的关键,粒径变化是影响制剂物理稳定性的主要原因,通过激光粒度仪可以快速的评估悬浮剂中粒子状态,评估制剂储存特性。同时,对于水乳剂分散度提高可以提高乳化率,不致于产生油水分离现象。[/font][/size][font=微软雅黑][size=10.5pt]粉剂的药效和细度有密切的关系,药粒愈小,愈易为害虫吞食,食后亦较易被肠道吸收而发挥毒效。但药粒过细,有效成分挥发加快,药效期缩短,喷药时飘移严重,反而会降低药效,并对环境不利。同时,在粉剂喷洒准备中,其悬浮率与其细度也是直接相关的。因此对生产的粉剂农药粒径进行合理的控制,根据原药特性、加工设备条件和施药机械水平,确定合适的粒径,可以发挥其用药效率,并避免对环境的污染,减少药害的发生。[/size][/font][size=10.5pt][font=微软雅黑] 此外,可溶性粉剂细度有直接要求,例如97%以上小于40um,在激光粒度分析仪测试结果对应参数为D97小于40um,细度与粉剂在水中溶解时间直接相关。种衣剂细度与其成膜性、包衣牢度、缓释性能等密切相关。泡腾片剂的分散粒径与分散时间、30min后悬浮率、热稳定性,缓释性能等相关。[/font][/size]

为促进外用制剂药物的发展,了解外用制剂技术的发展趋势,为广大外用制剂工作者提供应用技术交流的平台,由中国医药生物技术协会主办的“第十届外用制剂行业年会”于2014年12月15-18日在浙江省杭州市如期召开。 会议吸引了约200名来自科研院所、大专院校和企事业等从事外用制剂研发、生产和管理相关从业者;默克密理博作为特约厂商出席了此次会议。 会议上就Strat-M膜在外用制剂透皮扩散实验中的应用,及其优势以及和传统的猪皮、老鼠皮等动物皮肤的对比做了阐述。以其批次稳定性好,保存容易,和人类皮肤相关性极好等特点,受到与会者的一致好评,引发了与会众多老师纷纷前来咨询、交流。http://ng1.17img.cn/bbsfiles/images/2014/12/201412231153_528479_1342_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/12/201412231153_528480_1342_3.png
近年来,FDA鼓励及呼吁制药企业通过建立IVIVC (In Vitro-In Vivo Correlation,制剂的体内外相关性)方法,指导药物的研发并力争豁免生物等效性。其目的一为建立可说明生物利用度的体外质量标准;为制剂批量生产的指控提供依据。建立制剂的IVIVC,可更合理地开展仿制药(特别是缓控释制剂)、创新药物研究;FDA也颁发了IVIVC相关的研究指南。美国Simulations Plus开发的制剂模拟软件GastroPlus IVIVC模型基于独有的机制性的去卷积方法,基于BCS分类创始人Amidon教授的胃肠道CAT模型开发了ACAT模型。FDA药品审评中心仿制药司采用GastroPlus IVIVC模型进行大量缓控释制剂研究。2014年3月美国Simulations Plus与FDA合作开发机制性吸收模型(MAM,mechanisticabsorption modeling)。2014年9月获得FDA总计60万美金共同开发眼部模型。如需了解更多资料可下载附件

作者:曾中强(怀化市中医院药剂科,湖南怀化,418000)摘要: 目的:建立高效液相色谱法测定益母草药材及其颗粒制剂中水苏碱含量的方法.方法:色谱柱为Diamonsil C18(4.6mm×250mm);流动相为甲醇-0.05mol/L磷酸二氢钾溶液(70:30);检测波长210 nm,柱温25℃,流速1.0mL/min.结果:益母草药材及其制剂中水苏碱的保留时间均为15.1 min,色谱峰分离良好,对照品水苏碱线性范围为1.01~30.39 ug/mL(R2=O.9997,n=5),方法回收率为100.1%,RSD为1.03%。结论:该法可用于益母草流浸膏中及其颗粒制剂中水苏碱的含量测定,可以用来对提取物及相关制剂进行质量控制。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208071358_382237_1609970_3.jpg
辅料对于制剂人来说,就像大厨手中的佐料,其作用可以见一斑,可以说,没有这东西,我们只好回家卖红薯了,那个似乎不需要佐料。但是制剂就像做饭一样,有些特殊食材,或者某些厨师个人喜好的问题,喜欢一些重口味,这个时候就有了一些特殊辅料的出现。像我们这些仿制人士,为了和原研一致,这些重口味、不常见的辅料就成了挑战,这里笔者抛砖引玉,介绍了一些不常用而又无法替代的的辅料,希望其他园友继续补充,大家一起学习。
无论是自愿的还是形式所迫的转型,国内药企搞制剂出口还是习惯于一窝蜂,听说国家要扶持,管他有没有比较优势,有否可行性,先上了再说,前段时间通用名药物国际化专项没想到一下扶持30余家企业搞国际化,看得人热血沸腾,全球市场仿佛即将就是中国药企的盘中菜了。就像国内争取科研项目一样,管他怎么样,扶持资金几千万搞到手里才是首要的。滥竽充数者有之,浑水摸鱼者有之,盯着国内虚晃国外的也有之。昨天还在担忧国内仿制药的质量和安全问题,今天就开始大干快上,一下就有30余家企业有实力走向世界了,呵呵,势头太猛,已经有人在担心产能过剩的问题了。其实大可不必担心,过剩了没有比较优势的自己会死掉退出。更何况,出口规范市场并不是做衣服、拉链和钢铁,上了就能销售的,更大的可能是,以国内目前的质量管理现状,上的越大死的越快。毕竟这事可不是国内市场靠“营销”就可以征服的,意愿、能力、比较优势一个都不能少,研发、认证、文号、产能、高效管理、产业链一体化、成本优势、销售渠道等等缺一不可。缺任何一环,产能投产就等于折旧亏损。看看国内“致力于”制剂出口的企业,哪些是靠谱的:1、海正药业:05年就开始不断投入,后续两次增发募投,预计2012年底,海正药业在杭州富阳基地约80亿粒的固体片剂及其他注射剂产能将建成;该基地总投资30亿元,原始定位原料药及制剂出口,本来承载着海正甚至国内医药界期望的大手笔,由于文号认证的问题,返回来装进了海正辉瑞合资公司,在出口和国内市场之间摇摆,做了辉瑞的垫脚石和马前卒。欧洲出口吹得很**的他克莫司胶囊也未见起色,但还是相信海正制剂出口会实现的,毕竟他世界级的原料药还是很强大的,但还需要时间。2、恒瑞医药:尽管国内营销、关联问题倍受诟病,但这个企业研发和质量一直盯着国际领先水平。所以能够取得欧洲、美国注射剂的通行证也不意外,可喜可贺。恒瑞薄弱环节比较少,只是需要时间扩产产品线,增加效益比,以有效打开销售市场。对国内价格和招标的意义更大,恒瑞大概率会成为国际化中型药企。也算承载着我国医药国际化的期望,特别是如果创新药做出原创重磅,将来会走向武田走过的道路。3、华海药业:做的是相对容易的固体制剂仿制药,文号、销售刚刚摸到门道,产能规划200亿片,总投资13亿元。加上原有20亿片产能,和在建的5亿片肿瘤药产能,一旦建成合计达到225亿片。这个规模放在全世界可以做到仿制药前5名。33亿片已经建成,本身单位产能投资就最低,花的钱还比预算少。野心很大,关键在于怎么消化。原料药、管理、成本等都不是问题,需要文号、销售模式支撑,好在慢慢摸到了门道。大概率会成为国际化中型药企,但是长期的隐忧在于往高端爬升的新药进度、生物药介入较晚。4、海翔药业:像8年前的华海,规划制剂投资产能8亿片,投资1.5亿元。限制太多,目前还看不到希望所在。就是搞成了也没有什么比较优势,而且留给中国企业的大概就5年机遇期。5、浙江医药:募资20亿元,增资浙江昌海实施“生命营养品、特色原料药及制剂出口基地建设项目”。包括年产能42.75亿粒的口服制剂及年产300万瓶的冻干粉针剂与口服溶液等。预计两年半后完工,只能说还早,投产会不会和海正一样,难说,不确定性太多。好在浙江医药原料药业务利润现金流充足,估值也低,即使失败也不至于致命。6、 深圳立健药业:头孢类制剂自主出口欧盟,后头做国内市场的模式比较成功,但是规模很小,出口几千万,总产值约2亿。研发、产品线等受限,难以承载做大做强的希望。7、京新药业:他汀类为欧洲纯粹代工,5分钱一片,自己缩减募投产能10亿片至8亿片。8、东阳光药业:03年成立,目标是为欧美制药企业代加工制剂产品,即贴牌加工;长远目标是向美国FDA和欧洲EMEA递交制剂产品注册申请,真正把中国自主品牌的制剂推向欧美市场。目前已有产品美国获批,但产品单一销售受阻。9、人福医药:人福普克预计今年将通过FDA的cGMP认证,通过购买ANDA走捷径。反正既没有原料药支撑,也没有研发支撑。但是喊的很响亮:“人福医药已在美国研发和获得近20个美国食品和药物管理局颁发的药证。其位于光谷生物城的药品出口基地,一期工程的设计产能达15亿粒软胶囊,将于今年起全部出口到欧美市场。”人福医药董事长王学海曾表示,预计今年人福普克在美国市场能实现5000万元人民币的药品销售额,明年就能做到3亿元人民币的销售额;而5年后的目标,则是做到30亿元人民币。10、绿叶制药:绿叶制药在新加坡、马来西亚、越南、菲律宾、印尼等东南亚国家和地区获得血脂康系列、绿汀诺、麦通纳、欧莱等产品的注册并实现销售。公司2006~2009期间连续三年制剂产品出口增长率达到269%,实现跨越式发展。系列产品在俄罗斯和韩国的注册工作也在进行中,血脂康在美国已开展二期临床实验。走的是农村包围城市的路线。11、其他:目前已有20余家企业取得制剂的欧洲、美国、日本和世界卫生组织等规范市场认证。实现出口的也不少,但是都还很小,没看出来明显的优势和代表性模式。包括山东新华、桂林南药、新北江制药、浙江万丰、浙江日升昌、齐鲁制药、北京赛科、华益药业、北京悦康、深圳九新、杭州民生、深圳致君、康恩贝、北京泰德等等,还有石药、华北制药等国企也在搞,手笔惊人。但国企手笔越惊人,后果可能越恐怖。这样算起来确实有近30家。但需要面对的是全世界30余家国际化仿制药企的堵截和拼杀。这可不比国内市场,一个产品一个关系就可以放量。[color=#444444
作者:张玉题目:雷公藤中有效成分的提取分离与微球制剂的制备期刊:天津大学年份:2008链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&QueryID=4&CurRec=130&dbname=CMFDLAST2010&filename=2009073152.nh&urlid=&yx=
[size=12px]点击链接链接查看更多:[url]https://www.woyaoce.cn/service/info-18244.html[/url]酶制剂是指从生物中提取的具有酶特性的一类物质,主要作用是催化食品加工过程中各种化学反应,改进食品加工方法。其应用领域遍及轻工、食品、化工、医药、农业以及能源、环境保护等方面。对于酶制剂,广州工业微生物检测中心拥有丰富的检测经验、先进的实验室设备及权威的检测能力。用户或商家在选购或生产时,可把样品送到检测中心进行检验,以确保酶制剂质量可靠。[color=#777777] [/color][/size][table][tr][td=1,1,56][size=12px][font=Times, serif] [/font][font=宋体]产品类型[/font][font=Times, serif] [/font][/size][/td][td=1,1,125][align=center][font=宋体][size=12px]检测项目[/size][/font][/align][/td][td][align=center][font=宋体][size=12px]检测标准[/size][/font][/align][/td][td=1,1,0][size=12px][/size][/td][/tr][tr][td=1,2,56][align=center][size=12px][font=Times, serif] [/font]酶制剂[font=Times, serif] [/font][/size][/align][/td][td=1,2,125][align=center][size=12px][font=Times, serif] α[/font]-淀粉酶、[font=Times, serif] [/font][/size][/align][align=center][size=12px]糖化酶、[font=Times, serif] [/font][/size][/align][align=center][size=12px]糖化酶、[/size][/align][align=center][size=12px]蛋白酶、[/size][/align][align=center][size=12px][font=Times, serif]SOD[/font]活力、[/size][/align][align=center][size=12px]纤维素酶、[/size][/align][align=center][size=12px]脂肪酶、[/size][/align][align=center][size=12px]木聚糖酶、[/size][/align][align=center][size=12px]果胶酶、[/size][/align][align=center][size=12px][font=Times, serif]β-[/font]葡聚糖酶[/size][/align][/td][td=1,2][align=center][size=12px][font=Times, serif]GB 8275[/font]-[font=Times, serif]2009 2.2[/font]食品添加剂[font=Times, serif]α[/font]-淀粉酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.1[/font]-[font=Times, serif]1993[/font]工业用[font=Times, serif]α[/font]-淀粉酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 24401-2009α[/font]-淀粉酶制剂[/size][/align][align=center][size=12px][font=Times, serif]GB 8276[/font]-[font=Times, serif]2006 2.2[/font]食品添加剂糖化酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.2[/font]-[font=Times, serif]1993[/font]工业用糖化酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.31993[/font]工业用蛋白酶制剂[font=Times, serif]([/font]第二法 紫外分光光度法[font=Times, serif])[/font][/size][/align][align=center][size=12px][font=Times, serif]GB/T 23527-2009[/font]蛋白酶的测定[/size][/align][align=center][size=12px][font=Times, serif] GB/T 5009.171-2003[/font]保健食品中超氧化物歧化酶的活性第一法[font=Times, serif] [/font][/size][/align][align=center][size=12px][font=Times, serif]QB 2583[/font]-[font=Times, serif]2003[/font]工业用纤维素酶制剂酶活力测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 23881-2009[/font]饲用纤维素酶活性的测定 滤纸法[/size][/align][align=center][size=12px][font=Times, serif]QB 1805.4[/font]-[font=Times, serif]1993[/font]工业用脂肪酶制剂活力测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 23535-2009[/font]脂肪酶的测定[/size][/align][align=center][size=12px][font=Times, serif]GB/T 23874-2009[/font]饲料添加剂木聚糖酶活力测定[/size][/align][align=center][size=12px]分光光度法[/size][/align][align=center][size=12px][font=Times, serif]QB 1502-92[/font]食品添加剂 果胶酶制剂[/size][/align][align=center][size=12px][font=Times, serif]NY/T 911-2004[/font]饲料添加剂[font=Times, serif]β-[/font]葡聚糖酶的测定 分光光度法[/size][/align][/td][td=1,1,0][size=12px][/size][/td][/tr][tr][td=1,1,0][size=12px][/size][/td][/tr][/table]
(一)中药制剂化学成分的多样性与复杂性: 1.任何一种中药的化学成分都十分复杂,包括各类型的有机和无机化合物,由几味以至几十味药组成的复杂中药制剂所含成分更为复杂; 2.中药制剂化学成分可以是不同类别的,如生物碱,黄酮等,在相同类别的成分中可能含有性质相近的多种同系物; 3.中药制剂中所含成分的含量高低差别很大,含量高者可达百分之几十,低者可至千成分之几; 4.有些化学成分还会相互影响,含量发生较大变化,给质量分析增加难度。 (二)中药制剂原料药材质量的差别 1.原料药材的品种,规格,产地,生长环境,药用部位,采收季节,加工方法等均会影响药材中有效成分的含量,从而影响中药制剂的质量和临床疗效。 2.炮制方法的影响中药材经加工炮制后,其化学成分,性味,药理作用等方面都会发生一定的变化,为了保证中药制剂的质量,药材应严格遵守中药炮制规范,对炮制工艺,成品质量都要严格把关,才能保证中药制剂质量稳定,可靠。 (三)以中医药理论为指导原则,评价中药制剂质量 1.中药制剂的组方原则有君,臣,佐,使之分,在进行质量分析时,首先进行组方分析,按功能主治分出君,臣,佐,使药味,选择合适的化学成分为指标来评价中药制剂的质量。医学教育网搜集整理 2.由于中药成分的复杂性,药理作用的多方面性,难于以某个或某些成分的含量评价中药制剂质量。目前多根据制剂中单味药有效成分的特性建立控制制剂中某味药质和量的检测方法,随方分析主药或药群的有效成分,进行质量评价。 3.在检测成分上也要注意中医临床功能主治与现代药理学相结合进行研究 (四)中药制剂工艺及辅料的特殊性 1.同一种中药制剂,由于不同生产厂家生产工艺上的差别,将会影响到制剂中化学成分的含量。 2.中药制剂的剂型种类繁多,制备方法各异,工艺较为复杂,很多在单味中药鲜品中存在的化学成分,经过炮制或制备工艺中经加热处理后,结构发生变化,已不复存在或含量甚微,有些则在制备过程中因挥发,分解,沉淀等原因使质量分析更加困难。 3.中药制剂所用辅料各式各样,如蜂蜜,蜂蜡,糯米粉,植物油,铅丹等都可作为辅料,这些辅料的存在,则对质量分析均有一定的影响,需选择合适的方法,将其干扰排除,才能获得准确的分析结果。 (五)中药制剂杂质来源的多途径性 中药制剂的杂质来源要比化学制剂复杂的多, 1.由生产过程中带入的; 2.药材中非药用部位及未除净的泥沙;药材中所含的重金属及残留农药; 3.包装,保管不当所产生的霉变,走油,泛糖,虫蛀等产生的杂质; 4.洗涤原料的水质二次污染等途径均可混入杂质。所以中药制剂易含有较高的重金属,砷盐,残留农药等杂质。 (六)中药制剂有效成分的非单一性 1.中药制剂产生的疗效不是某单一成分作用的结果,也不是某些成分简单作用的加和,是各成分之间的协同作用。用一种成分衡量其质量优劣有失偏颇,某单一成分的含量高低并不一定与其临床作用效果具有简单的线性关系,检测任何一种活性成分均不能反映它所体现的整体疗效。 2.研究复方中药制剂的物质基础,应用灵敏可靠的分析仪器,测定多种有效成分,才能更加科学,客观地评价中药制剂质量。
摘要: 目的 通过处方筛选试验确定利巴韦林葡萄糖注射液的制备工艺。 方法 通过一系列处方筛选优化试验和药物稳定性研究试验,初步确定质量表现稳定的利巴韦林葡萄糖注射液的完整处方。并通过灭菌工艺选择和验证研究,使生产工艺符合国家化学药品注射剂的技术要求。 结果 确定了质量表现稳定的利巴韦林葡萄糖注射液的完整处方,并针对在试验中发现的活性炭对利巴韦林吸附较大的问题,通过试验确定了主药后加的工艺流程,避免了活性炭的吸附影响。结论 本品经由试验确定的制剂工艺具有路线短,污染小,成本较低的优点,有利于转化为产业化大生产,将具有较好的经济效益和社会效益。关键词:利巴韦林;葡萄糖;注射液;制剂;利巴韦林(Ribavirin)是一种广谱抗病毒核苷类药物,在体内、体外对多种病毒的脱氧核糖核酸(DNA)或核糖核酸(RNA)的合成有显著抑制作用。data:image/png;base64,R0lGODlhxQDNAHcAMSH+GlNvZnR3YXJlOiBNaWNyb3NvZnQgT2ZmaWNlACH5BAEAAAAALAIABQC/AL8AhQAAAAAAAB0AAAAAHQAAMwAdPQAdMgAcSAAzWh0zWh1GbDMAAD0dADQdNDMeRzNbgEgcAEgdHUceM1ozAEg0AFszM11/f0huf1l/bmxGHW5dXX9/XX9uSG6AbmaIiIBbM4iIZgECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwb/QIBwSCwaj8ikcslsOo2BKOFJrVqv2Kx22/wEigEFd0wum89ar5iYCTzQ8Lh8joVMjYsDfc/vzwVJA36DhIVWAQhHE1+GjY6PAIxHkpCVlnICekYQgpeen2ScF3iaoKanVZRDqqitrpNgr7KzRQtRAaW0uru8vb6/wMHCw2esxMd9xsjLcsrMz2bO0NNPxtLU2ErW2dxU293gS6zXV17WUQAMt52Rt2vhyarkWLhGEUQC70ITd/CE8nBsLVlwJJc/PwDPOIhURAIRgkUmGDyYLBYcZxCLTKTIJyGZhQAWsHM4xNatW7miJOJIx2MZDgL6PSw4JAEAmPpYXgRzsqdP/59FQALwMoWkkAU5JRrJsFFnnHlX2hioRdNIU6fFzAgV0kYm0ogTM2DdA1ULP3xHZI7taGYRuoZCIKxbdWttxVZv7KIpayin3jF8C51U+5de4XCBDwNLrNgX48a9HkPWJXmyt3o8Me+1jPDIvaec/dhaSTa0n4WqjEYzfRqAXCKqyVRmXQWkyCGxucymjSXmTt59hBIFoPrnSSa7gT/ZKrVBNeN1lQcv0lW2dEdnrV+X4zYMXO3bF4cXlnx8o/LmoWxelf53Vvbty7jUQgl9/PlZ6seXTwS9/v26WQQeQwDSJyBg/RVoIHz8MahgKgcimOCDEE64moMUNvHfe0LYt/8dfhJimGESIAZo4YjaRNggik6UiGAUBrUBI4sEiohGG1fR6KIZo323i1xRsHMcEUAGQJghO2pFgXe4/QKIEWolyZYhC8mVF3G/fEWEUjZ6eAgktwmTERGl2HFEHo54udwQvmHpi5ZDcAlAJkdwkqYjWxnpZi8m9VSKM2o+RyUYBjj3ZlJ/krZloN5YouebVc0ZiKOEbDXEkbPAuU+Z7DyU4yBvkRVqk5BaNYQXigLQxpWU8pZPRDK1QdoirF7CKDRFCunOQ9GhMuqIv0Li363IBHuniaYZi2RlxFLTbDVCmDPJqMqGVu0jmg3xWYfmXWuIQCTe9wlqPgLorWA0tlP/iW0joXguHzBhSuGzSORZlI6XSJUuvUdYWh2L/DaRnbuGdJdTbg9WVqS86VZ4hZQNI2eYeg9HXCMVZpJSccSM0blJp9ByvDEsX4pcBaqKuFFywx1vZOfK+2IB8lETs0xPqm3UHHNUiMSp8sg7Y9Hnp+JYHHC4JoeMXFlH28V0YFA1vVbUOiNtszjMXiP1WFoPSPHV00ajzNZYjQ3a10HTNcc4Rqt40YZBv7si2U4xIrXdRsv9Nt068c1t0thafDGSgg+OruB67+V332Qnbu6xhTsu2+J130153YQXrjaol1f+T+eM89ur5urGQ3p/ooNe+bOjny75w6qXzXrsq7f0/3qGtwt6OhS5L0277Iy2vns7wfc+r/FICD888Xsvz7uayi8ffX7I41496r87Dd323A/pfGbdh//T99OKb/711p9vPvnJc8i+2wu+D39+8qMdYv1/r4i/4VtkX5iH/vsLAPdno/jtb4AE5J8B8YdAAjbwgO5jYATr90AJXsiBE5RfBRPIwTEsjEhz6dD0PjiEXNEFfayZz5OKIC8VpgVwDhrTPqx2Ik0BQE4sylgtSiFDIbjsSGiimanS5bEivCwkiDpCEYnEDhvikGDtO8pPNgKokkyRZanahyR6+MQOZfGGP3Mi0fazQiM0MVJoQcIZh0ijI3qqJEn82Jl4GEcaoTSMDT8LCRpP1TM8XqmHABjjfmTlM1aVcR8tnJUqXrUlhlGoT0YMIfGYhIfWmVCEUfALNIIAADs=图1-1 利巴韦林的分子结构目前利巴韦林已在全球44个国家上市,相关制剂从口服、注射到外用,可谓应有尽有。本课题通过一系列处方筛选优化试验和药物稳定性研究试验,初步确定利巴韦林葡萄糖注射液的完整处方。通过灭菌工艺选择和验证研究,使生产工艺符合国家化学药品注射剂的技术要求。并针对在试验中发现的活性炭对利巴韦林吸附较大的问题,在查找、研究文献的基础上,通过试验确定了主药后加的工艺流程,避免了活性炭的吸附影响。1材料1.1 试剂利巴韦林(湖北潜江制药股份有限公司,国药准字H19999139);针用活性炭(上海活性炭厂);氢氧化钠、盐酸均为分析纯。1.2 仪器梅特勒pH计PE20K(梅特勒);Agilent 1100型HPLC(安捷伦);岛津UV2450紫外分光光度(岛津);电热鼓风干燥箱DHG-9123A(上海精宏实验设备有限公司);美的冰箱 BCD-183CM(美的集团冰箱制造合肥有限公司);YB-2照度仪(天津天光光学仪器有限公司)。2方法2.1 处方与依据利巴韦林葡萄糖注射液为利巴韦林和葡萄糖的灭菌水溶液。目前,利巴韦林葡萄糖注射液在国内上市的规格有100 ml : 0.1 g、100 ml : 0.2 g、100 ml : 0.5 g、250 ml : 0.25 g、250 ml : 0.5 g、500 ml : 0.5 g,在临床上用于治疗由呼吸道合胞病毒感染而引起的病毒性肺炎及支气管炎。在不改变原使用方法的情况下,我们拟开发规格为100 m l: 0.1 g、100 m l: 0.2 g、100 ml : 0.5 g的利巴韦林葡萄糖注射液。2.2 处方筛选按照注射液研究的一般要求,设计以下处方,逐步开展试验。2.2.1 处方1首先,对规格为100 ml: 0.5 g的注射液,进行处方筛选试验。处方1的设计方案如下: 利巴韦林 5 g 葡萄糖 50 g 注射用水 加至1000 ml 称取上述处方量的主药和葡萄糖,加入80%注射用水,搅拌使完全溶解,然后再加入注射用水至全量,检查外观,并测定pH值。2.2.2 处方2 处方2的设计方案如下: [td=1,
液体制剂 第一节 概述 液体制剂是指药物分散在液体分散介质中所制成的内服或外用制剂。对于由浸出法或经灭菌法制备的液体制剂将分别在浸出制剂和注射剂或其它章节中论述。 液体制剂的分散相,可以是固体、液体或气体药物,在一定条件下分别以颗粒、液滴、胶粒、分子、离子或其混合形式存在于分散介质中。药物在这样的分散系统中,分散介质的种类、性质和药物分散粒子的大小对药物的作用、疗效和毒性等有很大影响。 (一).特点 液体制剂与固体制剂(散剂、片剂等)相比有以下特点: (1)药物的分散度大,接触面积大,吸收快,能迅速发挥疗效。 (2)给药途径广泛,可用于内服,也可用于皮肤、粘膜和腔道给药。 (3)便于分取剂量,服用方便。 (4)减少某些药物的刺激性。一些易溶性固体药物如溴化物、碘化物、水合氯醛等口服后,因局部浓度过高,对胃肠道有刺激性,若制成液体制剂则易控制浓度而减少刺激。 但液体制剂尚存在许多需要注意和有待解决的问题,如化学稳定性差,药物之间容易发生作用而致减弱或失去原有的效能;以水为溶剂者易发生水解或霉败;非水溶剂的生理作用大、成本高,且有携带、运输、贮存不便等缺点。 (二).质量要求 (1)溶液型液体制剂应澄明,乳浊液型或混悬液型制剂应保证其分散相粒子小而均匀,振摇时可均匀分散。 (2)浓度准确、稳定、久贮不变。 (3)分散介质最好用水,其次是乙醇、甘油和植物油等。 (4)制剂应适口、无刺激性。 (5)制剂应具有一定的防腐能力。 (6)包装容器大小适宜,便于病人服用。 二、液体制剂的分类 液体制剂尚没有较理想的分类方法,目前常用的分类方法有两种,即按分散系统分类和按给药途径及应用方法分类。 (一)按分散系统分类 分成均相(单相)与非均相 (多相)液体制剂。在均相液体制剂中,药物以分子、离子形式分散在液体分散介质中,没有相界面的存在,称为溶液(真溶液)。非均相液体 制剂中,药物是以微粒(多分子聚集体)或液滴的形式分散在液体分散介质中, 表2—1分散体系的分类 类型 分散相粒子大小 特征 举例 分子分散系 lOOnm 有界面,非均相,热力学不稳定体系,形成混悬剂或乳剂,扩散很慢或不扩散,显徽镜下可见 无眯氯霉素混悬剂,鱼肝油乳剂等 (二)按给药途径与应用方法分类 1.内服液体制剂:如合剂、芳香水剂、糖浆剂、部分溶液剂、滴剂等。 2.外用液体制剂,包括有: (1)皮肤用液体制剂如洗剂、搽剂等。 (2)五官科用液体制剂如洗耳剂、滴鼻剂、含漱剂、滴牙剂等。 (3)直肠、阴道、尿道用液体制剂如灌肠剂、灌洗剂等。 三、液体制剂常用溶剂 优良的溶剂应该化学性质稳定、不影响主药的作用和含量测定、毒性小、成本低、无臭味且具有防腐性等。 (一)极性溶剂 1.水(water) 水是最常用的极性溶剂,本身无任何药理及毒理作用,价廉易得。能与乙醇、甘油、丙二醇等极性溶剂任意混合。但水性液体制剂不稳定,易长霉,不宜久贮。配制水性液体制剂宜用蒸馏水或去离子水,因饮用水杂质较多,故不宜用作溶剂。 2.乙醇(alcohol) 乙醇是除水以外最常用的有机极性溶剂。可与水、甘油、丙二醇等任意混合。乙醇的溶解范围也很广,能溶解大部分有机物质和植物中成分,如生物碱及其盐类、甙类、挥发油、树脂、鞣质及某些有机酸和色素等。其毒性比其它有机溶剂小,20%以上的乙醇即具有防腐作用。但与水相比有成本高,本身有药理作用,易挥发及易燃烧等缺点,其制剂应密闭贮存。 3.甘油(glycerin) 甘油为粘稠性液体,味甜(为蔗糖甜度的60%)、毒性小,能与水、乙醇、丙二醇等任意混合。可内服,也可外用。甘油多作为粘膜用药的溶剂,如酚甘油、硼酸甘油、碘甘油等。在外用液体制剂中,甘油还有防止干燥(作保湿剂)、滋润皮肤、延长药物局部疗效等作用。此外,甘油有防腐性,但成本高。 4.丙二醇(propyleneglycol) 药用品是1,2—丙二醇,性质与甘油相似,但粘度较甘油小,可作为内服及肌内注射用药的溶剂,毒性及刺激性小。 5.聚乙二醇类(polyethyleneglycol,PEG) 低聚合度的聚乙二醇,如PEG300~400,为透明液体,能与水任意混合,并能溶解许多水溶性无机盐和水不溶性有机物。 6.二甲基亚砜(dimethylsulfoxide,DMSO) 本品具有较大的极性,其结构为(CH3)2SO,能与水、乙醇、甘油、丙二醇等相混合,一般用其40%一60%的水溶液为溶剂。本品溶解范围很广,许多难溶于水、甘油、乙醇、丙二醇的药物,在本品中往往可以溶解,故有“万能溶剂”之称。但本品高浓度可引起皮肤灼烧感、瘙痒及发红。 (二)非极性溶剂 1.脂肪油(fattyoils) 脂肪油为常用的一类非极性溶剂,能溶解油溶性药物如激素、挥发油、游离生物碱及许多芳香族化合物等。常用的有麻油、豆油和花生油等植物油,多用于外用制剂,如洗剂、搽剂、滴鼻剂等。本品不能与水、乙醇、甘油等混合。 2.液状石蜡(1iquidparaffin) 本品为无色透明液体,是从石油矿中所得的液状烃的混合物。 3.油酸乙酯(ethyloleate) 本品为淡黄色或几乎无色易流动的油状液体,,酸值≤0.5,碘值75~85,皂化值177~188。 4.肉豆蔻酸异丙酯(isopropylmyristate) 本品常用作外用药物的溶剂,特别当药物需要与患部直接接触或渗透时更为理想。本品刺激性极低,无过敏性,可忍受性优于麻油和橄榄油。 第二节 溶解度、溶解速度及影响因素 一、溶解度及溶解速度 (一) 溶解度 药物的溶解度(solubility)是指在一定温度下(气体要求在一定压力下),在一定量溶剂的饱和溶液中溶解的溶质量。《中国药典》1995年版二部用以下名词表示药物的溶解度: 极易溶解:指溶质1g(m1)能在溶剂不到lml中溶解。 易溶,指溶质1g(ml)能在溶剂1~不到10ml中溶解。 溶解:指溶质18(ml)能在溶剂10~不到30ml中溶解。 略溶:指溶质1g(m1)能在溶剂30~不到lOOml中溶解。 微溶;指溶质1g(m1)能在溶剂lOO~不到1000ml中溶解。 极微溶解;指溶质1g(m1)能在溶剂1000~不到10000ml中溶解。 几乎不溶或不溶:指溶质1g(m1)• 在溶剂10000ml中不能完全溶解。
摘要] 本文以审评工作中遇到的固体分散体制剂、透皮贴剂等为例,讨论了制剂的残留溶剂对其质量、安全性的影响,希望引起药物研发者对制剂的残留溶剂研究的关注。 [关键词] 制剂 残留溶剂
目前,知道的中药缓控释制剂都有哪些呢?

[font=宋体] 阿戈美拉汀杂质是在阿戈美拉汀的生产或保存过程中产生的非目标化合物。这些杂质可能会影响阿戈美拉汀的纯度和药效。阿戈美拉汀[/font][font=宋体]在临床上[/font][font=宋体][font=宋体]是一种治疗抑郁症的药物,属于褪黑素受体激动剂和[/font][font=Calibri]5-[/font][font=宋体]羟色胺受体拮抗剂。[/font][/font][font=宋体][font=宋体] 阿戈美拉汀杂质有多种类型,每一种都具有不同的化学特性,如[/font][font=Calibri]CAS[/font][font=宋体]号、分子式、分子量等。例如,阿戈美拉汀杂质[/font][font=Calibri]7-Desmethyl-3-hydroxyagomelatine[/font][font=宋体]([/font][font=Calibri]3-Hydroxy-7-desmethyl agomelatine[/font][font=宋体])是[/font][font=Calibri]Agomelatine[/font][font=宋体]的代谢产物,其[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]166526-99-4[/font][font=宋体],纯度为[/font][font=Calibri]98%[/font][font=宋体],具有特定的化学结构和性质。另一种阿戈美拉汀杂质是[/font][font=Calibri]AgoMelatine DiMer Urea[/font][font=宋体],其[/font][font=Calibri]CAS[/font][font=宋体]号为[/font][font=Calibri]185421-27-6[/font][font=宋体]。[/font][font=Calibri]CATO[/font][font=宋体]标准品提供的阿戈美拉汀全套的杂质[/font][/font][font=宋体],[/font][font=宋体]这些杂质对于药物的纯度和稳定性研究至关重要,也是药物研发过程中不可或缺的一部分[/font][font=宋体]。[img=,606,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402182106267012_9724_6381607_3.png!w606x514.jpg[/img][/font][font=宋体][color=#05073b][back=#fdfdfe] 广州[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]佳途科技[/back][/color][/font][font=宋体][color=#05073b][back=#fdfdfe]股份有限公司[/back][/color][/font][font='Segoe UI'][color=#05073b][back=#fdfdfe]深知药物研发与质量控制的重要性[/back][/color][/font][font=宋体][font=宋体],[/font][font=Calibri]CATO[/font][font=宋体]标准品厂家,提供阿戈美拉汀全套[/font][/font][font=宋体]的[/font][font=宋体]杂质,为客户提供更加精准、可靠的分析标准品,助力药物研发事业的快速发展[/font][font=宋体],[/font][font=宋体]以满足客户在药物研发和质量控制方面的需求。[/font]
生物制剂 是用病原微生物(细菌、病毒、立充次体)、病原微生物的代谢产物(毒素)以及动物和人血浆等制成的制品,可用于预防、治疗和诊断疾病。用于防治传染病的生物制品可分为人工自动免疫制品(如疫苗和类毒素等)和人工被动免疫制品(如丙种球蛋白、白喉抗毒素、破伤风机毒素等)常用的生物制剂有干扰素、白介素、肿瘤坏死因子等。其主要特点为: 1、生物活性功能多,均具有抗肿瘤、抗病毒和免疫调节活性。 2、作用范围广,在体外这些生物制剂几乎对所有肿瘤细胞都有抑制效应。 3、对机体的免疫功能有调节增强作用。
您好!您可以告诉我微电泳法测定微粒分散制剂的荷电性质与ZETA电位这种实验仪器的销售厂家吗?急!!!多谢!
自己也尝试着将这几年的工作进行了一下小结。同前面两位前辈相比,我出道尚浅,谈不上什么经验,只能算是个人的一点心得体会吧,在高手们面前班门弄斧,仅供刚从事工作的学弟学妹们参考吧。由于自己是药剂专业的,一直从事相关的研发工作,所以将题目定为致:从事制剂研发的学弟学妹们从学科发展来说,药剂学从最初的工业药剂学,扩充到了物理药剂学(物理药学)、药用高分子材料学、药物动力学与生物药剂学、临床药剂学等等。因此对于从事制剂研究的人员来说,应当具备以下制剂理论吧。一、 必备的制剂理论首先,应当熟练掌握的是《药剂学》和《中药制剂学》两本教科书。有人会说,教科书上的东西太基础了太简单了,肯定是不能再熟悉了。其实不然,就是因为太简单了,我们常常忽视其发挥的作用。明明一个简单问题,其在教科书中也有所说明,但是如果没有意识到的话,往往会将问题复杂化。具体的例子一时没有想起来…….总之希望大家经常的温故而知新,多从字里行间中品味吧。其次,药剂学已经从最初的丸丹膏散历经常规制剂、缓控释制剂、靶向制剂、透皮制剂、发展到了第五代自调式智能给药系统。所以还需关注的两本书是《药物新剂型与新技术》《中药新剂型与新技术》(当然还有生物制剂新技术之类的,本人没有接触过,就不再罗列),这两本书涉及到的制剂信息量比较多,可以很好的扩充知识面。再者,如果数学和物理化学功底比较好的话,建议多看看《物理药学》、《生物药剂学和药物动力学》,前者主要是利用物理化学理论来解释制剂方面的问题吧,制剂学理论起源于物理化学吧。参加过近两届的中美药学论坛同行都能体会到,在国外的制剂过程中,对物理药学关注的非常多,而且做的也非常细,值得咱们好好的学习。另外,从事化药制剂的同行都熟悉,口服制剂基本上都要做生物等效性,所以,应当好好学习一下第二本书。有人说,会药剂的人饭做得也非常好,本人制剂做得一般,烧得小菜还是满不错得,呵呵(自我夸奖)。之所以这么说,有其道理,饭菜烧得好,油盐酱醋要搭配好,那么对于制剂中得油盐酱醋就是辅料了。因此,《药用辅料大全》(已有新版),和《药用辅料手册》两本书要像菜谱一样必备哦,并且要经常查看,不断更新搭配(方能改善口味)。需要说明得是,不要提起某种辅料就只想到是什么剂(填充剂、崩解剂啊),要多想想为什么能做此用途,这就要从其自身得性质来考虑了(如他的结构,分子量,取代度啊等等)。比如提起微粉硅胶,第一印象想到得是助流剂,其可以说是助流剂得经典代表了,其实,微粉硅胶在中药浸膏抗粘、抗湿得应用中也十分广泛的哦。还有,书籍毕竟是有一定的滞后期,要想了解最新的进展,就要多看期刊文献,专利文献,具体的网站就不罗嗦了,大家都很清楚,需要说明的是,在学校里看文献很便利,工作起来往往难以坚持,更多的时候根据需要才查阅文献。这里的建议是要坚持看外文文献(外文书籍也可以),哪怕一周看一篇也行啊。毕竟我们的制剂水平落后国外一大截,当然,这存在种种客观的原因(如整个工业水平,设备、辅料等等),但是,不要过多的抱怨,谦虚的学习吧,“师之长技以制夷”,总有一天咱们会赶美超日的。最后,要特别提醒的是,我们是从事的药品研发,不是纯粹的科研,要实实在在的拿出产品,所以药审中心的《技术指导原则》千万不可忽视,并要作为肘后备急要书。二.制剂技能前面说了一堆的理论,可谓“纸上谈兵”。做制剂的大忌就是一味的专注于上述理论,专注于文献,而袖手旁观(不动手操作)。药剂学是属于工科,是一门实践型的科学,实践、实践、再实践方能体会到药剂的乐趣。药剂简单说起来就是将原料和辅料一对付(混合),在一定的工艺条件下在某一设备上制出来的产品。所以,下面要说的是试验方面的心得:首先,是实验室的基本操作,这些在大学里都接触过,做研究生或博士时又加以强化,因此,大家上手都很快,好多是一看就会。为了避免“眼高手低”,还是要少说多做,从固体制剂的混合、制粒、干燥、压片、装胶囊、包衣到液体制剂浓配、活性炭、粗滤、精滤、灌封、灭菌整个过程都要达到熟能生巧的地步。比如说,有的人一小时只能灌封100支安剖,而有的仅需要一刻钟,为什么啊?“无他,维手熟尔。”试验的过程中还要多总结,不同的剂型各有差异,片剂胶囊颗粒是基本,做中药软胶囊滴丸也得掌握,对于中药来说,浸膏、半浸膏、全粉压片各有特色,醇提浸膏与水提浸膏各有千秋,所以要及时归纳总结。其次,是中试放大,学校里很少能接触到中试。在这里制剂就不能比作做饭了,不能认为简单的由小炒换成了大锅饭。对于做制剂研发的来说,在这方面要谦虚,在此面前“硕士毕业等于零”(没有读博,不敢评论博士)。一定要抛开以前的观念,虚心学习中试。我有幸接触过4个月的中试,最大的感触是从手工作坊进展到了小批量生产,打个比方是“人类从爬行进展到直立行走”。通过中试,才对设备有了感性的认识,才真真切切的体会到什么是总混(槽型混合、V型混合、双锥混合立体混合等)、制粒(湿法、干法、摇摆、一步、喷雾制粒等),干燥(热循环、真空、微波),明白了什么是高效包衣锅(不需要一手拿喷枪一手拿吹风机的),才知道用18冲的压片机压一万片的成品率是很低的,才体会到中药有效成分的转移率也有很多猫腻的,不是那么简单控制的。单举一真空干燥的例子吧,用试验室的真空干燥时,一般来说将浸膏往蒸发皿里一放,就可以抽真空,有时可走开让其连续的抽,顶多溢出一点料粘在壁上,挂下来仍可以用;用真空干燥箱可就不同了,其大约有3、4平大小,师傅让我在抽的过程中不时的用探照灯盯着,不时的开关真空,就是这样,还是一眼没照顾到,跑料了,满烘箱都是浸膏,整整擦了一个下午,而且还没法用了。另外,中试过程中对设备有了亲密的接触,不妨在理论上学习一下有关设备的知识,学者按照说明书撰写设备操作SOP,熟悉一下制药工程方面的书籍。最后,是大生产相关知识,“奋斗10年”在其文中总结了不少。这一方面也是我所欠缺并一直渴望学习而没有机会学到的,所以在此不详细谈,之所以提出来,希望有机会接触的学弟学妹们一定要利用好机会学习。通过与大生产人员的接触,最大的感触就是脑子中有了“成本”这一概念。在我们做研究的过程中,考虑更多的往往是如何做出来,不惜使用最好的辅料,这一点本身没有错。但是我想说得是,做出来之后,不要急着定处方,与生产的沟通一下,看看能否改用便宜的辅料。比如说,我在试验中习惯使用PVP做黏合剂,而且用起来也很顺手,有一次,车间反馈说,所制的颗粒在干燥过程中硬度不够,变成了粉末。原来车间多采用沸腾干燥,而实验室用烘箱干燥,最后换用廉价的淀粉浆一试,效果还不错,双方均接受。对此的体会是,我们研发人员的手边要有一本帐,那就是辅料的价格表,如果每一片节约一分钱,放大后节约成本非常客观,哪怕节约几厘,对车间来说都是好事情。因此,要多快好省的制备产品。看到这里,有的人会说,上面的都是小儿科,俺一看就会。那么下一步,我认为就是应该扩充知识面了。三、制剂知识面的扩充首先,给我们提供原料的是合成、植化的人员,有必要多了解一下原料的理化性质等对我们的处方设计有很大的帮助,当然这一点是前面在制备过程中应当具备的,之所以在这里提出来,是想加重一下印象。如《药物制剂化学》、《药物结构与制剂》、《药物的化学稳定性》等方面的书籍浏览一下,遇到问题有这方面的思路。体会比较深的是:要在处方筛选中认真的做影响因素试验,更重要的是要分析其结果,另外,多分析一下有关物质的破坏性试验结果,可以更好的了解原料的性质,对处方设计或许有一定的提示。还有,多查阅一下日本或FDA中的说明书,其中,大多都提到使用的辅料,要详细的分析。还是有很大的借鉴。其次,要学会常规的分析技术,溶出仪,HPLC要熟练使用。并能进行一定的方法学摸索,当然能够做完整的质量标准那就最好了。还有,体内分析,生物等效性对临床人员来说不如咱们制剂的熟悉,如果临床人员不愿做的话,要大胆的接过来做(当然是委托医院),从签订合同、到设计方案、到资料审查、甚至发补也不要怕,都会学到不少的东西。再者,要学会搭建技术平台。制剂涉及到的方面很多,剂型也很杂,一个人的精力是有限的,不可能所有的都精通,所以要结合自己的特长和兴趣,选择一个方向,深入研究。比如,可以选择缓控释制剂,其包括的内容就不少了,骨架制剂(亲水、疏水、融蚀),膜控制剂,虽然国外技术已经很成熟,在国内来说,产业化这一方面还是有很大空间的。有关缓控释的书籍主要有两本吧《缓释控释制剂的设计与开发》(主要是口服缓控释制剂),及《可注射用缓释制剂》(主要是注射缓控释制剂)。最后,做药的要熟悉药品法规,做医药研发的要熟悉药品注册管理办法,依法办事,不要抱有侥幸的心态,不要一味的打“擦边球”,如有精力,还要学习FDA、欧盟的相关法规,毕竟咱们要把自己的产品卖到国际市场上去的,人家做原料药的已经走在咱们前面了,十一五发展指导意见也提出“在化学药物制剂领域,争取有5个制剂产品取得美国或欧盟国家的上市资格,真正进入国际主流医药市场。”咱们要迎头赶上啊。否则,退休的时候说自己是做制剂研发的会让人汗颜的。时间关系,就先写到这里,由于经验尚浅,一些例子可能不太合适,说了不少的废话,请多指正,以在以后的工作中继续完善。如果上面所说的对你来说都小菜一碟的话,那么,你升级的机会到了,没有到的话就要考虑一下自己的待人处事,自己敬业精神,自己的项目管理能力等等。一旦升职应当做什么呢,请高手来谈吧。

http://ng1.17img.cn/bbsfiles/images/2011/06/201106190739_300436_1641557_3.jpg内地首在药品中检出塑化剂 国家药监局紧急通知要求停用药品“力百汀” 广东展开全面清查 国家食品药品监督管理局昨日在其网站上公布通知,要求立即停止销售和使用葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂(商品名为力百汀),已上市的要求召回。经中国食品药品鉴定研究院检验,力百汀中检出邻苯二甲酸二异癸酯(DIDP),即所谓的“塑化剂”。 本报讯 (记者刘俊)昨日,国家药监局官网紧急发出关于停止销售和使用葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂的通知,指经中国食品药品鉴定研究院检验,在上述药品中检出DIDP(即“塑化剂”),这也是继食品、保健品后内地首次检出药品“含塑”。 国家药监局通知表示,经中国食品药品鉴定研究院检验,在葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂中检出邻苯二甲酸二异癸酯(DIDP)。国家食品药品监督管理局决定立即停止葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂产品的销售和使用,已进口上市的由企业召回。 国家药监局这份通报并未同时提供需召回的药品的产地、批次、流向、检出塑化剂含量等更多详情。据记者了解,葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂是处方药,在内地的产品名为“力百汀”(Augmentin)。“力百汀”适用于治疗上呼吸道及下呼吸道感染、生殖泌尿道感染、皮肤及软组织感染、骨和关节感染,以及其他敏感菌引起的感染。 省药监局相关负责人昨日告诉记者,该局已在6月17日下午接到国家药监局通知,并于当天将该通知转发各地市局,在全省范围内部署展开葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂的检查、封存、登记、监督回收等工作。 昨日,记者走访广州市内多家药房,并未找到“力百汀”的踪影。在昌岗路口附近的大参林,销售员查询了电脑后称,只有儿童服用的阿莫西林克拉维酸钾胶囊,是南京一家药厂生产的;在江南大道的百健医药、岁岁康大药房,记者只看到白云山制药和浙江一家药厂制造的阿莫西林克拉维酸钾药片、胶囊。广东金康大药房、健民等药房均表示,已多年未经营“力百汀”。广东老百姓大药房则表示,该药在香港被曝光“含塑”后,为安全起见已将其下架。
开此贴跟大家讨论一下复方制剂杂质的控制以及分析方法建立的一些相关问题。本人在分析实验室做了6-7年仿制药申报,负责药物CMC方面的质量研究工作,接触了十几个项目。基本了解FDA/SFDA审评人员的一些要求和想法。此贴会结合本人的一些经验,探讨复方制剂有关物质分析的一些注意点,并且会结合产品申报以后FDA给的缺陷信,提示大家如何避免同样的问题。更希望抛砖引玉,各位版友和专家踊跃参与,共同提高。废话少说,对于有关物质的研究,最近几年国家法规的要求越来越高,可能大家也越来越重视此项研究。不过一个不可否认的事实是,我们的杂质研究水平和欧美或者印度等国家差距很大。我们的绝大部分药品企业基本处于食物链的最底端,以前经常听我们老板说他在美国的药厂工作的时候,要从其他公司买API,很多都是西班牙的,意大利的,或者印度的药厂以极其低廉的价格从国内厂家购买的粗品,然后拿回去做一到两步的提纯,再做一些法规文件,就可以以很多倍的价格卖出去。我们消耗了主要的人力,物力,牺牲了环境,结果回报只有人家的零头,可悲又可气!所以我们就要具体的看一看到底存在哪些差距。复方制剂有关物质控制的基本原则和单方一样,你就把他当作是在做两个或者三个产品,只不过是同时分析几个物质。相关的指导原则大家也应该都知道, ICH Q3A和Q3B; FDA也有相关的工业指南,跟这两个基本差不多。做杂质研究和其他大部分质量研究工作一样,首先要做的第一步就是去收集资料,包括:1. API厂家的技术资料,一般有DMF的会提供它的open part, 里面会大致列出它的工艺流程,合成路径和所有潜在的杂质。2. 药典的各论,包括USP, EP等等,看看药典有那些要求检测的杂质。3. 查阅文献,看看化合物的潜在杂质和降解产物。这一点对于制剂的杂质控制有时会提供很有用的信息。4. 国内申报仿制药最好弄到进口注册标准,看看原研厂家是怎样控制杂质的。收集完相关的资料后,下面就是分析方法的建立。杂质分析方法的建立又是一个巨大的topic,这里不细说,一个基本的原则就是你开发的方法要是可以用的并且用着比较舒服的,如果连方法开发的人自己都用的疙疙瘩瘩的,经常出问题,可想而知其他人用的会怎么样。另外很重要的一点就是测定有关物质的方法必须具有稳定性指示功能(stability indicating),这是在FDA deficiency letter里面最常见的一条关于分析方法的缺陷。含量测定和有关物质都有稳定性指示功能的要求,因此含量测定和有关物质测定方法一般采用相同的色谱条件,只是浓度有差别。评价方法是否具有稳定性指示功能的主要依据就是stress study (破坏实验),关于这一点,本人会在后面单独论述。杂质分析方法的建立,常见的方法有以下几种:1. 直接用杂质外标法定量这种方法最直接,精确。前提是你的杂质对照品充足而且来源可靠。2.带校正因子的外标法。一般按杂质的限度配置主成分对照品,计算各已知杂质的量时考虑校正因子即可,未知杂质校正因子按“1”算。90%的杂质分析都采用这种方法。3. 面积归一化法计算各杂质的面积百分比,这种方法如果单独作为杂质的检测方法申报,是基本不会被FDA接受的。
胆制剂 胆汁中含有胆盐、胆色素、卵磷脂、胆固醇、粘液蛋白、脂肪以及无机盐类。它们的含量比例随胆汁的来源不同而异。其中以胆盐为最重要。 各种胆酸常以甘氨酸或氨基乙磺酸用肽链结合而成各种胆汁酸,这些胆酸均具有固醇的结构,可认为是胆酸的衍生物,最重要的有胆酸,去氧胆酸。胆盐一般系指担汁酸的钠盐。 胆酸与脂肪酸能化合成次胆酸能溶于碱液及稀酸液中,能扩散,并能降低表面张力增进乳化,故胆汁在肠中对脂肪的消化和吸收有很大功用,此外,对油溶性维生素如A、D、E等的吸收也有同样功用。 胆盐常用于医治多种肝病,亦常用作利胆剂。近年临床用以治疗百日咳、支气管炎等症均有显著疗效。此外胆汁还有轻泻作用。
目前正是感冒的高发季节,患感冒后很多人会自行到药店购药服用,购买中西药复方制剂的不在少数,但却很少有人特意关注其是否为“中西药复方”。有关专家指出,不了解其中既含有中药成分也含有西药成分,超剂量用药、不合理地合并用药等,导致人们在使用中西药复方制剂时存在一些潜在的不安全因素。 去年9月,国家食品药品监管局发布通报,警示公众关注中西药复方制剂维C银翘片的安全性,引起坊间热议。其实,这并不是中西药复方制剂第一次出现在国家食品药品监管局的不良反应通报中,2002年,感冒通片(批准文号为H头,但其中含有马来酸氯苯那敏和人工牛黄等中西药成分)也曾因致血尿被通报。 你知道哪些药是中西药复方吗 公众对中西药复方制剂的认知度有没有随着药品监管部门的通告有所提高呢?记者随机选取维C银翘片、复方感冒灵片、消渴丸、珍菊降压片这四种比较常用的中西药复方制剂,通过网络分别对没有医药知识的普通人群和一线药学服务人员进行了小范围的调查。 在10名普通人中,有8人认为四药是纯中药,一人认为复方感冒灵片是西药,一人说出了维C银翘片含有西药成分;被调查的10名一线药学服务人员虽然知道四药为中西药复方,但具体添加了哪些成分却回答不确切,或表示要“看看说明书”、“查下资料”,并说不会在售药过程中特别提醒消费者。 据了解,经国家审批的含西药成分的中成药有160余种,均为Z字头批号,主要集中在抗感冒药、止咳平喘药、胃肠类药等种类,还有一些降糖药和降压药。添加的西药成分主要有马来酸氯苯那敏、对乙酰氨基酚、麻黄碱、苯海拉明、维生素C等。 尤其应注意的是,目前感冒药市场上的中西药复方制剂约有18种之多,且基本均为非处方药(OTC),不需医生处方,公众可自行购买。如强力感冒片、复方感冒灵片(胶囊)、速感康胶囊等。其添加的西药成分大同小异,除了抗过敏的马来酸氯苯那敏和能够解热镇痛的对乙酰氨基酚,有的还添加咖啡因等兴奋剂类成分。 国家药典委员会执行委员周超凡教授指出,由于在报批时将此类药物统一归类为中药,且药名表达不清,老百姓很难通过名称了解其成分,可能会重复用药,带来安全隐患。 如维C银翘片,从名字就很容易与它的“兄弟”银翘片相混淆。但其实银翘片是由金银花、连翘、薄荷、荆芥、淡豆豉、牛蒡子、桔梗、淡竹叶、芦根、甘草组成的纯中药。而维C银翘片则是在银翘片的基础上添加了维生素C、马来酸氯苯那敏、对乙酰氨基酚,因此自然也就具有这些西药成分的不良反应。 又如在临床上广泛应用的降糖药消渴丸,也与维C银翘片一样常常被误认为纯中药,但其实它既含有中药黄芪、地黄、天花粉,也含有二代磺脲类降糖药格列本脲,也就是优降糖。优降糖可能引起低血糖反应甚至低血糖昏迷;会加重肾功能不全、酮体阳性及肝炎患者病情;不适合肝肾功能异常的老年2型糖尿患者。 应用较广的降血压药珍菊降压片则是由珍珠层粉、野菊花膏粉、芦丁、氢氯噻嗪、盐酸可乐定组成。盐酸可乐定属于中枢性α受体激动药,氢氯噻嗪属于噻嗪类利尿药,芦丁属于维生素P类。三药有严格的使用剂量,有下列常见不良反应:导致水、电解质紊乱,如低钾血症等;可使糖耐量降低,血糖升高;可干扰肾小管排泄尿酸,引起高尿酸血症;可使低密度脂蛋白和三酰甘油水平升高,高密度脂蛋白降低等等。 1+1是否大于2 “一位67岁的高血压女患者,服用珍菊降压片一个月,血压控制还可以,就是有口干、烦渴、疲乏无力的感觉。我当时回答她,可能是药物的副作用。建议她复诊,查一下电解质,看是否有低钾血症。因为珍菊降压片是一个中西药复方制剂,其中的氢氯噻嗪长期服用易发生低钾血症。” 这是湖北省黄冈市中心医院药剂科的王树平药师在药物咨询时碰到的一个病例。他如此发问:“如果珍菊降压片中不加入芦丁、氢氯噻嗪、盐酸可乐定,是否有降压作用呢?中西药复方制剂真的有‘西药治标,中药治本’的好处吗?” 事实上,不仅王树平有如此疑问,在中药中添加西药的有效性和安全性一直在业内外争议不断。那么,中药加西药的中西药复方制剂到底能否达到“1+1大于2”的效果呢? 周超凡介绍,在中药中添加西药成分源于上个世纪50年代,兴盛于70年代末,主要是一些南方厂家生产。由于当时的质量和标准偏低,基本上就是简单地1+1形式,没有进行相应的疗效和安全性研究。因此在1985年《药品管理办法》实施后,国家严格药品审批制度,已经淘汰了一批质量、效果不好的中西药复方制剂,但仍有一部分品种留了下来。 记者在采访中发现,恰恰是中医药从业人员反对中西药复方制剂,确切地说是反对将这类药物归为中药管理。一位临床中药师说:“所谓中药,应是在中医药理论的指导下应用的药物。而中西药复方制剂中添加了西药成分,不能用中医理论来指导应用,不是中药。” “我更愿意给病人开汤药。”北京中医药大学东方医院主任医师杨晓晖是一位对糖尿病很有研究的内分泌科医生。他说,虽然中西药复方制剂在特定的历史时期发挥过积极的作用,但有关的基础研究相对薄弱,很多问题目前难以解释,给临床医生的合理应用带来了一定的困难。但由于这类药中有很多是OTC品种,因此用量还是很大。 “我个人认为这类药价值不是很大,因为医生完全可以开两种药,而不是固定成分、固定比例的复方制剂。”第二军医大学药物分析教研室的陆峰教授认为,与单独中药成分或者西药成分的新药相比,中西结合的复方对研发的要求也更高。他说,这不是简单的1对1或1对2的问题,而是既要研究西药成分的疗效和安全性,也要研究中药成分的疗效和安全性;还要证实中西药物合用后产生的疗效大于单独用药,并至少可降低毒副作用的发生;还要说明这些中西药成分和其他中西药应用的协同作用。这样的研发要求目前很难达到。 应展开中西药复方制剂再评价 目前有关中西药复方制剂的不良反应的文献报道非常少。有关专家介绍,由于这类药的主体为OTC品种,而我国百分之八九十的不良反应是由医疗机构而并非药厂和普通患者提供的,因此相关研究并不多。 2009年2月,《中国药物警戒》杂志发表的《消渴丸致严重低血糖反应36例文献分析》一文,是为数不多的对此类药物应用进行总结分析的文献。该文分析了在1994~2008年中国期刊全文数据库中检索到的36例由消渴丸导致的严重低血糖反应病例。其中表现为低血糖昏迷的共有28例,严重低血糖致死亡的有7例,表现为严重低血糖反应的1例。 杨晓晖也曾经关注过消渴丸的安全应用问题。他指出,不少不良反应是由于公众对其中含有西药成分不了解,超剂量用药、重复应用同类西药引起的。2006年3月的《中国药物警戒》杂志发表的他和另外几位学者撰写的《消渴丸的不良反应与合理应用》一文,认为该药的不良反应主要与以下因素有关:组方中含有化学药——格列本脲是导致低血糖的主要原因;临床使用不合理,出现低血糖反应救治不及时;患者对该药组方缺乏足够的认识,未严格在医生指导下使用等。 周超凡认为,对中西药联用要持谨慎态度,既不能急于肯定,也不能急于否定,而是要从临床实际出发及时总结中西药联用的利弊。作为一种药物创新的途径,中西药复方也是一种研究的方向,关键是要完善基础和临床研究。切实证实这类制剂能够达到1+1大于2的临床疗效,并能减少毒副作用。 “任何药物都有不良反应,不良反应的发生并不能说明药物的安全性不能保证,中西药复方制剂同样如此,公众应客观看待。在当前有关中西药复方制剂的基础研究相对薄弱的情况下,对中西药复方制剂进行上市后再评价十分必要。”杨晓晖说。 一些业内人士还表示,中西药复方生产厂家应主动承担社会责任,而不是遮遮掩掩。首先应完善产品说明书和包装、标签,增加相关安全性信息,提示医生和患者注意哪些药是中西药复方制剂;其次开展药物上市后的再评价工作,推进临床的合理、安全应用。
中药制剂 SOS专贴 要是你对中药制剂过程中有一些疑问、困难等,或者想要了解相关知识,请在此跟帖,提出你的问题、要求等!和版友进行讨论学习!回帖内容可以包括:问题,解答,经验分享,体会………………等,只要和制剂相关内容均可!!! 对于提问者和参与回答这会有适当奖励!
在介绍化学制剂这部分内容的时候,小编为大家讲解的也是比较多的,今天为大家介绍的是关于化学制剂发展方面的内容,希望大家能够简单的了解一下,看看在我国化学制剂有哪些是需要我们大家了解的。 化学药品制剂行业一直以来都是我国医药工业中的优势子行业,具有高技术含量、高资金投入、高风险、高收益和相对垄断的行业特征。从价值链来讲,化学药品制剂处于价值链高端,按价值递增依次为通用名药(非专利药)和专利药,专利药是整个价值链的顶端。 化学药品制剂涉及国民健康、社会稳定和经济发展,是国民经济一个特殊而重要的产业。改革开放30年以来,我国化学药品制剂工业的发展驶入快车道,近几年的工业总产值增长率都保持在18%以上,销售收入增长率基本保持在20%以上。从发展趋势看,化学药品制剂行业即将进入快速发展期,未来发展空间巨大,但利润分配将更加不均衡,行业集中度将进一步提高,具有研发、规模和产品优势的企业将强者恒强。 中国化学药品制剂行业已经完全发展成为一个竞争性的行业,在国际上的影响力也有所提高。在中国内地,外资及合资制药企业与内资制药企业之间的市场竞争非常激烈,尤其是近两三年,外资及合资企业大幅增加在华投资,强化市场力度。截至2011年底,中国大陆规模以上的化学药品制剂企业有1032家,经过快速发展阶段和激烈的市场竞争的锤炼,基本格局初步形成。外资及合资制药企业占据着中国化学药品制剂的高端市场,但内资品牌也正在逐步进军高端。
关于生物酶制剂,种类极其繁多。这里介绍部分体外诊断尤其是血液检测相关的酶制剂,有没说到的也欢迎大家补充。以便大家把作用功能相关的酶整理归类。
ICH指导原则分享-Q1d 新原料药及其制剂的稳定性试验中扩号法和矩阵化设计的应用Q1DBracketing and matrixing designs for stabilitytesting of drug substances and drug productsStep 2 9 November 2000
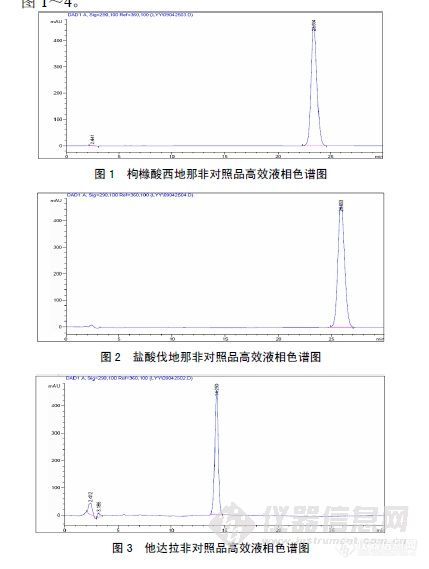
作者:倪晨;陈汀波;梁远园;王倩;(广东广州中医药大学;)摘要:目的建立快速、准确的检测中药保健品中非法添加磷酸二酯酶5(PDE5)抑制剂的方法。方法采用高效液相色谱法(HPLC)检测,DiamonsilC18色谱柱;流动相:乙腈-0.05mol·L-1三乙胺(用磷酸调PH至6.0)=40:60,流速1.0mL·min-1,检测波长290nm。结果该保健酒中未检出PDE5抑制剂:枸橼酸西地那非、盐酸伐地那非、他达拉非。结论该方法灵敏度高,重复性好,可用于PDE5抑制剂的定性检查。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208131450_383525_1606903_3.jpg