用于硬糖、果胶、琼脂、布丁、马希马洛糖、饼干、松蛋糕、蛋糕预制粉、稀奶油、冰淇淋、乳制品、蔬菜、青豆等罐头、饮料、果汁等的着色,为蓝色着色剂。在食品加工中直接着色不多,主要用于与天然的黄色素如栀子黄色素、红花黄色素等配伍,调配出不同色泽的绿色素,与提取的叶绿素相比,用栀子蓝色素调配的绿色素色调可以控制、耐酸性好,可用于偏酸性的食品、饮料中。另外栀子蓝色素还可与各种天然的红色素配伍,调配出不同色调的紫色。因此栀子蓝色素在食品加工中有较广阔的应用范围。栀子蓝色素因加工工艺的不同,可获得不同色调的蓝色素,颜色从天蓝色到海蓝色,还有耐酸性和不耐酸的品种,适合于不同的应用环境。天然的蓝色素自然界中是很少有的,栀子蓝色素是其中的一种,与合成色素食用亮蓝、靛蓝相比,其来源天然、人体相容性好,安全性高。是一种值得大力推广的天然色素。栀子蓝色素在食品、饮料、化妆品中的添加成本并不高,使用量为0.005%-0.01%之间,折算为单位成本约为0.025-0.05元/kg,当然与合成色素相比还是要高一些,合成色素在食品加工中的单位成本几乎为零,正是因为价格便宜,合成色素在食品上有滥用、超量使用的现象,这对人们的健康是不利的。
用于硬糖、果胶、琼脂、布丁、马希马洛糖、饼干、松蛋糕、蛋糕预制粉、稀奶油、冰淇淋、乳制品、蔬菜、青豆等罐头、饮料、果汁等的着色,为蓝色着色剂。在食品加工中直接着色不多,主要用于与天然的黄色素如栀子黄色素、红花黄色素等配伍,调配出不同色泽的绿色素,与提取的叶绿素相比,用栀子蓝色素调配的绿色素色调可以控制、耐酸性好,可用于偏酸性的食品、饮料中。另外栀子蓝色素还可与各种天然的红色素配伍,调配出不同色调的紫色。因此栀子蓝色素在食品加工中有较广阔的应用范围。栀子蓝色素因加工工艺的不同,可获得不同色调的蓝色素,颜色从天蓝色到海蓝色,还有耐酸性和不耐酸的品种,适合于不同的应用环境。天然的蓝色素自然界中是很少有的,栀子蓝色素是其中的一种,与合成色素食用亮蓝、靛蓝相比,其来源天然、人体相容性好,安全性高。是一种值得大力推广的天然色素。栀子蓝色素在食品、饮料、化妆品中的添加成本并不高,使用量为0.005%-0.01%之间,折算为单位成本约为0.025-0.05元/kg,当然与合成色素相比还是要高一些,合成色素在食品加工中的单位成本几乎为零,正是因为价格便宜,合成色素在食品上有滥用、超量使用的现象,这对人们的健康是不利的。
关于禁止使用和销售“蓝色素(Blue colourant)”的指令 欧盟官方公报2003年1月9日发布欧盟委员会指令2003/03/EC,认定“蓝色素”(索引号:611-070-00-2)具有很高的水生毒性,且不易降解,随废水排入环境后会对环境造成危害。为保护环境,该指令规定:禁止在纺织品和皮革制品上使用“蓝色素”,并禁止在市场上销售含“蓝色素”的纺织品和皮革制品。该指令要求各成员国在2003年12月31日前将该规定转换成本国的法规,并从2004年6月30日起生效。 根据该指令的提示,所谓“蓝色素”是一种混合物,属偶氮染料的范畴。该混合物包含两个组分,其分子式分别为C39 H23 Cl Cr N7 O12 S.2 Na(CAS号:118685-33-9)和C46 H30 Cr N10 O20 S2.3Na(无CAS号)。据欧盟委员会有关官员介绍,该“蓝色素”的商品名称为“海军蓝018112(Navy Blue 018112)”或“藏青018112(Navy 018112)”。由于是一种混合物,故没有单独的CAS或C.I.索引号。该“蓝色素”是一种新的物质,在有些手册中无法查到。据悉,该混合物的混合比未有公布。按一般的理解,任何比例均在本指令的限制范围之内。该指令是由德国负责起草的。 没有发布测试方法,现在求助测试方法,谢谢
在五十多年前,德国色素炭黑制造商,开发出了高质量的色素炭黑颜料,使用的工艺称为德固赛气黑工艺。使用此种工艺,该公司的产品基本上满足了汽车涂料工业的需求。当炭黑的原始粒径在13nm~15nm时,足够制造出最好的黑色,并能很好的保证涂料稳定性。这类产品通常需要经过后处理。后处理就是后氧化工艺,羧基、羟基、醌基等基团,被增加到了色素炭黑聚集体上。这些挥发性成分(900度以上)的增加,色素炭黑颜料更容易分散,稳定性更好。而且,其他性能要求,比如耐候性、两年之后的光泽度、耐化学品性能,等等都比较满意。名列第二的炭黑制造工艺,也是产量最大的是炉黑工艺。以前,这种工艺主要是制造大批量制造的颜料,用于橡胶、印刷油墨和塑料工业。到上世纪六十年代,卡博特和哥伦比亚化学公司纷纷推出了粒径较细的炉黑工艺。炉法炭黑产品经过表面氧化及后处理,应用性能大大增强,成为气黑工艺主要竞争对手。之后,随着树脂体系的改变,汽车工业涂料的施工工艺也有了变化。而且,根据越来越严格的环保法规,欧洲和北美向水性涂料转型,日本也随之跟上。 在新的上底漆树脂中,以前色素炭黑制造商的目标是找到最好的黑颜料,色彩一致,意味着深黑色,并且是蓝色相。气黑由于颗粒较小,虽没有经过后处理,在水性体系中,也具有良好的润湿性能。但是气黑产量较低,耗能较大,并且总产量有限,价格一直高居不下,在一般情况下并不是涂料厂家的首选。而近年来,各大公司经过深入研究,纷纷推出复杂先进的炉黑表面处理工艺,增加炉黑的各种性能,使其能比较容易地分散,稳定性较好,在水性底漆体系中有着良好的表现。并且价格优势明显,所以近年来各涂料厂纷纷选用性能较好,价位合适的炉黑产品。色素炭黑
蜡类样品中有机色素化妆品使用的色素,除少数无机色素为有机合成色素,其中多数对人体有害,有的甚至可能诱发癌症,故应当对这类色素严格管理。有机色素的测定方法有GC/MS、HPLC、分光光度法和层析法等,本文介绍吸收光谱法和层析法测定蜡类化妆品中有机色素,方法简单,易行,适于一般设备的实验室。1适用范围本方法适用于含蜡类的固状或半固状化妆品中有机色素的测定。2 原理样品中有机色素被乙醇提取,经滤纸层析或薄层层析法进行分离后,与标准比较定性、定量。3 试剂3.1 硫酸 乙酸 水(4 9 1)。3.2 吸附剂3.2.1 柱层析硅胶(100~200目)。3.2.2 柱层层析用硅胶。3.3 薄层析 用吸附剂(3.2.2)调制厚度为250~300μm薄层,于100℃加热活化1小时。3.4 滤纸层析用展开剂3.4.1甲醇 乙酸 水(80 5 1)。3.4.2丙酮 水(7 3)。3.5 薄层层析用展开剂3.5.1 1,2-二氯乙烷 石油醚(1 1.5)。3.5.2 二甲苯。3.6 着色剂标准溶液3.6.1 蓝色404号(酚菁蓝)标准溶液:称取一定量蓝色404号(Phthalocyanine Blue)溶于α-氯萘(α-Chloronaphthalene),配制成适当浓度。3.6.2 标准溶液:分别称取黄色404号(Oil Yellow AB),黄色405号(Oil Yellow OB)、黄色204号(Quinoline Yellow SS)、绿色202号(Quinizarine Green SS)及蓝色403号(Sudan Blue B)各0.1g,分别溶于100ml苯中,过滤、保存。3.6.3 黄色204号标准溶液:称取黄色204号(Quinoline Yellow SS)0.1g溶于100ml氯仿中,过滤,保存。3.7 乙醇:AR。3.8 四氯化碳: AR。3.9 α-氯萘: AR。3.10 石油醚(60-90):AR。3.11 苯:AR。4 仪器4.1 层析滤纸。4.2 薄层层析玻板(10×20cm)。4.3 展开槽。4.4 分光光度计。
测COD时滴定终点的蓝色是谁的颜色??超上限的亮蓝色是谁的颜色??刚接触COD有啥要注意的啊、求大佬给点意见。
1、样品是冰淇淋,比较油腻,前处理时要注意什么问题?还是完全照GB/T5009.35-2003的标准来做。2、有的文献中提到亮蓝色素不能用甲醇-甲酸(6+4)洗脱,会被洗脱掉,回收率低,那么请问有没有什么好的处理方法替代国标。3、按照国标要求,各色素的标准品是粉末状,但是我们单位买的是液体的,请问稀释至使用液时,要不要用PH=6的水稀释,还是纯水就够了?(对水的PH有要求吗?)国标上是写,用PH=6的水溶解粉末定容到一定浓度,作为标准溶液,标准溶液稀释到使用液用普通纯水就好了。4、若样品是卤鸡爪之类的,就是样品中蛋白质和脂肪含量比较高,在样品处理时,要加入,哪些试剂(浓度)来沉淀蛋白质和脂肪?
色素中的靛蓝怎么溶解,现在我在做靛蓝的紫外图谱,但是一过滤就没了。[img=,690,381]https://ng1.17img.cn/bbsfiles/images/2019/07/201907121336062061_4447_1850628_3.png!w690x381.jpg[/img]
最近做色素,按国标溶解靛蓝,好象溶不了啊,那位有做过的请赐教!还有,其他出峰也不好看,没有书上那么好,大家有什么别的方法做没?
请问各位有没有谁做过色素中靓蓝的测定的?标液配制的时候是用什么溶剂溶解的,昨天发现这个东西很难容,三氯甲烷可以溶解,不过跟液相有些不匹配,其他合适的溶剂都溶解性不好。请高手不吝赐教,谢过
大家好,哪位有200L蓝色塑胶桶的检验标准,可以传给我吗?谢谢!
[color=#333333]最近一款蓝色葡萄酒在法国引起轰动,首批2000瓶蓝色葡萄酒已销售一空。[/color][color=#333333]这是100%的霞多丽葡萄酒,加入红葡萄皮酿制而成,含有天然的花青素[/color][color=#333333]。这款蓝色葡萄酒[/color][color=#333333]喝起来像传统葡萄酒[/color][color=#333333]吗?这款蓝色葡萄酒做[/color][color=#333333]盲测,15个人中只有1个人觉得它是款葡萄酒,剩下的人都以为它只是甜甜的软饮料。[/color][color=#333333]这款葡萄酒[/color][color=#333333]成为人们衡量食物的标准之一,好喝似乎变得没那么重要了。[/color]
液状油类样品中有机色素1 适用范围本方法适用于测定发油等油类化妆品中色素。2 原理样品中色素经有机溶剂提取分离后,用吸收光谱和层析法进行比较判定。3 试剂3.1 吸附剂3.1.1 柱层析用硅胶:100目,临用前于100℃干燥1小时。3.1.2 薄层层析用硅胶。3.2 薄层板:用吸附剂(3.1.2)调节制成250~300μm的薄层,100℃加热活化1小时。3.3 层析用滤纸:将滤纸浸渍在液体石腊5g溶于石醚100ml的溶液中,30min后取出风干。3.4 滤纸层析用展开溶剂3.4.1 丙酮 水(7 2)。3.4.2 甲醇 乙醇 水(16 l 3)。3.4.3 丙酮 无水乙醇 乙酸 水(70 10 5 3)。(1)3.5 薄层层析用展开溶剂3.5.1 1,2-二氯乙烷 石油醚(l 1.5)3.5.2 二甲苯:AR3.5.3 1,1,2-三氯乙烷:AR3.5.4 氯仿:AR3.6色素标准溶液(2)3.6.1 称取红色501号(药用猩红),红色505号(油xa XO),橙色403号(橙色SS),黄色404号(黄AB),黄色405号(黄OB),绿色202号(酿茜绿SS),蓝色403号(苏丹蓝B)和油红OS各0.lg,分别溶于100ml苯中。3.6.2 称黄色204(喹啉黄SS)0.lg溶于100ml氯仿中,过滤。
有一种产品叫藻蓝蛋白,它是一种螺旋藻提取物,深蓝色粉末,100%溶于水,溶于水时颜色透亮可爱,是一种纯天然可食用色素。可应用于冰淇淋、口香糖、饮料、糕团、点心、糖果、果冻、馅料、面条、芥末、糖衣药片、胶囊等。藻蓝蛋白在欧盟是作为食品原料使用的,而不是食品添加剂。藻蓝蛋白是美国FDA允许的唯一天蓝蓝色色素。欧盟和美国FDA都不限制其使用量。藻蓝蛋白不仅颜色鲜艳,而且本身是一种营养丰富的蛋白质,其氨基酸组成齐全,必须氨基酸含量高。它既是一种蛋白质,又是一种极好的天然色素,同时又具有抗氧化、抗肿瘤、抗辐射、补血等保健功效。
请问用高效液相色谱法测定植物黑色素(almelanin)时,应该设定的波长、流动相、进样量等条件是多少?http://simg.instrument.com.cn/bbs/images/brow/emyc1010.gif
近日,欧盟委员会提议,对目前食品中使用的部分食用色素的最大值进行适当降低。同时还提议,禁止在食品中使用其他色素。爱尔兰食品安全局(FSAI)正在就该委员会的两项提议征求意见,而征询的主要对象为喹啉黄(E104)、日落黄(E110)以及胭脂红(E124)这三种食用色素。 欧盟委员会发现,儿童对于这三种食用色素暴露最多的食品为:软饮料、面包、甜点、糖果、鱼肉酱、调味汁以及调味品等;而成人对于这三种色素暴露最多的食品为:软饮料、面包、果酒、苹果酒和梨酒、甜点。这些食物也是委员会建议降低三种食用色素最大值的主要类别。 FSAI希望通过此次修订,引起消费者对于喹啉黄、日落黄和胭脂红这三种食用色素的关注。 意见征询的截止日期为2011年2月19日。
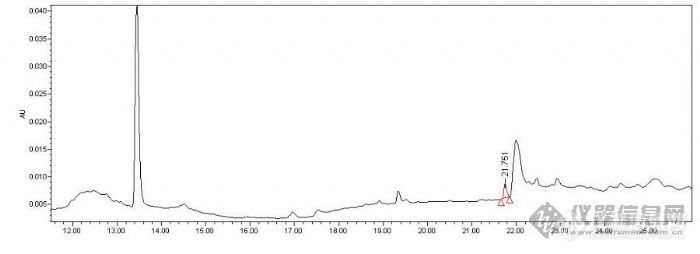
[color=#DC143C][B]我测苦瓜啤酒中的亮蓝[/B][/color]2005年的夏天,单位业务办来了个电话问:你们可以检测苦瓜啤酒中的亮蓝吗?而我蒙了,什么是苦瓜啤酒?我怎么没喝过。还是先上网查查吧。查了之后才发现什么叫苦瓜啤酒,按照国家标准,啤酒是不允许添加色素的。先摸索下吧,亮蓝色素照国家标准GB/T 5009.35-2003是可以做,一步一步照标准做出个结果,结果却做的不理想,结果不能肯定,峰响应很小,旁边还有杂峰,我能肯定就是它吗?是不是假阳性呢?(下面是254nm下测定的色谱图)[img]http://ng1.17img.cn/bbsfiles/images/2009/03/200903131559_138341_1608710_3.jpg[/img]国家标准检测亮蓝的波长是254nm,检测8个色素。在波长上还能改吗?开动脑筋想办法,又拿标准做了个紫外波长扫描,结果发现:亮蓝的灵敏波长是628nm。马上修改国家标准方法,把波长改了个628nm。结果真让人高兴:杂峰都不见了,灵敏度高了几十倍,样品的结果也很明显。没错,就是它了。呵呵。?(下面是628nm下测定的色谱图)[img]http://ng1.17img.cn/bbsfiles/images/2009/03/200903131559_138342_1608710_3.jpg[/img]当时兴奋了很久,事情已经过了很久,想起来还是有印象的。
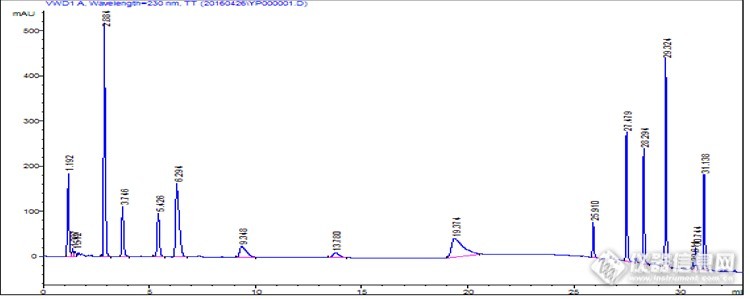
于近日收到月旭2.7um液相核壳色谱柱开始试用。1.两款色谱柱比较月旭2.7um 4.6*100mm Core-Shell BoltimateTM 另一款 5um 4.6*250mm C18http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_667557_1643288_3.jpghttp://ng1.17img.cn/bbsfiles/images/2017/10/2016042900302158_01_1643288_3.jpg2. 柱效比较:以色素为指标进行比较分别是:柠檬黄、新红、日落黄、胭脂红、诱惑红、赤藓红、靛蓝、苋菜红、亮蓝、酸性红共10种。http://ng1.17img.cn/bbsfiles/images/2017/10/2016042900370945_01_1643288_3.png4.6*250mmC18http://ng1.17img.cn/bbsfiles/images/2017/10/2016042900373953_01_1643288_3.png月旭柱流动相B 0.02mol/L 乙酸铵+5%甲醇 A 甲醇 梯度洗脱 普通柱 Time %A %B1 0.00 0.0 0.0 100.02 10.00 0.0 100.03 11.00 95.0 0.0 5.04 19.00 95.0 0.0 5.05 20.00 0.0 100.06 45.00 0.0 100.0月旭柱Time %B %C %D Flow Max.Press.1 0.00 0.0 0.0 100.02 5.50 0.0 0.0 100.03 6.00 10.0 0.0 90.04 10.00 10.0 0.0 90.05 19.00 70.0 0.0 30.06 19.10 90.0 0.0 10.07 29.00 90.0 0.0 10.08 29.50 0.0 0.0 100.09 35.00 0.0 0.0 100.0两相比较1).柱压的问题:月旭LP-C18 4.6*100mm 2.7μ 这款柱子在1mL/min、乙酸铵-甲醇流动相体系压力表现为170bar ,0.6 mL/min时是135bar,两者峰宽没有明显区别,因此采用0.6 mL/min。2)保留时间 从图中可以看出普通柱集中在21-36分钟,但由于峰较宽,所以分离度虽好,难以实现与杂质的有效分离月旭 在10-22分钟3)峰宽 月旭中 0.2分钟左右普通 0.6 分钟左右糕点样品图http://ng1.17img.cn/bbsfiles/images/2017/10/2016042900381728_01_1643288_3.png样品在色素峰出峰区域出现小峰,但由于标准品的峰宽较窄,所以不易引起误判,总结特点:节约仪器时间、节约流动相、改善了分离。月旭柱以普通柱的流动相进行洗脱时情况如下http://ng1.17img.cn/bbsfiles/images/2017/10/2016042900383696_01_1643288_3.png进行调整后如下图http://ng1.17img.cn/bbsfiles/images/2016/04/201604290038_591882_1643288_3.png
在做ISO105B02测试时,有两种系列的蓝色羊毛标准,这两种标准卡间有什么区别,分别用这两种来测试时结果会有什么不同,这两种间可否互相通用。如果说用欧盟的蓝色羊毛标准5晒至变色3级,与美国的晒40个AUF褪色单元,这两种情况哪种测试样品褪色会比较严重,还是说效果差不多?我这问的问题比较多且杂希望大家来帮忙。
新国标色素时间42分钟,有没有缩短出峰,并且亮蓝和酸性红都能分开的方法梯度啊?
请问,食品中的合成色素最常测的是哪几种?本来想买一个八种色素的混标,但是国家标物中心只有五种(亮蓝、日落黄、胭脂红、苋菜红和柠檬黄)单标,亟待大家的回复,谢谢!
今天试做了一下色素的标准(单标),结果亮蓝没有峰出来,其他四种(柠檬黄、日落黄等)都没问题,怎么回事啊?在线等您的答复!
发现亮蓝在254nm处的响应太小了,标准溶液浓度为50ppm。今天做的时候没有调流动相的pH,刚才测了一下,pH是6,是不是因为这个亮蓝的响应才小呢?除了254nm,在其他波长处亮蓝有没有特征吸收呢?
1.什么是色素:使各种物质产生各种颜色的物质就是色素,我们日常看到五颜六色的各种食品,就是因为含有各种不同的色素,所以我们才看到了各种不同颜色的食品,如果食品不含色素,那我们看到的食品都将是透明的或者白色的。2.食品中为何要添加色素:食品讲究色、香、味,颜色排在第一位,说明了色素在食品中的重要性,色、香、味俱佳的食品,能通过视觉感官刺激增强食欲,为了吸引人们的食欲,食品中添加了各种颜色来吸引消费者,据了解橙色的食品最能使人有食用的欲望。3.色素属于食品添加剂么:色素是食品添加剂,属于食品添加剂中的着色剂类别。4.色素的分类:食品中添加的色素分为人工合成色素和天然色素,各种色素通过红、黄、蓝三原色的不同比例的复配,可以生成无数种各种各样的颜色。5.色素的来源:合成色素是指用人工化学合成方法所制得的有机色素,主要是以煤焦油中分离出来的苯胺染料为原料制成的,按结构分,人工合成色素可分为偶氮类、氧蒽类和二 苯甲烷类色素;天然色素是指以植物、动物、微生物或矿物质为原料通过物理方法,再不改变色素分子结构的情况下提取分离出来的色素,从溶解性分可分为水溶 性、油溶性、醇溶性色素。6.色素的危害:合理合法使用各种色素是没有危害的。但大量研究表明过量食用合成色素会在肝脏沉积,可造成生育力下降、畸胎,有些合成色素在人体内可能转换成致癌物质, 可引起儿童发育障碍、多动症,在化妆品中使用有引起炎症,甚至癌变的可能;天然色素也不是没有危害,过量食用也会并不是就安全,比如连续大量食用柑橘类、 或萝卜之类的食品,会使或萝卜属类物质过量,造成皮肤泛黄等症状,不过停止食用一段时间就会自动恢复正常。7.我国允许在食品中使用合成色素种类:到2015年10月24日止GB2760里面允许使用的合成色素是:赤藓红及其铝色淀,靛蓝及其铝色淀,二氧化钛,蕃茄红,核黄素,β-胡萝卜素,喹啉 黄,亮蓝及其铝色淀,柠檬黄及其铝色淀,日落黄及其铝色淀,酸性红(又名偶氮玉红),苋菜红及其铝色淀,新红及其铝色淀,胭脂红及其铝色淀,氧化铁黑,氧 化铁红,诱惑红及其铝色淀等十七种。8.我国允许食品中使用天然色素种类:到2015年10月24日止GB2760里面允许使用的天然色素是:β-阿朴-8’-胡萝卜素,番茄红素,柑橘黄,黑豆红,黑加仑红,红花黄,红米红, 红曲红,红曲黄,天然β-胡萝卜素,花生衣红,姜黄素,焦糖色,金樱子棕,菊花黄浸膏,可可壳色,辣椒橙,辣椒红,辣椒油树脂,蓝靛果红,萝卜红,落葵 红,玫瑰茄红,密蒙黄,葡萄皮红,桑葚红,沙棘黄,酸枣色,天然苋菜红,橡子壳棕,胭脂虫红,胭脂树橙,杨梅红,叶黄素,叶绿素铜,叶绿素铜钠盐,叶绿素 铜钾盐,玉米黄,越橘红,藻蓝,栀子黄,栀子蓝,植物炭黑,紫草红,紫甘薯色素,紫胶红,高粱红,甜菜红等四十八种。9.色素的功能或生理活性:几乎所有人工合成色素都不能给人体提供营养物质,也没有什么有益的生理功能;部分天然色素本身也是保健品原料,对人体有保健作用和一定的生理功能,比如 番茄红素、胡萝卜素、花青素等的抗氧化、去除自由基功效、叶黄素对视黄斑的保护修复作用、姜黄素的消炎生肌、抗肿瘤功效等。
我们单位用的是日立Z-2000原子吸收。已将近6年的使用,没出现过什么问题。从去年9月份左右开始,每次做2种元素的时候,一切换元素,火焰就变成前一个元素的火焰颜色,如第一个测Mg,则火焰一直是红色,怎么也消退不下去,重新开机开气开空压机都没用,当天无论什么时候开,火焰仍不是蓝色。只有等到第二天再开机的时候,火焰才会变成淡纯蓝色。而到了现在,即使只做一种元素,样品做多了也会变成所测元素的火焰颜色。找来了厂家的人来解决也没解决的了。另外,我们的空压机每次做完放气的时候都会放出来很多水,有大概好几十滴,我的印象里以前没有这么多的水。我们测量的数据本身不需要太准确,是搞土壤改良剂的,不过也不能太不准了。现在我都不敢把数据报给上边,因为没法说这数据准确否。上边也在多方联系人来解决这个问题,至今仍无良策。.哦对了,还有几个情况,现在的吸光值比以前没出这问题的时候要小大概一半,测得的结果倒没什么问题。偶尔还会出现一种情况:火焰熄灭,电脑上显示“检查循环水流量”。我循环水一直开着啊,不知道为什么会出现这个错误提示。
客户送样的面料蓝色和兰色不分,经常混淆,大家怎么来区分这两种颜色?
[font=宋体][/font][font='微软雅黑','sans-serif'][size=12pt]用[/size][/font][font='Times New Roman','serif'][size=12pt]GB7489-1987[/size][/font][font='微软雅黑','sans-serif'][size=12pt]测定溶解氧时,一直到达不了滴定终点,变成无色之后迅速回复蓝色,而且蓝色越来越深,请问水样有可能是有什么因素干扰,怎么去除干扰?[/size][/font][font='微软雅黑','sans-serif'][size=12pt][color=#ff0000]注:问题来自水质分析交流群。[/color][/size][/font][font=宋体][/font]
[align=center][font='等线'][size=13px]栀子蓝的理化性质[/size][/font][/align][align=center][font='等线'][size=13px]吴琼[/size][/font][/align][font='宋体']摘要[/font][font='宋体']:栀子蓝耐酸性好性质稳定,色泽鲜艳,着色力良好,是一个较好的天然着色剂,制备方法通常是二步法和发酵法。制备好之后通常使用层析法精制纯化工艺纯化,本文还介绍相关的栀子蓝国家标准和检测方法,国家标准主要分为感官和理化指标。[/font][font='宋体']关键词[/font][font='宋体']:栀子蓝色素、精制纯化、层析法[/font][font='宋体']栀子蓝色素是近年我国批准使用的天然食用着色剂,色调柔和,染色性能好,易溶于水,对酸碱、热、[/font][font='宋体']pH和多种常用抗氧化剂等较稳定。栀子蓝色素可采用微生物发酵法或酶促转化法[/font][font='宋体']制备[/font][font='宋体']。栀子果实或栀子黄生产废液中含有京尼平苷,经β-葡萄糖苷酶(转色酶)水解作用,从其糖苷键上脱去一分子葡萄糖转变为京尼平([/font][font='宋体']geniposide[/font][font='宋体']),京尼平与伯氨化合物进行显色反应生成栀子蓝色素[/font][font='宋体']β[/font][font='宋体']-葡萄糖苷酶,属纤维素酶类,能够水解结合于未端非还原性的β-[/font][font='宋体']D[/font][font='宋体']-葡萄糖键,同时释放岀β-D-葡萄糖和相应配基,主要存在于自然界许多植物、昆虫、酵母、曲霉、木霉及细菌体内。微生物发酵法是利用微生物产生β-葡萄糖苷酶转化底物京尼平苷,经发酵、提取获得栀子蓝色素。因该方法发酵液成分复杂,体系中存在的多种氨基酸均可与京尼平发生显色反应,转色酶发酵温度与酶促温度差别大等原因,故生产出的栀子蓝色素产品色泽暗,转化率低,异味大,难纯化。有报道采用一步酶促转化法制备栀子蓝色素,在反应体系中同时加入京尼平苷、β-[/font][font='宋体']葡萄糖苷酶、显色氦基酸,经酶转化制备,特异性髙,然而仍未解决酶解温度与显色温度差异较大的矛盾,使得生产周期较长,不利于规模化生产。[/font][font='宋体']制备栀子蓝色素过程中,京尼平苷的纯度,酶系组成及对底物的亲和力,显色氨基酸种类等因素条件,影响栀子蓝色素的色泽、纯度、品质。[/font][font='宋体'][size=18px]1栀子蓝的理化性质[/size][/font][font='宋体']对于二步法生产的栀子蓝色素来说,该色素易溶于水,[/font][font='宋体']70%以下的乙醇,不溶于无水乙醇,也不溶于油脂。水溶液呈现鲜明的蓝色最大吸收波长为592nm。色素在pH 2-8范围内色调无变化,100℃ 120分钟色素基本不褪色,对光和其它天然色素相比较稳定。对蛋白质及碳水化合物着色良好。N[/font][font='宋体'][size=13px]4+[/size][/font][font='宋体']、K[/font][font='宋体'][size=13px]+[/size][/font][font='宋体']、Mg[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体']、A[/font][font='宋体']l[/font][font='宋体'][size=13px]3+[/size][/font][font='宋体']对色素无影响,Ca[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体']、[/font][font='宋体']Fe[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体']高浓度时略有影响,Fe[/font][font='宋体'][size=13px]3+[/size][/font][font='宋体']、Sn[/font][font='宋体'][size=13px]4+[/size][/font][font='宋体']对色素影响较大[/font][font='宋体'],[/font][font='宋体']抗坏血酸、双氧水、半胱氨酸对色素无影响,但亚硫酸钠,可使色素褪色。[/font][font='宋体']栀子蓝色素耐光、耐热、耐酸碱,尤其在酸性环境下有更好的稳定性,在偏碱条件下有増色效应。[/font][font='宋体']K[/font][font='宋体'][size=13px]+[/size][/font][font='宋体'],NH[/font][font='宋体'][size=13px]4[/size][/font][font='宋体'][size=13px]+[/size][/font][font='宋体'],Na[/font][font='宋体'][size=13px]+[/size][/font][font='宋体'],Mg[/font][font='宋体'][size=13px]2[/size][/font][font='宋体'][size=13px]+[/size][/font][font='宋体'],Ca[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体']对色素稳定性有一定影晌,但影响较小;Al[/font][font='宋体'][size=13px]3+[/size][/font][font='宋体'],Cu[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体'],Ba[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体']对色素稳定性影响较大;Fe[/font][font='宋体'][size=13px]3+[/size][/font][font='宋体'],Fe[/font][font='宋体'][size=13px]2+[/size][/font][font='宋体']对色素稳定性影响最显著;氯化钠、柠檬酸钠、碳酸氢钠对栀子蓝色素的颜色影响较小[/font][font='宋体']。文献结果表明,二步法生产的栀子蓝色素,耐酸性好性质稳定,色泽鲜艳,着色力良好,是一个较好的天然着色剂。[/font][font='宋体']以上特性可以为工业生产实际及使用时提供理论指导。[/font][font='宋体'][size=18px]2栀子蓝的制备[/size][/font]2.1 栀子蓝色素的合成方法[font='宋体']目前,生产栀子蓝色素的方法主要有两种:一种是两步法,一是发酵法[/font][font='宋体']。[/font][font='宋体']两步法是先将栀子[/font][font='宋体']苷[/font][font='宋体']水解成苷元,再与氨基酸反应生栀子蓝色素优化出栀子蓝色素分步制备的工艺条件,筛选出甲硫氨酸并优化了栀子蓝色素的的转化条件,当n[/font][font='宋体'][size=13px]甲硫氨酸[/size][/font][font='宋体']:[/font][font='宋体']n[/font][font='宋体'][size=13px]栀子[/size][/font][font='宋体'][size=13px]苷[/size][/font][font='宋体']=6[/font][font='宋体']:[/font][font='宋体']1时、在pH 7[/font][font='宋体'].[/font][font='宋体']0、温度80℃条件下反应10h,可获得色价为20.6的栀子蓝色素。[/font][font='宋体']继续[/font][font='宋体']优化固定化酶法合成栀子蓝色素的条件,[/font][font='宋体']可[/font][font='宋体']在温度为50℃,pH为5的条件下,酶解6h,再将酶解产物与谷氨酸钠反应得到色价为120的栀子蓝色素。[/font][font='宋体']发酵法是指将原料栀子苷与氨基酸及发酵菌种混在一起发酵培养,发酵菌种中产生的β[/font][font='宋体']-葡萄糖苷酶水解栀子苷,水解产物京尼平与培养基中的氨基酸反应转化成栀子蓝色素[/font][font='宋体']。有研究者研究了[/font][font='宋体']丝状真菌摇瓶发酵法转化为栀子蓝色素的方法并优化其工艺条件:栀子苷4%(纯度75%),摇瓶装量50/250mL,接种真菌量为4%,谷氨酸钠添加量2%,起始pH值为7.5的条件下培养120h,得到栀子蓝色素的色价大于90[/font][font='宋体']。研究表明[/font][font='宋体']栀子苷经米曲霉素发酵后与味精[/font][font='宋体']是[/font][font='宋体']制备栀子蓝色素的最优条件,10.64g栀子苷与129.36g水混合,加入米曲霉发酵液9.8mL,在50℃,160-180r/min的条件下水解6h,再投入3.15g味精,在80℃条件下反应4h,得到的栀子蓝色素色价为90.56.发酵法得到的栀子蓝色素色价通常不高。[/font]2.2发酵法2.2.1材料2.2.1.1菌种及主要试剂宇佐美曲霉 Asergillus usamiAs3.758(中科院微生物所);栀子甙标准品(中国药品生物制品检定所,编号749-200108);栀子(江西天顺生态农业有限公司);β-葡萄糖苷酶( Worthington Biochemical Corporation,3.4U/mg);D301为沧州宝恩化工厂产品 其它试剂均为分析纯,所用水均为去离子水。2.2.1.2培养基及标准溶液种子培养基:马铃薯250g,葡萄糖20g,水1000mL,121°C灭菌20min备用;发酵培养基:4%栀子黄废液、0.4%K[font='等线'][size=13px]2[/size][/font]HPO[font='等线'][size=13px]4[/size][/font]、0.3%NaNO[font='等线'][size=13px]3[/size][/font]、pH 6.5;0.132mg/mL京尼平甙标准溶液(E[font='等线'][size=13px]238mm[/size][/font]为9.0);0.2 mg/mL β-葡萄糖苷酶溶液。2.2.1.3仪器与设备U751GD型紫外可见分光光度计;GL-20G-工恒温振荡培养箱(广东医疗器械厂);高速冷冻离心机(上海安亭科学仪器厂);PHS-25B数字酸度计(上海大普仪器公2.2.2实验方法2.2.2.1菌种制备从活化斜面上挑起菌种到种子培养基中,25σmL三角瓶装液3mL,29℃、200rmin,振荡培养24h,然后过滤收集菌丝,并用少量蒸馏水洗涤菌丝,除去菌种表面少量培养基,再用等体积的0.85%NaC溶液悬浮菌体,备用2.2.2.2栀子黄废液发酵转化生成栀子蓝色素将步骤1.2.1所得菌丝悬液以一定接种量接入发酵培养基中,按250mL三角瓶装液30mL,29C、pH6.5、200r/min,振荡培养36h,发酵结束后置于50℃水解4h,过滤除去菌丝,滤液中加入0.7%谷氨酸钠,80℃反应h,即得栀子蓝色素。2.3 栀子蓝色素的测定方法[font='宋体']取栀子蓝色素发酵液,稀释适当倍数,用1cm比色皿以蒸馏水为空白,在分光光度计上取波长590nm,测其吸光度值,栀子蓝色素含量与吸光度值成正比[/font][font='宋体']。[/font][font='宋体']用薄层层析法检测栀子蓝色素的纯度[/font][font='宋体']。[/font]2.4 栀子蓝色素转化标准曲线的制定及转化率的定义[font='宋体']取[/font][font='宋体']O[/font][font='宋体']D[/font][font='宋体'][size=13px]238[/size][/font][font='宋体']为一定值的栀子甙标准液2[/font][font='宋体'].[/font][font='宋体']0 mL,混匀后再加入1.0 mLβ-葡萄糖苷酶溶液,50[/font][font='宋体']°C[/font][font='宋体']水浴水解4h,然后再加入1.0m[/font][font='宋体']L[/font][font='宋体'] 1% 谷氨酸钠溶液,80°℃水浴中反应1h,然后在590nm波长下测定吸光值,以OD[/font][font='宋体'][size=13px]238[/size][/font][font='宋体']为X轴,OD[/font][font='宋体'][size=13px]590[/size][/font][font='宋体']为Y轴作图,即为栀子[/font][font='宋体']蓝色素转化标准曲线转化率的定乂:假定栀子蓝色素转化标准曲线中[/font][font='宋体']D590值[/font][font='宋体'][[/font][font='宋体']下称[/font][font='宋体']O[/font][font='宋体']D[/font][font='宋体'][size=13px]590[/size][/font][font='宋体'](标)[/font][font='宋体']][/font][font='宋体']与0D[/font][font='宋体'][size=13px]238[/size][/font][font='宋体']值[/font][font='宋体'][[/font][font='宋体']下称OD238(标)[/font][font='宋体']][/font][font='宋体']之比为100%的转化率,栀子黄废液初始OD[/font][font='宋体'][size=13px]238[/size][/font][font='宋体']值称OD[/font][font='宋体'][size=13px]238[/size][/font][font='宋体'](试),栀子黄废液[/font][font='宋体']发酵转化后,测溶液OD[/font][font='宋体'][size=13px]590[/size][/font][font='宋体']值称OD[/font][font='宋体'][size=13px]590[/size][/font][font='宋体'](试),栀子蓝色素转化率定义如下[/font][font='宋体']:[/font][font='宋体']转化率=[/font][font='宋体'][[/font][font='宋体']OD[/font][font='宋体'][size=13px]590nm[/size][/font][font='宋体'](试)/OD[/font][font='宋体'][size=13px]238nm[/size][/font][font='宋体'](试)OD[/font][font='宋体'][size=13px]590nm[/size][/font][font='宋体'](标)OD[/font][font='宋体'][size=13px]238nm[/size][/font][font='宋体'](标)[/font][font='宋体']][/font][font='宋体']×100%[/font][font='宋体']=[OD[/font][font='宋体'][size=13px]590nm[/size][/font][font='宋体'](试)OOD[/font][font='宋体'][size=13px]590nm[/size][/font][font='宋体'](标)[/font][font='宋体']][/font][font='宋体']×100%[/font]2.3 二步法2.3.1材料[font='宋体']黑曲霉[/font][font='宋体']种子培养基PDA斜面培养基。发酵培养基[/font][font='宋体']:[/font][font='宋体']麸皮100g;(NH[/font][font='宋体'][size=13px]4[/size][/font][font='宋体'])[/font][font='宋体'][size=13px]2[/size][/font][font='宋体']SO[/font][font='宋体'][size=13px]4 [/size][/font][font='宋体']2g[/font][font='宋体'];[/font][font='宋体']KH[/font][font='宋体'][size=13px]2[/size][/font][font='宋体']PO[/font][font='宋体'][size=13px]4[/size][/font][font='宋体'] 0.2 g[/font][font='宋体'];[/font][font='宋体']Mg[/font][font='宋体']SO[/font][font='宋体'][size=13px]4[/size][/font][font='宋体'][/font][font='宋体']7H[/font][font='宋体'][size=13px]2[/size][/font][font='宋体']0,0.4g;蒸馏水100[/font][font='宋体']mL;自然[/font][font='宋体']pH。[/font][font='宋体']栀子黄废液(其所含固形物中栀子苷含量约[/font][font='宋体']50%)安徽省亳州市亚强天然产物制品厂。[/font]2.3.2方法2.3.2.1 β-葡萄糖苷酶的发酵[font='宋体']用接种铲取岀—块适当大小的成熟种子培养基接入发酵培养基中,振荡混匀后置32℃恒温培养箱培养72h,发酵好的培养基加入10倍重量的蒸馏水浸提2h后抽滤,所得滤液即为浸提酶液。[/font]2.3.2.2 栀子蓝的显色[font='宋体']将浸提酶液与栀子黄废液混和后水浴保温反应生成栀子苷元,栀子苷元液再与组氨酸髙温水浴可得栀子蓝溶液[/font]2.3.2.3色素含量的测定[font='宋体']取栀子蓝溶液适当稀释后,用lcm比色皿,于590nm波长处测其OD值[/font]2.3.2.4葡萄糖标准曲线的制作[font='宋体']分别取[/font][font='宋体']0.1%葡萄糖标准液0.2、0.4、0.6、0.8、1.0m,加蒸馏水至终体积1m,再加1mDNS试剂,混合后煮沸5min,冷却,用蒸馏水稀释至10m,于540nm波长处测定其OD值,以1m蒸馏水与1m DNS试剂的混和液为对照。所得结果作葡萄糖标准曲线[/font][font='宋体'][size=18px]3 [/size][/font][font='宋体'][size=18px]栀子蓝色素的精制纯化[/size][/font]3.1动态层析工艺条件选择[font='宋体']为了得到纯度和色价都较高的栀子蓝色素[/font][font='宋体'],[/font][font='宋体']有必要选择最佳的层析条件[/font][font='宋体']。[/font][font='宋体']选择直径为3cm的层析柱,考察不同的上样量洗脱速度和径长比对层析效果的影响。[/font]3.1.1上样量的选择[font='宋体']由于上样量直接影响层析柱的柱效及分离效果,因此,首先考察上样量的影响,洗脱速度为0.10m[/font][font='宋体']L[/font][font='宋体']/s,径长比为1:20,实验结果见表1。[/font][table][tr][td][font='宋体']上样量/填料(g/g)[/font][/td][td][font='宋体']1[/font][font='宋体']:20[/font][/td][td][font='宋体']1[/font][font='宋体']:40[/font][/td][td][font='宋体']1[/font][font='宋体']:60[/font][/td][/tr][tr][td][font='宋体']OD值[/font][/td][td][font='宋体']0[/font][font='宋体'].88[/font][/td][td][font='宋体']0[/font][font='宋体'].24[/font][/td][td][font='宋体']0[/font][font='宋体'].47[/font][/td][/tr][/table][align=center]表1上样量对分离效果的影响上样量/填料(g/g)[/align][font='宋体']通过表1可以看出,在层析柱径长比和洗脱时间不变的情况下,随着进样量的增加,分离效果明显变差。由柱层析的动力学分析可知,随着物料浓度的升高,传质动力增加,从而使物料在柱中的相对保留时间缩短;而进样量太少,单位时间内得到的产品很少,影响分离效率,因此选择上样量为1:40(上样量/填料)。[/font]3.1.2洗脱速度的选择[font='宋体']当上样量/填料为1:40,径长比为1:20,研究不同洗脱速度对分离效果的影响,结果见表[/font][font='宋体']2。[/font][font='宋体']洗脱速度过快,洗脱剂消耗量太大,色带易拖尾,各种成分分离不彻底;洗脱速度慢,分[/font][font='宋体']离时间长,经济效益比较低,因此要选择合适的洗速度,由表[/font][font='宋体']2可知,选择洗脱速度为0.1m/s较为[/font][font='宋体']适宜。[/font][table][tr][td][font='宋体']洗脱速度(mL[/font][font='宋体']/s)[/font][/td][td][font='宋体']0[/font][font='宋体'].05[/font][/td][td][font='宋体']0[/font][font='宋体'].10[/font][/td][td][font='宋体']0[/font][font='宋体'].20[/font][/td][td][font='宋体']0[/font][font='宋体'].30[/font][/td][/tr][tr][td][font='宋体']O[/font][font='宋体']D[/font][font='宋体']值[/font][/td][td][font='宋体']0[/font][font='宋体'].26[/font][/td][td][font='宋体']0[/font][font='宋体'].24[/font][/td][td][font='宋体']0[/font][font='宋体'].53[/font][/td][td][font='宋体']0[/font][font='宋体'].98[/font][/td][/tr][/table][align=center]表2洗脱速度对分离效果的影响洗脱速度(mL/s)[/align]3.1.3层析柱径长比的选择[font='宋体']对于选定的上样量填料和洗脱速度,层析柱的径长比是决定理论塔板数的一个重要因素,只有当理论塔板数达到一定值衬,也就是层析柱长度达到一定值时,混合物才能得到有效分离。当上样量/填料为1:40,洗脱速度为0.10mL/s,层析柱径长比对分离效果的影响见表3[/font][table][tr][td][font='宋体']直径/柱长(cm[/font][font='宋体']/[/font][font='宋体']cm)[/font][/td][td][font='宋体']1:1[/font][font='宋体']0[/font][/td][td][font='宋体']1:2[/font][font='宋体']0[/font][/td][td][font='宋体']1:3[/font][font='宋体']0[/font][/td][/tr][tr][td][font='宋体']OD值[/font][/td][td][font='宋体']0[/font][font='宋体'].75[/font][/td][td][font='宋体']0[/font][font='宋体'].24[/font][/td][td][font='宋体']0[/font][font='宋体'].29[/font][/td][/tr][/table][align=center]表3径长比对分离效果的影响[/align][font='宋体']由表3可见,当柱长减小时,分离效果明显变差。按层析塔板理论,柱高增加时,则理论塔板数増加,使物质分子的相对保留时间差异增大,物质组分的分离度提高。但也并不是层析柱越高越好,过的柱高可能产生以下几个问题:层析柱阻力增加,需要较高的操作压力;保留时间延长,单位时间内能获得的产品量减少;由于扩散作用的影响较大,引起层析峰形的扩散、产物浓度的降低等[/font][font='宋体']。[/font][font='宋体']根据实验的结果,选择层析柱的径长比为1:20[/font][font='宋体']。[/font]3.2层析柱的使用周期[font='宋体']在室温下,径长比1:20,上样量/填料比为1:40,洗脱速度为0.10mL/s的条件下对同一[/font][font='宋体']根柱子进行重复实验,测得其可重复使用[/font][font='宋体']6次以上[/font]3.3精制纯化效果验证[font='宋体']准确称取原料0.1191g,用蒸馏水溶解后定容于100mL的容量瓶中,用紫外[/font][font='宋体']-[/font][font='宋体']可见分光光度计进行扫描,得其色价为27,OD值为1.03[/font][font='宋体']准确称取层析法精制纯化后的栀子蓝色素产品0.1084g,用蒸馏水溶解后定容于100mL的容量瓶中,用紫外-可见分光光度计进行扫描,得其色价为238, OD值为0.24[/font][font='宋体']精制纯化的效果表明,用壳聚糖衍生物为填料对栀子蓝素色进行层析法精制,其色价提高了[/font][font='宋体']8.8倍,其OD值下降了39%[/font][font='宋体']。[/font][font='宋体'][size=18px]4 [/size][/font][font='宋体'][size=18px]栀子蓝色素的标准[/size][/font]4.1范围[font='宋体']本标准适用于以栀子的果实为原料,经水或食用乙醇浸提、酶解(β葡萄糖苷酶)、添加食用氨基酸化合、精制等工艺加工制成的食品添加剂栀子蓝[/font][font='宋体']。[/font]4.2 技术要求4.2.1感官要求[table][tr][td][align=center][font='宋体']项目[/font][/align][/td][td][align=center][font='宋体']要求[/font][/align][/td][td][align=center][font='宋体']检测方法[/font][/align][/td][/tr][tr][td][align=center][font='宋体']气味[/font][/align][/td][td][align=center][font='宋体']略有特殊的芳香性气味[/font][/align][/td][td=1,3][align=center][font='宋体']取适量样品置于清洁、干燥的白瓷盘中,在自然光线下,观察其色泽和状态,并嗅其气味[/font][/align][/td][/tr][tr][td][align=center][font='宋体']色泽[/font][/align][/td][td][align=center][font='宋体']蓝色至深紫蓝色[/font][/align][/td][/tr][tr][td][align=center][font='宋体']状态[/font][/align][/td][td][align=center][font='宋体']粉末、粒状或液体[/font][/align][/td][/tr][/table]4.2.2 理化指标[table][tr][td=1,2][font='宋体']项目[/font][/td][td=2,1][align=center][font='宋体']指 [/font][font='宋体'] [/font][font='宋体']标[/font][/align][/td][/tr][tr][td][align=center][font='宋体']粉末、粒状[/font][/align][/td][td][align=center][font='宋体']液体[/font][/align][/td][/tr][tr][td][align=left][font='宋体']色价[/font][font='宋体']E[/font][font='宋体'][size=13px]1[/size][/font][font='宋体'][size=13px]cm[/size][/font][font='宋体'][size=13px]1%[/size][/font][font='宋体'](5[/font][font='宋体']80-620[/font][font='宋体'])nm[/font][/align][/td][td=2,1][align=center][font='宋体']符合声称[/font][/align][/td][/tr][tr][td][font='宋体']干燥减量,w/%[/font][font='宋体'] [/font][font='宋体']≤[/font][font='宋体'] [/font][/td][td][align=center][font='宋体']7[/font][/align][/td][td][align=center][font='宋体']——[/font][/align][/td][/tr][tr][td][font='宋体']铅(Pb)/[/font][font='宋体'](mg/kg) [/font][font='宋体']≤[/font][/td][td][align=center][font='宋体']3[/font][/align][/td][td][align=center][font='宋体']3[/font][/align][/td][/tr][tr][td][font='宋体']总[/font][font='宋体']砷[/font][font='宋体'](以As计)/[/font][font='宋体'](mg/kg) [/font][font='宋体']≤[/font][/td][td][align=center][font='宋体']2[/font][/align][/td][td][align=center][font='宋体']2[/font][/align][/td][/tr][/table][font='宋体']注:商品化的栀子蓝产品应以符合本标准的栀子蓝为原料,可添加食用糊精和(或)乳糖而制成,其色价符合声称。[/font][font='宋体'][size=18px]5[/size][/font][font='宋体'][size=18px]栀子蓝的检测[/size][/font]5.1 一般规定[font='宋体']本标准所用试剂和水,在没有注明其它要求时,均指分析纯试剂和GB/T 6682中规定的三级水。分析中所用标准滴定溶液、杂质测定用标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T 601、GB/T 602、GB/T 603的规定制备。本试验所用溶液在未注明用何种溶剂配制时,均指水溶液。[/font]5.2 鉴别试验5.2.1 试剂和材料[font='宋体']0.2 mol/L 磷酸氢二钠溶液:准确称取磷酸氢二钠(Na2HPO412H2O)71.64 g,用水定容至1000 mL。0.1 mol/L 柠檬酸溶液:准确称取柠檬酸(C6H8O7H2O)21.01g,用水定容至1000 mL。pH7.0柠檬酸缓冲液:0.2 mol/L磷酸氢二钠溶液16.47 mL与0.1 mol/L柠檬酸溶液3.53 mL混合。次氯酸钠溶液:有效氯含量在4%以上。[/font]5.2.2 分析步骤5.2.2.1最大吸收波长[font='宋体']取5.3.2色价测定中的栀子蓝试样液,用分光光度计检测,在波长580 nm-620 nm之间应有最大吸收峰。[/font]5.2.2.2颜色反应[font='宋体']用pH 7.0柠檬酸缓冲液[/font][font='宋体']配制[/font][font='宋体']0.1%试样液,应呈蓝色。[/font]5.2.2.3褪色反应 [font='宋体']取0.1%试样液5mL,加盐酸1~2滴,再加含有效氯4%以上的次氯酸钠溶液1~3滴,应褪色。[/font]5.3 色价的测定5.3.1 仪器和设备[font='宋体']分光光度计。[/font]5.3.2 分析步骤[font='宋体']称取约0.2 g试样,精确至0.0001 g,用水溶解,转移至100 mL容量瓶中,加水定容至刻度,摇匀,然后吸取10 mL,转移至100 mL容量瓶中,加水定容至刻度,摇匀。取此试样液置于1 cm比色皿中,以水做空白对照,用分光光度计在580 nm-620 nm内的最大吸收波长处测定[/font][font='宋体']吸光度。(吸光度应控制在[/font][font='宋体']0.3-0.7之间,否则应调整试样液浓度,再重新测定吸光度。)[/font]5.3.3 结果计算[font='宋体']色价以被测试样液浓度为1 %、用1 cm 比色皿、在580 nm~620 nm范围内最大吸收波长处测得的吸光度[/font][font='宋体']E[/font][font='宋体'][size=13px]1[/size][/font][font='宋体'][size=13px]cm[/size][/font][font='宋体'][size=13px]1%[/size][/font][font='宋体']([/font][font='宋体']5[/font][font='宋体']80-620)n[/font][font='宋体']m[/font][font='宋体']计,按公式(5.1)计算:[/font][font='宋体']E[/font][font='宋体'][size=13px]1[/size][/font][font='宋体'][size=13px]cm[/size][/font][font='宋体'][size=13px]1%[/size][/font][font='宋体']([/font][font='宋体']5[/font][font='宋体']80-620)nm=[/font][font='宋体']A/[/font][font='宋体']C [/font][font='宋体']×[/font][font='宋体'] 1/100...........................................(5.1)[/font][font='宋体']式中:[/font][font='宋体']A[/font][font='宋体']——[/font][font='宋体']实测试样液的吸光度[/font][font='宋体']C——被测试样液浓度的数值,单位为克每毫升([/font][font='宋体']g/mL)[/font][font='宋体']100—浓度换算系数[/font][font='宋体']实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值[/font][font='宋体']不得超过2[/font][font='宋体']%[/font][font='宋体']。[/font][font='宋体'][size=18px]6[/size][/font][font='宋体'][size=18px] [/size][/font][font='宋体'][size=18px]展望[/size][/font][font='宋体']天然色素主要以红、黄色调为[/font][font='宋体']主,蓝色素非常稀少,文献中常以贵重”、“极少”、“罕见”等词语提及。[/font][font='宋体']在我国GB2760-2007《食品添加剂使用卫生标准》中列出的56种色素中蓝色素仅有栀子蓝色素和藻青素(即藻蓝蛋白色素)两种。蓝色是三原色之一,可用于多种色调的调配,但由于蓝色素非常稀少,使得天然蓝色素在国内外市场上均供不应求,因此积极开展天然蓝色素的研究开发工作,必将具有极大的现实意乂和诱人的市场前景[/font][font='宋体']。[/font]参考文献:[font='宋体'][1]顾卫民.栀子蓝色素理化性质的研究[J].江苏食品与发酵,2002(04):9-11.[/font][font='宋体'][2]吴一平,商锋,尹胜,肖潇,蔡浩,王成涛,孙宝国,文雁君.栀子蓝色素的分步制备工艺[J].中国食品学报,2017,17(11):113-120.[/font][font='宋体'][3]陈峰,陈剑锋.栀子蓝色素稳定性的研究[J].宁德师范学院学报(自然科学版),2013,25(03):236-239.[/font][font='宋体'][4]徐尤智,梁华正,陈贺,贺玉兰,李媛.高色价栀子蓝色素的制备及其稳定性研究[J].现代食品科技,2011,27(04):440-443.[/font][font='宋体'][5]罗义发,田妍基,周三女,刘丽清,潘斌,施满容.栀子蓝色素的稳定性研究[J].农产品加工,2019(19):6-8.[/font][font='宋体'][6]吴志梅,梁华正,李佳春,李媛.栀子蓝色素的发酵及分离纯化工艺的研究[J].生物技术,2005(04):61-63.[/font][font='宋体'][7]肖亚中,王怡平,王金木,周磊.栀子蓝色素生产工艺研究[J].食品与发酵工业,2002(07):37-41.[/font][font='宋体'][[/font][font='宋体']8]唐伯辰,梁华正,贺玉兰,等。共固定化酶催化栀子苷水解制备栀子蓝色素[/font][font='宋体'][[/font][font='宋体']J].食品科技,2013,38(2)229-232.[/font][font='宋体'][[/font][font='宋体']9]赵亚南。栀子苷生物转化制备栀子蓝和京尼平的研究[/font][font='宋体'][[/font][font='宋体']D].2012.[/font][font='宋体'][[/font][font='宋体']10]尹燕,黄相中,关小丽,等,栀子蓝色素的制备及其抗氧化活性研究[/font][font='宋体'][[/font][font='宋体']J].云南名族大学学报(自然科学版)2014,23(4)[/font][font='宋体']:[/font][font='宋体']243-247.[/font][font='宋体'][11]王梓瑜. [胆碱][氨基酸]离子液体提取栀子苷与栀子蓝色素的制备[D].湖南农业大学,2018.[/font][font='宋体'][12]凌敏,焦裕健,李立明,李培尊,吴晏玲.高色价栀子蓝色素的制备及其纯化工艺研究[J].食品工业科技,2009,30(09):262-264.[/font]
各位前辈好: 我想问一下,色素中的花青素含量要怎么测定,它与色素的色价之间有没有一个固定的关系式,谢谢!!!
大家好! 请问有哪位朋友检测过色素亮黑? 请指点!好心人加qq:103210598