氯化物标准溶液和氯离子标液一样吗? 这二个标液都可以标定硝酸银吗? 二个都是买来的。
按国标GB11896-89进行氯化物测定,硝酸银溶液标定后的浓度要怎么计算呢?国标上说:[b]计算每毫升硝酸银溶液所相当的氯化物量,然后校正其浓度,再作最后标定。[/b]是什么意思呢,没搞明白。另外,标定用的氯化钠标准溶液是将买的0.1002mol/L的标液稀释10倍,没有自己配制0.0141mol/L的氯化钠标准溶液,这对硝酸银溶液的标定会有影响吗?
关于检测食品氯化物含量的结果判定食品中氯化物检测中(直接沉淀法),用铬酸钾溶液边摇动边滴定硝酸银标准溶液至红黄色来判定滴定终点,加入检样溶液是黄色的话,终点很难确定,请问各路高手有什么办法可以解决?
请教各位“标准液、标准溶液、滴定液”的区别?我一直拎不清它们的关系。事先搜索了一下帖子,没找到相关内容!1.标准溶液是不是指譬如氯化物检查法中的标准氯化钠溶液、硫酸盐检查法中的标准硫酸钾溶液等等?2.在网站上曾查到一篇分析化学讲义,里面说“标准液是已知浓度的滴定液”,是这样子的吗?
GBZ//T 160.37 -2004 《工作场所空气有毒物质测定氯化物》中,为什么用溴酸钾来配制氯标准溶液?
实验室几个滴定实验涉及到标准溶液的标定,咨询大家一下这些标准溶液时每次测量的时候都要标定,还是说配置一次标定一次: 1.水质氯化物测定—硝酸银滴定法中的“硝酸银” 2.化学需氧量测定—重铬酸盐法中的“硫酸亚铁铵” 3.总硬度的测定—EDTA滴定法中的“EDTA”
我没有做过氯化物的实验,现在需要做一个浓度为260~320mg/L的考核样,心里好没底啊,希望求助好心人士告诉我这个浓度范围内有哪些考核样啊,浓度时多少?
依GB/T602-2002标准进行杂质标准溶液的配制,其中氯化物(以氯离子计)与氯杂质标准溶液的配制方法不一样,不明白这两种杂质标准溶液有什么区别?不都是以氯来计算么?
药典0800限量检查法中,有些检查项要先配贮备液,再将贮备液配成标准溶液去做检查,比如氯化物检查,先配氯化钠贮备液,再用贮备液现配标准氯化钠溶液。为什么要这样做呢?直接配标准氯化钠溶液不好吗?怕标准溶液长时间放置不稳定?
我需要配制氯仿和四氯化碳的标准溶液,用来检测自来水中的氯仿和四氯化碳,从厂家购进的1000微克每毫升的氯仿和四氯化碳标准溶液.说明书上写的是"甲醇中的氯仿,或甲醇中的四氯化碳"我需要配制成一定浓度的标准溶液,请问稀释的时候是用纯水稀释还是用甲醇稀释.请指教!
刚买了几台水质分析速测仪,想校正下仪器内各个水质指标的标准曲线准不准。请问各位哪里可以买得到标准溶液?急急急求助啊,项目如下:测试项目水质氯化物水质pH水质中氰化物水质中硫酸盐水质中亚铁 水质中磷酸盐水质中钡水质中总磷 水质中硝基苯类水质中甲醛水质中 铝水中总氯
能力验证----水质氯化物的测定摘要:水中氯化物的测定,硝酸银滴定法,它的难度在于,终点颜色不好把握,本文参考了其它标准与文献,顺利通过了水中氯化物的能力验证,将这一过程写出来共享。1 实验部分1.1 仪器与试剂氯化钠标准溶液、硝酸银标准溶液、铬酸钾溶液等。锥形瓶、滴定管、吸管。1.2实验方法GB11896-89《水质氯化物的测定硝酸银滴定法》、GB/T5750.5-2006《生活饮用水标准检验方法无机非金属指标》1.3 标准溶液的配置氯化物标准溶液:C(Nacl)=0.0141mol/L,相当于500mg/L氯化物含量:将氯化钠置于瓷坩埚内,在500∽600℃下灼烧40∽50min。在干燥器中冷却后称取8.2400g,溶于蒸馏水中,在容量瓶中稀释至1000mL。用吸管吸取10.0mL,在容量瓶中准确稀释至100mL。硝酸银标准溶液,C(AgNO3)=0.0141mol/L:称取2.3950g于105℃烘半小时的硝酸银,溶于蒸馏水中,在容量瓶中准确稀释至1000mL,贮于棕色瓶中。1.4样品的预处理干扰的排除,能力验证的水样呈透明色,按无干扰处理。1.5实验过程用吸管吸取50mL水样加入1mL铬酸钾溶液,用硝酸银标准溶液滴定至砖红色沉淀刚刚出现即为滴定终点。同法作空白滴定。
氯化钠标准溶液配置为什么要加入淀粉溶液~
[size=4]各位前辈,水中氯化物测定,在标定硝酸银这步可否不调整硝酸银溶液浓度使其1.00mL相当于0.50mg氯化物,直接用标定值m带入后面的计算式代替其中的0.50。[/size]
1主题内容与适用范围 本标准规定了用硫氰酸盐反滴定测定饲料中可溶性氯化物的方法。 本标准适用于各种配合饲料、浓缩饲料和单一饲料。检测范围氯元素含量为0~60mg。 2引用标准 GB 1.4标准化工作导则化学分析方法标准编写规定 GB 6682实验室用水规格 3方法原理 溶液澄清,在酸性条件下,加入过量硝酸银溶液使样品溶液中的氯化物形成氯化银沉淀,除去沉淀后,用硫氰酸铵回滴过量的硝酸银,根据消耗的硫氰酸铵的量,计算出其氯化物的含量。 4试剂 实验室用水应符合GB 6682中三级水用水的规格。使用试剂除特殊规定外应为分析纯。 4.1硝酸。 4.2硫酸铁(60g/L):称取硫酸铁〔Fe2(SO4)3xH2O〕60g加水微热溶解后,调成1000mL。 4.3硫酸铁指示剂:250g/L的硫酸铁水溶液,过滤除去不溶物,与等体积的浓硝酸混合均匀。 4.4氨水:1+19水溶液。 4.5硫氰酸铵〔c(NH4CNS)=0.02moL/L〕:称取硫氰酸铵1.52g溶于1000mL水中。 4.6氯化钠标准贮备溶液:基准级氯化钠于500℃灼烧1h,干燥器中冷却保存,称取5.8454g溶解于水中,转入1000mL容量瓶中,用水稀释至刻度,摇匀。此氯化钠标准贮备液的浓度为0.1000mol/L。 4.7氯化钠标准工作液:准确吸取(4.7)溶液20.00mL于100mL容量瓶中,用水稀释至刻度,摇匀。此氯化钠标准溶液的浓度为0.0200mol/L。 4.8硝酸银标准溶液〔c(AgNO3)=0.02mol/L〕:称取3.4g硝酸银溶于1000mL水中,贮于棕色瓶内。 4.8.1体积比:吸取硝酸银溶液20.00mL,加硝酸4mL,指示剂2mL,在剧烈摇动下用硫氰酸铵溶液滴定,滴至终点为持久的淡红色,由此计算两溶液的体积比F,见式(1):F = 20.00 / V2…………………………………………………(1)式中:F──硝酸银与硫氰酸铵溶液的体积比;20.00──硝酸银溶液的体积,mL; V2──硫氰酸铵溶液体积,mL。 4.8.2标定:准确移取氯化钠标准溶液10.00mL,于100mL容量瓶中,加硝酸4mL,硝酸银标准溶液25.00mL,振荡使沉淀凝结,用水稀释至刻度,摇匀,静置5min,干过滤入干锥形瓶中,吸取滤液50.00mL,加硫酸铁指示剂2mL,用硫氰酸铵溶液滴定出现淡红棕色,且30s不褪色即为终点。 硝酸银标准溶液浓度计算见式(2): C(AgNO3)=m′×(20/1000)(10/100) / 0.05845×(V1-F×V×100/50) ……………………………(2)式中:c(AgNO3)── 硝酸银标准溶液摩尔浓度,mol/L; m′── 氯化钠质量,g; V1── 硝酸银标准溶液体积,mL; V2── 硫氰酸铵溶液体积,mL; F── 硝酸银与硫氰酸铵溶液的体积比; 0.05845──与1.00mL硝酸银标准溶液〔c(AgNO3)=1.0000mol/L〕相当的以克表示的氯化钠质量。 所得结果应表示至四位小数。 5仪器设备 5.1实验室用样品粉碎机或研钵。 5.2分样筛:孔径0.45mm(40目)。 5.3分析天平:分度值0.1mg。 5.4刻度移液管:10、2mL。 5.5移液管:50、25mL。 5.6滴定管:酸式,25mL。 5.7容量瓶:100、1000mL。 5.8烧杯:250mL。 5.9滤纸:快速,直径15.0cm;慢速,直径12.5cm。 6样品的选取和制取 选取有代表性的样品,粉碎至40目,用四分法缩减至200g,密封保存,以防止样品组分的变化或变质。 7测定步骤 7.1氯化物的提取 称取样品适量(氯含量在0.8%以内,称取样品5g左右;氯含量在0.8%~1.6%,称取样品3g左右;氯含量在1.6%以上,称取样品1g左右),准确至0.0002g,准确加入硫酸铁溶液50mL,氨水溶液100mL,搅拌数分钟,放置10min,用干的快速滤纸过滤。 7.2测定 准确吸取滤液50.00mL,于100mL容量瓶中,加浓硝酸10mL,硝酸银标准溶液 25.00mL,用力振荡使沉淀凝结,用水稀释至刻度,摇匀。静置5min,干过滤入150mL干锥形瓶中或静置(过夜)沉化,吸取滤液(澄清液)50.00mL,加硫酸铁指示剂10mL,用硫氰酸铵溶液滴定,出现淡桔红色,且30s不褪色即为终点。 8测定结果的计算 氯化物含量用氯元素的百分含量来表示,见式(3):Cl(%)=〔(V1-V2×F×100/50)×c×150×0.0355〕/(m×50)×100……………(3)式中:m──样品质量,g; m′── 氯化钠质量,g; V1── 硝酸银溶液体积,mL; V2── 消耗硫氰酸铵溶液体积,mL; F── 硝酸银与硫氰酸铵溶液的体积比; 0.05845──与1.00mL硝酸银标准溶液〔c(AgNO3)=1.000 omol/L相当的以克表示的氯元素的质量。所得结果以表示至二位小数。 9允许差 每个样品应取两份平行样进行测定,以其算术平均值为分析结果。 氯含量在3%以下(含3%),允许绝对差0.05;氯含量在3%以上,允许相对偏差3%。 附录A 水溶性氯化物快速测定法 (补充件) 称取5~10g样品,准确至0.001g,准确加蒸馏水200mL,搅拌15min,放置15min,准确移取上清液20mL,加蒸馏水50mL,10%铬酸钾指示剂1mL,用硝酸银标准溶液滴定,呈现砖红色,且1min不褪色为终点。 计算见式(A1):Cl(%)=〔V2×c×200×0.0355/(m×20)〕×100…………………………(A1) 式中:同本标准式(3)。
测定水中氯化物时,配氯化钠溶液时需将氯化钠置于瓷坩埚内,在500~600摄氏度灼烧40~50min,我想问下用什么加热工具来完成这一步的啊,多谢了!
GB/T 601-2002 中氯化锌标准溶液配置是:把氯化锌溶于1L盐酸溶液中(1+2000)。1+2000的盐酸溶液我侧过PH值,大约在3左右。可是,这氯化锌标准溶液是用来做 PAC检测用的(GB 15892-2003 or 2009)。PAC样品最后处理是加入10mL乙酸-乙酸钠缓冲溶液(PH=5.5),用二甲酚橙做指示剂。加入缓冲溶液,样品PH自然到了5.5,可是氯化锌是3,在滴定过程中,随着氯化锌的不断加入,缓冲溶液会不会被破坏掉呢?氯化锌一般是要用40mL的。在配氯化锌的时候能不能少加一点盐酸呢?把PH尽量控制在5.5左右。
大家的氯化钠标准溶液是怎么配制!我查资料要在550度烘6个小时,有点质疑,不知道大家是怎么做的
请教各位一下: 标定氯化锌时可以用已知浓度的EDTA标准溶液标定吗? 如何计算? 谢谢
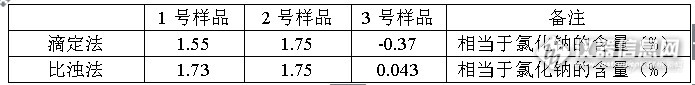
饲料中水溶性氯化物的检测一 范围 适用于饲料中水溶性氯化物的测定。二 原理 1. 试样中的氯离子溶解于水溶液中,如果试样含有有机质,需将溶液澄清,然后用硝酸稍加酸化,并加入硝酸银标准溶液使氯化物生成氯化银沉淀,过量的硝酸银用硫氰酸钾标准溶液滴定。 2.试样中的氯离子溶解于水溶液中,如果试样含有有机质,需将溶液澄清,取一定量的澄清液加入硝酸银溶液,会出现浑浊,在YN-2000上通过比浊法来检测试样中氯化物的含量。三 试剂和溶液 3.1 蒸馏水 3.2硝酸 3.3 活性炭:不含有氯离子也不能吸附氯离子; 3.4硫酸铁铵饱和溶液; 3.5 Carrez I:称取10.6g亚铁氰化钾,溶解并用蒸馏水定容至100ml。 3.6 Carrez II:称取21.9g乙酸锌,加3.0mL冰乙酸,溶解并用蒸馏水定容至 100ml。 3.7 硫氰酸钾标准溶液:c=0.1mol/L。 3.8 硝酸银标准滴定溶液:c=0.1mol/L。 3.9 有效氯掩蔽剂; 3.10 有效氯浊度剂; 3.11 有效氯助色剂;四 仪器 4.1 振荡器; 4.2 容量瓶:100mL,50mL,25mL; 4.3 移液管:5mL,2mL,1.0mL; 4.4 滴定管; 4.5 分析天平:感量0.0001g; 4.6 中速定量滤纸; 4.7 YN-2001土肥仪 4.8 小反应瓶; 4.9 比色皿; 4.10 三角瓶;五 步骤 5.1含有机物试样试液的制备 称取1.0g试样(质量m),精确到0.001,转移至100mL容量瓶中,加入0.1g活性炭,加入40mL温度约20℃的蒸馏水和1mLCarrez I溶液,摇匀,然后加入Carrez II溶液,混合,在振荡器上摇30min,用蒸馏水定容至刻度(Vi),混匀,过滤,滤液供滴定用。 5.2 滴定 量取过滤液50ml于250mL三角瓶中,加入5.0ml
在硝酸银滴定氯化物的实验中,配制氯化钠标准溶液为0.0141mol/L,为什么要先配置成1000ml的0.141mol/L,再吸取10ml定容至100ml,不能直接配置成0.0141mol/L的溶液吗?
GB 5009.44中第一法,测定氯化物含量的问题 按照此标准,滴定硝酸银溶液时,第一次添加硝酸银标准溶液--所需量的90%,90%是多少如何计算出来?
现国家标准中只有0.1mol/l氯化锌标准溶液的标定方法,但是0.02mol/l的标定方法和0.1mol/l的不一样吧,哪位大侠可以提供,小弟求教中
氯化钠标准溶液配制中的氯化钠为什麽要求在500-600度干燥
请教个问题:我购买了有证的氯化钠标准物质,纯度99.992%,用来配置氯离子标准溶液,此时数据溯源可以直接溯源到有证的氯化钠标准物质吗?还是需要用我配置的氯离子标准溶液来制备标准曲线溶液,然后再检测1支氯离子质控样,数据溯源到氯离子质控样?
我用硝酸银滴定法做氯化物,有一水样取25ml,滴定后计算其浓度为113.36mg/l。现我想做一个加标回收验证其准确度,请问我该取多少毫升的氯化钠标准溶液(氯化钠标液浓度为0.0141mol/l)
各位,我有一些难题需要大家帮忙一下的!就是那个水中的苯系物的测定,它里面的物质是八种的而那些标准溶液都是七种的,所以让我和迷茫不知道去哪里买这个苯系物中八种物质的标准溶液。各位可以来为小弟解答一下吗?
之前一直用着1000ug/ml的苯系物标准溶液。请问现在有没有二硫化碳中的苯系物的标准溶液,100ug/ml的(苯,甲苯,二甲苯,乙苯,苯乙烯)还有甲醇中的苯系物和二硫化碳中的苯系物有什么区别?做样的方法是584-2010二硫化碳中解析法来做苯系物的。
1标准溶液的配制方法及基准物质标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。不论采用何种滴定方法,都离不开标准溶液。因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。配制标准溶液的方法一般有以下两种:1.1直接配制法用分析天平 准确地称取一定量的物质,溶于适量水后定量转入容量瓶 中,稀释至标线,定容并摇匀。根据溶质的质量和容量瓶 的体积计算该溶液的准确浓度。能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。作为基准物质必须符合下列要求:(1) 试剂必须具有足够高的纯度,一般要求其纯度在99.9%以上,所含的杂质应不影响滴定反应的准确度。(2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼砂Na2B4O7.10H2O),其结晶水的数目也应与化学式完全相符。(3) 试剂应该稳定。例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。(4)试剂最好有较大的摩尔质量,这样可以减少称量误差。常用的基准物质有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K2Cr2O7 ,Na2CO3 , MgO , KBrO3 等,它们的含量一般在99.9%以上,甚至可达99.99% 。应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到99.9%,这时就不能用作基准物质。一些常用的基准物质及其应用范围列于表2.1中。表2.1 常用基准物质的干燥条件和应用基准物质干燥后的组成干燥条件℃标定对象名称化学式碳酸氢钠NaHCO3Na2CO3270─300酸十水合碳酸钠Na2CO3·10H2ONa2CO3·10H2O270─300酸硼砂Na2B4O7·10H2ONa2B4O7·10H2O放在装有NaCl和蔗糖饱和溶液的密闭器皿中酸二水合草酸H2C2O4·2H2OH2C2O4·2H2O室温空气干燥碱或KMnO4邻苯二甲酸氢钾KHC8H4O4KHC8H4O4110─120碱重铬酸钾K2Cr2O7K2Cr2O7140─150还原剂溴酸钾KBrO3KBrO3130还原剂草酸钠Na2C2O4Na2C2O4130KMnO4碳酸钙CaCO3CaCO3110EDTA锌ZnZn室温干燥器中保存EDTA氯化钠NaClNaCl500─600AgNO3硝酸银AgNO3AgNO3220─250氯化物1.2 间接配制法(标定法)需要用来配制标准溶液的许多试剂不能完全符合上述基准物质必备的条件,例如:NaOH极易吸收空气中的二氧化碳和水分,纯度不高;市售盐酸中HCl的准确含量难以确定,且易挥发;KMnO4和Na2S2O3等均不易提纯,且见光分解,在空气中不稳定等。因此这类试剂不能用直接法配制标准溶液,只能用间接法配制,即先配制成接近于所需浓度的溶液,然后用基准物质(或另一种物质的标准溶液)来测定其准确浓度。这种确定其准确浓度的操作称为标定。例如欲配制0.1mol.L-1HCl标准溶液,先用一定量的浓HCl加水稀释,配制成浓度约为0.1mol?L-1的稀溶液,然后用该溶液滴定经准确称量的无水Na2CO3 基准物质,直至两者定量反应完全,再根据滴定中消耗HCl溶液的体积和无水Na2CO3 的质量,计算出HCl溶液的准确浓度。大多数标准溶液的准确浓度是通过标定的方法确定的。在常量组分的测定中,标准溶液的浓度大致范围为0.01 mol.L-1至1 mol.L-1,通常根据待测组分含量的高低来选择标准溶液浓度的大小。为了提高标定的准确度,标定时应注意以下几点:⑴ 标定应平行测定3- 4次,至少重复三次,并要求测定结果的相对偏差不大于0.2% 。⑵ 为了减少测量误差 ,称取基准物质的量不应太少,最少应称取0.2g以上;同样滴定到终点时消耗标准溶液的体积也不能太小,最好在于20mL以上。⑶ 配制和标定溶液时使用的量器,如滴定管 ,容量瓶和移液管 等,在必要时应校正其体积,并考虑温度的影响。⑷ 标定好的标准溶液应该妥善保存,避免因水分蒸发而使溶液浓度发生变化;有些不够稳定,如见光易分解的AgNO3和 KMnO4等标准溶液应贮存于棕色瓶中,并置于暗处保存;能吸收空气中二氧化碳并对玻璃有腐蚀作用的强碱溶液,最好装在塑料瓶 中,并在瓶口处装一碱石灰管,以吸收空气中的二氧化碳和水。对不稳定的标准溶液,久置后,在使用前还需重新标定其浓度。2 标准溶液浓度表示方法2.1 物质的量浓度(c,简称浓度)物质的量浓度是指单位体积溶液中含溶质B的物质的量,以符号cB表示。即cB =nB /VB (2.1)因 nB = mB/MB (2.2)所以 mB=cBVBMB (2.3)式 (2-1)中,B代表溶质的化学式,nB为溶质B的物质的量,它的SI单位是mol,VB表示溶液的体积,其SI单位是m3;所以物质的量浓度cB的SI单位是mol.m-3,在分析化学中常用的单位为mol.L-1或mol.dm-3 。在式(2-2)中,mB是物质B的质量,常用单位
请问测溶液中的氯化物可以用离子选择性电极吗?干扰离子是什么,怎么消除干扰?谢谢