毛细管电泳分离分析中如何实现放射性测量的?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=40274]毛细管电泳分离中的涂层方法[/url]
三氧化二砷的毛细管电泳分离条件
为什么毛细管电泳分离碱性的物质分不好?看到有些文献上说,关于MEKC,为什么阴离子表面活性剂适合分离酸性物质,阳离子表面活性剂适合分离碱性的物质.但是没有看到原因.有哪位达人知道,请告之,顺便附带相关的文献把!先谢过了!
急!!手性药物的拆分-异常现象毛细管电泳分离弱碱性药物:我现在用5mg/ml 的样品,它就出峰了,有分离趋势,但是换成小浓度的1或0.5mg/ml的它就是个单峰没有分离趋势了!!!!请教一下这是什么原因:是因为药有问题呢还是说本身就没有分离趋势而是药里面含有什么杂质了呢?还是说因为浓度太小了?但是我看文献上的浓度也不大呀1或0.2的都有用过!
[em06] 我遇到一个这样的问题,我们老板让我做一个这样的试验,让我做免疫化学发光,但是我们不是用磁微球的,他让我用毛细管电泳分离标记过的和没有标记的hpr,我做了快一个礼拜了,发现了一个问题,我的hpr标记反应实在指定的缓冲溶液中进行的,反应完成以后直接对这个反映之后的溶液进行分离,我使用的是50微米内径的毛细管,电动进样,但是我觉得样品根本就进不去,我暂时还没有压力进样,我觉得电动进样应该能够进去,但是很奇怪,没有一点反应。希望有做过这个方面的高人指点一下迷津。非常感激!
用毛细管电泳分离蛋白组分时,样品峰比较宽,怎么样使样品峰变窄?
请问毛细管电泳分离胶是流动的还是固定不流动的
我想做毛细管电泳,分离一些分子体积比较大的物质,该做什么比较好呢?目前考虑的是多糖,多肽,但是感觉这两类物质分离起来有点困难。有哪位高手可以提供一些建议?
电泳现象 电泳是指带电粒子在电场作用下向电性相反的方向迁移的现象。利用这种现象对某些化学或生物化学物质进行分离分析的技术称为电泳技术,可完成电泳分离的仪器称为电泳仪。 不同的物质粒子在同一电场中,由于它们之间有效电荷、形状、大小的差别,它们的电泳迁移就会不同,所以有可能得到分离。也就是说,物质粒子在电场中迁移速度的不同是电泳分离的基础。 毛细管电泳是将电泳的场所置于毛细管中的一种电泳分离方法,它的装置结构非常简单,通常由高压电源、铂电极、缓冲液池、样品池、毛细管、检测器和分析记录仪构成。 利用上述的仪器,我们就可以进行毛细管电泳分离。它的基本流程有进样、分离和检测三步骤。 总的来说,毛细管电泳非常广泛地应用于生命科学中生物样品的分离分析,特别是蛋白质分离、糖分析、DNA测序、手性分离、单细胞分析等。
电泳现象 电泳是指带电粒子在电场作用下向电性相反的方向迁移的现象。利用这种现象对某些化学或生物化学物质进行分离分析的技术称为电泳技术,可完成电泳分离的仪器称为电泳仪。 不同的物质粒子在同一电场中,由于它们之间有效电荷、形状、大小的差别,它们的电泳迁移就会不同,所以有可能得到分离。也就是说,物质粒子在电场中迁移速度的不同是电泳分离的基础。 毛细管电泳是将电泳的场所置于毛细管中的一种电泳分离方法,它的装置结构非常简单,通常由高压电源、铂电极、缓冲液池、样品池、毛细管、检测器和分析记录仪构成。 利用上述的仪器,我们就可以进行毛细管电泳分离。它的基本流程有进样、分离和检测三步骤。 总的来说,毛细管电泳非常广泛地应用于生命科学中生物样品的分离分析,特别是蛋白质分离、糖分析、DNA测序、手性分离、单细胞分析等。
用区带毛细管电泳分离甲酸和乙酸,同系物,应该选择多大多长的毛细管?我的缓冲液是tris+柠檬酸的。请专家们帮帮我!!谢谢!!!!!!!!!!!!!

毛细管电泳求助: 常常说胶束毛细管电色谱(MEKC)与微乳毛细管电色谱(MEEKC)不仅适合带电物质的分离,还适合中性物质(neutral compounds)的分离,在其理论计算中,很多公式都是适合中性物质的,现想求助各位高手:中性物质的概念是怎样的?如何知道自己分析的化合物是否为中性物质啊?我做的是天然产物中的有效成分,但我不知道怎样判断它们是否为中性物质,因此涉及到理论计算让我很纠结。望高手帮助,最好能给予一点中性物质的资料啊。新手不胜感激!http://ng1.17img.cn/bbsfiles/images/2013/09/201309032132_462057_2783796_3.png
本人是新生,特来请教。我们在使用毛细管电泳的时候,通常会提供正电源和负电源,我们应该怎么选啊? 还有我看书知道 毛细管电泳分离的原理是 在柱子两端,一段是正电压,一段是负电压,这样才能工作。那提供正负电源又和这个是什么关系?还望各位 大虾 指教指教。

环糊精在毛细管电泳手性分离中的应用 毛细管电泳是色谱法中比较边缘化的一种分离方法,但是由于其操作相对简单,成本比较低廉,在手性药物的拆分分析中还是具有举足轻重的作用。本人多年以前读书的时候,选择的研究课题就是手性药物的分离。手性药物要想实现手性分离,最重要的就是要有手性选择试剂和分离通道,我们知道毛细管电泳已经提供了分离通道和检测器,所以分离一种药物,关键的还是手性选择试剂。常用的手性选择试剂有环糊精、大环抗生素、手性冠醚、蛋白质、手性配体试剂以及表面活性剂等。 http://ng1.17img.cn/bbsfiles/images/2013/12/201312011124_480148_2428063_3.jpg上图分别是α-CD、β-CD 和γ-CD的结构式,环糊精的简称就是CD。自然界是奇妙无比的,除了极少数生命体外,组成自然界的物种其体内含有的氨基酸都是左旋的,这说明了什么问题?大自然是有手性选择的,连行星轨道都是自西向东的!我们有必要对生命体的手性进行分离,药物合成的过程中,毕竟是人工过程,不是自然选择的过程,所以生成左右两种对应体的可能性是一致的。常用的手性选择试剂是环糊精及其衍生物,环糊精本身虽然有多个手性中,但是自然界存在着唯一的一种立体构型。现在的研究多集中在使用其衍生物进行分离,在一定的酸度条件下,环糊精能够与绝大多数药物相互作用。因为其结构呈为桶形状,药物能够与环糊精充分相互作用,根据结合能力的不同,产生了淌度差,进而实现分离。电泳分离不同于常规的色谱分离,她的分离基础是根据淌度的区别进行分离,属于电色谱的一种。当年我查阅了大量的文献,发现环糊精体系在50mM浓度的情况下,pH控制在2.5的时候,能够实现分离多种手性化合物。当然这里的环糊精就不是指环糊精本身了,还包括环糊精的衍生物。对于环糊精体系的分离机理,通常情况下按照下面的公式表示。http://ng1.17img.cn/bbsfiles/images/2013/12/201312011124_480149_2428063_3.jpg其中A1和A2是手性化合物的两个不同构造,在手性分离条件下K1不等于K2,从而实现外消旋体的手性分离。由此可以得到公式:http://ng1.17img.cn/bbsfiles/images/2013/12/201312011124_480150_2428063_3.jpg这个公式是我的一位师兄从液相色谱的原理公式中倒出来的,后来我看到90年代初期的一篇文献,发现推道的方法虽然不一样,但是最后得到的结论却完全一致,20年前,曾经发表在色谱杂志上。后面在兰州化物所陈立仁老师的书上也看到了类似的公式。当然复杂的公式大家可能看不懂,但是原理就是这么个原理。简单的原理可以指导我们的工作,让实践变成明明白白的实践,而不是糊涂的实践。以后遇到类似问题的时候,可能就会变得豁然开朗。现实的桎梏就是,毛细管电泳的认同度还是不高,好多检测机构里,还是没有配备毛细管电泳,其使用率和市场的占有率还是偏低,归根到底还是其自身重现性差,对操作人员的要求也比较高。毛细管电泳的使用还是集中在科研院所,不过现在欣喜的看到,在中华药典里,已经出现了毛细管电泳的身影,不远的将来,药物分析里,毛细管电泳必将是翘楚。
请问如果使用毛细管区带电泳分离两种离子,都带一个正电荷或负电荷,是根据其质量来进行分离吗?如果质量一样或者相差很小,可以实现分离吗?谢谢大家了。
第1节 概述.ppt 第2节 高效毛细管电泳的理论基础.ppt 第3节 高效毛细管电泳仪.ppt 第4节 高效毛细管电泳分离模式.ppt 第5节 应用与进展.ppt[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=23629]高效毛细管电泳分析法[/url]
请问专家:用毛细管电泳分离对映体时,两对映体峰中有一峰尖部又发生了分裂,是什么原因? 还有,在电泳图中,基底吸收为零,还存在负峰,且负峰总在固定位置出现,原因可能是什么?可能是水峰吗?或存在能增强紫外光的物质吗?谢谢!
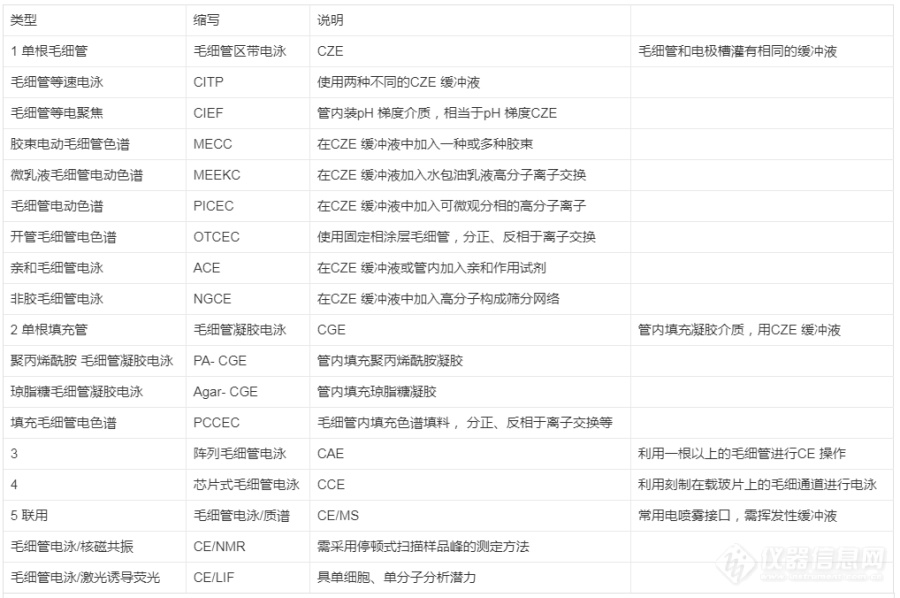
1. 分离模式毛细管电泳根据分离模式不同可以归结出多种不同类型的毛细管电泳,见表1。毛细管电泳的多种分离模式,给样品分离提供了不同的选择机会,这对复杂样品的分离分析是非常重要的。表1 毛细管电泳类型[img=,690,458]https://ng1.17img.cn/bbsfiles/images/2022/12/202212291514512122_3127_3237657_3.png!w690x458.jpg[/img]2. 操作方式毛细管电泳可以按操作方式重新分为手动、半自动及全自动型毛细管电泳。3. 分离通道形状按分离通道形状分为圆形、扁形、方形毛细管电泳等。4. 缓冲液的介质根据配制缓冲液的介质的不同,可以把CE分为水相毛细管电泳和非水毛细管电泳(NACE)。NACE是以有机溶剂作介质的电泳缓冲液代替以水为介质的缓冲溶液,增加了疏水性物质的溶解度,特别适用于在水溶液中难溶而不能用CE分离的物质或在水溶液中性质相似难以分离的同系物,拓宽了CE的分析领域。

毛细管电泳温控系统的改造方法温度控制是所有仪器非常重要的一个环节,老仪器,或者国产仪器大多没有温度控制系统,到了炎炎夏日,许多实验就做不成了。这让我们十分苦恼又十分为难!http://ng1.17img.cn/bbsfiles/images/2013/11/201311201731_478420_2428063_3.jpg以毛细管电泳为例,该仪器本身没有柱温箱,需要通过冷冻液局部致冷,贝克曼的MDQ可以实现温控功能。但是国产仪器构造相对简单,就需要想办法冷却毛细管了。以前看过一部电视剧,叫做《我的团长我的团》,里面谈到了一种机枪叫做马克沁机枪,是水冷的机枪。后面查阅资料,才知道机枪也有风冷机枪。后面我和同学聊天,说起摩托车致冷,他说也有两种方式,即风冷和水冷。但是,风冷的效果没有水冷的效果好!我们的毛细管处在大气环境中,可以将其理解为风冷。可不可以设计一种毛细管,使其也具有水冷效果呢?于是按照这个思路和想法,我进行了如下的设计和实验。http://ng1.17img.cn/bbsfiles/images/2013/11/201311201728_478419_2428063_3.jpg毛细管水冷原理图首先到当地药店或者诊所购买一根输液管,在输液管上开两个小孔,将毛细管的绝大部分通过两个小孔插入输液管内部,然后用胶水将开孔处密封,保证水路不漏液。随后取一大桶,里面装满自来水,与输液管的两端构成虹吸系统。必要的时候,为了降低水的温度,里面可以加入冰块,进行致冷。根据书本知识,水的比热容最大,降温效果最好。当然如果有超级恒温水浴槽。理论上就可以实现恒温了,不过降低温度的成本可能会有点高啊!本人在不改变仪器结构和原理的条件下,进行了DIY,完完全全服从毛细管电泳分离的基本原理,通过水冷的方式有效的降低了毛细管体系的温度,使毛细管电泳的体系稳定,测试的结果稳定性更好!不过改造过程还是有风险的,一旦密封座的不好,就会漏液。
分析大豆肽粉,主要是一些二肽,三肽,用毛细管电泳效果怎么样,还有其他分析手段么http://simg.instrument.com.cn/bbs/images/brow/em09511.gif多多指教啊

毛细管电泳分离影响因素及条件优化 By flysky97 PDF格式版本见附件! 原文来自本论坛“Nini2006”版主发的一篇帖子,毕业论文时深感其中精妙高深,遂加以整理,并加入箭头标志,希望大家进一步确认!原文见链接:【分享】电渗——不可不知关键参数http://bbs.instrument.com.cn/shtml/20130117/4520944/分离条件的优化是电泳实验中最重要也是最难的工作。可按以下途径入手:分析样品的来源、类型、组成及其生物和理化性质;据样品的性质,选择分离模式,确定检测方法;据样品解离常数计算最佳pH;据所需pH选择缓冲体系,进一步优化pH、缓冲液浓度等;优化其他参数,如分离电压和温度等;确定是否需要添加剂或非水溶剂等。对于实验条件的优化,影响分离的因素非常关键。缓冲溶液的类型、pH、浓度(离子强度)等是最为重要的几个因素。相同的 pH下,不同缓冲体系的分离效果可能相差甚远。缓冲试剂及pH调节剂的浓度也需要优化。缓冲溶液要有一定的pH调节范围和足够的缓冲容量;尽量选择浓度高而产生电流小的缓冲溶液;缓冲液的表观淌度(单位电场强度下离子的平均电泳速度称为淌度)与样品组分接近。分离效果的评价上需关注电渗流、分离速度、分离选择性、分离度等。电渗流可控制组分的迁移方向和速度,进而影响分离效率和重现性,所以电渗的控制是电泳研究的关键。如下公式所示,一般地,所有能改变电动势ξ、介电常数ε和粘度η的任何直接或间接的因素都可能用来控制电渗,直接因素如分离电场E、粘度h、介电常数和电动势z等;间接因素有:缓冲液的组成和pH、温度、管壁性质、外加电磁场等。其中温度和缓冲液的组成通过影响粘度h、介电常数e和管壁的ξ电势等来影响电渗。外加电磁场则通过改变管壁表面的电荷数量及其分布来改变电渗。http://ng1.17img.cn/bbsfiles/images/2013/10/201310091326_470039_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310091326_470040_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310091326_470041_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310091326_470042_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310091326_470043_1705310_3.jpg
[size=3]做电泳已有两年时间了,主要开展毛细管电泳电化学发光的应用研究,在此和大家一起分享下个人的小经验吧。[/size][size=3]毛细管电泳具有高分离效率、短的分析时间、少的样品和试剂消耗等诸多优点;电化学发光是由电化学反应引起的化学发光,其不需要外加激发光源,背景信号低和线性范围宽等优点,已成为一种常用的高灵敏度检测方法。毛细管电泳分离与电化学发光检测的结合联用充分展示了其高分离效率和高灵敏度的特点。但是,因为在毛细管窄内径下进行电驱动分离,这是一个大的挑战,虽然提高样品进样体积可以提高检测的灵敏度,但是简单的增加样品体积也可能导致分离度的下度。另一方面,电化学发光检测是由电化学引发的,这样毛细管电泳的高压电场对其也会造成一定的影响,而对于采用较大内径的毛细管影响尤为突出。以下通过毛细管电泳分离和电化学发光检测两方面来聊聊个人心得。[/size][b][size=3]一、毛细管电泳分离[/size][/b][size=3]为使多种混合样品试剂得到良好分离,需要考虑较多因素;如样品溶剂的选择、进样时间和进样电压、温度、电泳高压、电泳缓冲液类型、[/size][size=3]电泳缓冲液浓度及[/size][size=3]PH、是否需要添加剂以及添加剂的选择等等吧。以下从各个方面稍作介绍:[/size][size=3][b]样品溶剂的选择[/b];通过实验发现,不同样品溶剂对分离和灵敏检测都有一定的影响,水和电泳缓冲液作样品溶剂占多数,我们实验一般用水作溶剂,有时候也用有机溶剂。实验结果偏差较大。下面图[b]Ⅰ[/b]是我实验中考察样品溶剂对实验结果的影响,选择了A和B两种样品溶剂进行实验,发现B溶剂对分离效率和检测灵敏度都有明显改善作用。图Ⅱ是我的一个师兄以前做的实验关于样品溶剂的影响考察,他选择了5种样品溶剂,结果发E溶剂效果最佳。[/size][table=100%][tr][td][b][size=3]Ⅰ[/size][/b][/td][/tr][/table][table=100%][tr][td][b][size=3]Ⅱ[/size][/b][/td][/tr][/table][size=3]对原因的分析我们认为可能是由于背景电解质溶剂的粘度改变导致进样体积的改变,另外,分析物在不同样品溶剂中的溶解度不同应该也是一个因素吧。[/size][size=3][b]进样时间和进样电压;[/b]它们对样品的进样量有直接影响,上面我已经粗略聊过毛细管进样量的大小对分离效率的影响,进样量太大,峰可能脱尾加宽,这样分离效率不高应是必然了,进样量太少的话的检测灵敏度方面又会造成影响的。[/size][size=3][b]温度;[/b]这个因素我不加具体实验方面的讨论了,因为我们用的仪器根本就没有带温控装置;温度对毛细管电泳的影响也只是书上的理论知识,抱歉了!自己实验中根据气温变化一般开空调控制到室温啦,呵呵。[/size][size=3][b]电压高压;[/b]这一点我想做毛细管电压的同志基本都知道其影响了,也是实验中必要优化的条件之一吧。[/size][size=3][b]电压缓冲液类型;[/b]它的选择也确是一个因素,不管对分离还是检测。影响也比较明显。大家看一下我的这个关于缓冲液类型考察的图吧。[/size][b][size=3][/size][/b][size=3]四种不同种类的缓冲液,得到的分离效果图。很明显啊,D缓冲液为我所需![/size][size=3][b]电泳缓冲液浓度及PH;[/b]这个因素对分离和检测也是有影响的,一般对这个条件优化时,通过考察电泳缓冲液浓度对检测灵敏度的影响,而其PH不仅考察对检测灵敏度的影响,还有一个分离效率,即分离度。[/size][size=3][b]添加剂;[/b]添加剂包括的种类繁多,可根据不同需要选择不同的添加剂,比如做蛋白质分离检测时,可能需要找一些对防止蛋白质吸附效果较好的添加剂,文献报道比较多,我实验中曾经使用过聚乙烯吡咯烷酮(PVP),效果还不错,不过实验中得注意一个细节,每次实验结束后(欲关闭仪器停止实验一段时间的话),最好用水冲洗一下毛细管。要不然毛细管容易被堵死,因为PVP感觉粘粘的,时间长了好像会凝固。呵呵!另外,为了提高分离效率,也可选择一些像离子液体,表面活性剂等添加剂的,我一个师兄用过离子液体,效果不错。[/size][b][size=3]二、电化学发光检测[/size][/b][size=3]电化学发光与毛细管电泳目前一般采用柱后检测的,以Ru(bpy) [sub]3[/sub][sup]2+[/sup]的电化学发光行为为主,为提高检测灵敏度,需要考察电化学系统的工作电极类型及处理情况、工作电极与毛细管出口端的距离、检测恒电位、柱后液的PH及浓度等等因素。[/size][size=3][b]工作电极类型;[/b]Ru(bpy) [sub]3[/sub][sup]2+[/sup]的电化学发光通常采用铂电极和金电极作工作电极,我实验中采用铂电极;实验前,为得到良好效果,电极需要进行抛光处理并超声清洗表面。这方面如果是做电化学的同志应该都很清楚了。[/size][size=3][b]电极与毛细管出口端的距离;[/b]距离太近,在电极表面附近的柱后液被电泳缓冲液冲淡而影响灵敏度,距离太远的话,电泳分离的样品到达电极表面的发生电化学反应的程度可能不高,进而也影响灵敏度。[/size][size=3][b]检测电位;[/b]它对Ru(bpy) [sub]3[/sub][sup]2+[/sup]在电极表面的氧化速率有很大影响。[/size][size=3][b]柱后液PH及浓度;[/b]它们对电化学发光也有很大影响,选择合适的PH和浓度也有实验中需要考察的一个因素。[/size][size=3]以上是关于毛细管电泳分离电化学发光检测方面个人的一些粗浅认识,与大家分享,有不当之处请各位见谅,并提出宝贵意见。谢谢!(来源于[b][color=#3b85d6][font=Verdana]plf0717[/font][/color][/b])[/size]
目前,毛细管电泳的分离模式有以下几种。 (1)毛细管区带电泳,用以分析带电溶质。为了降低电渗流和吸附现象,可将毛细管内壁涂层。 (2)毛细管凝胶电泳,在毛细管中装入单体,引发聚合形成凝胶,主要用于测定蛋白质、DNA等大分子化合物。另有将聚合物溶液等具有筛分作用的物质,如葡聚糖、聚环氧乙烷,装人毛细管中进行分析,称毛细管无胶筛分电泳,故有时将此种模式总称为毛细管筛分电泳,下分为凝胶和无胶筛分两类。 (3)胶束电动毛细管色谱,在缓冲液中加入离子型表面活性剂如十二烷基硫酸钠,形成胶束,被分离物质在水相和胶束相(准固定相)之间发生分配并随电渗流在毛细管内迁移,达到分离。本模式能用于中性物质的分离。 (4)亲和毛细管电泳,在毛细管内壁涂布或在凝胶中加入亲和配基,以亲和力的不同达到分离目的。 (5)毛细管电色谱,是将HPLC的固定相填充到毛细管中或在毛细管内壁涂布固定相,以电渗流为流动相驱动力的色谱过程,此模式兼具电泳和液相色谱的分离机制。(6)毛细管等电聚焦电泳,是通过内壁涂层使电渗流减到最小,再将样品和两性电解质混合进样,两个电极槽中分别为酸和碱,加高电压后,在毛细管内建立了pH梯度,溶质在毛细管中迁移至各自的等电点,形成明显区带,聚焦后用压力或改变检测器末端电极槽储液的pH值使溶质通过检测器。 (7)毛细管等速电泳,采用先导电解质和后继电解质,使溶质按其电泳倘度不同得以分离。 以上各模式以(1)、(2)、(3)种应用较多。 电极槽和毛细管内的溶液为缓冲液,可以加入有机溶剂作为改性剂,以及加入表面活性剂,称作运行缓冲液。运行缓冲液使用前应脱气。电泳谱中各成分的出峰时间称迁移时间。胶束电动毛细管色谱中的胶束相当于液相色谱的固定相,但它在毛细管内随电渗流迁移,故容量因子为无穷大的成分最终也随胶束流出。其他各种参数都与液相色谱所用的相同。
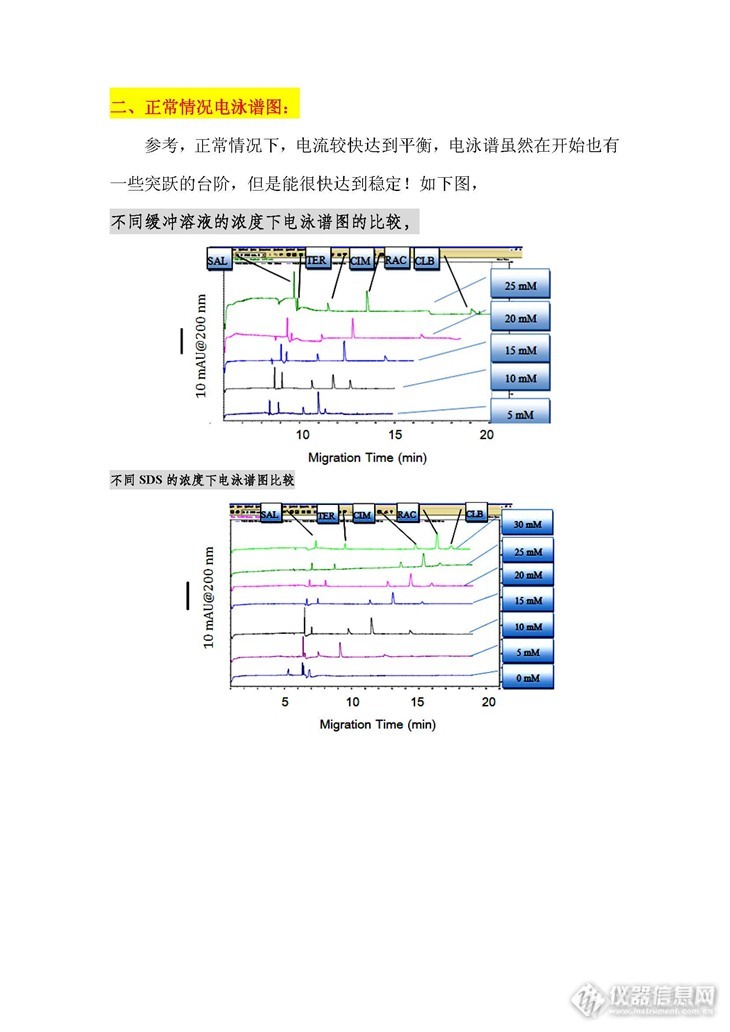
求解:毛细管电泳台阶跃式图谱是何原因? 之前的一段实验新机器,新实验,势如破竹,一直接近结题,后来文章因为要补些数据,是由同组后来的人员做的实验,一段时期,检测出现特异性台阶式峰,有时候反复冲洗毛细管或者更换都未见情况有所改善,后面因为一些特殊的原因而没有机会去验证其原因何在,如今,将这些图谱传上来,供大家讨论,恳请高手能指点迷津……毛细管电泳仪胶束电泳检测苯乙醇胺类物质,以硼砂(Na2B4O7-NaOH)为背景电解质,同时加入表面活性剂十二烷基硫酸钠(SDS)组成运行电泳介质,采用毛细管胶束电泳分离结合二极管阵列(PDA)检测器检测,检测仪器为Beckman P/ACE MDQ毛细管电泳仪(美国贝克曼公司);二极管阵列(DAD)检测器200 nm检测。http://ng1.17img.cn/bbsfiles/images/2013/10/201310081256_469726_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310081256_469727_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310081256_469729_1705310_3.jpghttp://ng1.17img.cn/bbsfiles/images/2013/10/201310081256_469730_1705310_3.jpg
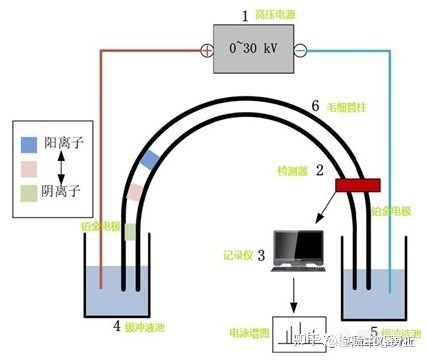
[b]一、毛细管电泳的原理简介:毛细管电泳[/b]又称“高效毛细管电泳 ”,指以高压电场为驱动力,以[b]毛细管[/b]为分离通道,依据试样中各组分[b]间淌度和分配行为[/b]上的差异而实现分离的一种分离技术。[align=center][img=,427,360]https://ng1.17img.cn/bbsfiles/images/2022/12/202212291436449476_2284_3237657_3.jpg!w427x360.jpg[/img][b]图1 毛细管电泳简易装置[/b][/align][align=left][b]二、毛细管电泳的专业术语:[/b][/align][b][/b][align=left][b]1)电泳:[/b]在电解质溶液中,[b]带电粒子[/b]在[b]电场[/b]作用下,以[b]不同的速度[/b]向其所带电荷[b]相反方向迁移[/b]的现象叫[b]电泳[/b]。[/align][align=left][b]2)电渗:[/b]在充满电解质溶液的毛细管柱中,柱内层氧化硅与溶质的界面上形成[b]双电层[/b]。当[b]高电压[/b]通过此含有缓冲溶液的[b]毛细管柱[/b]时,而此时双电层中的水合阳离子引起[b]流体整体[/b]朝负极方向[b]移动的现象叫电渗[/b]。[/align][align=left][b]3)电渗流(EOF):[/b]当高电压通过含有缓冲溶液的毛细管柱时,管内的[b]溶质[/b]向阴极或阳极[b]移动[/b],产生[b]电渗流[/b]。在柱内层氧化硅与溶质的界面上形成[b]双电层[/b]是[b]电渗流[/b]产生的原因。[/align][align=center][img=,526,231]https://ng1.17img.cn/bbsfiles/images/2022/12/202212291441064961_4781_3237657_3.jpg!w526x231.jpg[/img][b]图2 毛细管双电层与电渗流示意[/b][/align][align=left]粒子在电解质中的[b]迁移速度[/b]等于[b]电泳和电渗流(EOF)[/b]两种速度的[b]矢量和[/b]。[/align][align=left]阳离子的移动方向和电渗流一致,最先流出;中性粒子的电泳流速度为“0”,其迁移速度等于电渗流速度;阴离子的移动方向和电渗流相反,但因电渗流速度一般都大于电泳速度,它将在中性粒子之后流出,从而实现分离。[/align]
3的情况下,其内表面带负电,与缓冲液接触时形成双电层,在高压电场作用下,形成双电层一侧的缓冲液由于带正电而向负极方向移动,从而形成电渗流。同时,在缓冲溶液中,带电粒子在电场作用下,以各自不同速度向其所带电荷极性相反方向移动,形成电泳。带电粒子在毛细管缓冲液中的迁移速度等于电泳和电渗流的矢量和。各种粒子由于所带电荷多少、质量、体积以及形状不同等因素引起迁移速度不同而实现分离。 目前,毛细管电泳的分离模式有以下几种。 (1)毛细管区带电泳,用以分析带电溶质。为了降低电渗流和吸附现象,可将毛细管内壁涂层。 (2)毛细管凝胶电泳,在毛细管中装入单体,引发聚合形成凝胶,主要用于测定蛋白质、DNA等大分子化合物。另有将聚合物溶液等具有筛分作用的物质,如葡聚糖、聚环氧乙烷,装人毛细管中进行分析,称毛细管无胶筛分电泳,故有时将此种模式总称为毛细管筛分电泳,下分为凝胶和无胶筛分两类。 (3)胶束电动毛细管色谱,在缓冲液中加入离子型表面活性剂如十二烷基硫酸钠,形成胶束,被分离物质在水相和胶束相(准固定相)之间发生分配并随电渗流在毛细管内迁移,达到分离。本模式能用于中性物质的分离。 (4)亲和毛细管电泳,在毛细管内壁涂布或在凝胶中加入亲和配基,以亲和力的不同达到分离目的。 (5)毛细管电色谱,是将HPLC的固定相填充到毛细管中或在毛细管内壁涂布固定相,以电渗流为流动相驱动力的色谱过程,此模式兼具电泳和液相色谱的分离机制。 (6)毛细管等电聚焦电泳,是通过内壁涂层使电渗流减到最小,再将样品和两性电解质混合进样,两个电极槽中分别为酸和碱,加高电压后,在毛细管内建立了pH梯度,溶质在毛细管中迁移至各自的等电点,形成明显区带,聚焦后用压力或改变检测器末端电极槽储液的pH值使溶质通过检测器。 (7)毛细管等速电泳,采用先导电解质和后继电解质,使溶质按其电泳倘度不同得以分离。 以上各模式以(1)、(2)、(3)种应用较多。 电极槽和毛细管内的溶液为缓冲液,可以加入有机溶剂作为改性剂,以及加入表面活性剂,称作运行缓冲液。运行缓冲液使用前应脱气。电泳谱中各成分的出峰时间称迁移时间。胶束电动毛细管色谱中的胶束相当于液相色谱的固定相,但它在毛细管内随电渗流迁移,故容量因子为无穷大的成分最终也随胶束流出。其他各种参数都与液相色谱所用的相同。 一、对仪器的一般要求 所用的仪器为毛细管电泳仪。正文中凡采用毛细管电泳法测定的品种,其所规定的测定参数,除分析模式、检测方法(如紫外光吸收或荧光检测器的波长、电化学检测器的印加电位等)应按照该品种项下的规定外,其他参数如毛细管内径、长度、缓冲液的pH值、浓度、改性剂添加量、运行电压或电流的大小、运行的时间长短、毛细管的温度等,均可参考该品种项下规定的数据,根据所用仪器的条件和预试验的结果,进行必要的调整。 二、系统适用性试验 同高效液相色谱法项下,按各品种项下的要求,进行预试验,并调节各运行参数使达到规定指标,方可正式测定。 三、测定法 同高效液相色谱法项下。目前毛细管电泳仪的进样精度较高效液相色谱法低,定量分析时以用内标法为宜。
毛细管电泳通常使用内径为25-100 μm 的弹性(聚酰亚胺)涂层熔融石英管。标准毛细管的外径为375 μm,有些管的外径为160 μm。毛细管的特点是:容积小(一根100 cm×75 μm 管子的容积仅4.4 μL);侧面/截面积比大,因而散热快、可承受高电场(100-1000 V/cm);可使用自由溶液、凝胶等为支持介质;在溶液介质下能产生平面形状的电渗流。由此,可使毛细管电泳具备如下优点:(1) 高效 塔板数目在105-106 片/m 间,当采用CGE 时,塔板数目可达107 片/m 以上;(2) 快速 一般在十几分钟内完成分离;(3) 微量 进样所需的样品体积为nL 级;(4) 多模式 可根据需要选用不同的分离模式且仅需一台仪器;(5) 经济 实验消耗不过几毫升缓冲溶液,维持费用很低;(6) 自动 CE 是目前自动化程度较高的分离方法。毛细管电泳的缺点是:(1) 由于进样量少,因而制备能力差;(2) 由于毛细管直径小,使光路太短,用一些检测方法(如紫外吸收光谱法)时,灵敏度较低;(3) 电渗会因样品组成而变化,进而影响分离重现性。
毛细管电泳(capillary electrophoresis, CE):以高压电场为驱动力,以电解质为电泳介质,以毛细管为分离通道,样品组分依据淌度和分配行为的差异而实现分离的色谱方法。它有多种分离模式,可以采用液相色谱中的各种检测方法。CE既可以分离带电荷的溶质,也可以通过毛细管胶束电动色谱等分离模式分析中性溶质,CE的高分离效率、高检测灵敏度,样品用量极少等特点使它在生物医药样品的分析中显示出突出的优越性。 毛细管电色谱(capillary electrochromatography, CEC):毛细管电色谱结合了毛细管电泳的高柱效和高效液相色谱的高选择性,已成为近年来色谱领域研究的热点之一。是以电渗流(或电渗流结合高压输液泵)为流动相驱动力的微柱色谱法。CEC是液相色谱与毛细管电泳相结合的产物,它的分离机理包含有电泳迁移和色谱固定相的保留机理,一般而言,溶质与固定相间的相互作用对分离起主导作用。所用色谱柱为填充了HPLC填料的填充型毛细管柱和管内壁涂渍了固定相功能分子的开管毛细管柱。CEC还处在发展阶段,主要应用在药物、手性化合物和多环芳烃的分离分析。另外CEC与质谱联用既可解决LC/MS的分离效率不高的问题,又可克服CE/MS中质量流量太小的缺陷。
电泳是电解质中带电粒子在电场力作用下,以不同的速度向电荷相反方向迁移的现象。利用这种现象对化学和生物化学组分进行分离的技术称为电泳技术,可以实现电泳分离技术的仪器称为电泳仪。从20世纪30~40年代起,相继发展了多种基于抗对流载体的电泳仪(如纸电泳仪和凝胶电泳仪等)。传统电泳仪由于受到焦耳热的限制,只能在低电场强度下进行电泳操作,分离时间长,效率低。20世纪80年代初,小径毛细管被用于电泳仪,由此产生了毛细管电泳仪。毛细管电泳仪是分析科学继[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url]之后的又一重大进展,使分析科学从微升级进入到纳升级水平,不仅使单细胞乃至单分子分析成为可能,也使蛋白质和核酸等生物大分子分析有了新的转机。 1809年,发现电泳现象,即在湿粘土中插上带玻璃管的正负两个电极,加电压后,带负电荷的粘土颗粒向正极移动,正极玻璃管中原有的水层变混浊。 1909年,将胶体离子在电场中的移动现象称为电泳。用不同pH的溶液在U形管中测定了转化酶、过氧化氢酶的电泳移动和等电点。 1937年,发明U形管移动界面电泳仪。将蛋白质混合液放在两段缓冲液之间,两端施以电压进行自由溶液电泳,次将人血清提取的蛋白质混合液分离出白蛋白和α、β、γ球蛋白。 1948年,重新发展了纸电泳仪,对氨基酸的分离进行研究。 1959年,利用人工合成的凝胶作为载体,创建了聚丙烯酰胺凝胶电泳,极大地提高了电泳的分辨率,开创了近代电泳的新时代。 1967年,首先在3mm内径的毛细管中作自由溶液的区带电泳。 1974年,用200~500μm内径的毛细管作区带电泳分离。 1981年,用75μm内径的石英毛细管在3万伏高压下实现40万理论塔板数的分离效率,这一工作被认为是现代毛细管电泳发展的里程碑。随后毛细管电泳的研究急速升温,许多大科学家也开始参与研究。 1984年,使用含表面活性剂的背景电解质,开辟了毛细管电泳另一个重要分支-毛细管胶束电动色谱。 1987年,结合传统的等电聚焦电泳和凝胶电泳原理,实现了毛细管等电聚焦电泳和毛细管凝胶电泳。 1988年,实现了微量制备的可能性,提取和分离了50μmol的蛋白质、肽和寡核苷酸等。 20世纪80年代末,毛细管电泳的研究非常活跃,90年代起在技术和应用等方面都有了很大发展。 1989年,推出批毛细管电泳仪。 1990年,改进和应用了紫外检测器。 1992年,激发诱导荧光检测器诞生,毛细管电泳技术得到不断改进和更新,灵敏度和分辨率均达到预期的分离效率。