请问有哪位大侠做植酸酶活力测试的吗?小弟按照国标GBT 18634-2009方法做的,吸光度值刚开始比较低,到后来越来越高,到10次后才稳定下来!请问大家碰到过这样的问题吗?
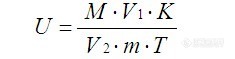
酶活力的测定方法(1)葡萄糖标准曲线的绘制取8只洗净烘干的20 mL具塞刻度试管,编号后分别吸取0.0 mL ~ 1.4 mL葡萄糖标液用蒸馏水定容至2 mL,配置成一系列不同浓度的葡萄糖溶液。充分摇匀后,向各试管中加入1.5 mLDNS溶液,摇匀后沸水浴5 min,取出冷却后用蒸馏水定容至20 mL,充分混匀。在540 nm波长下,以1号试管溶液作为空白对照,调零点,测定其它各管溶液的吸光度值并记录结果。以葡萄糖含量为横坐标,以对应的吸光度值为纵坐标,绘制出葡萄糖标准曲线。(2)滤纸酶活力的测定取4支洗净烘干的20 mL具塞刻度试管,编号后各加入0.5 mL酶液和1.5 mL 0.05 mol/L pH 4.5的柠檬酸缓冲液,向1号试管中加入1.5 mL DNS溶液以钝化酶活性,作为空白对照,比色时调零用。将4支试管同时在50℃水浴中预热5 min ~ 10 min,再各加入滤纸条50 mg(定量滤纸,约1 cm × 6 cm),50℃水浴中保温1 h后取出立即向2、3、4号试管中各加入1.5 mL DNS溶液以终止酶反应,充分摇匀后沸水浴5 min,取出冷却后用蒸馏水定容至20 mL,充分混匀。以1号试管溶液为空白对照调零点,在540 nm波长下测定2、3、4号试管液的吸光度值并记录结果。根据3个重复吸光度的平均值,在标准曲线上查出对应的葡萄糖含量,按下式计算出滤纸酶活力(U/g)。在上述条件下,每小时由底物生成1 μmol葡萄糖所需的酶量定义为一个酶活力单位(U)。 http://ng1.17img.cn/bbsfiles/images/2014/10/201410171615_518835_2770543_3.jpg 式中:U—滤纸酶活力(U/g); M—葡萄糖含量(mg);V1—酶液定容总体积(mL); K—5.56[font=宋体
1、 怎么进行酶活力单位FBG/g 和U/g 之间的换算 2、怎么测定酶活力,像果胶酶、纤维素酶、B-葡萄糖苷酶等
请教关于酶活力测定过程中加福林试剂后出现沉淀问题在用福林法测定酱油大曲酶活力过程中,在最后一步加入福林试剂后出现白色沉淀,这白色沉淀能自动慢慢沉淀下来。那位高手能指点一下这是那方面出现问题?
1.如题。GB/T23874-2009是检测饲料添加剂木聚糖酶活力的方法,现在我要检测猪饲料成品中的木聚糖酶活力,该采用什么方法?2.一般情况下猪饲料中木聚糖酶活力有多少?
那位朋友能告诉我测高温α-淀粉酶的活力(固体的)计算公式呢?
谁知道蛋白酶的活力如何进行检测?
在用连续监测法测定酶活力时,分光光度计一定要有保温装置吗?用普通的分光光度计可以测定吗
酪氨酸酶活力的测定,文献中报道的方法如下:[color=#DC143C]测定波长475nm的吸光值随时间增长直线,从直线斜率求得酶活力,消光系数按E=3700mol-1L.cm-1计算。[/color]但是我不明白通过吸光值对时间的直线斜率怎么求得酶活力?还有为什么要指定消光系数?计算过程中有什么作用?希望得到高人的指点阿问题补充:我测定时酪氨酸酶用的是mushroom tyrosinase,以酪氨酸为底物,475nm处测定吸光度是基于生成的dopachrome量。
想买一点酶制剂,但是看了1688上的厂商的酶活力的数字,不知哪个是虚标的。因为最近格力的董总揭漏了某克斯空调就是虚标,于是猜想酶制剂行业是否也有虚标?还有,作为消费者如何判断酶制剂的质量好坏?本人没有太多的专业知识。是不是外国的酶制剂比较质量可靠些?但是好像比国产贵很多。谢谢。
如题:急求青霉素酶及其活力测定有哪些品种?谢谢
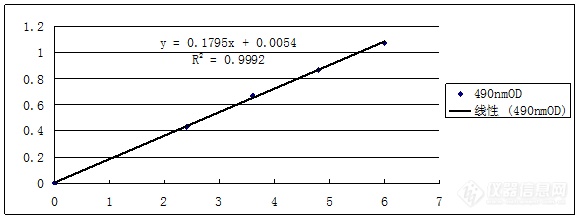
[align=center]几种酶的酶活力检测方法及结果分析[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]安评中心:王涛[/align]大蒜属百合科葱属植物蒜的鳞茎,其风味独特,营养丰富,用途十分广泛。在生产上,大蒜不能通过杂交制种,只能采用其鳞茎繁殖,由于长时间的营养繁殖造成植株体内病毒积累,使得蒜头变小,品种退化,产量降低,大大降低了大蒜的商品价值。大蒜在长期的生长过程中,由于受到病原菌的植物的附着与侵入,会产生自身的抗性机制,其中的保护性反应是复杂的新陈代谢的结果,其生理反应是通过酶催化活动来实现的。这些酶包括抗病性酶超氧岐化酶SOD,多酚氧化酶PPO和过氧化物酶POD等,以及感病性酶纤维素酶和果胶酶。本文主要描述了大蒜苗中的SOD,PPO,POD,纤维素酶和果胶酶的酶活力检测方法,并从酶活的角度分析,大蒜茎尖脱毒技术可以有效提高SOD,PPO,POD等与植物抗病性有关的酶的活性,而与植物感病性有关的酶的活性如纤维素酶和果胶酶的活性有所降低,其中脱毒苗中的SOD,PPO和POD的活性分别比未脱毒苗相应地高出93.37 U/g,19.48 U/gmin和382.55 U/gmin,纤维素酶和果胶酶的活性则分别低出18.29 U/gmin和38.08 U/gmin。这就从植物生理的角度上验证了脱毒大蒜苗抗病和高产的原因。[b]1实验药品及仪器1.1缓冲液的配置[/b]1.1.1磷酸缓冲液的配置首先分别配置母液A、B,再根据质量分数分别取对应的母液,调pH即可。母液A:0.2 mol/L Na[sub]2[/sub]HPO[sub]4[/sub]溶液:称量71.63 g Na[sub]2[/sub]HPO[sub]4[/sub]12H[sub]2[/sub]O,定容至1 L。母液B:0.2 mol/L NaH[sub]2[/sub]PO[sub]4[/sub]溶液:称量31.21 g NaH[sub]2[/sub]PO[sub]4[/sub]2H[sub]2[/sub]O,定容至1 L。0.05 mol/L磷酸缓冲液(pH7.8,内含1%PVP):22.875 mL A +2.125 mL l B+1 g聚乙烯吡咯烷酮(PVP),稀释至100 mL。0.05 mol/L磷酸缓冲液(pH6.0):3.075 mL A + 21.925 mL B,稀释至100 mL。0.1 mol/L磷酸缓冲液(pH6.0):12.3 mL A + 87.7 mL B,稀释至200 mL。1.1.2醋酸缓冲液的配置同磷酸缓冲液一样,先配置母液。母液A:0.2 mol/L HAc溶液:吸取11.5 mL 醋酸溶液,定容至1 L。母液B:0.2 mol/L NaAc溶液:称量27.2 g 三水合乙酸钠,定容至1 L。0.2 mol/L (pH4.6) 醋酸缓冲液:51 mL A + 49 mL B混合均匀即可。0.2 mol/L(pH4.8)醋酸缓冲液:40 mL A + 60 mL B混合均匀即可。1.1.3其他试剂的配置100 umol/L EDTA-Na[sub]2[/sub]溶液:称取0.03721 g EDTA-Na[sub]2[/sub],用磷酸缓冲液定容至1 L。20 umol/L核黄素:称取0.00753 g核黄素定容至1 L。130 mmol/L甲硫氨酸(Met):称取1.9399 gMet,用磷酸缓冲液定容至100mL。750 umol/L氮蓝四唑(NBT):称取0.06133 g NBT,用磷酸缓冲液定容至100 mL。0.1 mol/L邻苯二酚:称取1.1011 g邻苯二酚定容至100 mL。20%三氯乙酸(TCA):称取20 g TCA定容至100 mL。二氧甲基酚即愈创木酚30%H[sub]2[/sub]O[sub]2 [/sub]3,5-二硝基水杨酸显色剂(DNS显色剂):称取2.5 g DNS溶于水中,加入2.5 g氢氧化钠、50 g酒石酸钾钠和100 mL水,加热溶解后再加入0.5 g苯酚和0.125 g无水亚硫酸钠,待全部溶解后冷却,定容至500 mL,贮于棕色瓶中,放置一周后使用,用之前过滤[sup][/sup]。葡萄糖标准液:称取0.54 g葡萄糖定容至500 mL。纤维素底物(CMC):称取0.625 g羧甲基纤维素钠溶于0.2 mol/L (pH 4.6) 醋酸缓冲液中,定容至100 mL。果胶底物:称取0.5 g果胶溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL,放置冰箱内冷藏。D-半乳糖醛酸标准液:称取0.1 g D-半乳糖醛酸溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL。[b]1.2主要实验仪器[/b]紫外分光光度计 上海精密科学仪器有限公司可见光分光光度计 上海第三分析仪器厂TCL-16C型台式离心机 上海安亭科学仪器厂超净工作台 上海博迅实业有限公司医疗设备厂电热恒温水浴锅 上海跃进医疗器材厂灭菌器 上海申安医疗器械厂海尔冰箱 青岛海尔集团电子分析天平 北京赛多莉斯天平有限公司数显pH计;恒温光照培养箱;制冰机;计时器;[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url];试剂瓶;容量瓶。[b]2实验方法2.1材料[/b]大蒜脱毒试管苗:采用大蒜茎尖组织脱毒技术,经过3次继代培养所获得的生长健壮脱毒苗。大蒜苗植株:将市售山东金乡大蒜,分瓣去皮后,栽种于花盆中,日光照射,生长两个月之后所得植株。[b]2.2方法[/b]共测两组植株(第一组为大蒜脱毒苗,第二组为大蒜苗植株即未脱毒苗)的五种酶的酶活,这五种酶分别是超氧化物歧化酶、多酚氧化酶、过氧化物酶、纤维素酶和果胶酶,最后将两组酶活数据分别做对应比较。同一植株做三次平行实验,取平均值。[b]3酶活测定3.1超氧物歧化酶(SOD)活力的测定[/b]本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性的大小。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生超氧阴离子自由基,这种自由基可将氮蓝四唑还原为蓝色的甲腙。后者在560 nm处有最大吸收,而SOD可清除超氧阴离子自由基,从而抑制了甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。3.1.1粗酶液的提取取叶片于预冷的研钵中,加入1 mL 0.05 mol/L磷酸缓冲液(pH 7.8,内含1%PVP)在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心10 min,取上清液,冷藏待用。3.1.2显色反应取7只5 mL透明度好的试管,用记号笔编号,1为空白管,2~4为测定管,5~7为对照管。各管按照表3-1依次添加试剂溶液,混匀后,将空白管置于暗处,其它各管置于4000 lx日光灯下反应20 min。[align=center]表1 测定SOD活性试剂添加量[/align][align=center]Table 1 The add content of reagent to SOD[/align][table][tr][td][align=center]试剂[/align][/td][td][align=center]用量/ mL[/align][/td][td][align=center]备注[/align][/td][/tr][tr][td][align=center]0.05 mol/L磷酸缓冲液[/align][/td][td][align=center]1.5[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]130 mmol/L Met[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]750 umol/L NBT[/align][/td][td][align=center]0.3[/align][/td][td=1,2][align=center]总体积为3.0 ml,对照管与空白管加入缓冲液代替酶液[/align][/td][/tr][tr][td][align=center]100 umol/L EDTA-Na[sub]2[/sub][/align][/td][td][align=center]0.3[/align][/td][/tr][tr][td][align=center]20 umol/L 核黄素[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]酶液[/align][/td][td][align=center]0.05[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]蒸馏水[/align][/td][td][align=center]0.25[/align][/td][td][align=center] [/align][/td][/tr][/table]3.1.3活力测定与计算以暗处管为空白,分别测定其它各管在560 nm波长下的吸光度(OD)。以抑制NBT光化还原的50%作为一个酶活性单位(U)表示。按下式计算SOD的总活性:SOD总活性(U/g)=(A[sub]o[/sub]-A[sub]s[/sub])*V[sub]t[/sub]/ A[sub]o[/sub]*0.5*W*V[sub]1 [/sub](公式3-1)式中:SOD总活性以每克鲜质量的酶单位表示(U/g);A[sub]o[/sub]-照光对照管的吸光度;A[sub]s[/sub]-样品管的吸光度;V[sub]t[/sub]-样品液总体积(mL);V[sub]1[/sub]-测定时样品液用量(mL);W-样品鲜质量(g)。[b]3.2多酚氧化酶(PPO)活力的测定[/b]多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌,其活性可以用比色法测量产物的形成,邻苯二酚是其常用的底物。3.2.1粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.05 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.2.2活力测定与计算取2支试管,一支为空白对照管,对照管中加入1 mL酶液+3 mL 0.05 mol/L(pH 6.0)磷酸缓冲液;另一支为测定管,测定管中加入1 mL酶液+1 mL 0.1 mol/L邻苯二酚+2 mL 0.05 mol/L(pH 6.0)磷酸缓冲液。然后在37 ℃水浴保温10 min,立即冰浴,冷却下来之后,各管加入2 mL 20% TCA终止反应。立即在410 nm波长下测定吸光度,每min测一次,共测3 min。以每min内吸光度变化0.01为酶活性单位(U)。PPO活性(U/gmin)=ΔA*V[sub]0[/sub]/0.01W*V[sub]1[/sub]*t [sub] [/sub](公式3-2)式中:ΔA = A[sub]s[/sub]-A[sub]o[/sub];A[sub]o[/sub]-对照管的吸光度;A[sub]s[/sub]-测定管的吸光度;V[sub]0[/sub]-酶液提取总量(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.3过氧化物酶(POD)活力的测定[/b]选用愈创木酚法,即在过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,可用分光光度计测量生成物的含量。3.3.1反应混合液的制备量取50 mL 0.1 mol/L磷酸缓冲液(pH6.0),加入28 uL二氧甲基酚,加热搅拌至溶解,冷却后再加入19 uL 30% H[sub]2[/sub]O[sub]2[/sub],混合均匀保存于冰箱中。3.3.2粗酶液的提取取叶片于预冷的研钵中,加入5 mL 0.1 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.3.3活力测定与计算取2只比色杯,一只加入2 mL反应混合液和1 mL 0.1 mol/L磷酸缓冲液(pH 6.0),作为校零对照;另一只加入2 mL反应混合液和1 mL酶液,立即开启秒表计时器,在470 nm波长下测定吸光度,每隔1 min读数一次。以每min吸光度变化0.01为1个过氧化物酶活性单位(U)。POD活性=△A*Vt /0.01W* V[sub]1[/sub]*t (公式3-3)式中:△A-反应时间内吸光度的变化量;V[sub]t[/sub]-酶液总体积(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.4纤维素酶活力的测定[/b]选用DNS法测定纤维素酶活力。DNS法测定的是纤维素酶对羧甲基纤维素钠(CMC)的糖化能力,其水解产物如纤维二糖和葡萄糖是还原糖,可以将DNS还原成棕红色的氨基化合物,在一定浓度范围内,还原糖的量与该物质溶液颜色的深浅成比例,因此可以用分光光度计进行测定,该方法可表示纤维素酶的总活力。3.4.1绘制葡萄糖标准曲线取5支试管,用记号笔编号后,按表3-2量取试剂,每管分别加入1 mL 2 mol/L氢氧化钠和2 mL DNS显色液,摇匀后置于沸水浴中加热5 min,流水冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于490 nm波长处测吸光度,绘制标准曲线。[align=center]表2葡萄糖标准曲线制作表[/align][align=center]Table 2 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td]标准葡萄糖溶液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.6醋酸钠缓冲溶液(mL)[/td][td][align=center]试管中葡萄糖量(umol)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]4.6[/align][/td][td][align=center]2.4[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.6[/align][/td][td][align=center]4.4[/align][/td][td][align=center]3.6[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.8[/align][/td][td][align=center]4.2[/align][/td][td][align=center]4.8[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]1.0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]6.0[/align][/td][/tr][/table]3.4.2粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.2 mol/L醋酸缓冲液(pH 4.6),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,装入离心管中再离心10 min,定容至10 mL,冷藏待用。3.4.3活力测定与计算取3支试管,一支作为空白对照,另2支作为平行样品。样品管中加入50℃预热的酶液1 mL,底物溶液(CMC)4 mL;空白对照管加4 mL底物溶液(CMC)。3支试管放入50℃水浴中,5 min后取出,立即加入1 mL 2mol/L NaOH溶液和2 mL DNS显色剂。摇匀后,空白对照管中加入1 mL酶液,立即将3支试管放入沸水浴中,反应5 min后取出,流水冷却,定容至10 mL,在490 nm波长处测吸光度。用测得的OD值在标准曲线上差得相应的葡萄糖的量,代入下面公式计算活力。以每min催化纤维素水解成1 umol葡萄糖的酶量表示酶活大小(U)。纤维素酶活性(U/gmin)=葡萄糖量/5*E* W (公式3-4)式中:5为反应时间(min);Ew为1 mL酶液中含有的酶量(g);W-样品鲜重(g)。[b]3.5果胶酶活力的测定[/b]选用DNS法测定果胶酶活力。该方法是利用果胶酶在一定温度,时间和条件下水解果胶,释放出还原性D-半乳糖醛酸,与3,5-二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。在一定范围内,水解生成D-半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。3.5.1绘制D-半乳糖醛酸标准曲线取6支试管,编号后依次按照表3-3加入试剂,摇匀后置于沸水浴中反应5 min后,冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于540 nm波长处测吸光度,绘制标准曲线。[align=center]表3[b] [/b]D-半乳糖醛酸标准曲线的绘制[/align][align=center]Table 3 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td]D-半乳糖醛酸标准液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.8醋酸缓冲液(mL)[/td][td][align=center]DNS显色液(mL)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.2[/align][/td][td][align=center]3.8[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]3.4[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]0.8[/align][/td][td][align=center]3.2[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]6[/align][/td][td][align=center]1.0[/align][/td][td][align=center]3.0[/align][/td][td][align=center]2.5[/align][/td][/tr][/table]3.5.2粗酶液的提取与提取纤维素酶的方法相同。3.5.3活力测定与计算取5支试管,用记号笔编号。1、2号管为样品管,分别加入1 mL果胶底物,在48℃水浴中预热5 min,再分别加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),之后,1号管中加入1 mL酶液,立即摇匀,在48℃水浴中反应30 min;2号管中加入1 mL酶液,立即放入沸水浴中反应5 min,冷却。分别取1、2管中容液各2 mL于3、4管中,并加2 mL水,2.5 mL DNS显色剂,混匀,沸水浴反应5 min,流水冷却。5号管加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),2.5 mL DNS显色剂,静置20 min后以5号管为对照校零,在540 nm波长处测3、4管的吸光度;用测得的(OD[sub]3[/sub]-OD[sub]4[/sub])值在标准曲线上查得相应的D-半乳糖醛酸的量,代入下面公式计算活力。以每min酶作用生成的D-半乳糖醛酸的量为一个酶活单位(U)。果胶酶活性(U/ gmin)=Y*3*N/t* W [sub] [/sub](公式3-5)式中:Y-酶作用生成的D-半乳糖醛酸的量;3-测酶活取了反应液的1/3;N-样品稀释倍数;W-样品鲜重(g);t-反应时间(min)[b]4标准曲线的绘制4.1葡萄糖标准曲线[/b]依照3.4.1步骤,最后测得各个试管中的吸光度依次为0,0.432,0.672,0.865,1.073。按照表4,以葡萄糖浓度为横坐标,490 nm处的OD值为纵坐标,绘制葡萄糖标准曲线(如图1)。[align=center]表4葡萄糖标准曲线[/align][align=center]Table 4 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]葡萄糖浓度umol[/align][/td][td][align=center]0[/align][/td][td][align=center]2.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]4.8[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]490 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.432[/align][/td][td][align=center]0.672[/align][/td][td][align=center]0.865[/align][/td][td][align=center]1.073[/align][/td][/tr][/table][align=center][img=,580,219]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010439441511_1108_2904018_3.png!w580x219.jpg[/img] [/align][align=center]图1葡萄糖标准曲线[/align][align=center]Figure 1 Standard curve of Glucose[/align][b]4.2 D-半乳糖醛酸标准曲线[/b]依照3.5.1步骤,最后测得各个试管中的吸光度依次为0,0.211,0.384,0.561,0.743,0.965。按照表5,以D-半乳糖醛酸的量为横坐标,540 nm处的OD值为纵坐标,绘制D-半乳糖醛酸标准曲线(如图2)。[align=center]表5 D-半乳糖醛酸标准曲线[/align][align=center]Table 5 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]D-半乳糖醛酸的量mL[/align][/td][td][align=center]0[/align][/td][td][align=center]0.2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]0.8[/align][/td][td][align=center]1.0[/align][/td][/tr][tr][td][align=center]540 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.211[/align][/td][td][align=center]0.384[/align][/td][td][align=center]0.561[/align][/td][td][align=center]0.743[/align][/td][td][align=center]0.965[/align][/td][/tr][/table][align=center][img=,579,188]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440011153_826_2904018_3.png!w579x188.jpg[/img] [/align][align=center]图2 D-半乳糖醛酸标准曲线[/align][align=center]Figure 2 Standard curve of D-Galacturonic acid[/align][b]5结果与分析[/b]将所测得的OD值,根据各个公式计算出SOD,PPO,POD,纤维素酶和果胶酶的酶活力,结果如表6所示。再将大蒜脱毒试管苗与未脱毒苗酶活测定结果做成柱状图进行比较,如图3所示。可以看出,脱毒试管苗中的SOD,PPO,POD的活性均高于未脱毒试管苗的对应酶的活性,而这三种酶都与植物的抗病性有关,说明在抗病性上脱毒试管苗强于未脱毒试管苗;纤维素酶和果胶酶的活性则是未脱毒苗比脱毒试管苗高。此外,作为植物抗氧化系统第一道防线的SOD,其活性大小在脱毒试管苗与未脱毒苗中相差93.37 U/g,前者比后者高出约1.5倍,说明经脱毒的试管苗抵御活性氧侵害的能力更高。PPO能催化木质素及其他酚类氧化物的形成,从而构成保护性屏蔽,抵抗抗病菌的入侵,也可以通过形成醌类物质直接发挥抗病作用。脱毒试管苗的PPO活性比未脱毒苗的PPO活性高出19.48 U/gmin,约2.45倍。说明脱毒苗在抵抗抗病菌的入侵方面,能力更强。在植物对病原菌侵染的防卫反应中,POD和SOD都有着极其重要的作用,SOD能有效的清除机体内的超氧自由基,它可以把有害的超氧自由基转化为过氧化氢,而POD可以将过氧化氢分解为完全无害的水,在脱毒试管苗与未脱毒苗中POD的活性均比较大,两者相差382.55 U/gmin,约1.7倍,说明经脱毒的试管苗可以更有效的抵御过氧化氢的毒害。而纤维素酶和果胶酶均与植物的感病性有关,其活性则是未脱毒苗比脱毒试管苗高,分别高出18.29 U/gmin和38.08 U/gmin,约2.4倍和1.2倍,说明脱毒苗的感病几率有所降低。POD不仅可以将过氧化氢分解为完全无害的水,而且还具有多种生理功能,如从叶绿体和细胞质中去除过氧化氢、氧化有毒化合物、合成细胞壁、对各种胁迫的应急、吲哚-3-乙酸的调控、乙烯的生物合成等,还参与了植物酚类的聚合和氧化以及木质素和植保素的合成。因此POD是植物体中活性较高的一种酶,从图3中也可以看出,POD的活性在五种酶中最高。[align=center]表6 大蒜脱毒试管苗与未脱毒苗酶活测定结果[/align][align=center]Table 6 Enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align][table][tr][td][align=center]酶总活性[/align][/td][td][align=center]SOD[/align][align=center](U/g)[/align][/td][td][align=center]PPO[/align][align=center](U/gmin)[/align][/td][td][align=center]POD[/align][align=center](U/gmin)[/align][/td][td][align=center]纤维素酶[/align][align=center](U/gmin)[/align][/td][td][align=center]果胶酶[/align][align=center](U/gmin)[/align][/td][/tr][tr][td][align=center]脱毒苗[/align][/td][td][align=center]157.46[/align][/td][td][align=center]27.43[/align][/td][td][align=center]610.95[/align][/td][td][align=center]7.77[/align][/td][td][align=center]31.97[/align][/td][/tr][tr][td][align=center]未脱毒苗[/align][/td][td][align=center]64.09[/align][/td][td][align=center]7.95[/align][/td][td][align=center]228.40[/align][/td][td][align=center]26.06[/align][/td][td][align=center]70.05[/align][/td][/tr][/table][align=center][img=,564,289]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440223303_2970_2904018_3.png!w564x289.jpg[/img] [/align][align=center]图3大蒜脱毒试管苗与未脱毒苗酶活测定结果比较[/align][align=center]Table 3 Comparison of enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align]
我用SB/T 10317-1999标准中的甲醛法测定,不知道结果具体是几个酶活力单位代表小曲良好?
我用SB/T 10317-1999标准中的甲醛法测定,不知道结果具体是几个酶活力单位代表小曲良好?
我用SB/T 10317-1999标准中的甲醛法测定,不知道结果具体是几个酶活力单位代表小曲良好?
[align=center]几种酶的酶活力检测方法及结果分析[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]安评中心:王涛[/align]大蒜属百合科葱属植物蒜的鳞茎,其风味独特,营养丰富,用途十分广泛。在生产上,大蒜不能通过杂交制种,只能采用其鳞茎繁殖,由于长时间的营养繁殖造成植株体内病毒积累,使得蒜头变小,品种退化,产量降低,大大降低了大蒜的商品价值。大蒜在长期的生长过程中,由于受到病原菌的植物的附着与侵入,会产生自身的抗性机制,其中的保护性反应是复杂的新陈代谢的结果,其生理反应是通过酶催化活动来实现的。这些酶包括抗病性酶超氧岐化酶SOD,多酚氧化酶PPO和过氧化物酶POD等,以及感病性酶纤维素酶和果胶酶。本文主要描述了大蒜苗中的SOD,PPO,POD,纤维素酶和果胶酶的酶活力检测方法,并从酶活的角度分析,大蒜茎尖脱毒技术可以有效提高SOD,PPO,POD等与植物抗病性有关的酶的活性,而与植物感病性有关的酶的活性如纤维素酶和果胶酶的活性有所降低,其中脱毒苗中的SOD,PPO和POD的活性分别比未脱毒苗相应地高出93.37 U/g,19.48 U/gmin和382.55 U/gmin,纤维素酶和果胶酶的活性则分别低出18.29 U/gmin和38.08 U/gmin。这就从植物生理的角度上验证了脱毒大蒜苗抗病和高产的原因。[b]1实验药品及仪器1.1缓冲液的配置[/b]1.1.1磷酸缓冲液的配置首先分别配置母液A、B,再根据质量分数分别取对应的母液,调pH即可。母液A:0.2 mol/L Na[sub]2[/sub]HPO[sub]4[/sub]溶液:称量71.63 g Na[sub]2[/sub]HPO[sub]4[/sub]12H[sub]2[/sub]O,定容至1 L。母液B:0.2 mol/L NaH[sub]2[/sub]PO[sub]4[/sub]溶液:称量31.21 g NaH[sub]2[/sub]PO[sub]4[/sub]2H[sub]2[/sub]O,定容至1 L。0.05 mol/L磷酸缓冲液(pH7.8,内含1%PVP):22.875 mL A +2.125 mL l B+1 g聚乙烯吡咯烷酮(PVP),稀释至100 mL。0.05 mol/L磷酸缓冲液(pH6.0):3.075 mL A + 21.925 mL B,稀释至100 mL。0.1 mol/L磷酸缓冲液(pH6.0):12.3 mL A + 87.7 mL B,稀释至200 mL。1.1.2醋酸缓冲液的配置同磷酸缓冲液一样,先配置母液。母液A:0.2 mol/L HAc溶液:吸取11.5 mL 醋酸溶液,定容至1 L。母液B:0.2 mol/L NaAc溶液:称量27.2 g 三水合乙酸钠,定容至1 L。0.2 mol/L (pH4.6) 醋酸缓冲液:51 mL A + 49 mL B混合均匀即可。0.2 mol/L(pH4.8)醋酸缓冲液:40 mL A + 60 mL B混合均匀即可。1.1.3其他试剂的配置100 umol/L EDTA-Na[sub]2[/sub]溶液:称取0.03721 g EDTA-Na[sub]2[/sub],用磷酸缓冲液定容至1 L。20 umol/L核黄素:称取0.00753 g核黄素定容至1 L。130 mmol/L甲硫氨酸(Met):称取1.9399 gMet,用磷酸缓冲液定容至100mL。750 umol/L氮蓝四唑(NBT):称取0.06133 g NBT,用磷酸缓冲液定容至100 mL。0.1 mol/L邻苯二酚:称取1.1011 g邻苯二酚定容至100 mL。20%三氯乙酸(TCA):称取20 g TCA定容至100 mL。二氧甲基酚即愈创木酚30%H[sub]2[/sub]O[sub]2 [/sub]3,5-二硝基水杨酸显色剂(DNS显色剂):称取2.5 g DNS溶于水中,加入2.5 g氢氧化钠、50 g酒石酸钾钠和100 mL水,加热溶解后再加入0.5 g苯酚和0.125 g无水亚硫酸钠,待全部溶解后冷却,定容至500 mL,贮于棕色瓶中,放置一周后使用,用之前过滤[sup][/sup]。葡萄糖标准液:称取0.54 g葡萄糖定容至500 mL。纤维素底物(CMC):称取0.625 g羧甲基纤维素钠溶于0.2 mol/L (pH 4.6) 醋酸缓冲液中,定容至100 mL。果胶底物:称取0.5 g果胶溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL,放置冰箱内冷藏。D-半乳糖醛酸标准液:称取0.1 g D-半乳糖醛酸溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL。[b]1.2主要实验仪器[/b]紫外分光光度计 上海精密科学仪器有限公司可见光分光光度计 上海第三分析仪器厂TCL-16C型台式离心机 上海安亭科学仪器厂超净工作台 上海博迅实业有限公司医疗设备厂电热恒温水浴锅 上海跃进医疗器材厂灭菌器 上海申安医疗器械厂海尔冰箱 青岛海尔集团电子分析天平 北京赛多莉斯天平有限公司数显pH计;恒温光照培养箱;制冰机;计时器;[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url];试剂瓶;容量瓶。[b]2实验方法2.1材料[/b]大蒜脱毒试管苗:采用大蒜茎尖组织脱毒技术,经过3次继代培养所获得的生长健壮脱毒苗。大蒜苗植株:将市售山东金乡大蒜,分瓣去皮后,栽种于花盆中,日光照射,生长两个月之后所得植株。[b]2.2方法[/b]共测两组植株(第一组为大蒜脱毒苗,第二组为大蒜苗植株即未脱毒苗)的五种酶的酶活,这五种酶分别是超氧化物歧化酶、多酚氧化酶、过氧化物酶、纤维素酶和果胶酶,最后将两组酶活数据分别做对应比较。同一植株做三次平行实验,取平均值。[b]3酶活测定3.1超氧物歧化酶(SOD)活力的测定[/b]本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性的大小。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生超氧阴离子自由基,这种自由基可将氮蓝四唑还原为蓝色的甲腙。后者在560 nm处有最大吸收,而SOD可清除超氧阴离子自由基,从而抑制了甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。3.1.1粗酶液的提取取叶片于预冷的研钵中,加入1 mL 0.05 mol/L磷酸缓冲液(pH 7.8,内含1%PVP)在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心10 min,取上清液,冷藏待用。3.1.2显色反应取7只5 mL透明度好的试管,用记号笔编号,1为空白管,2~4为测定管,5~7为对照管。各管按照表3-1依次添加试剂溶液,混匀后,将空白管置于暗处,其它各管置于4000 lx日光灯下反应20 min。[align=center]表1 测定SOD活性试剂添加量[/align][align=center]Table 1 The add content of reagent to SOD[/align][table][tr][td][align=center]试剂[/align][/td][td][align=center]用量/ mL[/align][/td][td][align=center]备注[/align][/td][/tr][tr][td][align=center]0.05 mol/L磷酸缓冲液[/align][/td][td][align=center]1.5[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]130 mmol/L Met[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]750 umol/L NBT[/align][/td][td][align=center]0.3[/align][/td][td=1,2][align=center]总体积为3.0 ml,对照管与空白管加入缓冲液代替酶液[/align][/td][/tr][tr][td][align=center]100 umol/L EDTA-Na[sub]2[/sub][/align][/td][td][align=center]0.3[/align][/td][/tr][tr][td][align=center]20 umol/L 核黄素[/align][/td][td][align=center]0.3[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]酶液[/align][/td][td][align=center]0.05[/align][/td][td][align=center] [/align][/td][/tr][tr][td][align=center]蒸馏水[/align][/td][td][align=center]0.25[/align][/td][td][align=center] [/align][/td][/tr][/table]3.1.3活力测定与计算以暗处管为空白,分别测定其它各管在560 nm波长下的吸光度(OD)。以抑制NBT光化还原的50%作为一个酶活性单位(U)表示。按下式计算SOD的总活性:SOD总活性(U/g)=(A[sub]o[/sub]-A[sub]s[/sub])*V[sub]t[/sub]/ A[sub]o[/sub]*0.5*W*V[sub]1 [/sub](公式3-1)式中:SOD总活性以每克鲜质量的酶单位表示(U/g);A[sub]o[/sub]-照光对照管的吸光度;A[sub]s[/sub]-样品管的吸光度;V[sub]t[/sub]-样品液总体积(mL);V[sub]1[/sub]-测定时样品液用量(mL);W-样品鲜质量(g)。[b]3.2多酚氧化酶(PPO)活力的测定[/b]多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌,其活性可以用比色法测量产物的形成,邻苯二酚是其常用的底物。3.2.1粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.05 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.2.2活力测定与计算取2支试管,一支为空白对照管,对照管中加入1 mL酶液+3 mL 0.05 mol/L(pH 6.0)磷酸缓冲液;另一支为测定管,测定管中加入1 mL酶液+1 mL 0.1 mol/L邻苯二酚+2 mL 0.05 mol/L(pH 6.0)磷酸缓冲液。然后在37 ℃水浴保温10 min,立即冰浴,冷却下来之后,各管加入2 mL 20% TCA终止反应。立即在410 nm波长下测定吸光度,每min测一次,共测3 min。以每min内吸光度变化0.01为酶活性单位(U)。PPO活性(U/gmin)=ΔA*V[sub]0[/sub]/0.01W*V[sub]1[/sub]*t [sub] [/sub](公式3-2)式中:ΔA = A[sub]s[/sub]-A[sub]o[/sub];A[sub]o[/sub]-对照管的吸光度;A[sub]s[/sub]-测定管的吸光度;V[sub]0[/sub]-酶液提取总量(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.3过氧化物酶(POD)活力的测定[/b]选用愈创木酚法,即在过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,可用分光光度计测量生成物的含量。3.3.1反应混合液的制备量取50 mL 0.1 mol/L磷酸缓冲液(pH6.0),加入28 uL二氧甲基酚,加热搅拌至溶解,冷却后再加入19 uL 30% H[sub]2[/sub]O[sub]2[/sub],混合均匀保存于冰箱中。3.3.2粗酶液的提取取叶片于预冷的研钵中,加入5 mL 0.1 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。3.3.3活力测定与计算取2只比色杯,一只加入2 mL反应混合液和1 mL 0.1 mol/L磷酸缓冲液(pH 6.0),作为校零对照;另一只加入2 mL反应混合液和1 mL酶液,立即开启秒表计时器,在470 nm波长下测定吸光度,每隔1 min读数一次。以每min吸光度变化0.01为1个过氧化物酶活性单位(U)。POD活性=△A*Vt /0.01W* V[sub]1[/sub]*t (公式3-3)式中:△A-反应时间内吸光度的变化量;V[sub]t[/sub]-酶液总体积(mL);V[sub]1[/sub]-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。[b]3.4纤维素酶活力的测定[/b]选用DNS法测定纤维素酶活力。DNS法测定的是纤维素酶对羧甲基纤维素钠(CMC)的糖化能力,其水解产物如纤维二糖和葡萄糖是还原糖,可以将DNS还原成棕红色的氨基化合物,在一定浓度范围内,还原糖的量与该物质溶液颜色的深浅成比例,因此可以用分光光度计进行测定,该方法可表示纤维素酶的总活力。3.4.1绘制葡萄糖标准曲线取5支试管,用记号笔编号后,按表3-2量取试剂,每管分别加入1 mL 2 mol/L氢氧化钠和2 mL DNS显色液,摇匀后置于沸水浴中加热5 min,流水冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于490 nm波长处测吸光度,绘制标准曲线。[align=center]表2葡萄糖标准曲线制作表[/align][align=center]Table 2 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td]标准葡萄糖溶液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.6醋酸钠缓冲溶液(mL)[/td][td][align=center]试管中葡萄糖量(umol)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]5.0[/align][/td][td][align=center]0[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]4.6[/align][/td][td][align=center]2.4[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.6[/align][/td][td][align=center]4.4[/align][/td][td][align=center]3.6[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.8[/align][/td][td][align=center]4.2[/align][/td][td][align=center]4.8[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]1.0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]6.0[/align][/td][/tr][/table]3.4.2粗酶液的提取取叶片于预冷的研钵中,加入2 mL 0.2 mol/L醋酸缓冲液(pH 4.6),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,装入离心管中再离心10 min,定容至10 mL,冷藏待用。3.4.3活力测定与计算取3支试管,一支作为空白对照,另2支作为平行样品。样品管中加入50℃预热的酶液1 mL,底物溶液(CMC)4 mL;空白对照管加4 mL底物溶液(CMC)。3支试管放入50℃水浴中,5 min后取出,立即加入1 mL 2mol/L NaOH溶液和2 mL DNS显色剂。摇匀后,空白对照管中加入1 mL酶液,立即将3支试管放入沸水浴中,反应5 min后取出,流水冷却,定容至10 mL,在490 nm波长处测吸光度。用测得的OD值在标准曲线上差得相应的葡萄糖的量,代入下面公式计算活力。以每min催化纤维素水解成1 umol葡萄糖的酶量表示酶活大小(U)。纤维素酶活性(U/gmin)=葡萄糖量/5*E* W (公式3-4)式中:5为反应时间(min);Ew为1 mL酶液中含有的酶量(g);W-样品鲜重(g)。[b]3.5果胶酶活力的测定[/b]选用DNS法测定果胶酶活力。该方法是利用果胶酶在一定温度,时间和条件下水解果胶,释放出还原性D-半乳糖醛酸,与3,5-二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。在一定范围内,水解生成D-半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。3.5.1绘制D-半乳糖醛酸标准曲线取6支试管,编号后依次按照表3-3加入试剂,摇匀后置于沸水浴中反应5 min后,冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于540 nm波长处测吸光度,绘制标准曲线。[align=center]表3[b] [/b]D-半乳糖醛酸标准曲线的绘制[/align][align=center]Table 3 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td]D-半乳糖醛酸标准液(mL)[/td][td]0.2 mol.L[sup]-1[/sup],pH4.8醋酸缓冲液(mL)[/td][td][align=center]DNS显色液(mL)[/align][/td][/tr][tr][td][align=center]1[/align][/td][td][align=center]0[/align][/td][td][align=center]4.0[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]2[/align][/td][td][align=center]0.2[/align][/td][td][align=center]3.8[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]3[/align][/td][td][align=center]0.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]3.4[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]5[/align][/td][td][align=center]0.8[/align][/td][td][align=center]3.2[/align][/td][td][align=center]2.5[/align][/td][/tr][tr][td][align=center]6[/align][/td][td][align=center]1.0[/align][/td][td][align=center]3.0[/align][/td][td][align=center]2.5[/align][/td][/tr][/table]3.5.2粗酶液的提取与提取纤维素酶的方法相同。3.5.3活力测定与计算取5支试管,用记号笔编号。1、2号管为样品管,分别加入1 mL果胶底物,在48℃水浴中预热5 min,再分别加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),之后,1号管中加入1 mL酶液,立即摇匀,在48℃水浴中反应30 min;2号管中加入1 mL酶液,立即放入沸水浴中反应5 min,冷却。分别取1、2管中容液各2 mL于3、4管中,并加2 mL水,2.5 mL DNS显色剂,混匀,沸水浴反应5 min,流水冷却。5号管加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),2.5 mL DNS显色剂,静置20 min后以5号管为对照校零,在540 nm波长处测3、4管的吸光度;用测得的(OD[sub]3[/sub]-OD[sub]4[/sub])值在标准曲线上查得相应的D-半乳糖醛酸的量,代入下面公式计算活力。以每min酶作用生成的D-半乳糖醛酸的量为一个酶活单位(U)。果胶酶活性(U/ gmin)=Y*3*N/t* W [sub] [/sub](公式3-5)式中:Y-酶作用生成的D-半乳糖醛酸的量;3-测酶活取了反应液的1/3;N-样品稀释倍数;W-样品鲜重(g);t-反应时间(min)[b]4标准曲线的绘制4.1葡萄糖标准曲线[/b]依照3.4.1步骤,最后测得各个试管中的吸光度依次为0,0.432,0.672,0.865,1.073。按照表4,以葡萄糖浓度为横坐标,490 nm处的OD值为纵坐标,绘制葡萄糖标准曲线(如图1)。[align=center]表4葡萄糖标准曲线[/align][align=center]Table 4 Standard curve of Glucose[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]葡萄糖浓度umol[/align][/td][td][align=center]0[/align][/td][td][align=center]2.4[/align][/td][td][align=center]3.6[/align][/td][td][align=center]4.8[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]490 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.432[/align][/td][td][align=center]0.672[/align][/td][td][align=center]0.865[/align][/td][td][align=center]1.073[/align][/td][/tr][/table][align=center][img=,580,219]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010439441511_1108_2904018_3.png!w580x219.jpg[/img] [/align][align=center]图1葡萄糖标准曲线[/align][align=center]Figure 1 Standard curve of Glucose[/align][b]4.2 D-半乳糖醛酸标准曲线[/b]依照3.5.1步骤,最后测得各个试管中的吸光度依次为0,0.211,0.384,0.561,0.743,0.965。按照表5,以D-半乳糖醛酸的量为横坐标,540 nm处的OD值为纵坐标,绘制D-半乳糖醛酸标准曲线(如图2)。[align=center]表5 D-半乳糖醛酸标准曲线[/align][align=center]Table 5 Standard curve of D-Galacturonic acid[/align][table][tr][td][align=center]试管号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][td][align=center]6[/align][/td][/tr][tr][td][align=center]D-半乳糖醛酸的量mL[/align][/td][td][align=center]0[/align][/td][td][align=center]0.2[/align][/td][td][align=center]0.4[/align][/td][td][align=center]0.6[/align][/td][td][align=center]0.8[/align][/td][td][align=center]1.0[/align][/td][/tr][tr][td][align=center]540 nm OD[/align][/td][td][align=center]0[/align][/td][td][align=center]0.211[/align][/td][td][align=center]0.384[/align][/td][td][align=center]0.561[/align][/td][td][align=center]0.743[/align][/td][td][align=center]0.965[/align][/td][/tr][/table][align=center][img=,579,188]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440011153_826_2904018_3.png!w579x188.jpg[/img] [/align][align=center]图2 D-半乳糖醛酸标准曲线[/align][align=center]Figure 2 Standard curve of D-Galacturonic acid[/align][b]5结果与分析[/b]将所测得的OD值,根据各个公式计算出SOD,PPO,POD,纤维素酶和果胶酶的酶活力,结果如表6所示。再将大蒜脱毒试管苗与未脱毒苗酶活测定结果做成柱状图进行比较,如图3所示。可以看出,脱毒试管苗中的SOD,PPO,POD的活性均高于未脱毒试管苗的对应酶的活性,而这三种酶都与植物的抗病性有关,说明在抗病性上脱毒试管苗强于未脱毒试管苗;纤维素酶和果胶酶的活性则是未脱毒苗比脱毒试管苗高。此外,作为植物抗氧化系统第一道防线的SOD,其活性大小在脱毒试管苗与未脱毒苗中相差93.37 U/g,前者比后者高出约1.5倍,说明经脱毒的试管苗抵御活性氧侵害的能力更高。PPO能催化木质素及其他酚类氧化物的形成,从而构成保护性屏蔽,抵抗抗病菌的入侵,也可以通过形成醌类物质直接发挥抗病作用。脱毒试管苗的PPO活性比未脱毒苗的PPO活性高出19.48 U/gmin,约2.45倍。说明脱毒苗在抵抗抗病菌的入侵方面,能力更强。在植物对病原菌侵染的防卫反应中,POD和SOD都有着极其重要的作用,SOD能有效的清除机体内的超氧自由基,它可以把有害的超氧自由基转化为过氧化氢,而POD可以将过氧化氢分解为完全无害的水,在脱毒试管苗与未脱毒苗中POD的活性均比较大,两者相差382.55 U/gmin,约1.7倍,说明经脱毒的试管苗可以更有效的抵御过氧化氢的毒害。而纤维素酶和果胶酶均与植物的感病性有关,其活性则是未脱毒苗比脱毒试管苗高,分别高出18.29 U/gmin和38.08 U/gmin,约2.4倍和1.2倍,说明脱毒苗的感病几率有所降低。POD不仅可以将过氧化氢分解为完全无害的水,而且还具有多种生理功能,如从叶绿体和细胞质中去除过氧化氢、氧化有毒化合物、合成细胞壁、对各种胁迫的应急、吲哚-3-乙酸的调控、乙烯的生物合成等,还参与了植物酚类的聚合和氧化以及木质素和植保素的合成。因此POD是植物体中活性较高的一种酶,从图3中也可以看出,POD的活性在五种酶中最高。[align=center]表6 大蒜脱毒试管苗与未脱毒苗酶活测定结果[/align][align=center]Table 6 Enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align][table][tr][td][align=center]酶总活性[/align][/td][td][align=center]SOD[/align][align=center](U/g)[/align][/td][td][align=center]PPO[/align][align=center](U/gmin)[/align][/td][td][align=center]POD[/align][align=center](U/gmin)[/align][/td][td][align=center]纤维素酶[/align][align=center](U/gmin)[/align][/td][td][align=center]果胶酶[/align][align=center](U/gmin)[/align][/td][/tr][tr][td][align=center]脱毒苗[/align][/td][td][align=center]157.46[/align][/td][td][align=center]27.43[/align][/td][td][align=center]610.95[/align][/td][td][align=center]7.77[/align][/td][td][align=center]31.97[/align][/td][/tr][tr][td][align=center]未脱毒苗[/align][/td][td][align=center]64.09[/align][/td][td][align=center]7.95[/align][/td][td][align=center]228.40[/align][/td][td][align=center]26.06[/align][/td][td][align=center]70.05[/align][/td][/tr][/table][align=center][img=,564,289]http://ng1.17img.cn/bbsfiles/images/2018/07/201807010440223303_2970_2904018_3.png!w564x289.jpg[/img] [/align][align=center]图3大蒜脱毒试管苗与未脱毒苗酶活测定结果比较[/align][align=center]Table 3 Comparison of enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets[/align]
测2709蛋白酶活力时,待处理液能够使用多久,在冰箱中保存?
求助一篇文献,RT,乙醇对聚半乳糖醛酸酶的活力及荧光光谱,CD光谱的影响[url]http://www.cqvip.com/qk/94824X/199802/2965702.html[/url]链接在此
一、原理 超氧物歧化酶(superoxidedismutase,SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生O2,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。而SOD可清除O2,从而抑制了甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。据此可以计算出酶活性大小。 二、材料、仪器设备及试剂 (一)材料;水稻或小麦叶片 (二)仪器设备:1.高速台式离心机;2.分光光度计;3.微量进样器;4.荧光灯(反应试管处照度为4000Lx);5.试管或指形管数支。 (三)试剂 1. 0.05mol/L 磷酸缓冲液(pH7.8);2. 130mmol/L 甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml;3.750μmol/L 氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存;4. 100μmol/L EDTA-Na2溶液:称取0.03721gEDTA-Na2用磷酸缓冲液定容至1000ml;5. 20μmol/L 核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml避光保存。三、实验步骤 1. 酶液提取 取一定部位的植物叶片(视需要定,去叶脉)0.5g于预冷的研钵中,1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5ml。取1.5~2ml于1000rpm下离心20min,上清液即为SOD粗提液。2. 显色反应 取5ml指形管(要求透明度好)4支,2支为测定管,另2支为对照管,按下列加入各溶液:试剂(酶)用量(ml)终浓度(比色时)0.05mol/L 磷酸缓冲液1.5130mmol/L Met溶液0.313mmol/L 750μmol/L NBT溶液0.375μmol/L 100μmol/L EDTA-Na2液0.310μmol/L 20μmol/L 核黄素0.320μmol/L 酶液0.052支对照管以缓冲液代替酶液蒸馏水0.25总体积3.0混匀后将1支对照管置暗处,其它各管于4000Lx日光下反应20min(要求各管受光情况一致,温度高时间缩短,低时延长)。 3. SOD活性测定与计算 至反应结束后,以不照光的对照管做空白,分别测定其它各管的吸光度。四、结果计算 已知SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位表示,按下式计算SOD活性。SOD总活性=(Ack-AE)×V/(Ack×0.5×W×Vt) 上式中,SOD比活力=SOD总活性蛋白质含量式中SOD总活性以每克鲜重酶单位表示;比活力单位以酶单位/mg蛋白表示Ack照光对照管的吸光度AE样品管的吸光度V样品液总体积(ml)Vt测定时样品用量(ml)W样鲜重(g)蛋白质含量单位为:mg蛋白/g鲜重。
LST_6124-2017 粮油检验 小麦粉多酚氧化酶活力的测定 分光光度法.pdf
一、原理硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α–萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。其反应如下: http://tong.dxy.cn/upload/asset/2009/10/26/1256434988.jpg生成的红色偶氮化合物在540nm波长下有最大吸收峰,可用分光光度法测定。硝酸还原酶活性可由产生的亚硝态氮的量表示。一般以Nμg·g-1·h-1为单位。NR的测定可分为活体法和离体法。活体法步骤简单,适合快速、多组测定。离体法复杂,但重复性较好。二、仪器与用具分光光度计;真空抽气泵(或20ml注射器筒);天平;单面刀片;保温箱(或恒温水浴);刻度试管(15ml);移液管(5ml×2,2ml×8,1ml×2)。三、试剂1. 亚硝酸钠标准液 称取分析纯NaNO2 0.1000g水溶后定容至100ml,吸取5ml用水稀释定容至1000ml,即为每ml含NaNO2 5μg(亚硝态氮近似1μg/ml)的标准液。2. 0.1mol/L pH7.5的磷酸缓冲液:K2HPO4 19.24g,KH2PO4 2.2g,加水溶解后定容至1000ml。3. 1%(W/V)对-氨基苯磺酸溶液:称取1.0g加入25ml浓HCl中,用蒸馏水定容至100ml。4. 0.2%(W/V)α-萘胺溶液:称取0.2gα-萘胺溶于25ml冰醋酸中,用蒸馏水定容至100ml。5. 30%三氯乙酸溶液:75.0g三氯乙酸水溶后定容250ml。6. KNO3(0.1mol/L)、异丙醇(1% V/V)、磷酸缓冲液(0.1mol/L)混合液:称3.03g KNO3溶于300ml 0.1mol/L的磷酸缓冲液中,再加3ml异丙醇混匀。四、方法1. 标准曲线制作取7支洁净烘干的15ml刻度试管按表13-1顺序加试剂,即配成0-2.0μg的系列标准亚硝态氮溶液。摇匀后在30℃保温箱或恒温水浴中保温30min,然后在540nm波长下比色。以亚硝态氮(μg)为横坐标,光密度值为纵坐标绘标准曲线或建立回归方程。表13-1 各试剂加入顺序 http://tong.dxy.cn/upload/asset/2009/10/26/1256434989.jpg
GB/T23874-2009饲料添加剂木聚糖酶活力测定中4.6木聚糖溶液浓度为100mg/ml,有错误吗?因为其描述为:4.6木聚糖溶液浓度为100mg/ml:称取木聚糖(sigmaX0627)1.00g,加入0.32g氢氧化钠,再加入90ml水,磁力搅拌,同时缓慢加热,直至木聚糖完全溶解。然后停止加热,继续搅拌30min,加入0.5 ml冰乙酸。继续磁力搅拌,测定器pH,若PH为5.50,用乙酸-乙酸钠缓冲溶液定容至100ml。大家帮忙计算一下,国标上这样写的浓度是不是应该为10mg/ml啊?是不是国标出错了。另外sigmaX0627国内无现货,可以用别的代码的sigma药品啊?可以推荐下吗?急急急急急急
童心无关乎年龄大小,更多象征着一种充满活力的生命境界。若带着灰色眼镜看世界,生活索然无味,双目无神,死气沉沉;拥有一颗童心,天性乐观、积极,即使闭上了眼睛,也能想象出一片烂漫春光。回归纯真,对世界保持热爱和好奇,思维神采飞扬,怎能不洋溢着青春的活力。[img]https://ng1.17img.cn/bbsfiles/images/2023/11/202311190228274497_728_1642069_3.png[/img]
IU和FPU我大概知道是什么了,但是我遇到一个30CBU β-葡萄糖苷酶/g生物质,这个CBU表示什么意思呢?谢啦~~
活力、执行力、竞争力是纵横职场不可缺少的三件法宝。活力让自己找到工作的乐趣;执行力是工作落实到位保证,没有执行力就没有竞争力;竞争力是提升自己价值的保证。 马群为何总是给人以充满活力的感觉?因为马蝇对它的叮咬时刻都不放松。在任何一个马群里,都可以发现这个充满哲理的现象:马蝇会不时地在马匹身上叮上一口。马被其叮咬后,疼痒难忍,便用尾巴不停地驱赶;若拂之不去,就会发足狂奔,企图将其甩掉。结果被叮咬的马不仅没有血尽身亡,反而由于不停运动,生命力更加旺盛。 与此有着异曲同工之处的是我们熟知的“鲶鱼效应”也称“鲇鱼效应”,当鲶鱼放进鱼槽后,由于环境陌生,自然会四处流动到处挑起摩擦。而大量的沙丁鱼发现多了一个“异已分子”,自然也会紧张起来,加速游动。这样一来,沙丁鱼就一条条活蹦乱跳地回到渔港。这两个管理的效应法则都强调的是管理者如何在企业团队或组织中引进活力元素。 事实上也是这样的。随着管理科学的发展,越来越多的企业开始重视激励员工的重要性,不遗余力地用薪资福利、培训、授权等方式激发员工。可是,一些员工还是似乎失去了发展动力,做事情没精打采。原因到底出在哪里? 企业当然希望拥有积极、充满活力的员工,可要实现员工始终保持工作的活力,不是企业一方努力就能够达到的,更需要员工有自我调整、自我激励的意识。当员工对工作不再感到新鲜,缺乏创新,甚至开始有了厌倦情绪时,一个不可忽视的原因就可能出在员工的职业心理状态上。这种缺乏活力的职业心理状态被称之为职业倦怠感。 我的朋友玛丽是一家房地产公司的总经理秘书,在这个职位上已经工作一年多了,她很希望能在工作中有所建树,但老板交给她的都是事务性的琐碎工作,她感觉工作缺乏挑战,学不到东西,又没有发展前途,再加上公司成立不久,管理中还存在不少不规范的地方,玛丽于是产生了严重的职业倦怠感,对工作提不起兴趣,工作起来自然也就是无精打采。她很想转行从事销售行业,可又怕自己做不好,为此苦恼不已。 通过研究我发现:所有忠诚、积极、高效的员工身上都有一个重要的共同点——积极健康的职业心理。他们对未来的职业目标有清晰的定位,对自己的优缺点有比较清醒的认识,在出现问题时能有意识地调整自己的心理状态,把自己的目标和企业的目标统一起来,积极愉快地投入工作。这种自我激励、自我调整的良好心态是员工充满活力的内因。 所以,我对玛丽的建议是,工作不可能总是充满刺激的,有很多平常的小事和琐事,这些都是工作不可分割的一部分,而你又不可能舍弃它们,因此,你必须学会调节自己的心理状态,让自己始终对工作保持热情,才能克服倦怠的心理。为此,需要从以下几个方面入手: 1清醒地认识自己。感觉到自己的状态出了问题,先不要归咎于企业或上司、同事,更不要用跳槽、花钱充电等方法来解决问题,这样做收效甚微。你应该先从自己入手,分析当前的职业和你的人生目标是否统一,是不是有其他的生活问题带到工作中去了等等。如果他们不意识到自己的根本问题,并加以调整,换多少份工作都无济于事。 2如果自己无法准确地找到问题的症结,不妨请教一些这方面的专家。因为如果问题得不到及时的解决,只会越来越向不好的方向发展,千万不要抱“说不定过一段时间就会好了”的侥幸心理。 在工作中充满活力是取得优异工作成果的保证,充满活力地工作表明你热爱工作,你愿意将自己的努力全部贡献给工作,刻苦钻研的结果是创意不断涌现。而且,你的活力也会感染周围的同事,赢得好的人际交往,得到他们的帮助。 对工作充满活力也就意味着拥有很强的执行力。 执行力,简单的说,就是对上司指令的贯彻和落实程度。我用这样一个形象的语言故事来说明一下: 耶稣带着他的门徒彼得远行,途中发现一块破烂的马蹄铁,耶稣希望彼得捡起来,不料彼得懒得弯腰,假装没听见。耶稣自己弯腰捡起马蹄铁,用它在铁匠那儿换来3文钱,并用这些钱买了十几颗樱桃。出了城,两人继续前进,经过的是茫茫荒野,耶稣猜到彼得渴得厉害,就让藏在袖子里的樱桃悄悄地掉出一颗,彼得一见,赶紧捡起来吃。耶稣边走边丢,彼得也就狼狈地弯了十七八次腰。于是耶稣笑着对他说:“要是按我想的做,你最开始弯一次腰,我也就不用一次又一次重复地扔樱桃,你也就不会在后来没完没了地弯腰。” 这个寓言很有意思,它反映出这样一个问题:在企业中领导所想的和员工所想的,往往不能得到有效地统一,这也就是导致执行力缺失得原因。而执行力的缺失,使得领导者的所有工作都会变成一纸空文或一场空谈。 对于员工来说,执行力直接决定着工作的结果。一个团队,或者是一名员工,要完成上级交付的任务就必须具有强有力的执行力。因为,你接受了任务就意味着作出了承诺,而完成不了自己的承诺是不应该找任何借口的。可以说,没有任何借口是执行力的表现,这是一种很重要的思想,体现了一个人对自己的职责和使命的态度。思想影响态度,态度影响行动,一个不找任何借口的员工,肯定是一个执行力很强的员工。可以说,工作就是不找任何借口地去执行。 在这一点上,我非常赞赏西点军校的文化,他们就是提倡没有任何借口地去执行,这才是强有力的执行的保证。同样的道理,一个员工对于上司的指令,也应该具有这样的精神,因为这是工作得以顺利完成的保证。一个团队、一名员工,如果没有超强的执行力,就算有再多的创造力也可能没有什么好的成绩。员工所要培养的正是那种克服一切困难完成任务的决心,哪个老板会不喜欢这样员工呢? 巴顿将军在他的战争回忆录《我所知道的战争》中曾写到这样一个细节: “我要提拔人时常常把所有的候选人排到一起,给他们提一个我想要他们解决的问题。我说:‘伙计们,我要在仓库后面挖一条战壕,8英尺长,3英尺宽,6英寸深。’我就告诉他们那么多。我有一个有窗户或有大节孔的仓库。候选人正在检查工具时,我走进仓库,通过窗户或节孔观察他们。我看到伙计们把锹和镐都放到仓库后面的地上。他们休息几分钟后开始议论我为什么要他们挖这么浅的战壕。他们有的说6英寸深还不够当火炮掩体。其他人争论说,这样的战壕太热或太冷。如果伙计们是军官,他们会抱怨他们不该干挖战壕这么普通的体力劳动。最后,有个伙计对别人下命令:‘让我们把战壕挖好后离开这里吧。那个老畜牲想用战壕干什么都没关系。’”最后,巴顿写到:“那个伙计得到了提拔。我必须挑选那些不找任何借口地完成任务的人。” 无论什么工作,都需要这种不找任何借口去执行的人。对我们而言,无论做什么事情,都要记住自己的责任,无论在什么样的工作岗位上,都要对自己的工作负责。不要用任何借口来为自己开脱或搪塞,完美的执行是不需要任何借口的。 没有执行力就没有竞争力。当然,竞争力失一个宽泛的概念,它包括职业态度、职业精神等等。竞争力是脱颖而出的保证。企业要想在同行业中占据领先优势地位,就必须增强自身的竞争力,企业的竞争力来自员工;而一个员工要想从众人中脱颖而出,就必须增强自身的竞争力,员工的竞争力来自不断的学习。学习是增强竞争力的最好方法。 我注意到这样一个现象:当今名列世界500强的绝大部分企业都对其人员的内部培训给予了前所未有的重视,企业为培养人才所花的费用已达到了企业总销售额的10%,为培训所花费的人力成本也已占到了企业总人力投入的10%。例如,美国惠普公司几万名员工,每周至少要有20个小时用于学习业务知识。这是为什么?因为这些企业的管理者都懂得,培训是企业持续竞争力的“发动机”。 而对于员工来说,也应该不断地进行学习来增强自身的竞争力,提高自己的知识水平和职业技能,有效地减少工作压力并增加工作的乐趣,提高自身的整体素质,加强自己与职业的契合度,成为企业不可或缺的人才。
1 目的要求(1)初步掌握乳酸菌活力测定的一般方法。(2)了解乳酸菌在乳发酵过程中所起的作用。2 基本原理乳酸菌的细胞形态为杆状或球状,一般没有运动性,革兰氏染色阳性,微需氧、厌氧或兼性厌氧,具有独特的营养需求和代谢方式,都能发酵糖类产酸,一般在固体培养基上与氧接触也能生长。酸乳风味的形成与乳酸菌发酵过程代谢的多种物质有关,而这些物质的产生与发酵速度等活力指标有密切关系。乳酸菌的活力可由多种参数确定,如细胞生长情况,细胞干重和光密度(OD值)等。由于乳液不透明,不能直接测OD值,可用NaOH和EDTA处理使其澄清后再测。较简便的活力测定包括凝乳时间,产酸和活菌数量等指标的检测。3 实验材料3.1样品 市售酸奶或乳酸菌饮料。3.2 培养基 MRS固体和液体培养基,复原脱脂乳培养基。3.3 实验用仪器设备 超净工作、恒温培养箱、鼓风干燥箱、高压蒸汽灭菌锅、冰箱、油镜显微镜、碱式滴定仪、天平、培养皿、移液管、试管、烧杯、量筒、温度计、酒精灯、接种针、载玻片等。4 实验方法与步骤4.1 菌种的分离(1)编号 取五支无菌水试管,分别用记号笔标明10-1、10-2~10-5。(2)稀释 将酸奶样品搅拌均匀,用无菌移液管吸取样品25mL,移入含有225mL无菌水的三角瓶中,在漩涡混合器上充分振摇,使样品分散均匀,获得10-1的样品稀释液,然后根据对样品含菌量的估计,将样品稀释至适当稀释度。(3)倒平板 选用2~3个适宜浓度的稀释液,分别吸取1mL注入平皿内,然后倒入事先溶化并冷却至45℃左右的MRS固体培养基,迅速转动平皿使之混合均匀,待冷却凝固后倒置,于40℃培养48h。(4)分离 无菌操作,从培养好的固体平皿中分别挑取5个单菌落接种于液体MRS培养基中,置40℃培养箱中培养。(5)镜检 通过镜检,确定所分离的乳酸菌是乳杆菌还是链球菌。保加利亚乳杆菌呈杆状,单杆、双杆或长丝状;嗜热链球菌呈球状,成对、短链或长链状。4.2 接种按1%的接种量,将MRS液体培养物接种于已灭菌的复原脱脂乳中,另分别接种具有较高活力的保加利亚乳杆菌和嗜热链球菌作为对照。培养温度为保加利亚乳杆菌40℃, 嗜热链球菌45℃。4.3 观察与测定(1)观察: 观察并记录各试管的凝乳时间。(2)酸度测定:用NaOH滴定法,测定发酵乳液的滴定酸度。(3)计数:采用倾注平板法,测定活菌数量。
QB/T ——2003 纤维素酶制剂 附录B 羧甲基纤维素酶活力测定 有人在测吗? 我曲线做得出来, 样品酶活力测得的结果超低,与理论酶活相差了78%,有没有人也有相同情况的,是什么问题导致误差这么大的呢?
根据1961年国际酶学会议规定:1个酶活力单位是指在特定条件(25℃,其它为最适条件)下,在1分钟内能转化1微摩尔底物的酶量,或是转化底物中1微摩尔的有关基团的酶量,缩写为1U或者1IU。现在一些生化产品供货商对酶用的很多都是自己的定义1unit而不是1U,那这二者之间是否可以换算得到一个转换系数?比如酸性磷酸酶A供货商的酶活定义为:One unit will hydrolyze 1.0 μmole of p-nitrophenyl phosphate per min at pH 4.8 at 37 °C. B供货商的酶活定义为:Specific activity: ~ 17 U/mg (40oC, pH 5.0, 4-Nitrophenyl phosphate). 问题:A供货商的1unit是否是1U?A供货商的1unit与B供应商的1U是否一致?另外对于国际酶活力概念中提到的“在25°C条件下,其他为最适条件”是否温度必须为25°C条件下测得才为酶活国际单位,还是比如在其他温度下入37°C或者40°C等不同温度测得的也为国际酶活力单位IU?
[b][font='微软雅黑','sans-serif'][color=#FF6600]实验原理[/color][/font][/b][font='微软雅黑','sans-serif']碱性磷酸酶(alkaline phosphatase EC 3.1.3.1简称为ALPase)广泛存于微生物界和动物界。ALPase能催化几乎所有的磷酸单酯的水解反应,产生无机磷酸和相应的醇、酚或糖。它也可以催化磷酸基团的转移反应,磷酸基团从磷酸酯转移到醇、酚或糖等磷酸受体上。在磷的生物和化学循环过程中,ALPase起了及其重要的作用。在生物体内ALPase与磷的代谢直接相关,参与磷与钙物质的消化、吸收、分泌以及骨骼的形成等生理生化过程。ALPase的作用最适PH在碱性区域,一般在PH9.0~10.5范围内。Mg[sup]2+[/sup]对该酶的活力有显著的激活使用。[/font][font='微软雅黑','sans-serif']为了获得好的提取效果,在酶的制备过程,特别应注意以下几点:[/font][font='微软雅黑','sans-serif'](1)[/font][font='微软雅黑','sans-serif']选取来源丰富、酶含量高的新鲜材料。提取工作应在获得材料后立刻开始,否则应在低温下保存。[/font][font='微软雅黑','sans-serif'](2)[/font][font='微软雅黑','sans-serif']用盐分级沉淀是一种应用非常广泛的方法。碳酸铵是最常用的盐。操作时,要注意保持缓冲液的合适PH值和温度。在加碳酸铵时需事先将其研细,需缓慢加入并及时搅拌溶解,尽量防止泡沫形成,以免酶蛋白在溶液中表面变性。盐析生成的沉淀,要静置20min以上,以使沉淀完全,然后方可时行离心分离。[/font][font='微软雅黑','sans-serif'](3)[/font][font='微软雅黑','sans-serif']有机溶剂沉淀法也常用于蛋白质的分离提纯。丙酮和乙醇是使用最为广泛的两种有机溶剂。应注意在低温下操作,缓慢加入,充分搅拌,避免局部浓度过高放出大量热量而使酶蛋白变性。离心收集沉淀后,最好立即将其溶于适量缓冲液中,以避免酶活力的丧失。[/font][font='微软雅黑','sans-serif'](4)[/font][font='微软雅黑','sans-serif']在酶的制备过程中,每经一步处理,都需测定酶的活力和比活力。唯有比活力提高较大,提纯步聚才有效。[/font][align=left][font='微软雅黑','sans-serif'] [/font][font='微软雅黑','sans-serif']酶活力的分析:通常是以对—硝基苯磷酸二纳(pNPP)为底物,在PH10.1的碳酸盐缓冲液(含2mmol/L Mg[sup]2+[/sup])的测活体系中检测酶催化pNPP水解产生黄色的对硝基苯( pNP)在405 nm处有最大的吸收峰,可以根据OD[sub]4[/sub][sub]〇5[/sub]值的增加计算酶活力的大小。酶活力定义为在37℃下,以5mmol/L pNPP为底物,在pH 10.1的碳酸盐缓冲液含2 mmol/L Mg[sup]2+[/sup]的测活体系中每分钟催化产生1 mol/L pNP的酶量定为1个酶活力单位。酶的比活力定义为每mg蛋白所具有的酶活力单位数。 [/font][/align]
如题,请教各位常规络合物的活力顺序?