请教各位高手,溶液中锰离子含量精确测量的方法,谢谢
怎么测锰酸锂(有少量铝离子)材料中的锰离子含量用EDTA滴定法....我是加了三乙醇胺遮蔽铝离子,但是这样是不是也遮蔽了三价的锰离子了啊,是不是在前处理时,加点盐酸羟胺或是过氧化氢把锰离子还原到2价就行了啊,求大神指导方法
请教各位: 纳基蒙脱土中纳离子含量能否测出来? 在作报告时,有老师问,我将纳基蒙脱土有机化处理后,有多少纳离子被置换了出来?他想知道量化的指标,以前好像没看到有文献报道测试有机化的转换率的,因为100克纳基蒙脱土中可能有100mmol的纳离子,经过处理后,含量会更少,不知道通过元素分析或者能谱,能否测出处理后剩余的纳离子含量?谢谢各位!
方法联用测定锰硅合金中的锰、硅、磷含量摘要:建立了一种同时测定锰硅合金中主量、次量元素的方法。样品经溶解后,用电感耦合等离子体发射光谱法测定锰硅合金中的硅、磷含量,用自动电位滴定法测定锰硅合金中的锰含量。该方法用于两种标准物质YSBC18603-08和GSB03-1946-2005的实际分析,Mn、Si、P的测定值与标准值吻合,RSD(n=11)为0.147%~1.42%;Mn、Si、P 的回收率为95.8%~99.64%。与现行国标方法相比,分析周期短,适用于大宗锰硅合金进出口检验的要求。关键词:锰硅合金 锰 硅 磷 电感耦合等离子体发射光谱法 自动电位滴定法锰硅合金是由锰、硅、铁、磷及少量碳和其它元素组成的合金,是一种用途较广、产量较大的铁合金。锰硅合金是炼钢常用的复合脱氧剂,又是生产中低碳锰铁和电硅热法生产金属锰的还原剂。随着中国经济的发展,汽车、道路、建筑、房地产等市场的持续发展,对钢铁的需求量将继续增大,因而对锰硅合金的需求也会持续增大。锰是炼钢过程中最主要的脱氧剂之一,几乎所有的钢种都需要用锰来脱氧。硅是生铁和碳钢中仅次于锰的最重要的合金元素。锰、硅、磷的含量是评价锰硅合金质量的重要指标。现有的对锰硅合金中锰、硅、磷含量的检测方法,多采用对不同元素逐一样品前处理,再测定,而且测定方法较为复杂,不利于口岸的快速通关。例如现行国标方法GB/T5686.1采用滴定法测定锰含量,方法1电位滴定法使用氢氟酸及高氯酸,有一定的危险性,而且使用的电位滴定仪自动化程度较差,方法2硝酸铵氧化法和方法3高氯酸氧化法都需要对试样中含有的钒、铈等元素进行校正;GB/T 5686.2测定硅含量的三种方法及GB/T 5686.4测定磷含量的操作步骤都较繁琐,不易掌握;由于锰硅合金是一种重要的战略物资,在当前的贸易形势下,建立对锰硅合金的锰、硅、磷含量的快速检测方法有利于维护我国的贸易利益。 电感耦合等离子体原子发射光谱法具有灵敏度高,干扰少、线性范围宽并能连续测定多种元素等优点,自动电位滴定仪以不需要指示剂,自动判断滴定终点等当点,人为误差因素小等优点在食品、化工、矿产、环保及其它领域得到了广泛的应用。本方法旨在采用样品一次前处理,引入ICP-AES(电感耦合等离子体发射光谱),对硅、磷含量进行测定,用自动电位滴定仪法通过对锰含量进行测定,实现快速测定锰硅合金的锰、硅、磷含量,精密度和准确度均满足国标要求,方法快速,准确,容易操作,尤其适合口岸大批检验的要求。1 实验部分1.1 仪器及工作条件美国热电ICAP6300 型光谱仪,光室通氩气12h以上,发生器功率1150w;辅助器流量1.0L/min;雾化器流量0.5L/min;分析泵速50r/m;观测高度17mm;短波积分时间15s,长波积分时间10s;进样清洗时间30s,波长范围及背景扣除见表1。瑞士梅特勒公司DL55自动电位滴定仪,搅拌速度50%,搅拌时间20s,电极DM140,滴定剂添加模式:动态添加,终点识别模式:等当点控制,阈值:3000,等当点个数:1个,dE(set):2.0mV, dV(min):0.01mL, dV(max): 0.2mL。美国LINDBERG/BLUE M BF51700马弗炉;瑞士梅特勒AE240电子天平,感量:0.0001g。表1波长范围及背景扣除元素Si2881P1782
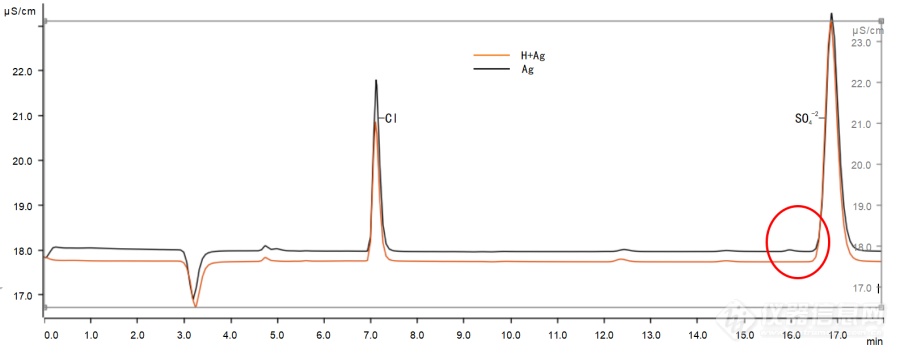
离子色谱法测定镍锰酸锂正极材料中的硫酸根含量邓 蓓*1,2,彭桂香1,2(1、宜春市锂电产业研究院,江西宜春,336000;2、江西省锂电产品质量监督检验中心,江西宜春,336000)摘 要 采用离子色谱法测定镍锰酸锂中硫酸根离子的含量,用盐酸和双氧水溶解试样,通过固相萃取柱净化后至离子色谱仪上进样测试,通过多次对比实验,优化了试验方法;在优化的试验条件下,硫酸根在0~20.0μg?L-1范围内具有良好的线性关系,其线性相关系数为0.9998。对4个不同含量的样品分别进行了11次平行测定,相对标准偏差(RSD)为1.6~5.9%。在镍锰酸锂试样中加入硫酸根标液进行加标回收实验,硫酸根离子的加标回收率在96.1%~106.3%之间。与传统的硫酸钡比浊法相比,离子色谱法操作简便快捷,方法检出限低,测量范围更宽,干扰少,测定结果可靠,再现性良好,适合大批量快速样品分析。关键词 镍锰酸锂;离子色谱法;硫酸根离子 Determination of sulfate in LiNi0.5Mn1.5O4 cathode materials by Ion chromatographyDENG Bei*1,2,PENG Guixiang1,2(1. Yichun research institute of lithium battery industry,Yichun,Jiangxi,336000,China 2.Jiangxi Province Litium Product Quality Supervision and Inspection Center, Yichun, Jiangxi, 336000, China )Abstract: The component of sulfate in LiNi0.5Mn1.5O4 were determined by Ion chromatography,The samples were dissolved in hydrochloric acid and hydrogen peroxide, purified by solid phase extraction column and injected into ion chromatography for test. The mass concentration of sulfate ion in the range of 0~20.0μg?L-1 had a good linear relationship with correlation coefficients of 0.9998.Under the optimal conditions,the relative standard deviations (RSD) of four different mass concentration samples were 1.6~5.9% for 11 parallel measurements. For recovery tests, sulfate ion were added into the LiNi0.5Mn1.5O4 samples and the recovery rates of sulfate ions were in the range of 99.4%~100.2%. Compared with the double indicator titration method, the ion chromatography method is convenient and fast. At the same time, this method has the advantages of simple operation,a lower detection limit,a wider measurement range,less interference, high precision, reliable determination results and good reproducibility. It is suitable for rapid analysis of large quantities of samples. Keywords: LiNi0.5Mn1.5O4 ion chromatography sulfate ion 摘要 随着锂离子电池在新能源汽车领域的应用扩展以及“双碳”政策的深入。人们对锂电池性能的要求越来越高。锂电池的性能很大程度上取决于正极材料,而镍锰酸锂正极材料具有资源丰富、成本低、环境友好、电压高且能量密度高等优势,在大功率领域中得到了广泛应用,从而成为了研究热点。在制备镍锰酸锂的过程中,会残留一定量的硫酸盐,因此,硫酸根含量是其成品的一项重要技术指标。现有的测定硫酸根的方法主要有:离子色谱法、分光光度法和电位滴定法。其中,分光光度法需严格控制操作条件,且测定镍锰类等有色金属化合物时,本底值有颜色需要差减法扣除,含量较低时精密度不够好;电位滴定法只适合高含量的硫酸根离子测定;而离子色谱法检出限低、操作便捷高速效率高且样品前处理简单。因此,在镍锰酸锂中测定硫酸根时选择离子色谱法。1实验部分1.1主要仪器与试剂 除非另有说明,本文中实验用水均为去离子水(18.25MΩ?cm)。 Metrohm ECO-IC离子色谱仪(瑞士万通公司);Metrosep A Supp 5-250/4.0色谱柱(瑞士万通公司);H型预处理柱:AnL Pre IC-H-1cc(宁波鸿谱仪器科技有限公司);Ag型预处理柱:AnL Pre IC-Ag-2.5cc(宁波鸿谱仪器科技有限公司);水系微孔过滤滤膜:50(mm)×0.45(μm);聚醚砜(PES)针筒式过滤器:13(mm)×0.22(μm);万分之一天平(梅特勒MS205DU);Milli-Q去离子水制备装置(德国默克密理博);真空抽滤装置(天津市津腾实验设备有限公司)无水碳酸氢钠(优级纯);无水碳酸钠(优级纯);浓硫酸(优级纯);浓盐酸(优级纯);30%过氧化氢(分析纯);7种阴离子(氟离子、氯离子、硝酸根离子、亚硝酸根离子、溴离子、硫酸根离子、磷酸根离子)混合标准溶液(质量浓度为1000mg?L-1) 国家标准物质中心。 1.2 实验方法1.2.1 标准溶液的配制 储备液的配制:用移液枪准确移取10mL混合标准溶液于100mL容量瓶中,加水稀释至终点刻度,摇匀,静置备用,放置于4℃冰箱中保存。此溶液1.00mL相当于100μg硫酸根。标准曲线溶液的配制:用移液枪分别准确移取0mL、0.50mL、1.25mL、2.50mL、5.0mL和10.0mL储备液,分别置于50mL容量瓶中,加水稀释至终点刻度,摇匀,静置备测。该系列溶液1.00mL分别相当于0.00μg、1.00μg、2.50μg、5.00μg、10.00μg、20.00μg硫酸根。在本方法确定的最佳实验条件下依次从浓度低到高的顺序进样,绘制标准曲线。 1.2.2 色谱条件 色谱柱选用 Metrosep A Supp 5-250/4.0色谱柱;流速0.7mL?min-1 ;流动相4.5mmol?L-1NaHCO3-4.5mmol?L-1Na2CO3溶液;进样体积20μL;电导检测器。1.2.3 样品测定将镍锰酸锂样品在105-110 ℃下烘干2h,然后置于干燥器内,冷却至室温,备用。准确称取 0.2000g(精确至0.0001g)镍锰酸锂试样于100 mL 烧杯中,缓慢加入3.0mL盐酸(1+1),再加入4-5滴过氧化氢,低温加热至完全溶解且蒸发至近干,冷却,加5-10mL水溶解,转移至100mL容量瓶中,用水洗涤烧杯3-5次,同时将洗涤液转移至容量瓶中,用水稀释至刻度,摇匀,待净化。 将H柱和Ag柱用10mL水活化,静置10min,将上述溶液缓慢通过活化好的H柱和Ag柱,弃去前3mL滤出液,获取后续2mL滤出液,过0.22μm聚醚砜(PES)针筒式过滤器,上机待测。 2 结果与讨论2.1 淋洗液浓度的选择 为了检验其他阴离子对硫酸根离子峰积分的干扰,选择了7种阴离子(氟离子、氯离子、硝酸根离子、亚硝酸根离子、溴离子、硫酸根离子、磷酸根离子)混合标准溶液进行分离,分别使用三种不同浓度的淋洗液对待测标准溶液进行淋洗分离。实验结果如图1所示,具体浓度等信息见表1。https://ng1.17img.cn/bbsfiles/images/2022/09/202209081603235950_1568_5824073_3.png!w690x283.jpg图1 不同浓度淋洗液的离子色谱图Fig. 1 Ion chromatograms of different concentrations of eluent表1 不同浓度淋洗液的出峰时间Table 1 Peak time of different concentrations编号No.淋洗液浓度concentrations of eluent7种阴离子分离情况Separation of 7 anionsSO42-出峰时间Peak time/minNa2CO3 /(mmol/L)NaHCO3 /(mmol/L)1#4.540.8好16.32#3.21.0好21.83#4.51.4好24.5由图1和表1可知,三种浓度的淋洗液都能很好的将7种阴离子分离,但是,从时间、资源和环境的角度,我们选择了更早出峰的1#淋洗液(4.54mmol/LNa2CO3-0.8mmol/LNaHCO3 ),这样既节省时间、节约资源,同时更少的淋洗液减少了废液的处理从而对环境更友好。 2.2 溶样方法的选择采用硝酸和盐酸加双氧水的方式溶样,称样量均为0.2g时的试验结果见表2。由表2可知,硝酸较难溶解样品,盐酸能够溶解样品但是速度缓慢,盐酸和双氧水加入样品混匀,在低温电热板上微热数分钟即可将样品完全溶解。表2 溶样方法Table 2 Methods of sample dissolving溶样介质Sample dissolving medium溶解状态Dissolved state溶样介质Sample dissolving medium溶解状态Dissolved stateHNO3难溶HCl溶解缓慢HNO3 + H2O2溶解缓慢HCl + H2O2溶解,澄清 2.3 盐酸+双氧水加入量试验 由于离子色谱仪测定时,氯离子也会出峰,浓度过大会造成拖尾并且会严重影响硫酸根离子的出峰和积分。溶解样品的盐酸中含有大量的氯离子,因此,盐酸的加入量在保证能够溶解样品的条件下应当越少越好。所以,做了盐酸和双氧水加入量的一系列试验。表3是称样量为0.2g时不同盐酸和双氧水加入量的试验结果。由表3中结果可知,当称样量为0.2g,盐酸(1+1)用量3mL、双氧水用量0.5mL时,样品在低温电热板上微热数分钟刚好能够完全溶解,满足测定分析要求。因此,当称样量为0.2g时,选择3mL盐酸(1+1)、0.5mL双氧水作为溶样体系。表3 盐酸+双氧水加入量试验Table 3 Hydrochloric acid + hydrogen peroxide addition test盐酸(1+1)加入量Addition of HCl(1+1)双氧水加入量 Addition of H2O2溶解状态Dissolved state1.00mL0.50mL部分溶解,有黑渣1.00mL2.00mL0.50mL基本溶解,有少量残余1.00mL3.00mL0.50mL完全溶解,澄清1.00mL4.00mL0.50mL完全溶解,澄清1.00mL 2.4 溶液是否蒸干再定容试验由于氯离子对硫酸根的测定有一定的干扰,而加入的盐酸可以通过加热的形式蒸发掉一部分,所以,进行了定容前是否蒸干的对比试验,其结果如图2所示。https://ng1.17img.cn/bbsfiles/images/2022/09/202209081601009376_9858_5824073_3.png!w690x324.jpg图2 样品蒸干与不蒸干的图谱Fig. 2 Ion chromatograms of dried and non dried samples由图2可知,未蒸干时的氯离子峰又宽又长,已经影响了硫酸根的出峰时间,而蒸干后的氯离子峰虽然仍旧较宽但已经明显小了不少,并且没有影响硫酸根离子的出峰时间。所以,蒸干有利于硫酸根的测定,因此,选择在定容前将溶液低温加热至近干。2.5 固相萃取柱的选择由于溶液中含有锂、钠、钾、钙、铁、铜、铬和镉等金属离子以及残留的氯离子的干扰,在溶液进样前需要过柱子净化。选取H柱去除溶液中可能存在的金属离子和Ag柱去除溶液中氯离子,其结果见图3、图4。 https://ng1.17img.cn/bbsfiles/images/2022/09/202209081600325635_5928_5824073_3.png!w690x274.jpg图3 过H柱和过H柱+Ag柱的试验结果Fig. 3 Test results of passingH column and passing H column + Ag column由图3可知,溶液只过H柱时氯离子峰特别高,严重影响了硫酸根离子的测定;而同时过H柱和Ag柱的话,氯离子峰就大大变小了,有利于硫酸根的测定。https://ng1.17img.cn/bbsfiles/images/2022/09/202209081600025629_4582_5824073_3.png!w690x271.jpg 图4 过Ag柱和过H柱+Ag柱的试验结果Fig. 4 Test results of passing Ag column and passing H column + Ag column由图4可知,只过Ag柱时硫酸根离子附近会有干扰峰,而同时过H柱和Ag柱则没有。所以综上所述,选择过H柱+Ag柱为佳。2.6 标准曲线、检出限及定量限在 1.2.2仪器工作条件下,分别测定了1.2.1中系列混合标准工作溶液。以硫酸根质量浓度(x)为横坐标,色谱峰面积(y)为纵坐标绘制校准曲线。结果表明,硫酸根离子的线性范围为0~20.0μg?L-1,线性方程为y=8.54057×10-3+7.01333×10-3x,相关系数为0.9998。依据计量规范JJG823-2014,选取相应的1.0μg?L-1硫酸根标准溶液进行11次平行测定并计算检出限为0.01μg?L-1,依据EPA SW-846方法规定采用4倍检出限浓度作为定量限为0.04μg?L-1。2.7 精密度试验选取4个不同品位的产品,按照设定的实验方法对样品中的硫酸根含量分别进行11次平行测定。得到11个测定值,计算其平均值、标准偏差及相对标准偏差,结果见表4,结果证明精密度满足分析要求。表4方法精密度实验结果Table 4 Precision tests of the method(n=11) /%样品编号Sample No.测定值(n=11)Found平均值Average标准偏差SD相对标准偏差RSD1#0.06430.05790.0567 0.0539 0.05850.3435.8650.0595 0.06130.06180.0605 0.0534 0.0554 0.0585 2#0.1120.118 0.118 0.116 0.1150.2241.9530.1140.114 0.115 0.113 0.1160.1110.115 3#0.3180.3030.308 0.317 0.3140.7772.4730.323 0.3180.313 0.316 0.3090.304 0.328 4#0.6520.632 0.655 0.650 0.6381.0581.6580.6320.6230.635 0.6430.6340.6260.638 2.8 加标回收试验由于目前还没有相应的镍锰酸锂标准样品,所以采取在样品中添加不同含量的硫酸根离子进行加标回收试验,按照试验方法进行样品处理、测定,其结果见表5。该方法加标回收率在96.1~106.3%之间,能够满足测定要求。表5 加标回收试验Table 5 Recovery tests样品编号Sample No.样品量m1Mass of Sample/g本底值SO42Mass of SO42-/μgSO42-加标量m2Spiked/μg测定值m3Measured value/μg回收率ηRecovery/%1#0.2013117.5250169.22103.40.2002117.02100213.1296.12#0.2003230.01100326.4196.40.2005231.03200426.6297.83#0.2015628.565001160.06106.30.2008629.017501367.7698.54#0.20111277.055001768.5598.30.20061276.137502041.88102.1 2.9方法比对目前,测定硫酸根的含量主要有两种方法,分别是离子色谱法和硫酸钡比浊法。对该两种方法分别进行了试验,结果如表6所示。由表6可知,含量高的时候两种方法的结果相差不大,但是含量低的时候,硫酸钡比浊法测定结果不理想。并且,硫酸钡比浊法对加入的硝酸钡状态和用量要求较高,测定前的静置时间也比较严格,在一定的时间内必须完成测定,同时对实验人员的操作手法要求严苛,因此,不适合批量测定。而离子色谱法前处理简单便捷,样品处理后稳定性良好,可用于大量样品的测定。表6 测定镍锰酸锂中的硫酸根含量Table 6 Determination of sulfate content in LiNi0.5Mn1.5O4 /% 样品编号Sample NO.离子色谱法测定值Found by ion chromatography method硫酸钡比浊法测定值Found by barium sulfate turbidimetry method1#0.0585未检出2#0.1150.0893#0.3140.3214#0.6380.650在实验过程中,从称样量、检出限和前处理等方面对比了离子色谱法和硫酸钡比浊法,具体对比结果见表7。表7 两种方法对比Table 7 Comparison of two methods序号NO.项目Content离子色谱法 Ion chromatography method硫酸钡比浊法Barium sulfate turbidimetry method1方法检出限0.01%0.1%2称样量0.2g1.0g3前处理样品稳定性常温下15天内稳定静置15-30min内完成测定4测定范围0.01%-0.7%0.1%-0.7%由表7可知,离子色谱法不仅测定结果可靠、方法检出限低,而且前处理样品稳定性好。因此,不管是从结果准确性和测定范围还是从效率上来看,离子色谱法都更胜一筹。3 结语镍锰酸锂正极材料样品用盐酸和双氧水溶解,通过固相萃取柱净化后至离子色谱仪上进样测定,较传统的硫酸钡比浊法,方法操作简单便捷,样品稳定性良好,干扰少,方法检出限低,测定范围宽,精密度较高,测定结果可靠,再现性良好,适合大批量快速样品分析。 References李 旺,周 兰,刘佳丽.镍锰酸锂正极材料及其适配性电解液研究最新进展.无机盐工业,2019,51(6):5-10.Li Wang , Zhou Lan , Liu Jiali.Latest development of LiNi0.5 Mn1.5 O4 cathode materials and adaptive electrolytes.Inorganic chemicals industry,2019,51(6):5-10 钟茂初."双碳"目标有效路径及误区的理论分析.中国地质大学学报(社会科学版).2022,22(1):10-21.ZHONG Mao-chu.A Theoretical Analysis on the Effective Path and the Misunderstanding of "Dual Carbon" Goal.Journal of China University of Geosciences (Social Sciences Edition).2022,22(1):10-21. 王静,吴比赫,林伟庆,等.锂离子电池高电压正极材料LiNi0.5Mn1.5O4-----研究进展.厦门大学学报:自然科学版,2015,54(5):630—642. Wang Jing,Wu Bihe,Lin Weiqing,eta1.Research progress in high—voltage LiNi0.5Mn1.5O4 for lithium ion batteries.Journal of Xia’men University:Natural Science,2015,54(5):630—642. 金彦章,王永和,刘强,等.高电压正极材料LiNi0.5Mn1.5O4制备及性能研究.无机盐工业, 2017, 49 ( 6 ): 45-49. Jin YanzhangWang YongheLiu Qiang,eta1.Study on synthesis and performance of high-voltage LiNi0.5Mn1.5O4 cathode material for lithium-ion battery.Inorganic Chemicals Industry.2017, 49(6):45-49 Rahaye I,Noviyanti A R,Rakmawaty D,etal.Preparation of Lithium Iron Phosphate-Carbon Composite as a Cathode for Lithium Ion Battery.Materials Science Forum,2019,966:392-397. Wen Weicheng,Yang Xiukang,Wang Xianyou,etal.Improved electrochemical performance of the spherical LiNi0.5Mn1.5O4 particles modified by nano-Y2O3 coating.Journal of Solid State Electrochemistry,2015,19(4):1235-1246. Nageswaran S,Keppeler M,Kim S J,etal.Morphology controlled Simodified LiNi0.5Mn1.5O4,microspheres as high performance high voltage cathode materials in lithium ion batteries.Journal of Power Sources,2017,346:89-96. 杨强强 , 崔雅茹,李 倩,等.共沉淀法合成镍锰酸锂正极材料前驱体.矿冶工程.2020,40(5):134-138YANG Qiang-qiang,GUI Ya-ru,LI Qian,etal.Synthesis of Precursor of LNMO Cathode Material by Coprecipitation Method.Mining and metallurgical engineering. 2020,40(5):134-138刘春峰. 离子色谱法测定镍钴锰氢氧化物中硫酸根离子含量.中国无机分析化学.2013,3(z1).LIU Chunfeng.Determination of Principal Components in Industrial and Battery Lithium Carbonate by Automatic Potentiometric Titration MethodDetermination of sulfate ion in Nickel Cobalt Manganese Hydroxide by ion chromatography.Chinese Jorunal of Inorganic Analytical Chemistry.2013,3(z1).张枫华,雷仲存,顾红琴.离子色谱法测定水中硫酸根离子浓度范围的探讨.冶金动力.2013,161(7):56-60.ZHANG Fenghua,LAI Zhongcun,GU Hongqin.Discussion on suitable concentration range of sulfate ion in water determined by ion chromatography.Metallurgical Power,2013,161(7):56-60. GB/T 11064.9-2013碳酸锂、单水氢氧化锂、氯化锂化学分析方法 第9部分 硫酸根量的测定 硫酸钡浊度法.GB/T 11064.9-GB/T 11064.9-2013 Methods for chemical analysis of lithium carbonate, lithium hydroxide monohydrate and lithium chloride - Part 9:determination of sulfate content Barium sulfate nephelometry method. 刘月菊,宋明明,邸卫利,等.电位滴定法测定钒电池电解液中硫酸根.冶金分析.2019,39(4):75-79.LIU Yue-ju,SONG Ming-ming,DI Wei-li,etal.Determination of sulfate in vanadium battery electrolyte by potentiometric titration.Metallurgical Analysis,2019, 39(4):75-79 JJG823-2014离子色谱仪检定规程.JJG823-2014Verification Regulation of Ion Chromatographs:.2013 Methods for chemical analysis of lithium carbonate, lithium hydroxide monohydrate and lithium chloride - Part 9:determination of sulfate content Barium sulfate nephelometry method. 刘月菊,宋明明,邸卫利,等.电位滴定法测定钒电池电解液中硫酸根.冶金分析.2019,39(4):75-79.LIU Yue-ju,SONG Ming-ming,DI Wei-li,etal.Determination of sulfate in vanadium battery electrolyte by potentiometric titration.Metallurgical Analysis,2019, 39(4):75-79 JJG823-2014离子色谱仪检定规程.JJG823-2014Verification Regulation of Ion Chromatographs:.
请问专家:我想检测污水中的柠檬酸等有机酸根阴离子含量,但是该水中重金属含量也比较高,跟柠檬酸有络合作用,请问我应该采取什么方法比较好?请各位指点,谢谢!
急急急!急求SN/T 3301-2012汽油中锰、铁、铅含量的测定 电感耦合等离子体原子发射光谱法
GB/T 24194-2009 硅铁 铝、钙、锰、铬、钛、铜、磷和镍含量的测定 电感耦合等离子体原子发射光谱法
电感耦合等离子体原子发射光谱法同时测定锰精矿中高含量的钨、锡、钼、铌、钽、钒
老师们你们好,我想请问如何用[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]法测量血液中金属离子如铁、铬、锰、镁等的种类和含量?
不知各位有没有谁做过酱油里面的锰,我们无意中发现几种的酱油中的锰含量比较高,国家对酱油中锰含量好象没有要求,

摘要:采用碱熔融酸化方法处理样品,电感耦合等离子体原子发射光谱法同时测定锰精矿中的钨、锡、钼、铌、钽、钒。方法相对标准偏差(RSD,n=11)低于5.0%;回收率为99.5~105%,经国家有证标准物质分析验证,测定结果与标准值吻合很好。关键词:电感耦合等离子体原子发射光谱法,锰精矿,熔融,同时测定Simultaneous Determination of high grade tungsten, stannum, molybdenum,niobium, tantalum and vanadium in manganic concerntrate Samples by Inductively Coupled Plasma –OpticalEmission SpectrometryAbstract: The quantitative analysis of W, Sn,Mo,Nb, Ta, V in manganic concerntrate samples were tested using ICP-OES with Na2O2 fusion. The reliability of the methodhas been tested by determination of these elements in rock and mineral NationalStandard Reference samples and the results are in agreement with certifiedvalues with the precision of less than 5.0% RSD(n=11).Recoveries for differentelements are between 99.5% and 105%.Key words:InductivelyCoupled Plasma –Optical Emission Spectrometry,manganic concerntrate,fusion, Simultaneous Determination自然界中的锰呈化合物存在,具有工业意义的大部分是锰的氧化物和碳酸盐矿物(见表)。锰矿石的工业类型有碳酸锰矿石、氧化锰矿石、混合锰矿石及多金属锰矿石等。中国的锰矿以碳酸锰矿石为主,铁锰矿石次之,还有氧化锰矿石、混合锰矿石及多金属锰矿石。其中含有大量的有价值的多金属矿。准确了解这些主要元素的含量,具有重要的意义。在矿石样品的分析中,国家标准方法主要采用原子吸收光谱法测定各元素的含量。原子吸收法具有一定的缺陷,不能同时测定多种元素。而电感耦合等离子体原子发射光谱法(ICP-OES)具有线性范围宽、灵敏度高、多元素同时测定等优点。在样品分析测试中,电感耦合等离子体原子发射光谱法已得到广泛应用;但是利用ICP-OES法同时测定岩矿中高含量的砷、锑、锡、钨、钼、铌、钽、钒,文献报道较少。固体地球化学样品的溶解一般有混合酸消解法、碱熔消解法两类。虽然HCl-HNO3-HF-HClO4混合酸能溶解大多数金属元素,如铜、铅、锌、镍等元素,但对于高含量的难溶金属元素,过氧化钠碱熔是个不错的选择。本文采用锆坩锅为容器,过氧化钠为熔剂,高温熔融,盐酸提取,以Eu为内标元素,采用内标校正法,用ICP-OES测定岩矿中高含量的砷、锑、锡、钨、钼、铌、钽、钒。研究了试样熔融时间、熔剂量、盐酸量对试样溶解结果的影响,选择了仪器的最佳工作条件,消除了对被测元素和被测元素之间的干扰,用有证标准物质验证,测定值与标准值一致,本法简便易行、快速准确。1 实验部分1.1 仪器及工作参数Varian735ES ICP-OES电感耦合等离子体原子发射光谱仪(美国瓦里安公司),功率[/fon
各位高手:你们有没有做代森锰锌含量的?分析时应注意什么问题?我们做时含量相差太远.不知为何?
各位 今天突然要求测锰含量测定,硅铁中硅含量测定 ,你们谁有方法 介绍下可以么,详细的那种,以前没有做过。谢谢
磷铁中锰含量的测定,在样品处理,标准线制定的过程中。将含量0.47的标样使用氢氟酸跟硝酸溶解过程中,是否需要加盖子。在加热过程中?
AK-QC203-1/AK-QC203-2 滤膜中锰含量的测定AK-QC209-1/AK-QC209-2滤膜中铬含量的测定。有谁做过这两个的含量,是否能告诉我一下结果
有感于这一贴http://bbs.instrument.com.cn/shtml/20120604/4073295/,说说我的看法 我这里有几个问题,你这个结论有点危言耸听:第一,你的第一点论据,只是说明你不了解茶叶,普洱茶是越陈越香,所以一般普洱茶年限越长,价格也就越高,所以普洱茶中为了掩盖普洱茶的真实年限以及保证茶汤的通透,加入高锰酸钾,这个我不置可否;但是红茶没有越陈越好这一说,而且红茶跟黑茶以外的所有茶叶一样,越新越好,所以也没用必要人为加入高锰酸钾,四价锰离子遇茶多酚色泽变黄,从感官评价的角度上来讲,加入高锰酸钾对茶叶进行浸泡也不可能成立,一般只要有一点感官基础的人都可以很清楚的喝出其中的差异,所以你的论据不成立,一般的茶叶中无必要也不可能使用高锰酸钾,从茶叶感官评价的角度也难以通过;第二,关于你的第二点论据,18g茶叶锰的提取量是17.7mg,也就是说接近1g/kg,但是茶叶中锰大部分是螯合状态存在的,也就是大部分不溶于水,你是如何得出超标79倍的结论?!而且每天18g茶叶有这么高消耗量的人非常少。第三,换一句话说,就算真的是如你所说,有1g/kg的含量,但是溶于水中也最多只有30%,那么就是5.2mg,就是说人体每日从茶叶中摄取最多不超过5.2mg,但是你每天吃的蔬菜锰含量你了解过吗,大米呢?!按照每天主食1kg来计算,你觉得谁超标以后对人体的危害更大呢?!第四,水中的铁不超过0.3mg/L,那么你能以此来判断菠菜汁中铁超标多少倍了吗,显然菠菜富含铁,但是我想问一句:生活饮用水是判断菠菜汁的标准吗?!或者说水中氯离子有一个限定,你能据此判断你做的汤(加了盐的)氯离子超标了吗?显然是无稽之谈,因为水有水的标准,就像氯化钠有氯化钠的标准一样,不能以水中的氯离子含量来说明氯化钠中氯超标了,这样的说法只能说比较搞笑。第五,国家基本上很少有食品对锰的含量作要求,肯定有他的原因,锰对人体的危害,最好能够拿出FDA或者世界粮农组织的毒理学报告作为结论,一般成年人每日摄入5mg锰属于正常,但是每日摄入多少算超标,这个我没有查到,就像铁离子一样!所以此贴的标题实际上是个大大的噱头,无非就是吸引大众的眼球而已,另外楼主可能不知道茶多酚可以螯合锰离子,无论是二价或者四价锰离子,而且茶多酚有着良好的抗氧化性,并能很好清除人体自由基,锰在茶叶中没有国家标准,此贴作者移花接木的做法无非就是为了吸引大家的关注,但是我只能说结论及其不可靠。 另外,如果作者真的想做一个严肃的话题就找些严肃点的论据,危言耸听不好!!!
求锰酸锂中锰含量的方法!谢谢各位!
请问锰含量的检测有哪些方法,哈希粉包测定是什么原理,显色是橙色是怎么反应的

自来水中铁锰含量测定【摘要】本文用原子吸收分光光度计测定自来水中铁、锰含量,结果表明,铁含量为0.099mg/L、锰含量为0.109mg/L,实验的方法检出限、精密度、加标回收率满意,此方法可以满足水中铁锰含量测定。【关键词】自来水铁锰原子吸收分光光度计 铁、锰元素是人体买不可缺少的微量元素。人的体内缺铁,会得缺铁性贫血等疾病,直接影响身体健康。人体内所需要的铁锰主要来源于食物和饮水,一般认为铁锰过多对人体无害,其实则不然,饮用水铁锰过多,可引起食欲不振、呕吐、腹泻、胃肠道紊乱等,研究证明人体中铁过多对心脏有影响,甚至比胆固醇更危险。因此,自来水中铁锰含量测定是很重要的。根据我国《生活饮用水卫生标准》GB5749-2006中规定铁含量≤0.3mg/L,锰含量≤0.1mg/L。 在《水质铁、锰的测定》GB 11911-89中规定,水质中铁、锰用火焰原子吸收分光光度法测定。1、实验部分1.1、仪器及试剂仪器:TAS990-原子吸收分光光度计、铁锰空心阴极灯、容量瓶、移液管等标准溶液:1000ug/ml铁、锰标准储备液1.2、仪器条件http://ng1.17img.cn/bbsfiles/images/2013/11/201311141758_477281_2352694_3.jpg1.3、样品采集用硝酸浸泡后洗净的聚乙烯瓶盛装样品,样品为实验室自来水。2、结果与讨论2.1、标准曲线绘制用1000ug/ml铁、锰标准储备液逐级吸收,配置系列标准溶液,在仪器条件下测定标液和样品,并绘制标准曲线。http://ng1.17img.cn/bbsfiles/images/2013/11/201311141759_477282_2352694_3.jpg2.2、检出限计算测定空白溶液6次,计算标准偏差,3倍空白溶液的标准偏差即为方法检出限。http://ng1.17img.cn/bbsfiles/images/2013/11/201311141800_477283_2352694_3.jpg2.3、实验结果及精密度计算样品测定6次,实验结果及精密度见下表所示http://ng1.17img.cn/bbsfiles/images/2013/11/201311141800_477284_2352694_3.jpg2.4、加标回收率计算http://ng1.17img.cn/bbsfiles/images/2013/11/201311141800_477286_2352694_3.jpg3、结论3.1、实验室用自来水中铁含量为0.099mg/L,满足《生活饮用水卫生标准》中对于铁元素含量的规定,锰含量为0.108mg/L,稍高于《生活饮用水卫生标准》中对于锰元素含量的规定。3.2、实验中铁和锰的方法检出限分别为0.039ug/ml和0.015ug/ml,精密度分别为14.08%和5.69%,加标回收率分别为102.0%和95.0%。实验结果中,铁测定是精密度较差的原因是水中铁元素含量太低导致。
氟离子选择电极法测定食品中氟化物含量摘要 用氟离子选择电极法来测定食品中氟化物含量,探讨了该法中不同总离子强度调节缓冲液(TISAB)及不同的TISAB中柠檬酸钠浓度和pH值对食品中氟含量测定过程中它们消除Fe3+和Al3+干扰的能力。结果表明:柠檬酸钠作为TISAB中的络合剂对消除食品样液中Fe3+和Al3+的干扰消除能力最强,当TISAB中柠檬酸钠浓度达68g·L-1时,对其样液中低于25mg·L-1的Al3+干扰消除最好;实际样液测定时TISAB消除Al3+干扰的最合适的pH为5.0。选取优化的TISABⅢ作为氟离子选择电极法所用的总离子强度调节缓冲液,进行食品中氟化物含量测定,是一种简便、快捷、定量准确的测定食品中氟化物的方法。关键词 氟离子选择电极法; 氟化物含量测定;TISAB; 条件优化中图分类号: 文献标识码: 文章编号:收稿:2012.3.19Fluoride Ion Selective Electrode Method for the Determination of Fluoride Content in foodAbstract This article focuses on the fluoride ion selective electrode method to determine the fluoride content of food, and discusses the different total ionic strength adjustment buffer TISAB and different sodium citrate and pH in the Act on the Determination of fluorine content in foodthe TISAB elimination of Fe3 + and Al3 + interference in the process. The results showed that: less than 25mg L-1sodium citrate as complexing agent in the TISAB The strongest ability to eliminate the interference of the sample solution of Fe3 + and Al3 + TISAB in sodium citrate concentration of 68g L-1 in the sample solution Al3 + interfere with the elimination of the b
各位老师,如何测培养基中二价锰四价锰含量?
如果是纯锰,那换算成MNo2的含量又对不上,因为标签上标示TMn含量为25.24,而Mno2是36.92.........请大家指点!
各位老师,如何测培养基中二价锰四价锰含量?
哪位朋友有石英砂中锰含量的测定方法,急需啊?
氯离子含量快速测定仪北京耐尔公司是专业研究及生产混凝土耐久性试验设备的制造商。产品包括:混凝土电通量测定仪、氯离子扩散系数测定仪、氯离子含量快速测定仪等。氯离子含量快速测定仪采用离子选择电极法(ion selective electrode,ISE)ISE法,可快速测定混凝土、砂石子、外加剂等氯离子含量,氯离子浓度的量测范围在1.0 x10-5~1.0 x10-2mol/L。设备操作简便,数据准确快速,全自动数据处理,是目前快速测定氯离子含量的先进电测产品。可测定混凝土、砂石子、外加剂、水等氯离子含量检测浓度范围在1.0 x10-5~1.0 x10-2mol/L可连续自动记录测试数据,数据具有重现性北京耐尔公司张晶96096953 82755675www.cnnel.comwww.cnnel.netadminhr@cnnel.com
如何测锰酸锂中铌的含量?
有用原吸做过土壤铁,锰全含量的吗?有什么好的前处理方法?这前处理方法有国家标准,或者行业标准方法吗?
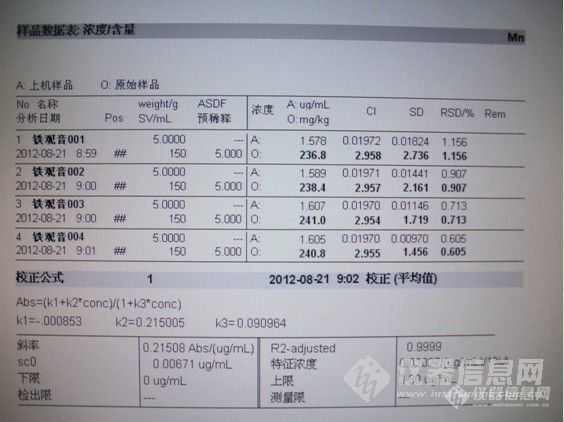
本来不想参与茶叶浸出物中锰含量的这个活动,但是已经组队参加信息网第五届原创大赛了,所以就忙里偷闲捎带检测一下锰含量,一来参加锰含量检测活动,二来顺便检测其它元素捎带参加第五届原创大赛,一举两得。(想回复帖子请进第五届原创大赛帖子回复http://bbs.instrument.com.cn/shtml/20120821/4201106/)由于发表后突然想到可以参加第五届原创大赛,所以就锁定此贴,重新发布了一次。1、样品来源同事去福建出差,说是购买的当地新茶——安溪铁观音,给了我一盒,让品尝一下,鄙人平时就喝白开水,所以也没有泡茶喝过,不过这次刚好用上,顺便测测这个所谓的新茶,看看到底浸出物里面锰含量有多高,但愿同事购买的时候不是上当受骗滴(不是安溪铁观音的牌子,就是顺便测测,含量到底多少,这个其实国家中没有明确限量,所以多少就是多少,意义不大,到底国家标准以后是不是规定茶叶中的锰含量,这是国家的事情,和鄙人关系不大,也就是参与一下活动而已),茶叶是铁盒子装的,里面包装也很精美,见照片。http://ng1.17img.cn/bbsfiles/images/2012/08/201208211237_384958_1751239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211237_384959_1751239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211238_384960_1751239_3.jpg2、测定打开包装,称取5克茶叶,用烧开的超纯水150mL在烧杯中浸泡40分钟后过滤,然后做锰标准曲线,直接上火焰测定,由于浓度太高,继续稀释5倍后测定出结果。(见照片)http://ng1.17img.cn/bbsfiles/images/2012/08/201208211248_384964_1751239_3.jpg 撕开茶叶包装http://ng1.17img.cn/bbsfiles/images/2012/08/201208211249_384965_1751239_3.jpg 称取样品5.240ghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211251_384966_1751239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211251_384967_1751239_3.jpg 用热水壶把超纯水烧沸腾http://ng1.17img.cn/bbsfiles/images/2012/08/201208211253_384970_1751239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211252_384968_1751239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211252_384969_1751239_3.jpg 用沸水浸泡40分钟http://ng1.17img.cn/bbsfiles/images/2012/08/201208211255_384971_1751239_3.jpg 用滤纸过滤http://ng1.17img.cn/bbsfiles/images/2012/08/201208211255_384972_1751239_3.jpg 超纯水的火焰颜色http://ng1.17img.cn/bbsfiles/images/2012/08/201208211256_384973_1751239_3.jpg 过滤后的茶溶液及火焰颜色http://ng1.17img.cn/bbsfiles/images/2012/08/201208211257_384974_1751239_3.jpg 直接测试茶叶浸出物超过了标准曲线线性http://ng1.17img.cn/bbsfiles/images/2012/08/201208211258_384975_1751239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211259_384977_1751239_3.jpg 容量瓶将茶浸出液稀释5倍后测定http://ng1.17img.cn/bbsfiles/images/2012/08/201208211300_384978_1751239_3.jpg 锰标准曲线http://ng1.17img.cn/bbsfiles/images/2012/08/201208211300_384979_1751239_3.jpg 测定稀释5倍后的溶液浓度1.6mg/Lhttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211302_384981_1751239_3.jpg 茶浸出液中锰含量239mg/kghttp://ng1.17img.cn/bbsfiles/images/2012/08/201208211302_384982_1751239_3.jpg 最终含量报告单3、讨论从此次测定结果可以看出,茶叶中的锰含量还真的不低,沸水浸泡40分钟后测定平均值为1.59mg/L,计算后原始茶叶含量239.25mg/kg(注意:这只是浸泡液的计算结果,如果直接把茶叶用硝酸消解后测定锰的结果比这个含量应该高很多,有兴趣的版友可以用微波消解后测定完成,这里不再赘叙),浸泡液的含量如此之高,情何以堪?到底国家今后是不是要做一个专门的限制标准,不好说,不过我就是参与一下这个活动,至于今后修订不修定相关限值标准,我不关心,呵呵,因为我就喝白开水,现在感觉没有什么安全的食品,尽量喝白开水,虽然说水的污染也可怕,但是至少还行,也许信息网的这个活动能让国家相关人员看到,祈祷能修订相关限值标准吧。(既然测定了锰的含量,那么一发不可收拾,我就把铅镉铁铜锌也做个测定吧)
请教锰锌铁氧体中锌含量如何检测?