钨灯丝电镜想拍植物叶片看看细胞结构,想知道怎么制样?
各位大佬请教个问题 使用钼蓝比色法测定植物叶片无机磷 为什么不显色呢?

[size=16px] 植物冠层分析仪是用于研究植物群落结构、生长和生态系统功能的仪器。测量植物叶片的平均倾角是其中的一个重要参数,它可以揭示植物在空间上的排列方式、生长状态以及对光能的吸收利用情况。以下是一般情况下植物冠层分析仪测量植物叶片平均倾角的基本步骤: 仪器设置和安装: 安装冠层分析仪,确保其与被测量的植物位于适当的距离和角度。通常,仪器需要放置在离植物适度远的位置,以获取整体叶片分布的信息。 数据采集: 冠层分析仪通常会发射激光束或其他传感信号,然后测量信号的反射或传播情况。这些信号在与植物叶片交互时会发生变化,从而可以推断出叶片的倾角信息。 数据处理: 仪器收集到的数据需要进行处理,以计算出植物叶片的平均倾角。处理的方法可能因仪器型号和工作原理而异。一种常见的方法是基于接收到的信号强度变化来计算叶片的角度。 统计分析: 多次测量不同位置的数据,然后对这些数据进行统计分析,以获得叶片的平均倾角。这可以帮助消除单一测量点的误差,并提供更准确的结果。 需要注意的是,不同的植物冠层分析仪可能有不同的工作原理和测量方法,因此在使用特定仪器时,应该参考其使用手册或操作指南,以了解详细的操作步骤和数据处理方法。[/size][align=left] 此外,随着技术的不断发展,可能会有新的方法和技术用于测量植物叶片的平均倾角,所以建议在实际操作中保持关注最新的技术进展。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308251019084435_6824_6098850_3.png!w690x690.jpg[/img][/align]

植物的叶片一般由上表皮,叶肉组织,下表皮,保卫细胞,气孔五个部分组成,由于下表皮含有保卫细胞和气孔两个组织,在实验中一般选择植物叶片下表皮细胞来观察植物叶片生长发育情况。而植物下表皮作为叶片一部分,而且十分轻薄,要怎样快速的获得该组织呢?http://ng1.17img.cn/bbsfiles/images/2017/10/2015071521495131_01_3021049_3.png我搜查了一下有关剥离植物叶片下表皮的方法。包括有透明法,铬酸离析法,指甲油、琼脂等物质的印拓法和次氯酸钠离析法等。不过指甲油和琼脂的印拓法的指甲油和琼脂在显微镜下影像模糊,影像气孔数据统计,而次氯酸钠离析法剥离下表皮操作时比较复杂,以上这些方法都相对来说操作较复杂。对于一般的叶片,比如玉米,可以有最简便的办法。方法一是直接撕取法,选取一些相对老的叶片较容易剥离,手指夹紧叶片,用尖头夹紧一小片,直接撕取,在撕下的叶片边缘会有一些只有下表皮层,这个方法要多试几次。方法二,胶带撕取法。先用刀片在叶片背面轻轻的划一些小道,要轻轻的,不能划穿了叶片。然后用胶带粘住叶片,可以用力按压,然后快速撕下胶带,在胶带上会沾上下表皮层,可以直接观察。http://ng1.17img.cn/bbsfiles/images/2017/10/2015071522180481_01_0_3.jpghttp://ng1.17img.cn/bbsfiles/images/2017/10/2015071522181077_01_3021049_3.jpg本人推崇简单,一般采用下面两个最简单的办法。下面是拍摄的图片。接下来想做叶片纵切,不知道大家有谁有简便的叶片纵切方法,希望能一起交流。http://ng1.17img.cn/bbsfiles/images/2015/07/201507152224_555710_3021049_3.jpg
请问测定“植物叶片水势”的仪器?哪里有?
GCMS测植物叶片代谢产物(氨基酸、有机酸、糖))前,样品处理的标准化,应该怎么处理植物叶片,从采摘下后,越详细越好,非常感谢
扫描电镜能否观察植物细胞器尊敬的老师们,大家好!我做了植物叶片的断面,看了其中的细胞器,发现细胞里面全都是大小不一得圆颗粒,但是分不清是什么细胞器,请问扫描电镜能否观察细胞器,由于细胞经过干燥处理后,里面的细胞器自然就分散开来,细胞仪破碎后,细胞器全部掉出,请问大家有没有什么好办法可以看见细胞里面的细胞器呢?补充一下:如果想用扫描电镜观察植物叶片的断面,应当怎么操作?在固定之前就用刀切断,还是干燥完了之后切呢?我在干燥之后掰断的叶片,发现细胞都是破的,而且很不整齐。
请教各位元素分析仪可以测定植物叶片的全N 吗?用来计算光合N利用率好象一般都是用凯式半微量定氮法,凯式定氮法请问他们有什么区别吗?什么做的好呢?
看了一篇文章,说植物吸收汞的主要方式是通过叶片吸收的(室外,垃圾焚烧厂附近),不知道是不是因为汞易挥发的原因?那么对于其他重金属呢?pb、cd?请大家给个解答
光照培养箱介绍光对植物生长分解叶片空气中碳 光照培养箱介绍:绿色植物需要光进行光合作.居室的进光量变化极大,它不仅依窗户的大小,位置不同而不同,而且依季节,天气,室外遮蔽光线的树和建筑物而变化. 南墙:南墙的玻璃门或落地窗能充分满足采光要求.在南面窗的前面白天都有明亮的光线,但光线的强弱或距离窗户的远近有关,离窗户越远,光线越弱.在窗户两侧的光线相对较弱.此处适合摆放一些喜阳的植物,尤其适合摆放株型较高大的绿色植物,它能充公利用从地板到天花板整个空间的光线. 当然,空气中所有碳和水中所有氢不一定都是植物可利用的,它们必须保持一定核旋速以下,否则不可能在植物体中结晶,旋速高了还会蒸发出体外。光照培养箱介绍这就是为什么高海拔或岗地不利植物生长的重要原因,这些地方不利重气体停留或堆积,光照度好的低海拔或洼地是植物生长的良好环境,当然植物生长还要一定的风摆作用,否则不利营养输送。 植物生长,光起到分解叶片内空气中的碳,分解根部输送来的水中氢,然后碳氢输送到冷环境(植物背光处)结晶形成植物体。所以说:光对植物的作用不是“光合”而是“光解”,因此,要想让植物生长的快必须提高上下温差或昼夜温差,水和化肥就是用来降低根部温度的,当然水中低能氢是植物必须的。农家肥不能为植物提供必须营养,它的作用只是培养微生物,利用微生物活动提高土壤透气透水性。 信息来自:光照培养箱 人工气候箱
[color=#DC143C]大家好,本人新手,问一个初级问题,麻烦有知道的帮忙给解答下,十分感谢! 我打算用[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用仪[/color][/url]对植物叶片的化学成分做一个分析,从文献上看前人大多是用GC-MS分析植物叶中的挥发油成分,但我想对植物叶中乙醇提取液、丙酮提取液中的化学成分做个全面分析,而其中大多是不易挥发成分,且其中应该还有蛋白质等生物大分子物质的干扰,怎样预处理一下样品才能达到最好的效果?[/color]

摘要: 本小论文利用GC-MS测定了两种含有特殊脂肪酸植物(琉璃苣和报春)叶片的脂肪酸含量和种类,提供了提取植物叶片脂肪酸的方法,并对实验结果进行了简单的分析和讨论。前言: 多不饱和脂肪酸是重要的生物营养物质,指含有两个或两个以上双键并且碳链长度为18~22个碳原子的直链脂肪酸。它们在机体内发挥着重要的生理功能和生物学效应。其中,亚油酸(LA)及亚麻酸(ALA)被公认为人体必需脂肪酸,可进一步衍生为具有不同功能的高度不饱和脂肪酸,如花生四烯酸(AA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等。 人体自身不能合成亚油酸和亚麻酸(所以这两种脂肪酸被称为必需脂肪酸),但是却含有进一步合成更长链多不饱和脂肪酸的酶。而高等植物体内都能合成亚油酸和亚麻酸,但却不能合成进一步合成更长链脂肪酸的酶,也就不能不能合成多不饱和脂肪酸。仅有少数高等植物如月见草,琉璃苣,报春等能合成利用亚油酸和亚麻酸的Δ6-脂肪酸脱氢酶,因而可以进一步合成γ-亚麻酸(GLA)和十八碳四烯酸(OTA)。二者在人体内都具有重要的生理功能。GLA是重要的前体物质,可合成AA、前列腺素等,同时GLA还有降血脂、减肥、抗血栓性心血管疾病等生物学功能。OTA是EPA和DHA的前体,可以有效缓解与EPA和DHA缺乏有关的生理疾病。 琉璃苣,为紫草科琉璃苣属植物,1年生草本,果实为小坚果,主要分布在欧洲与非洲地区。报春,为报春花科报春花属植物,一年生草本,果实为小坚果,主要分布于北温带,少产于南半球,是一种重要的观赏植物。这两种植物种子都含有丰富的GLA和OTA,但对于其叶片脂肪酸种类却鲜有报道,这里利用GC-MS检测了两种植物叶片的脂肪酸组成及含量。http://ng1.17img.cn/bbsfiles/images/2012/11/201211271753_407677_1306303_3.bmp 图1:琉璃苣植株及花器官(图片来源于网络)http://ng1.17img.cn/bbsfiles/images/2012/11/201211271754_407678_1306303_3.jpg图2:报春植株及花器官(图片来自网络) 气相色谱-质谱联用仪(GC-MS)是油脂研究中的常用仪器之一。组成油脂的脂肪酸部分大多容易气化,在试验中,常利用GC-MS检测油脂中脂肪酸的组成及含量。这里用GC-MS检测报春及琉璃苣叶片中脂肪酸组成及含量。实验材料及采用仪器:1 实验材料: 自己栽培的琉璃苣及报春。2实验主要仪器: 恒温水浴锅,氮气吹干仪,PerkinElmer GC-MShttp://ng1.17img.cn/bbsfiles/images/2012/11/201211271756_407680_1306303_3.png图3 恒温水浴锅http://ng1.17img.cn/bbsfiles/images/2012/11/201211271756_407681_1306303_3.jpg图4 氮气吹干仪http://ng1.17img.cn/bbsfiles/images/2012/11/20121127
我想用ICP-AES分析植物叶片中的硫含量,请问叶片前处理有哪些方法?用微波消解或敞开式酸消解可行吗?具体的试剂配比是怎样的?
一、实验目的 通过采用改进的SDS法提取植物叶片基因组DNA,使学生学习和掌握从植物组织中提取DNA的方法和原理。二、实验原理 基因组DNA的提取通常用于构建基因组文库、Southern杂交、RFLP、PCR分离基因和分子标记分析等。利用基因组DNA序列较长的特性,可以将其与细胞器或质粒等小分子DNA分离。加入一定量的异丙醇或乙醇,大分子的基因组DNA形成沉淀,而小分子DNA则附于管壁及管底,通过离心方法即可将它们分离,从而达到提取的目的。在提取过程中,若操控不当,基因组DNA会发生机械断裂,产生大小不同的片段,因此分离基因组DNA时应尽量在温和的条件下操作,如尽量减少酚/氯仿抽提、混匀过程要轻缓等,以保证得到较完整的基因组DNA。一般来说,构建基因组文库,初始DNA长度必须在100kb以上,否则酶切后两边都带合适末端的有效片段很少。而进行RFLP和PCR分析, DNA长度可短至50kb, 在该长度以上,可保证酶切后产生RFLP片段(20kb以下),并可保证包含PCR所扩增的片段(一般2kb以下)。不同生物(植物、动物、微生物)的基因组DNA的提取方法有所不同; 不同种类或同一种类的不同组织因其细胞结构及所含的成分不同,分离方法也有差异。在提取某种特殊组织的DNA时可参照文献和经验建立相应的实验方法, 以获得可用的DNA大分子。组织中的多糖和酶类物质对随后的酶切、PCR反应等有较强的抑制作用,因此用富含这类物质的材料提取基因组DNA时, 应考虑除去多糖和酚类物质。三、实验仪器和材料 台式高速离心机恒温水浴陶瓷研钵1.5ml 离心管移液器无菌枪头无菌牙签液 氮吸水纸四、实验试剂 DNA提取洗涤液100 mmol/L Tris•HCl(pH8.0),3%可溶性PVP,20 mmol/L 巯基乙醇,20 mmol/L EDTA(pH8.0))DNA裂解液(100 mmol/L Tris•HCl(pH8.0),20 mmol/L EDTA(pH8.0),500 mmol/L NaC1,1.5%SDS)酚/氯仿/异戊醇(v:v:v=25:24:1)5M KAc无水乙醇异丙醇70%乙醇含5g/ml RNase 的TE缓冲液
银杏叶片(1)PA萃取头,叶片清洗晾干,45-50度水浴,萃取30min。GC/MS,DB-5MS柱,50度保持1min;15度/min升到200度,保持5min;10度/min升到280度,保持5min。解析1min,NIST02库。测定成分:12种,酸(壬酸、十四酸、十五酸、十六酸);丁羟甲苯;酮(6,10,14-三甲基-2-十五烷酮,二苯甲酮);苯酚(4,6-二特丁基-2-甲基苯酚);3-甲基-2-丁烯醇;5,7-二甲基-1,8-嘧啶-2-氨;1-甲基-9-4-吡哆吲哚-7-醇;1-苯-5-(1-蒎)-4-己烯-2-炔酮。(2)50/30 µm DVB/CAR/PDMS萃取头。叶片擦净污渍,45度平板保温30min萃取。GC/MS,RTX-5MS。柱初温35℃,保持2 min,以6℃/min上升至100℃,再以8℃/min上升至140℃,随后以12℃上升至250℃,保留3 min。NITSO8和NITSO8S数据库。测定成分:醇(1-戊烯-3-醇,2-戊烯-1-醇,己醇,叶醇,1-辛烯-3-醇);醛(3-己烯醛,2-己烯醛,壬醛,葵醛);其他(5-乙基-2(5H)呋喃酮,2-戊基呋喃,2-甲基-3-庚酮),还有酸、酯(2-氧-乙酸甲酯,乙酸叶醇酯)等。不知道两种具体方法测定结果为什么差别这么大?谢谢
刚才我们的问题还少了一个,请各位前辈帮我分析一下我上传2个光谱图,一个是叶片对照,一个是叶片逆境处理的。
采用SPME方法测定植物叶片挥发物时,有下列几种物质,是否是萃取头释放的呢?测定时有几种硅类化合物,很容易排除了。采用的50/30 dvb/car/pdms萃取头,40度下萃取30分钟。我没有做空针的样,下次实验时补上。这次分析数据请教下大家。Diphenylene,联苯烯,亚联苯,C12H8;Dibenzofuran,环氧联苯,C12H8O;3-Methyl-biphenyl,3-甲基-联苯,C13H12;Acenaphthylene,1,8-亚乙基萘,C12H8;Diethyl phthutale,邻苯二甲酸二乙酯C12H24O4特别是联苯烯和邻苯二甲酸二乙酯,在所有测定中都出现了。是因为看到版主发的另一个帖子突然想到的这个问题,这些物质在参考文献中没有出现过,查其性质好像在植物中也不太可能出现,特来请教。谢谢大家!
植物叶片中DNA的含量大概占多少,可以使用近红外来分析吗?近红外分析下限是千分之一,求各位大侠指教。
我要做一个实验,将植物叶片放进一个盛溶液的容器当中,需要将植物叶片的水分抽空,并且让溶液渗透进去,这样叶片就会在沉入液体中,但是前提是我选用的溶液只有在4°左右的环境中才能保持其活性,请问各位老师,大侠我需要用什么仪器比较合适啊!!http://simg.instrument.com.cn/bbs/images/default/emyc1004.gif谢谢!!!
[size=16px] 叶面积测量仪通常用来测量植物的叶片表面积,而不是叶片的长度。如果您想测量植物叶片的长度,您可以考虑使用一个普通的尺子或者显微镜测量。以下是如何使用叶面积测量仪来测量叶片表面积的步骤: 准备工作: 确保您有一台叶面积测量仪,通常它由一个扫描仪和适用于测量的软件组成。您还需要植物的叶片样本。 准备叶片样本: 从植物中选择您想要测量的叶片样本。尽量选择完整、健康的叶片,并在测量前将其清洁干净。 扫描叶片: 将叶片放在叶面积测量仪的扫描台上。根据仪器的使用说明,启动扫描仪,它将会自动扫描叶片的表面。 分析数据: 扫描仪将生成一个叶片的图像,并提供叶片的表面积数据。您可以使用附带的软件或其他图像处理软件来测量叶片的总表面积。通常,这涉及在图像上勾画叶片的边界,然后软件会计算出所勾画区域的面积。 保存结果: 一旦测量完成,您可以将测量结果保存下来,以备将来参考或记录。 需要注意的是,叶面积测量仪测量的是叶片的二维表面积,而不考虑其长度、宽度和形状等其他参数。如果您对测量叶片的长度感兴趣,云唐建议您可能需要使用传统的测量工具,如尺子、标定尺或显微镜来进行测量。[/size]
[size=16px] 叶面积测量仪是用来测量植物叶片表面积的设备。植物叶片的形状和大小因植物种类、生长状态以及环境条件而异,因此平均叶面积会根据这些因素而有所不同。 要测量植物的平均叶面积,通常需要采取一定数量的叶片样本,并使用叶面积测量仪测量每片叶片的表面积,然后计算这些样本叶片的平均值。平均叶面积的单位通常是平方厘米(cm2)或平方米(m2),取决于叶面积测量仪的精度和所使用的单位制。 由于不同植物之间存在巨大的变异性,无法提供一个通用的平均叶面积数值。如果您想要测量特定植物的平均叶面积,云唐建议您需要在具体的实验或调查中使用叶面积测量仪进行测量。记住,同一植物在不同生长阶段、生长条件下的叶面积也会有很大的变化。[/size]
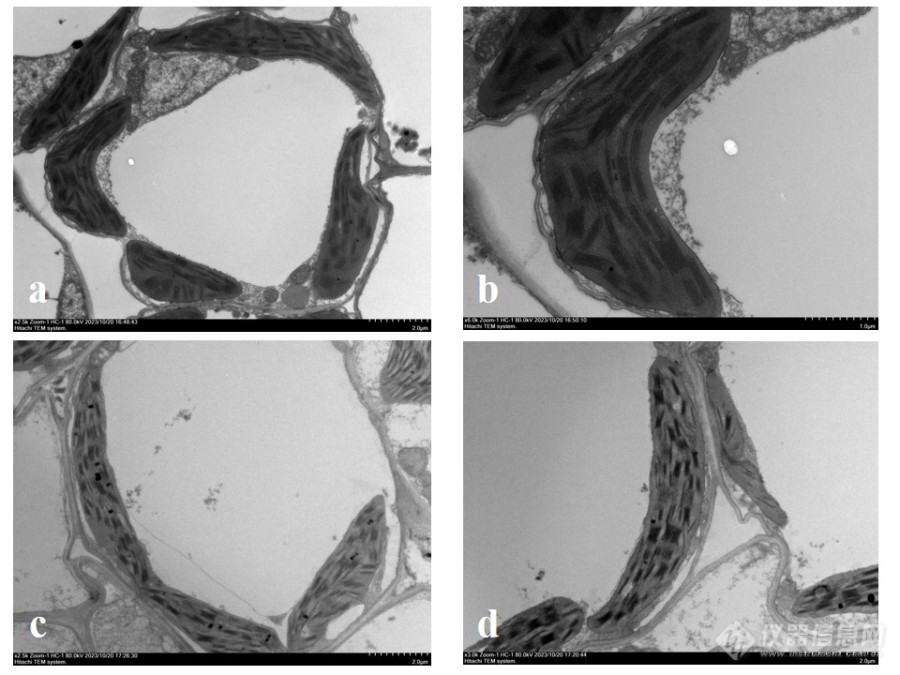
[align=center]不同环氧树脂对水稻叶片超微结构的影响[/align][align=center]吴佳楠[url=#footnote_1]1[/url][font=times new roman][size=13px],张丽娜[/size][/font][font=times new roman][sup][size=13px]2[/size][/sup][/font][/align][align=center](中国农业科学院 作物科学研究所 重大平台中心,北京 100089)[/align]摘要:树脂包埋是制备超薄切片前的关键一步,良好的包埋效果是保证超微结构真实的保证,不同的包埋剂根据其自身特点对样品包埋过程产生不同的影响。本文以水稻超微结构为例,对比实验室常用的两种环氧树脂spurr和epon812的包埋效果,发现spurr的包埋效果整体上要优于epon812,但是在干燥的环境下,epon812包埋效果较好。关键词:树脂;spurr;epon812;水稻叶片实验室常用环氧树脂spurr和epon812均可以用于制备水稻叶片超薄切片,其中spurr树脂的流动性好、黏度小,常用于植物组织的包埋;epon812由于黏度大、易吸潮,较少的用于植物组织。但因为epon812具有高度反差和良好的切割性能,在保证环境湿度的前提下,epon812也可以用于植物组织的渗透包埋。本文以水稻叶片为例,通过相同的样品制备流程,对比spurr和epon812在不同环境条件下的包埋效果,spurr树脂的整体包埋效果,如切片的平整度和衬度要优于epon812,但是在干燥环境中epon812包埋的样品,其切片的平整度和衬度要优于spurr,并且在切片的时候无需采用氯仿薰片,即可获得平整的超薄切片。1[font=宋体] 实验方法[/font]1.1取材取新鲜的水稻叶片,蒸馏水清洗表面杂质,用干净的双面刀片切成1mm[sup]3[/sup]大小的组织块,立即投入2.5%戊二醛+4%多聚甲醛固定液中抽真空固定24h[font=calibri][sup][1][/sup][/font]。1.2清洗、脱水固定完成的水稻叶片经0.1mol PB清洗后采用30%、50%、70%、90%、100%、100%丙酮依次脱水10min。1.3树脂渗透分别配置spurr和epon812树脂,具体配方见表1和表2。采用丙酮:树脂为1:1和1:3的比例配置spurr和epon812的树脂渗透液,每个梯度渗透12小时。纯树脂渗透2次,每次24小时树脂渗透过程需辅助旋转装置,保证渗透完全[font=calibri][sup][2][/sup][/font]。[align=center]表1 spurr树脂配方[/align][table][tr][td][align=center]树脂单体[/align][/td][td][align=center]质量(g)[/align][/td][/tr][tr][td][align=center]ERL-4221[/align][/td][td][align=center]10[/align][/td][/tr][tr][td][align=center]DER-736[/align][/td][td][align=center]4[/align][/td][/tr][tr][td][align=center]NSA[/align][/td][td][align=center]26[/align][/td][/tr][tr][td][align=center]DMAE[/align][/td][td][align=center]0.4ml[/align][/td][/tr][/table][align=center]表2 epon812树脂配方(Luft配方,1961)[/align][table][tr][td][/td][td][align=center]树脂单体[/align][/td][td][align=center]质量(ml)[/align][/td][/tr][tr][td=1,2][align=center]A液[/align][/td][td][align=center]Epon812[/align][/td][td][align=center]62[/align][/td][/tr][tr][td][align=center]DDSA[/align][/td][td][align=center]100[/align][/td][/tr][tr][td=1,2][align=center]B液[/align][/td][td][align=center]Epon812[/align][/td][td][align=center]100[/align][/td][/tr][tr][td][align=center]MNA[/align][/td][td][align=center]89[/align][/td][/tr][tr][td=3,1][align=center]根据湿度将A和B液在使用前混合:[/align][align=center]夏季A:B=1:4;冬季A:B=1:9[/align][align=center]混合后滴加催化剂DMP-30[/align][/td][/tr][/table]1.4包埋聚合spurr和epon812渗透的水稻组织均采用包埋板包埋(包埋板使用之前需在70℃烘箱中过夜,去除微滴水分),其中spurr70℃聚合48h,epon812 40℃聚合6h后60℃聚合42h。1.5切片染色观察聚合好的叶片经超薄切片机切片70nm,捞于铜网上干燥后染色,于HT7700透射电子显微镜下观察,记录实验结果。2 实验结果与讨论2.1干燥环境下两种环氧树脂渗透的水稻叶片及叶绿体[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311528566275_9449_3446098_3.jpg[/img][/align][align=center]图1 干燥环境(北京4、5月份)下spurr树脂和epon812树脂渗透的水稻叶片和叶绿体[/align][align=center]a和b为spurr树脂渗透包埋的水稻叶片及叶绿体;[/align][align=center]c和d为epon812树脂渗透包埋的水稻叶片及叶绿体[/align]图1为干燥环境下spurr树脂和epon812树脂渗透的水稻叶片及叶绿体,从图中可以看出,干燥环境下,两种环氧树脂渗透的水稻叶片切片的平整度和均一性良好,细胞结构清晰、细胞膜完整,叶绿体类囊体层次清晰;且epon812树脂渗透的水稻叶片及叶绿体的衬度较高。2.2干燥环境下两种环氧树脂渗透的水稻叶片及叶绿体[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311528566912_7299_3446098_3.jpg[/img][/align][align=center]图2 潮湿环境(北京6、7月份)下spurr树脂和epon812树脂渗透的水稻叶片和叶绿体[/align][align=center]a和b为spurr树脂渗透包埋的水稻叶片及叶绿体;[/align][align=center]c和d为epon812树脂渗透包埋的水稻叶片及叶绿体[/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311528570282_501_3446098_3.jpg[/img][/align][align=center]图3 潮湿环境(北京6、7月份)下epon812树脂渗透的水稻叶片和叶绿体[/align]图2为潮湿环境下spurr树脂和epon812树脂渗透的水稻叶片及叶绿体,从图中可以看出,潮湿环境下,spurr树脂渗透的水稻叶片及叶绿体结构完整、清晰,叶绿体类囊体层次清晰。而图2中epon812树脂渗透的水稻叶片及叶绿体结构模糊,衬度明显下降;在图3中可以看到叶片呈现“磨砂玻璃”状形态,提示严重吸潮。2.3讨论从实验结果中我们发现,spurr树脂在干燥(本文选择的是北京4.5月份)和潮湿(本文选择的是北京6、7月份)的环境中均能获得良好的切片效果,切片的平整度和均一性较高,切片衬度良好。这是因为spurr树脂的黏度较低(60CPS)[font=calibri][sup][3][/sup][/font],对于有细胞壁限制的植物细胞较友好,容易渗透;而且不易吸潮,即使环境潮湿,也可以获得良好的细胞结构。epon812树脂在潮湿环境下(北京6、7月份)渗透的组织,其切片平整度和衬度较差。主要在于epon812配方中使用的NMA和DDSA均为酸酐,极容易吸潮[font=calibri][sup][4][/sup][/font],而且催化剂DMP-30可以溶于水,尤其是相对湿度在35%以上的环境,会将水分子引入已脱水的组织中,导致组织渗透聚合不良,影响交联反应的均一度和完整度[font=calibri][sup][5][/sup][/font],最终降低切片质量。树脂受到水分子的干扰,切片会呈现出一种被“磨砂玻璃”覆盖的状态,显示出细胞结构模糊不清,对比度下降;树脂渗透不良,会造成细胞结构出现空洞并造成切片的整体支撑度不均一,致使切片出现长条形的褶皱。此外,吸潮的epon812树脂发脆,切片修块时,容易崩断或呈现粉末状态,严重影响切片操作。但是在干燥环境下(北京4.5月份),spurr和epon812树脂渗透的组织切片平整度无较大差异,并且epon812的衬度要优于spurr,这主要是因为epon812分子量和黏度均较大,可以提高切片的整体支撑度,并且epon812中包含两种酸酐成分,与环氧集团的交联反应优于spurr。Epon812树脂的此种特性也决定切片时,epon812不用采用氯仿薰片即可获得平整的切片,减少了氯仿的使用,节约了切片时间[font=calibri][sup][6][/sup][/font]。3 结论本文对比组织切片中常用的两种环氧树脂在水稻叶片的渗透和包埋效果,发现在保证环境湿度的情况下可以可以优先考虑使用epon812树脂,但是对于密度较高、结构坚硬的组织或者环境湿度较大的情况下,则优先考虑spurr树脂。也有文章指出,可以将两者进行混合使用,根据组织的特点选择不同的比例进行渗透聚合,也可以很好的正好两种树脂的优点[font=calibri][sup][3][/sup][/font]。参考文献:黄吉雷,伦璇,刘传荷.水稻叶片透射电镜制样方法探讨[J].电子显微学报, 2018, 37(4):4..曹媛,陈家宝,殷亚方.通过改良超薄切片制样法观察汉代饱水考古木材细胞壁的超微构造[J].电子显微学报, 2022(003):041.杨慧,金良韵,姬曼,等.不同树脂对特殊生物样品包埋效果的比较[J].分析仪器, 2019(5):46-51.吴丽莉,颜永碧,陆月良.使用Epon-812包埋剂的体会[J].解剖学杂志, 1998, 21(06):521.刘庆宏,何幼英.不同湿度下Epon812,Epon618对电镜制样的影响[J].临床与实验病理学杂志, 2015, 31(7):824-825.[color=#333333]Finck.H.Epoxy resin in electron microscopy.J Biophys Biochem Cytol,1960,7(2):27-30[/color][url=#footnote_back_1]1[/url] [font=calibri][size=12px]1作者介绍:吴佳楠,[/size][/font][size=12px]([/size][size=12px]1989-[/size][size=12px]),女(汉族),河北石家庄人,工程师[/size][size=12px].[/size][size=12px] [/size][size=12px]E-mail[/size][size=12px]:[/size][size=12px]wujianan1989@126.com[/size][font=calibri]2[/font][font=calibri][size=12px]通讯作者:张丽娜,[/size][/font][size=12px]女(汉族),辽宁丹东人,副研究员[/size][size=12px].[/size][size=12px] [/size][size=12px]E-mail[/size][size=12px]:[/size][size=12px]zhanglina@caas.cn[/size][font='Times New Roman'][color=#333333] [/color][/font]
在植物样品中,水稻的叶片因含有较多硅,故比较难磨。即便是用机械研磨设备,有时也不容易研细,可以说如果水稻叶片如果研好了,草本植物的叶片就都没啥大问题了。我们是通过在某省农科院的实验室反复试验,得到以下条件提供参考: 1 将离心管编号,对应编号将相应的水稻叶片截成1cm左右的小段,每个离心管中放3段,用镊子夹住中间位置,放入管底。2 分装珠子:内侧两排装2颗5mm珠子和5颗3mm珠子;外侧两排装1颗5毫米珠子和6颗3mm珠子。3 冷冻:将摆好的夹具,放到泡沫盒中,加液氮冷冻,3-5分钟,充分冷冻夹具及管内样品。4 *转速与时间设定:1500转/分钟 3min5 研磨:在上夹具时,要注意一是要带上厚一点的手套,防止被液氮冻伤;一是要迅速,且要保证螺栓拧紧,卡上保险扣。然后,启动研磨。6 取下夹具,使整体离心管盖子向上,在桌面上拍一拍,使样品粉末沉落管底,进行下一步实验。*目前研磨仪的速度可以达到更高,但考虑离心管材质差异,建议一开始不要设定太高的速度,根据实际情况调整。感谢大家的积极回复,虽然没有像样的照片,但我还是很佩服各位的见识,正如“雾非雾”所说,刚研磨出的样品就是粉末状的,细度比咱们平时冲的豆奶,芝麻糊之类的粉末更细一点,但由于在常温下很容易化冻,如果不抓紧处理,这种粉末很快就会变成“菜泥”状,就是给宝宝吃的那种蔬菜泥。 另外其实就像雾非雾所说,很多实验室也是将样品经低温冷冻,一般是-80℃,这种低温对样品中温度敏感的成分保护已经足够了,但浸液氮的作用除了降温还有一个重要的作用就是脱水,使样品变干变脆,研磨过程中研磨珠与样品进行刚性作用,就像铁锤砸石头,作用力完全被样品吸收,才会被打得粉碎。以前像水稻叶片这种样品之所以不好磨,就是因为叶片本身比较韧,低温冻过之后变蔫变软,研磨珠有劲使不上。 目前我们在植物样品的研磨上获得了不少的经验,下一步还会在其他类型的样品上下功夫,当然,在不透露更多机密的情况下,我会拿来和大家分享。
[size=16px] 叶绿素测定仪是一种用于测量植物叶片中叶绿素含量的设备。叶绿素是植物中进行光合作用的关键色素,它们吸收光能并将其转化为化学能以支持植物的生长和发展。以下是一般情况下使用叶绿素测定仪测量植物叶绿素相对含量的步骤: 样本准备: 从要测量的植物中选取代表性的叶片样本。这些叶片应该是健康的、没有损伤的,并且尽可能避免太老或太嫩的叶片。 叶片处理: 如果需要,将叶片处理成较小的块状或碎片,以确保测量时样本的均匀性。同时,避免过度损伤叶片,因为这可能会影响叶绿素的测量结果。 提取叶绿素: 使用适当的提取液(比如乙醇、乙醚等)将叶片中的叶绿素提取出来。提取的过程通常需要在低温下进行,以防止叶绿素的降解。 测量光吸收: 将提取液中的叶绿素溶液置于叶绿素测定仪中。这种仪器通过照射样本并测量样本对不同波长光的吸收来确定叶绿素的含量。最常见的方法是使用分光光度计,它可以测量不同波长下样本吸收的光强度。 建立标准曲线: 使用已知浓度的叶绿素标准溶液,进行一系列测量以建立标准曲线。标准曲线可以用来将样本吸收的光强度值转换为叶绿素浓度值。 测量样本: 使用同样的方法测量你的样本,获取其吸收的光强度值。 计算叶绿素含量: 根据标准曲线,将样本的光吸收值转化为叶绿素浓度。如果你感兴趣的是叶绿素的相对含量,可以将不同样本的叶绿素浓度与标准样本进行比较。 请注意,使用叶绿素测定仪需要一定的实验操作技能和基本的化学常识。在操作之前,云唐建议仔细阅读仪器的操作手册,并根据实际情况调整实验步骤。另外,确保在实验过程中遵循安全操作规范,使用适当的防护措施。[/size]
背景简介小麦灌浆期叶片的持绿功能期对籽粒产量具有重要意义,是小麦育种专家极为重视的表型特征,目前小麦叶片衰老态势主要通过叶色、绿叶相对面积以及叶绿素荧光等方法来评价前两种方法受观测者的主观感受影响,后者则受太阳辐射等因素影响,且叶室夹具容易对叶片造成损伤低场核磁共振以1H 为探针,可用于探测植物水分生理状态。比如植物叶片的核磁共振T2弛豫特性( NMR T2 Relaxivity) 与含水率、水分分布、蒸腾活性以及水势等密切相关。与其他技术相比,核磁共振技术具有检测快速、检测方式多样、无损和非接触等优点。利用核磁共振T2弛豫谱技术和磁共振成像技术,建立小麦植株的核磁共振活体检测系统,研究小麦叶片含水率、叶绿素含量与核磁共振T2弛豫谱的关系,并在此基础上评价核磁共振T2弛豫谱和磁共振成像技术反映叶片衰老态势的有效性。http://pic.yupoo.com/niumagqw2/FCKpAOb9/13DK4k.png小麦叶片的T2弛豫谱幅度和含水率随日序的变化如图2 所示。5 月下旬为陕229 灌浆乳熟期,该时期倒2 叶进入降解期,叶色开始变黄,而旗叶亦有衰老迹象,叶色亦开始变淡,但是T2 弛豫谱幅度和含水率并未出现明显变化。6 月上旬陕229 灌浆趋近结束,叶片进入衰亡期,T2弛豫谱幅度和含水率均出现显著减小。http://pic.yupoo.com/niumagqw2/FCKpCldR/DRLQ6.png小麦叶片的平均T2弛豫时间和叶绿素含量的日序变化如图3 所示。叶片在衰老前期( 6 月1 日之前) 平均T2弛豫时间逐渐增大,叶绿素含量逐渐减小,旗叶的叶绿素含量大于倒2 叶,而且旗叶的平均T2弛豫时间相对较小; 6 月4 日选取的陕229 植株均有倒2 叶完全衰亡,其平均T2弛豫时间和叶绿素含量均达到最小值,而旗叶仍保持一定的含水率,虽然其叶绿素含量亦基本达到最小值,但平均T2弛豫时间仍未到衰减阶段。http://pic.yupoo.com/niumagqw2/FCKpCqOU/qLGHx.png同时,核磁共振成像技术可以对活体小麦样品进行成像分析http://pic.yupoo.com/niumagqw2/FCKpCyvo/82VIT.png参考文献:“小麦叶片衰老态势核磁共振分析” 《农业机械学报》2014年4月 第45 卷第4
[size=16px] 叶面积测量仪是用于测量植物叶片表面积的工具。它可以通过不同的方法来估算叶片的表面积,其中一些常见的方法包括: 直接测量法: 这种方法涉及将叶片放在一块已知面积的测量板上,然后使用划分网格或数字图像处理来测量叶片的轮廓。然后可以使用这些测量值来计算叶片的总表面积。 扫描法: 这种方法使用数码扫描仪或图像扫描仪来扫描叶片的图像。扫描后,使用图像处理软件测量叶片的轮廓,并计算出叶片的表面积。 影像分析法: 使用数字相机或移动设备拍摄叶片的图像,然后使用专业的图像分析软件来处理图像,提取叶片的轮廓并测量表面积。 数学模型法: 通过测量叶片的长度、宽度和其他几何特征,然后应用数学模型(如椭圆形、矩形等)来估算叶片的表面积。 叶片分段法: 对于大型或不规则形状的叶片,可以将其分成几个较小的部分,测量每个部分的面积,然后将这些面积相加以得到总表面积。 无论使用哪种方法,都需要确保测量精确度和可靠性。在使用叶面积测量仪进行测量时,云唐建议遵循制造商提供的操作说明,并根据需要进行校准,以确保获得准确的叶面积数据。另外,不同类型的植物可能需要针对其特定叶片形状和大小的方法进行微调。[/size]
苜蓿(mùxu)是苜蓿属(Medicago)植物的通称,俗称金花菜,是一种多年生开花植物。其中最著名的是作为牧草的紫花苜蓿(Medicago sativa)。苜蓿种类繁多,多是野生的草本植物。中国产的苜蓿主要有三种。营养价值很高,具有清脾胃、利大小肠、下膀胱结石的功效。 苜蓿含有最丰富的维他命K,成分之高,驾乎一切蔬菜之上。其他如维他命C、B也相当丰富。多为牲畜饲料。在[url=https://baike.so.com/doc/5417629-5655777.html]西汉[/url]从[url=https://baike.so.com/doc/5415894-5654039.html]西域[/url]引进。
离体植物叶片在自然摊放过程中水分状况(如叶片内自由水、束缚水的散失,叶片水势等)一般用什么方法测定更合适,有没有比较合适的仪器测定,若有,一般这种仪器的价格大约需要多少?
[font=-apple-system, BlinkMacSystemFont, &][color=#05073b][size=18px] 便携式光合仪如何同化CO2的叶片面积,便携式光合仪在测定同化CO?的叶片面积时,主要是通过测量植物光合速率,并结合叶片面积来估算的。以下是一个清晰的步骤说明和归纳: 步骤说明 植物光合速率的测定: 使用便携式光合仪,在精确控制环境因子的条件下,通过红外线气体分析仪检测二氧化碳的消耗速率来测定植物的光合速率。 这个过程基于红外光被二氧化碳分子吸收的原理,通过测量透射光能量的减少来推算二氧化碳的消耗速率。 叶片面积的测量: 可以使用标准方格纸或其他测量工具来测量叶片的实际面积。对于大于或等于半格的部分算作一格,小于半格的部分可以舍去。 例如,如果使用边长为1厘米的透明方格纸来测量,可以计算出叶片的近似面积。 同化CO?的叶片面积估算: 根据测定的光合速率和叶片面积,可以估算出同化CO?的叶片面积。这通常是一个相对值,表示在给定的时间和条件下,叶片同化CO?的能力。 需要注意的是,这个估算值受到多种因素的影响,如光照、温度、水分等环境因子以及植物本身的生理状态等。 归纳 便携式光合仪通过测量植物的光合速率和叶片面积,可以估算出同化CO?的叶片面积。这个过程结合了光合作用的基本原理和叶片面积的测量方法,提供了一种方便、快捷的方式来评估植物的光合作用效率。然而,需要注意的是,这个估算值受到多种因素的影响,因此在实际应用中需要结合具体情况进行综合考虑。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405301144376028_9059_6098850_3.jpg!w690x690.jpg[/img][/size][/color][/font]
植物中传播的病毒致使叶片产生斑点,萎黄,甚至坏死,通常在这些病症对植物造成可视损伤时再作治疗,为时已晚。更有效的方式是通过远程监测,对植物叶片的变化作出及时监控及准确评估,以减少损失。通常远程监测基于以下推断,即环境有害因素对植物光合作用或物理形态的影响会导致植物反射光谱和叶绿素荧光光谱发生改变。因此监测主要通过反射及荧光光谱的摄取及分析实现。