细胞的癌变是细胞在信号通路调节失控情况下的无限制增生,而RAF-MEK-ERK信号通路的持续性激活则是诱导细胞癌变的重要原因。因此,对RAF-MEK-ERK信号通路的研究一直是分子生物学研究的热点。英国科学家在最近一期《分子与细胞生物学》杂志上发表论文称,真核翻译起始因子3a(EIF3a)可以通过和RAF激酶结合,抑制RAF-MEK-ERK信号通路,是这一信号通路的重要“刹车”蛋白。这一发现意味着EIF3a可能成为下一代抗癌药物全新的靶标蛋白,为抗癌药物的研发提供新思路。 EIF3a是细胞蛋白质翻译起始复合物的重要构件。由英国格拉斯哥大学和爱尔兰都柏林大学研究人员组成的研究小组研究发现,EIF3a能够与细胞外信号调节激酶通路的两个组成部分SHC蛋白和Raf1蛋白绑定,不仅可以调节蛋白质翻译,影响细胞的生长和分化,还通过和RAF激酶结合,抑制RAF-MEK-ERK信号通路,成为RAF-MEK-ERK信号通路的重要“刹车”蛋白。同时,研究人员还发现,EIF3a和另一个“刹车”蛋白——β抑制蛋白(β-arrestin2)结合,能够调节细胞的另一条最主要信号通路:G蛋白偶联受体(GPCR)信号通路。 该论文首席作者,格拉斯哥大学生物医学与生命科学学院的徐天瑞博士指出, RAF-MEK-ERK信号通路是细胞外信号传递入细胞内的主干通路,绝大多数细胞外信号都可以通过RAF-MEK-ERK通路影响细胞行为,诸如细胞增值、细胞分化、细胞凋亡。新发现表明,EIF3a可以抑制RAF-MEK-ERK信号通路,从而抑制癌症的产生;其通过与β抑制蛋白结合影响其功能,可治疗由G蛋白偶联受体信号通路失控而导致的癌症;同时,EIF3a可以抑制RAF激酶活性,诱导细胞凋亡,从而杀灭癌细胞;而对EIF3a本身蛋白质翻译的调节,也可以作为治疗癌症的重要手段。 徐天瑞博士说:“信号抑制蛋白EIF3A的发现意义重大,《科学—信号传导》杂志最近将其列为2011年度细胞生物学领域八项重大进展之一。我们的新研究证明,EIF3a不仅是蛋白质翻译起始因子,也是RAF-MEK-ERK信号通路和G蛋白偶联受体信号通路交汇点上的重要调控蛋白。通过对EIF3a的调控,有可能四管齐下地杀灭癌细胞,从而使EIF3a可能成为下一代抗癌药物全新的靶标蛋白,为抗癌药物的研发提供新思路。”(记者 刘海英)
[font=宋体][font=宋体]无细胞蛋白表达是一种体外重组蛋白质表达技术也称为无细胞蛋白质合成技术([/font][font=Calibri]CFPS[/font][font=宋体]:[/font][font=Calibri]Cell-free protein synthesis[/font][font=宋体]),是指用含有蛋白合成必需的组分(核糖体,转运[/font][font=Calibri]RNA[/font][font=宋体],氨酰合成酶,启动[/font][font=Calibri]/[/font][font=宋体]延伸[/font][font=Calibri]/[/font][font=宋体]终止因子,三磷酸鸟苷,[/font][font=Calibri]ATP[/font][font=宋体],[/font][font=Calibri]Mg2+[/font][font=宋体]和[/font][font=Calibri]K+[/font][font=宋体])的细胞裂解物在体外进行蛋白合成。无细胞蛋白表达技术适用于制备各种类型的蛋白质,包括难表达蛋白质、毒性蛋白质、复杂蛋白质等。在药物研究、生物制造和生命科学等领域中得到广泛关注和应用,无论是研究、开发还是商业化应用过程。目前无细胞蛋白表达主要应用于药物研发领域,例如抗体制备和生物药物生产等。随着人工智能技术的不断发展,无细胞蛋白表达技术可以与人工智能算法结合,构建计算机辅助的高通量生产系统,实现个性化、精准的生物医学治疗。除此之外,还能够应用于其他领域,例如基因工程、环境保护和农业生产等。随着无细胞蛋白表达技术的不断发展和人工智能技术的不断进步,我们可以看到更多的新领域和新应用出现,给生物科技行业带来更多的机遇和挑战。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]相较于传统的活细胞蛋白表达技术,无细胞蛋白表达技术具有以下几个显著的优势:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]更高的蛋白质表达量:传统的活细胞蛋白表达技术受限于细胞本身的多方面因素,其表达的蛋白质数量往往受到限制。而无细胞蛋白表达技术通过在体外底物浓度高的环境中进行合成反应,不但避免了传统活细胞表达所面临的方方面面的限制,还能够很好地控制反应体系,从而获得表达量更高的蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]更快的表达速度:传统活细胞蛋白表达需要细胞生长并达到最佳密度才能进行蛋白质表达,这个过程往往需要数天时间。而无细胞蛋白表达技术通常只需要数小时就能够完成蛋白质的表达,这个速度明显快于传统活细胞表达技术。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]更精准的蛋白质合成:无细胞蛋白表达技术在体外进行蛋白质合成,能够精确控制底物浓度、反应温度、反应剂比例等参数,因此可以更加精准地合成定制的蛋白质,这对于研究和应用来讲具有重要意义。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]更灵活控制:在无细胞蛋白表达技术中,可以使用分离的组分体系进行蛋白质的合成,可以控制底物和反应剂的比例,也可以在适当的反应条件下进行自定义的修饰,如蛋白质标记、药效分析等。这些优点使得无细胞蛋白表达技术更加灵活、可控,适用于更广泛的应用领域。[/font][/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]无细胞蛋白表达应用[/font][/b][font=宋体] [/font][font=宋体]无细胞蛋白表达技术是一种飞速发展的新型生物技术,具有广阔的应用前景和潜力。该技术可以快速、高效、经济地合成蛋白质,可广泛应用于医疗、制药、农业、生物材料等多个领域。[/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]医疗领域:无细胞蛋白表达技术在医疗领域应用广泛,可以用于生产多种蛋白质药品,如单克隆抗体等。其中,单克隆抗体是一种重要的治疗药物,具有高度特异性和亲和力,可用于肿瘤、心血管疾病、自身免疫性疾病等疾病的治疗。传统单克隆抗体生产方法需要花费大量时间和成本,而无细胞蛋白表达技术则可以在短时间内大规模合成单克隆抗体,从而大大缩短生产周期,并且可以降低成本。此外,无细胞蛋白表达技术也可以用于疫苗研发。比如疟疾疫苗研究开发昂贵又耗时,目前利用[/font][font=Calibri]WGE[/font][font=宋体]系统可加速疫苗研发,并建立高通量疟原虫抗体筛查系统。[/font][font=Calibri]Stark[/font][font=宋体]等利用大肠杆菌的便携式冻干裂解物再水化,[/font][font=Calibri]1h[/font][font=宋体]内合成高致病性病原体土拉弗朗西斯菌亚种的生物偶联疫苗,与工程菌生产的疫苗相比,其可引发更高水平的病原体特异性抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]制药领域:是无细胞蛋白表达技术的一个重要应用领域。药物开发的成功率取决于药物分子对目标蛋白的亲和力,而目标蛋白对于专一的细胞表达系统和分类的组织或器官非常敏感。通过无细胞蛋白表达技术,研究人员可以在不依赖于细胞的情况下直接生产大量需要的蛋白质,为药物研发提供了更快更便捷的方法。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]基础研究领域:利用无细胞蛋白质合成系统可以直接对表达产物进行核磁共振分析,目前已确定了数千个蛋白质的结构。可以通过合成蛋白质建立蛋白质阵列,解开基因产物的功能;应用核糖体展示和 [/font][font=Calibri]mRNA [/font][font=宋体]展示技术,更有利于实现高通量筛选,全面深入研究基因特征和功能。通过无细胞蛋白表达技术可以实现对大型蛋白质的生产和分析,同时也为基础研究打开了新的研究领域。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州无细胞合成服务正在活动中,活动时间[/font][font=Calibri]2023[/font][font=宋体]年[/font][font=Calibri]10[/font][font=宋体]月[/font][font=Calibri]23[/font][font=宋体]日[/font][font=Calibri]-12[/font][font=宋体]月[/font][font=Calibri]31[/font][font=宋体]日。有需求的可以咨询或者进入义翘神州网进行查看。更多详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
请教一下该图为一角蛋白材料,请问能分析出有哪些氨基酸成分吗?根据文献内应含约17种,请问应如何分析?能否定量测出各种氨基酸含量?http://ng1.17img.cn/bbsfiles/images/2012/10/201210230158_398636_2032315_3.jpg
最近做了几个毛角蛋白红外定性分析可是出的红外图谱看不是很懂~
[b][font=宋体]前言[/font][/b][font=宋体]在蛋白质研究领域,稳定细胞系的应用已成为生产高质量结构生物学蛋白质的关键手段。随着技术的不断进步,稳定细胞系的生成与筛选方法得到了显著改进,从而推动了蛋白质生产的高效化与精准化。[/font][font=Calibri] [/font][b][font=宋体]细胞系的建立和应用[/font][font=宋体][font=Calibri]HEK293[/font][font=宋体]和[/font][font=Calibri]CHO[/font][font=宋体]细胞系[/font][/font][/b][font=宋体]因其稳定的蛋白表达和适当的翻译后修饰而被广泛用于结构生物学研究。这些细胞系能有效地生产具有复杂糖基化模式的蛋白质,这对于确保蛋白质的功能和稳定性至关重要。糖基化缺陷细胞系通过特定的基因改造,能够分泌脱糖基化糖蛋白,为蛋白质生产提供了更加纯净的原料。[/font][font=Calibri] [/font][b][font=宋体]稳定细胞系的生成[/font][/b][font=宋体][font=宋体]传统的稳定细胞系生成技术如瞬时转染,虽然方法简便,但存在整合频率低、转基因沉默等问题。为了克服这些困难,研究者们开发出了一系列新技术,如细胞分选技术、位点特异性重组(如[/font][font=Calibri]FLP/FRT[/font][font=宋体]系统)、转座子系统(如[/font][font=Calibri]piggyBac[/font][font=宋体])、慢病毒系统以及噬菌体整合酶等,提高了稳定细胞系的生成效率和稳定性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]序列特异性基因组工程也为稳定细胞系的生成提供了新的思路。通过敲除或修饰特定的基因,研究者们能够实现对细胞功能的精准调控,从而优化蛋白质生产的效率和纯度。例如,一种同时缺乏[/font][font=Calibri]GnTI[/font][font=宋体]和谷氨酰胺合成酶([/font][font=Calibri]GS[/font][font=宋体])活性的[/font][font=Calibri]CHO[/font][font=宋体]细胞系被成功开发出来,为高效筛选具有[/font][font=Calibri]GS[/font][font=宋体]标记的稳定细胞系提供了有力工具。[/font][/font][font=Calibri] [/font][b][font=宋体]稳定细胞系与瞬时转染的比较[/font][/b][font=宋体]稳定细胞系相较于瞬时转染具有多个优点,包括能够进行大规模生产和保持高水平的蛋白表达稳定性。尽管瞬时转染在某些情况下能快速产生大量蛋白,但其表达水平和重复性通常不如稳定细胞系。[/font][font=Calibri] [/font][b][font=宋体]展望[/font][/b][font=宋体]近年来,利用稳定细胞系高效生产结构生物学蛋白质已成为研究的热点和趋势。通过引入新技术、优化筛选方法和改进整合系统,不仅能够提高蛋白质生产的效率和纯度,还能够为结构生物学研究提供更加精准、可靠的实验工具。随着基因编辑和细胞工程技术的进步,预计在未来,通过精确的基因操作能够更有效地创建和利用稳定细胞系。这些技术的进步将促进结构生物学和药物开发中蛋白质的高效和可持续生产。[/font][font=宋体] [/font][font=宋体]本文由义翘神州进行整理,同时提供[/font][url=https://cn.sinobiological.com/services/stable-cell-line-development-service][u][font=宋体][color=#0000ff]稳定细胞系构建服务[/color][/font][/u][/url][font=宋体],详情可点击了解![/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Büssow K. Stable mammalian producer cell lines for structural biology. [/font][i][font=Calibri]Curr Opin Struct Biol[/font][/i][font=Calibri]. 2015 32:81-90. doi:10.1016/j.sbi.2015.03.002[/font]
我们知道,PeproTech的所有细胞因子和蛋白均为冻干粉,这使得运输非常便捷,只要常温即可。而且,细胞因子和蛋白冻干粉非常稳定,在-20℃或-80℃条件下可保存数年。冻干粉在使用前需进行溶解,然后以液体形式加到培养体系或注射入动物体内。溶解步骤非常关键,因溶解不好会导致细胞因子或蛋白的失活,这也是很多用户在实际使用中经常遇到的问题。 那么,应该如何进行正确的溶解呢? 下面我们以Recombinant Human IL-4 (重组人IL-4,产品编号:200-04)的说明书为例,对细胞因子或蛋白的溶解方法进行详细的阐述。 拿到重组人IL-4的说明书后,您会发现有一段关于Reconstitution(重悬)的叙述,这段内容含有溶解相关的所有信息。 1. Centrifuge the vial prior to opening.第1步:开盖前离心试剂管 PeproTech的细胞因子或蛋白冻干粉装盛在塑料管中,为无菌包装。冻干粉在运输过程中可能会因颠簸而漂散并粘贴于管壁或管盖上,所以在打开塑料瓶盖前,需将冻干粉通过离心收集到管底,以便用很小体积的液体即可将冻干粉完全溶解。 有很多用户会问一个问题,即应该用多少转速、多长时间离心试剂管,才能达到良好的收集效果?答:有些小型高速离心机(多为进口品牌)的面板上有一个Spin键,按了此键后,离心机会自动快速上升到其最大速度(10000rpm或12000rpm),上升到最高点后速度即刻下降,直至停止旋转,整个过程大约30s。这个Spin键足以很好的将细胞因子或蛋白收集到管底。 但有些实验室没有这样的高速离心机,只有最高转速为4000-4500rpm的离心机。这种情况下,需3000-3500rpm离心5min,也能达到类似的效果。 2. Reconstitute in water to a concentration of 0.1-1.0 mg/ml. Do not vortex.第2步:用无菌水重悬至0.1-1.0 mg/ml,不可振荡。 这个步骤即为溶解步骤,非常重要。 1) 一定要用推荐的溶液重悬(或溶解)冻干粉 用于溶解细胞因子或蛋白的溶液千差万别。此例中的重组人IL-4需用水溶解,而重组人IL-2 (产品编号:200-02)则需用100mM Acetic Acid (醋酸)溶解,重组人TGF-beta1 (产品编号:100-21)需用10mMCitric Acid (柠檬酸),pH3.0溶解,重组人FGF-basic(产品编号:100-18B)需用5mMTris,pH7.6溶解,重组人FGF-10(产品编号:100-26)需用5mMSodium Phosphate(磷酸钠),pH7.4溶解,重组IL-13(产品编号:200-13)需用20mMMHCl溶解。(注:即使同一重组细胞因子或蛋白,不同批次的溶解方法也可能有所不同,因此上面的叙述仅供参考。具体应该如何溶解应以相应批次的官方说明书为准)。后续的文章中将对各种溶解液的配制方法进行详细的阐述,望继续关注。 经常有用户会问,为什么会有这么多种溶解方法?答:我们知道,蛋白的溶解性与很多因素有关,其中比较重要的是pH值和离子强度。PeproTech的细胞因子或重组蛋白在出厂前均经严格测试,说明上所标明的溶解液是能够将该细胞因子或重组蛋白完全溶解的液体。如果您所用的溶解液的pH值和离子强度与说明书中所标明的不符,很多时候会造成细胞因子或重组蛋白不能完全溶解或者根本无法溶解,这样所配得的细胞因子或重组蛋白必然活性不够或丧失。 有不少用户没注意说明书上的描述,而是根据习惯,直接用PBS或培养液(1640或DMEM等)等溶解细胞因子或蛋白的冻干粉。这样做可以吗?答:有时可以,要看具体情况。PeproTech的大多数细胞因子或蛋白冻干粉的溶解液不是PBS,此时千万不能用PBS或培养液直接来溶解,具体原因在上面已经叙述过。而有部分细胞因子,如重组人KGF(产品编号:100-19)和重组人FGF-23(产品编号:100-52)等,说明书上的溶解液即为1x PBS,此时用PBS溶解完全没问题,那么用培养液溶解也是可以的,不过最好还是用先用PBS溶解,然后再用培养液稀释。
美国北卡罗莱纳大学教堂山分校文理学院的首席化学教授约瑟夫—德西蒙博士领导的研究小组发现,人体中的一种正常的良性蛋白质,如果和纳米粒子相结合,就能瞄准并杀死癌细胞,而无须负载那些携带化疗药物的粒子。此前,研究人员曾认为,纳米粒子只有携带了有毒的化学载体才能达到这样的效果。转铁蛋白是人体血液中数量第四多的蛋白质,近20年来一直被作为肿瘤靶向载体用以递送治癌药物。纳米粒子通常也是无毒的,需要通过负载标准化疗药物来治疗癌症。然而,结合转铁蛋白的“打印”纳米粒子,不仅能识别它们,还能诱导癌细胞死亡。而不与任何纳米粒子结合的自由转铁蛋白,能从拉莫斯癌细胞中获得养料生长,即使在很高浓度下也不会杀死任何拉莫斯癌细胞。然而令人吃惊的是,转铁蛋白附着在纳米粒子表面后,其能有效地筛选标靶,攻击并杀死B细胞淋巴瘤。在许多迅速生长的癌细胞表面,蛋白质受体被过度表达,于是和转铁蛋白配体结合的治疗就能找到并瞄准它们,而结合转铁蛋白的纳米粒子被认为是安全且无毒的。德西蒙实验室发明了一种“打印”技术,能人为造出尺寸精确且形状符合预期的纳米颗粒。他们采用这种技术制作出一种可与人类转铁蛋白相结合的生物相容性纳米粒子,其能安全且精确地识别广谱癌症,除了B细胞淋巴瘤外,还能有效地指向非小型细胞,如肺、卵巢、肝脏和前列腺的癌细胞。研究人员目前正在进一步研究,携带转铁蛋白的纳米粒子如何及为何对于拉莫斯癌细胞是有毒的,而对其他细胞却无毒。化学治疗和放射治疗曾被认为是癌症的最有效疗法,但这些疗法通常会损害健康组织和器官。这一发现将可能发展出一种全新的策略来治疗某种类型的淋巴瘤,而副作用更小。不过,德西蒙承认,该研究也会引起一些人对不可预期后果的担忧,即一个设计好的针对某类癌症的靶向化疗载体是否会偏离目标。
[font=宋体][font=宋体]无细胞蛋白表达系统([/font][font=Calibri]Cell-Free Protein Expression System[/font][font=宋体])是一种基于原核和真核细胞提取物构建的体外蛋白表达系统。它具有许多优点,例如可以在短时间内生产大量的蛋白质,同时避免了细胞内的复杂调控机制和翻译后修饰等繁琐过程。因此,无细胞蛋白表达系统在生物制药、生物材料、生物燃料等领域具有广泛的应用前景。本文将详细介绍无细胞蛋白表达系统的优缺点。[/font][/font][font=宋体][b]一、无细胞蛋白表达系统的优点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]高效性:无细胞蛋白表达系统具有高表达效率的优点,这是由于体外体系中不存在靶蛋白累积所需的细胞分裂和细胞复杂代谢反应。此外,由于无细胞蛋白表达系统不受到细胞毒性和免疫反应的限制,可以实现大规模的蛋白质表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]灵活性:无细胞蛋白表达系统可以使用一系列不同的原核和真核细胞提取物作为反应体系,例如[/font][font=Calibri]E.coli[/font][font=宋体]、小麦胚芽和人类细胞等。这意味着可以根据不同的实验目的和需求进行合理的选择,以适应多样化的研究需要。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]易操作性:无细胞蛋白表达系统非常容易操作。与传统的细胞表达系统相比,无细胞蛋白表达系统不需要细胞培养、生长和繁殖。此外,无细胞蛋白表达系统可以快速进行,通常只需要数小时至几天即可完成目标蛋白的表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]简单纯化:由于无细胞蛋白表达系统可以避免有机溶剂和离子交换剂等复杂的步骤,从而使目标蛋白的纯化工作更加简便和迅速。例如,可以使用亲和柱、凝胶过滤和电泳分析等方法来快速分离和纯化蛋白质。[/font][/font][font=宋体] [/font][font=宋体][b]二、无细胞蛋白表达系统的缺点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]成本较高:尽管无细胞蛋白表达系统可以大规模进行蛋白质表达,但是所需的原核和真核细胞提取物通常需要较高的成本。此外,涉及到的一些试剂和设备也比较昂贵,使得无细胞蛋白表达系统在应用过程中存在一定的经济压力。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]表达限制:由于无细胞蛋白表达系统缺乏复杂的代谢反应和细胞分化机制,因此它不适用于某些特定类型的蛋白。例如,它无法表达复杂的膜蛋白和困难的药物蛋白等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]不稳定性:无细胞蛋白表达系统通常具有一定的稳定性问题。由于缺乏细胞膜的保护,无细胞蛋白表达体系会更容易受到外部条件的影响,如温度、[/font][font=Calibri]pH[/font][font=宋体]、离子浓度等,从而导致蛋白质的不稳定性、聚集和降解等现象。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]不适合复杂蛋白结构:无细胞蛋白表达系统对于复杂蛋白结构的模拟效果不佳。例如,膜蛋白、多肽和糖蛋白等复杂蛋白质可能会被无细胞蛋白表达系统无法很好地复制,从而限制了其应用范围。[/font][/font][font=宋体] [/font][font=宋体]无细胞蛋白表达系统具有高效、灵活、易操作、简单纯化等优点,但同时也存在着成本较高、表达限制、不稳定性和不适合复杂蛋白结构等缺点。在实际应用中,需要根据具体的研究目的和需求进行选择,并结合其他技术手段来弥补其不足之处。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/cell-free-protein-synthesis-service][b]无细胞蛋白表达服务[/b][/url],服务优势:[/font][font=宋体]①快速、高效 ②高成功率 ③一致性 ④高难度抗体表达[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以咨询,具体[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
酒精废水生产单细胞蛋白技...
俄亥俄州哥伦布市一项新的研究表明,成熟脑细胞表面的三种特定蛋白量的增加可促使细胞产生新的生长延伸。该研究探讨了小鼠脑神经细胞上的三个相关的受体蛋白:GPR3,GPR6和GPR12。当研究人员增加这三种蛋白的量后,细胞生长延伸比蛋白水平正常时的神经细胞的生长大三倍,延伸速度比对照细胞快4-8倍。俄亥俄州立大学医学中心的项目主持人Yoshinaga Saeki说,“我们的研究结果显示,这三种蛋白可能是用于治疗中风、脑和脊髓损伤及神经退行性疾病的重要靶点。”该研究刊登在4月6日的《生物化学杂志》(Journal of Biological Chemistry)上。 这些蛋白量的增加与神经细胞cAMP内的一种重要的信号分子的水平的增加有关。这个分子在调控神经细胞生长、分化和生存,以及传输神经冲动的轴突再生中起着关键作用。随着哺乳动物神经细胞的成熟,其细胞内的cAMP水平下降,这可以部分解释为什么成熟神经细胞受损的轴突不能再生。神经外科副教授、俄亥俄州州立dardinger神经肿瘤及神经科学实验室主管Saeki声称,“我们的发现为cAMP在轴突生长中起着重要作用这一观点提供了更多证据,并显示出这些受体蛋白可能在调节神经细胞cAMP的产生中起主要作用。” 该研究的第一作者Shigeru Tanaka是Saeki所在实验室的一名博士后研究员。在本项研究中,他与同事从小鼠与大鼠脑组织神经母细胞瘤中取得神经细胞,使之在培养基中生长以了解更多关于这三种蛋白及其调控cAMP生长中的作用。他们向这些细胞中注入三种基因以增加这三种蛋白的含量水平,然后用一种被称为核糖核酸干扰的实验室技术关闭这三种蛋白的产生。上述三个蛋白分子中GPR3在神经细胞中最为丰富,而GPR12刺激神经细胞延伸的作用最强。研究表明,阻断GPR3的产生会大大减慢神经细胞的生长速度,研究者们通过修复GPR3或GPR12的产生扭转了这种效应。三种蛋白质的含量水平高也与较高水平的cAMP有关,同时GPR6和GPR12能增加两倍到三倍的水平。 Saeki说,“总的来说,我们的研究结果显示,这三种蛋白能加快神经细胞的生长即使在抑制分子的存在下也是如此,我们迫切希望能找出可以在临床前中风或脊髓损伤动物模型身上重现此结果的方法。”来源:生物谷
转铁蛋白与纳米粒子结合就可瞄准并杀死拉莫斯癌细胞,而无需负载其他化疗药物,此项发现将有望发展出癌症靶向治疗的新策略。 相关研究成果发表在本周的《美国化学协会杂志》上。 美国北卡罗莱纳大学教堂山分校文理学院的首席化学教授约瑟夫德西蒙博士领导的研究小组发现,人体中的一种正常的良性蛋白质,如果和纳米粒子相结合,就能瞄准并杀死癌细胞,而无须负载那些携带化疗药物的粒子。此前,研究人员曾认为,纳米粒子只有携带了有毒的化学载体才能达到这样的效果。 转铁蛋白是人体血液中数量第四多的蛋白质,近20年来一直被作为肿瘤靶向载体用以递送治癌药物。纳米粒子通常也是无毒的,需要通过负载标准化疗药物来治疗癌症。然而,结合转铁蛋白的“打印”纳米粒子,不仅能识别它们,还能诱导癌细胞死亡。而不与任何纳米粒子结合的自由转铁蛋白,能从拉莫斯癌细胞中获得养料生长,即使在很高浓度下也不会杀死任何拉莫斯癌细胞。 然而令人吃惊的是,转铁蛋白附着在纳米粒子表面后,其能有效地筛选标靶,攻击并杀死B细胞淋巴瘤。在许多迅速生长的癌细胞表面,蛋白质受体被过度表达,于是和转铁蛋白配体结合的治疗就能找到并瞄准它们,而结合转铁蛋白的纳米粒子被认为是安全且无毒的。 德西蒙实验室发明了一种“打印”技术,能人为造出尺寸精确且形状符合预期的纳米颗粒。他们采用这种技术制作出一种可与人类转铁蛋白相结合的生物相容性纳米粒子,其能安全且精确地识别广谱癌症,除了B细胞淋巴瘤外,还能有效地指向非小型细胞,如肺、卵巢、肝脏和前列腺的癌细胞。 研究人员目前正在进一步研究,携带转铁蛋白的纳米粒子如何及为何对于拉莫斯癌细胞是有毒的,而对其他细胞却无毒。 化学治疗和放射治疗曾被认为是癌症的最有效疗法,但这些疗法通常会损害健康组织和器官。这一发现将可能发展出一种全新的策略来治疗某种类型的淋巴瘤,而副作用更小。 不过,德西蒙承认,该研究也会引起一些人对不可预期后果的担忧,即一个设计好的针对某类癌症的靶向化疗载体是否会偏离目标。(科技日报)

http://ng1.17img.cn/bbsfiles/images/2012/10/201210230150_398632_2032315_3.jpg我想请教一下,蓝色和绿色谱线为一角蛋白材料加pbs降解后的谱线,测出来明显在500cm-1至1500cm-1处多一宽峰,请问该部分是什么呢或者是什么原因造成的呢?
中国科技网伦敦9月20日电 英国科学家在最近一期《临床调查杂志》上刊发论文称,他们利用新的检测技术证明,导致亨廷顿病的有害蛋白是逐渐在血液细胞中积累起来的。他们在论文中对这些有害细胞是如何损害人的大脑进行了详细阐述,而这一新发现不仅有助于监测亨廷顿病的进展情况,也有助于开发抑制有害蛋白的新药。 亨廷顿病是一种致命的遗传神经疾病。患者由于基因突变导致机体细胞错误地制造一种名为“变异亨廷顿蛋白”的有害物质,这些异常蛋白会损坏部分脑细胞,导致患者神经系统逐渐退化,致使身体出现不可控制的抽搐,并能发展成痴呆,最后导致死亡。 发表论文的研究小组由英国伦敦大学学院、伦敦国王学院以及诺华生物医学研究所的研究人员组成。他们使用一种新的超敏测试技术测量亨廷顿病患者发病不同阶段体内变异亨廷顿蛋白的水平。这种测试技术名为时间分辨荧光共振能量转移(TR-FRET),可对变异亨廷顿蛋白进行极为精确的测量。研究人员发现,在亨廷顿病患者表现出相关症状之前,其体内变异亨廷顿蛋白即开始逐渐积累,而正常的亨廷顿蛋白含量则在整个发病过程中保持不变。核磁共振扫描显示,亨廷顿病患者脑萎缩的速度明显高于常人。而令研究人员惊讶的是,变异亨廷顿蛋白在白血细胞中的数量与脑萎缩的速率极为一致。这一发现表明,未来或许可以利用血检来预测神经退行性疾病患者脑萎缩的速度。 “使用TR-FRET技术测量变异蛋白水平,是治疗亨廷顿病的一个十分有用的新手段,”研究小组的领导者,伦敦大学学院的萨拉·塔布利兹教授说,“如今获得患者的血液样本很方便,这使得我们能够准确地研究变异亨廷顿蛋白的毒性。而变异亨廷顿蛋白水平与脑萎缩间的关联,使我们对亨廷顿病患者大脑退化的过程有了更新的了解。” 塔布利兹教授指出,TR-FRET技术对于未来基因沉默药物的临床试验也十分有用。她表示,基因沉默药物可用来抑制大脑中有毒蛋白的产生,十分有前途,但也极有可能产生副作用,因此了解药物降低变异亨廷顿蛋白水平的过程十分重要。而TR-FRET技术则提供了这样的手段,这对于新药的开发十分有利。(记者刘海英) 《科技日报》(2012-09-22 二版)
据美国物理学家组织网报道,北卡罗莱纳大学科学家的一项最新发现显示,细胞感染人类疱疹病毒(EBV)后,会产生小泡或被称为外体的液囊,从而改变细胞中所含的蛋白质和RNA(核糖核酸)。这种变质的外体一旦进入健康细胞,就能转变细胞的良性生长方式,使之变成不可控的致癌生长。这一发现刊登于美国《国家科学院院刊》网络版。EBV可能是世界上最成功的病毒,它无法被免疫系统彻底清除,几乎每个人终生都被它感染。它们不断进入唾液,在这里进行有效地传播。感染这种病毒很少致病,然而在几种主要的癌症中都发现了它的踪迹,包括淋巴瘤和鼻咽癌,它的蛋白质劫持了细胞生长调控机制,引发不可控的细胞生长,从而导致癌变。研究认为一种名为潜伏膜蛋白质1的蛋白质是EBV的致癌基因。通过外体,它们被传递给未受感染的细胞。研究人员还指出,EBV也彻底改变了外体的内含物,在细胞之间传递能激活癌症的蛋白质,这是值得注意的地方。这些发现表明,通过这种方式,病毒感染细胞能广泛影响并潜在控制全身其他细胞,引发它们的不可测生长。免疫系统不断地监视着外来病毒蛋白质,然而经外体携带的这些蛋白质可以不向免疫系统“报告”感染,并刺激癌细胞生长,由此容许了一种不可测的生长。该研究还显示,细胞能产生血管,这一被称为血管新生的过程很容易接受变质外体并引发潜在生长。北卡罗莱纳大学莱恩伯格综合癌症研究中心微生物与免疫学教授南希·瑞玻-特拉玻说:“外体就像特洛伊木马,EBV通过木马甚至能控制那些还没有感染的细胞。但重要的是,外体的产生可能为我们提供了一种新的治疗标靶,封锁它们就能控制癌症蔓延。”论文第一作者、瑞玻-特拉玻实验室博士后戴维·麦克表示,下一步研究是测定哪些蛋白质被选中进入外体,病毒如何控制了这些蛋白质,以及怎样才能遏制这一过程。
我正在做细胞色素C 胰蛋白酶酶解后[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]测序,我想请教一下酶解的条件。酶的用量,时间,温度,pH,还有缓冲溶剂的配置
将在药物开发进程中发挥重要作用2011年03月26日 来源: 科技日报 作者: 常丽君 本报讯 据每日科学网近日报道,美国范德堡大学研究人员开发出一种新型激光技术,可检测细胞膜上的蛋白质和其它多种生物分子之间的相互反应。这种检测将在药物开发进程中发挥重要作用。 人类细胞中约有7000种蛋白质,其中30%在细胞膜上,控制细胞分子运作机制的信号有60%—70%由这些膜蛋白产生,因此当前市场上约一半的药物都是瞄准细胞膜蛋白。但因为膜蛋白很难提纯,科学家在研究它们的结构时面临很多困难。现有的检测膜手段大多是将膜蛋白从其所处环境中分离,或用不同方式如荧光标签加以修改,以分析它们的活性。这些方法不仅昂贵耗时,还可能会影响目标膜蛋白的功能。 范德堡大学化学生物研究院化学教授达里尔·波恩霍普领导的研究小组和斯克里普斯研究院合作,开发了一种名为“后向散射干涉仪”(BSI)的新型激光技术,能精确检测出膜蛋白和自然界中各种分子之间的结合力。 BSI操作起来很简单,只要把两种分子混合装入一个充满液体的显微镜小盒中,用一束类似于条形码扫描仪的红色激光照射,就能测出它们之间的结合力。小盒的几何形状调整合适后,激光就会产生干涉图案,而这种干涉图案对分子之间的反应非常敏感。如果分子开始互相作用,图案就开始变换。 为了检验BSI的准确性,研究人员制造了一种含有GM1小蛋白质的合成膜,霍乱毒素要进入细胞,主要结合对象就是这种小蛋白质。他们把霍乱毒素B和这些膜混合,检测出的结合力结果与用其他方法所得到的结果一致。为了进一步确认,他们还用了一种和胸腺癌相关的天然分离膜和3种分别与疼痛、发炎和神经传导素GABA(用于放松、睡眠和调节紧张)相关的蛋白质膜进行检验,把包含这些蛋白质的膜和对应结合分子相混合,用BSI技术测得的值也和用其他方法得到的结果一样。 此外,该技术进入商业化也前景广阔,范德堡大学对新型激光检测技术已申请了专利,并已获得3项批准。他们还专门成立了一家分子传感公司对新技术进行独家开发。
位于HIV病毒表面的糖蛋白gp120可让人体B免疫细胞失去活性,这是《自然—免疫学》Nature Immunology上一项研究给出的结论。这项发现解释了为什么HIV病人抗体反应比较弱。人们已经发现HIV能够引起CD4+辅助性T免疫细胞不断丧失,导致免疫系统功能受损、其他感染更容易乘机而入。但人们一直没有弄清为何在HIV感染早期,T细胞数量还处于相对正常时,人体就不产生有力的抗体反应了。Claudia Cicala与同事发现,HIV的gp120蛋白可通过宿主细胞表面受体α4β7直接作用于B细胞。通过α4β7将信号传递给B细胞,诱发一种免疫反应抑制分子和一种抑制受体的表达。这种由gp120引发的反应大大影响了B细胞活性并降低其产生病毒抗体的能力。
Scientists Ratchet Up Understanding of Cellular Protein Factory科学家对于分子蛋白工厂的理解ScienceDaily (Dec. 1, 2010) — Theoretical biologists at Los Alamos National Laboratory have used a New Mexico supercomputer to aid an international research team in untangling another mystery related to ribosomes -- those enigmatic jumbles of molecules that are the protein factories of living cells. The research, published December 2 in the journal Nature, could aid in development of new antibiotics used to fight multidrug resistant superbugs such as MRSA (methicillin-resistant Staphylococcus aureus infections) found in many U.S. hospitals. The work may also be important for combating engineered strains of anthrax and plague.科学日报(2010年12月1日) - 在美国洛斯阿拉莫斯国家实验室的理论生物学家已经使用了新墨西哥州的超级计算机,以帮助一个国际研究小组解开有关核糖体另一个谜- 活细胞的蛋白质工厂分子神秘动力 。这项研究发表在12月2日的自然杂志上,可以有助于研发药针对美国许多医院中的对抗生素抗药的葡萄球菌(耐甲氧西林金黄色葡萄球菌感染)。这项工作也可用于防治炭疽工程菌和鼠疫。In the context of synthetic biology, understanding the ribosome could be key to developing nanofactories that produce designer biomolecules and polymers.在生物合成方面,了解核糖体是关键,发展纳米工厂来生产所设计的生物分子和聚合物。In the paper, "Head swivel on the ribosome facilitates translocation via intra-subunit tRNA hybrid sites," Los Alamos National Laboratory researchers Karissa Sanbonmatsu and Paul Whitford and José N. Onuchic at the University of California-San Diego join Christian Spahn, Andreas Ratje, and others from the Institute for Medical Physics and Biophysics, Berlin, Germany, to describe for the first time how a complicated swivel movement within a bacterial ribosome accommodates synthesis of proteins.在论文中,“头部旋转有利于通过内部核糖体亚基的tRNA移位”, 加州大学圣迭戈分校洛斯阿拉莫斯国家实验室的研究人员卡Karissa Sanbonmatsu 、 Paul Whitford 和 José N. Onuchic,其他来自柏林,德国医学物理学和生物物理学研究所,来形容首次如何在细菌核糖体进行复杂旋转运动来合成蛋白质。Ribosomes are composed of long chemical chains, called ribonucleic acids (RNA), and proteins. Each ribosome has two interlocked subunits, one large and one small, which behave as a single molecular machine. Because of its makeup, each ribosome resembles a tangle of threads or a handful of rubber bands tossed together. Despite the ribosome's outwardly disjointed appearance, researchers have found that the two subunits ratchet, un-ratchet, and swivel during protein synthesis to allow introduction of helper chemicals called transfer RNAs (tRNAs) into its folds to manufacture new chains of protein molecules. The proteins are used to create new cells or perform necessary functions within the host cell or organism.核糖体是由称为(RNA)的核糖核酸和蛋白质长化学链构成。每个亚基核糖体有两个相关的亚单位,一大一小,这表现为一个单一的分子机器。由于其构成,每个核糖体类似于一个线程缠结或一把橡皮筋捆在一起。尽管核糖体的表面上出现脱节,研究人员发现,这两个亚基有助于转运RNA(tRNA基因)来制造新的蛋白质分子链。这些蛋白质被用来制造新的细胞或在宿主细胞内或者生物体中执行必要的功能。Ribosomes build proteins by linking chemical segments fashioned from instructions delivered via messenger RNA, which is DNA's molecular cousin. Each segment, or amino acid, corresponds to a trio of bases in the message that, in turn, complement trios encoded in transfer RNA. Each base in the trio corresponds to a single chemical complement found on the RNA. In order for protein synthesis to occur, the tRNA must bind to the ribosome at two distinct sites -- one to decode the information and another to link the new amino acid to the emerging protein.核糖体从通过信使RNA将化学片段链接来制造蛋白,这是DNA的分子交付。每一部分,或氨基酸,对应于信使中的三个碱基,反过来,转运RNA编码的三个互补碱基。三人中的每个碱基都对应RNA上的一个化学成分。为了使蛋白质的合成,tRNA必须在两个不同位点结合到核糖体 - 一个解码信息,另一个连接新的氨基酸去合成新的蛋白质。After each amino acid is added, the ribosome must crawl along the message to create additions. Exactly how this crawling occurs has been a mystery for several decades. Researchers have suspected that ratcheting motions of the two ribosomal subunits are key to allowing RNA and associated catalysts into the complex structure of the ribosome so the RNA and ribosome can couple at the crucial sites to create proteins. In the Nature paper, the researchers discovered that the majority of crawling (movement along messenger RNA) occurs during a new kind motion, "head swivel," rather than ratcheting.每个氨基酸添
1、雷公藤红素抑制CML细胞增殖作者首先进行了网络药理学分析,以评估在治疗CML方面最有效的天然产物。通过对3882种天然产物进行了网络药理学分析,发现从传统中药“雷公藤”(Tripterygium wilfordii)根皮中提取的五环三萜雷公藤红素在抑制CML方面排名第一。为了验证网络药理学筛选的可靠性,作者在CML细胞中进行细胞活力测定。选择18β-甘草次酸作为阴参,因为它与雷公藤红素的结构最相似,但在3882 种天然产物中预测得分不高,选择17-AAG(HSP90抑制剂,已有文章报道HSP90是雷公藤红素的靶点)和TKI 药物伊马替尼作为阳参。结果表明雷公藤红素、17-AAG和伊马替尼均能有效抑制CML细胞增殖,而18β-甘草次酸几乎不影响细胞生长。作者进一步开展细胞实验,发现雷公藤红素对K562和K562T315I细胞表现出抗增殖活性,诱导细胞凋亡。尽管对雷公藤红素的研究很深入,但尚未系统地鉴定出雷公藤红素在CML中的直接蛋白质靶点,尤其是在耐药性CML细胞中 雷公藤红素抑制CML细胞增殖2、雷公藤红素处理后 K562T315I 细胞的转录组和蛋白质组学分析接着,作者通过RNA 测序发现富集的通路包括铁死亡、蛋白水解调节、响应p53介导的DNA损伤等。作者还进行了蛋白质组学分析雷公藤红素对K562T315I细胞中蛋白质表达水平的调节,下调蛋白主要富集于DNA和RNA代谢途径以及 DNA损伤反应,以及蛋白质加工途径。MCODE分析发现“对DNA损伤刺激的反应”和“对未折叠蛋白的反应”分别是最具特征性的途径。雷公藤红素与其已知靶标HSP90的相互作用可能是“对未折叠蛋白的反应”上调的关键贡献事件。而目前尚未有报道称雷公藤红素的直接蛋白质靶标与“对DNA损伤刺激的反应”途径有关( 雷公藤红素处理后 K562T315I 细胞的定量蛋白质组学分析3、雷公藤红素处理后 K562T315I 细胞的CETSA-MS分析作者接着检测了K562T315I细胞中celastrol处理后可溶性蛋白质水平的变化,在雷公藤红素处理后鉴定了178种差异溶解蛋白质,主要位于DNA中心区域,包括细胞核和线粒体,更具体地说是在DNA损伤位点。此外,“分子伴侣复合物”中溶解度降低,这可能是由于雷公藤红素和HSP90之间的互作所致 雷公藤红素处理后 K562T315I细胞的CETSA-MS分析4、雷公藤红素诱导 K562T315I 细胞DNA损伤对 K562T315I细胞经雷公藤红素处理后总蛋白和可溶性蛋白水平变化的系统分析表明,雷公藤红素主要诱导K562T315I细胞中的DNA损伤和未折叠蛋白反应。因此,作者进行了实验来验证这些观察结果。结果显示雷公藤红素显著诱导γ-H2AX(DNA损伤的常见标志物)的表达,并降低DNA损伤修复相关蛋白FANCD2水平,彗星试验进一步证实了雷公藤红素促进的DNA损伤( 雷公藤红素诱导 K562T315I细胞DNA损伤5、雷公藤红素在K562T315I细胞中的靶点鉴定然后,作者在细胞裂解物中开展质谱耦合等温剂量反应-细胞热位移分析(MS-ITDR-CETSA)实验,以确定雷公藤红素的直接蛋白质靶标,特别是那些参与DNA损伤反应的蛋白质靶标。在检测到的3393种蛋白质中,有12种蛋白质表现出热稳定性的显著变化,代表了最有潜力且可信度高的靶标蛋白质。值得注意的是,雷公藤红素的已知靶标HSP90 (HSP90AA1和HSP90AB1) 的热稳定性仅表现出很小的变化,并且没有超过阈值。对这12个潜在靶标和定量蛋白质组学以及CETSA-MS分析的差异蛋白进行PPI分析,发现 YY1均为最紧密相关的蛋白质。因此,YY1与所有这些DEP/DSP的关联节点数量最多,并且可能是与DNA损伤相关的最重要的靶标。现有研究表明,YY1作为转录因子,可以调节参与DNA修复和细胞存活的各种蛋白质的表达,以响应DNA损伤。此外,HMCES已被确定为通过屏蔽脱碱基位点来保护基因组完整性免受氧化碱基损伤的关键蛋白。因此,作者继续通过蛋白质印迹结合细胞热位移分析(WB-CETSA)验证了celastrol与YY1和HMCES的互作。同样,报道的阳性对照HSP90蛋白也显示出明显的热稳定性增加( 雷公藤红素在K562T315I细胞中的靶点鉴定6、雷公藤红素与YY1和HMCES相互作用的验证为了进一步验证celastrol与YY1和HMCES的直接相互作用,合成了可点击炔烃标签功能化celastrol探针(Cel-P),该探针保留了celastrol对K562T315I细胞的抑制活性。利用该探针开展Pulldown实验发现Cel-P 能够成功地从细胞中拉下HMCES和HSP90蛋白,但由于尚不清楚的原因,在蛋白质印迹膜上的下拉样本中未检测到YY1。随后,表达并纯化重组YY1(rYY1)蛋白,发现随着Cel-P浓度的增加,rYY1的标记以剂量依赖性方式增加 雷公藤红素与YY1和HMCES相互作用的验证7、雷公藤红素通过靶向YY1和HMCES诱导DNA损伤在验证了celastrol与YY1和HMCES之间的相互作用后,作者继续在K562T315I细胞中敲低 YY1或HMCES。结果显示YY1或HMCES的敲低显著增加了DNA损伤的发生率,同时影响细胞生长,增强细胞对celastrol的敏感性。此外,与HMCES相比,YY1敲低对细胞的影响更为显著,表明YY1发挥着更为重要的作用。对接分析显示,与HMCES相比,celastrol对YY1的亲和力略强,且Celastrol与YY1上的Leu132和Val316形成氢键,与HMCES的Glu127、Arg130和Arg137形成氢键 雷公藤红素通过靶向 YY1 和 HMCES 诱导 DNA 损伤鉴于YY1在雷公藤红素诱导的DNA损伤反应中发挥关键作用,作者对YY1蛋白进行了进一步实验。发现YY1过表达对细胞生长没有显著影响,但减轻了雷公藤红素引起的细胞死亡和DNA损伤,且通过裂解的PARP1和Caspase-3水平发现YY1表达与雷公藤红素诱导的细胞凋亡呈负相关。使用双荧光素酶报告基因发现雷公藤红素显著抑制了YY1的转录活性,BLI结合试验发现celastrol 可以与 rYY1 结合(图8)。图8 YY1在雷公藤红素诱导的 K562T315I细胞DNA损伤和细胞死亡中起关键作用总结研究使用多组学方法对雷公藤红素的作用机理进行了系统研究,利用蛋白质组范围的无标记靶标反卷积方法MS-CETSA来识别雷公藤红素的蛋白质靶标。研究不仅验证了雷公藤红素通过靶向HSP90来诱导未折叠蛋白反应,而且还发现它通过直接靶向耐药 K562T315ICML 细胞中的YY1和HMCES来诱导DNA损伤(图9)。研究有助于更好地理解雷公藤红素的多方面机制。研究提供了一种有效的系统药理学工作流程范例,该范例集成了网络药理学分析、蛋白质丰度和溶解度测量以及 MS-CETSA,以揭示任何天然产物或活性化合物的作用机理。
1月2日,佛山奥素博新科技有限公司(以下简称奥素科技)宣布完成近亿元A轮融资。本轮融资由鲁信创投领投,老股东启明创投、线性资本、同创伟业等持续加码,凯乘资本(WinX Capital)担任财务顾问。本轮融资后,奥素科技将进一步加速在单细胞蛋白组学领域的商业化推广,提供差异化的产品和服务,填补实验室样本预处理、功能发现及验证等需求的空白,力争将中国制造的先进生命科学仪器推向全球市场。奥素科技成立于2021年,具有全球领先的有源数字微流控液滴操控平台,在两年多时间内已连续获得四轮融资,股东包括诸多顶级VC及知名产业投资人。公司推出的第一款商业化产品Boxmini? SCP,是全球首款全流程微流控片上单细胞蛋白组学样本前处理工具,高效协助用户实现高通量、快速、精确的微量样本控制,一站式完成复杂的单细胞蛋白质样本前处理工作,且对无标记和TMT标记处理方案均可适配,产品推出后备受市场关注。[img=图片]https://img1.17img.cn/17img/images/202401/uepic/ea05f042-359a-4e3c-a6db-2edf2fa796f0.jpg[/img]对于本次融资,[b]奥素科技创始人兼CEO马汉彬博士[/b]表示:“将消费电子半导体技术引入到生命科学领域,奥素团队已经完成了0到1的积累:特别是在单细胞蛋白质组学样本前处理应用场景,我们通过有源数字微流控微芯片上纳升样本精准操控及全流程集成能力,获得了海内外多位头部PI的认可并产生了对整个领域有促进意义的实验结果;在单细胞多组学、微生物及合成生物学等其他领域,奥素也将与不同的下游伙伴携手前行,加速新产品的开发及商业化落地。我们将在新老股东的支持下,利用产品技术优势,迅速开拓海内外市场,以单细胞蛋白质组学产品为突破点,通过开放式数字微流控共享平台打造半导体技术的生物芯片生态,让生命科学实验室及医疗检验自动化快速迈入消费电子时代。”此前,在仪器信息网[url=https://www.instrument.com.cn/webinar/meetings/icca2023][font=arial][color=#000000]第六届细胞分析网络大会(iCCA2023)的【单细胞分析技术】专题会场中,[/color][/font][/url][url=https://www.instrument.com.cn/webinar/meetings/icca2023]马汉彬[/url]研究员分享《[url=https://www.instrument.com.cn/webinar/meetings/icca2023][font=arial][color=#c00000] [/color][/font][color=#c00000]基于有源数字微流控的单细胞分选和操控系统[/color][/url]》的主题报告。[url=https://www.instrument.com.cn/webinar/meetings/icca2023][i](详情点击)[/i][/url][align=center][url=https://www.instrument.com.cn/webinar/meetings/icca2023][img=,200,200]https://img1.17img.cn/17img/images/202308/uepic/34781884-5a9f-4e5a-b5df-03783a77c663.jpg[/img][/url][/align][align=center][url=https://www.instrument.com.cn/webinar/meetings/icca2023]马汉彬 中国科学院苏州生物医学工程技术研究所 研究员[/url][/align]马汉彬研究员课题组也在2023年成功研发出了一套基于大面积薄膜晶体管开关阵列的有源数字微流控平台,在Analytical Chemistry发表并被选为当期的封面论文。[url=https://www.instrument.com.cn/news/20230817/680090.shtml][i](详情点击)[/i][/url][align=center][img=7872d6238fc05517bb5f145142a71dee_7b4ffe77-43f0-48a2-886a-b31b248d32ca.jpg,350,465]https://img1.17img.cn/17img/images/202401/uepic/e362de5d-8580-4bc7-baf3-7272a8a7d52c.jpg[/img][/align]本轮领投方,[b]鲁信创投副总经理邱方[/b]表示:“鲁信创投作为国有控股的专业创投机构,一贯秉持以创业投资形式,支持我国自主的研究平台、仪器设备成果应用转化,将实现我国高水平科技自立自强的任务放在首位。奥素科技掌握有源数字微流控的核心底层技术,有潜力将实验室自动化推进到一个全新的局面,形成新的研究平台。公司推出的单细胞蛋白组学产品,为单细胞多组学等前沿研究提供先进工具,在包括鲁信已投企业在内的下游客户中引起强烈关注,体现出国产科学仪器的高水平自立自强,即将迎来新的局面。鲁信创投将支持奥素科技,打好科学仪器设备国产化攻坚战。”[b]启明创投合伙人陈侃[/b]表示:“启明创投作为上轮领投方,已连续两轮增资奥素科技。公司凭借强大的研发能力和优秀的执行力,快速的推出了单细胞领域的尖刀产品,面向一片蓝海市场。我们对公司未来充满信心,继续助力公司海外市场的商业化,期待奥素科技将“中国智造”先进科学仪器推向世界。”[b]线性资本董事总经理郑灿[/b]表示:“线性资本作为天使轮领投方,坚定认为投资要找到正确的人。我们亲眼见证了马汉彬博士从一名科研工作者向现代企业家的转变。马汉彬博士的为人、科学素养、前沿视野和企业家精神令我们印象深刻。在他带领下,公司首先推出了具有划时代意义的单细胞蛋白质组学解决方案,为全球蛋白组学领域研究再填一把火。我们本轮继续增持,推动奥素科技向先进科学仪器标杆企业迈进。”[b]同创伟业北京医药基金合伙人郗砚彬[/b]表示:“我们始终认为,奥素科技的数字微流控芯片系统,有望成为下一代生命科学微反应器的关键载体,持续为科学研究、医药工业等提供创新解决方案。公司的单细胞蛋白组学产品,将蛋白组学研究推进到了切实可行的单细胞颗粒度,使客户能够不再受工具所限,以全新的角度验证所知和探索未知。我们本轮继续增持,期待奥素科技能够让先进技术在应用层面全面开花。”[b]凯乘资本创始合伙人邹国文[/b]表示:“凯乘资本很荣幸连续第三轮担任奥素科技融资的财务顾问,见证了奥素从初创、一路飞速发展及商业化;作为数字微流控行业头部企业,奥素能够穿越市场周期,在不到三年的时间连续获得四轮融资,充分体现了资本端对公司的高度认可。期待奥素在下游领域的进一步拓展,成为世界领先的生命科学工具企业。”[b]关于鲁信创投:[/b]鲁信创投是山东省鲁信投资控股集团有限公司控股的省内最大、国内具有重要影响力的专业创投机构,是国内资本市场首家上市的创投机构(股票代码:600783.SH)。成立20余年以来,管理运作各类基金已达40余只,基金规模约200亿元,覆盖医疗健康、军民融合、先进制造、电子信息、新能源、新材料等细分产业,境内外上市公司40余家,在医疗健康领域先后投资了思路迪、硅基仿生、中科新生命、爱博泰克、唯迈医疗、美东汇成、英赛斯、荣昌生物等一批优秀企业。[来源:仪器信息网] 未经授权不得转载[align=right][/align]
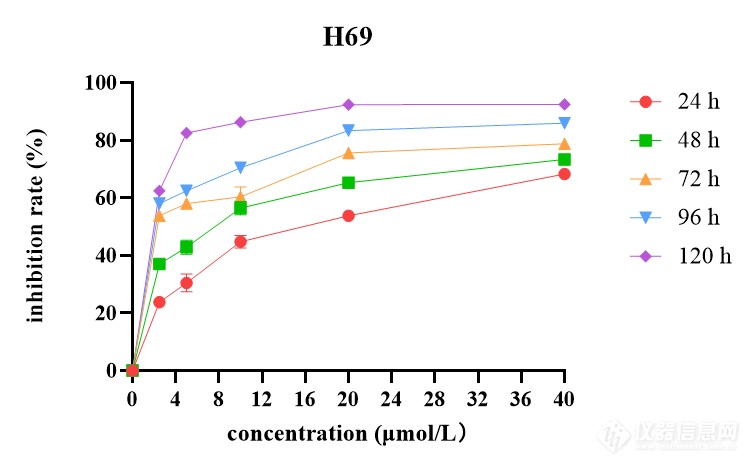
[align=left][size=18px]西达本胺促进[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系组蛋白乙酰化[/size][/align][align=left][size=18px] [/size][size=18px] [/size][size=16px]为验证西达本胺是否上调[/size][size=16px]SCLC[/size][size=16px]细胞系的乙酰化水平,我们使用[/size][size=16px]Western blot[/size][size=16px]检测了不同浓度([/size][size=16px]I[/size][size=16px]C10[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系中乙酰化组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平,并以组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平为对照。结果如图所示。在四种亚型细胞系中,总组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平无变化,乙酰化组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达量随加药浓度增大而增多,这证明了西达本胺对[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系组蛋白乙酰化的促进作用,这种作用呈剂量依赖性。[/size][/align][align=left][size=18px]A[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350400898_8640_5887180_3.png[/img][/align][align=left][/align][align=left][/align][align=left][/align][align=center][/align][align=left][size=18px] [/size][size=18px]西达本胺通过线粒体凋亡途径诱导[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系凋亡[/size][/align][align=left][size=16px]我们的功能实验表明,西达本胺[/size][size=16px]可剂量依赖的[/size][size=16px]促进[/size][size=16px]SCLC[/size][size=16px]细胞[/size][size=16px]系[/size][size=16px]凋亡[/size][size=16px],但其机制尚未明确。[/size][size=16px]依据国内外报道,西达本胺主要通过线粒体凋亡途径诱导细胞凋亡[/size][size=16px]。除此之外,[/size][size=16px]西达本胺[/size][size=16px]能[/size][size=16px]使[/size][size=16px]线粒体[/size][size=16px]DNA[/size][size=16px]双链断裂,发生损伤。[/size][size=16px]为探究其是否通过此途径在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系中发挥作用,我们检测了加药[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]细胞中由线粒体介导的[/size][size=16px]C[/size][size=16px]aspase[/size][size=16px]信号通路相关蛋白[/size][size=16px]Bcl-2[/size][size=16px],[/size][size=16px]Bax[/size][size=16px],细胞色素[/size][size=16px]C[/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 9[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved Caspase 9[/size][size=16px],[/size][size=16px]P[/size][size=16px]ARP[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved [/size][size=16px]PARP[/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 3[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved Caspase 3[/size][size=16px]以及[/size][size=16px]D[/size][size=16px]NA[/size][size=16px]双链断裂标志物[/size][size=16px] [/size][size=16px]γH2AX[/size][size=16px]表达水平。[/size][size=16px]Western blot[/size][size=16px]结果显示,[/size][size=16px]Ca[/size][size=16px]spase 9[/size][size=16px],[/size][size=16px]P[/size][size=16px]ARP[/size][size=16px] [/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 3[/size][size=16px]表达水平无明显变化,[/size][size=16px]Bcl-2[/size][size=16px]表达下调,其余蛋白表达均上调。这些结果表明,在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞中,西达本胺可以通过线粒体凋亡途径诱导细胞凋亡。[/size][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][size=16px]A[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350402755_79_5887180_3.png[/img][/align][align=left][size=18px] [/size][size=18px]西达本胺通过抑制[/size][size=18px]C[/size][size=18px]yclin-CDK[/size][size=18px]复合物活性阻滞[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系周期[/size][/align][align=left][font='宋体'][size=16px]据文献报道,[/size][/font][size=16px]不同[/size][size=16px]HDACI[/size][size=16px]对不同细胞阻滞时相不一致。为验证西达本胺对[/size][size=16px]SCLC[/size][size=16px]细胞周期的作用,我们检测了[/size][size=16px]经[/size][size=16px]西达本胺[/size][size=16px]处理[/size][size=16px]48[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H446[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]细胞中细胞周期相关蛋白的表达水平,如图所示。[/size][size=16px]在[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞系中[/size][size=16px]P21[/size][size=16px]、[/size][size=16px]P27[/size][size=16px]表达上调,[/size][size=16px]C[/size][size=16px]yclin A2[/size][size=16px]与[/size][size=16px]C[/size][size=16px]DK[/size][size=16px]2[/size][size=16px]表达下调[/size][size=16px],[/size][size=16px]说明西达本胺阻滞[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]于[/size][size=16px]S[/size][size=16px]期。在[/size][size=16px]H446[/size][size=16px]细胞系中[/size][size=16px]C[/size][size=16px]yclin E1[/size][size=16px]与[/size][size=16px]C[/size][size=16px]DK2[/size][size=16px]表达下调[/size][size=16px],说明西达本胺阻滞其于[/size][size=16px]G[/size][size=16px]1[/size][size=16px]/S[/size][size=16px]期。[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350422585_1956_5887180_3.png[/img][size=16px] [/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350405804_8826_5887180_3.png[/img][/align][align=left][size=18px]小结[/size][/align][size=16px]1[/size][size=16px].[/size][size=16px]西达本胺可以增强[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系组蛋白乙酰化水平。[/size][size=16px]2.[/size][size=16px]西达本胺诱导[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞凋亡的机制可能与其激活线粒体介导的[/size][size=16px]caspase[/size][size=16px]凋亡途径有关。[/size][size=16px]3[/size][size=16px].[/size][size=16px]西达本胺可阻滞[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞周期,可能与其上调细胞周期蛋白激酶抑制剂表达、从而抑制[/size][size=16px]C[/size][size=16px]yclin-CDK[/size][size=16px]复合物活性有关。[/size]
一、原理:本法系依据特异性抗体(免疫球蛋白)F a b段与红细胞上已包被的相应抗原结合,抗体暴露出F c段补体Clq的结合位点,从而激活后续的补体各成分,最终导致红细胞的细胞膜受到攻击、破裂,释放出血红蛋白。通过溶血反应动力学曲线,计算人免疫球蛋白激活补体活性的功能指数(4 ) ,以此测定供试品F c段生物学活性。二、试剂(1) P B S (pH7.2) 称取无水磷酸氢二钠1.02g,无水磷酸二氢钠0.34g、氣化钠8.77g,加适量水溶解,用lmol/L氢氧化钠溶液或盐酸溶液调p H 值至7.2,再加水稀释至1000ml。( 2 )钙-镁贮备液 称取氯化钙1.10g、氯化镁5. 0 8 g ,加水25ml使溶解。( 3 )巴比妥-钙镁贮备液称取氯化钠51.85g、巴比妥钠6.37g,加水1000ml使溶解,加人钙-镁贮备液3.125ml,用lmol/L盐酸溶液调p H 值至7. 3,再加水稀释至1250ml。除菌过滤后4°C保存备用。( 4 )牛白蛋白-巴比妥缓冲液称取牛血清白蛋白0. 15g加入巴比妥-钙镁贮备液20 m l中,加水溶解并稀释至100ml。临用前配制。(5) 1. 3mg/L 鞣酸 P B S (pH7. 2) 溶液A 液称取鞣酸l m g ,加PBS (pH7.2) 10ml,使溶解。B 液量取 A 液 0.1ml,加 F*BS (pH7. 2) 7.5ml,混匀,即得,临用前配制。(6) 10%氯化铬溶液称取氯化铬5g,加生理氯化钠溶液50ml使溶解。4°C保存(可保存半年)。(7) 1 % 氯化铬溶液取1 0 %氯化铬溶液0. lml,加生理氯化钠溶液0.9ml,混匀。临用前配制。(8)敏化红细胞的制备A 液取健康人抗凝的O 型血3 人份以上混合,用P B S 洗涤3 次,最后一次以每分钟2 0 0 0转离心1 0分钟分离红细胞。取适量压积红细胞悬浮于1 . 3 m g / L鞣酸P B S(1 : 4 0 ) , 置3 7 ° C水浴中轻摇3 0分钟后再用P B S 洗涤3次,最后用P B S 制备成2. 5 % 红细胞悬浮液。B 液用P B S适当稀释的白喉类毒素或腮腺炎病毒与1 % 氯化铬溶液0.25ml混合(1 0 : 1 ) 后,置37°C水浴中轻摇1 5分钟。将A 液、B 液按1 : 4 混合,置37°C水浴中轻摇3 0分钟。离心,去上清液,用P B S将沉淀(敏化红细胞)洗涤3 次,用牛白蛋白-巴比妥缓冲液悬浮红细胞,调节至适宜浓度,使其在波长5 4 1 n m处的吸光度为1.0土0. 1。
1、C反应蛋白概述 1930年Tillet和Francis在急性大叶性肺炎患者血清中发现一种物质,能在钙离子存在时与肺炎球菌C-多糖起沉淀反应,随后证实这种能与C-多糖反应的物质是一种蛋白质,因而将这种蛋白质命名为C反应蛋白(C-reactive protein,CRP)。 CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白(注:急性时相反应包括感染、炎症及创伤时某些血清蛋白浓度的变化,这些蛋白除CRP外,还包括血清淀粉样蛋白A、纤维蛋白原、触珠蛋白、α1酸性糖蛋白、铜蓝蛋白、α1抗胰蛋白酶等。其中CRP在健康人血清中浓度<5mg/L,而在细菌感染或组织损伤时,浓度可升高上千倍,循环中的CRP半衰期为19小时,故被认为其最有价值),由五个相同的亚基依靠非共价键形成的环状五聚体,这一特征性结构使其归类于五聚素(一组具有免疫防御特性的钙结合蛋白)家族。CRP是机体非特异性免疫机制的一部分,它结合C-多糖,在Ca2+存在时可结合细胞膜上磷酸胆碱,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成,在动脉粥样硬化斑块中也可检测到CRP。 人CRP主要生物学功能: 通过与配体(凋亡与坏死的细胞,或入侵的细菌、真菌、寄生虫等的磷酰胆碱)结合,激活补体和单核吞噬细胞系统,将载有配体的病理物质或病原体清除。 (1)识别外来物质,激活补体系统; (2)增强条理作用,增强吞噬细胞吞噬作用; (3)与血小板激活因子(RAF)结合,降低炎症反应; (4)与染色体结合,消除坏死组织里的细胞DNA。
朊蛋白是所有哺乳动物的神经细胞里都有的一种蛋白质。每个神经细胞里都有无数的朊蛋白,但没有人确切知道朊蛋白的作用。如上所述,在染上疯牛病的牛和克雅氏病/新型克雅氏病患者的脑内都有许多变异朊蛋白。而朊蛋白假说是指: 口蹄疫除了疯牛病,您可能还听说过口蹄疫。 一个人从受污染的食品中吸收了变异朊蛋白。 变异朊蛋白被吸收到血流中并进入神经系统。 变异朊蛋白接触正常朊蛋白并改变其形状,使成为变异朊蛋白,从而破坏正常朊蛋白的原有功能。 然后,原有的和新形成的变异朊蛋白接触并改变神经细胞中其他正常朊蛋白的形状。
[b][font=宋体]整合蛋白和跨膜蛋白定义:[/font][/b][font=宋体] [/font][font=宋体]整合蛋白和跨膜蛋白是两类重要的蛋白质,它们在细胞分子水平上起着重要的作用。[/font][font=宋体] [/font][font=宋体]整合蛋白,也称为内在蛋白或跨膜蛋白,部分或全部镶嵌在细胞膜中或内外两侧,以非极性氨基酸与脂双分子层的非极性疏水区相互作用而结合在质膜上。它们是生物膜的基本结构成分,许多具重要生理功能的膜蛋白均属整合蛋白,如膜结合的酶类、载体蛋白、通道蛋白、膜受体等。[/font][font=宋体] [/font][font=宋体]跨膜蛋白,是可以跨越细胞膜的蛋白,它在细胞的信号传递系统中担当着重要的角色。跨膜蛋白在结构上可以分为单次跨膜、多次跨膜、多亚基跨膜等,它们具有能够跨越细胞膜的能力。[/font][font=宋体] [/font][b][font=宋体]整合蛋白和跨膜蛋白在位置、结构和功能上存在显著的差异[/font][/b][font=宋体] [/font][font=宋体]①位置:整合蛋白主要存在于细胞质内,细胞核或其他非细胞膜结构中,它们容易在细胞中自由移动。而跨膜蛋白则嵌入细胞膜中,一部分位于细胞膜的胞外侧,另一部分位于细胞膜的胞内侧,形成了一个穿过细胞膜的通道。[/font][font=宋体][font=宋体]②结构:整合蛋白的结构通常由两个独立的部分组成,一个是靠近细胞膜的膜结合区域([/font][font=Calibri]TM[/font][font=宋体]),另一个是靠近细胞骨架的非膜结合区域([/font][font=Calibri]N-TM[/font][font=宋体])。当接受到外界的信号时,整合蛋白的[/font][font=Calibri]TM[/font][font=宋体]区域会被激活,把来自外界的信号转化为细胞内可以识别的信号,直接参与细胞信号传导系统中。[/font][/font][font=宋体]③功能:整合蛋白主要是用来从外界传达信号到细胞内,充当细胞与外界信号的桥梁。而跨膜蛋白则在细胞的信号传递系统中担当着重要的角色。[/font][font=宋体]总的来说,整合蛋白和跨膜蛋白在位置、结构和功能上存在显著的差异,这些差异使得它们在生物体中扮演着不同的角色。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins][b]跨膜蛋白表达与制备服务[/b][/url],制备流程图:基因合成[/font][font=宋体]→载体构建→细胞转化[/font][font=Calibri]/[/font][font=宋体]转染→蛋白表达→细胞收集→细胞破碎→膜脂提取→膜脂增溶→蛋白纯化→质量检测,同时义翘拥有[/font][/font][b][font=宋体]三大跨膜蛋白制备平台[/font][/b][font=宋体],可以为客户提供全面的多次跨膜蛋白产品和服务。同时,为基础研究和药物研发提供更加优质的原材料。[/font][font=宋体] [/font][b][font=宋体][font=Calibri]VLP[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=宋体]正确折叠的膜蛋白在细胞膜上表达,类病毒颗粒[/font][font=Calibri]VLP[/font][font=宋体]通过出芽的方式包裹上携带有靶标蛋白的细胞膜,形成包膜的[/font][font=Calibri]VLP[/font][font=宋体]。它是由病毒的衣壳蛋白通过自组装而形成的纳米级颗粒(直径约[/font][font=Calibri]100[/font][font=宋体]~[/font][font=Calibri]300[/font][font=宋体]纳米),不含病毒核酸,不能进行自主复制,生产操作过程中较为安全。产生的[/font][font=Calibri]VLP[/font][font=宋体]蛋白可直接像可溶蛋白一样进行包被进行[/font][font=Calibri]ELISA[/font][font=宋体]检测。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州已成功开发[/font][font=Calibri]VLP[/font][font=宋体]技术平台,它可以将完整天然构象的膜蛋白展示在类病毒颗粒表面,这种方法不仅可以保留膜蛋白的完整结构,同时也能够真实地模拟其在细胞膜上的位置和构象。[/font][/font][font=宋体] [/font][b][font=宋体]去垢剂技术平台[/font][/b][font=宋体][font=宋体]由于存在疏水结构域,跨膜蛋白与膜的结合非常紧密,需要用去垢剂([/font][font=Calibri]detergent[/font][font=宋体])才能从膜上洗涤下来,[/font][font=Calibri]Detergent[/font][font=宋体]作为一种两亲性分子,疏水尾部包裹目的蛋白的疏水区域,亲水头部位于与溶液接触的界面。微团的形成是膜蛋白增溶的基础,当去垢剂浓度高于[/font][font=Calibri]CMC[/font][font=宋体]([/font][font=Calibri]Critical micelle concentration[/font][font=宋体],临界胶束浓度)时会形成微团,增溶后,去垢剂将蛋白周围的磷脂置换,从而实现收集目标膜蛋白的目的,后续再进行蛋白纯化,最终蛋白呈现在含有[/font][font=Calibri]Detergent[/font][font=宋体]的溶液中。义翘神州成功搭建了去垢剂技术平台,利用该平台可有效提高跨膜蛋白的产量和纯度。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]结构稳定,与天然的生物膜非常相似,使得[/font][font=Calibri]Nanodisc[/font][font=宋体]能够很好地应用于膜蛋白的研究。目前[/font][font=Calibri]Nanodisc[/font][font=宋体]平台有[/font][font=Calibri]2[/font][font=宋体]种方式,一种是基于苯乙烯马来酸酐共聚物([/font][font=Calibri]SMA[/font][font=宋体])组装的[/font][font=Calibri]SMA-Nanodisc[/font][font=宋体]平台,如下图(左)所示,它可以直接从细胞膜上提取膜蛋白,使其变为可溶性蛋白,组装完成的蛋白样品很稳定,更能维持蛋白的天然构象。另一种是基于膜骨架蛋白([/font][font=Calibri]MSP[/font][font=宋体])的[/font][font=Calibri]MSP-Nanodisc[/font][font=宋体]平台(下图右),它需要先将膜蛋白利用去垢剂制备出来,然后再加入磷脂分子和[/font][font=Calibri]MSP[/font][font=宋体]进行组装。通过调整磷脂、[/font][font=Calibri]MSP[/font][font=宋体]和待组装膜蛋白三者的比例,可以使得待组装膜蛋白在[/font][font=Calibri]Nanodisc[/font][font=宋体]中呈不同聚集状态。义翘神州已成功搭建了[/font][font=Calibri]Nanodisc[/font][font=宋体]技术平台,利用跨膜蛋白与磷脂结合能够维持其良好活性的特性,制备出稳定的产品,满足动物免疫、抗体筛选、[/font][font=Calibri]cell-based assays[/font][font=宋体]等场景。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins[/font][/font]
[font=宋体][font=宋体]重组蛋白([/font][font=Calibri]recombinant protein[/font][font=宋体])是指应用重组 [/font][font=Calibri]DNA [/font][font=宋体]或重组 [/font][font=Calibri]RNA [/font][font=宋体]技术而获得的蛋白质。重组蛋白工程先应用基因克隆或化学合成技术获得目的基因([/font][font=Calibri]gene of interest[/font][font=宋体],[/font][font=Calibri]GOI[/font][font=宋体]),连接到适合的表达载体,导入到特定的宿主细胞,利用宿主细胞的遗传系统,表达出有功能的蛋白质分子。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白的产生是应用了重组[/font][font=Calibri]DNA[/font][font=宋体]或重组[/font][font=Calibri]RNA[/font][font=宋体]的技术从而获得的蛋白质。体外重组蛋白的生产主要包括四大系统:原核蛋白表达,哺乳动物细胞蛋白表达,酵母蛋白表达及昆虫细胞蛋白表达。生产的蛋白在活性和应用方法方面均有所不同。根据自身的下游运用选择合适的蛋白表达系统,提高表达成功率。[/font][/font][font=宋体] [/font][font=宋体]其获得途径可以分为体外方法和体内方法。两种方法的前提都是应用基因重组技术,获得连接有可以翻译成目的蛋白的基因片段的重组载体,之后将其转入可以表达目的蛋白的宿主细胞从而表达特定的重组蛋白分子。[/font][font=宋体] [/font][font=宋体][font=宋体][b]当前重组蛋白的生产主要有四大系统[/b]:原核表达系统:最常用的大肠杆菌蛋白表达,真核表达系统如酵母,哺乳动物细胞蛋白表达(常用的细胞[/font][font=Calibri]CHO[/font][font=宋体],[/font][font=Calibri]HEK293[/font][font=宋体])及、昆虫细胞蛋白表达系统。重组蛋白的产生尚可利用转基因动物的乳腺或者植物产生,产生的重组蛋白作为生物制药的产物,在医学中作用显著。利用基因工程技术,可以使细胞或者动物本身变成“批量生产药物的工厂”。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]以利用转基因动物的乳腺表达重组蛋白为例:其方法是将药用蛋白基因与乳腺蛋白基因的启动子等调控组件重组在一起,通过显微注射等方法,导入哺乳动物(哺乳动物才会泌乳)的受精卵中,然后,将受精卵送入母体内,使其生长发育成转基因动物。转基因动物进入泌乳期后,可以通过分泌的乳汁来生产所需要的蛋白质药品,因而称为动物乳腺生物反应器或乳房生物反应器。科学家已在牛和山羊等动物的乳腺生物反应器中表达出了抗凝血酶、血清白蛋白、生长激素和[/font][font=宋体]α[/font][font=Calibri]-[/font][font=宋体]抗胰蛋白酶等重要的医药产品。[/font][/font][font=宋体]重组蛋白在制药工业上主要是指表达获得的细胞因子、凝血因子或者人工设计的蛋白分子。[/font][font=宋体] [/font][font=宋体][font=宋体]目前,重组蛋白试剂已被广泛应用于生物药、细胞免疫治疗及诊断试剂的研发和生产中。其中重组蛋白药物是生物药物的重要组成成分,常被被广泛应用于医疗领域[/font][font=Calibri],[/font][font=宋体]包括肿瘤治疗、免疫调节、神经保护、结缔组织疾病、肾病治疗等。包括细胞因子类、抗体治疗性疫苗、激素及酶等。[/font][/font][font=宋体] [/font][font=宋体]义翘神州致力于提供[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白生产[/b][/url]、[url=https://cn.sinobiological.com/resource/protein-review/protein-expression][b]重组蛋白表达[/b][/url]及[url=https://cn.sinobiological.com/resource/protein-review/protein-production-systems][b]重组蛋白系统[/b][/url]详情的咨询与解决方案。为实验中特定的应用选择正确的表达系统是成功的关键所在。在选择表达系统时,蛋白溶解度、功能、纯化速度和产量通常是必须考虑的重要因素。此外,每个表达系统都有其独特的优势和挑战,这一点在选择时也需着重考虑。我们的专业团队将为您提供个性化的建议,以帮助您根据实验需求选择最合适的表达系统。[/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][font=Calibri] [/font]
细胞是如何出口和嵌入蛋白于细胞膜Grenoble, 12 December 2010 How cells export and embed proteins in the membraneEMBL scientists first to visualise crucial stephttp://www.embl.de/aboutus/communication_outreach/media_relations/2010/101212_Grenoble/index.htmlLike an overprotective parent on the first day of school, a targeting factor sometimes needs a little push to let go of its cargo. Scientists at the European Molecular Biology Laboratory (EMBL) in Grenoble, France, have visualised one such hand-over. They were the first to determine the structure of a ribosome-protein complex involved in carrying nascent proteins out of the cell. Their work, published online today in Nature Structural and Molecular Biology, could increase understanding of illnesses such as cystic fibrosis and some forms of Parkinson’s disease, in which improper protein targeting leads proteins to harmfully accumulate inside cells.In most organisms, proteins destined to cross or be embedded in a membrane contain a polypeptide sequence that is recognized during translation by a targeting factor known as the signal recognition particle (SRP). SRP binds to the ribosome synthesizing the polypeptide, and subsequently also binds an SRP receptor, located next to the machinery that transfers proteins across the membrane and out of the cell. EMBL scientists have now generated the first-ever structural image of this important step in the process.“The SRP receptor acts as a switch between the cargo binding and the release,” says Christiane Schaffitzel, who led the research at EMBL, “Now we have seen for the first time how the release can happen at a molecular level.”Schaffitzel’s group is taking structural snapshots of entire pathways by which proteins are synthesized and targeted to their final positions. To capture this hand-over step, the scientists had to overcome the fact that the link between SRP and its receptor is usually transient, chemically unstable. They engineered the SRP receptor so that it would bind more stably to SRP, then introduced ribosomes and observed the resulting complexes using cryo-electron microscopy (cryo-EM).Cryo-EM can be performed in roughly physiological conditions, providing a picture that closely resembles what happens in living cells. This picture can then be combined with higher-resolution crystallography data and biochemical studies – an exciting hybrid approach the EMBL scientists will further exploit to follow protein targeting all the way from start to finish.A particular asset for success in this project was the close collaboration with Guy Schoehn at the Institut de Biologie Structurale (IBS). IBS and EMBL are part of the Partnership for Structural Biology (PShttp://i.0dxy.cn/images_new/smiles/smile_blackeye.gif in Grenoble, France.Source ArticleEstrozi, L.F., Boehringer, D., Shan, S., Ban, N., Schaffitzel, C.. Cryo-EM structure of the E. coli translating ribosome in complex with SRP and its receptor. Nature Structural and Molecular Biology, Advance Online Publication 12 December 2010. DOI: 10.1038/nsmb.1952.
[size=15px][font=宋体]结直肠癌([/font][font=&]Colorectal Cancer[/font][font=宋体],[/font][font=&]CRC[/font][font=宋体])是全球常见的恶性肿瘤,术后复发转移已成为结直肠癌患者死亡的主要原因,特别是结直肠癌肝转移([/font][font=Georgia, &][color=#333333]CRLM[/color][/font][font=宋体])。因此,迫切需要深入研究[/font][font=Georgia, &][color=#333333]CRLM[/color][/font][font=宋体]的病理和分子机制。原发性肿瘤细胞与远端器官中的免疫细胞或基质细胞之间的信息传递是转移前微环境([/font][font=&]PMN[/font][font=宋体])形成的关键因素,了解这一机制对于制定有效的肿瘤转移治疗策略至关重要。[/font][font=&][/font][/size][size=15px][font=宋体]细胞外囊泡([/font][font=&]EV[/font][font=宋体])作为各种细胞分泌的功能实体,富含蛋白质、核酸、脂质和其他分子,促进肿瘤细胞和基质细胞之间的重要通讯。越来越多的报道表明,肿瘤衍生的[/font][font=&]EV[/font][font=宋体]([/font][font=&]TEV[/font][font=宋体])有助于[/font][font=&]PMN[/font][color=#333333]和[/color][font=Georgia, &][color=#333333]CRLM[/color][/font][font=宋体]的形成,为转移器官中循环肿瘤细胞的增殖提供必需肿瘤微环境([/font][font=&]TME[/font][font=宋体])。作者推测[/font][font=&]circRNA[/font][font=宋体]富集的[/font][font=&]TEVs[/font][font=宋体]介导[/font][font=&]PMN[/font][font=宋体]的形成,并且靶向[/font][font=&]circRNA[/font][font=宋体]富集的[/font][font=&]TEVs[/font][font=宋体]可能是针对[/font][font=&]PMN[/font][font=宋体]形成和[/font][font=&]CRLM [/font][font=宋体]的有效治疗策略。[/font][/size][size=15px][font=宋体]肿瘤细胞分泌的富含[/font][font=&]circ-0034880[/font][font=宋体]的细胞外囊泡通过增强[/font][font=&] SPP1[sup]high[/sup]CD206[sup] +[/sup][/font][font=宋体]促肿瘤巨噬细胞的活化来促进结直肠癌肝转移。重要的是,研究确定人参皂苷[/font][font=&]Rb1[/font][font=宋体]是一种潜在的治疗剂,通过直接靶向[/font][font=&]QKI [/font][font=宋体]蛋白,从而减少[/font][font=&]circ-0034880[/font][font=宋体]的生物合成并抑制[/font][font=&]SPP1[sup]high[/sup]CD206[sup] +[/sup][/font][font=宋体]促肿瘤巨噬细胞的活化,最终抑制结直肠癌肝转移。研究从调控[/font][font=&]TME[/font][font=宋体]的角度,特别是抑制[/font][font=&]circ-0034880[/font][font=宋体]的生物合成和细胞外囊泡的生成,首次揭示了人参皂苷[/font][font=&]Rb1[/font][font=宋体]在肿瘤防治领域的特殊作用,为今后的临床药物转化奠定了坚实的基础。 [size=15px][b]1、富含Circ-0034880的血浆EV与CRLM相关[/b][/size][font=宋体]基于细胞外囊泡在肿瘤转移中的重要作用,作[/font][font=宋体]者首先人类血液外泌体数据库、GSE159669数据集,以及临床血浆细胞外囊泡样本发现[/font][size=15px]一个环状RNA circ-0034880在结直肠癌肝转移患者中具有更高的表达水平,表明该环状RNA与结直肠癌的肝转移密切相关[/size] [size=15px][b]2、富含Circ-0034880的TEV在体内促进CRLM[/b][/size][size=15px]为了进一步研究circ-0034880富集的TEVs对CRC肝转移的体内影响,作者通过体内示踪实验发现了肿瘤细胞MC38来源的EVs在肝中高度积累。体内注射肿瘤细胞MC38来源的EVs可以促进肝转移,而缺失circ-0034880的EVs却丧失其促肝转移的作用,结果表明EVs依赖于其携带的circ-0034880发挥作用[/size] [size=15px][b]3、Circ-0034880富集的TEV激活肝脏转移前微环境中的CD206+促肿瘤巨噬细胞[/b][/size][size=15px]为了全面评估circ-0034880富集的TEV对肝脏转移前微环境的影响,研究人员对小鼠持续进行TEV注射和肿瘤细胞注射,建立了一个肝转移小鼠模型,多重免疫荧光分析显示TEV处理促进CD206 +促肿瘤巨噬细胞在转移前肝脏中的显著浸润,且circ-0034880表达水平与CD206 +促肿瘤TAM浸润之间存在正相关性 [/size][size=15px][/size][size=15px][b]4、Circ-0034880富集的TEV通过激活CD206 +促肿瘤巨噬细胞促进CRC细胞迁移[/b][/size][size=15px]由于有多项报道显示活化的巨噬细胞对CRC细胞迁移有促进作用,作者进一步研究利用示踪实验发现TEV可以携带circ-0034880被巨噬细胞所吸收。此外,功能实验表明富含circ-0034880 的TEV可以促进CD206+促肿瘤巨噬细胞的活化,并且携带circ-0034880的TEV的巨噬细胞上清会显著促进肿瘤细胞的迁移 [/size][size=15px][b]5、Circ-0034880富集的TEV促进SPP1[sup]high[/sup]CD206 +促肿瘤巨噬细胞的激活[/b][/size][size=15px]为了探究携带circ-0034880的TEV对CD206+促肿瘤巨噬细胞的激活机制,研究人员对TEV处理的巨噬细胞进行了转录组数据分析,进一步通过体外基因和蛋白检测和体内IF实验验证了巨噬细胞中SPP1是其调控的靶点,这些发现表明circ-0034880富集的TEV促进了SPP1[sup]high[/sup] CD206 +促肿瘤巨噬细胞的激活。鉴于已知circRNA可作为miRNA海绵发挥作用,作者分析了circ-0034880靶向的miRNA和SPP1结合的miRNA,发现了有2个miRNA重叠:miR-200a-3p和miR-141-3p。结合实验证明这两个miRNA可结合circ-0034880和SPP1,表明 circ-0034880和SPP1竞争结合miRNA,使SPP1不被miRNA所抑制。SPP1是巨噬细胞活化的关键蛋白,因此,研究结果表明TEV释放的circ-0034880通过保护SPP1免受miR-200a-3p和miR-141-3p介导的降解来提高巨噬细胞中SPP1的表达,促进SPP1[sup]high[/sup]巨噬细胞亚群增加 [/size][size=15px][b]6、人参皂苷Rb1给药可通过阻止富含circ-0034880的TEVs介导SPP1[sup]high[/sup]CD206+促肿瘤巨噬细胞的激活来阻止CRC细胞迁移[/b][/size][size=15px]鉴于circ-0034880的重要作用,下调其表达可以作为抑制癌症肝转移的策略,于是作者对103种天然药物进行了筛选,发现4种天然产物(人参皂苷Rb1、异鼠李素、山奈酚和槲皮素)对该circ-0034880的抑制作用最强,其中人参皂苷Rb1具有更强抑制作用。同样人参皂苷Rb1预处理的肿瘤细胞来源的TEV,其作用于巨噬细胞后下游的SPP1的蛋白表达造成下调作用,后续对结直肠癌细胞迁移能力下降,效果类似于沉默circ-0034880。总之,研究结果表明人参皂苷Rb1给药可通过抑制富含circ-0034880的TEV介导的SPP1[sup]high[/sup] CD206+促肿瘤巨噬细胞的激活来阻止CRC细胞迁移 [/size][size=15px][b]7、人参皂苷Rb1直接与QKI蛋白结合,抑制circ-0034880的生物合成[/b][/size][size=15px]为了确定影响circ-0034880表达的Rb1的直接靶点,作者进行了DARTS实验筛选出151种差异表达蛋白,其中一个蛋白QKI被报道与调控前mRNA剪接和促进circRNA生物合成。研究者接下来采用CETSA分析来验证了QKI和Rb1的结合,证实了Rb1能够显著增加QKI的热稳定性。进一步采用SPR分析验证了Rb1与QKI之间的很强的结合亲和力,通过分子对接预测了结合模式。此外,敲低QKI能够显著抑制该circRNA的表达。研究结果表明Rb1直接与QKI蛋白结合,抑制circ-0034880的生物合成[/size] [size=15px][/size][size=15px][b]8、[/b][/size][size=15px][b]人参皂苷[/b][/size][size=15px][b]Rb1给药通过阻止circ-0034880富集的TEV介导SPP1[sup]high[/sup]CD206+促肿瘤TAM的激活来抑制CRLM[/b][/size][size=15px]最后,作者验证了Rb1 给药的[i]体内[/i]效果,发现与单独使用TEV相比,使用Rb1预处理的TEV给药组的肝转移显著减少,与直接沉默circ-0034880的效果非常相似。然而,在沉默circ-0034880的情况下,使用Rb1预处理的TEV给药对肝转移的影响很小。接下来,作者探讨了Rb1对肝转移中CD206+促肿瘤TAM浸润的影响,发现在Rb1预处理的TEVs给药组中,SPP1表达显著下调,类似于直接沉默circ-0034880的效果。然而,在沉默circ-0034880的前提下,相应肝转移中的SPP1表达受到Rb1预处理的TEVs给药的影响最小。总之,体内功能实验证明Rb1预处理的肿瘤细胞来源的TEV失去了促进癌症肝转移的作用[/size][/font][/size]
朊蛋白与免疫系统相互作用的新发现http://www.bioon.com/biology/UploadFiles/201112/2011123113381385.jpg 12月29日,据《每日科学》报道,痒病是一种神经退行性疾病,它可以作为其他由蛋白积累致组织畸形(蛋白质病)疾病的模型,如阿尔兹海默氏病和帕金森氏病。有关这些基因的许多问题仍然悬而未决。在一个新的博士论文研究中,发现了数个与阮蛋白(PrPSc,与疾病的发展有关)摄取相关的因子以及朊蛋白是如何与肠道内的免疫细胞相互作用。 羊瘙痒病属于一组被称为"传染性海绵状脑病(TSE)"的疾病,因为它们可以在动物个体之间传播,并导致大脑产生海绵状、退行性改变。这些疾病不仅折磨羊,还折磨牛(牛海绵状脑病,又称疯牛病,BSE)、鹿(鹿慢性消耗性疾病,又称疯鹿病,CWD)以及人类(克雅氏病CJD)。它们在一定程度上也可以在物种见传播,在20世纪90年代,超过200人经由食物感染而患上了克雅氏病。 传染性海绵状脑病(TSE),或者称阮病毒疾病,被认为是感染了一种能致病的蛋白质变体--朊蛋白,它是机体细胞的正常组成部分,在脑中含量最为丰富。一般而言,阮病毒疾病可能是传染的、遗传的或偶发/自发的。当正常的朊蛋白突变成致病的变种,疾病便发生了,变种朊蛋白在空间结构上与健康的朊蛋白不同。由于变种的朊蛋白具有不同的空间结构,机体细胞很难降解它,因此它就一直在积累。 因为朊蛋白(PrPSc)是在疾病早期在肠道系统的淋巴组织中被发现,推测它是经由肠胃道传染。在兽医学家Caroline Piercey Akesson博士研究杂交仪期间,研究了朊蛋白在肠道内的吸收,从而对疾病发展的早期阶段所发生的过程有了新的了解。与早先的推测相反,她通过免疫电镜证明阮蛋白不是直接从肠道转运到肠道相关的的淋巴组织。相反,她发现朊蛋白自由地穿过或穿进肠道淋巴组织之外的淋巴细胞。 树突状细胞据推测发挥着"看门人"的作用,它决定机体能容忍什么以及当面对外来物时该策划哪一种免疫防御反应。Akeeson的目标之一就是树突细胞与朊蛋白摄取之间的相互作用。首先,需要了解正常的羊肠道内树突状细胞的特点;其次,去调查哪一类型的细胞与阮病毒的摄取有关。 她的研究结果表明,不是树突状细胞,而是巨噬细胞负责朊蛋白的摄取。Akesson的研究揭示,朊蛋白利用了肠道中大分子物质摄取的正常生理通道,这可能对机体的免疫监视系统有显著影响。一个可能的后果就是免疫耐受被激活,从而阻碍了肠道对所吸收的朊蛋白的正常免疫反应。 今后的研究能够揭示免疫细胞是如何运输朊蛋白及机体是如何处理朊蛋白,这将具有非常重要的意义,不仅是为了提供更多的关于痒病的知识,还为研究人类和其他动物中神经退行性蛋白质病提供重要见解。 Caroline Piercey Akesson于12月20日在挪威兽医科学系进行了博士论文答辩,论文的题目是:研究阮病毒的摄取及其与羊肠道中免疫细胞的早期相互作用。
现在,在实验研究基础上,借助多方面的生物信息学方法,可以快速高通量的预测和进行蛋白质鉴定蛋白翻译后修饰。分泌蛋白和膜相关蛋白附着于细胞膜上的或将被排泄出去的蛋白质是由细胞内质网膜上附着的核糖体合成。附着有核糖体的内质网被称为糙面型内质网。这类蛋白质都含有一个N-末端(或氨基端),我们称之为信号序列或信号肽。这个信号肽通常情况下含有13-36个主要疏水性残基,同时它含有多蛋白复合物,我们称之为信号识别粒子(SRP)。这种信号肽在通过内质网膜之后会被去除。信号肽的去除过程是在信号肽酶催化作用下完成的。含有一个信号肽的蛋白质被称为前蛋白,有别于原蛋白。然而,某些用于分泌的蛋白在分泌之后会进一步被蛋白水解,因此包含有原蛋白的序列。这类蛋白质被称为前原蛋白。蛋白水解性裂解许多蛋白质在翻译之后会经历水解性裂解过程。其中最为简单的形式是去除起始蛋氨酸。许多蛋白质合成了不活跃的前体细胞,这些细胞只能在合适的生理条件下通过限制性蛋白水解过程产生活性。在凝血过程中使用到的胰腺酶和酶类就是后者的例证。多肽去除时产生活性的不活跃的前体蛋白,我们称之为原蛋白。前原蛋白的翻译后加工过程的一个复杂的例子就是脑垂体分泌合成的前阿黑皮素原的裂解过程(有关前阿黑皮素原的讨论,见肽类激素页)。这类前原蛋白经过复杂的裂解,根据合成的前阿黑皮素原的细胞定位而不同,其路径也有所不同。另一个前原蛋白的例子就是胰岛素。由于胰岛素是由胰腺分泌的,因此它有一个前肽。随着含24个氨基酸的信号肽的裂解,这类蛋白也折叠成了胰岛素原。胰岛素原进一步分裂,产生活跃的胰岛素,它包含两个肽链,由二硫键进行连接。但仍有其他的蛋白(酶类)被合成为非活跃的前体细胞,被称为酶原。酶原在蛋白水解性裂解时会产生活性,在凝血串联蛋白质链的若干蛋白质中都会发生这种现象。甲基化作用蛋白翻译后的甲基化过程主要发生在氮原子和氧原子上。活性甲基供体是活性腺苷甲硫胺酸(SAM)。最常见的甲基化作用发生在赖氨酸残基的ε-amine上。脱氧核糖核酸组蛋白中赖氨酸残基的甲基化作用可调节核染色质结构,因此可调节其转录活性。赖氨酸原本被认为是一种常设共价标记,可提供长期信号,甚至包括转录记忆时的组蛋白依赖机制。然而,最近的临床研究表明赖氨酸甲基化作用与其他共价修饰体相似,作用时间短,并能通过反脱甲基化活动进行动态调节。最近的组学研究发现表明,赖氨酸残基的甲基化作用不仅发生在核染色质层面,而且还通过修订转录因子影响基因表达。组氨酸的咪唑环,精氨酸的胍基部分以及谷氨酸盐和天冬氨酸盐的R组酰胺(R-group amides )上,都发现了额外的氮甲基化作用。谷氨酸盐和天冬氨酸盐的R组羧化物也会发生氧甲基化作用并形成甲基酯。蛋白可能在半胱氨酸的R[