脱盐柱有什么要求?
多肽药物常见的纯化方法是采用凝胶柱脱盐,这个脱盐过程是什么机理啊?
原油脱水脱盐的原理浅析 您清楚脱盐脱水设备的脱水原理吗?如果不知道的话就学习一下吧: 脱盐设备的脱水就是在120-150℃左右温度下,原油中注入不超过占原油量约5% 的净化水将悬浮在油中的盐分溶解,同时注入一定量的破乳剂. 通过混合器的混合进入电脱盐罐,由于破乳剂的作用打破微小液滴外牢固的乳化膜,这些液滴在高压电场的作用下产生诱导偶极或带电荷,使得液滴在电场力的作用下做定向运动,原油中小水滴聚结成大水滴,在油水比重差和电场等因素作用下,水穿过油层落于罐底,罐底的水和溶解在水中的盐通过自动控制连续地自动排出,脱盐后油从罐顶集合管流出,进入脱盐原油换热部分
原油脱水脱盐的原理浅析 您清楚脱盐脱水设备的脱水原理吗?如果不知道的话就学习一下吧: 脱盐设备的脱水就是在120-150℃左右温度下,原油中注入不超过占原油量约5% 的净化水将悬浮在油中的盐分溶解,同时注入一定量的破乳剂. 通过混合器的混合进入电脱盐罐,由于破乳剂的作用打破微小液滴外牢固的乳化膜,这些液滴在高压电场的作用下产生诱导偶极或带电荷,使得液滴在电场力的作用下做定向运动,原油中小水滴聚结成大水滴,在油水比重差和电场等因素作用下,水穿过油层落于罐底,罐底的水和溶解在水中的盐通过自动控制连续地自动排出,脱盐后油从罐顶集合管流出,进入脱盐原油换热部分。
请教大伙一个问题,关于SPE C18脱盐 我的样品是小鼠肝全蛋白,经过胰酶酶切和定量标记后想在上[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]前脱盐。用的是waters的Sep Pak C18脱盐柱,样品和填料比为1:1000。 流程如下: 活化:1、1mL 100%乙腈 2、1mL 50%乙腈/50%水 平衡:0.1% FA,10倍柱体积 上样:样品用FA调至3~4,加入萃取柱中,使其按重力自然流出 清洗:1mL 0.1% FA,洗盐 洗脱:1mL 洗脱液(50%乙腈,0.1% FA),静置2min后,洗脱样品 回收穿过液,清洗液和洗脱液测肽段浓度,用的是thermo家的肽段定量试剂盒。回收效率只有60~70%。请问该如何改进流程?

1.脱盐乳清粉(demineralised whey powder)个人档案姓名脱盐乳清粉http://ng1.17img.cn/bbsfiles/images/2012/12/201212301304_417263_2227357_3.png身份辅料主要应用婴幼儿配方粉座右铭努力接近母乳水平主要产地欧盟澳洲美国2.脱盐乳清粉按脱盐程度的分类 D90:脱掉90%的灰分,灰分在1.5%以下 D70:脱掉70%的灰分,灰分在3.0%以下 D50:脱掉50%的灰分,灰分在4.0%以下 D40:脱掉40%的灰分,灰分在6.5%以下http://ng1.17img.cn/bbsfiles/images/2012/12/201212301305_417266_2227357_3.png3.工艺过程溶粉→离子交换1→ 纳滤→ 电渗析→ 离子交换2→ 标准化→ 杀菌→浓缩4.检验项目类型编号检验指标检验方法感官要求1色泽目测2滋味气味鼻嗅、口尝3组织状态[color
脱盐乳清粉在检测三聚氰胺时在加入15ml三氯乙酸时沉淀的效果不好!!这是为什么?加什么才能沉淀的彻底?????谢谢
蛋白质如何脱盐?
大家好: 本人在纯化蛋白时需要脱盐这一步,选择sephadex G25进行,可是层析图谱中层析峰只是显示280nm处的吸光值。 本人曾尝试用AgNO3滴定,但是不是很准确,请教高手帮助
麻烦请教一下大家,要用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]检测氯吡脲,猕猴桃基质,经过实验后,样品中引入了一些难挥发盐类,NaCl、NaH2PO4、KCl、CaCl2、NaHCO3、KH2PO4、MgCl2,应该用什么手段脱盐,或者用什么小柱脱盐,如果有相关文献就更好了,谢谢了!
在HC-C18小柱使用过程中,在加入上清液后,用水淋洗,出现了把待测物质淋洗下来的情况,而且脱盐是在这一步吗,如果不要这一步,能不能脱盐呢。如何解决这个问题。
我在一份RO机图纸的技术指标上看到以下两点关于脱盐率的测试,但由于经验有限,对这个不懂,请问有这个行业的同仁可以告知指导一下吗?在下不胜感激,谢谢了!1、15%回收率:纯水加标氯化钠250ppm±10,60psig,水温25±2℃,ph值7-8,回收率在15%条件下,通水30min,脱盐率≥90%。2、在标准测试条件下(水温25±2℃,ph值7-8,纯水加标氯化钠250ppm±10),通水连续运行24h后,脱盐率≥93%。这个技术要求的标准哪里找得到,或者具体的区别是什么,怎么实现这个操作的呢?
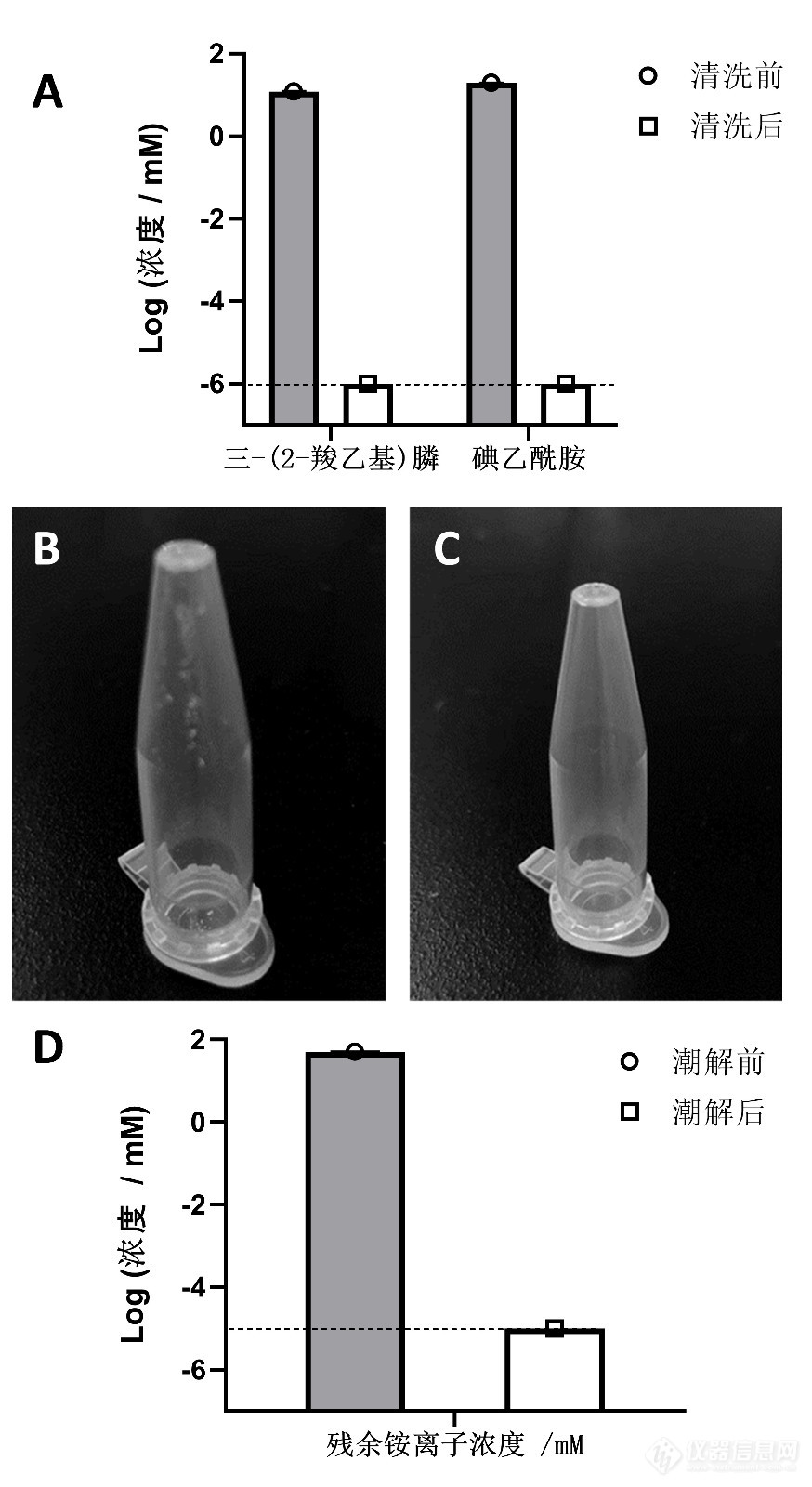
[align=center]免脱盐柱除盐的蛋白组学前处理方法[/align][align=center]季学猛,史爱莹,张 燕,王 硕[/align][align=center](南开大学 医学院, 天津 300071)[/align]摘 要:现有的蛋白组样品前处理中脱盐柱除盐的方法存在步骤繁多、易损失微量样品等缺点。这里,一种超滤管辅助酶解及加热潮解除盐的蛋白组学前处理方法被提出。具体而言,是利用超滤管辅助,通过离心在酶解前将缓冲液置换成碳酸氢铵溶液,酶解后多肽溶液中的碳酸氢铵被加热除去,最终得到脱盐的纯净多肽。该方法操作简便,无需洗脱步骤,可以方便地与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]直接衔接,而且可以减少前处理引起的氨基酸残基去酰胺和氧化修饰,有利于蛋白组学及其蛋白修饰分析。关键词:蛋白组学;样品前处理;脱盐柱 加热 碳酸氢铵中图分类号:O657.63 文献标识码:[align=center]An Improved Proteomic Pretreatment Method without Desalination Column [/align][align=center]JI Xuemeng,SHI Aiying,ZHANG Yan,WANG Shuo[/align][align=center](School of Medicine, Nankai University, Tianjin 300071, China)[/align]Abstract: The existing method for desalting protein samples in pre-processing is associated with several drawbacks, including a high number of procedural steps and the potential loss of minute sample quantities. In this context, a novel protein sample pre-processing method is proposed, which utilizes ultrafiltration tubes to assist in enzymatic digestion and employs heat-induced desalting. Specifically, the ultrafiltration tubes are employed to facilitate the replacement of the buffer solution with an ammonium bicarbonate solution via centrifugation before enzymatic digestion. Subsequently, following enzymatic digestion, the ammonium bicarbonate within the peptide solution is removed through a heating process, ultimately yielding desalted and pure peptides. This method offers simplicity in operation, eliminates the need for elution steps, enables seamless integration with [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url], and serves to mitigate the formation of amino acid residue deamidation and oxidation modifications that may be induced during pre-processing, thereby benefiting both proteomics and protein modification analyses.Key words: Proteomic analysis Sample pre-treatment Desalting column Heating Ammonium bicarbonate通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]串联质谱对生物系统中全蛋白进行定性定量,已经成为一种主流的分析工具。通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]串联质谱对生物系统中全蛋白进行定性定量,已经成为一种主流的分析工具。大规模的蛋白组研究依赖于蛋白被切割成肽段,然后进行后续的定性定量分析。目前,蛋白组学样品前处理方法通常使用胰蛋白酶将蛋白质样品切割成多肽。胰蛋白酶的最适作用pH为7.5-8.5[sup][back=yellow][1][/back][/sup],碳酸氢铵是质谱预处理中最常用到的一种盐,50mM碳酸氢铵水溶液可以提供酶解过程需要的弱碱性环境。然而,碳酸氢铵在酶解过程中大量存在,容易影响后续质谱分析。目前常用反相C18树脂去除盐和缓冲液[sup][back=yellow][2-4][/back][/sup]。多肽在高水相流动相中与反相柱结合,盐和缓冲液被洗去,然后用高有机相流动相洗脱多肽。然而,多肽对C18吸附性有差异,包括磷酸化多肽在内的亲水肽可能不能与C18树脂很好地结合,疏水性强的多肽与C18树脂可能结合牢固,不易被洗脱[sup][back=yellow][5-7][/back][/sup],这些问题可能导致样品的损失;而且,用来洗脱多肽的有机溶剂还需进一步通过真空离心干燥去除,极性较小的有机溶剂还可能溶解塑料制品中聚合物,造成多肽样品的聚合物污染,导致质谱峰偏移[sup][back=yellow][8,9][/back][/sup]。这些问题可能导致蛋白质检出种类减少、重复性差、甚至无检出信号等问题。基于这种临床和科研上的需求, 需要对蛋白组学样品前处理方法进行改进。1? 实验原理蛋白质组学是后基因组时代的产物。基因需要依赖于转录和翻译后后的产物蛋白质行使功能。基因组是固定不变的,而蛋白质组会响应环境的变化。因此,同一生物在生物体不同部位、生命的不同时期以及不同的环境中,具有不同的蛋白质表达。人类基因组测序计划的完成并没有给人提供解开生命的密钥,科学家把兴趣转到蛋白质,希望通过蛋白质组的研究来进一步解开生命的本质。目前鸟枪法是蛋白质组学分析应用最广的分析策略[sup][back=yellow][10-12][/back][/sup]。该方法先将蛋白酶解成肽段,然后通过色谱分离肽段混合物,再用质谱的电喷雾电离(ESI)技术将肽段碎裂,根据碎裂谱图的离子峰信息进行数据库搜索来鉴定肽段,最后将鉴定的肽段进行组装、重新归并为蛋白质[sup][back=yellow][13][/back][/sup]。电喷雾电离具体包括以下几个过程:样品首先通过一个毛细管喷针被喷出来,进入质谱仪,在喷针的外面用鞘气加热样品,辅助样品的雾化。加热雾化过程中溶液中的流动相或者溶剂挥发,剩下的气态离子在毛细管喷针尖端被电离。这些离子在质谱仪入口处被真空抽到质谱仪里,电场驱动进入质谱仪进行分子量的检测[sup][back=yellow][14][/back][/sup]。一般来说,电喷雾质谱法对盐类的容忍度较低。一方面是因为小分子盐类在电喷雾系统中存在较强的竞争性电离效应,从而导致强烈的离子抑制效应,使待测物的灵敏度明显降低[sup][back=yellow][15][/back][/sup]。其次,盐类的存在会产生一系列的离子加成峰,这使得谱图的解析变得复杂[sup][back=yellow][16-18][/back][/sup]。此外,过多的盐分会腐蚀和污染质谱系统的硬件,严重时导致硬件损坏,需要及时清洗[sup][back=yellow][19][/back][/sup]。因此,蛋白组学样品前处理过程中,脱盐步骤是非常必要的。2? 存在问题为减少机器的损坏,并且提高检测灵敏度,上机前一般都会要求对蛋白组学样品脱盐处理。目前脱盐常用的方法是反相C18树脂脱盐柱法。脱盐柱法分为结合、清洗、洗脱三步。首先,利用疏水相互作用,多肽在高水相流动相中与反相柱结合。然后,使用水反复清洗盐和缓冲液。最后,用有机溶剂破坏多肽与C18的结合,洗脱多肽。然而,该方法存在一系列的弊端,比如多肽对C18吸附性有差异,包括磷酸化多肽在内的亲水性比较强的多肽可能不能与C18树脂很好地结合,会造成结合阶段的样品损失,而疏水性强的多肽与C18树脂结合牢固,洗脱阶段却难以洗脱下来,所以亲水性强的多肽和疏水性强的多肽都会在脱盐柱脱盐过程中损失,进而导致样品的选择性偏好,会损坏质谱结果的客观性。而且,最终多肽样品上机前需要在0.1%甲酸溶液中溶解,因此,有机溶剂洗脱后的多肽不能很好的与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]衔接,还需真空离心干燥去除有机溶剂。使用有机溶剂洗脱样品可能会造成样品的PEG聚合物污染,导致质谱峰偏移。这些问题导致脱盐柱脱盐后的蛋白组学样品重复性差、检出蛋白质种类低问题,因此亟需一种脱盐柱脱盐的替代方法。3? 改进措施将酶解前超滤管中的缓冲液通过反复离心置换成碳酸氢铵水溶液。酶解后利用碳酸氢铵加热潮解的特性除去多肽溶液中的碳酸氢铵成分,最终得到纯净的多肽。多肽样品溶解在0.1%甲酸溶液中后可以直接上机检测。4? 改进后效果首先取100μg蛋白样品,用6 M 盐酸胍稀释至400μL。加入10μL 500mM 三-(2-羧乙基)膦、 8 μL 1M 碘乙酰胺,混匀。室温避光振荡反应 40 min。将样品转移至10KD超滤管,室温10000g离心30分钟。加入400 μL 50mM碳酸氢铵溶液置换5次。用200 μL 50 mM 碳酸氢铵溶液垂悬,加入2μg胰蛋白酶,于37 ℃酶解过夜。10000g离心10分钟,收集滤液。真空离心干燥滤液,干燥后观察管底,如有白色盐粉末,加入少量超纯水溶解白色盐,转入75℃金属浴烘干,碳酸氢铵在烘干过程中分解挥发。上机前加入50μL 0.1% 甲酸溶液,装入超洁净样品瓶,上机检测。4.1 潮解脱盐效果评估利用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)分析表明,在五次洗涤步骤后 ,三-(2-羧乙基)膦和碘乙酰胺的浓度至少降低了100000倍,并且降至检测阈值以下,表明五次连续洗涤足以将杂质降低到不干扰的水平([color=#c45911]图1A[/color])。酶解后,离心[color=black]收集到滤液200μL。试纸法测滤液pH,呈弱碱性(pH 7.5-8.0)。[/color]多肽样品经过真空离心干燥后,观察管底,可见白色盐粉末,如[color=#c45911]图1B[/color]所示。加入2μL 超纯水溶解白色盐,转入75℃金属浴烘干,碳酸氢铵在烘干过程中分解挥发,白色粉末消失,如[color=#c45911]图1C[/color]所示。用200[color=black]μL超纯水复溶多肽,测pH为7.0。[/color]这些结果说明碳酸氢铵被去除。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411135143_5595_5680383_3.jpg[/img][color=#c45911]图1 [/color][color=#c45911]脱盐的效果与验证。A:高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)分析图;B:多肽干燥后可观察到管壁上残留白色盐分;C:加热碳酸氢铵潮解后管壁上白色盐分消失; D:潮解前后的氨离子浓度对比图。数据来自三次独立重复实验(n = 3)。[/color]为了直接确认碳酸氢铵的去除,采用分光光度尼斯勒试剂法对氨浓度进行定量。分光光度尼斯勒试剂法包括以下步骤:将样品用去离子水稀释,向样品中加入一定量的分光光度尼斯勒试剂,封闭瓶子并摇动,让混合物静置5-10分钟,使用分光光度计在紫外-可见光谱范围内的波长630nm处测量吸光度,通过相同方法处理一系列氨标准溶液,测量吸光度值并绘制标准曲线,最后,通过使用样品的吸光度值查找标准曲线上相应的氨离子浓度来计算样品浓度。实验结果显示氨离子浓度从50 mM降低到不到10 nM,证实了通过热力潮解去除碳酸氢铵的有效性([color=#c45911]图1D[/color])4.2 新方法对不同分子量的蛋白质进行的蛋白质回收性能的研究蛋白质的分子量分布范围很大,从几千到几十万道尔顿不等。为了研究在酶解之前,超滤管辅助酶解及加热潮解除盐的蛋白组学前处理方法(以下称为新方法)在蛋白质回收方面是否存在偏好,在酶解前比较了溶液法(in-solution)、过滤辅助样品制备法(Filter-Aided Sample Preparation, FASP) 和本研究提出的新方法中的蛋白质回收率。蛋白质定量采用了与还原剂相容的BCA蛋白质测定试剂盒,吸光度在分光光度计(Agilent Technologies,美国)上以562纳米的波长读取。在本研究中测试的蛋白质包括细胞色素C(约12.4 kDa)、绿色荧光蛋白(GFP)(约27 kDa)、抗凝血酶III(约58 kDa)、转铁蛋白(约80 kDa)、免疫球蛋白G(IgG)(约150 kDa)和纤维连接蛋白(具有广泛的分子量范围,通常超过200 kDa)。实验进行了三次重复,并使用小提琴图来呈现结果。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411144597_3153_5680383_3.jpg[/img][color=#c45911]图2使用溶液法、过滤辅助样品制备法和新方法对不同分子量的蛋白质进行的蛋白质回收率评估图。[/color]结果清晰地表明,在不同分子量的蛋白质中,无论是在溶液法、过滤辅助样品制备法还是新方法中,所有三种方法在蛋白质回收率方面均达到了80%以上(图2)。总的来说,在所测试的分子量范围内,过滤辅助样品制备法和新方法之间的蛋白质回收率没有显著差异。然而,值得注意的是,对于低分子量蛋白质,溶液方法展现了略高的回收率,这可能归因于使用了10 kDa分子量截止滤器。 具体来说,对于低分子量蛋白质细胞色素C,过滤辅助样品制备法和新方法的平均回收率分别为85%和83%,而溶液方法的回收率为96%。然而,随着蛋白质分子量的增加,过滤辅助样品制备法和新方法的回收率显著提高。例如,对于分子量约为27 kDa的绿色荧光蛋白(GFP),过滤辅助样品制备法和新方法的回收率约为93%,而溶液方法对GFP蛋白的回收率为97%。此外,对于分子量超过50 kDa的较大蛋白质,如抗凝血酶III,使用过滤辅助样品制备法和新方法的回收率与溶液方法没有显著差异,均达到约98%。可见,本发明方法在蛋白质酶解之前对不同分子量的蛋白质回收率能达到83%至98%范围,达到了较好的蛋白截流作用。4.3新方法中潮解脱盐对不同大小和亲水性的肽段回收性能的研究为了探究不同方法酶解后对不同分子量的肽段进行潮解除盐的潜在偏好,对潮解法脱盐和C18脱盐的多肽回收率进行比较分析。在脱盐过程之前和之后,使用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)测量了肽段的浓度。使用了一个反相柱,并监测了220 nm处的吸光度。受测试的肽段包括亮氨酸脑啡肽(分子量:555.68 Da,由五个氨基酸组成)、血管加压素(分子量:1084.23 Da,由九个氨基酸组成)、生长抑素(分子量:约1637.89 Da,由十四个氨基酸组成)和胰高血糖素(分子量:约3483.87 Da,由二十九个氨基酸残基组成),三次重复实验的结果呈现在小提琴图中(图3A)。结果显示,通过C18柱脱盐得到的回收率在75%到90%之间,与肽段的分子量之间没有明显的相关性。这可能是由于在C18柱脱盐过程中样品损失的因素,比如柱子的结合性能和洗脱效率。相比之下,潮解脱盐在所有测试的肽段中实现了超过96%的回收率,而不受它们的分子量影响。这一结果表明,潮解脱盐在回收不同分子量的肽段方面非常有效。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411149252_2052_5680383_3.jpg[/img][color=#c45911]图3肽段回收性能比较。A:使用两种脱盐方法(潮解去盐和脱盐柱脱盐)评估不同分子量的肽段回收率;B:使用潮解去盐和脱盐柱脱盐对高亲水性和疏水性肽段进行比较回收分析;实验均进行了三次独立的重复。[/color]接下来,使用C18脱盐柱脱盐和潮解脱盐对高亲水性和疏水性肽段的回收率进行了比较分析。选择了抗菌肽(Cat. No. LL37-05MG)和细胞穿膜肽(CAS号:697226-52-1)分别代表疏水性和亲水性肽段。结果显示,脱盐柱脱盐对抗菌肽和细胞穿膜肽的回收率相对较低,平均回收率分别为45%和39%。相比之下,新方法潮解除盐后对这两种肽段都实现了超过95%的回收率,而不受它们的亲水性影响(图3B)。这些发现表明,脱盐柱脱盐中的回收率受到肽段亲水性的影响。这可能归因于脱盐柱脱盐依赖于疏水相互作用将肽段结合到C18柱树脂上,然后使用亲水溶剂进行洗脱,这可能导致不同亲水性的肽段被选择性保留。另一方面,潮解脱盐提供了原位操作的优势,从而在脱盐过程中避免了肽段的损失。我们的研究结果表明,潮解脱盐不会导致肽段的损失,并实现了比C18柱脱盐更高的多肽回收率。4.4 新方法在实际蛋白质组学分析中的应用比较小鼠肠组织用PBS磷酸盐缓冲液润洗两次,以去除任何残留物质,然后与蛋白酶抑制剂混合。将组织使用组织研磨仪进行破壁,然后在冰浴中使用超声波(200W)裂解,直到悬浮液变清澈。通过孔径为0.22μm的微孔滤器纯化得到裂解物。使用BCA分析试剂盒测定蛋白质浓度。随后,采用三种方法进行了酶解:溶液法、过滤辅助样品制备法和新方法[color=black](蛋白组学原始数据保存于PXD044209)[/color]。酶解后,使用高性能[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]将蛋白质分离,并使用QE质谱仪进行分析。具体来说,酶解后的肽样品采用Q Exactive Plus质谱仪联用EASY nano[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统进行分析,该系统配备了EASY纳米电喷雾接口。色谱装置包括Pepmap纳米捕获柱(C18,5 μm,100 ?,100 μm × 2 cm)和EASY-Spray柱(Pepmap RSLC,C18,2 μm,100 ?,50 μm × 15 cm)。在色谱梯度中使用溶剂A(0.1%甲酸)和溶剂B(80% CH3CN/0.1%甲酸),梯度如下:0–8% B持续3分钟,8–28% B持续42分钟,28–38% B持续5分钟,38–100% B持续10分钟。质谱数据经Maxquant软件处理,Maxquant分析考虑至少具有两个肽段的蛋白质,并根据特定的参数和说明搜索UniProt数据库。修饰方面,半胱氨酸的烷基化修饰被设置为固定修饰,而氧化(M)被考虑为可变修饰。设置蛋白质为胰蛋白酶的特异性剪切,最多允许两个漏切位点。片段质量容差设置为0.02 Da。为确保可靠的鉴定,要求蛋白质和肽段的最大假阳性发现率(FDR)均为1.0%。蛋白质的鉴定基于至少有一个唯一的肽段鉴定,而蛋白质的定量是通过计算每个蛋白质的唯一肽段的中位数来执行的。每种方法产生了不同的蛋白质鉴定结果,如[color=#c45911]图4A[/color]所示。总体而言,新方法鉴定的蛋白质数量最多(2975±52),其次是过滤辅助样品制备法(2964±102),最后是溶液法(2803±57)。每种方法的已鉴定肽段数量如[color=#c45911]图4B[/color]所示。使用溶液法,鉴定了10931±16个独特的肽段。过滤辅助样品制备法和新方法分别鉴定了10981±48和10959±23个独特的肽段。平均而言,在溶液法中每个蛋白质匹配到3.90个独有肽段,在过滤辅助样品制备法中匹配到3.70个独有肽段,在新方法方法中匹配到3.68个独有肽段。这表明新方法表现出最高的蛋白质鉴定效率。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411151149_9928_5680383_3.png[/img][color=#c45911]图 4 不同蛋白组学前处理方法在实际蛋白质组学分析中的应用。A:使用三种方法(溶液法、过滤辅助样品制备法和新方法)比较蛋白质鉴定结果;图B为每种消化方法鉴定的独特肽段,结果代表了三次生物学实验;图C为使用组内相关系数(ICC)评估无标签定量分析的可重复性;每种方法都有三次生物学重复。[/color]随后,使用ICC评估无标签定量分析的可重复性([color=#c45911]图4C[/color])。发现新方法显示出最佳的可重复性,平均ICC值为0.622,有1375个蛋白质的ICC值大于0.4。过滤辅助样品制备法表现出稍弱的可重复性,平均ICC值为0.533,有1180个蛋白质的ICC值大于0.4。相比之下,溶液法的可重复性最差,平均ICC值仅为0.477,有1017个蛋白质的ICC值大于0.4。4.5 新方法有助于减少氨基酸残基的不利修饰[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411148874_7284_5680383_3.png[/img][color=#c45911]图 5 样品制备方法对氨基酸残基修饰的影响。A:比较三种样品制备方法(溶液法、过滤辅助样品制备法和新方法)引入的单氧化修饰;B:三种方法对氨基酸残基脱酰胺化修饰的影响,该实验作为生物学重复进行了三次。[/color]氧化修饰和去酰胺修饰通常在天然蛋白质和多肽样本中被观察到,研究这些修饰对于理解蛋白质的固有应激至关重要。然而,样品预处理引起的人为修饰可能会对修饰蛋白组学分析带来挑战。为了评估在样品处理过程中引入的这些不利修饰对样品的影响,我们比较了三种方法:溶液法、过滤辅助样品制备法和新方法,关于它们对氧化和去酰胺修饰的影响。我们鉴定和定量了不同数量的单氧化和去酰胺修饰,但未检测到双氧化和三氧化修饰。在这三种方法中,新方法和溶液法显示出相对较低水平的单氧化修饰([color=#c45911]图5A[/color])。此外,新方法还减少了非必要的去酰胺修饰([color=#c45911]图5B[/color]),鉴定了具有去酰胺修饰的蛋白质最少(473±8),其次是溶液法(485±23),最后是过滤辅助样品制备法(544±23)。考虑到有机溶剂中的羟基可以与酰胺键形成氢键,因此在溶液法和过滤辅助样品制备法中观察到较高水平的去酰胺修饰可能归因于在去盐过程中使用有机溶剂,而新方法更加高效的样品处理可能有助于减少人为的氧化修饰。总之,新方法有效减少了氨基酸残基的去酰胺和氧化修饰。5? 结语南开大学医学院实验室改进的蛋白组学样品前处理方法,利用超滤管将酶解缓冲液置换成碳酸氢铵水溶液,酶解后利用碳酸氢铵加热潮解的特性除去多肽溶液中的碳酸氢铵成分,最终得到纯净的多肽,可以方便地与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]直接衔接,进行质谱分析。与传统的方法相比,无样品损失,提高了蛋白质检测数目,同时操作简单快捷。值得注意的是,与传统的过滤辅助样品制备法相比,新方法在最小化氧化和去酰胺修饰方面表现出卓越的性能。这一创新的方法代表了蛋白质组学分析的重大进展,为质谱分析提供可靠和高效的结果。虽然新方法和过滤辅助样品制备法在使用基于滤膜的蛋白质截断方法方面有相似之处,但它们之间的关键区别变得显而易见。过滤辅助样品制备法在酶解前需要进行更彻底的洗涤,通常需要使用碳酸氢铵水溶液进行5次洗涤,而过滤辅助样品制备法通常只需要进行2次洗涤[sup][color=black][back=yellow][20][/back][/color][/sup]。此外,新方法可以通过轻度加热实现原位样品脱盐和纯化方法的完美集成。相比之下,过滤辅助样品制备法通常需要额外的脱盐柱纯化步骤。与新方法和过滤辅助样品制备法不同,悬浮陷阱法(S-Trap)采用三维多孔材料来捕获蛋白质 [sup][color=black][back=yellow][21][/back][/color][/sup]。由于其较大(亚微米级)的孔径,悬浮陷阱法滤膜的每个离心循环只需1分钟,实现了比本文中新方法和过滤辅助样品制备法更高的洗涤效率[sup][color=black][back=yellow][22][/back][/color][/sup]。然而,值得注意的是,与悬浮陷阱法相比,超滤管目前的成本较低,悬浮陷阱法在酶解后需要多次使用有机溶剂(如甲酸和乙腈)进行洗涤。悬浮陷阱法还涉及额外的脱盐柱纯化步骤,增加了实验的复杂性。总之,本文描述了一种独特的蛋白组学前处理方式,显著提高了高效样品制备的能力。6? 数据可用性声明本研究所有数据均包含在论文中。所有的蛋白质组学质谱数据已被存储在ProteomeXchange,并可通过访问编号PXD044209:[url=https://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD044209][color=#0563c1]https://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD044209[/color][/url] [sup][color=black][back=yellow][23, 24][/back][/color][/sup]来获取。参考文献(References):[1]? Solari F A, Kollipara L, Sickmann A, et al. Two birds with one stone: parallel quantification of proteome and phosphoproteome using iTRAQ[M]//Proteomics in Systems Biology. Humana Press, New York, NY, 2016: 25-41.[2]? Zhang G, Xue W, Dai J, et al. Quantitative proteomics analysis reveals proteins and pathways associated with anthocyanin accumulation in barley[J]. Food chemistry, 2019, 298: 124973.[3]? Zhu Z, Chen T, Wang Z, et al. Integrated Proteomics and Metabolomics Link Acne to the Action Mechanisms of Cryptotanshinone Intervention[J]. Frontiers in pharmacology, 2021, 12: 700696.[4]? Liu C, Si X, Yan S, et al. Development of the C12Im-Cl-assisted method for rapid sample preparation in proteomic application[J]. Analytical Methods, 2021, 13(6): 776-781.[5]? Liu Q, Shi J, Sun J, et al. Graphene and graphene oxide sheets supported on silica as versatile and high‐performance adsorbents for solid‐phase extraction[J]. Angewandte Chemie, 2011, 123(26): 6035-6039.[6]? Kecskemeti A, Bako J, Csarnovics I, et al. Development of an enzymatic reactor applying spontaneously adsorbed trypsin on the surface of a PDMS microfluidic device[J]. Analytical and bioanalytical chemistry, 2017, 409(14): 3573-3585.[7]? Li L, Wu R, Yan G, et al. A novel method to isolate protein N-terminal peptides from proteome samples using sulfydryl tagging and gold-nanoparticle-based depletion[J]. Analytical and bioanalytical chemistry, 2016, 408(2): 441-448.[8]? Shieh I F, Lee C Y, Shiea J. Eliminating the interferences from TRIS buffer and SDS in protein analysis by fused-droplet electrospray ionization mass spectrometry[J]. Journal of Proteome Research, 2005, 4(2): 606-612.[9]? LaCava J, Molloy K R, Taylor M S, et al. Affinity proteomics to study endogenous protein complexes: pointers, pitfalls, preferences and perspectives[J]. Biotechniques, 2015, 58(3): 103-119.[10]? Dupree E J, Jayathirtha M, Yorkey H, et al. A critical review of bottom-up proteomics: The good, the bad, and the future of this field[J]. Proteomes, 2020, 8(3): 14.[11]? Duong V A, Park J M, Lee H. Review of three-dimensional liquid chromatography platforms for bottom-up proteomics[J]. International Journal of Molecular Sciences, 2020, 21(4): 1524.[12]? 翟芳. 鸟枪法蛋白质组学质谱平台性能标准和参考数据集的建立[D]. 重庆大学, 2018.[13]? Shen Y, Toli? N, Zhao R, et al. High-throughput proteomics using high-efficiency multiple-capillary liquid chromatography with on-line high-performance ESI FTICR mass spectrometry[J]. Analytical Chemistry, 2001, 73(13): 3011-3021.[14]? Livesay E A, Tang K, Taylor B K, et al. Fully automated four-column capillary LC? MS system for maximizing throughput in proteomic analyses[J]. Analytical chemistry, 2008, 80(1): 294-302.[15]? Ca?as B, Pi?eiro C, Calvo E, et al. Trends in sample preparation for classical and second generation proteomics[J]. Journal of chromatography A, 2007, 1153(1-2): 235-258.[16]? Wheeler A R, Moon H, Bird C A, et al. Digital microfluidics with in-line sample purification for proteomics analyses with MALDI-MS[J]. Analytical chemistry, 2005, 77(2): 534-540.[17]? Kim K H, Compton P D, Tran J C, et al. Online matrix removal platform for coupling gel-based separations to whole protein electrospray ionization mass spectrometry[J]. Journal of proteome research, 2015, 14(5): 2199-2206.[18]? Wang C, Wu Z, Yuan J, et al. Simplified quantitative glycomics using the stable isotope label Girard’s reagent p by electrospray ionization mass spectrometry[J]. Journal of Proteome Research, 2014, 13(2): 372-384.[19]? Righetti P G, Boschetti E, Lomas L, et al. Protein Equalizer? Technology: The quest for a “democratic proteome”[J]. Proteomics, 2006, 6(14): 3980-3992.[20]? Homsi C, Rajan R E, Minati R, et al. A Rapid and Efficient Method for the Extraction of Histone Proteins[J]. Journal of Proteome Research, 2023, 22(8): 2765-2773.[21]? Fu Q, Murray C I, Karpov O A, et al. Automated proteomic sample preparation: The key component for high throughput and quantitative mass spectrometry analysis[J]. Mass Spectrometry Reviews, 2023, 42(2): 873-886.[22]? Duong V A, Lee H. Bottom-Up Proteomics: Advancements in Sample Preparation[J]. International Journal of Molecular Sciences, 2023, 24(6): 5350.[23]? Ma J, Chen T, Wu S, et al. iProX: an integrated proteome resource[J]. Nucleic acids research, 2019, 47(D1): D1211-D1217.[24]? Chen T, Ma J, Liu Y, et al. iProX in 2021: connecting proteomics data sharing with big data[J]. Nucleic Acids Research, 2022, 50(D1): D1522-D1527.[size=12px]收稿日期:[/size][size=12px]2023-10-27[/size] [size=12px]修改日期:[/size][size=12px] [/size]基金项目:国家重点研发计划(32030083)。作者简历:季学猛,硕士,实验师,研究方向为微生物学、蛋白组学。E-mail:jixuemeng@nankai.edu.cn。
求助各位, 我需要用0.5mM的NaOH溶液做流动相,但是工程师说钠离子不挥发不能用来做流动相,用太长时间会在质谱中聚集并可能结晶堵塞管道,可是我的研究中又必须要用,那么有什么脱盐装置是可以安在液质之间的吗?如果不用NaOH,有哪位大神用过氨水来做分离的吗?我现在用的是Thermal Fisher的Carbopac PA1 的阴离子交换柱,请问流动相如果用氨水分离效果会好吗?急求答案,谢过!
我用阳、阴离子离子树脂层析柱对糖浆进行脱盐,结果发现,糖浆经过阳离子树脂后含糖量基本不变,但是经过阴离子树脂以后糖液中的糖基本被脱光掉了。阳离子树脂为氢型,阴离子树脂为氢氧根型,糖液中主要为:低聚糖、蔗糖、葡萄糖。请问各位大虾,阴离子树脂怎么处理能对糖浆脱盐起作用,并且能够减少阴离子树脂对糖的吸附作用。
最近在做一种注射剂产品GC分析方法,直接进样法进样,但制剂中存在氯化钠直接进样容易带进盐去,有什么好办法脱盐啊?还望同僚们指点一二,不胜感激!
脱盐乳清粉D90检测三聚氰胺,样品加入三氯乙酸和乙腈提取,超声震荡离心后滤纸过滤,完全过滤不动,有人有方法可以让样液过滤吗?
(一)原理凡盐析所获得的粗制蛋白质(盐析得到的IgG)中均含有硫酸铵等盐类,这类将影响以后的纯化,所以纯化前均应除去,此过程称为“脱盐”(desalthing)。脱盐常用透析法和凝胶过滤法,这两种方法各有利弊。前者的优点是透析后析品终体积较小,但所需时间较长,且盐不易除尽;凝胶过滤法则能将盐除尽,所需时间也短,但其凝胶过滤后样品体积较大。所以,要根据具体情况选择使用。前实验中样品体积较小,凝胶达滤后样品体积不会太增加,所以选用凝胶过滤法。(二)试剂与器材(1)Sephadex G-25。(2)0.0175mol/L,pH6.7磷酸盐缓冲液。(3)奈氏(Nessler)试剂:于500ml锥形瓶内加入碘化钾150g,碘110g,汞150g及蒸馏水100ml。用力振荡7~15min,至碘的棕色开始转变时,混合液温度升高,将此瓶浸于冷水内继续振荡,直到棕色的碘转变为带绿色的碘化钾汞液为止。将上清液倾入2000ml量筒内,加蒸馏水至2000ml,混匀备用。(4)20%(W/V)磺基水杨酸溶液。(5)1.5cm×20cm层析柱。(6)黑、白比色磁盘。
大家在[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]收峰的杂质鉴定时,脱盐浓缩有什么好的方法吗。超滤管超滤浓缩损失太大了,经常浓缩完的信号反而更低。尝试过冻干,效果也不好。大家有什么好的方法推荐吗。
脱盐乳清粉的生产工艺中有一步是纳滤,如果纳滤膜漏了,需要怎么样监控,除了全面更换滤膜还有其他方法么?
实验七 葡聚糖凝胶层析脱盐一. 目的学习凝胶层析的工作原理和操作方法掌握利用葡聚糖凝胶层析进行蛋白质脱盐的技术二. 原理凝胶层析又称凝胶过滤或排阻层析。凝胶过滤的主要装置是填充有层析介质的层析柱。1. 层析介质的特点(1)遇水为不溶解的固相;(2)是化学惰性物质;(3)离子基团含量少;(4)颗粒大小和网眼均匀;(5)机械强度较强;(6)具有可选择的多种孔径。目前使用较多的是葡聚糖凝胶、聚丙烯酰胺凝胶、琼脂糖凝胶及其衍生物。尤其葡聚糖凝胶(商品名称Sephadex)是最常用的层析介质。它是由一定平均分子量的葡聚糖和交联剂1-氯-2,3-环氧丙烷( )交联成的具有三维结构不溶于水的高分子化合物。调节葡聚糖和交联剂配比,可以获得网眼大小不同,型号各异的凝胶。当葡聚糖分子量越小,交联剂用量越大,则交联度越大,凝胶网眼越小,吸水量越小,G值也越小。G值表示每克干胶吸水量(mL)的十倍。例如Sephadex G-25其吸水量应为2.5mL/g干胶。常用的葡聚糖凝胶有多种规格,如G-10、G-15、G-25、G-50、G-75、G-100等。实验中选用何种型号应根据被分离的混合物分子的大小及工作目的来确定(参见附录五)。2. 分离原理当混合样液加到凝胶柱上,随着洗脱剂而通过凝胶柱时,分子大小不同的物质受到不同的阻滞作用。颗粒接近或大于网眼的分子,不能进入凝胶的网眼中,在重力作用下它们随着溶剂在凝胶颗粒之间沿较短流程向下流动,受到的阻滞作用小,移动速度快,先出层析柱(此现象叫作被排阻。被排阻的最小分子量称为该规格凝胶的排阻极限);而颗粒小于网眼的分子可渗入凝胶网眼之中,它们被洗脱时不断地从一个网眼穿到另一个网眼,逐层扩散,阻滞作用大,流程长,移动速度慢,因而后出层析柱。在层析柱的出口处,我们用多个试管分步收集洗脱液,就可将混合物中各组分彼此分离。当我们从生物组织中用盐析法提取蛋白质后,常需要进行蛋白质的脱盐工作,我们可采用层析介质为葡聚糖凝胶G-25(或G-15、G-50),用适当的洗脱剂进行洗脱,经凝胶层析,就可以将大分子蛋白质与小分子盐类分离。三. 实验材料及设备1. 材料含硫酸铵盐的蛋白质溶液(参见附注3)2. 器材层 析 柱:内径×柱高=1.0cm×25cm滴定台架、螺丝夹:各1刻度试管:10mL×14移 液 管:1mL×1烧 杯:250mL×1 50mL×1滴 管:2洗 耳 球:2洗瓶、试管架、移液管架、玻棒:各1四. 试剂的配制1. 葡聚糖凝胶G-25(或G-15、G-50)溶胀凝胶方法:按每个层析柱约4g的量称取葡聚糖凝胶G-25于烧杯中,加过量蒸馏水于沸水浴中溶胀2小时或在室温下溶胀6小时以上。用倾泻法除去上层漂浮的细碎凝胶,重复3~4次。操作中避免剧烈搅拌,防止破坏其交联结构。2. BaCl2溶液(1%)3. 考马斯亮蓝G-250称取0.1g考马斯亮蓝G-250,先溶于50mL95%乙醇中,再加入85%的磷酸100mL,最后用蒸馏水定容到1000mL。暗处存放。4. 脲(6mol/L)5. 洗脱剂应依据被纯化的蛋白质的不同特性而选用不同的缓冲液。五. 操作步骤1. 层析柱的准备(1) 清洗:每组取一支层析柱,用清水冲洗干净。(若玻璃柱较脏,应卸去塑料装置,先入洗液中浸泡2小时。)(2) 安装与检查:检查出口装置中尼龙绸或烧结滤板是否完好干净。安装层析柱,让其垂直固定于滴定台架上。对准出口处,放一只250mL烧杯。向层析柱内灌洗脱剂,打开出口螺旋夹,检查有无渗漏、出口乳胶管是否通畅等情况。(3) 排气泡:保持柱内一定的水位,用手指弹击柱壁,部分气泡会从溶液中上浮排出。出口处的小气泡易停留在螺旋夹附近的乳胶管内,要想法排尽,否则会影响分离结果,排气完毕,保留柱内1~2cm高水位,关紧螺旋夹。(4) 标记高度:在距顶端8~10cm处做一标记,作为衡量灌装层析介质床体高度(15~17cm)的依据。2. 装柱每组用50mL烧杯取溶胀的凝胶悬浆25~30mL,静置片刻,观察凝胶沉淀与水的体积之比,约为1:1即可,否则应作调整。轻轻搅匀杯中凝胶,用玻璃棒引流入柱,打开出水口,并不断地向柱内补充凝胶,直到凝胶沉淀高度位于标记上方约2cm为止,凝胶柱内若有气泡和断层或柱床表面干水和歪斜,都将影响分离效果。必要时,需倒出凝胶,重新装柱。3. 平衡取15mL洗脱剂,用滴管沿柱内壁旋转着缓缓流下,不可冲动胶平面,打开出水口,经洗脱液的流动,一方面清洗内壁,另一方面使胶床收紧。洗脱平衡完毕,胶床上方保留约4cm高水位,关闭出水口。此时,胶床高度≥15cm为宜。4. 准备收集取6只干净的刻度试管(除净试管内残留的水),1~6编号,并在试管2mL处作一标记,插入试管架上,为收集洗脱样品作好准备。5. 上样与收集打开出口排水,当胶床与上方水层的弯月面相切时,关闭出口,用滴管将0.2mL混合样液沿柱内壁缓缓加入,勿冲动胶面。上样完毕,打开出水口,开始收集一号管。每管收集洗脱液2mL。当样液进入胶床,其弯月面与胶平面相切时,暂停排液,用滴管将洗脱剂沿柱内壁旋转着加入1cm高水位,然后排液,至其弯月面与胶平面相切,再缓缓注入3~5cm高的洗脱剂。6. 洗脱不断向柱内加洗脱剂,保持胶床上水位3~5cm。出口流速控制在每6秒1滴,直至收集到6号管达2mL时,关闭出口。7. 鉴定另取6只干净试管,按收集顺序将洗脱液一分为二,即每管1mL,依次在试管架上排成二排。第一排每管加2滴BaCl2,根据白色沉淀多少,判断SO42-在各管中的浓度。第二排每管加1mL考马斯亮蓝G-250试剂,根据蓝色情况,判断蛋白质在各管中的浓度。将结果记录于下表中。若鉴定的第6号管中,仍有样品,表明洗脱和收集不够,需增加7号、8号……试管继续洗脱与收集,同上法鉴定其蛋白质和盐浓度情况。管 号项 目1234567891011白色沉淀量蓝色深浅8. 再生鉴定完毕,打开出水口,继续用2~3倍床体积洗脱剂洗脱,洗脱后关闭出口,以备下次使用。六. 结果处理1. 根据实验结果,在同一坐标系中,以收集的管号为横坐标,颜色深浅程度为纵坐标,绘制二条(蛋白质及(NH4)2SO4)洗脱曲线。2. 分析混合样品分离效果。七. 思考题1. 利用凝胶层析分离混合物时,怎样才能得到较好的分离效果?2. 还有哪些方法可进行蛋白质脱盐?附注1. 凝胶的再生通常层析柱经洗脱剂再生、平衡后,就可反复使用。但使用过多次后凝胶床体积变小,流速降低,凝胶污染杂质过多,甚至变色,需经再生后才可使用。再生方法有多种:如(1)用水进行逆向冲洗,再用洗脱剂平衡,便可重新使用。又如(2)把凝胶倒出,用6mol/L脲浸泡凝胶半小时,抽滤,再用水漂洗数次,除净脲,必要时重复上述操作即可重新使用。2. 凝胶的保存(1) 湿法保存,可保存几个月至一年,有多种方法: 加入防腐剂硫柳汞,使其浓度为0.005%,下次使用前,水洗除去硫柳汞。 加入几滴氯仿,摇匀存放。下次使用前用热水浴除去氯仿。(沸点60℃)。 凝胶保存在60~70%乙醇溶液中,即凝胶以部分收缩状态保存。(2) 干法保存此法操作不及湿法简便,但处理得好,凝胶存放时间长。先抽取过量水分,再向凝胶逐步加入百分浓度递增的乙醇溶液,每次停留一段时间,使凝胶逐步脱水,最后加入95%乙醇,凝胶脱手收缩。抽干,铺与搪瓷盆中,60~80℃经常翻动烘烤。若有结块,在下次膨胀时会散开的,不可用力敲碎,否则会破坏颗粒结构。3. 用盐析法分离提取麦清蛋白取10g小麦种子,粉碎。转入250mL具塞磨口锥形瓶中。加100mL蒸馏水,在康氏震荡器上震荡1小时。静置半小时,上清液以3000转/分钟离心15分钟。将上清液在布氏漏斗上(铺3~4层滤纸)抽滤。滤液应透明。用醋酸酸化滤液至pH4.7。加等体积的饱和硫酸铵溶液,边加边搅动,即有白色絮状沉淀生成。置冰箱过夜,使麦清蛋白全部盐析沉淀出来,以3000转/分钟离心20分钟,弃去上清夜,加10mL无离子水使沉淀溶解,即得麦清蛋白和硫酸铵的混合液。
载气瓶更换后,标准物质的出峰时间拖延了0.5min,请问各位如何解决?谢谢。(载气的纯度99.999%)

[font=none][size=16px][color=#004be0]第16届原创大赛继续与中国仪器仪表学会合作。凡符合要求的原创作品将被推荐到“ 科研仪器案例库 ”,被案例库收录后,将由中国仪器仪表学会授予“科研仪器案例库收录证书”;征集活动结束后,被评为优秀案例的,将由中国科协授予“优秀案例授予证书”,助力参赛者评定职称。(注:往届获奖作品若有投递案例库的意向,可咨询主办方)[/color][/size][/font][align=center][size=18px][b]【科研仪器案例库收录文章展示】:免脱盐柱除盐的蛋白组学前处理方法[img=,690,491]https://ng1.17img.cn/bbsfiles/images/2024/01/202401191644483441_3917_3237657_3.png!w690x491.jpg[/img][img=,690,322]https://ng1.17img.cn/bbsfiles/images/2024/01/202401191645088078_8778_3237657_3.png!w690x322.jpg[/img]原文链接:[/b][url]https://bbs.instrument.com.cn/topic/8279851[/url][/size][/align]
经过淡化的海水,不用烧开就可以直接饮用,这样的水你敢喝吗?市政协常委、民盟市委专职副主委李波博士说,他喝过这样的水,不但没有异味,而且符合饮用标准。莱特莱德专业的团队和成熟的技术,正以坚实稳健的步伐,朝着规模化,产业化的方向发展,13年专注研发海水淡化方法技术。为现代化海水淡化提供强有力的技术方案。 发展海水淡化工程时机已到来莱特莱德先进技术提供优质服务 海水淡化不是新话题,之所以重提,是因为厦门市发展海水淡化工程的时机已经到来。据水利部门最新数据,厦门人均水资源占有量仅340立方米,低于全省人均水资源占有量的40%,仅为全国人均水资源占有量的20%,远低于国际公认的1000立方米的缺水警戒线。缺水问题不解决,将成为制约厦门未来经济社会发展的“瓶颈”。 莱特莱德海水淡化技术主要采用两种方法淡化海水,即蒸馏法和反渗透法。蒸馏法主要被用于特大型海水淡化处理上及热能丰富的地方。反渗透膜法适用面非常的广,且脱盐率很高,因此被广泛使用。反渗透膜法首先是将海水提取上来,进行初步处理,而降低海水浊度,防止细菌、藻类等微生物的生长,然后用特种高压泵增压,使海水进入反渗透膜,由于海水含盐量高,所以海水反渗透膜必须具有高脱盐率,耐腐蚀、耐高压、抗污染等特点,经过反渗透膜处理后的海水,其含盐量大大降低,TDS含量从36000毫克/升降至200毫克/升左右。 莱特莱德海水淡化装置的特点 莱特莱德海水淡化装置发展方向大体可以总结出以下四点: 一、这种海水淡化装置必将向大型化的规模甚至超大型化规模方向发展。 二、提高工艺技术,且采用新型材料以提高系统性能。这种海水淡化技术改进系统的热过程,而目前所采用的新型材料大多是光滑铝合金管以及铝合金波纹管,采用这种材料制成的特种混凝土和传热管等壳体热过程得到了很大的改进,从而使得系统的性能得到了很大的提高。 三、同新型能源相结合。这种技术可以应用新型能源反应堆提供的清洁低品味热能。 四、向高效方向发展。这种技术的结垢问题需要得到很好的解决,从而使得系统向高温多效蒸馏方向发展,从而使得获得淡水比例大大提升。 沿海地区发展淡化水产品莱特莱德专业团队提供优质服务 沿海地区发展淡化水产品系列,鼓励海水淡化企业对淡化水深度利用,制作瓶装、桶装淡化纯净水和其他特色淡化水功能饮料,通过后续产品的开发,既提高淡化水的利用率和产业附加值,增强产业竞争力,也可通过市场推广,提高民众对海水淡化水的认知度。莱特莱德拥有50人海水淡化专业团队,全程技术支持,重点高新技术企业,售后服务完善可信,从事海水淡化研究13年,设备已经达到国际领先水平。 莱特莱德拥有行业最前沿的技术支持和多年的专业经验,优秀的设计团队和与国际同步的技术规范标准,提供全面解决方案和服务。
因锅炉水一般采用处理后的冷凝液和脱盐水做补水,还有必要分析锅炉水中的微量油含量和铁吗?
目的工序编号检验指标标准值检验频率检验方法脱盐乳清粉前处理溶粉1感官(溶解情况)完全溶解每罐目测、手感2脂肪提供数据每罐FT1203蛋白质4乳糖5干物质6pH值6.0~7.0每罐(3小时1次,以后毎小时1次)pH计7杂质度≤0.75mg/L每罐GB 5413.308酸度(乳酸)≤0.12%每罐(3小时1次,以后毎小时1次)GB 5413.349温度35~40℃每罐(3小时1次,以后毎小时1次)温度计离子交换Ⅰ1电导率20~30ms/cm1次/每个溶粉批次电导率仪2pH值1~31次/每个溶粉批次pH计纳滤1电导率10~20ms/cm1次/3小时电导率仪2干物质提供数据1次/3小时折光计电渗析1电导率1~30ms/cm1次/3小时电导率仪2pH值1~31次/3小时pH计离子交换Ⅱ1电导率≤200μs/cm1次/3小时电导率仪2pH值4.5~5.81次/3小时pH计3干物质提供数据1次/3小时折光计暂存(标准化前)1脂肪提供数据每罐FT1202蛋白质3乳糖4干物质5pH值4.5~5.8每罐pH计6杂质度≤0.75mg/L每罐GB 5413.307酸度(乳酸)≤0.12%6~24h,1次/2小时GB 5413.348温度5~10℃温度计9灰分提供数据每罐GB 5009.410电导率提供数据每罐电导率仪11钾提供数据每罐GB 5413.2112钙提供数据每罐13钠提供数据每罐14镁提供数据每罐15磷提供数据每罐GB 5413.2216氯提供数据每罐GB 5413.24暂存(标准化后)1脂肪提供数据每罐FT1202蛋白质3乳糖4干物质5pH值6.0~7.0每罐pH计6杂质度≤0.75mg/L每罐GB 5413.307酸度(乳酸)≤0.12%6~24h,1次/2h,24h以上,1次/1hGB 5413.348温度35~40℃温度计9灰分提供数据每罐GB 5009.410电导率提供数据每罐电导率仪脱盐乳清粉后处理杀菌、浓缩1浓度(波美度、折光度)提供数据生产前、中、后期手工法、波美计、折光计2杂质度≤0.75mg/LGB 5413.303菌落总数≤5000CFU/mL生产前、中、后期GB 4789.24大肠菌群≤10CFU/mLGB 4789.3平板计数法5芽孢总数≤200CFU/mL生产中、后期NY/T 1331 6嗜热芽孢总数≤100CFU/mL半成品1感官合格1次/吨肉眼观察,品尝滋气味2冲调性合格按标准比例冲调3水分提供数据快速水分测定仪4杂质度≤6mg/kgGB 5413.305蛋白质产品标准乳粉快速分析仪
[font=Symbol][/font][font=Symbol][size=3][/size] [/font][size=3][font=宋体]中国供水需求急剧增长[/font][/size][font=Symbol][size=3][/size] [/font][size=3][font=宋体]水处理和海水淡化将在供水保障中发挥重要作用[/font][/size][size=3][font=宋体]海水淡化已成为许多中国科研机构的研究重点[/font][/size][font=宋体][/font][font=宋体]水常被冠以“头号食品”之称。事实上没有水,人类就无法生存。同时,不仅人依赖于水的供应,几乎所有的工业部门也都离不开水。充足的数量和合格的水质是经济可持续增长及稳定发展的关键。[/font][font=Arial]2008[/font][font=宋体]奥运会让更多的世人首次看到,中国近几年的经济增长对该国的水平衡产生了怎样的影响。工业增长、城市扩大和人民生活水平的整体提高使中国的水需求不断上升,单靠自然水源(河流、地下水)已难以为继。在[/font][font=Arial]2010[/font][font=宋体]年北京市水务工作会议上,水务局领导程静指出,形势依然严峻。专家认为,尽管有新的节水激励措施出台,中国的水消耗仍居高不下,日用水量将达到[/font][font=Arial]280[/font][font=宋体]万吨。据估计,目前每年的用水缺口约达[/font][font=Arial]4[/font][font=宋体]亿吨,而地下水位已连续[/font][font=Arial]9[/font][font=宋体]年下降。[/font][font=Arial][/font][b] 中国已经发展成为重要的脱盐工业基地[/b][font=宋体]作为拥有大片临海区域的沿海国家,中国正力求通过卤水和海水的淡化及污水处理来开发水资源管理的新途径,以保障淡水供应。可以说,除了地中海国家和阿拉伯半岛,中国目前已成为海水淡化产业的一个重要新兴市场。[/font][font=Arial][/font][font=宋体]国际脱盐协会([/font][font=Arial]IDA[/font][font=宋体])的报告表明,目前全球日脱盐能力为[/font][font=Arial]5990[/font][font=宋体]万吨。仅[/font][font=Arial]2009[/font][font=宋体]年,由全球各地约[/font][font=Arial]700[/font][font=宋体]套设备所新形成的日处理能力即达[/font][font=Arial]660[/font][font=宋体]万吨。另有[/font][font=Arial]224[/font][font=宋体]套设备已签约或处于在建之中。海水淡化设备经历了最为繁荣的时期:其生产能力在[/font][font=Arial]2007[/font][font=宋体]年[/font][font=Arial]11[/font][font=宋体]月至[/font][font=Arial]2009[/font][font=宋体]年[/font][font=Arial]11[/font][font=宋体]月间增长了[/font][font=Arial]29.6%[/font][font=宋体],达到[/font][font=Arial]3590[/font][font=宋体]万吨[/font][font=Arial]/[/font][font=宋体]日。[/font][font=Arial][/font][font=宋体]过去[/font][font=Arial]10[/font][font=宋体]年里,仅中国就建成了约[/font][font=Arial]50[/font][font=宋体]套海水淡化装置,并投入使用,生产能力在[/font][font=Arial]30[/font][font=宋体]万吨[/font][font=Arial]/[/font][font=宋体]日左右。对于未来[/font][font=Arial]10[/font][font=宋体]年,中国,特别是中国的沿海经济特区,已为海水淡化绘制了一幅宏伟蓝图。中国东北海岸的大量中小岛屿已开始利用海水淡化,为居民解决饮水问题。例如,由德国[/font][font=Arial]ProMinent[/font][font=宋体]公司在大长山岛和獐子岛完成的海水淡化工程,每天为[/font][font=Arial]8[/font][font=宋体]万[/font][font=Arial]9[/font][font=宋体]千人(大长山岛)供应[/font][font=Arial]1500[/font][font=宋体]吨,为[/font][font=Arial]7[/font][font=宋体]万人(獐子岛)供应[/font][font=Arial]1200[/font][font=宋体]吨淡水。这些设备均采用反渗透法工艺。[/font]
为什么一些鱼类要在海水(盐水)中才能生存?海水渗透压大,为何不会导致他们脱水呢?[em09512]
既要满足国家“十五”863重点示范工程的生产用水,又要不和严重缺水城市的居民“争水”,华能玉环电厂果断作出“向大海要水”,此举不仅解决了生产的全部用水,还反过来可解决所在地区1/3的居民用水。 2008年3月24日,是一个很平凡的日子,但对于中国华能集团玉环电厂来说,却是个不同寻常的日子,因为,这一天宣告着我国最大的“双膜法”35000吨/日海水淡化工程已成功运行两年,宣告着我国已经具备大型海水淡化工程设计、施工和运营的经验。向大海要水中国华能集团玉环电厂是国家“十五”863计划“超超临界燃煤发电技术”课题的依托工程和超超临界国产化示范项目,总装机4台百万千瓦级机组平均每小时用水量达1330吨。电厂位于浙江省玉环岛西侧,三面环山,一面临海。玉环岛陆地面积小,低山丘陵,集水面积不足,没有修建大型水库的条件,天然降水虽充沛,但淡水资源非常紧张,人均拥有水资源仅656吨,远低于浙江省2400吨及全国2700吨人均水平。玉环县水利局原副局长钱云飞在谈及玉环县的水资源时说:“2002年以来,玉环县遭遇连年的大旱,枯水季节县城居民3天供一次水,供水时间只有2、3小时,给电厂专用的里墩水库也是玉环县比较大的水库,由于大坝建在海涂淤泥上,设计沉降高度是2.8米,但当水面沉降到1.2米时就出现了管涌,整个水库不得不放水维修,政府曾从台州紧急调水甚至考虑把调水作为长远规划,但工期太长、造价也高。”如何保障生产用水,又不与当地百姓“争水”?玉环电厂果断作出“向大海要水”的决策,即通过海水淡化解决电厂的全部生产用水和生活用水,处理规模高达35000吨/日。然而,国内运营的海水淡化工程大多为几百吨或者几千吨,尚无万吨级以上工程可借鉴,国外更没有一家大型电厂全部采用海水淡化供应淡水,同时和玉环电厂相似的美国Tampa Bay项目在运行中又出现了问题。科研人员在对数万页的国内外数据资料分析研究的基础上,结合玉环当地能源紧张、水污染严重、水质变化大等实际情况,决定大胆尝试和采用膜法海水淡化的技术工艺,并且为确保拟建海水淡化工程系统运行的安全、经济和高效性,先期邀请了6家跨国公司竟标,6 家公司分别在现场采用不同的技术工艺进行了为期5个多月的中试,科研人员在对每天的运行和性能指标进行仔细对比分析之后,最后选用北京赛恩斯特科技有限公司的双膜法(超滤加双膜法)工艺。安全、经济、高效又节能的海水淡化技术工艺最适合我国国情海水淡化的技术工艺发展至今有20多种,但大规模工程常用的只有膜法(反渗透)和热法(蒸馏法)两种,由于生产同等质量的淡水,膜法所消耗的能源仅为热法的40%―60%。因此,在全球能源普遍紧缺的前提下,除能源丰富的海湾国家外,膜法海水淡化被世界各国广为采用。膜法海水淡化工艺分预处理和脱盐两部分,传统工艺在海水的预处理阶段一般采用消毒、杀菌、沙石、多介质过滤、活性碳除氯等相结合的工艺,但由于海水的悬浮物杂质多、细菌微生物复杂、胶原体多,传统的预处理工艺常常技术路线长、操作难度大,稍有不慎,就会使预处理之后的水中微生物残留物含量高,当海水进入反渗透膜后,就很容易造成反渗透膜的生物污染和堵塞,使产水率下降,不仅需要频繁地清洗膜,保证高产水率,而且还使膜的使用寿命缩短。而新的膜法预处理工艺以其流程短、工序少、能耗低、产能高、寿命长、占地面积小等独特的技术优势不仅确保淡化系统运行安全性,而且使整个系统运行成本大大降低。承担此工程设计和建设的北京赛恩斯特科技有限公司总经理吴红梅在接受采访时说:“双膜法已经成功应用在燕山石化30000吨/日炼油废水回用工程和邯钢21000吨/日钢铁废水回用工程上,系统连续运行平稳,出水水质完全符合设计要求。在设计玉环电厂水处理技术方案时,本着节能降耗,降低成本的原则,我们对以前的双膜法做了两大改进,首先,采用低压浸入式超滤膜。就是把膜直接浸入水箱中,不再使用价格昂贵的玻璃钢壳,这样不仅省去了壳与壳之间的繁琐连接,还使膜材料的清洗和安装更为方便和快捷,因此成本低、抗污染性强、系统集成度高、便于维护。由于膜装置是膜法海水淡化工程的核心,约占工程总投资的40%,仅此一项改进,就使工程的总投资减少了15%-20%;第二,采用高效能量回收装置。在一级反渗透系统中处理掉的 “浓”水,其剩余压力很高,以前这部分水都是白白排放掉的,造成能量的极大浪费,现在,我们使用了效率为94%的能量回收装置,依靠水压,在不需任何驱动的情况下,将它再能量转换到原料海水中。新工艺使系统吨水能耗降低到4度左右,比传统工艺降低了30-40%。另外,系统设计实现标准模块化,产能可无限放大。”我国发展大规模海水淡化时机已成熟,到2020年总投资高达560亿元玉环电厂海水淡化工程,不仅解决了企业自身全部生产和生活用水,还在枯水季节,反过来提供给玉环县城10000吨/日的居民用水,相当于县城用水总量的1/3。它的成功运行,给我国沿海地区的工业企业和城市的开源和节流起到了很好的榜样和示范作用,也为我国建设10万吨以上的大规模海水淡化工程奠基了基础,向大海要水不仅是解决我国沿海地区淡水资源短缺的现实选择,也是实现以水资源可持续利用,保障沿海地区经济社会可持续发展的战略性措施。我国是海洋大国,海岸线长达18000公里。据国家统计局资料显示,我国沿海11省、市、区以全国15%的土地,养活了全国40%的人口,创造了全国67%的国内生产总值,沿海城市的发展不仅是全国经济发展的示范园,也是中国经济发展的基石。但沿海地区水资源的总量仅占全国的1/4,北方沿海天津、河北、辽宁和山东4省市人均综合用水量仅为269吨,南方沿海7省市人均综合用水量为560吨,均处于极度缺水状态,部分地区地下水超采,已经造成地面下沉、海水倒灌、生态环境恶化。水短缺已经成为制约沿海经济可持续发展的重要瓶颈之一。对此,国家发改委、国家海洋局、财政部在2005年及时颁布《海水利用专项规划》,其中对沿海地区的城市和高耗水企业利用海水做出了明确要求:沿海的电力、石化、冶金等行业要以海水解决作为工业冷却水和工业纯净水,其中电力企业直接利用海水约占总量的85%;新建的电力、石化、冶金等企业要求配套建设海水淡化作为纯净水;对现有企业要进行改造,将现有的自来水、纯净水改造成以海水淡化水作为工业纯净水。此外,对沿海16省市的“十一五”海水淡化目标也做出了具体的战略部署,要求2010年建设若干个10万吨/日以上的海水淡化示范工程,实现海水淡化水量80吨/日-100万吨/日,对沿海的缺水贡献率16-24%,海水淡化国产化率大于60%;2020年,建设若干个20-50万吨/日的大规模工程,海水淡化水量达到250万吨/日-300万吨/日,对沿海的缺水贡献率26-37%,海水淡化国产化率大于90%。要实现这些目标,总投资就需410-560亿元。此外,政府还把海水淡化列为《当前国家重点鼓励发展的产业、产品和技术目录》、《当前优先发展的高新技术产业化重点领域指南》等,并组织国债资金支持海水淡化的科技攻关和示范项目,海水淡化已经成为21世纪我国令人瞩目又商机无限的朝阳产业。
不知道自己想做什么,就先把手头的事做好;不知道自己会遇到谁,就先学会善待身边的人。迷雾里你或许只能看见眼前的五米,但一步一步走下来,雾就会慢慢散了。等待和拖延只会夺走你的动力,新的一天,行动起来。早安!