如何用普通生物显微镜拍清楚非小细胞肺癌细胞的细胞膜呢
我想用液相色谱法测定红细胞膜脂肪酸,想请教一下样品前期怎么处理?哪位高手可以提供具体的步骤,感激不尽!
细胞膜脂肪酸甲酯化要用什么作反应容器?反应液大概1.5ml,看了文献说用反应样品瓶,具体是什么容器?[img]https://ng1.17img.cn/bbsfiles/images/2019/03/201903282206509758_5524_3499435_3.png[/img]
美国科学家彼得阿格雷博士因找到了允许水分子出入的细胞膜蛋白“水通道”,而荣获2003年度诺贝尔化学奖,但该通道的具体工作机制却一直是未解之谜。记者近日从中科院上海应用物理研究所获悉,我国科学家在此基础上续写下文,发现这种纳米级水通道上具有两把“锁”,分别通过力学和电学开关机制控制着水分子进出。该研究成果已发表在国际权威学刊《美国科学院院刊》(PNAS)在线版上。 在生物体内,蛋白水通道和周围的水溶液中都存在电荷。在纳米和分子尺度上,这些通道因为热噪音效应引起力学形变和电荷移位,这会否影响水通道的开或关?上海应用物理所方海平课题组与浙大、浙江师大、IBM公司研究所和哥伦比亚大学科研人员合作,采用纳米级“碳管”作为生物膜蛋白水通道的简化模型开展研究,结果发现,水分子在通过水通道时,不仅对作用在水通道管壁上的力学响应具有开关特性,对管壁上的电荷响应也有极好的开关特性。研究表明:有效力学信号会导致管壁产生足够大的形变,由此带来开或关的状态变化;而只有在水分子与外界电荷的作用距离非常接近时,通道才会响应,迅速开或关。 专家认为,这一新发现的机制不仅对生物化学有意义,对设计人工分子机器也具有一定启示性。来源:解放网-解放日报
细胞膜脂肪酸甲酯化要用什么反应容器?反应液大概有1.5ml,有文献说用反应样品瓶,具体是指什么容器?[img]https://ng1.17img.cn/bbsfiles/images/2019/03/201903291023427595_5464_3499435_3.png[/img]
测红细胞膜表面DHA DHA的分离度不是很好 怎么解决?
【序号】:1【作者】:马宏1邢飞1项舟【题名】:干细胞膜片在骨与软骨修复中的应用【期刊】:华西医学. 【年、卷、期、起止页码】:2023,38(10)【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=Eo9-C_M6tLk9uZm4IkSK1syfkr0KDbFTcR0617hZuaOO2RfuHSxVbqaoIynt7ZcTvLJt5-3SIRpa86mQX1e7IjPPmI8GtcsVZ8ywUEJunoyVxXNl-EZ7vjp8_-Gb8KPo9lovkvfL5A4=&uniplatform=NZKPT&language=CHS
将在药物开发进程中发挥重要作用2011年03月26日 来源: 科技日报 作者: 常丽君 本报讯 据每日科学网近日报道,美国范德堡大学研究人员开发出一种新型激光技术,可检测细胞膜上的蛋白质和其它多种生物分子之间的相互反应。这种检测将在药物开发进程中发挥重要作用。 人类细胞中约有7000种蛋白质,其中30%在细胞膜上,控制细胞分子运作机制的信号有60%—70%由这些膜蛋白产生,因此当前市场上约一半的药物都是瞄准细胞膜蛋白。但因为膜蛋白很难提纯,科学家在研究它们的结构时面临很多困难。现有的检测膜手段大多是将膜蛋白从其所处环境中分离,或用不同方式如荧光标签加以修改,以分析它们的活性。这些方法不仅昂贵耗时,还可能会影响目标膜蛋白的功能。 范德堡大学化学生物研究院化学教授达里尔·波恩霍普领导的研究小组和斯克里普斯研究院合作,开发了一种名为“后向散射干涉仪”(BSI)的新型激光技术,能精确检测出膜蛋白和自然界中各种分子之间的结合力。 BSI操作起来很简单,只要把两种分子混合装入一个充满液体的显微镜小盒中,用一束类似于条形码扫描仪的红色激光照射,就能测出它们之间的结合力。小盒的几何形状调整合适后,激光就会产生干涉图案,而这种干涉图案对分子之间的反应非常敏感。如果分子开始互相作用,图案就开始变换。 为了检验BSI的准确性,研究人员制造了一种含有GM1小蛋白质的合成膜,霍乱毒素要进入细胞,主要结合对象就是这种小蛋白质。他们把霍乱毒素B和这些膜混合,检测出的结合力结果与用其他方法所得到的结果一致。为了进一步确认,他们还用了一种和胸腺癌相关的天然分离膜和3种分别与疼痛、发炎和神经传导素GABA(用于放松、睡眠和调节紧张)相关的蛋白质膜进行检验,把包含这些蛋白质的膜和对应结合分子相混合,用BSI技术测得的值也和用其他方法得到的结果一样。 此外,该技术进入商业化也前景广阔,范德堡大学对新型激光检测技术已申请了专利,并已获得3项批准。他们还专门成立了一家分子传感公司对新技术进行独家开发。
请问有没有人做过红细胞膜脂肪酸的检测啊?例如检测其中反式脂肪酸,用什么方法比较好?可以用液相色谱么?
用[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用仪[/color][/url]测红细胞膜脂肪酸,参考文献里有20种脂肪酸,我只测出了7种脂肪酸,是不是甲酯化方法不好?我用的甲酯化方法是:取分离好的红细胞样本各50μL,依次加入已用BHT乙醇溶液抗氧化处理过的具塞玻璃试管中;在具塞玻璃试管中加入400μL3N盐酸-甲醇溶液,充分混匀3分钟,然后放置于90℃烘箱中避光反应3小时,反应完毕后取出冷却至室温;加入正己烷800μL到具塞玻璃试管中,充分混匀5分钟,4000rpm/min,2-8℃离心5min;将离心后的上层正己烷溶液尽量完全转移至另一个1.5ml离心管中,室温环境下,用氮气吹干仪吹干;在氮气吹干后的离心管中加入正己烷400μL溶解脂肪酸甲酯产物,充分混匀3分钟,然后转移100μL至样品瓶中,待测。
细胞是如何出口和嵌入蛋白于细胞膜Grenoble, 12 December 2010 How cells export and embed proteins in the membraneEMBL scientists first to visualise crucial stephttp://www.embl.de/aboutus/communication_outreach/media_relations/2010/101212_Grenoble/index.htmlLike an overprotective parent on the first day of school, a targeting factor sometimes needs a little push to let go of its cargo. Scientists at the European Molecular Biology Laboratory (EMBL) in Grenoble, France, have visualised one such hand-over. They were the first to determine the structure of a ribosome-protein complex involved in carrying nascent proteins out of the cell. Their work, published online today in Nature Structural and Molecular Biology, could increase understanding of illnesses such as cystic fibrosis and some forms of Parkinson’s disease, in which improper protein targeting leads proteins to harmfully accumulate inside cells.In most organisms, proteins destined to cross or be embedded in a membrane contain a polypeptide sequence that is recognized during translation by a targeting factor known as the signal recognition particle (SRP). SRP binds to the ribosome synthesizing the polypeptide, and subsequently also binds an SRP receptor, located next to the machinery that transfers proteins across the membrane and out of the cell. EMBL scientists have now generated the first-ever structural image of this important step in the process.“The SRP receptor acts as a switch between the cargo binding and the release,” says Christiane Schaffitzel, who led the research at EMBL, “Now we have seen for the first time how the release can happen at a molecular level.”Schaffitzel’s group is taking structural snapshots of entire pathways by which proteins are synthesized and targeted to their final positions. To capture this hand-over step, the scientists had to overcome the fact that the link between SRP and its receptor is usually transient, chemically unstable. They engineered the SRP receptor so that it would bind more stably to SRP, then introduced ribosomes and observed the resulting complexes using cryo-electron microscopy (cryo-EM).Cryo-EM can be performed in roughly physiological conditions, providing a picture that closely resembles what happens in living cells. This picture can then be combined with higher-resolution crystallography data and biochemical studies – an exciting hybrid approach the EMBL scientists will further exploit to follow protein targeting all the way from start to finish.A particular asset for success in this project was the close collaboration with Guy Schoehn at the Institut de Biologie Structurale (IBS). IBS and EMBL are part of the Partnership for Structural Biology (PShttp://i.0dxy.cn/images_new/smiles/smile_blackeye.gif in Grenoble, France.Source ArticleEstrozi, L.F., Boehringer, D., Shan, S., Ban, N., Schaffitzel, C.. Cryo-EM structure of the E. coli translating ribosome in complex with SRP and its receptor. Nature Structural and Molecular Biology, Advance Online Publication 12 December 2010. DOI: 10.1038/nsmb.1952.
[size=3][font=宋体]基本原理[/font][font=Times New Roman] [/font][/size][size=3][font=宋体]细胞凋亡早期改变发生在细胞膜表面,目前早期识别仍有困难。这些细胞膜表面的改变之一是磷脂酰丝氨酸([/font][font=Times New Roman]PS[/font][font=宋体])从细胞膜内转移到细胞膜外,使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外表面。[/font][font=Times New Roman]PS[/font][font=宋体]是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外。[/font][font=Times New Roman]Annexin V[/font][font=宋体]是一种[/font][font=Times New Roman]Ca+[/font][font=宋体]依赖的磷脂结合蛋白,最初发现是一种具有很强的抗凝血特性的血管蛋白,[/font][font=Times New Roman]Annexin V[/font][font=宋体]具有易于结合到磷脂类如[/font][font=Times New Roman]PS[/font][font=宋体]的特性。对[/font][font=Times New Roman]PS[/font][font=宋体]有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的[/font][font=Times New Roman]PS[/font][font=宋体]。[/font][font=Times New Roman]PS[/font][font=宋体]转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以建立一种用[/font][font=Times New Roman]Annexin V[/font][font=宋体]结合在细胞膜表面作为凋亡的指示并结合一种染料排除试验以检测细胞膜的完整性的检测方法。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]试剂与仪器[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]孵育缓冲液:[/font][font=Times New Roman]10mmol/L HEPES/NaOH[/font][font=宋体],[/font][font=Times New Roman]PH 7.4[/font][font=宋体],[/font][font=Times New Roman]140mmol/L NaCl[/font][font=宋体],[/font][font=Times New Roman]5mmol/L CaCl2 [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]标记液:将[/font][font=Times New Roman]FITC- Annexin V[/font][font=宋体](宝灵曼公司产品)和[/font][font=Times New Roman]PI[/font][font=宋体]加入到孵育缓冲液中,终浓度均为[/font][font=Times New Roman]1ug/ml [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]流式细胞仪[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]实验步骤[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]1. [/font][font=宋体]细胞收集:悬浮细胞直接收集到[/font][font=Times New Roman]10ml[/font][font=宋体]的离心管中,每样本细胞数为([/font][font=Times New Roman]1~5[/font][font=宋体])×[/font][font=Times New Roman]106[/font][font=宋体],[/font][font=Times New Roman]/mL[/font][font=宋体] [/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体],弃去培养液。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]2. [/font][font=宋体]用孵育缓冲液洗涤[/font][font=Times New Roman]1[/font][font=宋体]次,[/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]3. [/font][font=宋体]用[/font][font=Times New Roman]100ul[/font][font=宋体]的标记溶液重悬细胞,室温下避光孵育[/font][font=Times New Roman]10~15min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]4. 500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]沉淀细胞孵育缓冲液洗[/font][font=Times New Roman]1[/font][font=宋体]次。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]5. [/font][font=宋体]加入荧光([/font][font=Times New Roman]SA-FLOUS[/font][font=宋体])溶液[/font][font=Times New Roman]4[/font][font=宋体]℃下孵育[/font][font=Times New Roman]20min[/font][font=宋体],避光并不时振动。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]6. [/font][font=宋体]流式细胞仪分析:流式细胞仪激发光波长用[/font][font=Times New Roman]488nm[/font][font=宋体],用一波长为[/font][font=Times New Roman]515nm[/font][font=宋体]的通带滤器检测[/font][font=Times New Roman]FITC[/font][font=宋体]荧光,另一波长大于[/font][font=Times New Roman]560nm[/font][font=宋体]的滤器检测[/font][font=Times New Roman]PI[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]7. [/font][font=宋体]结果判断:凋亡细胞对所有用于细胞活性鉴定的染料如[/font][font=Times New Roman]PI[/font][font=宋体]有抗染性,坏死细胞则不能。细胞膜有损伤的细胞的[/font][font=Times New Roman]DNA[/font][font=宋体]可被[/font][font=Times New Roman]PI[/font][font=宋体]着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期[/font][font=Times New Roman]PI[/font][font=宋体]不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为([/font][font=Times New Roman]FITC-/PI-[/font][font=宋体]);右上象限是非活细胞,即坏死细胞,为([/font][font=Times New Roman]FITC+/PI+[/font][font=宋体]);而右下象限为凋亡细胞,显现([/font][font=Times New Roman]FITC+/PI-[/font][font=宋体])。[/font][/size]
[size=3][font=宋体]基本原理[/font][font=Times New Roman] [/font][/size][size=3][font=宋体]细胞凋亡早期改变发生在细胞膜表面,目前早期识别仍有困难。这些细胞膜表面的改变之一是磷脂酰丝氨酸([/font][font=Times New Roman]PS[/font][font=宋体])从细胞膜内转移到细胞膜外,使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外表面。[/font][font=Times New Roman]PS[/font][font=宋体]是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外。[/font][font=Times New Roman]Annexin V[/font][font=宋体]是一种[/font][font=Times New Roman]Ca+[/font][font=宋体]依赖的磷脂结合蛋白,最初发现是一种具有很强的抗凝血特性的血管蛋白,[/font][font=Times New Roman]Annexin V[/font][font=宋体]具有易于结合到磷脂类如[/font][font=Times New Roman]PS[/font][font=宋体]的特性。对[/font][font=Times New Roman]PS[/font][font=宋体]有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的[/font][font=Times New Roman]PS[/font][font=宋体]。[/font][font=Times New Roman]PS[/font][font=宋体]转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以建立一种用[/font][font=Times New Roman]Annexin V[/font][font=宋体]结合在细胞膜表面作为凋亡的指示并结合一种染料排除试验以检测细胞膜的完整性的检测方法。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]试剂与仪器[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]孵育缓冲液:[/font][font=Times New Roman]10mmol/L HEPES/NaOH[/font][font=宋体],[/font][font=Times New Roman]PH 7.4[/font][font=宋体],[/font][font=Times New Roman]140mmol/L NaCl[/font][font=宋体],[/font][font=Times New Roman]5mmol/L CaCl2 [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]标记液:将[/font][font=Times New Roman]FITC- Annexin V[/font][font=宋体](宝灵曼公司产品)和[/font][font=Times New Roman]PI[/font][font=宋体]加入到孵育缓冲液中,终浓度均为[/font][font=Times New Roman]1ug/ml [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]流式细胞仪[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]实验步骤[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]1. [/font][font=宋体]细胞收集:悬浮细胞直接收集到[/font][font=Times New Roman]10ml[/font][font=宋体]的离心管中,每样本细胞数为([/font][font=Times New Roman]1~5[/font][font=宋体])×[/font][font=Times New Roman]106[/font][font=宋体],[/font][font=Times New Roman]/mL[/font][font=宋体] [/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体],弃去培养液。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]2. [/font][font=宋体]用孵育缓冲液洗涤[/font][font=Times New Roman]1[/font][font=宋体]次,[/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]3. [/font][font=宋体]用[/font][font=Times New Roman]100ul[/font][font=宋体]的标记溶液重悬细胞,室温下避光孵育[/font][font=Times New Roman]10~15min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]4. 500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]沉淀细胞孵育缓冲液洗[/font][font=Times New Roman]1[/font][font=宋体]次。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]5. [/font][font=宋体]加入荧光([/font][font=Times New Roman]SA-FLOUS[/font][font=宋体])溶液[/font][font=Times New Roman]4[/font][font=宋体]℃下孵育[/font][font=Times New Roman]20min[/font][font=宋体],避光并不时振动。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]6. [/font][font=宋体]流式细胞仪分析:流式细胞仪激发光波长用[/font][font=Times New Roman]488nm[/font][font=宋体],用一波长为[/font][font=Times New Roman]515nm[/font][font=宋体]的通带滤器检测[/font][font=Times New Roman]FITC[/font][font=宋体]荧光,另一波长大于[/font][font=Times New Roman]560nm[/font][font=宋体]的滤器检测[/font][font=Times New Roman]PI[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]7. [/font][font=宋体]结果判断:凋亡细胞对所有用于细胞活性鉴定的染料如[/font][font=Times New Roman]PI[/font][font=宋体]有抗染性,坏死细胞则不能。细胞膜有损伤的细胞的[/font][font=Times New Roman]DNA[/font][font=宋体]可被[/font][font=Times New Roman]PI[/font][font=宋体]着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期[/font][font=Times New Roman]PI[/font][font=宋体]不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为([/font][font=Times New Roman]FITC-/PI-[/font][font=宋体]);右上象限是非活细胞,即坏死细胞,为([/font][font=Times New Roman]FITC+/PI+[/font][font=宋体]);而右下象限为凋亡细胞,显现([/font][font=Times New Roman]FITC+/PI-[/font][font=宋体])。[/font][/size]
摘要:细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。一、细胞凋亡的形态学检测根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。1. 光学显微镜和倒置显微镜(1) 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。贴壁细胞出现皱缩、变圆、脱落。(2) 染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。2. 荧光显微镜和共聚焦激光扫描显微镜一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与 DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376278_small.jpg3 透射电子显微镜观察结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376295_small.jpg二、磷脂酰丝氨酸外翻分析(Annexin V法)磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376296_small.jpg方法1. 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100 ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10 ul,室温避光30 min,再加入PI(50 ug/ml)5 ul,避光反应5 min后,加入400 ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1 h), 同时以不加AnnexinV-FITC及PI的一管作为阴性对照。2. 贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。3. 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。结果 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376298_small.jpg http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376300_small.jpg
目前,细胞冻存最常用的技术是液氮冷冻保存法,主要采用加适量保护剂的缓慢冷冻法冻存细胞。细胞在不加任何保护剂的情况下直接冷冻,细胞内外的水分会很快形成冰晶,从而引起一系列不良反应。如细胞脱水使局部电解质浓度增高,pH值改变,部分蛋白质由于上述原因而变性,引起细胞内部空间结构紊乱,溶酶体膜由此遭到损伤而释放出溶酶体酶,使细胞内结构成分造成破坏,线粒体肿胀,功能丢失,并造成能量代谢障碍。胞膜上的类脂蛋白复合体也易破坏引起细胞膜通透性的改变,使细胞内容物丢失。如果细胞内冰晶形成较多,随冷冻温度的降低,冰晶体积膨胀造成细胞核DNA空间构型发生不可逆的损伤,而致细胞死亡。因此,细胞冷冻技术的关键是尽可能地减少细胞内水分,减少细胞内冰晶的形成。采用甘油或二甲基亚砜作保护剂,这两种物质分子量小,溶解度大,易穿透细胞,可以使冰点下降,提高细胞膜对水的通透性,且对细胞无明显毒性。慢速冷冻方法又可使细胞内的水分渗出细胞外,减少胞内形成冰结晶的机会,从而减少冰晶对细胞的损伤。二、细胞冻存操作步骤:(1)选择处于对数生长期的细胞,在冻存前一天最好换液。将多个培养瓶中的细胞培养液去掉,用0.25%胰蛋白酶消化。适时去掉胰蛋白酶,加入少量新培养液。用吸管吸取培养液反复吹打瓶壁上的细胞,使其成为均匀分散的细胞悬液。悬浮生产细胞则不要消化处理。然后将细胞收集于离心管中离心(1000r/min,10分钟)。(2)去上清液,加入含20%小牛血清的完全培养基,于4℃预冷15分钟后,逐滴加入已无菌的DMSO或甘油,用吸管轻轻吹打使细胞均匀,细胞浓度为3×106~1×107/mL之间。(3)将上述细胞分装于安瓿或专用冷冻塑料管中,安瓿装1~1.5mL在火焰喷灯上封口,封口处要完全封闭,圆滑无勾。冷冻管要将盖子盖紧,并标记好细胞名称和冻存日期,同时作好登记(日期、细胞种类及代次、冻存支数)。(4)将装好细胞的安瓿或冻存管装入沙布袋内;置于液氮容器颈口处存放过夜,次日转入液氮中。采用控制降温速度的方法也可采用下列步骤:先将安瓿置入4℃冰箱中2~3小时,再移至冰箱冷冻室内3~4小时(此步可省略),再吊入液氮容器颈气态部分存放2小时,最后沉入液氮中。细胞冻存在液氮中可以长期保存,但为妥善起见,冻存半年后,最好取出一只安瓿细胞复苏培养,观察生长情况,然后再继续冻存。
β分散频率范围内,生物量容积率与培养液中介电系数有关。在一定电场频率范围内,生物量容积与细胞大小无关,只与细胞浓度成线性关系。在外界交变电场的影响下,培养基中的离子向电极靠近,带有完整细胞膜的细胞(活细胞)在培养基中发生极化现象,形成一个极小的电容,这些小的“电容”可以被传感器两端的检测器检测到,从而得到实时的细胞浓度不知道这种仪器在学术研究上作用如何?请大家给点建议!
鸡蛋,在如今的社会里,更多时候是作为一种营养丰富的食品出现在我们的餐桌上。现代化大型养殖场如生产产品般输出鸡蛋的方式颠覆了人们对鸡蛋的认识,或许已经很少有人能够联想到从蛋黄蛋白到一个小生命的奇迹升华。但在人类漫长的历史中,农业是文明的核心。就在不太遥远的过去,大多数人还可以在家中目睹鸡生蛋、蛋生鸡的奇迹。这种神秘的现象让古时的人们感到好奇、困惑,甚至产生莫名的崇拜。我们华夏文明由雏鸡的诞生联想到世界的起源,“天地混沌如鸡子,盘古生其中”,看来在我们祖先的眼中,鸡蛋的孵化犹如天地诞生般神秘。这种“卵生崇拜”在史籍中屡见不鲜,如《史记·殷本纪》记述商朝人先祖契的来历时提到有娀氏的女儿简狄“见玄鸟坠其卵,简狄取吞之,因孕生契”,同样,在《史记·秦本纪》中,文章伊始就记载了颛顼的孙女女修织布时“玄鸟陨卵,女修吞之,生子大业”,而这位大业就是秦人的先祖。不得不佩服古人的想象,这玄鸟蛋孵化出了两个重要朝代。在漫长的历史中,这种对蛋朦胧而浪漫的崇拜逐渐融入了我们的文化中,直到如今,染红壳的鸡蛋依旧是新婚、生子、满月时,人们表达祝福的重要载体。随着科技的进步,人们对蛋的理解逐渐清晰,现在很多人都知道蛋和卵细胞有千丝万缕的关系。可是鸡蛋到底是否就是一个细胞?答案可谓五花八门,有人说整个鸡蛋就是一个放大的卵细胞,蛋壳内的那层膜是细胞膜,蛋清是细胞质,蛋黄是细胞核;也有人说蛋黄是卵细胞,卵黄膜就是细胞膜,蛋黄就是细胞质,而蛋黄上面的小白点是细胞核;还有人认为鸡蛋本就是由很多细胞构成的。
大家好,我初次接触TEM准备看细胞的精细结构,完全没有经验,想做一个关于在细胞膜上看到5nm量子点,我看文献主要涉及到为了制备TEM样品,将裸露的的细胞固定在戊二醛(2.5%)溶液中。 然后将细胞样品用1%四氧化锇后固定。 用二甲胂酸盐缓冲液(0.1M)洗涤后,用一系列乙醇溶液(30,50,70,90和100%)使细胞脱水。 所有这些处理均在4℃下进行。 之后,将细胞用环氧丙烷处理,渗透并包埋在液体树脂中。 使用超薄切片机切割树脂块,并在网格上收集切片。 使用TEM和STEM模式在FEI Talos F200X高分辨率透射电子显微镜下进行成像。我目前能做到的就是用戊二醛溶液把细胞固定,其他试剂或者仪器暂时都没有,所以想联系老师是否可以帮忙测试。价格可以协商,手机号:15122625693
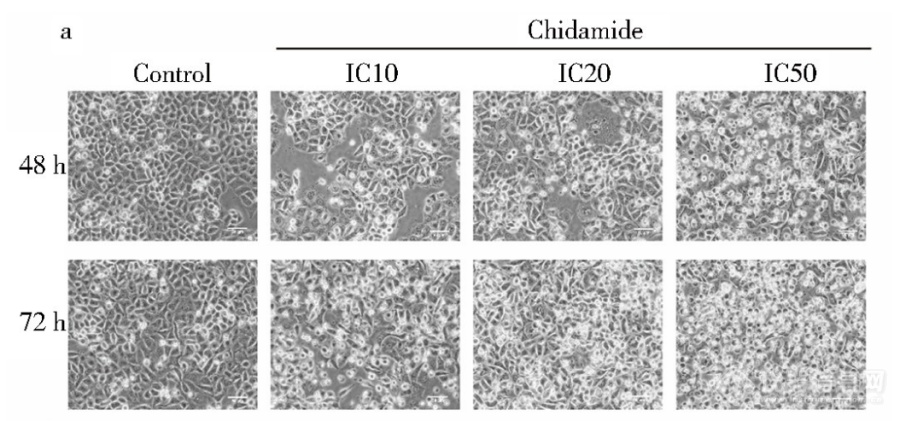
显微镜下西达本胺影响HCT-15细胞形态细胞经不同浓度药物处理后形态发生变化(图),随着药物浓度及作用时间的增加,细胞形态变为长 梭形,触角增多,细胞内颗粒物增多,并且可见空泡 同时相邻细胞之间连接疏松,细胞膜折光度下降,细胞数 量也随之减少[img]https://ng1.17img.cn/bbsfiles/images/2023/06/202306302200230901_4314_5389809_3.png[/img]
十三.流式细胞术在血液学中的应用 淋巴瘤免疫分型 目前淋巴瘤的分类方法已从LSG的形态学分类逐渐转变为REAL分类法, REAL分类法是以肿瘤发生源为基础的分类方法,在原来的形态学基础上加上免疫学分型后再加以分类,这种分类方法不仅能够推断肿瘤的发生源,对治疗也有指导意义。因此淋巴瘤的免疫分型越来越重要。如同白血病免疫分型一样,淋巴瘤的免疫分型也是利用单克隆抗体检测淋巴瘤细胞的细胞膜和细胞浆抗原,分析其表现型,以了解被测淋巴瘤细胞所属细胞系列及其分化程度。流式细胞仪能对多数的淋巴瘤细胞的细胞膜和细胞浆抗原迅速客观地做出检测,在淋巴瘤的免疫分型中起着不可替代的作用。临床淋巴瘤的免疫分型的检测标本一般是淋巴结、脾脏、胸水、腹水等。在临床淋巴瘤的免疫分型工作中常可遇到以下四种情况:①B细胞系淋巴瘤②T/NK细胞系淋巴瘤③淋巴细胞系以外的造血细胞肿瘤④造血细胞以外的肿瘤。REAL分类淋巴瘤的免疫表型见表12.8。*:弱表达或阴性。BLBL :前B原始淋巴细胞淋巴瘤/白血病; BSLL: B-小淋巴细胞淋巴瘤; LPL:淋巴浆细胞样淋巴瘤; MCL: 斗篷细胞淋巴瘤; FCL:滤泡中心淋巴瘤; MZL: 边缘带B细胞淋巴瘤; SMZL :脾MZL ;HCL:毛细胞白血病; PC:浆细胞瘤;DLBL: B-弥漫性大细胞淋巴瘤; BL: Burkitts淋巴瘤; HBLB:高度B细胞淋巴瘤, Burkitts样; TLB L: 前T原始淋巴细胞淋巴瘤/白血病; TPLL: T幼淋细胞白血病; LGLT:大颗粒淋巴细胞白血病, T细胞型[col
美国俄亥俄州立大学李巨研究小组首次在分子层面上设计一种模型,能够描述血红细胞是如何从正常的扁圆形缩成子弹形,穿过比它们的正常直径还小的血管。该研究结果在线发表在3月12日的《美国科学院院刊》上。 研究血红细胞如何从柔软的物体变成几乎液化的形态,能够帮助科学家们更好地了解疟疾、镰状细胞贫血症以及球形红细胞贫血症等。 人类血红细胞在其4个月的生命中,要成百万次地挤过细小的毛细血管,以便输送氧气,运走二氧化碳等废物。这是生命必需的过程。血红细胞的直径约为8微米,它们在流动过程中,常常穿过直径只有2微米的血管。血红细胞会拉长成子弹形状,然后在穿过血管后,恢复成本来的扁圆形。 李巨研究小组设计的这种模型显示,血红细胞的细胞骨架在这个变形过程中起到了重要作用。每个血红细胞都有一个细胞骨架,它由一种名为“血影蛋白”的蛋白分子构成,以一种类似毛刷的结构附着在细胞膜内侧。当这层蛋白质结构之间的键接破裂,或者这层结构与细胞膜之间的附着破裂,细胞就会变得更加柔软,从而能够穿过狭窄的通道。 研究人员发现这种变化或者是由于两个血影蛋白分子之间的键被断开,或者是由于血影蛋白与一种细胞膜中的肌动蛋白的键被断开。而加诸机械力(如挤压或者切断)或者化学能(如ATP),都足以断开这些化学键,进而引起细胞骨架的变形。 研究人员将利用该模型进一步研究几种血液疾病,包括疟疾、镰状细胞贫血症以及球形红细胞贫血症等。在疟疾患者中,细胞里的寄生虫会改变细胞膜和细胞骨架,从而使细胞失去原有的弹性,无法穿过血管。在镰状细胞贫血症中,红细胞会变成镰刀状,而在球形红细胞贫血症中,红细胞会变成球形,因而都无法正常地通过血管。 李巨博士1994年毕业于中国科学技术大学少年班。2000年获得麻省理工学院核工程技术系博士学位,之后在该系从事博士后研究工作,2002年成为俄亥俄州立大学助理教授。曾获美国材料学会2006年度青年科学家奖。
据美国物理学家组织网报道,研究人员发现,在酸度出现变化的环境下,蛋白分子的结构将在原子水平上发生改变,引发病毒入侵并与宿主细胞发生融合。美国普渡大学和巴斯德研究所的研究小组分别研究了酸性环境和中性环境中的蛋白结构。结合两个小组的研究成果,能够说明病毒在进入宿主细胞并准备与之融合时蛋白质结构所发生的变化,而这恰恰是病毒感染的关键步骤。研究人员借助电子显微镜清楚观测到这种病毒表面蛋白质的3D结构,他们发现,蛋白质E1、E2、p62等在病毒入侵机制中发挥着关键作用。此前研究人员已经知道了包膜蛋白1(E1)的结构,仅知道包膜蛋白2(E2)的一般特征,如它在蛋白质复合体的位置,但还不了解它的结构。普渡大学研究人员现在已确定了E2的结构,以及E1、E2蛋白质复合体在原子水平上的精确结构。他们已经了解了E2的三种结构域,以及在酸性环境中,E2如何与细胞膜融合。E2是一种受体结合蛋白,病毒可附着其上进入宿主细胞。病毒在宿主细胞的酸性环境中引发蛋白复合物结构发生变化,从而可使病毒与细胞膜融合,形成一个“融合孔”,病毒可通过“融合孔”将遗传物质转移到宿主细胞,宿主细胞在感染病毒后会产生新的病毒粒子。普渡大学著名生物科学教授迈克尔·罗斯曼认为,这一发现具有里程碑意义,有助于人们掌握病毒如何感染人类和其他生物的相关知识,也有助于人们生产更好的疫苗和抗病毒药物。
[align=center][size=18px][b]细胞信号通路那些事儿[/b][/size][/align][align=center][size=14px]会议时间[/size][size=14px]:[/size][size=14px]2020年[/size][size=14px]5[/size][size=14px]月[/size][size=14px]2[/size][size=14px]8[/size][size=14px]日1[/size][size=14px]4[/size][size=14px]:00[/size][/align][size=16px][b]内容[/b][/size][size=16px][b]介绍:[/b][/size]信号通路(signal pathway)的提出最早可以追溯到1972年,信号通路是指能将细胞外的分子信号经细胞膜传入细胞内发挥效应的一系列酶促反应通路。这些细胞外的分子信号(称为配体,ligand)包括激素、生长因子、细胞因子、神经递质以及其它小分子化合物等。配体特异性地结合到细胞膜或细胞内的受体(receptor)后,在细胞内的信号又是如何传递的呢?细胞内各种不同的生化反应途径都是由一系列不同的蛋白组成的,执行着不同的生理生化功能。各个信号通路中上游蛋白对下游蛋白活性的调节(包括激活或抑制作用)主要是通过添加或去除磷酸基团,从而改变下游蛋白的立体构象完成的。所以,构成信号通路的主要成员是蛋白激酶和磷酸酶。受体蛋白将细胞外信号转变为细胞内信号,经信号级联放大、分散和调节,最终产生一系列综合性的细胞应答,包括下游基因表达的调节、细胞内酶活性的变化、细胞骨架构型和DNA合成的改变等。这些变化并非都是由一种信号引起的,也可以通过几种信号的不同组合产生不同的反应。本次讲座将为大家介绍几种常见的信号通路及酶标仪在其中的应用。[size=16px][b]讲师[/b][/size][size=16px][b]介绍:[/b][/size] [size=14px][b]田华[/b][/size][size=14px][b]:[/b][/size][size=14px]现任[/size][size=14px]MolecularDevices[/size][size=14px]高级应用科学家,在[/size][size=14px]MolecularDevices[/size][size=14px]公司从事酶标仪的售前售后技术支持工作,熟悉酶标仪的原理及各种应用。毕业于南京农业大学遗传学专业,曾就职于中国科学院植物生理生态研究所和生物公司,拥有8年生物技术公司工作经验,熟悉各种分子和细胞生物学实验[/size][size=14px]。[/size]报名地址:[url]https://www.instrument.com.cn/webinar/meeting_13687.html[/url]
发酵过程中,细胞浓度是一个非常重要的生理参数,不但可以计算比生长速率,底物消耗速率、生物量产率和维持系数等参数,还可以及时判断是否有染菌等异常情况发生。目前测量细胞浓度的方法主要有化学法(DNA/RNA分析)和物理法(干重、光密度、呼吸商等)两大类。一般来说,与物理法相比,化学法能较准确的测量有代谢活性的生物量,缺点是花费时间长,而利用物理法测量,无法区分区分处于悬浮状态的颗粒和微生物,也无法分别活死细胞。 实现在线活细胞浓度一直是发酵领域的热门话题,仅些年来出现了不少的测量方法,依据的工作原理也是五花八门,其中最具代表性的有声学,激光散色、荧光、核磁、量热或电容。 其中法国fogale公司的测量仪器,以电容法为工作原理,直接将传感器安装与发酵罐上,可承受121℃高温灭菌,理论技术也比较成熟,是目前最为理想的适合工业级别的在线活细胞传感器。工作原理:电容传感器采用活细胞的介电特性,实时连续测量活细胞的生物体积,可应用于实验室桌面型的反应器或者是工业规模的大型反应器两对对电极位于传感器的顶部,一对用于在培养基中产生交变的电场,在电场范围内,带有完整细胞膜的细胞会在培养基中发生极化现象,发生极化的细胞可以认为是极小的电容,死细胞或者其他粒子没有完整的细胞膜,所以不能形成电容型号。另一对电极用于检测培养基中的介电信号,培养基中的介电信号和细胞的浓度是精确关联的。细胞的极化率和电场的频率纯在函数关系,当频率增加时,培养基中细胞的介电常数由低频峰(最大极化)降低到高频峰(最小极化)。这种随频率增加极化率降低的现象称为β-散射。传感器采用双频测量模式:培养基的基线在10MHz左右得到,细胞的信号在临界频率区域获得,在曲线的拐点,(动物细胞和细菌在1MHz,酵母在2MHz)我们获得了最佳的信号线性。应用:这项技术可广泛应用于各种细胞培养,生物发酵过程。已被文献证实可应用的细胞如下:动物细胞:CHO, BHK, MDCK, PERC6, NSO, HEK, Hela,Hybridoma, Vero细 菌:E.Coli, Bacillus Thuringensis, Salmonella,Streptomyces, Lactic Bacteria酵 母:Pichia Pastoris, Saccharomyces Cervisiae, PolymorphaHasenula昆虫细胞:sf9, Hi-5真 菌:Absidia
这样理解有没有问题?
一、实验目的1、掌屋凋亡细胞的形态特征 2、学会用荧光探针对细胞进行双标记来检测正常活细胞、凋亡细胞和坏死细胞的方法二、实验原理 细胞死亡根据其性质、起源及生物学意义区分为凋亡和坏死两种不同类型。凋亡普遍存在于生命界,在生物个体和生存中起着非常重要的作用。它是细胞在一定生理条件下一系列顺序发生事件的组合,是细胞遵循一定规律自己结束生命的自主控制过程。细胞凋亡具有可鉴别的形态学和生物化学特征。在形态上可见凋亡细胞与周围细胞脱离接触,细胞变园,细胞膜向内皱缩、胞浆浓缩、内质网扩张、细胞核固缩破裂呈团块状或新月状分布、内质网和细胞膜进一步融合将细胞分成多个完整包裹的凋亡小体,凋亡小体最后被吞噬细胞吞噬消化。在凋亡过程中细胞内容物并不释放到细胞外,不会影响其它细胞,因而不引起炎症反应。在生物化学上,多数细胞凋亡的过程中,内源性核酸内切酶活化,活性增加。核DNA随机地在核小体的连接部位被酶切断,降解为180-200bp或它的整倍数的各种片断。如果对核DNA进行琼脂糖电泳,可显示以180-200bp为基数的DNA ladder(梯状带纹)的特征。相比之下,坏死是细胞处于剧烈损伤条件下发生的细胞死亡。细胞在坏死早期即丧失质膜完整性,各种细胞器膨胀,进而质膜崩解释放出其中的内容物,引起炎症反应,坏死过程中细胞核DNA虽也降解,但由于存在各种长度不等的DNA片断,不能形成梯状带纹,而呈弥散状。一些温和的损伤刺激及一些抗肿瘤药物可诱导细胞凋亡,通常这些因素在诱导凋亡的同时,也可产生细胞坏死,这取决于损伤的剧烈程度和细胞本身对刺激的敏感程度。三尖杉酯碱(HT)是我国自行研制的一种对急性粒细胞白血病,急性单核白血病等有良好疗效的抗肿瘤药物。研究表明HT在0.02~5μg/ml范围内作用2小时,即可诱导HL-60细胞凋亡,并表现出典型的凋亡特征。本实验用1μg/ml HT在体外诱导培养的HL-60细胞发生凋亡,同时也有少数细胞发生坏死。用Hoechst33342和碘化丙啶(propidium iodide,PI)对细胞进行双重染色,可以区别凋亡、坏死及正常细胞。细胞膜是一选择性的生物膜,一般的生物染料如PI等不能穿过质膜。当细胞坏死时,质膜不完整,PI就进入细胞内部,它可嵌入到DNA或RNA中,使坏死细胞着色,凋亡细胞和活细胞不着色。而一些活细胞染料由于为亲脂性物质,可跨膜进入活细胞,因而可进行活细胞染色。Hoechst33342是一种活性荧光染料且毒性较弱,它是双苯并咪唑的一种衍生物。与DNA特异结合(主要结合于A-T)碱基区),显示凋亡细胞和活细胞。凡是看到有凋亡小体的细胞都是凋亡细胞。三、实验用品1、试剂:三尖杉酯碱(HT),300μg/ml,100mmol/L Tris-HCl(pH7.5),5mol/L EDTA缓冲液、碱性裂解液:0.2mol/L NaOH, 1%SDS、醋酸钠:3mol/L KAc(pH4.8);异丙醇;70%乙醇;溴酚蓝,蔗糖指示剂。TBE电泳缓冲液,1%琼脂糖,溴乙锭。PI母液:500μg/ml;Ho33342母液:2mmol/L。 2、仪器设备:荧光显微镜,电泳仪,电泳槽,微量加样器(1ml,100μl)0.5、1.5ml离心管,载玻片,盖玻片。四、实验材料人早幼粒白血病HL-60细胞,用含10%小牛血清的RPMI1640培养基在37℃,5%CO2条件下培养。五、方法步骤 1、三尖杉酯碱诱发HL-60细胞凋亡 (1)实验前约24小时,接种两瓶HL-60细胞,标记①、②,每瓶含约6ml培养液,置37℃,5%CO2培养箱培养。 (2)实验前约2.5小时,当细胞密度达到70%,①号瓶加入三尖杉酯碱200μl,使终浓度为1μg/ml,②号瓶中加入同等量PBS(pH7.4)作对照。共同放入培养箱中继续培养2.5小时。2、Ho33342和PI双重染色鉴别三种细胞 (1)染色:将瓶中的细胞摇匀取200μl于1.5ml的离心管中,加入Ho33342母液2μl,PI 20μl,染色15分钟。 (2)滴片:取一载玻片用双面胶围成一小室,从离心管中各取以上染色后的细胞悬液10μl,加入小室内盖上盖玻片,荧光镜下用紫外激发光,高倍镜下观察,区别三种细胞,并注意三者比例。六、注意事项1、诱导培养HL-60细胞时间要准确; 2、荧光显微镜下观察细胞时,由于荧光易碎灭,观察时要尽量快。
[b][font=微软雅黑][size=10.5pt]一、机械破碎法:[/size][/font][/b][font=微软雅黑][size=10.5pt][font=微软雅黑]是指利用捣碎机、研磨器或匀浆器[/font] [font=微软雅黑]等将细胞破碎开来[/font] [font=微软雅黑]。[/font][/size][/font][font=微软雅黑][size=10.5pt]1. 高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。此法适用于动物内脏组织、植物肉质种子等。[/size][/font][font=微软雅黑][size=10.5pt]2. 玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。[/size][/font][b][font=微软雅黑][size=10.5pt]二、物理破碎法:[/size][/font][/b][font=微软雅黑][size=10.5pt]指利用温度差、压力差或超声波等将细胞破碎开来。[/size][/font][font=微软雅黑][size=10.5pt]1.用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂(借助超声的震动力破碎细胞壁和细胞器)。[/size][/font][font=微软雅黑][size=10.5pt]机制:可能与强声波作用溶液时,气泡产生、长大和破碎的空化现象有关,空化现象引起的冲击波和剪刀力使细胞裂解。[/size][/font][font=微软雅黑][size=10.5pt]超声波破碎的效率取决于声频、声能、处理时间、细胞浓度和细胞类型等。(使用时注意降温,防止过热)。[/size][/font][font=微软雅黑][size=10.5pt]2. 高压破碎:细胞悬浮液从高压室的环状隙喷射到静止的撞击环上,被迫改变方向经出口管流出。此过程中细胞经历了高速造成的剪切的碰撞及高压到常压的变化,从而破碎释放内含物。[/size][/font][font=微软雅黑][size=10.5pt]这是一种温和的、彻底破碎细胞的较理想的方法。[/size][/font][font=微软雅黑][size=10.5pt]3. 反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。[/size][/font][b][font=微软雅黑][size=10.5pt]三、化学破碎法:[/size][/font][/b][font=微软雅黑][size=10.5pt][font=微软雅黑]指利用甲醛、丙酮等有机溶剂或表面活性剂作用于细胞膜,使细胞膜的结构遭到破坏或透性发生改变[/font] [font=微软雅黑]。[/font][/size][/font][font=微软雅黑][size=10.5pt][font=微软雅黑]有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠([/font]SDS)、去氧胆酸钠等细胞膜破坏。浓度一般为1mg/ml。[/size][/font][font=微软雅黑][size=10.5pt][font=微软雅黑]四、酶学破碎法[/font] [font=微软雅黑]:[/font][/size][/font][font=微软雅黑][size=10.5pt]选用合适的酶,使细胞壁遭到破坏,进而在低渗溶液中将原生质体破碎开来。[/size][/font][font=微软雅黑][size=10.5pt]细菌细胞壁较厚,可采用溶菌酶处理效果更好。[/size][/font][font=微软雅黑][size=10.5pt][font=微软雅黑]裂解液标准配方[/font]: :50mM Tris-HCl(pH8.5~9.0), 2mM EDTA, 100mM NaCl, 0.5% Triton X-100, 1mg/ml溶菌酶。(溶菌酶在这个pH范围内比较好发挥作用) 。[/size][/font][font=微软雅黑][size=10.5pt][font=微软雅黑]综合叙述:无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸([/font]DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入PMSF也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。[/size][/font]
激光扫描共聚焦显微镜是近十年发展起来的医学图像分析仪器,与传统的光学显微镜相比,大大地提高了分辨率,能得到真正具有三维清晰度的原色图像。并可探测某些低对比度或弱荧光样品,通过目镜直接观察各种生物样品的弱自发荧光。能动态测量Ca2+ 、pH值,Na+、Mg2+等影响细胞代谢的各种生理指标,对细胞动力学研究有着重要的意义。同时激光扫描共聚显微镜可以处理活的标本,不会对标本造成物理化学特性的破坏,更接近细胞生活状态参数测定。可见激光扫描共聚焦显微镜是普遍显微镜上的质的飞跃,是电子显微镜的一个补充,现已广泛用于荧光定量测量,共焦图像分析,三维图像重建、活细胞动力学参数分析和胞间通讯研究等方面,在整个细胞生物学研究领域有着广阔的应用前景。1. 定量荧光测量ACAS可进行重复性极佳的低光探测及活细胞荧光定量分析。利用这一功能既可对单个细胞或细胞群的溶酶体,线粒体、DNA、RNA和受体分子含量、成份及分布进行定性及定量测定,还可测定诸如膜电位和配体结合等生化反应程度。此外,还适用于高灵敏度快速的免疫荧光测定,这种定量可以准确监测抗原表达,细胞结合和杀伤及定量的形态学特性,以揭示诸如肿瘤相关抗原表达的准确定位及定量信息。2. 定量共聚焦图像分析借助于ACAS激光共焦系统,可以获得生物样品高反差、高分辨率、高灵敏度的二维图像。可得到完整活的或固定的细胞及组织的系列及光切片,从而得到各层面的信息,三维重建后可以揭示亚细胞结构的空间关系。能测定细胞光学切片的物理、生物化学特性的变化,如DNA含量、RNA含量、分子扩散、胞内离子等,亦可以对这些动态变化进行准确的定性、定量、定时及定位分析。3. 三维重组分析生物结构ACAS使用SFP进行三维图像重组,SFP将各光学切片的数据组合成一个真实的三维图像,并可从任意角度观察,也可以借助改变照明角度来突出其特征,产生更生动逼真的三维效果。4. 动态荧光测定Ca2+、pH 及其它细胞内离子测定,利用ACAS能迅速对样品的点,线或二维图像扫描,测量单次、多次单色、双发射和三发射光比率,使用诸如Indo-1、BCECF 、Fluo-3等多种荧光探针对各种离子作定量分析。可以直接得到大分子的扩散速率,能定量测定细胞溶液中Ca2+对肿瘤启动因子、生长因子及各种激素等刺激的反应,以及使用双荧光探针Fluo-3和CNARF进行Ca2+和pH的同时测定。5. 荧光光漂白恢复(FRAP)——活细胞的动力学参数荧光光漂白恢复技术借助高强度脉冲式激光照射细胞某一区域,从而造成该区域荧光分子的光淬灭,该区域周围的非淬灭荧光分子将以一定速率向受照区域扩散,可通过低强度激光扫描探测此扩散速率。通过ACAS可直接测量分子扩散率、恢复速度,并由此而揭示细胞结构及相关的机制。6. 胞间通讯研究动物细胞中由缝隙连接介导的胞间通讯被认为在细胞增殖和分化中起非常重要的作用。ACAS可用于测定相邻植物和动物细胞之间细胞间通讯,测量由细胞缝隙连接介导的分子转移,研究肿瘤启动因子和生长因子对缝隙连接介导的胞间通讯的抑制作用,以及胞内Ca2+、PH和cAMP水平对缝隙连接的调节作用。7. 细胞膜流动性测定ACAS设计了专用的软件用于对细胞膜流动性进行定量和定性分析。荧光膜探针受到极化光线激发后,其发射光极性依赖于荧光分子的旋转,而这种有序的运动自由度依赖于荧光分子周围的膜流动性,因此极性测量间接反映细胞膜流动性。这种膜流动性测定在膜的磷脂酸组成分析、药物效应和作用位点,温度反应测定和物种比较等方面有重要作用。8. 笼锁-解笼锁测定许多重要的生活物质都有其笼锁化合物,在处于笼锁状态时,其功能被封闭,而一旦被特异波长的瞬间光照射后,光活化解笼锁,使其恢复原有活性和功能,在细胞的增值、分化等生物代谢过程中发挥功能。利用ACAS可以人为控制这种瞬间光的照射波长和时间,从而达到人为控制多种生物活性产物和其它化合物在生物代谢中发挥功能的时间和空间作用。9. 粘附细胞分选ACAS是目前唯一能对粘附细胞进行分离筛选的分析细胞学仪器,它对培养皿底的粘附细胞有两种分选方法: ① Coolie-CutterTM法,它是Meidian公司专利技术,首先将细胞贴壁培养在特制培养皿上,然后用高能量激光的欲选细胞四周切割成八角形几何形状,而非选择细胞则因在八角形之外而被去除,该分选方式特别适用于选择数量较少诸如突变细胞、转移细胞和杂交瘤细胞,即使百万分之一机率的也非常理想。 ② 激光消除法,该方法亦基于细胞形态及荧光特性,用高能量激光自动杀灭不需要的细胞,留下完整活细胞亚群继续培养,此方法特别适于对数量较多细胞的选择。10. 细胞激光显微外科及光陷阱技术借助ACAS可将激光当作“光子刀”使用,借此来完成诸如细胞膜瞬间穿孔、切除线粒体、溶酶体等细胞器、染色体切割、神经元突起切除等一系列细胞外科手术。通过ACAS光陷阱操作来移动细胞的微小颗粒和结构,该新技术广泛用于染色体、细胞器及细胞骨架的移动。
特点:实时在线测量活细胞浓度,只对活细胞敏感,电容探头对于悬浮液中的死细胞、细胞碎片、微载体、非细胞粒子不敏感。优化细胞生长、培养基、补料策略、诱导时间、收获时间、或者检测细胞裂解以及其他培养过程中的偏差工作原理:电容传感器采用活细胞的介电特性,实时连续测量活细胞的生物体积,可应用于实验室桌面型的反应器或者是工业规模的大型反应器两对电极位于传感器的顶部,一对用于在培养基中产生交变的电场,在电场范围内,带有完整细胞膜的细胞会在培养基中发生极化现象,发生极化的细胞可以认为是极小的电容,死细胞或者其他粒子没有完整的细胞膜,所以不能形成电容型号。另一对电极用于检测培养基中的介电信号,培养基中的介电信号和细胞的浓度是精确关联的。细胞的极化率和电场的频率纯在函数关系,当频率增加时,培养基中细胞的介电常数由低频峰(最大极化)降低到高频峰(最小极化)。这种随频率增加极化率降低的现象称为β-散射。传感器采用双频测量模式:培养基的基线在10MHz左右得到,细胞的信号在临界频率区域获得,在曲线的拐点,(动物细胞和细菌在1MHz,酵母在2MHz)我们获得了最佳的信号线性。参考文献:如果您想进一步了解这项技术、相关应用、结果,请查看以下文献Monitoring nutrient limitations by onlinecapacitance measurements in batch and fed-batch CHO fermentations. SvenAnsorge. ESACT 2005 Poster; CCEX 2006 PosterOnline Measurement of Viable Cell Density inAnimal Cell Culture Processes. Georg Schmid. CCE IX 2003 Poster. Evaluation of a Novel Capacitance Probe forOn-Line Monitoring of Viable Cell Densities in Batch and Fed-Batch Animal CellCulture Processes. Georg Schmid. ESACT 2003 Poster On-line viable cell density andphysiological states monitoring by dielectric spectroscopy sf9 growth andinfection process. G.Esteban. CCEX 2006 Poster. On-line monitoring of infected Sf-9 insectcell cultures by scanning permittivity measurements and comparison withoff-line biovolume measurements. Sven Ansorge. Cytotechnology (2007) 55:115–124Process optimization of large-scaleproduction of recombinant adeno-associated vectors using dielectricspectroscopy. Alejandro Negrete. Appl Microbiol Biotechnol (2007) 76:761–772. Online monitoring of vero cells culturesduring the growth and rabies virus process using biomass spectrometer. Samia Rourou.ESACT 2007 Poster On-Line Monitoring of Lentiviral VectorProduction for Characterization of Viral Production and Release Kinetics. SvenAnsorge. ESACT 2009 Poster On-line Pichia pastoris physiological statemonitoring by dielectric spectroscopy. L. PREZIOSI-BELLOY. ECB12 2005 Poster
随着分子生物学的快速发展,许多实验的目标物质都是细胞内物质,要进行实验研究或产物收集就必须将细胞破壁,使产物得以释放,才能进一步提取,因此细胞破碎就变成了提取胞内产物的关键步骤,破碎方法的得当与否,直接影响到所提取产品的产量、质量和生产成本。现将常用的几种细胞破碎方法介绍如下。1.超声波破碎 利用超声波高强度声能产生的空化现象引起冲击波和剪切力进行细胞破碎。超声破碎的效率与超声频率、超声功率、处理时间、细胞浓度及处理量等因素有关。 不足及须加强的问题:超声波破碎在实验室规模应用较普遍,处理少量样品时操作简便,液量损失少,但超声波产生的化学自由基团可能使某些敏感性活性物质变性失活影响实验结果。且大容量装置声能利用率低,装置散热性差。2.生物酶溶法 就是用生物酶将细胞壁和细胞膜消化溶解的方法。常用的溶酶有溶菌酶β-1.3-葡聚糖酶、蛋白酶等。 不足:易造成产物抑制作用,这可能是导致胞内物质释放率低的最主要因素。而且溶酶价格高,限制了大规模利用。若回收溶酶,则又增加分离纯化溶酶的操作。另外酶溶法通用性差,不同菌种需选择不同的酶。3.物理珠磨法 微生物细胞悬浮液与极细的研磨剂在搅拌浆作用下充分混合,珠子之间以及珠子和细胞之间和互相剪切、碰撞,使细胞壁破碎,释出内容物,在珠波分离器的协助下,珠子被滞留在破碎室内,浆液流出,从而实现连续操作,破碎中产生的热量由夹套中的冷却液带走。缺陷:效能利用率仅为1%左右,且破碎过程产生大量的热能无法利用。4.化学渗透法 某些有机溶剂(如苯、甲苯)、抗生素、表面活性剂、金属螯合剂、变性剂等化学药品都可以改变细胞壁或膜的通透性从而使细胞内容物物有选择地渗透出来。其作用机理;化学渗透取决于化学试剂的类型以及细胞壁和膜的结构与组成。 不足:时间长,效率低;化学试剂毒性较强,同时对产物也有毒害作用,进一步分离时需要用透析等方法除去这些试剂;通用性差。