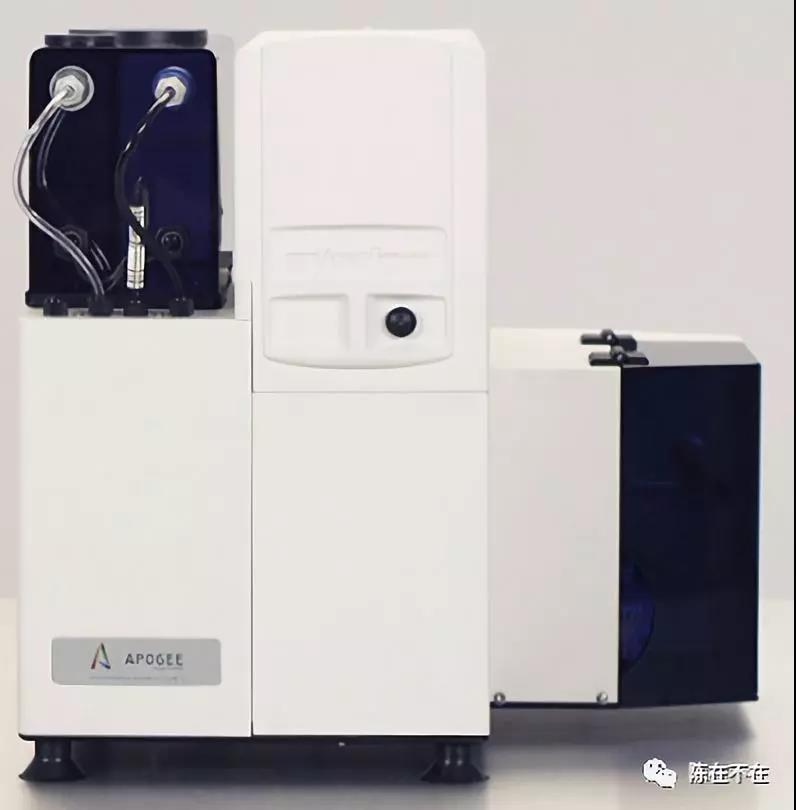
浅谈流式细胞仪十大发展趋势
p style="text-indent: 2em "从二十世纪八十年代至今,世界上生产流式细胞仪的厂家几经变迁,BC & BD仍在,新玩家不断进入,并购重组各取所需,它们生产各种不同性能和功能的流式细胞仪。总体而言,呈现出以下的发展趋势:br//pp strongspan style="color: rgb(0, 112, 192) "1. 应用对象从细胞到颗粒/span/strong/pp 一般而言,流式细胞仪检测的对象是细胞,而且是呈独立状态的悬浮于液体中的细胞,即单细胞悬液。组织和器官中的细胞,必须用各种方法制备成单细胞悬液,才能进行检测。/pp 细菌、浮游生物等也可以用流式细胞仪分析。/pp 一些不是细胞的单个粒子,如病毒、细胞核、染色体、原生质体等也是流式细胞仪的检测对象。实际上,用“颗粒”而不仅仅是“细胞”来定义流式细胞仪的检测对象,显然更有代表意义。/pp 因为流式细胞仪可以将“颗粒”视同为“细胞”来进行检测,在特制的微球上包被抗原,抗体或核酸探针,以微球为载体来检测各种可溶性蛋白、细胞因子、自身抗体、特定的核酸序列等,从而使流式细胞仪的检测对象扩展到分子范围。/pp Luminex公司的多重流式检测平台能够自一个微量反应孔中同时检测50、100甚至多达500种分析物,俨然成为这一技术的金标准。/pp strongspan style="color: rgb(0, 112, 192) "2. 检测颗粒尺度大大拓宽/span/strong/pp 常规流式细胞仪检测颗粒的范围为0.5-50μm。/pp 电荷分选流式细胞仪检测颗粒范围与喷嘴直径等相关,最大应到喷嘴直径的1/3-1/2,目前最大直径的喷嘴为200μm。/pp Union Biometrica公司的气流分选平台COPAS FP和BioSorter能够适应大到1500μm的颗粒,可以用于分选模式动物的卵和幼虫 模式植物种子与花粉 大体积细胞与细胞簇等。CytoBuoy公司的Cytosense也可以到1500μm。 /pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/aca8ce15-8bb8-42f4-8863-4675f7724835.jpg" title="01.jpg" alt="01.jpg" width="381" height="417" style="width: 381px height: 417px "//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Union Biometrica公司气流分选流式原理图/span/pp 通过光路优化,采用多角度光散射,使用特殊荧光探针,甚至加装紫色激光收集散射光信号,有些流式细胞仪可以实现0.2μm颗粒与噪音信号的鉴别。/pp Apogee着力于微颗粒分析,其A50-Micro plus散射光的检测低限至80nm,可用于循环微粒,外泌体及特殊微生物检测。/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/28e29df6-ee87-449c-b362-20f9785b26ec.jpg" title="02.jpg" alt="02.jpg" width="311" height="320" style="width: 311px height: 320px "//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Apogee A50-Micro plus/span/pp strongspan style="color: rgb(0, 112, 192) " 3.多种流路技术商品化/span/strong/pp 绝大多数流式细胞仪基于鞘液流体动力学模式。/pp 因为负压进样省去了庞大的压缩气源,可以灵活使用各种上样管,已经成为几乎所有公司新仪器的选择。/pp 一般认为,流式细胞仪采用毛细管而非鞘液,容易被大的细胞或聚集细胞所阻塞,而且流动细胞难以准确聚焦,流速难以维持恒定。/pp Guava平台easyCyte(现被Luminex公司收购)通过负压进样,采用高压注射泵与PEEK管路,建立自稳流的微毛细管系统,据称解决了以上困扰,带来的好处是无需鞘液,产生废液也少。/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/bebe5684-49c2-419d-aa5c-e4fc9f47041a.jpg" title="03.jpg" alt="03.jpg"//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Guava easyCyte(Luminex)/span/pp Thermo公司声波流式细胞仪Attune NxT ,该产品利用超声波将细胞聚集在样品流中轴线上。进样速度至1mL/min时,也可以避免基于鞘液的流式的所谓轴流加宽和细胞分散现象,这一技术的最大优势是快速检测,同时对稀有细胞的分析比较有利。/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/407f47e9-043f-4bea-a5ab-dcd240aebc70.jpg" title="04.jpg" alt="04.jpg"//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Thermo Attune NxT/span/pp strongspan style="color: rgb(0, 112, 192) "4.从相对计数到直接绝对计数/span/strong/pp 为满足统计学要求,流式细胞仪必须采集一定数量的细胞,仪器设定以细胞数为停止条件。传统流式细胞仪测试结果为相对计数,即目标细胞在某一总体系中的比值。/pp 随着应用深入,人们发现比值的变或者不变,以及变化大小不能反映细胞的真实变化,绝对计数,即单位体积内的细胞数被证明更具实际价值。/pp 最早是采用双平台法来解决以上问题,即用血细胞分析仪来获得白细胞,淋巴细胞等浓度,再结合流式细胞仪测定的百分比来计算被测细胞的绝对计数值。由于该法需要使用两种仪器,操作步骤多、变异系数大,不同实验室之间的差异也较大,因此应用受到限制。/pp 后来人们采用微球法,即用已知浓度的微球作为参比,通过被测细胞和微球的比例关系来进行绝对计数,但因计数微球价格较为昂贵,实际应用受到限制。/pp 近年来,厂家的共识回到了测定进样体积这一思路上来,替代微球法直接进行绝对计数,取得更为精确的结果。区别在于不同产品具体测定技术的差别。/pp 蠕动泵:Accuri C6 Plus、CytoFlex/pp 注射泵:easyCyte、NovoCyte、CytoFlow/pp 流量传感器:FACSVerse、Bricyte E6/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/ccfa4c2d-589a-4fd1-8bcd-17e1112840b1.jpg" title="05.jpg" alt="05.jpg"//pp style="text-align: center "Sysmex CytoFlow系列TVAC体积测定原理/pp strongspan style="color: rgb(0, 112, 192) "5.光路优化和光学新元件的应用/span/strong/pp 庞大的水冷或气冷的激光器逐渐被小型化的固态激光器取代。/pp 光纤传导应用越来越普遍。/pp 光纤耦合让光能量传输更高效,而不为公司所专有。/pp 雪崩光电二极管等等新检测器提供新的选择。请见专家分析:/pp 流式细胞仪是怎么“看见”光的?/pp 以及光学元件的神级组合让灵敏度达到新的高度。/pp MESF是仪器灵敏度衡量的标准,基于微球,基于鞘液。/pp 不同公司没有约定俗成,不是那么容易比较,但就同一公司产品而言:/pp BD FACSCelesta FITC 25 PE 15/pp Beckman Coulter CytoFlex FITC 30 PE 10/pp strongspan style="color: rgb(0, 112, 192) "6.以多色分析为核心的新型光学技术的迅速发展/span/strong/pp 早期流式细胞仪的主要应用还是细胞DNA含量测定,这一技术对设备要求不高,通常配备一个散射光和一个荧光信号的流式细胞仪就足以应付。随着新型荧光探针的不断开发和仪器软、硬件的逐步更新,流式细胞仪多色荧光分析得到了迅速发展,包括两个方面:/pp 单激光多色,如488nm激光同时激发7色,紫色激光同时激发10色/pp 多激光:如10激光机器。/pp 也包括两种新的光学设计机型:/pp 光谱流式,利用特殊的接受装置收集某范围内的全发射光谱,无需补偿,区别发射光谱重合度高的荧光染料对。目前有Sony公司SP6800Z和SA3800,Cytek公司的Aurora。/pp 质谱流式,利用质谱原理对单细胞进行多参数检测的流式技术。这个名为CyTOF的平台最初由DVS Sciences公司开发,后被Fluidigm公司收购。仪器采用同位素标记抗体来标记或识别细胞表面和内部的信号分子,并根据流式细胞原理分离单个细胞,再用感应耦合等离子质谱(ICP-MS)观察单个细胞的原子质量谱,最后将原子质量谱的数据转换为细胞表面和内部的信号分子数据。2015年推出的Helios的检测通道达到135个,几乎没有信号重叠或背景噪音。/pp img src="https://img1.17img.cn/17img/images/201901/uepic/c79c2dc9-dc52-45a2-9c40-da860593a6cd.jpg" title="06.jpg" alt="06.jpg" style="text-align: center "//pp style="text-align: center "span style="color: rgb(127, 127, 127) "来自CyTek网站,不代表本人观念/spanbr//pp 必须注意的是,多色分析提供了多种细胞特性的相互关系图,从而更加精确地界定一种细胞亚群,更好地对不同细胞进行分类。但是,同时检测的荧光染料越多,需准确调节各通道之间的补偿,技术难度更大,因为其中包含的信息量非常大,错误信号掺杂的概率也相应增加,所以数据分析时需格外注意,一般需采用不同的标记方案多次相互验证才能得出重要结论。光谱流式和质谱流式的出现克服了补偿问题。/pp 但是,荧光染料匹配仍未解决,毕竟不是每个激光器都能如设计所愿,同时激发6色,7色到10色,甚至如光谱流式所希望的16色或者32色。所以,对20色以上多色分析仪器来说,标称往往都是理论,至少在目前还是设计师的想象。/pp strongspan style="color: rgb(0, 112, 192) "7.数据处理能力不断提升/span/strong/pp 随着数字化技术的引入,以及数据处理系统的升级,流式细胞仪的数据处理能力得到极大提升。/pp 数据处理速度:反映数据扫描频率,用Hz表示。/pp 处理精度:信号采集精度,用比特表示,反映采集通道多少。目前仪器一般在20比特(2的20次方,100万通道)以上,最高达32比特(43亿通道)。/pp 线性范围:目前一般在105以上,最高到107。/pp 单文件存储能力:反映文件储存能力,对稀有细胞分析有利。/pp 数据能力的提升直接影响到仪器的分析和分选速度。/pp 速度的提升是光路,流路和数据采集系统三者共同优化改善的结果。/pp 传统的流式细胞仪,分析速度不超过10000 events/s,新上市产品基本达到25000 events/s(注意:不是细胞/s)以上,如Beckman Coulter公司CytoFlex为30000 events/s,Cytek公司Aurora 为35000 events/s ,BD公司的LSRFortessa 为40000 events/s with beads,Bio-Rad公司ZE5为100000 events/s。/pp style="text-align: center " img src="https://img1.17img.cn/17img/images/201901/uepic/eb697251-c070-476d-8a38-812717426182.jpg" title="07.jpg" alt="07.jpg" style="text-align: center "//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Bio-Rad ZE5/spanbr//pp BD公司FACSCalibur的机械分选,速度只有300/秒,对少量细胞收集困难,须配用浓缩系统进行细胞回收 捕获管的移动和浓缩系统对细胞的机械损伤大,影响分选目的细胞功能特性 由于捕捉器移动不可避免地影响到流路稳定,造成不确定性 机械装置较难彻底清洗消毒。机械式分选已被速度更高的电荷分选所完全取代。/pp 如BD公司FACSAria III(70 psi /90 kHz)和InFlux(60 psi /100 kHz) 四路分选,纯度 98%,得率 80%, 分选速度25000 events/s,继续提高分选速度,纯度不受影响,得率会按Poisson分布下降。/pp Beckman Coulter公司的MoFlo XDP和MoFlo Astrios EQ,据称有效分选速度达到70000细胞/s。/pp strongspan style="color: rgb(0, 112, 192) "8.仪器不断小型化到微流控/span/strong/pp 追求小型化,几乎是所有流式制造商开发新产品的共识。/pp 看一组数字:主机W x D x H/pp span style="color: rgb(192, 0, 0) "strongBD/strong/span Accuri C6 plus / FACSVia/pp 37.5 x 41.9 x 27.9 cm/pp span style="color: rgb(192, 0, 0) "strongBD/strong/span FACSVerse / FACSlyric/pp 63.2 x 57.9 x 57.9 cm/pp span style="color: rgb(192, 0, 0) "strongBD/strong/span FACSCelesta/pp 58 x 61 x 59 cm/pp span style="color: rgb(192, 0, 0) "strongBeckman Coulter/strong/span CytoFlex/pp 42.5 x 42.5 x 34 cm/pp span style="color: rgb(192, 0, 0) "strongMiltenyi Biotec/strong/span MACSQuant/pp 60 x 35 x 40 cm/pp span style="color: rgb(192, 0, 0) "strongThermo/strong/spanstrong /strongAttune NxT/pp 58 x 43 x 40 cm/pp span style="color: rgb(192, 0, 0) "strongCytek/strong/span Aurora/pp 54 x 52 x 52 cm/pp span style="color: rgb(192, 0, 0) "strongMindray/strong/span BriCyte E6/pp 50 x 55 x 50 cm/pp “小”意味着节省空间,容易安装和转移,“小”更值得期许的是减少样本体积,降低试剂消耗,提高检测速度,以及缩小空间所带来的光电及液路的改善。/pp 微流控技术兴起于上世纪90年代,顾名思义就是使用微通道(尺寸为数十到数百微米)处理或操纵微小流体。/pp On-chip公司于2012年推出了世界上第一台微流控芯片流式On-Chip Sort,以低压对细胞进行分选,降低对细胞的损伤 简化实验操作 容易实现系统的无菌 使用一次性交换型模块,减少样品间交叉污染 无需清洗流路通道。Miltenyi Biotec公司的MACSQuant Tyro、Namocell公司的Namocell等亦先后推出类似的微流控流式分选产品。/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/4447d8ae-2611-4183-8988-ecc0f9183d53.jpg" title="08.jpg" alt="08.jpg" width="485" height="215" style="width: 485px height: 215px "//pp style="text-align: center "span style="color: rgb(127, 127, 127) "on-chip公司之on-chip sort/spanbr//pp Sony公司分选平台的两大核心技术即为所谓的CoreFinder全自动校准技术和可更换式微流体芯片的液路设计。最新型号MA900,全自动光路及液流校准 立体式双光斑四激光激发,最多同时检测12色荧光 四路分选。/pp style="text-align: center " img src="https://img1.17img.cn/17img/images/201901/uepic/16b8cd31-0eb3-44ff-bd93-1450cf1ba662.jpg" title="09.jpg" alt="09.jpg" width="415" height="293" style="text-align: center width: 415px height: 293px "//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Sony MA900/spanbr//pp 专门生产分析型微流控流式的制造商Handyem公司,针对微流控装置容易导致细胞黏附和堵塞的问题,于2015年推出HPC-150(国内品牌深圳芯凯瑞),采用双高精度玻璃注射泵代替蠕动泵或单注射泵,据称克服了上一代产品易见的流路堵塞沉积等问题。/pp span style="color: rgb(0, 112, 192) "strong9.融合显微成像技术和流式细胞术/strong/span/pp 细胞生物学两大技术平台分别基于显微镜和流式,前者以形态分析为优,可提供详细的细胞图像信息,但解释主观、费时费力 后者以统计学见长,却缺乏成像能力,因此无法了解亚细胞定位。/pp 融合显微成像技术和流式细胞术的图像流式细胞仪,以Amnis平台为代表(现被Luminex公司收购),最新型号ImageStreamX Mark II,从细胞经过流动池开始即按线性分拆进行分线性照相,其冷CCD采用时间延迟积分方式进行信号采集,每一个样本的分析都生成该样本中所有细胞的荧光强度测量参数和图像数据库,包括“每个细胞”的明场、暗场以及荧光图像。/pp 对于微弱荧光信号可以通过明视野细胞图像辅助设定遮罩,特定加强遮罩下细胞荧光信号,实现对微弱荧光图像的捕捉和分析。/pp 系统可以对每个细胞分析超过500种量化参数,包括细胞整体的散射光和荧光信号强度,以及对细胞形态,细胞结构及亚细胞信号分布的分析。/pp 图像流式细胞仪无须为了得到细胞群统计学资料而损失丰富的形态信息,也无须为了获得细胞细节而损失统计学功能。/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201901/uepic/9d9b7215-7328-4a75-9018-1c4425cc45d0.jpg" title="010.jpg" alt="010.jpg"//pp style="text-align: center "span style="color: rgb(127, 127, 127) "Amnis图像流式细胞仪ImageStreamX Mark II/span/pp Sysmex公司最近推出MI-1000,自动检测多达10000细胞的图像荧光。/pp Union Biometrica公司的气流分选平台COPAS VISION也加入了明场图像。/pp span style="color: rgb(0, 112, 192) "strong10.专业化和临床型仪器纷纷面世/strong/span/pp CytoBuoy公司生产多种用于水体微型生物分析的流式细胞仪,如CytoBuoy安放在浮标上 CytoSub具有特殊的耐压装置,以及内部鞘液循环处理装置,不需外部加入鞘液,可在水下200米使用。Bentley Instruments 公司和Delta Instruments 公司公司专门提供牛奶场使用的专项检测仪器。/pp 临床市场是商品流式细胞仪最具潜力的发展方向。但是,诊断流式试剂的研发和报证,以及符合检验流程的仪器开发,与不断增长的临床应用需求并不匹配。/pp 一些公司推出了专门的小型流式细胞仪,用于CD4细胞的快速计数,如FACSCount、CyFlow Counter等。/pp 迈瑞公司面向临床用户工作流程和场景推出BriCyte E6,针对淋巴细胞亚群分群等临床常规分析,可以实现检验仪器常有的一键得结果,免去繁复的电压和补偿调整,其LIS的双向通信,数据管理都非常符合临床诊断的期望。类似思路在后来上市的BD公司FACSlyric也有体现。/pp 老牌血球生产厂商Sysmex 在收购Partec后的第五年,推出了PS-10流式样本前处理系统,配合新款流式XF-1600,实现样本处理、离心和检测的全自动化流程。详情请见:/pp 全自动流式检测时代的来临!/pp 可以期待,流式细胞仪未来将会作为一个重要的组成部分被整合到血液细胞分析流水线上,在这个系统中,血液细胞分析仪提供血常规结果和异常报警信息,流式细胞仪则根据这些信息对异常细胞进行不同策略的精细鉴别。/pp style="text-indent: 2em "strong style="text-decoration: underline color: rgb(0, 112, 192) "span style="text-decoration: underline color: rgb(0, 112, 192) "了解a href="https://www.instrument.com.cn/zc/144.html" target="_self" style="text-decoration: underline color: rgb(0, 112, 192) "详情请进入流式细胞仪专场/a/span/strong/p