[b][font=宋体]前言[/font][/b][font=宋体]在蛋白质研究领域,稳定细胞系的应用已成为生产高质量结构生物学蛋白质的关键手段。随着技术的不断进步,稳定细胞系的生成与筛选方法得到了显著改进,从而推动了蛋白质生产的高效化与精准化。[/font][font=Calibri] [/font][b][font=宋体]细胞系的建立和应用[/font][font=宋体][font=Calibri]HEK293[/font][font=宋体]和[/font][font=Calibri]CHO[/font][font=宋体]细胞系[/font][/font][/b][font=宋体]因其稳定的蛋白表达和适当的翻译后修饰而被广泛用于结构生物学研究。这些细胞系能有效地生产具有复杂糖基化模式的蛋白质,这对于确保蛋白质的功能和稳定性至关重要。糖基化缺陷细胞系通过特定的基因改造,能够分泌脱糖基化糖蛋白,为蛋白质生产提供了更加纯净的原料。[/font][font=Calibri] [/font][b][font=宋体]稳定细胞系的生成[/font][/b][font=宋体][font=宋体]传统的稳定细胞系生成技术如瞬时转染,虽然方法简便,但存在整合频率低、转基因沉默等问题。为了克服这些困难,研究者们开发出了一系列新技术,如细胞分选技术、位点特异性重组(如[/font][font=Calibri]FLP/FRT[/font][font=宋体]系统)、转座子系统(如[/font][font=Calibri]piggyBac[/font][font=宋体])、慢病毒系统以及噬菌体整合酶等,提高了稳定细胞系的生成效率和稳定性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]序列特异性基因组工程也为稳定细胞系的生成提供了新的思路。通过敲除或修饰特定的基因,研究者们能够实现对细胞功能的精准调控,从而优化蛋白质生产的效率和纯度。例如,一种同时缺乏[/font][font=Calibri]GnTI[/font][font=宋体]和谷氨酰胺合成酶([/font][font=Calibri]GS[/font][font=宋体])活性的[/font][font=Calibri]CHO[/font][font=宋体]细胞系被成功开发出来,为高效筛选具有[/font][font=Calibri]GS[/font][font=宋体]标记的稳定细胞系提供了有力工具。[/font][/font][font=Calibri] [/font][b][font=宋体]稳定细胞系与瞬时转染的比较[/font][/b][font=宋体]稳定细胞系相较于瞬时转染具有多个优点,包括能够进行大规模生产和保持高水平的蛋白表达稳定性。尽管瞬时转染在某些情况下能快速产生大量蛋白,但其表达水平和重复性通常不如稳定细胞系。[/font][font=Calibri] [/font][b][font=宋体]展望[/font][/b][font=宋体]近年来,利用稳定细胞系高效生产结构生物学蛋白质已成为研究的热点和趋势。通过引入新技术、优化筛选方法和改进整合系统,不仅能够提高蛋白质生产的效率和纯度,还能够为结构生物学研究提供更加精准、可靠的实验工具。随着基因编辑和细胞工程技术的进步,预计在未来,通过精确的基因操作能够更有效地创建和利用稳定细胞系。这些技术的进步将促进结构生物学和药物开发中蛋白质的高效和可持续生产。[/font][font=宋体] [/font][font=宋体]本文由义翘神州进行整理,同时提供[/font][url=https://cn.sinobiological.com/services/stable-cell-line-development-service][u][font=宋体][color=#0000ff]稳定细胞系构建服务[/color][/font][/u][/url][font=宋体],详情可点击了解![/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Büssow K. Stable mammalian producer cell lines for structural biology. [/font][i][font=Calibri]Curr Opin Struct Biol[/font][/i][font=Calibri]. 2015 32:81-90. doi:10.1016/j.sbi.2015.03.002[/font]
[font=宋体]慢病毒构建稳转细胞系的原理主要是利用慢病毒载体将外源基因导入宿主细胞,并实现外源基因的稳定表达。具体来说,构建稳转细胞系的核心是将慢病毒矢量载体导入宿主细胞中,慢病毒载体通常包含病毒的复制和包装组件,以及外源基因的表达调控序列。当慢病毒载体被导入宿主细胞后,它可以利用细胞的复制和转录机制将外源基因插入宿主细胞的染色体中,从而实现外源基因的稳定表达。[/font][font=宋体] [/font][font=宋体][b]构建稳定的慢病毒转染细胞系是在细胞中稳定表达外源基因的一种有效方法。下面是一般慢病毒构建稳定转染细胞系的步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、选择慢病毒载体: 选择适当的慢病毒载体,通常是一个包含[/font][font=Calibri]LTR[/font][font=宋体]、包装信号、引导[/font][font=Calibri]RNA[/font][font=宋体]序列和多功能质粒载体的质粒。这个载体应该包含要表达的外源基因。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、转染慢病毒包装细胞: 使用慢病毒包装细胞系,例如[/font][font=Calibri]293T[/font][font=宋体]或其他适合的细胞系。这些细胞通常被选择因为它们能够支持慢病毒复制和包装。将慢病毒载体与包装蛋白的表达质粒一同转染进这些细胞中。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、病毒产生和收集: 慢病毒包装细胞会开始产生慢病毒颗粒,这些颗粒包含了慢病毒载体和外源基因。培养一定时间后,收集细胞培养上清液,这是富含病毒的液体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、测定病毒滴度: 对采集的上清液进行病毒滴度的测定,通常可以通过转染一定数量的目标细胞,然后测定这些细胞的感染率来确定病毒的滴度。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5[/font][font=宋体]、转染目标细胞: 将上一步获得的病毒用于转染目标细胞。这些目标细胞可以是要建立稳定转染细胞系的细胞。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6[/font][font=宋体]、筛选稳定细胞系: 添加适当的筛选物质,例如抗生素,以选择表达了外源基因的细胞。这可以通过在培养基中添加抗生素,使得只有表达了外源基因的细胞能够存活下来。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7[/font][font=宋体]、单克隆分离: 对稳定表达细胞群进行单克隆分离,以确保每个克隆都来自单一细胞。这有助于保持表达的一致性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8[/font][font=宋体]、验证表达: 对所得的单克隆细胞系进行验证,确认外源基因的表达水平和稳定性。这可以通过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]、[/font][font=Calibri]Western blotting[/font][font=宋体]等分子生物学技术来实现。[/font][/font][font=宋体] [/font][font=宋体]通过这些步骤,可以建立一个稳定表达外源基因的慢病毒转染细胞系,为后续的实验和研究提供了有力的工具。这种方法常用于基因功能研究、药物筛选和基因治疗等领域。[/font][font=宋体] [/font][font=宋体][b]慢病毒构建稳转细胞系的优点:[/b][/font][font=宋体] [/font][font=宋体]与常用的转染方法相比,慢病毒构建稳转细胞系有以下几个优点:[/font][font=宋体] [/font][font=宋体]①高效性:慢病毒能够将外源基因整合到宿主细胞基因组中,实现稳定的外源基因表达。[/font][font=宋体] [/font][font=宋体]②特异性:由于慢病毒的感染和复制比较特异,只会影响一定类型的细胞,因此可以实现对具体细胞的选择性转染。[/font][font=宋体] [/font][font=宋体]③安全性:慢病毒的基因转移速度较缓慢,对宿主细胞和人体的损伤较小,因此具有较高的安全性。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳转细胞株构建服务[/b][/url],包含过表达细胞系构建服务和[/font][font=Calibri]CHO[/font][font=宋体]稳定细胞株开发服务,详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/stable-cell-line-development-service[/font][/font]

细胞系对外泌体的细胞内摄取,在37℃、5% CO2孵育6 h。合并图像为受体细胞摄取dii标记的外泌体(红色)。[img]https://ng1.17img.cn/bbsfiles/images/2023/11/202311222030103069_495_5389809_3.png[/img]
肝癌(hepatocellular carcinoma,HCC)是发病率高、治疗困难、死亡率高的恶性肿瘤,全球每年有1000000人死于肝癌。我国肝癌的死亡率在所有恶性肿瘤中居第二位,年死于肝癌的人数占全世界肝癌年死亡总数的53%。虽然肝癌的诊断和治疗有了长足的进步,但生存率在总体水平上变化不是很明显。迄今已建立的一系列人肝癌细胞系(cell line)和人肝癌细胞系的动物模型,为肝癌的发病机理和治疗研究奠定了良好的基础。咱们坛子里是否有做这方面工作的战友,分享一下相关文献。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=122088]人肝癌细胞系研究进展[/url]
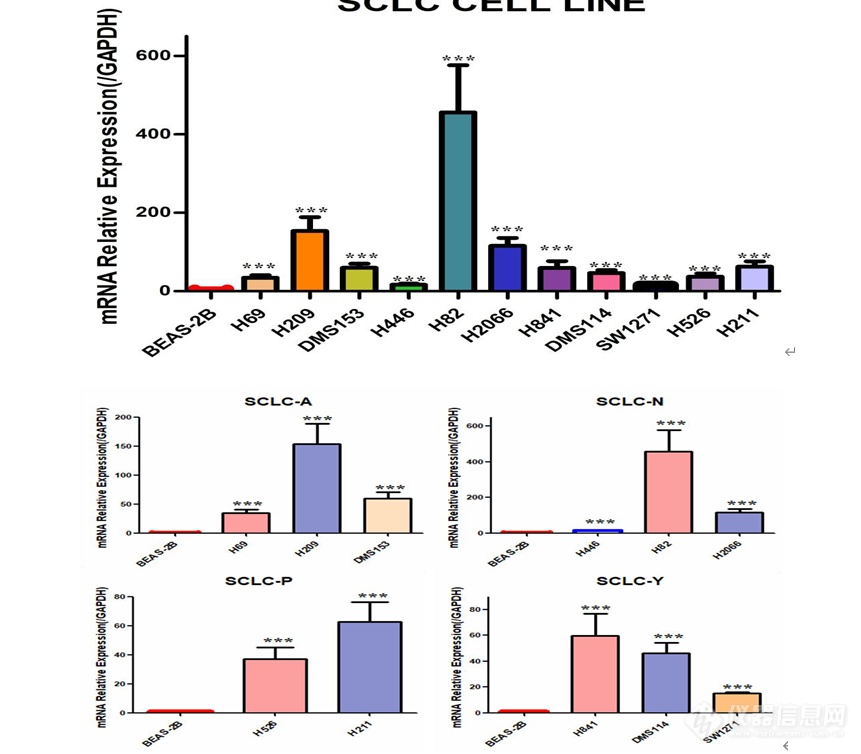
[font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]在人小细胞肺癌细胞系中的表达及[/color][color=#000007] [/color][font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]低表达[/color][color=#000000]细胞模型的构建[/color]MSI1 在人小细胞肺癌细胞系中高表达提取人正常肺上皮细胞 BEAS-2B,SCLC-A 型 H69、H209、DMS153 细胞,SCLC-N 型 H446、H82、H2066 细胞,SCLC-P 型 H526、H211 细胞,SCLC-Y 型 H841、DMS114、SW1271 细胞的 RNA,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 检测 MSI1 在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图 2-1 显示,MSI1 在小细胞肺癌细胞系中的表达远远高于正常肺上皮细胞,综合分析,选取了 H69、H82、H526 及 SW1271 细胞用于后续实验。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326443512_4838_5389809_3.png[/img]图 小细胞肺癌细胞系中 MSI1 mRNA 的表达(***P0.001)MSI1 低表达细胞模型的构建本实验选取人小细胞肺癌细胞系 H69、H82、H526、SW1271 细胞,使用慢病毒感染技术敲低 MSI1 的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选, 然后在荧光显微镜下观察如图 , 可见 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2细胞均产生绿色荧光,表明人小细胞肺癌细胞慢病毒感染成功。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326451025_2121_5389809_3.png[/img]图 慢病毒感染后 4X 荧光显微镜下图片(H69、H82、H526、SW1271 明场及荧光照片) 敲低 MSI1 后转录和蛋白水平验证分别提取对数生长期的 H69-NC 、H69-shMSI1-1 、H69-shMSI1-2 、H82-NC 、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 RNA 和蛋白,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 技术分别检测各细胞 MSI1 mRNA 相对表达量,结果如图 所示,与对照组相比,H69-shMSI1-1、 H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、SW1271-shMSI1-1、SW1271-shMSI1-2 组 MSI1 mRNA 表达量明显降低(P0.01), 抑制率约为 75%。利用 Western blot 技术检测各细胞内 MSI1 蛋白的表达情况。结果如图 2-3 所示,与对照组相比,MSI1 蛋白表达在 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞中明显降低。表明 MSI1 低表达细胞模型构建成功。[img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326454704_2148_5389809_3.png[/img]图 敲低 MSI1 在转录水平和蛋白水平的验证(***P0.001)
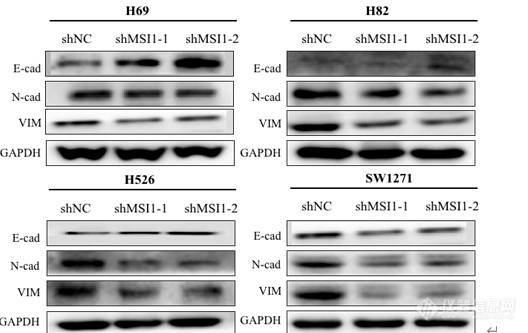
[align=center]敲低 MSI1 对 SCLC 细胞系抑制作用的机制研究[/align]敲低 MSI1 对 SCLC 细胞系 EMT 的影响提取对数生长期的 H69、H82、H526、SW1271 对照组及实验组细胞总蛋白,利用Western blot 检测E-cadherin、N-cadherin、Vimentin 的表达量。E-粘连蛋白(E-cadherin) 表达下调是 EMT 的一个主要标志,削弱了上皮细胞之间的强大粘附力,使细胞流动性增强。N-钙粘蛋白(N-cadherin)、波形蛋白(Vimentin)上调,导致肿瘤细胞骨架重排,促进肿瘤的转移。结果如图 显示,与对照组相比,实验组 E-cadherin 表达量增加,而 N-cadherin、Vimentin 表达量显著下降,证明 MSI1 低表达使小细胞肺癌细胞的 EMT 过程受到明显抑制。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232328545719_4765_5389809_3.png[/img]图 EMT 相关蛋白在 H69、H82、H526、SW1271 对照组与实验组的表达情况 敲低 MSI1 对 SCLC 细胞系周期的影响提取对数生长期的 H69、H82、H526、SW1271 对照组及实验组总蛋白,利用Western blot 检测敲低 MSI1 对 SCLC 细胞周期的影响。结果如图 4-2 显示,在细胞系 H69、H82 中,与对照组相比,实验组 Cyclin B1 表达上调,Cyclin A2 的表达下调,说明敲低 MSI1 后,细胞阻滞于 G2 /M 期。细胞系 H526 中,与对照组相比,实验组 Cyclin E1 表达上调,Cyclin A2 的表达下调,说明敲低 MSI1 后,细胞阻滞于 G1 /S 期。细胞系 SW1271 中,与对照组相比,实验组Cyclin D1 表达上调,Cyclin E1 表达下调,说明敲低 MSI1 后阻滞其于 G1 期。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232328548906_4460_5389809_3.png[/img]图 周期相关蛋白在 H69、H82、H526、SW1271 对照组与 MSI1 敲低组的表达情况 敲低 MSI1 对 SCLC 细胞系凋亡的影响提取对数生长期的 H69、H82、H526、SW1271 对照组及实验组细胞总蛋白,利用Western blot 检测敲低 MSI1 对 SCLC 细胞凋亡的影响,因此我们检测了 Caspase 信号通路相关蛋白 BCL-2,BAX,Cytochrome c,Caspase 3,cleaved Caspase 3,PARP, cleaved PARP。结果如图 4-3 所示,与对照组相比,实验组的抗凋亡蛋白 BCL-2 表达下调,促凋亡蛋白 BAX 显著上调, Cytochrome c,cleaved Caspase 3,cleaved PARP 显著上调,Caspase 3 的表达下调,PARP 无明显变化。这些结果表明,在 SCLC 细胞中, 敲低 MSI1 诱导 SCLC 细胞凋亡,且诱导凋亡的的机制可能是激活了 Caspase 凋亡途径。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232328545353_2689_5389809_3.png[/img]图 凋亡相关蛋白在 H69、H82、H526、SW1271 对照组与实验组的表达情况4 敲低 MSI1 对 SCLC 细胞系 Wnt 信号通路的影响MSI1 作为一种干细胞决定因素发挥作用,促进癌细胞存活、肿瘤进展,大量研究证实 MSI1 在肿瘤中发挥作用与 Wnt 信号通路密切相关,而 β-Catenin 是 Wnt 信号通路下游关键调控分子,细胞表面标记物 CD44、CD133 是肿瘤干细胞标志物,因此本研究检测在人 SCLC 细胞中 MSI1 敲低后 β-Catenin、CD44、CD133 的表达情况。结果如图所示,与对照组相比,实验组的 CD44、CD133、β-Catenin 的表达量明显下调,敲低 MSI1 后在一定程度上抑制了 Wnt 信号通路,表明 MSI1 在人小细胞肺癌细胞中通过激活 Wnt 通路发挥作用。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232328553033_2421_5389809_3.png[/img]图 Wnt 信号通路相关蛋白 H69、H82、H526、SW1271 对照组与实验组的表达情况
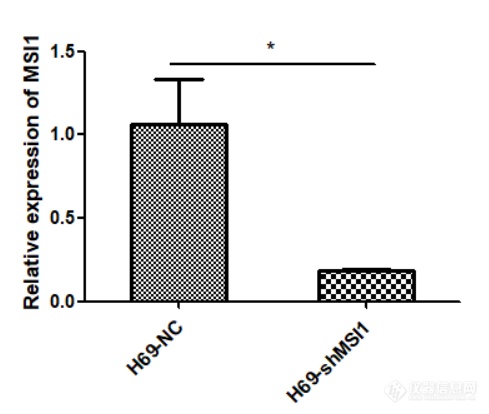
MSI1在人小细胞肺癌细胞系中的表达及MSI1低表达细胞模型的构建实验方法与步骤 细胞的复苏 1.复苏前的准备:打开水浴锅,设置温度37℃;紫外线将超净台消毒30 min;配置完全培养基。 2.将要复苏的H69、H446细胞从液氮取出,用一次性PE手套包裹冻存管,迅速放入水浴锅中震荡,使其快速融化。 3.在15 mL离心管中加入5 mL完全培养基及融化的细胞悬液,900 r/min离心8分钟,弃去上清,得到细胞沉淀。 4.在25 cm2的培养瓶中加入5 mL完全培养基,并用1 mL培养基将沉淀的细胞重悬并加入准备好的培养瓶中,放入CO2恒温培养箱中继续培养。 细胞的传代 1.选取在悬浮培养瓶中生长至90%的H69细胞,用移液枪将细胞悬液移入15 mL离心管中,选取在贴壁培养瓶中生长至90%的H446细胞,用PBS溶液将细胞吹至漂浮,并移入15 mL离心管中,两种细胞均900 r/min离心8分钟,弃掉上清。 2.分别在3个25 cm2培养瓶中加入5 mL完全培养基,在细胞沉淀中加入3 mL培养基并充分吹打混匀,将3 mL细胞悬液平均放入3个培养瓶中并混匀,放入培养箱中继续培养。 MSI1低表达细胞模型的构建1.从-80℃冰箱取出慢病毒载体冰上融化,将慢病毒用空白培养基稀释为滴度2×108,充分混匀,准备好病毒感染增强液。2.将25 cm2悬浮培养瓶中H69细胞移入15 mL离心管中并用移液枪充分吹打混匀,取其中500 μL放入细胞计数仪中计数,取出1.2×106个细胞置入新的离心管中,加入空白培养基至6 mL。3.在12孔板中以MOI=10的病毒滴度进行感染,培养16 h。4.16 h后将细胞悬液离心,换成不加双抗的完全培养基继续培养,72 h后观察荧光。5.待细胞生长至状态良好,加入1 μg/mL嘌呤霉素筛选至90%以上细胞均产生荧光。荧光实时定量PCR(Q-PCR)检测MSI1在mRNA水平的表达 总RNA的提取分别将细胞离心,PBS缓冲液清洗2次,900 r/min离心8 min,得到细胞沉淀。分别加入1 mL Trizol,用移液枪吸打至细胞完全破裂,加入200 μL氯仿,震荡30 s,室温静置10 min,以有效分离无机相和有机相,随后4℃,12,000 g/min离心15 min。将上清移至高压过的1.5 mL离心管中,加入与上清等体积的异丙醇,轻柔颠倒震荡数次,室温静置10 min,随后4℃,12,000 g/min离心10 min。弃去上清,加入75%无水乙醇,4℃,12,000 g/min离心5 min。弃去上清,沉淀置于冰上自然干燥,但不可完全干燥。用30 μL DEPC水溶解总RNA。用NanoDrop One超微量分光光度计进行定量和纯度检测,用1%琼脂糖凝胶电泳进行完整性检测。 cDNA的合成逆转录体系试剂名称使用量模板RNAMonScriptTM 5*RT111 All-in-One MixMonScriptTM dsDNaseNuclease-Free Water1 μg4 μL1 μLup to 20 μL将混合液轻柔吹打混匀,瞬时离心,37℃ 2 min,55℃ 15 min,85℃ 5 min,得到cDNA。 Q-PCR检测MSI1 mRNA的表达GAPDH引物序列:Forward primer:Reverse primer:5’-GGTCGGAGTCAACGGATTTG-3’5’-ATGAGCCCCAGCCTTCTCCAT-3’MSI1引物序列:Forward primer:Reverse primer:5’-GAACCATCCCGTCCTGTATCA-3’5’-GAAACCATGAAGCCCCAACC-3’Q- PCR反应体系:Q-PCR反应体系试剂名称使用量cDNAForward primerReverse primerMonAmpTM Chemhs qPCR MixLow ROXNuclease-Free Water50 ng0.2 μL0.2 μL5 μL0.1μLup to 10 μLQ-PCR反应程序: Q-PCR反应程序反应步骤反应温度反应时间循环次数预变性95℃10 min1变性95℃10 s40退火55-65℃10 s延伸72℃30 s溶解曲线溶解曲线按仪器默认溶解曲线 结果采用t检验,用Graphpad prism5计算MSI1在mRNA水平的表达量。 Western blot检测MSI1在蛋白水平的表达总蛋白的提取将对数生长期的H69-NC、H69-shMSI1细胞移入15 mL离心管中,900 r/min离心8 min,并用PBS溶液洗涤2次,以去除培养基中血清影响。分别加入含PMSF的蛋白裂解液100 μL,与细胞充分混匀。4℃裂解1小时后,4℃,12000 g/min离心15 min,将上清移至新的离心管中,得到细胞总蛋白。 BCA法测定蛋白浓度 将Solution A和Solution B以50:1的体积比配置BCA工作液,充分混匀。将2 mg/mL蛋白标准品等比稀释,最小浓度为125 μg/mL,并分别与配置好的200 μL BCA工作液混匀,铺入96孔板中。37℃孵育30 min,测定波长562 nm处OD(光密度值)值,并绘制蛋白标准曲线。取适量H69-NC、H69-shMSI1细胞总蛋白,20:1稀释后,与200 μL BCA工作液混合均匀。37℃孵育30 min,用酶标仪测定波长562 nm处OD值,根据标准曲线计算出样品中的蛋白浓度。Western blot检测MSI1蛋白的表达 分别收集对数生长期的H69-NC、H69-shMSI1细胞总蛋白,加入相应体积4×SDS Loading Buffer,沸水浴煮5 min,分别取40 μg细胞总蛋白,在提前配制的10% SDS-PAGE分离胶电泳。电泳结束后,将蛋白转至PVDF膜上。用含5%脱脂牛奶的封闭液 37℃封闭1.5 h。弃去封闭液,用TBST缓冲液洗3次,每次10 min,加入MSI1兔单克隆抗体(1:1000),并以GAPDH为内参,加入GAPDH鼠单克隆抗体(1:5000);4℃孵育过夜,次日用TBST缓冲液洗膜3次,每次10 min。在敷有MSI1抗体的膜上加入辣根酶标记山羊抗兔IgG(1:5000),在敷有GAPDH抗体的膜上加入辣根酶标记山羊抗鼠IgG(1:5000),37℃敷育1 h,TBST 缓冲液洗膜3次,每次10 min。用增敏化学发光底物试剂检测,暗室曝光显影。在GAPDH表达量相同的情况下比较MSI1的表达情况。多次重复,应用ImageJ计算出各个蛋白条带的灰度对比,结果采用t检验,并应用Graphpad prism5作出柱状图。 MSI1在人小细胞肺癌细胞系中高表达 提取人正常肺上皮细胞BEAS-2B、小细胞肺癌细胞H446、H69的RNA,利用Q-PCR检测MSI1在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图2-1显示,MSI1在小细胞肺癌细胞系H446、H69中的表达远远高于正常肺上皮细胞。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428158_6718_5389809_3.png1 MSI1 mRNA在小细胞肺癌细胞系中的表达(**代表与正常肺上皮细胞相比,小细胞肺癌细胞MSI1表达量增高具有统计学意义,P0.01)。 MSI1低表达细胞模型的构建本实验选取人小细胞肺癌细胞系H69细胞,使用慢病毒感染技术敲低MSI1的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选,然后在荧光显微镜下观察如图2-2,可见H69-NC、H69-shMSI1细胞均产生绿色荧光,表明人小细胞肺癌H69细胞慢病毒感染成功。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428036_9359_5389809_3.png MSI1低表达细胞模型的构建。应用shMSI1慢病毒载体感染H69细胞,利用嘌呤霉素筛选,并在荧光显微镜下观察。 荧光实时定量PCR(Q-PCR)检测MSI1的mRNA表达水平提取对数生长期的H69-NC、H69-shMSI1细胞的RNA,并测量RNA浓度及完整性,用1%琼脂糖凝胶电泳检测完整性可见,RNA有三条带,从上到下依次为28S rRNA、18S rRNA和5S rRNA,且28S rRNA的亮度是18S rRNA的两倍。用NanoDrop One超微量分光光度计测定人总RNA的A260/A280的值为2.00左右,A260/A230的值为2.30左右,说明提取的RNA质量和完整性很好,可以用于后续试验。利用Q-PCR技术检测各细胞内MSI1 mRNA相对表达量,结果如图2-3所示,与对照组相比,H69-shMSI1组MSI1 mRNA表达量明显降低(P0.01),抑制率约为75%。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434330_8277_5389809_3.png MSI1在RNA水平的表达(***代表与对照组相比,H69-shMSI1组MSI1 mRNA表达量下降具有统计学意义,P0.001)。 Western blot检测MSI1蛋白表达水平将BSA标准品(2 mg/mL)进行等比稀释,最低浓度为125 ug/mL,并应用BCA蛋白质浓度测定试剂盒测定在波长562 nm下的OD值,以OD值为纵坐标,对应蛋白质浓度(μg/mL)为横坐标,绘制标准蛋白曲线如图2-4所示。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201435248_4142_5389809_3.png图2-4 标准蛋白曲线分别提取H69-NC、H69-shMSI1细胞的总蛋白质,利用Western blot技术检测各细胞内MSI1蛋白的表达情况。结果如图2-5所示,与对照组相比,MSI1蛋白表达在H69-shMSI1细胞中明显降低。表明MSI1低表达细胞模型构建成功。ahttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201437240_855_5389809_3.pngbhttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434999_3303_5389809_3.png图2-5 MSI1蛋白水平表达:(a)MSI1蛋白表达条带;(b)MSI1蛋白的相对表达量。(*表示与对照组相比,H69-shMSI1组MSI1蛋白表达下降具有统计学意义,P0.05)。首先验证MSI1在小细胞肺癌细胞系中的表达情况,利用Q-PCR技术检测在RNA水平,MSI1在肺正常上皮细胞及小细胞肺癌细胞系中的表达,结果显示,MSI1在小细胞肺癌细胞中的表达明显高于正常肺上皮细胞。随后以人经典型小细胞肺癌细胞系H69细胞为研究对象,构建MSI1低表达细胞模型,应用shMSI1慢病毒载体感染H69亲本细胞,同时设置对照组除外病毒本身对细胞产生的影响,利用Q-PCR及Western blot验证MSI1在RNA及蛋白水平的表达,结果显示,H69-shMSI1组MSI1的mRNA及蛋白的表达明显降低。表明MSI1低表达细胞模型构建成功,可以用于后续实验。
[align=left][size=18px]西达本胺促进[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系组蛋白乙酰化[/size][/align][align=left][size=18px] [/size][size=18px] [/size][size=16px]为验证西达本胺是否上调[/size][size=16px]SCLC[/size][size=16px]细胞系的乙酰化水平,我们使用[/size][size=16px]Western blot[/size][size=16px]检测了不同浓度([/size][size=16px]I[/size][size=16px]C10[/size][size=16px]、[/size][size=16px]IC20[/size][size=16px]、[/size][size=16px]IC50[/size][size=16px])西达本胺处理[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系中乙酰化组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平,并以组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平为对照。结果如图所示。在四种亚型细胞系中,总组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达水平无变化,乙酰化组蛋白[/size][size=16px]H[/size][size=16px]3[/size][size=16px]、[/size][size=16px]H[/size][size=16px]4[/size][size=16px]表达量随加药浓度增大而增多,这证明了西达本胺对[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系组蛋白乙酰化的促进作用,这种作用呈剂量依赖性。[/size][/align][align=left][size=18px]A[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350400898_8640_5887180_3.png[/img][/align][align=left][/align][align=left][/align][align=left][/align][align=center][/align][align=left][size=18px] [/size][size=18px]西达本胺通过线粒体凋亡途径诱导[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系凋亡[/size][/align][align=left][size=16px]我们的功能实验表明,西达本胺[/size][size=16px]可剂量依赖的[/size][size=16px]促进[/size][size=16px]SCLC[/size][size=16px]细胞[/size][size=16px]系[/size][size=16px]凋亡[/size][size=16px],但其机制尚未明确。[/size][size=16px]依据国内外报道,西达本胺主要通过线粒体凋亡途径诱导细胞凋亡[/size][size=16px]。除此之外,[/size][size=16px]西达本胺[/size][size=16px]能[/size][size=16px]使[/size][size=16px]线粒体[/size][size=16px]DNA[/size][size=16px]双链断裂,发生损伤。[/size][size=16px]为探究其是否通过此途径在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系中发挥作用,我们检测了加药[/size][size=16px]4[/size][size=16px]8[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H[/size][size=16px]446[/size][size=16px]、[/size][size=16px]H[/size][size=16px]526[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]细胞中由线粒体介导的[/size][size=16px]C[/size][size=16px]aspase[/size][size=16px]信号通路相关蛋白[/size][size=16px]Bcl-2[/size][size=16px],[/size][size=16px]Bax[/size][size=16px],细胞色素[/size][size=16px]C[/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 9[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved Caspase 9[/size][size=16px],[/size][size=16px]P[/size][size=16px]ARP[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved [/size][size=16px]PARP[/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 3[/size][size=16px],[/size][size=16px]c[/size][size=16px]leaved Caspase 3[/size][size=16px]以及[/size][size=16px]D[/size][size=16px]NA[/size][size=16px]双链断裂标志物[/size][size=16px] [/size][size=16px]γH2AX[/size][size=16px]表达水平。[/size][size=16px]Western blot[/size][size=16px]结果显示,[/size][size=16px]Ca[/size][size=16px]spase 9[/size][size=16px],[/size][size=16px]P[/size][size=16px]ARP[/size][size=16px] [/size][size=16px],[/size][size=16px]Ca[/size][size=16px]spase 3[/size][size=16px]表达水平无明显变化,[/size][size=16px]Bcl-2[/size][size=16px]表达下调,其余蛋白表达均上调。这些结果表明,在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞中,西达本胺可以通过线粒体凋亡途径诱导细胞凋亡。[/size][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][/align][align=left][size=16px]A[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350402755_79_5887180_3.png[/img][/align][align=left][size=18px] [/size][size=18px]西达本胺通过抑制[/size][size=18px]C[/size][size=18px]yclin-CDK[/size][size=18px]复合物活性阻滞[/size][size=18px]S[/size][size=18px]CLC[/size][size=18px]细胞系周期[/size][/align][align=left][font='宋体'][size=16px]据文献报道,[/size][/font][size=16px]不同[/size][size=16px]HDACI[/size][size=16px]对不同细胞阻滞时相不一致。为验证西达本胺对[/size][size=16px]SCLC[/size][size=16px]细胞周期的作用,我们检测了[/size][size=16px]经[/size][size=16px]西达本胺[/size][size=16px]处理[/size][size=16px]48[/size][size=16px] [/size][size=16px]h[/size][size=16px]后,[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H446[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]DMS114[/size][size=16px]细胞中细胞周期相关蛋白的表达水平,如图所示。[/size][size=16px]在[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞系中[/size][size=16px]P21[/size][size=16px]、[/size][size=16px]P27[/size][size=16px]表达上调,[/size][size=16px]C[/size][size=16px]yclin A2[/size][size=16px]与[/size][size=16px]C[/size][size=16px]DK[/size][size=16px]2[/size][size=16px]表达下调[/size][size=16px],[/size][size=16px]说明西达本胺阻滞[/size][size=16px]H69[/size][size=16px]、[/size][size=16px]H526[/size][size=16px]、[/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]于[/size][size=16px]S[/size][size=16px]期。在[/size][size=16px]H446[/size][size=16px]细胞系中[/size][size=16px]C[/size][size=16px]yclin E1[/size][size=16px]与[/size][size=16px]C[/size][size=16px]DK2[/size][size=16px]表达下调[/size][size=16px],说明西达本胺阻滞其于[/size][size=16px]G[/size][size=16px]1[/size][size=16px]/S[/size][size=16px]期。[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350422585_1956_5887180_3.png[/img][size=16px] [/size][img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211302350405804_8826_5887180_3.png[/img][/align][align=left][size=18px]小结[/size][/align][size=16px]1[/size][size=16px].[/size][size=16px]西达本胺可以增强[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系组蛋白乙酰化水平。[/size][size=16px]2.[/size][size=16px]西达本胺诱导[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞凋亡的机制可能与其激活线粒体介导的[/size][size=16px]caspase[/size][size=16px]凋亡途径有关。[/size][size=16px]3[/size][size=16px].[/size][size=16px]西达本胺可阻滞[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞周期,可能与其上调细胞周期蛋白激酶抑制剂表达、从而抑制[/size][size=16px]C[/size][size=16px]yclin-CDK[/size][size=16px]复合物活性有关。[/size]
[size=16px]西达本胺对[/size][size=16px]SCLC[/size][size=16px]细胞系在体外水平的作用及机制[/size][size=16px]西达本[/size][size=16px]胺属于苯[/size][size=16px]酰胺类化合物,是我国自主研发的首个亚型选择性口服[/size][size=16px]HDAC[/size][size=16px]I[/size][size=16px],国家食品药品监督管理局已批准其用于临床试验[/size][font='times new roman'][size=16px],[/size][/font][size=16px]其选择性抑制[/size][size=16px]I[/size][size=16px]类[/size][size=16px]H[/size][size=16px]DAC1[/size][size=16px]、[/size][size=16px]2[/size][size=16px]、[/size][size=16px]3[/size][size=16px]亚型和[/size][size=16px]I[/size][size=16px]I[/size][size=16px]类[/size][size=16px]H[/size][size=16px]DAC10[/size][size=16px]亚型,可抑制肿瘤细胞增殖、促进凋亡,阻滞周期、引发[/size][size=16px]DNA[/size][size=16px]损伤,还可以增强抗肿瘤免疫反应。与其他抗肿瘤药物相比,西达本胺疗效好、选择性高、不良反应少。[/size][size=16px]西达本胺可激活死亡受体途径和线粒体凋亡途径诱导细胞凋亡,其中最为主要的是线粒体凋亡途径,[/size][size=16px]该途径[/size][size=16px]受[/size][size=16px]B[/size][size=16px]cl-2[/size][size=16px]家族[/size][size=16px]介[/size][size=16px]导的细胞色素[/size][size=16px]C[/size][size=16px]释放通路调控。抗凋亡蛋白[/size][size=16px]B[/size][size=16px]cl-2[/size][size=16px]表达受到抑制,促凋亡蛋白[/size][size=16px]Bax[/size][size=16px]表达上调,使线粒体膜电位降低,细胞色素[/size][size=16px]C[/size][size=16px]释放到细胞质中,[/size][size=16px]C[/size][size=16px]aspase[/size][size=16px]途径被激活,细胞发生凋亡。例如:西达本[/size][size=16px]胺增强[/size][size=16px]B[/size][size=16px]淋巴瘤细胞组蛋白[/size][size=16px]H3[/size][size=16px]、[/size][size=16px]H4 [/size][size=16px]乙酰化水平,使线粒体膜电位降低随后激活[/size][size=16px]C[/size][size=16px]aspase[/size][size=16px] [/size][size=16px]3[/size][size=16px],促进细胞凋亡;在肾癌中,它可以[/size][size=16px]下调[/size][size=16px]Bcl-2[/size][size=16px]表达,上调[/size][size=16px]Bax[/size][size=16px]表达[/size][size=16px],随着药物浓度增加引起[/size][size=16px]786-O [/size][size=16px]细胞凋亡[/size][size=16px]。[/size][size=16px]西达本[/size][size=16px]胺可以[/size][size=16px]调控[/size][size=16px]R[/size][size=16px]OS[/size][size=16px]水平。[/size][size=16px]H[/size][size=16px]DACI[/size][size=16px]可以上调[/size][size=16px]R[/size][size=16px]OS[/size][size=16px]水平,导致[/size][size=16px]D[/size][size=16px]NA[/size][size=16px]双链损伤。研究证明,西达本[/size][size=16px]胺作用[/size][size=16px]于白血病细胞后,诱导细胞内[/size][size=16px]R[/size][size=16px]OS[/size][size=16px]产生,细胞凋亡增加。此外,在胰腺癌细胞系中,西达本[/size][size=16px]胺明显[/size][size=16px]增强细胞内[/size][size=16px]ROS[/size][size=16px]的产生,上调γ[/size][size=16px]H2AX[/size][size=16px]([/size][size=16px]D[/size][size=16px]NA[/size][size=16px]双链断裂的标志物)表达水平,诱发细胞[/size][size=16px]DNA[/size][size=16px]损伤[/size][font='times new roman'][size=16px][[/size][/font][font='times new roman'][size=16px]18][/size][/font][size=16px]。[/size][size=16px]西达本[/size][size=16px]胺通过[/size][size=16px]调控细胞周期蛋白([/size][size=16px]Cyclin[/size][size=16px])、细胞周期蛋白依赖性激酶([/size][size=16px]Cyclin-dependent kinases[/size][size=16px],[/size][size=16px]CDKs[/size][size=16px])以及细胞周期蛋白依赖性激酶抑制剂([/size][size=16px]Cyclin-dependent kinases inhibition[/size][size=16px],[/size][size=16px]CDKI[/size][size=16px])的表达阻滞细胞周期。例如,西达[/size][size=16px]本胺使[/size][size=16px]MM[/size][size=16px]细胞系[/size][size=16px]P21[/size][size=16px]、[/size][size=16px]P27[/size][size=16px]的表达量增高,[/size][size=16px]C[/size][size=16px]DK4[/size][size=16px]、[/size][size=16px]C[/size][size=16px]DK6[/size][size=16px]、[/size][size=16px]Cyclin D2[/size][size=16px]表达[/size][size=16px]量下降,阻滞[/size][size=16px]M[/size][size=16px]M[/size][size=16px]细胞系于[/size][size=16px]G[/size][size=16px]1[/size][size=16px]期。在[/size][size=16px]N[/size][size=16px]K/T[/size][size=16px]细胞淋巴瘤中,西达本胺上调[/size][size=16px]P21[/size][size=16px]表达,下调[/size][size=16px]Cyclin E[/size][size=16px]表达,诱[/size][size=16px]导细胞发生[/size][size=16px]G0/G1[/size][size=16px]期阻滞,从而抑制细胞的增殖[/size][size=16px]。[/size][size=16px]目前为止,关于西达[/size][size=16px]本胺在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]中的研究并不多,为探究西达本胺对[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞系[/size][size=16px]的作用及机制,探究[/size][size=16px]西达本胺对[/size][size=16px]SCLC[/size][size=16px]细胞系在体外水平的作用及机制[/size][size=16px],发掘西达[/size][size=16px]本胺在[/size][size=16px]SCLC[/size][size=16px]治疗中的潜力,为[/size][size=16px]SCLC[/size][size=16px]靶[/size][size=16px]向治疗[/size][size=16px]提供新的思路[/size][size=16px]仍有重要意义[/size][size=16px]。[/size]
美国典型物保藏中心,又称美国模式典型物收集中心(ATCC),ATCC是位于马里兰洲洛克菲勒的一家私营的,非赢利性组织。目前它可以提供以下物品:细胞系(3000种);细菌和噬菌体(15000种);动植物病毒(2500种);原生动物 1200种以及重组物品等。北京时代新光TEl: 010-87875910 010-87875015 13371681771 E-mail: zfyu@ bio-life.cnweb: www.bio-life.cn
细胞培养是细胞和分子生物学中最重要的一项技术。广泛应用于现代医学、农业科学、生物科学、材料科学和环境科学等领域,培养的细胞为上述领域提供研究的模型和实验材料。目前细胞间可以供从事蛋白质表达工作的昆虫细胞培养实验及如HEK293T细胞系,Hela细胞系,CHO细胞系等常用细胞系的培养、传代及其他分子实验的操作条件。
7月6日,Cell Stem Cell杂志报道,来源于男性和女性的人类诱导多能干细胞,在表观遗传稳定性和癌基因的表达方面均有较大的差异。 虽然人类诱导多能干细胞(hiPSCs)在再生医学中具有巨大潜力,他们的表观遗传变异性表明,有些hiPSCs细胞系可能不适合人类治疗。目前对hiPSCs进行质量评估的基准很有限。 本研究表明,X染色体失活标记可以用来将表观遗传学上独特的hiPSCs和表型上独特的hiPSCs区分开来。XIST(X-inactive specific transcript)是一个X染色体上的胎盘哺乳动物的X染色体失活过程中发挥主要效应的RNA基因。Xist表达的缺失与X-连锁癌基因的表达上调、细胞在体外加速增长,在体内较差的分化密切相关。 在X染色体失活潜力的差异可导致女性hiPSC细胞系在表观遗传学上的差异,而男性hiPSC细胞系一般彼此相似,并且不过度表达癌基因。 生理水平的氧气含量和组蛋白去乙酰化酶(HDAC)抑制剂均不能促进女性hiPSC细胞系的培养。 在X染色体失活潜力的差异可导致女性hiPSC细胞系在表观遗传学上的差异,而男性hiPSC细胞系一般彼此相似,并且不过度表达癌基因。推荐关注:磷酸化特异性ELISA试剂盒 反义寡核苷酸类 生理水平的氧气含量和组蛋白去乙酰化酶(HDAC)抑制剂均不能促进女性hiPSC细胞系的培养。 据此,研究者得出这样的结论:在培养条件下,女性hiPSCs的表观遗传稳定性比男性的较差;Xist的丢失可能导致质量不理想的干细胞系。
日本理化学研究所(REKIN)的小保方晴子等人 2014 年年初在《自然》上发表了两篇干细胞研究领域的重磅论文,但很快被质疑其研究存在学术不端。日本理化学研究所和《自然》(Nature)随后分别展开调查。日本理化学研究所在 4 月 1 日认定小保方晴子篡改及捏造实验数据。但目前对于该研究的争议还有一个关键性的问题尚未解决:小保方晴子等人在研究中观察到的现象究竟存在吗?或者说 STAP 真的存在吗?日本媒体 6 月 3 日发表的报道称,在对 STAP 实验中用到的细胞进行了基因检测后,结果显示,不存在。根据小保方晴子等人的研究结果,对体细胞进行简单的酸浴刺激,或者施加物理应激,就可以得到 STAP 细胞。这些细胞具有和胚胎干细胞相同的特性。对这些细胞进行进一步操作后,它们也可以形成可自我更新的干细胞系,这就是 STAP 干细胞,它们具有和胚胎干细胞系几乎相同的特性。之前《自然》上发表的论文中报告称,小保方晴子所在的实验室共创建了 8 个 STAP 干细胞系。今年3月,论文合作者之一、山梨大学的若山照彦曾要求文章的第一作者向其提供用某一品系的小鼠细胞制备的 STAP 细胞,但当若山照彦对细胞进行了简单的遗传分析后发现,文章的第一作者小保方晴子给他的干细胞,是由其他品系的小鼠细胞制备的。这表明这些细胞可能受到了污染。但是若山照彦并没有发现《自然》发表的论文中提到的 STAP 干细胞系存在问题。为了验证他的结论,若山照彦将 20 个干细胞系(包括论文中提到的 8 个),寄送给了一家匿名的独立遗传分析小组进行检测。根据日媒援引多方信源的报道,这次检测的结果已经送回理研。检测结果显示,所有 STAP 干细胞系都与论文声称的小鼠品系不符,这一结果对 STAP 现象是否存在提出了质疑。若山照彦表示,他将尽快召开媒体发布会公布相关检测细节。另据报道,日本理化所将有可能支持小保方晴子继续研究工作,设法重演STAP结果。
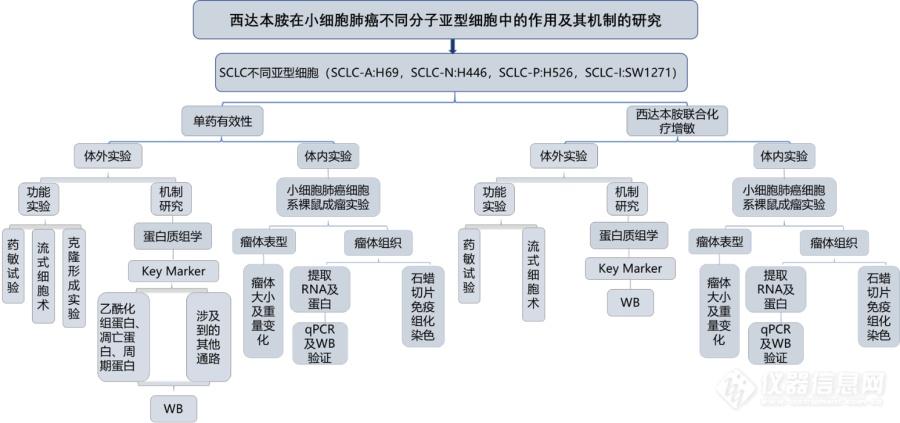
[align=center][size=16px][color=#000000][back=#ffffff]西达[/back][/color][/size][size=16px][color=#000000][back=#ffffff]本胺在不同[/back][/color][/size][size=16px][color=#000000][back=#ffffff]亚型[/back][/color][/size][size=16px][color=#000000][back=#ffffff]SCLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]细胞系中的作用及机制[/back][/color][/size][size=16px][color=#000000][back=#ffffff]探究方案[/back][/color][/size][/align][size=16px][color=#000000][back=#ffffff]组蛋白乙酰化是一种普遍存在的表观遗传修饰,可通过调节组蛋白尾部乙酰化赖氨酸的存在,参与基因转录过程,进而调节抑癌基因表达,重塑染色质,改变细胞表型,促进癌症的发展。而组蛋白去乙酰化酶抑制剂是一类重要的抗肿瘤药物,临床前数据显示[/back][/color][/size][size=16px][color=#000000][back=#ffffff]SCLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]细胞系对新型[/back][/color][/size][size=16px][color=#000000][back=#ffffff]组蛋白去乙酰基[/back][/color][/size][size=16px][color=#000000][back=#ffffff]酶抑制[/back][/color][/size][size=16px][color=#000000][back=#ffffff]剂帕比司他[/back][/color][/size][size=16px][color=#000000][back=#ffffff]([/back][/color][/size][size=16px][color=#000000][back=#ffffff]LBH589[/back][/color][/size][size=16px][color=#000000][back=#ffffff])高度敏感,在转基因小鼠实验中,在可耐受的剂量下,肿瘤几乎完全消退[/back][/color][/size][font='times new roman'][sup][size=16px][color=#000000][[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]11[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]][/color][/size][/sup][/font][size=16px][color=#000000][back=#ffffff]。西达本胺([/back][/color][/size][size=16px][color=#000000][back=#ffffff]Chidamide[/back][/color][/size][size=16px][color=#000000][back=#ffffff])是我国首创的新药,是一种口服的选择性组蛋白去乙酰化酶抑制剂,通过选择性抑制[/back][/color][/size][size=16px][color=#000000][back=#ffffff]HDAC1[/back][/color][/size][size=16px][color=#000000][back=#ffffff]、[/back][/color][/size][size=16px][color=#000000][back=#ffffff]HDAC2[/back][/color][/size][size=16px][color=#000000][back=#ffffff]、[/back][/color][/size][size=16px][color=#000000][back=#ffffff]HDAC3[/back][/color][/size][size=16px][color=#000000][back=#ffffff]和[/back][/color][/size][size=16px][color=#000000][back=#ffffff]HDAC10[/back][/color][/size][font='times new roman'][sup][size=16px][color=#000000][1[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]3[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]][/color][/size][/sup][/font][size=16px][color=#000000][back=#ffffff],提高染色体上的组蛋白的乙酰化水平,有利于[/back][/color][/size][size=16px][color=#000000][back=#ffffff]DNA[/back][/color][/size][size=16px][color=#000000][back=#ffffff]和组蛋白八聚体的解离,核小体结构变得松弛,使得原本无法和启动子接触的区域成为新的转录靶点,各种转录因子与[/back][/color][/size][size=16px][color=#000000][back=#ffffff]DNA[/back][/color][/size][size=16px][color=#000000][back=#ffffff]结合,激活转录过程[/back][/color][/size][font='times new roman'][sup][size=16px][color=#000000][1[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]4[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]][/color][/size][/sup][/font][size=16px][color=#000000][back=#ffffff],从而诱导肿瘤细胞凋亡、分化、周期阻滞、新血管生成、肿瘤免疫微环境及调控[/back][/color][/size][size=16px][color=#000000][back=#ffffff]ROS[/back][/color][/size][size=16px][color=#000000][back=#ffffff]水平发挥抗肿瘤作用[/back][/color][/size][font='times new roman'][sup][size=16px][color=#000000][1[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]5[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]][/color][/size][/sup][/font][size=16px][color=#000000][back=#ffffff]。目前已获[/back][/color][/size][size=16px][color=#000000][back=#ffffff]批用于[/back][/color][/size][size=16px][color=#000000][back=#ffffff]治疗复发及难治性外周[/back][/color][/size][size=16px][color=#000000][back=#ffffff]T[/back][/color][/size][size=16px][color=#000000][back=#ffffff]细胞淋巴瘤及激素受体阳性、人表皮生长因子受体[/back][/color][/size][size=16px][color=#000000][back=#ffffff]-2[/back][/color][/size][size=16px][color=#000000][back=#ffffff]阴性、绝经后、经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者等多个癌种[/back][/color][/size][font='times new roman'][sup][size=16px][color=#000000][[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]16-18[/color][/size][/sup][/font][font='times new roman'][sup][size=16px][color=#000000]][/color][/size][/sup][/font][size=16px][color=#000000][back=#ffffff],但其在[/back][/color][/size][size=16px][color=#000000][back=#ffffff]SCLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]患者中的疗效尚无定论[/back][/color][/size][size=16px][color=#ed7d31][back=#ffffff]。[/back][/color][/size][size=16px][color=#000000][back=#ffffff]为了探究西达[/back][/color][/size][size=16px][color=#000000][back=#ffffff]本胺在不同[/back][/color][/size][size=16px][color=#000000][back=#ffffff]亚型[/back][/color][/size][size=16px][color=#000000][back=#ffffff]S[/back][/color][/size][size=16px][color=#000000][back=#ffffff]CLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]细胞系中的作用及机制,我们设计了本课题,使用四种不同亚型[/back][/color][/size][size=16px][color=#000000][back=#ffffff]SCLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]分别通过体内、体外实验和机制探索评价西达本胺的抗肿瘤活性,并探索西达[/back][/color][/size][size=16px][color=#000000][back=#ffffff]本胺在这[/back][/color][/size][size=16px][color=#000000][back=#ffffff]四种[/back][/color][/size][size=16px][color=#000000][back=#ffffff]S[/back][/color][/size][size=16px][color=#000000][back=#ffffff]CLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]亚型细胞中的作用差异,为探索新的[/back][/color][/size][size=16px][color=#000000][back=#ffffff]S[/back][/color][/size][size=16px][color=#000000][back=#ffffff]CLC[/back][/color][/size][size=16px][color=#000000][back=#ffffff]治疗思路提供理论依据。[/back][/color][/size][align=left][/align][align=left][size=18px]1[/size][size=18px]、主要研究内容[/size][/align][font='times new roman']1) [/font][font='times new roman'][size=16px]西达[/size][/font][font='times new roman'][size=16px]本胺单药[/size][/font][font='times new roman'][size=16px]在[/size][/font][font='times new roman'][size=16px]SCLC[/size][/font][font='times new roman'][size=16px]不同亚型细胞([/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-A:H69[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-N:H446[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-P:H526[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-I:SW1271[/size][/font][font='times new roman'][size=16px])中的抗肿瘤活性,分为体内和体外实验,体内实[/size][/font][font='times new roman'][size=16px]验需完成[/size][/font][font='times new roman'][size=16px]SW1271[/size][/font][font='times new roman'][size=16px]的荷瘤鼠模型,检测西达本胺对其肿瘤抑制作用。[/size][/font][font='times new roman']2) [/font][font='times new roman'][size=16px]蛋白质组学分析西达本[/size][/font][font='times new roman'][size=16px]胺单药处理[/size][/font][font='times new roman'][size=16px]后不同亚型[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-A:H69[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-N:H446[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-P:H526[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-I:SW1271[/size][/font][font='times new roman'][size=16px]的差异蛋白变化,探索其诱导凋亡的机制同时比较各个[/size][/font][font='times new roman'][size=16px]亚型间的[/size][/font][font='times new roman'][size=16px]差异。[/size][/font][font='times new roman']3) [/font][font='times new roman'][size=16px]在[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-A:H69[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-N:H446[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-P:H526[/size][/font][font='times new roman'][size=16px],[/size][/font][font='times new roman'][size=16px]S[/size][/font][font='times new roman'][size=16px]CLC-I:SW1271[/size][/font][font='times new roman'][size=16px]细胞中通过[/size][/font][font='times new roman'][size=16px]C[/size][/font][font='times new roman'][size=16px]CK8[/size][/font][font='times new roman'][size=16px]实验验证西达本[/size][/font][font='times new roman'][size=16px]胺联合[/size][/font][font='times new roman'][size=16px]化疗是否可以起到增敏的作用,同时比较分析不同[/size][/font][font='times new roman'][size=16px]亚型间的[/size][/font][font='times new roman'][size=16px]增敏差异,并探究其机制。[/size][/font][font='times new roman']4) [/font][font='times new roman'][size=16px]发起一项西达[/size][/font][font='times new roman'][size=16px]本胺多中心[/size][/font][font='times new roman'][size=16px]临床研究[/size][/font][align=left][size=18px]2[/size][size=18px]、技术路线[/size][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310242318231330_5518_6216056_3.png[/img][/align][align=left][/align][align=left][size=18px]3[/size][size=18px]、创新点[/size][/align][align=left][size=16px]1[/size][size=16px])[/size][size=16px] [/size][size=16px]首次在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]不同亚型细胞中探索西达本胺的抗肿瘤活性及其不同的分子机制。[/size][/align][align=left][size=16px]2[/size][size=16px])[/size][size=16px] [/size][size=16px]探索西大本[/size][size=16px]胺[/size][size=16px]联合化疗[/size][size=16px]是否能在[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]不同亚型细胞中起到[/size][size=16px]增敏[/size][size=16px]效果,并[/size][size=16px]研究其机制,这一研究不仅具有首创性同时也有巨大的临床转化意义。[/size][/align][align=left][font='宋体'][size=16px]小细胞肺癌是肺癌[/size][/font][font='宋体'][size=16px]中[/size][/font][font='宋体'][size=16px]一种具有高度侵袭性的神经内分泌肿瘤亚型,由于其生长和进展迅速,经组织病理学检查确诊时常为晚期,预[/size][/font][font='宋体'][size=16px]后[/size][/font][font='宋体'][size=16px]较差[/size][/font][font='宋体'][size=16px]。[/size][/font][font='宋体'][size=16px]我们的研究以小细胞肺癌最新分子分型为框架和基础分析西达本胺的抗肿瘤活性,有利于我们从多个维度研究其不同分型的临床病理特点和药物治疗疗效差异[/size][/font][font='宋体'][size=16px],[/size][/font][font='宋体'][size=16px]从而为实现小细胞肺癌的分层治疗奠定基础[/size][/font][font='宋体'][size=16px];[/size][/font][/align][align=left][font='宋体'][size=16px]2[/size][/font][font='宋体'][size=16px]、[/size][/font][font='等线'][size=16px][color=#000000]探索西达本胺[/color][/size][/font][font='等线'][size=16px][color=#000000]联合化疗是否起到增敏[/color][/size][/font][font='等线'][size=16px][color=#000000]作用,将有可能进一步改善小细胞肺癌临床治疗结果[/color][/size][/font][font='等线'][size=16px][color=#000000],[/color][/size][/font][font='等线'][size=16px][color=#000000]为患者提供一种新的治疗方法[/color][/size][/font][font='等线'][size=16px][color=#000000],[/color][/size][/font][font='等线'][size=16px][color=#000000]带来巨大的社会效益[/color][/size][/font][font='等线'][size=16px][color=#000000];[/color][/size][/font][/align]
十二. 流式细胞术在血液学中的应用 白血病免疫分型其临床意义 目前公认的系列特异性指标是:T淋巴细胞系--胞浆CD3(cCD3),B淋巴细胞系-- cCD22或cCD79,髓系---MPO 或cCD13,一般可先用他们区分细胞系列后再进一步分析某一系列亚型和分化阶段。1. ALL的免疫学分型1986年前分为普通型ALL(cALL)、未分化细胞ALL (Null-ALL)、T细胞ALL( T-ALL) 、前B细胞ALL (PreB-ALL)、B细胞ALL (B-ALL)五型;1986-1994年分为两大类九型(非T-ALL六型,T-ALL三型),九十年代后期有人按临床实用性一般分为B祖细胞ALL、前B细胞ALL、B细胞ALL、T细胞ALL四型。表12.1-表12.4列出ALL的五型、九型( B[color=blac
十三.流式细胞术在血液学中的应用 淋巴瘤免疫分型 目前淋巴瘤的分类方法已从LSG的形态学分类逐渐转变为REAL分类法, REAL分类法是以肿瘤发生源为基础的分类方法,在原来的形态学基础上加上免疫学分型后再加以分类,这种分类方法不仅能够推断肿瘤的发生源,对治疗也有指导意义。因此淋巴瘤的免疫分型越来越重要。如同白血病免疫分型一样,淋巴瘤的免疫分型也是利用单克隆抗体检测淋巴瘤细胞的细胞膜和细胞浆抗原,分析其表现型,以了解被测淋巴瘤细胞所属细胞系列及其分化程度。流式细胞仪能对多数的淋巴瘤细胞的细胞膜和细胞浆抗原迅速客观地做出检测,在淋巴瘤的免疫分型中起着不可替代的作用。临床淋巴瘤的免疫分型的检测标本一般是淋巴结、脾脏、胸水、腹水等。在临床淋巴瘤的免疫分型工作中常可遇到以下四种情况:①B细胞系淋巴瘤②T/NK细胞系淋巴瘤③淋巴细胞系以外的造血细胞肿瘤④造血细胞以外的肿瘤。REAL分类淋巴瘤的免疫表型见表12.8。*:弱表达或阴性。BLBL :前B原始淋巴细胞淋巴瘤/白血病; BSLL: B-小淋巴细胞淋巴瘤; LPL:淋巴浆细胞样淋巴瘤; MCL: 斗篷细胞淋巴瘤; FCL:滤泡中心淋巴瘤; MZL: 边缘带B细胞淋巴瘤; SMZL :脾MZL ;HCL:毛细胞白血病; PC:浆细胞瘤;DLBL: B-弥漫性大细胞淋巴瘤; BL: Burkitts淋巴瘤; HBLB:高度B细胞淋巴瘤, Burkitts样; TLB L: 前T原始淋巴细胞淋巴瘤/白血病; TPLL: T幼淋细胞白血病; LGLT:大颗粒淋巴细胞白血病, T细胞型[col
西达本胺通过信号通路调节促进癌细胞凋亡在我国,西达本胺已获批作为PTCL临床用药。西达本胺属于苯酰胺类化合物,是我国自主研发的首个亚型选择性口服HDACI,国家食品药品监督管理局已批准其用于临床试验,其选择性抑制I类HDAC1、2、3亚型和II类HDAC10亚型,可抑制肿瘤细胞增殖、促进凋亡,阻滞周期、引发DNA损伤,还可以增强抗肿瘤免疫反应。与其他抗肿瘤药物相比,西达本胺疗效好、选择性高、不良反应少。西达本胺可激活死亡受体途径和线粒体凋亡途径诱导细胞凋亡,其中最为主要的是线粒体凋亡途径,该途径受Bcl-2家族介导的细胞色素C释放通路调控。抗凋亡蛋白Bcl-2表达受到抑制,促凋亡蛋白Bax表达上调,使线粒体膜电位降低,细胞色素C释放到细胞质中,Caspase途径被激活,细胞发生凋亡。例如:西达本胺增强B淋巴瘤细胞组蛋白H3、H4 乙酰化水平,使线粒体膜电位降低随后激活Caspase 3,促进细胞凋亡;在肾癌中,它可以下调Bcl-2表达,上调Bax表达,随着药物浓度增加引起786-O 细胞凋亡。西达本胺可以调控ROS水平。HDACI可以上调ROS水平,导致DNA双链损伤。研究证明,西达本胺作用于白血病细胞后,诱导细胞内ROS产生,细胞凋亡增加[17]。此外,在胰腺癌细胞系中,西达本胺明显增强细胞内ROS的产生,上调γH2AX(DNA双链断裂的标志物)表达水平,诱发细胞DNA损伤。西达本胺通过调控细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin-dependent kinases,CDKs)以及细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent kinases inhibition,CDKI)的表达阻滞细胞周期。例如,西达本胺使MM细胞系P21、P27的表达量增高,CDK4、CDK6、Cyclin D2表达量下降,阻滞MM细胞系于G1期[19]。在NK/T细胞淋巴瘤中,西达本胺上调P21表达,下调Cyclin E表达,诱导细胞发生G0/G1期阻滞,从而抑制细胞的增殖。
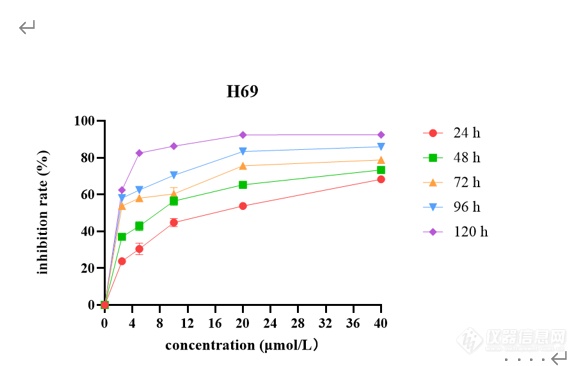
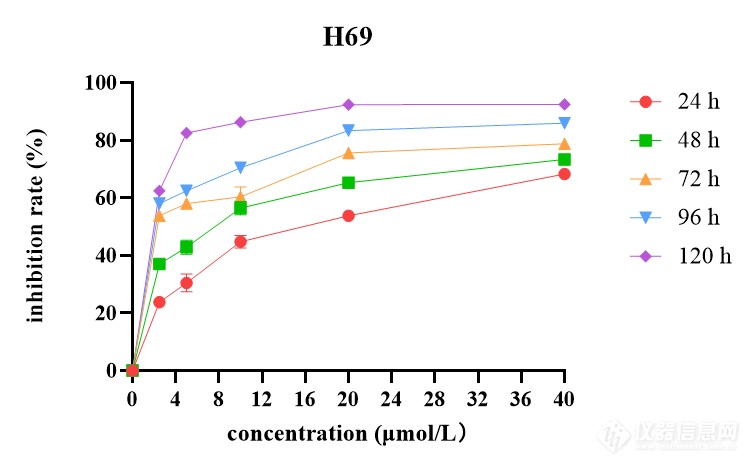
[font=黑体]西达本胺抑制[/font]SCLC[font=黑体]细胞增殖和凋亡[/font]CCK-8[font=宋体]药敏实验结果表明,[/font]SCLC[font=宋体]细胞系[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]经不同浓度西达本胺处理[/font] 24[font=宋体]、[/font]48[font=宋体]、[/font]72[font=宋体]、[/font]96[font=宋体]、[/font]120 h[font=宋体]后,细胞产生明显的增殖抑制现象,且随着药物浓度增加及作用时间延长,抑制作用逐渐增强,呈现出时间[/font]-[font=宋体]浓度依赖性,如图[/font]2[font=宋体]所示。同时得到西达本胺对四种细胞系作用[/font]72h[font=宋体]后的[/font]IC10[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体]见表[/font]1-8[font=宋体]。结果显示四种细胞系对西达本胺均较为敏感,其中,与[/font]H69[font=宋体]相比,[/font]DMS114[font=宋体]对西达本胺相对不敏感。[/font][align=center][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image002.png[/img] [img=,579,366]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020948338518_7449_3237657_3.png!w579x366.jpg[/img][/align][align=center][font=宋体]不同浓度西达本胺作用不同时间后对[/font]H69[font=宋体]的增殖抑制情况[/font][/align][align=center] [/align][align=center][font=宋体]表[/font]1-8 [font=宋体]西达本胺作用[/font]72 h[font=宋体]后达到不同抑制效果的药物浓度([/font]μmol/L[font=宋体])[/font][/align] [table=95%][tr][td] [font=宋体]细胞名称[/font] [/td][td] [align=center] IC10[/align] [/td][td] [align=center] IC20[/align] [/td][td] [align=center] IC50[/align] [/td][/tr][tr][td] [align=center]H69[/align] [/td][td] [align=center][font='Times New Roman',serif]0.423[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]0.632[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]2.916[/font][/align] [/td][/tr][tr][td] [align=center]H446[/align] [/td][td] [align=center][font='Times New Roman',serif]0.404[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]0.571[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]1.033[/font][/align] [/td][/tr][tr][td] [align=center]H526[/align] [/td][td] [align=center][font='Times New Roman',serif]0.118[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]0.261[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]1.015[/font][/align] [/td][/tr][tr][td] [align=center]DMS114[/align] [/td][td] [align=center][font='Times New Roman',serif]1.272[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]2.815[/font][/align] [/td][td] [align=center][font='Times New Roman',serif] 10.943[/font][/align] [/td][/tr][/table][font=黑体]西达本胺改变[/font]SCLC[font=黑体]细胞形态[/font][font=宋体]不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺作用于[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞[/font]48[font=宋体]及[/font]72 h[font=宋体]后在显微镜下观察细胞形态改变如图[/font]1-3[font=宋体]所示。随着药物浓度及作用时间的增加,[/font]SCLC[font=宋体]细胞系形态发生了变化,细胞增殖率减低。[/font]H69[font=宋体]团状细胞减少,单个凋亡细胞增多;[/font]H446[font=宋体]贴壁细胞减少,凋亡细胞增多,触角伸长,形状变得不规则;[/font]H526[font=宋体]细胞体积缩小,由片状变为球形团块,周围散在大量凋亡细胞;[/font]DMS114[font=宋体]由椭圆形变为长梭形,细胞内颗粒物增多,可见空泡,出现凋亡小体。由此可见,低剂量西达本胺即可影响[/font]SCLC[font=宋体]细胞形态,促进细胞凋亡,四种细胞系对西达本胺均较为敏感。[/font][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image004.png[/img][align=center][img=,690,437]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020948563335_146_3237657_3.png!w690x437.jpg[/img][/align][align=center] [/align][font=黑体]西达本胺诱导[/font]SCLC[font=黑体]细胞凋亡[/font][font=宋体]流式结果显示,用不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺处理[/font]SCLC[font=宋体]细胞系[/font]48 h[font=宋体]后,四种亚型细胞系凋亡率均上升,且与加药浓度成正比,如图[/font]1-4 A[font=宋体]所示。[/font]48 h[font=宋体]检测在[/font]IC20[font=宋体]、[/font]IC50[font=宋体]浓度下[/font]H69[font=宋体]细胞凋亡率为[/font]8.45%[font=宋体]和[/font]14.46%[font=宋体],[/font]H446[font=宋体]细胞凋亡率为[/font]8.88%[font=宋体]和[/font]41.6%[font=宋体],[/font]H526[font=宋体]细胞凋亡率为[/font]11.48%[font=宋体]和[/font]20.77%[font=宋体],[/font]DMS114[font=宋体]细胞凋亡率为[/font]11.83%[font=宋体]和[/font]16.07%[font=宋体],与对照组相比,差异具有统计学意义([/font]P0.05[font=宋体])(图[/font]1-4 B[font=宋体])。为了进一步检测西达本胺在[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]四种细胞系中的作用差异,[/font][font=宋体]我们用[/font]1 μmol/L[font=宋体]的西达本胺分别处理[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞[/font]48h[font=宋体]后进行流式细胞仪检测,结果如图[/font]1-4 C[font=宋体]所示,与[/font]DMS114[font=宋体]比较,[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]对西达本胺更敏感。[/font][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image006.png[/img][align=center][img=,690,711]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020949136557_2690_3237657_3.png!w690x711.jpg[/img][/align][align=center][font=黑体]图[/font][font=宋体]不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺作用[/font]48 h[font=宋体]后[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞凋亡率柱状图[/font][/align][align=center]. 1 μmol /L[font=宋体]西达本胺作用[/font]48 h[font=宋体]后对[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞凋亡的影响[/font][/align][align=center] [/align] [font=黑体]西达本胺抑制[/font]SCLC[font=黑体]细胞克隆[/font][font=宋体]用不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺处理[/font]SCLC[font=宋体]细胞系[/font]48 h[font=宋体]后,[/font][font=宋体]在细胞克隆第[/font]14[font=宋体]天,镜下观察细胞克隆情况并拍照(图[/font]1-5 A[font=宋体]),细胞单克隆数量随加药浓度增加而减少。各组细胞克隆形成率绘制成柱状图,如图[/font]1-5 B[font=宋体]所示,随着加药浓度增加细胞克隆形成率逐渐减小,与对照组相比,差异具有统计学意义([/font]P0.05[font=宋体])。[/font]H446[font=宋体]、[/font]DMS114[font=宋体]细胞[/font][font=宋体]进行了平板克隆实验,随着加药浓度的增加,克隆数明显减少,结果[/font][font=宋体]如图所示。[/font][b][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image008.png[/img][/b][align=center][b][img=,690,425]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020949347589_4119_3237657_3.png!w690x425.jpg[/img][/b][/align]
[font=宋体]随着生物技术的快速发展,稳定转染细胞株的构建在基础研究和应用研究中变得越来越重要。这一技术涉及到将外源基因稳定整合到宿主细胞基因组中,从而实现基因的长期表达。然而,这一过程也伴随着一系列的挑战和常见问题。本文将深入探讨稳转细胞株构建的方法,以及在实践过程中可能遇到的问题,旨在为研究者提供实用的指导和建议。[/font][font=宋体] [/font][font=宋体][b]稳定转染细胞株构建方法:[/b][/font][font=宋体] [/font][font=宋体]一、慢病毒感染细胞[/font][font=宋体] [/font][font=宋体][font=宋体]慢病毒因为可以感染大多数的分裂细胞和非分裂细胞,包装技术成熟,[/font][font=Calibri]II[/font][font=宋体]代和[/font][font=Calibri]III[/font][font=宋体]代慢病毒包装系统均能包装高滴度的慢病毒,是稳转细胞系构建的首选系统。但是因为慢病毒有包装容量限制,不适合转录本区域比较长的基因,对较大的基因有局限性。另外由于慢病毒是逆转录病毒,病毒表达载体中,是由[/font][font=Calibri]WPRE[/font][font=宋体]元件代替[/font][font=Calibri]PolyA[/font][font=宋体]稳定以达到稳定[/font][font=Calibri]mRNA[/font][font=宋体]的作用,对部分基因的翻译有一定影响。[/font][/font][font=宋体] [/font][font=宋体]二、转座子介导的稳转细胞系构建[/font][font=宋体] [/font][font=宋体][font=宋体]转座子是存在于各种生命细胞内的可移动遗传信息元件,能实现[/font][font=Calibri]DNA[/font][font=宋体]片段在染色体内部[/font][font=Calibri]/[/font][font=宋体]之间的转移。工程化的转座子由[/font][font=Calibri]ITR[/font][font=宋体]和转座酶编码基因组成,通过转座酶与[/font][font=Calibri]ITR[/font][font=宋体]结合实现基因转移。将转座子的两个元件分别构建在两个独立载体上,并将目的基因序列替换转座酶序列,与另一个载体共转染目的细胞,实现目的基因在宿主基因组上的整合。与其他技术不同,目的基因在整合酶存在下会持续处于切割—整合状态,实现连续跳跃。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]三、[/font][font=Calibri]CRISPR/Cas9 [/font][font=宋体]基因敲入[/font][/font][font=宋体] [/font][font=宋体][font=宋体]利用[/font][font=Calibri]CRISPR/Cas9[/font][font=宋体]系统,通过[/font][font=Calibri]NHEJ[/font][font=宋体]和[/font][font=Calibri]HDR[/font][font=宋体]修复机制,可将目的基因(如抗性基因和荧光标志)定点敲入细胞基因组。在哺乳动物细胞中,[/font][font=Calibri]NHEJ[/font][font=宋体]的效率高于[/font][font=Calibri]HDR[/font][font=宋体]。设计特定[/font][font=Calibri]sgRNA[/font][font=宋体]和[/font][font=Calibri]donor[/font][font=宋体]载体,可在[/font][font=Calibri]AAVS1[/font][font=宋体]位点(人基因组安全港)实现基因定点敲入。此方法稳定、安全,但敲入概率在不同细胞和位点中有所差异,需筛选单克隆以获得稳定细胞系。随着编辑效率提高,此方法将更省时省力。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]四、[/font][font=Calibri]CRISPR SAM[/font][font=宋体]系统,通过融合[/font][font=Calibri]VP64[/font][font=宋体]、[/font][font=Calibri]MS2-P65-HSF1[/font][font=宋体]系统对基因进行过表达和干扰[/font][/font][font=宋体][font=Calibri]CRISPR SAM[/font][font=宋体]通过[/font][font=Calibri]dCas9-VP64[/font][font=宋体]、[/font][font=Calibri]MS2-P65-HSF1[/font][font=宋体]激活蛋白实现了多数细胞内源基因的特异性激活,不受基因大小限制。主要优势是应用广泛,但需要三种不同抗性病毒逐次或同时感染细胞。[/font][font=Calibri]CRISPR SAM[/font][font=宋体]将[/font][font=Calibri]sgRNA[/font][font=宋体]序列构建在[/font][font=Calibri]lenti[/font][font=宋体]载体中,配合其他两种慢病毒可激活任何基因。主要缺点是筛选细胞时需要三种不同抗性的病毒,部分细胞筛选后表型变化明显。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]稳转细胞系构建中常见问题解析:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]是否需要进行密码子优化?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]由于氨基酸密码子的简并性和[/font][font=Calibri]tRNA[/font][font=宋体]的种类多样性、数量的差异,密码子优化对长基因稳转细胞系的构建有很强的必要性,可以大幅提高目标蛋白的表达量。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. Kozak[/font][font=宋体]序列是必须要添加的吗?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Kozak[/font][font=宋体]序列(通常是[/font][font=Calibri]GCCACCatgG[/font][font=宋体]),真核生物[/font][font=Calibri]mRNA[/font][font=宋体]真正的起始密码子位于[/font][font=Calibri]Kozak[/font][font=宋体]序列的保守序列中,其共有序列是[/font][font=Calibri]CCRCCAUGG[/font][font=宋体],几乎所有[/font][font=Calibri]mRNA[/font][font=宋体]的翻译起始都依赖于[/font][font=Calibri]5[/font][font=宋体]’帽子结构募集小亚基,少数通过内部核糖体进入位点[/font][font=Calibri](IRES)[/font][font=宋体]募集小亚基。[/font][font=Calibri]Kozak[/font][font=宋体]序列通过与翻译起始因子[/font][font=Calibri]eIF[/font][font=宋体]形成翻译起始复合物,起始蛋白的翻译。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]启动子应如何选择?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]CMV[/font][font=宋体](巨细胞病毒)启动子除了在干细胞外,其他大多数细胞类型中均可以获得高表达活性。悬浮细胞中[/font][font=Calibri]SFFV[/font][font=宋体]启动子表达活性相对较高。而[/font][font=Calibri]EF1a[/font][font=宋体](延伸因子[/font][font=Calibri]-1[/font][font=宋体]α)启动子更适用于表达长片段的基因。[/font][font=Calibri]CMV[/font][font=宋体];[/font][font=Calibri]EF1A[/font][font=宋体];[/font][font=Calibri]CAG[/font][font=宋体];[/font][font=Calibri]CBh[/font][font=宋体];[/font][font=Calibri]SFFV[/font][font=宋体],等均属于强启动子,都可作为稳转细胞系构建可选启动子。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]稳转细胞系培养体系[/font][/font][font=宋体] [/font][font=宋体][font=宋体]稳转细胞系一般建议用半抗性筛选浓度维持细胞生长,如[/font][font=Calibri]hepG2[/font][font=宋体]细胞[/font][font=Calibri]puro[/font][font=宋体]抗性筛选浓度为[/font][font=Calibri]2[/font][font=宋体]μ[/font][font=Calibri]g/ml[/font][font=宋体],则建议用[/font][font=Calibri]1ug/mL+[/font][font=宋体]完全培养基维持生长;部分基因过表达后会影响细胞代谢,尤其肿瘤细胞,糖酵解代谢速率受影响,细胞生长缓慢,可相应添加葡萄糖或者[/font][font=Calibri]HEPES[/font][font=宋体]调节细胞细胞代谢水平,维持细胞增殖。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]标签放在[/font][font=Calibri]N[/font][font=宋体]端还是[/font][font=Calibri]C[/font][font=宋体]端好?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]如果[/font][font=Calibri]N[/font][font=宋体]端有信号肽,建议放在[/font][font=Calibri]C[/font][font=宋体]端;蛋白如果较小,建议放在[/font][font=Calibri]C[/font][font=宋体]端,减少蛋白降解;如果下游有[/font][font=Calibri]P2A[/font][font=宋体],[/font][font=Calibri]T2A[/font][font=宋体]等自剪切肽,建议放在[/font][font=Calibri]C[/font][font=宋体]端。如果为了添加[/font][font=Calibri]Kozak[/font][font=宋体]序列,建议加在[/font][font=Calibri]N[/font][font=宋体]端。如果纯化中需要酶切标签,建议放在[/font][font=Calibri]N[/font][font=宋体]端。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6. [/font][font=宋体]是否可以构建稳转敲除的细胞系?[/font][/font][font=宋体] [/font][font=宋体]一般不建议,因为敲除元件稳定持续的表达在细胞中,累积脱靶效应明显,影响细胞状态。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳定细胞系构建服务[/b][/url],包含过表达细胞系构建服务和[/font][font=Calibri]CHO[/font][font=宋体]稳定细胞株开发服务,其服务内容详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/services/stable-cell-line-development-service[/font][/font]
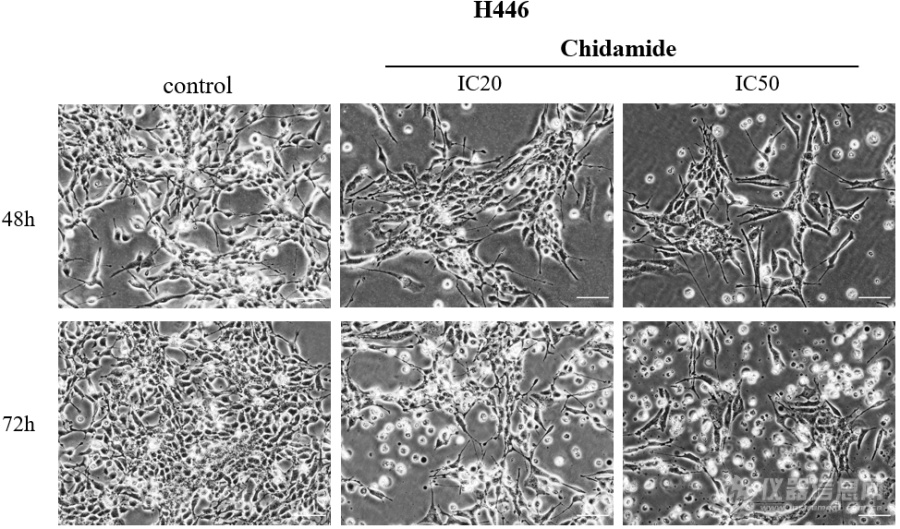
[font='宋体'][size=16px]不同浓度([/size][/font][size=16px]0[/size][font='宋体'][size=16px]、[/size][/font][size=16px]I[/size][size=16px]C20[/size][size=16px]、[/size][size=16px]I[/size][size=16px]C50[/size][font='宋体'][size=16px])西达本胺作用于[/size][/font][size=16px]H[/size][size=16px]446[/size][size=16px]细胞[/size][size=16px]48[/size][size=16px]及[/size][size=16px]7[/size][size=16px]2[/size][size=16px] h[/size][size=16px]后在显微镜下观察细胞形态改变如图所示。随着药物浓度及作用时间的增加,[/size][size=16px]SCLC[/size][size=16px]细胞系形态发生了变化,细胞增殖率减低。[/size][size=16px]H[/size][size=16px]446[/size][size=16px]贴壁细胞减少,凋亡细胞增多,触角伸长,形状变得不规则[/size][size=16px]。[/size][img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308301955281629_7570_5389809_3.png[/img]

[font='宋体'][size=16px]不同浓度([/size][/font][size=16px]0[/size][font='宋体'][size=16px]、[/size][/font][size=16px]I[/size][size=16px]C20[/size][size=16px]、[/size][size=16px]I[/size][size=16px]C50[/size][font='宋体'][size=16px])西达本胺作用于[/size][/font][size=16px]H69[/size][size=16px]细胞[/size][size=16px]48[/size][size=16px]及[/size][size=16px]7[/size][size=16px]2[/size][size=16px] h[/size][size=16px]后在显微镜下观察细胞形态改变如图所示。随着药物浓度及作用时间的增加,[/size][size=16px]SCLC[/size][size=16px]细胞系形态发生了变化,细胞增殖率减低。[/size][size=16px]H[/size][size=16px]69[/size][size=16px]团状细胞减少,单个凋亡细胞增多[/size][size=16px]。[/size][size=16px]由此可见,低剂量西达本胺即可影响[/size][size=16px]S[/size][size=16px]CLC[/size][size=16px]细胞形态,促进细胞凋亡。[/size][img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308301954210149_5675_5389809_3.png[/img]
由于传统的血球计数板已不能满足高速发展的细胞研究需要,市场上各种自动细胞计数的设备越来越多。常见的主要分为两 类:基于图像的细胞计数仪(Automated vision-based counter)和基于库尔特电阻抗原理的细胞计数仪。两者主要区别在于,前者扫描仪器视野内图像,依靠设定的上下限细胞大小来进行图像识别,而后者根据细胞通过小孔引起电位变化来计算细胞个数(关于库尔特原理,详见此处),两者原理不同,因此所获得的效果也大相径庭。以下对各类细胞计数仪的计数准确性、可重复性、快捷性做结果数据比较,建议读者根据您自身需要选购适合您使用的细胞计数仪。【准确性比较】http://www.bioon.com/tech/UploadFiles_3081/201107/2011072416480295.jpg图1. 不同细胞浓度下各种细胞计数仪的计数结果与实际数值的对比上图可见:血球计数板在高细胞密度 时,计数结果与实际细胞密度有偏差,而基于图像的细胞计数仪则在多个浓度下均有较大偏差。这表明基于库尔特原理的细胞计数仪(Coulter counter和Scepter cytometer)在计数准确性上优于其他两种细胞仪。(样品为常见的COS7细胞)【可重复性比较】http://www.bioon.com/tech/UploadFiles_3081/201107/2011072416514090.jpg 图3. 不同细胞浓度下细胞计数的可重复性比较上图可见:基于库尔特原理细胞计数仪的可重复性均明显好于血球计数板和基于图像的细胞计数仪。(样品为19种细胞系)【快捷性】http://www.bioon.com/tech/UploadFiles_3081/201107/2011072416541552.jpg图5. 三种细胞计数法的计数时间对比上图可见:传统的血球计数板的计数时间远长于其他两种计数。库尔特原理计数法与基于图像的细胞计数法相比,计数速度更为稳定,而且计数时间约为后者的一半。(样品为常见的SF9,MCF7,HEK293细胞)
各国争相发展的重点项目 iPS技术,即诱导性多能干细胞技术,是一种将成体成熟、分化的体细胞重编程获得类似胚胎干细胞的新兴技术。2007年11月美国和日本科学家分别独立宣布可将人类皮肤细胞转化为iPS细胞。这一发现被《自然》和《科学》杂志分别评为2007年第一和第二大科学进展。之后,iPS细胞研究迅猛发展,不同的国家和实验室纷纷报道了多种方法建立的iPS细胞系。就连世界第一只体细胞克隆动物多利羊的培育者伊恩·威尔莫特也宣布放弃人类胚胎干细胞克隆研究,转而进行 iPS 细胞研究,因为他认为这种细胞比胚胎干细胞更具潜在优势。 我国连续多年将干细胞研究列入“863”、“973”、国家自然基金重点项目。国务院2006年发布的《国家中长期科学和技术发展规划纲要(2006-2020年)》中,干细胞作为五项生物技术之一成为未来15年我国前沿技术的重点研究领域。 致瘤风险浮出水面 Yamanaka研究组在《自然·生物技术》上发表的文章显示,用iPS细胞诱导的神经干细胞,即使不含c-Myc(曾被认为是导致肿瘤的主要原因),在植入NOD/SCID免疫缺陷小鼠后仍有很强的致瘤性,甚至高于胚胎干细胞。 他们共研究了36个iPS细胞克隆,在诱导方式上,有些诱导剂配方中含有c-Myc基因,有些没有,因此具有较好的代表性。同时他们选择了3株胚胎干细胞作为对照。在45周的观察中,移植胚胎干细胞来源神经干细胞的34只小鼠有4只长出肿瘤。在100只移植胚胎成纤维细胞来源的iPS神经干细胞小鼠中34只发现肿瘤,概率和胚胎干细胞相当。在55只移植成人成纤维细胞来源的iPS神经干细胞小鼠中46只发现肿瘤,概率远高于胚胎干细胞。在36只移植肝细胞来源的iPS神经干细胞小鼠中10只发现肿瘤,概率高于胚胎干细胞。8只移植胃上皮细胞来源的iPS神经干细胞小鼠中未发现肿瘤。病理学检查证实肿瘤均为畸胎瘤,部分为恶性畸胎瘤。 研究还发现,以前认为致瘤性很强的c-Myc在去掉后并没有减少iPS神经干细胞的致瘤性,相反以前认为没有致瘤性的Nanog基因却可以明显增强iPS神经干细胞的致瘤性。 这次试验的另一个意外结果是并未发现在生成的肿瘤细胞中有c-Myc或其他基因的激活。以前的观点认为,转入的癌基因是iPS致瘤性的基础,只要在iPS细胞诱导成功后通过各种方法去除已完成使命的癌基因即可使iPS细胞免于致瘤性。这次试验的结果无疑给这些想法留下了阴影,而且使iPS致瘤的机制更加扑朔迷离。
水果树莓可明显抑制肝癌细胞系增殖,使肝癌细胞血管内皮生长因子(VEGF)的表达减弱,并使抑癌基因野生p53的表达增强。由哈医大附属第四医院刘明博士完成的一项国家自然基金课题,首次成功锁定树莓预防肝癌生长的两个特异性蛋白质作用靶点,为果蔬预防原发性肝癌提供了重要的理论依据。这一成果近日获得2008年度黑龙江省医药卫生科技进步一等奖。 2000年,刘明博士赴美国康奈尔大学研修深造期间,尝试将树莓中的鞣化酸与肝癌细胞混合培养,发现前者能显著抑制后者的生长。近年来,他从医学、营养学等角度开展了“树莓预防及抑制肝癌机制的研究”。 研究结果表明,随着树莓中植物化学物质浓度的增加,总抗氧化自由基清除能力也随之增强。0.25毫克/毫升至10毫克/毫升的树莓提取物对肝癌细胞系HepG-2的抑制率呈逐渐增加趋势,最高抑制率可达90%%左右。 在利用化学毒物黄曲霉毒素和二乙基亚硝胺建立的稳定大鼠原发肝癌模型上,随着树莓提取物浓度的增高,实验组大鼠肝脏上的瘤径变小,肿瘤的数量减少,成瘤率减低,结节程度减轻;肝癌细胞VEGF、增殖细胞核抗原表达的程度亦明显降低。同时,实验组大鼠血清在两种特异蛋白(M2597、M4513)质峰上与树莓干预组及正常大鼠血清差异明显,说明蛋白质峰M2597、M4513极有可能为树莓预防肝癌的蛋白质作用靶点。 专家评价,今后,利用树莓中提取的植物化学成分,进行合理搭配及组成预防剂,十分有助于防范肝癌的发生,并能抑制肝癌的发展,提高患者生存率。
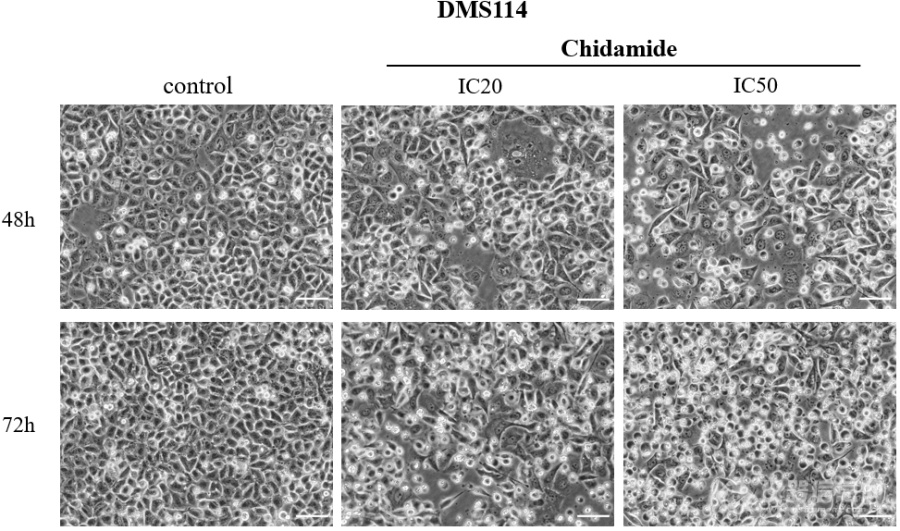
[font='宋体'][size=16px]不同浓度([/size][/font][size=16px]0[/size][font='宋体'][size=16px]、[/size][/font][size=16px]I[/size][size=16px]C20[/size][size=16px]、[/size][size=16px]I[/size][size=16px]C50[/size][font='宋体'][size=16px])西达本胺作用于[/size][/font][size=16px]D[/size][size=16px]MS114[/size][size=16px]细胞[/size][size=16px]48[/size][size=16px]及[/size][size=16px]7[/size][size=16px]2[/size][size=16px] h[/size][size=16px]后在显微镜下观察细胞形态改变如图所示。随着药物浓度及作用时间的增加,[/size][size=16px]SCLC[/size][size=16px]细胞系形态发生了变化,[/size][size=16px] [/size][size=16px]D[/size][size=16px]MS114[/size][size=16px]由椭圆形变为长梭形,细胞内颗粒物增多,可见空泡,出现凋亡小体。[/size][img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308301953282482_3858_5389809_3.png[/img]
[align=center][b][size=14pt][font=等线]如何做好细胞培养?[/font]—实验室细胞培养技术面面观[/size][/b][/align][align=center][size=11pt]会议时间[/size][size=11pt]:[/size][size=11pt]2020年[/size][size=11pt]4[/size][size=11pt]月[/size][size=11pt]17[/size][size=11pt][font=等线]日[/font]1[/size][size=11pt]4[/size][size=11pt]:00[/size][/align][b][size=12pt]内容[/size][size=12pt]介绍:[/size][/b][size=10.5pt]1. 细胞培养简介[/size][size=10.5pt];[/size][size=10.5pt]2. 细胞培养实验室[/size][size=10.5pt]:实验室安全等级、培养设备[/size][size=10.5pt]/耗材[/size][size=10.5pt]、无菌技术;[/size][size=10.5pt]3. 细胞培养基础[/size][size=10.5pt]:细胞系、细胞培养环境([/size][size=10.5pt]PH,CO2浓度,温度,湿度)[/size][size=10.5pt];[/size][size=10.5pt]4. 细胞培养方案[/size][size=10.5pt]:贴壁细胞传代、悬浮细胞传代、细胞冻存、细胞复苏、细胞计数;[/size][size=10.5pt]5. 细胞培养常见问题[/size][size=10.5pt]:细胞污染、细胞太稀、细胞消化过度、细胞复苏状态不佳。[/size][b][size=12pt]讲师[/size][size=12pt]介绍:[/size][size=11pt]雷俊[/size][size=11pt]:[/size][/b][size=11pt]北京大学细胞生物学博士博士研究生期间,主要从事细胞周期事件与肿瘤发生关系的研究,具有细胞生物学、蛋白质组学等学科背景,精通分子细胞生物技术、成像技术等研究手段。现任瑞沃德生命科技有限公司细胞产线产品经理。[/size][b]报名地址:[/b][url=https://www.instrument.com.cn/webinar/meeting_10287.html][u][font='Times New Roman'][color=#0000ff]https://www.instrument.com.cn/webinar/meeting_10287.html[/color][/font][/u][/url]
如果不小心,液氮罐可能会意外地掉进细胞中,对细胞造成严重损害。那么,当液氮罐掉进细胞时,我们该如何处理呢? 1. 立即移除液氮罐 当液氮罐掉进细胞中时,第一步是立即移除液氮罐。这可以通过使用钳子或其他合适的工具将液氮罐从细胞中取出。在这个过程中,需要注意不要进一步损伤细胞或污染实验环境。 2. 冲洗细胞 一旦液氮罐被移除,下一步是冲洗细胞。这可以通过将细胞置于含有适当缓冲剂的培养基中进行。缓冲剂可以帮助稀释液氮和减轻细胞受到的损害。同时,冲洗还有助于清除细胞表面的残留液氮。 3. 检查细胞状态 冲洗后,需要对细胞进行检查,以确定其状态。这可以通过使用显微镜观察细胞形态和结构来完成。如果细胞出现明显的损伤或死亡,那么可能需要重新开始实验或采取其他措施修复细胞。 4. 细胞培养和恢复 如果细胞没有受到严重损害,那么接下来的步骤是将细胞继续培养和恢复。这可以通过将细胞放入新的培养皿中,并提供适当的培养基和条件来完成。在此过程中,可以使用细胞培养技术和方法来促进细胞的生长和再生。 5. 监测细胞恢复 一旦细胞开始恢复,我们需要密切监测细胞的恢复情况。这可以通过定期观察细胞形态、增殖和功能来完成。如果发现细胞的恢复速度较慢或存在其他异常情况,可能需要调整培养条件或采取其他干预措施。 总之,当液氮罐掉进细胞时,及时处理是至关重要的。通过立即移除液氮罐、冲洗细胞、检查细胞状态、细胞培养和恢复以及监测细胞恢复等步骤,我们可以最大程度地减少细胞受损并帮助其恢复。当然,在实验室操作中,预防措施也是非常重要的,包括正确使用液氮罐、操作时保持专注和谨慎等。只有这样,我们才能更好地保护细胞并确保实验的准确性和可靠性。 预防措施 在实验室工作中,事故的发生往往可以通过采取预防措施来避免。对于液氮罐掉进细胞的情况,以下是一些预防措施的建议: 1. 储存和运输细胞时,确保液氮罐被正确放置并固定。使用适当的支架和保护装置可以降低液氮罐掉入细胞的风险。 2. 在操作期间保持专注和谨慎。避免在操作液氮罐时分心或急躁,以免发生意外。 3. 定期检查液氮罐的状态。确保液氮罐没有损坏或出现其他问题,以减少安全隐患。 通过采取这些预防措施,可以降低液氮罐掉落细胞的风险,保护细胞和实验的安全。[url=http://www.mvecryoge.com/]金凤液氮罐[/url] 应对不同情况 [url=http://www.yedanguan365.com/]液氮罐[/url]掉进细胞的情况可能会有所不同,因此我们需要根据具体情况采取不同的应对策略。以下是一些常见的情况及相应的处理方法: 1. 液氮罐只接触到细胞表面而未完全陷入细胞:在此情况下,可以尝试使用吸管或其他工具轻轻将液氮罐从细胞上移开,然后进行细胞冲洗和恢复。 2. 液氮罐陷入细胞内部:在这种情况下,需要谨慎地将液氮罐从细胞中取出,以避免进一步损伤细胞。然后进行细胞冲洗和恢复。 3. 细胞受到严重破坏或死亡:如果细胞受到严重损害或死亡,可能需要重新开始实验或采取其他措施来修复细胞。这可能包括使用新的细胞系或进行其他细胞培养操作。
注意事项: 1.配制溶液时必须用新鲜的蒸馏水。2.安装蔡式滤器时通常使用孔径 0.45 微米 和 0.22 微米滤膜各一张,放置位置为 0.45 的位于 0.22 微米的滤膜上方,并且要特别注意滤膜光面朝上。 3.配制 RPMI1640 培养基时因为还要加入小牛血清,而小牛血清略偏酸性,为了保证培养液 PH 值最终为 7.2 ,可在配制时调 PH 至 7.4 。 细胞培养的一般过程 一、准备工作准备工作对开展细胞培养异常重要,工作量也较大,应给予足够的重视,推备工作中某一环节的疏忽可导致实验失败或无法进行。准备工作的内容包括器皿的清洗、干燥与消毒,培养基与其他试剂的配制、分装及灭菌,无菌室或超净台的清洁与消毒,培养箱及其他仪器的检查与调试,具体内容可参阅有关文献。二、取材在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的首次培养称为原代培养。R 理论上讲各种动物和人体内的所有组织都可以用于培养,实际上幼体组织(尤其是胚胎组织)比成年个体的组织容易培养,分化程度低的组织比分化高的容易培养,肿瘤组织比正常组织容易培养。取材后应立即处理,尽快培养,因故不能马上培养时,可将组织块切成黄豆般大的小块,置 4℃的培养液中保存。取组织时应严格保持无菌,同时也要避免接触其他的有害物质。取病理组织和皮肤及消化道上皮细胞时容易带菌,为减少污染可用抗菌素处理。由组织并分离分散细胞的方法可参阅有关文献。 三、培养将取得的组织细胞接入培养瓶或培养板中的过程称为培养。如系组织块培养,则直接将组织块接入培养器皿底部,几个小时后组织块可贴牢在底部,再加入培养基。如系细胞培养,一般应在接入培养器皿之前进行细胞计数,按要求以一定的量(以每毫升细胞数表示)接入培养器皿并直接加入培养基。细胞进入培养器皿后,立即放入培养箱中,使细胞尽早进入生长状态。正在培养中的细胞应每隔一定时间观察一次,观察的内容包括细胞是否生长良好,形态是否正常,有无污染,培养基的 PH是否太酸或太碱(由酚红指示剂指示),此外对培养温度和 CO2浓度也要定时检查。一般原代培养进入培养后有一段潜伏期(数小时到数十天不等),在潜伏期细胞一般不分裂,但可贴壁和游走。过了潜伏期后细胞进入旺盛的分裂生长期。细胞长满瓶底后要进行传代培养,将一瓶中的细胞消化悬浮后分至两到三瓶继续培养。每传代一次称为“一代”。二倍体细胞一般只能传几十代,而转化细胞系或细胞株则可无限地传代下去。转化细胞可能具有恶性性质,也可能仅有不死性(Immortality)而无恶性。培养正在生长中的细胞是进行各种生物医学实验的良好材料。四、冻存及复苏为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度?-196℃,将细胞收集至冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,最终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入 37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。冻存过程中保护剂的选用、细胞密度、降温速度及复苏时温度、融化速度等都对细胞活力有影响。
[font=宋体][font=宋体]稳定细胞,又被称为静止细胞,是那些在生理状态下增殖不明显,处于细胞增殖周期静止阶段的细胞([/font][font=Calibri]G0[/font][font=宋体]期)。然而,当它们受到组织损伤的刺激时,这些稳定细胞会迅速反应,进入[/font][font=Calibri]DNA[/font][font=宋体]合成前期([/font][font=Calibri]G1[/font][font=宋体]期),展现出强大的再生能力。它们是维持组织和器官稳态的关键因素。[/font][/font][font=宋体] [/font][font=宋体]稳定表达细胞株,也被称为稳定转染细胞株,是一种特殊的细胞株。这些细胞能够持续、稳定地表达特定的基因或干扰特定基因的表达。在生物学和医学研究中,稳定表达细胞株被广泛应用于基因功能研究、药物筛选和疾病模型建立等领域。[/font][b][font=宋体] [/font][font=宋体]稳定细胞株平台的常见问题解答[/font][/b][font=宋体] [/font][font=宋体]①若想做稳定细胞株,需提供哪些信息?[/font][font=宋体][font=宋体]客户仅需提供目标蛋白的序列信息和希望表达的目标蛋白的区段,义翘神州技术人员会根据客户要求进行表达风险评估和制定表达纯化策略。常见蛋白序列信息来源包括[/font][font=Calibri]UniProt[/font][font=宋体]和[/font][font=Calibri]NCBI[/font][font=宋体]等数据库。客户也可直接提供编码目标蛋白的核苷酸序列。[/font][/font][font=宋体] [/font][font=宋体]②稳定株细胞如何交付?[/font][font=宋体]采用干冰运输,尽可能减少温度波动对细胞造成的影响。[/font][font=宋体] [/font][font=宋体][font=宋体]③单克隆和[/font][font=Calibri]pool[/font][font=宋体]怎么选择?[/font][/font][font=宋体][font=宋体]成药蛋白需要单克隆,以便溯源。如只需拿到蛋白[/font][font=Calibri]/[/font][font=宋体]抗体的话,[/font][font=Calibri]pool[/font][font=宋体]即可满足。需要提醒的是,通常情况下,[/font][font=Calibri]pool[/font][font=宋体]产量较单克隆低。[/font][/font][font=宋体] [/font][font=宋体]④稳定细胞株做重组蛋白,能否根据蛋白活性进行克隆筛选?[/font][font=宋体][font=宋体]是可以的,只要客户有完整的活性检测方法,我们可以提供[/font][font=Calibri]minipool[/font][font=宋体]供客户进行活性检测(或由义翘进行活性检测)。符合客户对活性的要求后再进行后续的实验。[/font][/font][font=宋体] [/font][font=宋体]⑤为什么要构建稳定细胞株?[/font][font=宋体]稳定株一个很大的优势是减小重组表达蛋白的批间差异,并且表达量通常比瞬转高。对于成药性抗体来说,构建稳定细胞株是十分必要的。[/font][font=宋体] [/font][font=宋体]⑥为什么稳定细胞株构建周期较长?[/font][font=宋体]稳定株的构建周期长,很大程度是由于要筛选出阳性克隆,并需要对细胞株的稳定性进行检测。[/font][font=宋体] [/font][font=宋体]⑦制备稳定株表达蛋白的周期大致如何?[/font][font=宋体][font=宋体]如只需要[/font][font=Calibri]pool[/font][font=宋体]即可,从基因合成到得到纯化后的蛋白,周期一般在[/font][font=Calibri]7[/font][font=宋体]周左右。如需引入多步纯化方案,标签切除,以及额外检测服务则周期会根据具体项目情况有所延长。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/stable-cell-line-development-service][b]稳定细胞系构建服务[/b][/url],同时提供[url=https://cn.sinobiological.com/services/platform/stable-cell-line-development][b]稳定细胞株构建平台[/b][/url],详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/platform/stable-cell-line-development[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
第四种淋巴细胞—NKT细胞 通常认为,构成机体免疫系统的淋巴细胞有三种细胞系组成,一是由胸腺产生的T细胞,二是由骨髓分化而来的产生抗体的B细胞,三是自然杀伤(NK)细胞。而新近发现存在第四种淋巴细胞—NKT细胞。1. NKT细胞的发现1986年,克隆成功了NKT细胞的特征性抗原受体基因。将其命名为Va14基因,与其他T细胞抗原受体的(TCR)基因不同,有其独特的结构特征。1987年美国国立卫生研究所的Fawlkes与瑞士的Budd分别领导的两个研究小组报告指出,胸腺细胞中的T细胞通常不能表达受体,仅有部分未成熟T细胞选择表达V-β8.2受体。随后的研究证明这种细胞不是T细胞,考虑是NK细胞的受体,这种细胞集团的数量极少,生理意义不明。1994年,这两个研究小组的研究人员发现,他们报道的细胞为同一细胞,从此NKT细胞的研究引起人们的广泛关注。T细胞识别的抗原是蛋白质,而NKT细胞是别的抗原是α-Gal-Cer即所谓的糖脂质,这是该免疫系统与通常的免疫系统重要的不同点。NKT细胞的分化与T细胞不同的是在胸腺形成前的胎生初期6.5日在胸腺外组织分化。NKT细胞与T细胞比较,机能处于不发达状态。T细胞分化为功能不同的Th1和Th2细胞群,Th1细胞产生INFγ及IL-2,引起迟发行过敏症等细胞性炎症。Th2细胞能产生IL-4和IL-10,参与变态反应及抗体产生等体液免疫反应。而NKT细胞不但能分泌Th1和Th2细胞因子,同时还具有与CD8+伤害性T细胞(cytotox-ic Tlymphocyte,CTL)相同的杀伤靶细胞作用。毫无疑问,NKT细胞在免疫调节系统中占有重要位置。NKT细胞与疾病可能有诸多关系,可能与自身免疫性疾病的发病机制、变态反应的调节、抗肿瘤作用、及抑制寄生虫感染等有关。2. NKT细胞的多样性分化NKT细胞具有T细胞和NK细胞细胞两重性质,既能表达Va14/Ja281特定的T细胞受体又能由CD1介导识别脂质抗原。NKT细胞的分化是否依赖胸腺尚有争议。根据其表达TCR等多种表面抗原的不同,提示NKT细胞存在两个以上细胞群。从CD4/8的表达看,可将其分为(1)CD4-NKT细胞,(2)CD8-NKT细胞,(3)CD4和CD8均不能表达的DN-NKT细胞。第一类的全部和第二类的半数是Va14/Ja281-T细胞。3.人类NKT细胞人末梢血中的DN-NKT细胞V区域,可高度表达Va24/JaQ(这与鼠的Va14/Ja281高度相似)及Vβ11(与鼠Vβ18高度相似)。这种TCR的组合表达可见于DN-NKT细胞和CD4+细胞。而未见于CD8+细胞。小鼠的CD1相当于人的CD1d的Va24/JaQ。此外,人末梢血中1~2%的T细胞能表达抑制性受体,即抑制型NK细胞受体(KIR),而Va24/JaQ+细胞则不能表达。它的NK相关分子是CD16、CD56或CD57,Va24/JaQ+细胞异不能表达这些分子。在小鼠中还可以看到Va24/Ja281+T细胞以外的NKT细胞。人类Va24/JaQ+细胞与KIR+T细胞能形成不同的亚群。且具有不同的功能。4. NKT细胞分化的胸腺依赖性这是目前存在争议的问题,可以肯定地说NKT细胞分化过程中胸腺是有作用的。NKT细胞多见于胸腺及脾脏以外的肝脏和骨髓种,胸腺缺损的小鼠与正常小鼠比较,NKT的分化并不少。将出生三日小鼠的胸腺摘除,虽然NKT细胞的分化显著受到抑制,但此时CD8+NKT细胞的分化未受到影响。由此认为CD8+NKT细胞在胸腺外分化的可能。5. NKT细胞产生细胞因子的意义 NKT细胞是指能够表达NKT细胞标志NKT1.1的T细胞,其机能具有T细胞和NKT细胞双重特征。NKT细胞在TCR和NKR介导下,产生大量的IL-4及INFγ,对肿瘤细胞有细胞伤害作用。 NKT细胞能表达T细胞的TCR与NK细胞的NKR-P1两种受体,特别是NKT细胞多数表达Va14TCR,识别CD1抗原,而NKR-P1识别各种糖链。 NKT细胞,特别是CD4-NKT细胞,对TCR刺激可产生大量IL-4及IFNγ,同时具有ThO型细胞因子产生能力。NKT细胞不但产生IL-4的主要细胞,而且强力产生IFNγ。IFNγ参与自身Th1诱导,具有极强的Th1诱导能力,从而是IL-2产生亢进。它同时还具有Th2细胞分化抑制功能。IL-12能诱导NKT细胞产生IFNγ。IL-12对TCR的刺激是IFNγ的产生显著亢进。综上所述,NKT细胞不但是IL-4和IFNγ的强力产生细胞,同时参与Th1/Th2分化的抑制,而这些作用都不是单纯的。 虽然NKT细胞能大量产生细胞因子,但仅在机体内保持这种功能。当初一度认为,NKT细胞只是IL-4的产生细胞,而不是Th2分化的必需细胞。并不认为在CD1缺损的小鼠中NKT细胞的分化和对TCR刺激使IL-4产生减少,且对Th2分化必需的IL-4及IgE的产生没有多大影响。但给小鼠投于α-GalCer可使NKT细胞活化,IL-4的产生诱导Th2的应答。有报告指出,同样投于α-GalCer,可使NKT细胞产生IFNγ而致IgE产生低下。由此可见,NKT细胞能产生IL-4与IFNγ两种功能相反的细胞因子。这种微妙的协调作用可能是NKT机能表达的重要特征。NKT细胞的活化通常伴有T细胞、B细胞及NK细胞的活化,这对NKT细胞活化后的免疫应答有较大影响。