
【专家讲座】:显微成像与显微切割在干细胞研究领域应用实例分享【讲座时间】:2016年03月31日 10:00【主讲人】:张坤 徕卡显微系统生命科学部应用专家。【会议简介】干细胞涉及到个体发育、器官移植、延缓衰老、癌症治疗等方方面面。单个的干细胞是如何分裂、分化成新的细胞、组织或器官呢?在成体中,干细胞又是如何完成细胞修复更新的使命呢?如果要将特定的干细胞从复杂的组织器官中分离出来,分析其特异的遗传、代谢性质,该采用什么样的手段呢?在这次Webinar中,我们将介绍如何借助共聚焦、双光子、超高分辨率显微镜及激光显微切割等先进的显微成像分析技术一一解决在干细胞研究中的这些问题。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年03月31日 9:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/18985、报名及参会咨询:QQ群—171692483http://ng1.17img.cn/bbsfiles/images/2017/01/201701191700_667315_2507958_3.jpg
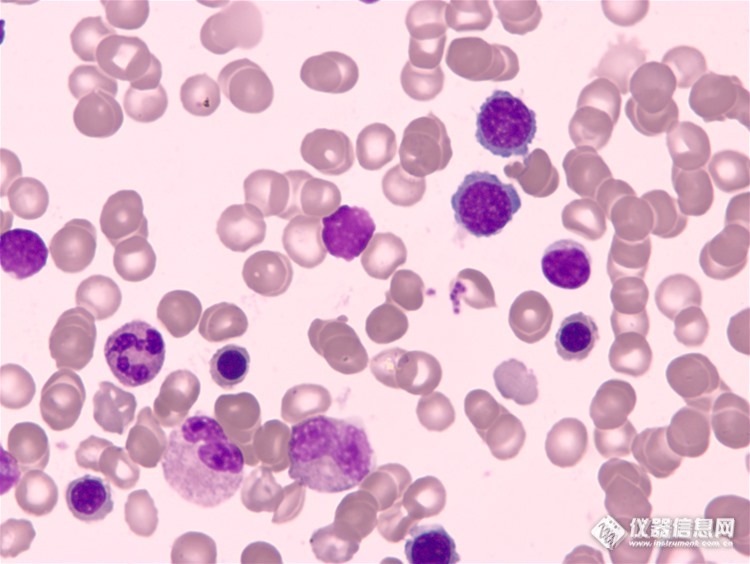
骨髓细胞是我们人体不可或缺的一部分,随着不同的生理条件,骨髓像的变化范围也很广,下面我们一起来看看在广州明美光电最新产品科研级摄像头MSX2下看到的骨髓细胞成像。MSX2是最新研发的科研级数字摄像头,采用大靶面高性能的成像芯片,设计USB3.0数据传输接口,具有高分辨率、颜色还原准确和高灵敏度的特点,其优秀的色彩表现,是液基细胞分析、免疫组化、骨髓细胞分析等对颜色要求高的病理诊断的理想工具。此外在明暗场、相衬、偏光、DIC、荧光成像等领域同样表现出色。科研级数字摄像头MSX2性能特点高分辨率、图像精细。 大靶面芯片、拍摄视野更接近目镜观察视野、图像更真实。 优化颜色算法,色彩还原准确,辨识度高。高灵敏度,适合弱光条件使用。高速USB3.0传输,高效数据处理,1200万全分辨下最高15fps。http://ng1.17img.cn/bbsfiles/images/2016/06/201606080956_596339_1783654_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/06/201606080956_596340_1783654_3.jpg以上图片是在显微镜摄像头下所观察到的现象。

http://ng1.17img.cn/bbsfiles/images/2017/10/2016082816541190_01_3092793_3.jpg YEESPEC智能细胞成像系统已全面升级:强大的配置与功能,高品质成像质量,更方便的显微操作,绝对能带给您眼前一亮的全新体验。 作为新一代的智能细胞成像系统,它比传统显微镜操作要方便许多,所有的操作工程都可以通过前面的触摸控制屏完成。只要轻轻地点几下屏幕,就可以轻松地完成整个细胞成像过程,包括:镜头切换、荧光切换、聚焦。 同时,因为设计的小巧,我们也可以把它放在培养箱或者安全柜里使用,可以边做实验室边观察。 YEESPEC智能细胞成像系统,更是科研的得力助手。与传统活细胞工作站相比,它具有更强大的功能特点。 1、 操作方便,即开即用: 采用全触控屏操作,也可以通过手机端平板端进行操作;荧光光源采用高亮度LED光源,不需要预热。 2、 成像质量好,光路的主要元器件均采用原装进口: 采用顶级CCD芯片、原装进口长工作距离荧光物镜、Omega荧光滤光片、K9光学玻璃载物台,透过率非常高。 3、 没有耗材,使用成本低: 采用高亮度白色LED,荧光光源采用高亮度单色LED。LED的寿命是5万个小时以上,基本上仪器买回去10年都不用更换。 4、保证实验安全: 内部装有两块10000mAh,12V的电池,短时间观察使用时可以不需要接电源,即使停电也可以完成实验,保证了实验安全。
[b][url=http://www.f-lab.cn/cell-analyzers/ctc-enumeration.html]CTC细胞计数成像系统[/url][/b]集细胞荧光成像和罕见细胞计数功能于一体,自动聚焦成像,能够探测超级罕见细胞,包括[color=#333333]循环肿瘤[/color]细胞(Circulating Tumor Cells, CTCs),CTCs细胞。CTC细胞计数成像系统采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[img=CTC细胞计数成像系统]http://www.f-lab.cn/Upload/CTCs-enumeration.JPG[/img][img=CTC细胞计数成像系统]http://www.f-lab.cn/Upload/CTC-enumeration.JPG[/img]CTC细胞计数成像系统:[url]http://www.f-lab.cn/cell-analyzers/ctc-enumeration.html[/url][b][/b]
高内涵技术优势高内涵细胞成像分析系统由三个部分组成:全自动高速显微成像,全自动图像分析和数据管理。全自动高速显微成像在短时间内生成大量的图像,全自动图像分析从这些图像中提取大量的数据,数据管理软件负责建档存储、注释比较、检索分享这些图像和数据。高内涵,意味着丰富的信息。这些信息包括:单个细胞图像和各项指标,细胞群体的统计分析结果,细胞数量和形态的改变,亚细胞结构的变化,荧光信号随时间的变化,荧光信号空间分布的改变等等。人们往往因为特定的问题去设计实验,在图像中找到答案的同时,其他的信息会带来意外的新发现。
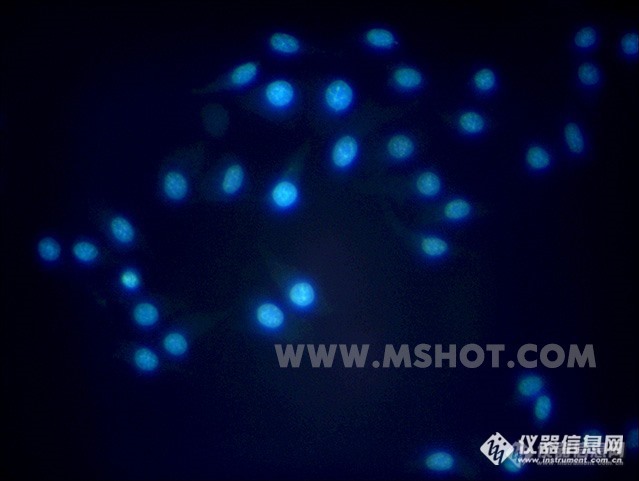
细胞活体的培养,是现代生物医学界一重要科研项目,细胞的繁殖,复制,新陈代谢过程,这些都是科学家们都想观察到的现象,借助于荧光显微镜,我们可以很清楚的观察到细胞的所有繁殖过程,那么什么样的倒置荧光显微镜比较好呢? 我们需要注意一下几点:倒置荧光显微镜一般由落射荧光显微系统与倒置生物显微系统组成,采用优良的无限远色差独立校正光学系统,配置长工作距离平场消色差物镜与大视野目镜。紧凑稳定的高刚性主体,充分体现了显微操作的防振要求。落射荧光显微系统采用模块化设计理念,可以安全、快揵地调整照明系统,切换荧光滤色片组件。产品可应用于细胞组织,透明液态组织的显微观察,也可用于生物制药,医学检测、疾病预防等领域内的荧光显微术观察。 我们来看看倒置荧光显微镜到底是怎么样的!http://ng1.17img.cn/bbsfiles/images/2016/06/201606131012_596689_1783654_3.jpg倒置荧光显微镜成像效果http://ng1.17img.cn/bbsfiles/images/2016/06/201606131014_596690_1783654_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/06/201606131014_596691_1783654_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/06/201606131014_596692_1783654_3.jpg
虽然经过几个世纪的研究,人类的生长于发育过程中仍遗留有很多的未解之谜。人类胚胎发育的研究始于20世纪,一般以观察胚胎的组织图像的方式来研究如器官发生的机制等,传统的方式如切片一直使用至今。现今,对于胚胎3D图像的数字化构建也已经开始,使用核磁共振、X光摄影等方法均可获得胚胎的3D图像,但分辨率仍无法达到细胞水平。本研究使用了妊娠期6-14周的胚胎和胎儿共36个,结合免疫染色、3DISCO组织透明技术和光片照明技术,获得了人类胚胎细胞级分辨率的3D图像,清晰地显示了胚胎的外周神经、肌肉、血管、心、肺和泌尿系统。通过这种方法,我们可以建立人类生长发育的图库,研究人类胚胎发育的分子机制。[b]3D图像示例:1) 周围神经系统3D成像(使用中间纤维外周蛋白(Prph)的抗体标记Prph): [/b][align=center][img=,450,317]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/2.jpg[/img] [/align][align=center](A)7周龄胚胎的表面造影图像(左);对Prph进行标记所得图像。[/align][align=center](B)8周龄胚胎的表面造影图像(灰色)和标记Prph所得图像(绿色)的叠加图像。[/align][align=center](C)8周龄胚胎的面部神经分布。表面造影图像和标记Prph所得图像的叠加(中)(右)。 [/align][align=center]感觉神经轴突和运动神经轴突在手脚的分布:分别使用胆碱乙酰转移酶(ChAT)和瞬态粘附糖蛋白-1(Tag-1)的抗体来标记。[/align][align=center](D)在外周神经,染色产生重叠现象,但在末端Tag-1(绿色)更为明显。(D-F)ChAT染色与Prph和Tag-1均无重叠。 [/align][align=center][img=,550,177]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/3.jpg[/img] [/align][align=center](D)9.5周龄的拇指,标记Prph和Tag-1。染色发生重叠,但在末端区域Tag-1更显著。[/align][align=center](E)9.5周龄的左手,ChAT与Prph表达区域不同。[/align][align=center](F)9周龄的右脚,ChAT与Tag-1表达区域不同。 [/align][align=center] [img=,550,177]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/4.jpg[/img][/align][align=center](G)7周龄的头部,标记Prph显示颅神经。(右)对颅神经分布使用Imaris软件进行3D虚拟解剖、区分并着色。 [/align][b]2) 手足的神经分布的3D成像:对Prph和Tag-1进行免疫染色以建立胚胎和胎儿手部的感觉神经及其分支的3D图像,并可观察感觉神经随时间推移的发育情况。 [/b] [align=center] [img=,450,362]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/5-1.jpg[/img][/align][align=center](A)8周龄标记Prph的右手,感觉神经分为尺骨神经、正中神经和桡神经。[/align][align=center](B)右手从7周龄到11周龄的神经分布随时间的变化。肌皮神经(指针处)很快便延长深入手部。 [/align][align=center] 之后分别对ChAT和Tag-1标记,建立了运动和感觉神经的分布的图像,以确定两种神经在何处以何种方式分离。 [/align][align=center][img=,550,286]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/5-2.jpg[/img] [/align][align=center](C)(D)9周龄的右脚和8周龄的左手的感觉神经和运动神经的3D图像。 [/align][b]3) 对肌肉生长进行3D成像分析:[/b]转录因子Pax7是有颌下门动物的肌肉干细胞标记物,是肌肉生成的关键启动因子。在肌肉的生长中,表达Pax7的细胞均匀分布于生长中的肌肉,表达肌细胞生成素(Myog)的细胞成簇分布于运动神经末端。生长中的肌肉表达了双皮质素(Dcx),可能影响神经肌肉接点的发育。 [align=center][img=,550,259]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/7-1.jpg[/img] [/align][align=center](A)9.5周龄标记Pax7的右脚和右手。[/align][align=center](B)10.5周龄标记Pax7与ChAT的右脚。[/align][align=center](C)9周龄标记Myog、ChAT和Tag-1的右脚。[/align][align=center]表达Myog的细胞成簇分布于运动神经分支末端。[/align][align=center](D)9.5周龄的左脚标记Dcx与ChAT。[/align][align=center]Dcx在肌肉(*号)和感觉神经中检测到,但在运动神经轴突中未检测到。 [/align][align=center] [img=,450,334]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/7-2.jpg[/img][/align][align=center](E)8周龄标记MHC与Tag-1的胚胎。[/align][align=center](中上)动眼肌肉的图像。[/align][align=center]点状线标示出了肌肉的分界线,此处照明被色素上皮所减弱。[/align][align=center](中下)肌肉与感觉神经。(右)左臂的肌肉与感觉神经。[/align][align=center](F)9.5周龄标记MHC与ChAT的左手,显示了肌肉与运动神经。[/align][align=center]使用不同颜色对肌肉进行了区分,同时能够观察到正在发育的骨骼。 [/align][b]4) 人类胚胎脉管系统的3D成像分析:[/b]质膜膜泡关联蛋白(Plvap)是一种由网状微血管内皮细胞表达的跨膜糖蛋白。对整个胚胎标记Plvap并成像,可以观察到致密的血管网络。对平滑肌表达的α肌动蛋白(SMA)进行免疫染色可以观察到生长中的动脉的3D结构。 [align=center][img=,450,414]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/9.jpg[/img] [/align][align=center](A)(B)8周龄标记Plvap的胚胎。[/align][align=center]Plvap在整个胚胎中形成了致密的网络。[/align][align=center](A中、右)右臂与右手。(B左)左腿的Z轴投射图像。[/align][align=center](*号)血管网络穿过了除了骨骼的所有组织。[/align][align=center](B右)面部图像。(箭头)角膜处没有血管。[/align][align=center](C)11周龄胎儿,标记胶原IV的肋骨表面。[/align][align=center](D左)11.5周龄胎儿的右腿和右膝,标记MyoSM的动脉。[/align][align=center](D右)11.5周龄胎儿的右脚,标记SMA的动脉。[/align][align=center] 对胃肠道的淋巴细胞表达的Podoplanin进行标记以研究淋巴管形成,表达Podoplanin的细胞覆盖了肠胃,[/align][align=center]而含Podoplanin的微管数量较少,说明人类淋巴系统成熟可能晚于血管系统。[img=,550,181]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/10.jpg[/img][/align][align=center](E)14周龄标记Podoplanin的消化道。表达Podoplanin的细胞位于肠胃上方。 [/align][align=center](右)表达Podoplanin的细胞尚未发育形成淋巴管。[/align][b]5) 肺的生长发育的3D分析:[/b]标记鼠的性别决定基因Sox9转录因子和Dcx,观察到Sox9在人的末端支气管芽处表达,Dcx在每个气道的近端上皮部分表达。用Plvap标记肺部的血管,发现肺间质内微血管和大血管形成了连续的网络。肺部气道的分支方式是高度保守的,包括域分支、水平分支和垂直分支,使用Sox9/Dcx标记小支气管,可以观察到3种分支方式,并发现了不对称分支现象。 [align=center][img=,550,329]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/11.jpg[/img] [/align][align=center](A)9.5周龄标记Sox9、Dcx和Plvap的胎儿的肺部。Sox9在上皮小管的末端表达,Dcx在近端表达。Plvap在整个肺的血管中表达。[/align][align=center](B)肺上皮小管Z轴光学切面。[/align][align=center](C)末端的微血管网络。[/align][align=center](D)气道分支的3D图像。肺叶(蓝绿),支气管(红)。[/align][align=center](E)支气管的3D图像。(右)三种分支方式。[/align][align=center] 标记SMA和平滑肌肌凝蛋白(MyoSM),两者均于围绕支气管和气道上皮小管的平滑肌处表达。标记Sox9显示出末端没有平滑肌。[/align][align=center]对平滑肌进行染色同时可以显示动脉和微动脉。可以使用SMA和酪氨酸羟化酶(TH)标记心脏来观察血管和神经分布。 [/align][align=center][img=,550,289]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/12.jpg[/img] [/align][align=center](F)9.5周龄的标记MyoSM的肌凝蛋白平滑肌的染色。(箭头)支气管及分支。[/align][align=center](G)11.5周龄的左肺标记SMA显示出气道平滑肌的分支方式。(箭头)动脉周围肌肉和(指针)近端气道周围肌肉。[/align][align=center](H)10周龄的肺的分支图像。末端芽部用Sox9标记。表达SMA的平滑肌分布于不表达Sox9的近端区域。[/align][align=center](I-K)心脏的光片显微图像。 [/align][b]6) 泌尿生殖系统发育的3D分析:[/b]人类生殖道分为两种结构:由中肾分化而来的中肾管(WD)和由中肾管诱导分化而来的副中肾管(MD)。性别决定伴随着生殖道的重构。Pax2转录因子可用于标记中肾和WD。8周龄的雄性胚胎中,MD尖端与WD紧密接触但并未完全生长。肾处于腹侧位置邻接生殖嵴。9.5周龄时MD继续沿WD延伸但并未连接。10周龄时两条MD连接,从两侧WD的中间延伸至泌尿生殖窦,同时开始降解,融合的剩余MD分化为前列腺囊。14周龄时,WD的中肾肾小管退化,附睾与输精管出现。Sox9是睾丸分化的必需因子,在睾丸索中表达,对Sox9使用免疫染色可以观察到睾丸索。[align=center][img=,350,415]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/13.jpg[/img][/align][align=center](A)8周龄标记Pax2的胚胎。[/align][align=center](B)(箭头)MD/WD连接。[/align][align=center](C)(D)9.5周龄的泌尿生殖系统。(箭头)MD尾端沿WD延长但仍未融合。[/align][align=center](E)10周龄的泌尿生殖系统。MD在底端融合(指针)并开始降解(箭头)。[/align][align=center](F)降解的继续。[/align][align=center](G)14周龄的泌尿生殖系统。输精管进一步发育(指针)。[/align][align=center](H)10周龄标记Pax2和Sox9的睾丸。[/align][align=center](I)10周龄标记Pax2的睾丸。[/align][align=center](J)14周龄的睾丸。[/align][align=center][img=,350,452]http://www.qd-china.com/uploads/Mandy/LaVision%20Application/14.jpg[/img][/align][align=center](A)10.5周龄标记Pax2的泌尿生殖系统。WD连续,MD已融合。(B)11.5周龄标记Pax2的生殖系统。(箭头)WD开始降解。(C)13周龄,标记Pax2的生殖系统。(箭头)子宫大小增加,WD显著降解。(右)MD顶端发育中的输卵管纤毛。(D)8周龄标记Pax2和Plvap的睾丸。(指针)微血管覆盖了睾丸和WD。而MD却没有血管形成。(E)10周龄的雄性胎儿中,MD没有微血管形成。(F)(G)10.5和13周龄标记Pax2和Plvap的卵巢。WD和MD均有致密的血管覆盖。 [/align][align=center][/align][b]总结:[/b]将免疫标记与3D成像技术结合,能够完好地保存器官的3D结构并使分辨率达到细胞水平,简单、快速、稳定、可重复,以上这些优势适合其应用于胚胎学,可用于研究遗传疾病或畸胎。此方法的限制条件主要在材料的获得,同时使用得抗体最大数量,抗体与实验方法的兼容性和大容量数据的存储。然而其应用的广泛程度依然不可限量。以后甚至可用于建立人类生长发育的3D图库。
作为第一位获美国麦克阿瑟基金会“天才奖”的华人女科学家,庄晓薇教授获得了许多重要成果,尤其是在生物物理显微成像领域,近期庄晓薇教授在《细胞》发表了题为“Breaking the Diffraction Barrier: Super-Resolution Imaging of Cells”,描述了超分辨率细胞成像的最新进展。传统光学显微镜受限于光的波长,对于200nm以下的小东西只能摇头兴叹。虽然电子显微镜可以达到纳米级的分辨率,但通电的结果容易造成样品的破坏,因此能观测的样本也相当有限。分子生物学家虽然可以做到把若干想观察的蛋白质贴上荧光卷标,但这些蛋白质还是经常挤在一块,在显微镜下分不出谁是谁。这几年高分辨率荧光显微镜跨越了一大步,使得研究者可以从纳米级观测细胞突起的伸展,从而宣告200—750纳米大小范围的模糊团块的时代结束了。比如利用光敏定位显微镜:PALM可以用来观察纳米级生物,相较于电子显微镜有更清晰的对比度,如果给不同蛋白接上不同的荧光标记,就能用来进一步研究蛋白质间的相互作用。庄晓薇研究组一直在研究如何用光敏开关探针来实现单分子发光技术。他们希望能用光敏开关将原本重叠在一起的几个分子图像暂时分开,这样就能获得单分子图像,从而提高分辨率。2004年庄晓薇研究组偶然发现某种花青染料具有光控开关,也就是说,通过使用不同颜色的光,可以随意地把它们激活成荧光状态和失活成黑暗状态。自此庄晓薇生开始研究这些光控探针,用它们来短暂地分离个体分子在空间上的重叠影像从而提高分辨率。之后这一研究组在Nature Methods杂志上发表文章,命名了一种随机光学重建显微镜(stochastic optical reconstruction microscopy, STORM)。使用STORM可以以20nm的分辨率看到DNA分子和DNA-蛋白质复合体分子。这一方法基于光子可控开关的荧光探针和质心定位原理,在双激光激发下荧光探针随机发光,通过分子定位和分子位置重叠重构形成超高分辨率的图像,其空间分辨率目前可达20nm。STORM虽然可以提供更高的空间分辨率,但成像时间往往需要几分钟,同时还不能满足活体实时可视的成像的需要,发展空间很大。近期庄晓薇研究组也在Science杂志上发表了他们的3D STORM成像成果,该技术的空间分辨率比以往所有光学3D成像技术的分辨率都要高出10倍。研究人员展示了用3D STORM成像技术拍摄的肾细胞内微管结构图和其它的分子结构图。随后,他们又进一步将该技术发展成了多色3D成像技术(multicolor 3D imaging)。除了庄晓薇研究组之外,另外一个华人研究团队在这方面也获得了杰出成果,来自哈佛大学的谢晓亮教授在单分子光谱检测及其在生命科学中的应用方面也作出了许多贡献,十年前,谢晓亮教授因为发布了CARS显微技术而引发了巨大轰动。这种技术通过一种叫做自发拉曼散射的现象来增强信号。在自发拉曼散射中,样品内的化学键能够改变通过其中的光的波长。更早使用的拉曼散射显微术要求的激光功率很高,而且有时候需要曝光时间长达一天。近期谢晓亮教授研究组将SRS显微技术与核磁共振成像(MRI)技术联合起来,从而能快速灵敏的捕捉活体组织中分子运动,比如血细胞挤压通过血管的过程。这项技术镜头分辨程度达到亚细胞水平,可记录下蛋白、脂肪及细胞内液的情况。由于SRS显微镜可以探测到原子间化学键的共振,因此无需荧光标记。研究人员认为SRS显微镜可以在肿瘤摘除手术方面有所帮助,加快手术进程。传统的样本分析需要花费约20分钟,SRS 显微镜几乎可以做到实时扫描。同多种常用的观察生物分子的技术相比,新型SRS显微技术优势明显:它能采集分析照射生物样本的近30%激光,比传统SRS显微镜高出30倍;并且不需要插入荧光标记,避免了绿色荧光标记蛋白质扰乱生物路径或压住较小生物分子的问题。此外,传统的红外显微镜空间分辨率太低,并需要给样本脱水;自然的拉曼显微镜需要很高的激光能量,整体耗时很长,在活样本中的应用受到限制;相干反斯托克拉曼散射显微镜在拍摄除了脂质以外的大多数分子时对比度不够,而新型SRS显微技术都能突破这些局限。(来源:生物通 万纹)
近日,德国IBIDI公司成功开发出一款超高分辨率生物显微镜。该公司宣称基于新型随机光学重建显微技术“(d)STORM”,利用该公司独创的特殊塑料底板“μ-Slides”可实现超高分辨率观察活体细胞。 STED,SIM,(F)PALM 和(d)STORM等新型光学显微技术可有效避免衍射极限,获得纳米级水平的超高分辨率成像。这些超高分辨率显示技术可应用到生物实验研究,观察了解组织细胞分子结构。IBIDI公司采用了创新性的含有亲水性膜涂层的塑料材质底板“μ-Slides”替代传统玻璃底板,首次实现了“活体细胞”超高分辨率观察。这种被成为“ibi-Treat”的亲水性膜涂层性能可以与标准的细胞培养瓶和培养皿相媲美。 IBIDI公司相关研发工作受到了德国联邦教研部《生命科学领域光学技术—基本细胞功能》项目的资助。
利用活细胞成像工作站进行细胞和基因的功能研究,是生物医学研究的最新趋势。固定细胞观察仅能提供固定瞬间细胞的静态信息,无法反映细胞在正常生理生化条件下的状态活细胞观察,对处于正常生理状况下的细胞进行全程扫描和记录,获得其连续、全面、动态过程。由于其显示的正常细胞动态的活动过程,很容易发现和确定细胞间相互作用和信号传导的过程,以及在活细胞水平上的生物分子间的相互作用,不仅可以解决长期以来悬而未解的问题,更为未来的研究提出新的问题,指出新的方向。
中国科技网讯 从一个受精卵发育成多种功能的胚胎,细胞要经过上千次分裂和复杂的排列重组。据物理学家组织网6月3日报道,霍华德·休斯医学研究院珍妮莉娅法姆研究学院开发出一种最新的成像技术,能以前所未有的速度和精确度看到这一过程,让人们能追踪胚胎成形时每个细胞在几天甚至几小时内的变化。相关论文发表在6月3日出版的《自然·方法学》上。 研究人员演示了一段约20小时的果蝇胚胎发育视频。在视频中,生物结构逐渐出现,从一小团简单的细胞簇慢慢变长,变成上万个细胞紧紧挤在一起的拉长的小胚胎,然后在新形成的肌肉收缩舒张下开始颤动,此时胚胎仅有半毫米长。此外,论文中还有一段果蝇胚胎中枢神经系统完整的发育视频,跟踪了单个细胞发育出感觉器官、脑叶及其他结构的过程,由于分辨率足够高,还能看到神经轴突尖端迅速变化。 发明该技术的珍妮莉娅法姆研究学院的菲利普·凯勒说,要理解一个单细胞怎样变成了复杂的组织,真实看到这一过程非常重要。传统光学显微镜速度太慢,无法跟踪细胞在生命初期的迅速变化,也容易破坏一个活胚胎,只能通过把多阶段、多组织的照片拼在一起,才能推测发生的变化,但“细胞分裂重组每次都不一样,这种观察方法可能会产生误导”。 新技术基于一种高速非侵入式光学显微镜,称为SiMView光层显微镜,能从4个角度同时拍摄图像,不仅能跟踪细胞运动,还能对发展过程进行数量分析。该显微镜由凯勒小组和德国的欧洲分子生物实验室合作开发,攻克了传统光学显微镜的两个难题:一是光源对样本造成的伤害,二是对海量数据进行处理分析。 大部分光源都会伤害细胞,使其中的荧光标记消失。研究小组设计的照明技术是一种激光扫描层,一次照射样本极薄的一层以减少伤害,由探测仪记录下被照亮的部分。光层来自两个相反方向,并用两个探测仪来探测荧光,照明与探测相结合,提供了4个不同的观察角度。不仅能避免由于光散射而造成的模糊,还将图像采集速度提高了50倍。 要让照亮样本和探测荧光在时间、位置上协调一致,时机吻合极为重要,光层交叉通过会造成图像模糊,发光间隔仅几毫秒。为了保持精度,SiMView还安装了实时调节的电子系统。 显微镜每秒会收集350Mb的数据,一个样本一天要产生海量数据,而不同条件或不同基因的发育对比实验,所要求的数据比这还要多好多倍。为此,研究人员开发出一种新的计算方法,能识别并跟踪显微镜视频中单个细胞并自动分析。这些都构成了拍摄活样本这一完整技术框架的必要组成部分。 凯勒表示,他们还将继续改进显微镜使计算过程更加有效。今后不仅能追踪胚胎中细胞的一代代世系,还可能控制发育以探索发育机制,并研究其他更大更复杂样本的发育过程。(常丽君) 《科技日报》(2012-06-05 二版)
微生物细胞大小的测定和显微镜直接计数 目的 1.1 学习接目测微计的校正方法, 了解血球计数板的构造和计数原理 1.2 学习使用显微镜测微尺测定微生物细胞大小, 掌握用血球计数板测定微生物细胞总数 的方法。 2 原理 微生物细胞的大小是微生物分类鉴定的重要依据之一。微生物个体微小,必须借助于显微镜才能观察,要测量微生物细胞大小,也必须借助于特殊的测微计在显微镜下进行测量。 显微测微计由镜台测微计和目镜测微计两部分组成。后者可直接用于测量细胞大小。它是一块圆形玻片(图7—1),其中央有精确等分到度,测量时将其放在接目镜中的隔板上。由于目镜测微计所测量的是微生物细胞经过显微镜放大之后所成像的大小,刻度实际代表的长度随使用的目镜和物镜放大倍数及镜筒的长度而改变,所以,使用前须先用镜台测微计进行标定,求出某一放大率下,目镜测微计每一小格所代表的长度,然后用目镜测微计直接测被测对象的大小。镜台测微计是一块中央有精确刻玻片(图7—1),刻度的总长为lmm,等分为100小格,每小格长10um,专用于对目镜测微计进行标定的。 3 材料 3.1 器械 显微镜、目镜测微尺、镜台测微尺,载玻片、盖玻片、血球计算板、擦镜纸、吸水纸、玻片架、肾形盘、洗瓶、接种环、酒精灯、火柴、滴管。 3.2 菌种 培养48h的啤酒酵母斜面菌体和菌悬液。 3.3 革兰氏染液 4流程 4.1 置目测微计→置台测微计→标定目测微计→测菌体大小→记录结果→用毕擦拭干净 4.2 检查计数板→稀释样品→加样→计数→计算→清洗 5 步骤 5.1 微生物菌体大小的测定 5.1.1 目镜测微尺的校正 5.1.1.1 更换目镜镜头 更换目镜测微尺镜头(标记为PF);或者取下目镜上部或下部的透镜,在光圈的位置上安上目镜测微尺,刻度朝下,再装上透镜,制成一个目镜测微尺的镜头。 5.1.1.2 某一倍率下标定目镜刻度 将镜台测微尺置于载物台上,使刻度面朝上,先用低倍镜对准焦距、看清镜台测微尺的刻度后,转动目镜,使目镜测微尺与镜台测微尺的刻度平行,移动推动器使两尺重叠,并使二尺的左边的某一刻度相重合,向右寻找另外二尺相重合的刻度。记录两重叠刻度间的目镜测微尺的格数和镜台测微尺的格数(图7-1C)。 5.1.1.3 计算该倍率下目镜刻度 目镜测微尺每格长度=镜台测微尺格数/目镜测微尺格数xl0um 5.1.1.4 标定并计算其他放大倍率下的目镜刻度 以同样方法分别在不同倍率的物镜下测定目镜测微尺每格代表的实际长度。如此测定后的测微尺的长度,仅适用于测定时使用的显微镜以及该目镜与物镜的放大倍率。 5.1.2 菌体大小的测定 5.1.2.1 将啤酒酵母制成水浸片。 5.1.2.2 大小换算 将标本先在低倍镜下找到目的物,然后在高倍镜下用目镜测微尺测定每个菌体长度和宽度所占的刻度,即可换算成菌体的长和宽。 5.1.2.3 求平均值 一般测量微生物细胞的大小,用同一放大倍数在同一标本上任意测定l0一20个菌体后,求出其平均值即可代表该菌的大小。 5.2 用血球计数板测定微生物细胞的数量 5.2.1 检查血球计数板 取血球计数板一块,先用显微镜检查计数板的计数室,看其是否沾有杂质或干涸着的菌体,若有污物则通过擦洗、冲洗,使其清洁。镜检清洗后的计数板,直至计数室无污物时才可使用。 5.2.2 稀释样品 将培养后的酵母培养液振荡振摇混匀,然后作一定倍数的稀释。稀释度选择以小方格中的分布的菌体清晰可数为宜。一般以每小格内含4~5个菌体的稀释度为宜。 5.2.3 加样 取出一块干净盖玻片盖在计数板中央。用滴管取1滴菌稀释悬液注入盖玻片边缘,让菌液自行渗入,若菌液太多可用吸水纸吸去。静置5—10分钟。 5.2.4 镜检 待细胞不动后进行镜检计数。先用低倍镜找到计数室方格后,再用高倍镜测数。一般应取上下及中央五个中格的总菌数。计数时若遇到位于线上的菌体,一般只计数格上方(下方)及右方(左方)线上的菌体。每个样品重复3次。 5.2.5 计算 取以上计数的平均值,按下列公式计算出每毫升菌液中的含菌量。 菌体细胞数(cfu/mL)=小格内平均菌体细胞数%26#215 400%26#215 104%26#215 稀释倍数 5.2.6 清洗 计数板用毕后先用95%的形酒精轻轻擦洗,再用蒸馏水淋洗,然后吸干,最后用擦镜纸揩干净。若计数的样品是病原微生物,则须先浸泡在5%石炭酸溶被中进行消毒,然后再行清洗。清洗后放回原位,切勿用硬物洗刷。 图7-2 血细胞计数板 6 结果 6.1计算出目镜测微尺在低、高倍镜下的刻度值。 6.2 记录菌体大小的测定结果。 6.3 计算样品中酵母菌浓度。 7 思考 7.1 为什么随着显微镜放大倍数的改变,目镜测微计每格相对的长度也会改变?能找出这种变化的规律吗? 7.2 根据测量结果,为什么同种酵母菌的菌体大小不完全相同? 7.3 能否用血球计数板在油镜下进行计数?为什么? 7.4 根据自己体会,说明血球计数板计数的误差主要来自那些方面?如何减少误差? 8 附录 目镜测数尺有两种:一是特制的目镜镜头,镜片上刻有50等分或100等分的刻度,使用时直接安装在显微镜上,取代没有刻度的目镜镜头;另一种是一块直径大约17.5 mm的圆玻璃片,其中央刻有50等分或100等分的刻度(图7-1A),使用时将该玻璃片安装在原来的目镜镜头上即可。由于不同的显微镜放大倍数不同,既使同一显微镜在不同的目镜、物镜组合下其放大倍数也不同,故目镜测微尺每格实际表示的长度随显微镜放大倍数不同而异。也就是说,目镜测微尺上的刻度只代表相对的长度。因此在使用前须用镜台测微尺校正,以确定在一定放大倍数下目镜测微尺的每格长度。 血球计数板是一块特别的厚玻片,玻片中央分剖成两个平面,上面各刻有9区,中央一区为计数室,供计数用(图7-2A),此区的长和宽各为1mm。中央平面两侧有小沟,小沟外有两条突起的平台,平台比中央平面高0.1mm,因此计数室体积为0.1mm3,容积为10-4ml。通常计数室分为25个大格,每大格又分为16个小格,每小格容积为4%26#215 10-6ml,即lml菌液容积相当于400万个小格体积。因此只要将细胞悬液注人计算室,计算出一定数量小格的平均菌数即可算出每毫升的细胞数。
请教大家:有人用AFM进行过细胞成像吗? 就是样品基底上生长细胞后,经过固定、脱水、干燥,能直接用AFM观察吗?(很多是经干燥后喷金,进行SEM观察的)要注意哪些问题呢?
[b]摘要[/b]在神经科学和神经外科中对活体大脑组织中神经元的成像能力是一项基本要求。尤其是需求一种具有测微计尺分辨率的大脑形态学的非侵入探针的开发,因为它可以在临床诊断上提供一种非侵入式光学活体组织检查的手段。在这一领域,双光子激光扫描显微镜(2PLSM)是一个强大工具,并已成为活体生物样品最小侵入性损害的高分辨率成像的标准方法。但是,(2PLSM)基于光学方法提供足够分辨率的同时,对荧光染料的需求妨碍了图像对比度的提高。本文中,我们提供了一种活体大脑组织以细胞分辨率的高对比度成像方法,无需荧光探针,使用光学三次谐波发生进行成像。我们利用细胞水平的特殊几何学和大脑组织的液体内容物来获取THG的部分相匹配,提供了一种荧光对比度机制的替代方法。我们发现THG大脑图像允许快速、无侵入性标记的神经元、白质结构、血管同时成像。而且,我们利用THG成像来引导微吸管指向活体组织中指定的神经元。这个工作是一个无标记活体大脑成像的主要步骤,并开启了活体大脑中激光引导的微注射技术发展的可能性。[b]材料与方法[/b]THG成像对于THG成像实验,我们使用了一台商业化双光子激光扫描显微镜([color=#ff0000]TrimScope, Lavision BioTec[/color])。光源是一个光学参量震荡器(Mira-OPO,APE),810nm泵浦光来自一个Ti:Sa锁模激光器(Coherent Chameleon Ultra II)。使用一个20X,0.95N.A水浸物镜(Olympus XLUMPFL-IR)将光聚焦到样品上。使用epidetection几何学描述THG实验。使用分光镜(Chroma T800lpxrxt)将背景散射THG光子从入射激光束中分离出来,用一个THG波段的带通滤波器(Chroma HQ390-70X)过滤。检测器是GaAsP高灵敏度光电倍增管(Hamamatsu H7422-40),400nm处量子效率为25%。最高分辨率成像(1024×1024像素)的典型获取时间为1.6s,我们用于目标定向实验的512 X 512像素成像时间为0.6s。 为与前向端口比较,使用了一个定制的投射端口。这个端口使用了一个1.4N.A油浸物镜,一个长波分光镜(UQG optics)和一个400nm的相干窄带滤波器。对于THG与SR-101联合实验我们用1200nm的OPO来同时产生两种信号。使用一个594nm带通和561nm隔断的分光镜将SR-101荧光从THG信号中分离。SR-101信号使用一个PMT检测(Hamamatsu H6780-20)。Nile Red和THG成像也是由1200nm的OPO同步激发。在这个案例中THG信号由投射端口测量,Nile Red荧光通过一个593∕40 nm的带宽滤波器检测。对于THG和GFP联合成像,用来泵浦OPO的Ti:Sa激光被调谐到970nm并耦合到显微镜中。组织块的GFP和THG信号使用同一个检测器连续测量。但使用一个不同的(561∕40 nm)带通滤波器检测GFP。使用显微镜软件(Imspector Pro)获取图像并以16bit 的tiff格式存储,图像分析使用Image J(MacBioPhotonics)进行。[b]主要结果[/b] [img=,575,768]http://qd-china.com/uploads/bio-product/21.jpg[/img]Fig. 1.无标记活体大脑的三次谐波显微成像(A)脑组织THG成像的epidetection几何学图示。插图:THG原理。注意基质中没有光学激发发生。(B) 树突处的聚焦激光束。通过将激光聚焦体积设定到树突直径的几倍大小,可以获得部分相匹配,显著的THG信号将会产生。(C)细胞体内的聚焦激光束。由于不好的结构相匹配状态,没有THG信号产生。(D) 小鼠大脑组织的活神经元成像。体细胞以暗影存在。 [img=,466,500]http://qd-china.com/uploads/bio-product/22.jpg[/img]Fig. 2.活体大脑组织的THG成像(A)小鼠皮质的THG图像 (B) 与A同位置的Nile Red染色的双光子荧光图像 (C) 大鼠凹陷的脑回THG图像(水平切面) (D)小鼠脑胼胝体THG图像,轴突纤维束被清晰得分辨。Movie S1是这个结构的一个3D投影 (E)小鼠大脑纹状体的THG图像(冠状面)。白质和神经元细胞清晰可见。明亮的粒状结构是垂直穿行图像平面的轴突纤维。Movie S2是这个区域的3D投影。(F)麻醉活小鼠的脑皮质上层的血管THG图像(z栈平均投影密度是50um) [img=,510,767]http://qd-china.com/uploads/bio-product/23.jpg[/img]Fig. 3. THG与双光子成像的叠加 (A)小鼠额前叶脑皮质的THG图像 (B)SR-101标记的星细胞双光子图像 (C) A、B的叠加提供了神经网络中星细胞的分布信息 (D) 小鼠额前叶皮质的THG图像 (E) GFP标记的生长抑素神经元的双光子荧光图像 (F)D、E的叠加显示了生长抑素神经元在脑前叶皮质结构中的分布 [img=,461,768]http://qd-china.com/uploads/bio-product/24.jpg[/img]Fig. 4.THG成像深度与自动化细胞检测 (A-C) 小鼠额前叶皮质的THG图像,成像深度分别为100, 200, and 300 μm 。每幅图像都是3个以2微米深度间隔独立图像的最大密度投影(D) 110 μm深度处神经元细胞的自动检测THG图像。细胞检测的运算法则定义为以红色显示的神经元 (E)红色标记:来自A-C的图像栈的细胞可见性对比。黑色标记:作为一个深度功能的平均检测到的THG密度。 [img=,531,768]http://qd-china.com/uploads/bio-product/25.jpg[/img]Fig. 5. 无标记目标定向和细胞活性(A)小鼠新大脑皮层的THG图像 (B) 在对一个神经元进行THG引导膜片钳之后同一位置的THG图像 (C)一个200um深处钳住神经元的大视野THG图像(5幅深度间隔2um的图像平均) (D)记录以100pA电流脉冲刺激B中被钳住的神经元的动力势训练 (E) 测量在THG扫描期间静止膜电位的改变。即使以最高的能量,也只观察到4%的电压变化,保持了完全的可逆性。0.8秒的周期相应于图像扫描时间。(F)最大观察到的静止膜电位Vs扫描时的激光能量。没有非线性效应出现。
[align=left][font=宋体][color=#374151]摘要:光学显微成像技术在神经科学研究中发挥着不可或缺的作用。文章将深入探讨两种主要的光学显微成像技术,即荧光显微镜和多光子显微镜,在神经科学领域的应用案例。我们首先介绍了这些技术的基本原理和发展历程,然后详细描述了它们在神经细胞成像、突触可塑性研究和脑功能成像中的应用。通过这些案例,我们展示了光学显微成像技术在神经科学研究中的重要性,以及它们对我们深入理解神经系统的贡献。[/color][/font][/align][font=宋体][color=#374151]关键词:神经科学、荧光显微镜、多光子显微镜、神经细胞成像[/color][/font][font=宋体][color=#374151]光学显微成像技术自17世纪以来一直在科学研究中扮演着重要的角色。随着技术的不断发展,光学显微镜已经成为许多科学领域的核心工具之一,尤其在生命科学和神经科学领域。文章将深入探讨光学显微成像技术在神经科学研究中的应用案例,重点介绍荧光显微镜和多光子显微镜这两种主要技术的原理和应用。[/color][/font][font=宋体][color=#374151]一、光学显微成像技术应用[/color][/font][font=宋体][color=#374151]1.荧光显微镜的应用[/color][/font][font=宋体][color=#374151]荧光显微镜是一种广泛应用于神经科学研究的工具,它使用荧光染料或标记物来可视化和研究神经系统的结构和功能。以下是荧光显微镜在神经科学研究中的应用案例,包括神经细胞成像、突触可塑性研究、脑疾病研究等方面。[/color][/font][font=宋体][color=#374151](1)神经细胞成像[/color][/font][font=宋体][color=#374151]荧光显微镜在观察和研究神经细胞的结构和功能方面发挥了关键作用。通过使用荧光标记的抗体或分子探针,研究人员可以可视化神经元的不同结构,包括轴突、树突、细胞核等。这有助于研究神经细胞的形态特征以及它们在不同生理条件下的变化。[/color][/font][font=宋体][color=#374151](2)突触可塑性研究[/color][/font][font=宋体][color=#374151]荧光显微镜在突触可塑性研究中也具有重要应用。突触可塑性是指突触的结构和功能如何受到刺激和学习的影响。通过标记突触相关的蛋白质或分子,研究人员可以实时观察突触的变化,如突触增强或突触抑制,以深入理解学习和记忆的神经机制。[/color][/font][font=宋体][color=#374151](3)脑功能成像[/color][/font][font=宋体][color=#374151]荧光显微镜在脑功能成像方面也具有潜力。通过将钙指示剂或光遗传学标记物引入神经元,研究人员可以实时监测神经元的活动。这种技术使我们能够理解大脑不同区域的活动模式,以及不同刺激下神经元的响应。这对于研究认知过程、行为和神经疾病有着重要意义。[/color][/font][font=宋体][color=#374151](4)神经干细胞研究[/color][/font][font=宋体][color=#374151]荧光显微镜也被广泛用于研究神经干细胞。通过标记和追踪神经干细胞的命运和分化过程,研究人员可以理解神经系统的发育和再生机制。这对于神经系统修复和治疗神经系统疾病具有潜在应用。[/color][/font][font=宋体][color=#374151](5)荧光标记的蛋白表达[/color][/font][font=宋体][color=#374151]荧光显微镜也可用于研究不同蛋白质在神经系统中的表达和定位。通过使用荧光标记的蛋白表达技术,研究人员可以观察不同蛋白质的分布和相互作用,从而深入理解神经系统中的信号传导和调控。[/color][/font][font=宋体][color=#374151](6)脑疾病研究[/color][/font][font=宋体][color=#374151]荧光显微镜在研究脑疾病方面也发挥着关键作用。研究人员可以使用荧光显微镜来研究神经系统疾病的病理机制,如帕金森病、阿尔茨海默病和精神分裂症。这有助于发现潜在的治疗方法和药物筛选。[/color][/font][font=宋体][color=#374151]荧光显微镜在神经科学研究中的应用是多方面的,涵盖了神经细胞成像、突触可塑性研究、脑功能成像、神经干细胞研究、蛋白质表达和脑疾病研究等多个领域。这一技术为神经科学家提供了非常强大的工具,帮助他们深入理解神经系统的结构和功能,以及与神经相关的疾病的机制。未来,随着技术的不断发展,荧光显微镜将继续在神经科学领域中发挥关键作用,为我们揭示神经系统的奥秘提供更多的洞察力。[/color][/font][font=宋体][color=#374151]2.多光子显微镜的应用[/color][/font][font=宋体][color=#374151]多光子显微镜(Multi-Photon Microscopy)是一种先进的成像技术,它利用非线性光学效应,如多光子吸收,为神经科学家提供了强大的工具,用于研究神经系统的结构和功能。相比传统的荧光显微镜,多光子显微镜具有许多显著的优势,包括更深的成像深度、较少的光损伤、更少的荧光标记物和更高的空间分辨率。以下是多光子显微镜在神经科学研究中的应用领域:[/color][/font][font=宋体][color=#374151](1)脑功能成像[/color][/font][font=宋体][color=#374151]脑功能成像是多光子显微镜的一个主要应用领域。这种技术允许研究人员实时观察活体动物的脑活动,包括神经元的兴奋与抑制、突触传递和脑区之间的相互作用。多光子显微镜能够提供高分辨率的三维图像,而无需使用荧光标记物。这对于研究大脑的基本功能、学习和记忆等过程至关重要。[/color][/font][font=宋体][color=#374151](2)钙离子成像[/color][/font][font=宋体][color=#374151]钙离子在神经元内起着关键的信号传导作用。多光子显微镜可以用于监测神经元内的钙离子浓度变化,这对于理解神经元的兴奋性和突触传递至关重要。通过使用荧光钙染料,研究人员可以实时观察神经元内钙离子浓度的动态变化,以及不同神经元之间的协同作用。[/color][/font][font=宋体][color=#374151](3)神经元形态学研究[/color][/font][font=宋体][color=#374151]多光子显微镜在研究神经元的形态学和结构上也具有独特的优势。它可以提供高分辨率的三维成像,允许研究人员详细观察神经元的分支结构、突触连接和细胞器的分布。这对于理解神经元的连接方式、发展和退行性疾病的机制至关重要。[/color][/font][font=宋体][color=#374151](4)活体动物模型研究[/color][/font][font=宋体][color=#374151]多光子显微镜也在活体动物模型研究中发挥着关键作用。研究人员可以使用这种技术观察小鼠、果蝇等模型动物的脑活动,从而研究不同物种的神经系统功能和行为。这对于神经药理学、疾病建模和药物筛选具有重要意义。[/color][/font][font=宋体][color=#374151](5)细胞内成像[/color][/font][font=宋体][color=#374151]多光子显微镜也可用于单个神经元或突触的细胞内成像。这允许研究人员观察细胞内的亚细胞结构、蛋白质运输和突触形成等过程。这对于研究神经元的分子机制和突触可塑性非常有帮助。[/color][/font][font=宋体][color=#374151]多光子显微镜的应用领域不仅局限于神经科学,还扩展到其他生命科学领域,如细胞生物学、免疫学和生物医学研究。其高分辨率和深层成像能力使其成为许多领域中不可或缺的工具。[/color][/font][font=宋体][color=#374151]尽管多光子显微镜在神经科学研究中具有巨大的潜力,但它也面临着一些挑战。其中之一是成像速度,尤其在观察大脑活动时,需要高速成像以捕捉快速的神经事件。另一个挑战是数据处理和分析,因为高分辨率、三维和四维成像产生了大量的数据,需要强大的计算资源和分析工具。[/color][/font][font=宋体][color=#374151]未来,我们可以期待多光子显微镜技术的不断改进和发展,以应对这些挑战。新的激光技术、荧光标记物和成像算法将继续推动这一领域的进展,为我们深入理解神经系统的复杂性提供更多的洞察力。多光子显微镜将继续在神经科学领域中发挥关键作用,有望帮助我们解决一些最具挑战性的神经科学问题。[/color][/font][font=宋体][color=#374151]二、光学显微成像技术在神经科学研究中的应用存在问题[/color][/font][font=宋体][color=#374151]光学显微成像技术在神经科学研究中的应用虽然具有众多优势,但也存在一些问题和挑战,这些问题需要科研人员不断努力来解决。以下是一些存在问题:[/color][/font][font=宋体][color=#374151]1.有限的成像深度[/color][/font][font=宋体][color=#374151]传统的光学显微成像技术受到光的折射和吸收的限制,导致成像深度受到限制。这在研究深层脑区时成为问题,因为光无法有效透过多层组织,导致深层神经元无法清晰成像。多光子显微镜已经在这一方面取得了进展,但仍然存在深度限制。[/color][/font][font=宋体][color=#374151]2.光损伤和毒性[/color][/font][font=宋体][color=#374151]荧光标记物和强光源在成像过程中可能对生物样本产生光损伤和毒性作用。这对于活体成像和长时间观察是一个挑战,因为它可能导致样本的退化和死亡。科研人员需要努力寻找更温和的成像方法和标记物,以减轻这些问题。[/color][/font][font=宋体][color=#374151]3.数据量庞大[/color][/font][font=宋体][color=#374151]高分辨率和多维成像技术产生大量的数据,需要强大的计算资源和复杂的数据分析工具。处理和管理这些数据可能是一个挑战,尤其是在长期实验和大规模成像项目中。[/color][/font][font=宋体][color=#374151]4.标记物的选择[/color][/font][font=宋体][color=#374151]合适的荧光标记物对于获得高质量的成像数据至关重要。然而,选择适当的标记物可能会受到限制,因为一些标记物可能会干扰样本的正常生理活动,或者不适合特定的实验条件。因此,需要不断开发新的标记物和成像方法。[/color][/font][font=宋体][color=#374151]5.解析度限制[/color][/font][font=宋体][color=#374151]光学显微成像的分辨率受到光的波长限制,通常受到绕射极限的限制。虽然一些超分辨率成像技术已经出现,但它们仍然无法突破光学分辨率极限。这可能会限制对神经系统微观结构的精确观察。[/color][/font][font=宋体][color=#374151]6.活体成像的挑战[/color][/font][font=宋体][color=#374151]对于活体成像,尤其是在大脑中,样本的运动和呼吸等因素可能导致成像失真。稳定和精确定位样本是一个技术挑战。[/color][/font][font=宋体][color=#374151]尽管存在这些问题,光学显微成像技术仍然是神经科学研究的不可或缺的工具,因为它们提供了独特的实时、高分辨率和非侵入性的成像能力。科研人员不断努力解决这些问题,通过技术创新和改进,光学显微成像技术有望继续为神经科学领域的研究提供更多洞察力。[/color][/font][font=宋体][color=#374151]三、下一步研究方向[/color][/font][font=宋体][color=#374151]基于上述问题,光学显微成像技术在神经科学研究中的应用仍然需要不断改进和发展。下面是可能的下一步研究方向,以解决这些问题:[/color][/font][font=宋体][color=#374151]1.改进成像深度[/color][/font][font=宋体][color=#374151]研究人员可以探索新的成像方法,如双光子显微镜和光学波前调制成像,以增加成像深度。此外,开发新的光学透明样本制备技术,如透明大脑样本技术,可以帮助克服深度限制问题。[/color][/font][font=宋体][color=#374151]2.减少光损伤和毒性[/color][/font][font=宋体][color=#374151]研究人员可以寻找更温和的成像条件,减少光损伤和荧光标记物的毒性。此外,使用先进的成像系统,如自适应光学成像,可以减小激光功率,同时保持高分辨率。[/color][/font][font=宋体][color=#374151]3.数据管理和分析工具[/color][/font][font=宋体][color=#374151]开发更强大的数据管理和分析工具,以处理庞大的成像数据。机器学习和深度学习方法可以帮助提高数据分析的效率,并自动检测和量化细胞和结构。[/color][/font][font=宋体][color=#374151]4.标记物的改进:寻找更多、更具选择性的标记物,以减少对样本的干扰。这可以包括荧光标记物的改进、发展新的基因表达标记和探测技术。[/color][/font][font=宋体][color=#374151]5.突破分辨率极限[/color][/font][font=宋体][color=#374151]进一步发展超分辨率成像技术,以突破传统光学分辨率极限,获得更高的细节分辨率。例如,结构光显微镜和单分子成像技术可以帮助提高分辨率。[/color][/font][font=宋体][color=#374151]6.活体成像技术改进:研究人员可以探索新的样本固定和稳定技术,以减小样本运动对成像的影响。另外,开发新的活体成像方法,如头部悬置成像和小型显微成像技术,可以帮助在动态活体条件下进行成像。[/color][/font][font=宋体][color=#374151]7.多模态成像[/color][/font][font=宋体][color=#374151]结合不同的成像技术,如光学显微镜与电生理记录、光学显微镜与功能磁共振成像(fMRI)等,以获得更全面的神经科学数据。[/color][/font][font=宋体][color=#374151]8.多尺度成像[/color][/font][font=宋体][color=#374151]开发多尺度成像方法,能够在微观和宏观水平上同时观察神经系统的活动,从神经元到整个脑区。[/color][/font][font=宋体][color=#374151]这些研究方向代表了改进和扩展光学显微成像技术在神经科学研究中的应用的可能途径。通过不断的技术创新和跨学科合作,神经科学家和工程师有望克服这些问题,提高光学显微成像技术的效能和应用广度,以更深入地理解神经系统的复杂性。[/color][/font][font=宋体][color=#374151]四、结论[/color][/font][font=宋体][color=#374151]光学显微成像技术在神经科学研究中的应用案例清楚地表明,这些技术在揭示神经系统的复杂性和功能中起到了关键作用。然而,这仅仅是一个开始,未来仍有许多挑战和机遇等待我们探索。例如,新的成像技术和荧光标记方法的不断发展将进一步扩展我们的研究领域。此外,将光学显微成像技术与其他分子生物学和生物化学技术相结合,可以更全面地理解神经系统的功能。[/color][/font][font=宋体][color=#374151]在未来,我们可以期待更高分辨率、更深层次的成像以及更多三维和四维成像的发展。这将有助于解决神经科学中的一些最具挑战性的问题,如神经网络的复杂性和神经退行性疾病的机制。光学显微成像技术将继续为神经科学研究提供有力的工具,推动我们对大脑和神经系统的理解不断深入。[/color][/font][font=宋体][color=#374151]参考文献:[/color][/font][font=宋体][color=#374151][1]高宇婷,潘安,姚保利等.二维高通量光学显微成像技术研究进展[J].液晶与显示,2023,38(06):691-711.[/color][/font][font=宋体][color=#374151][2]王义强,林方睿,胡睿等.大视场光学显微成像技术[J].中国光学(中英文),2022,15(06):1194-1210.[/color][/font][font=宋体][color=#374151][3]章辰,高玉峰,叶世蔚等.自适应光学在双光子显微成像技术中的应用[J].中国激光,2023,50(03):37-54.[/color][/font][font=宋体][color=#374151][4]曹怡涛,王雪,路鑫超等.无标记光学显微成像技术及其在生物医学的应用[J].激光与光电子学进展,2022,59(06):197-212.[/color][/font][font=宋体][color=#374151][5]关苑君,马显才.光学显微成像技术在液-[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]分离研究中的应用[J].中山大学学报(医学科学版),2022,43(03):504-510.DOI:10.13471/j.cnki.j.sun.yat-sen.Univ (med.sci).2022.0319.[/color][/font][font=宋体][color=#374151][6]陈廷爱,陈龙超,李慧等.结构光照明超分辨光学显微成像技术与展望[J].中国光学,2018,11(03):307-328.[/color][/font][font=宋体][color=#374151][7]安莎. 轴平面光学显微成像技术及其应用研究[D].中国科学院大学(中国科学院西安光学精密机械研究所),2021.DOI:10.27605/d.cnki.gkxgs.2021.000055.[/color][/font][font=宋体][color=#374151][8]杜艳丽,马凤英,弓巧侠等.基于空间光调制器的光学显微成像技术[J].激光与光电子学进展,2014,51(02):13-22.[/color][/font][font=宋体][color=#374151][9]莫驰,陈诗源,翟慕岳等.脑神经活动光学显微成像技术[J].科学通报,2018,63(36):3945-3960.[/color][/font][font=宋体][color=#374151][10]张财华,赵志伟,陈良怡等.自适应光学在生物荧光显微成像技术中的应用[J].中国科学:物理学 力学 天文学,2017,47(08):26-39.[/color][/font]
如何用普通生物显微镜拍清楚非小细胞肺癌细胞的细胞膜呢
生物显微镜观察细胞,光强对细胞状态有影响吗
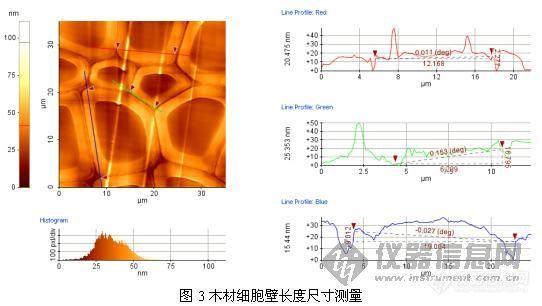
原子力显微镜(AFM)是我们学校新进的大型仪器设备之一。与光学显微镜及电子显微镜不同,AFM可利用微小探针“摸索”样品表面来获得信息。其成像原理决定了它具备其他显微技术所不具有的优点:受工作环境限制较少,可以在真空、气相、液相和电化学的环境下操作;可以对导体、半导体、绝缘体等多种样品成像,样品制备简单,且对样品的破坏性较小;具有原子级高分辨率,可得到观测表面的三维立体图像,并能获得探针与样品相互作用的信息。AFM可以观察许多不同材料的原子级别的高分辨表面形貌与结构,是一种新型的表面结构分析仪器。它的出现使人类在认识和改造自然方面进入一个新的层次,已被广泛应用于高分子材料、生物学以及生命科学等领域。近年来,研究人员也开始将这种新型的表面分析技术应用于木材微观结构的研究。这为人们进一步认识和了解木材微观世界,提供了一种有效的分析手段。目前在木材科学与技术领域内的研究内容主要包括两个方面:一方面是材料表面形貌、相结构的表征,在微米、纳米的范围内获取图像。另一方面是木质材料细胞壁的力学性能,如硬度、弹性模量和屈服强度的测量。我是实验室参加工程师培训的人员之一,由于课题的需要,我尝试利用AFM技术对杨木木纤维形态尺寸特性进行了测量,具体测量与分析方法如下:1材料与方法1. 1 试样制备试材为速生杨木,切削成横截面尺寸为5 mm×1 mm×5-8mm的木片,再用Spurr树脂进行包埋,然后用超薄切片机(LKB-2188,瑞典)进行表面抛光。1.2 测试方法测量时,将用双面胶固定在钢制样品垫上,再放置在原子力显微镜(AFM XE-100型,PSIA公司)的样品台上(磁铁固定)进行扫描。AFM主要参数设定如下:接触模式,扫描速度和扫描力分别为0.5Hz和1.08nN。2 图像处理图像扫描后还需要通过原子力显微镜配套软件(XEI 1.5)进行数据处理与分析。得到原始的形貌像之后,图像处理主要步骤如下:第一步是斜度校正(Slope Correction ),为的是消除样品倾斜或弯曲(极小程度)造成的图像失真。通过软件的拉平(Flatten )功能可以方便地消除x, y方向的图像倾斜。第二步是消除噪声,保证图像的真实性。第三步根据需要还可以对图像进行滤波、放大、灰度转换、改变像素以及切面、输出3D图像等操作图。处理图像结束后得到了相对真实的表面形貌图,再直接进行分析。图1是一组木材横切表面斜度校正处理前后的表面形貌图。3 杨木细胞壁特征参数测量杨木细胞壁特征参数测量是通过原子力显微镜配套软件(XEI 1.5)来实现的。测量原理与方法见图所示。其中图2和图3分别为AFM扫描的杨木表面形貌图及细胞壁厚度、长度尺寸测试图。通过测量可知,所测杨木细胞横截面的壁厚尺寸为1.026-4.082μm;壁长为2.195-21.004μm。这与前人的研究结论相一致。这说明原子力显微镜完全可以在微/纳米尺度下对木材的细胞形态特征进行测量。http://ng1.17img.cn/bbsfiles/images/2009/01/200901081623_128216_1615676_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/01/200901081625_128217_1615676_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/01/200901081627_128220_1615676_3.jpg
[url=http://www.f-lab.cn/microscope-incubators/mio.html][b]显微镜活细胞培养箱[/b]([b]Microscope Incubation Chamber[/b] )[/url]是欧盟专业为生物,生命科学,医学等科学实验而设计的[b]显微镜CO2培养箱[/b]和[b]显微镜活细胞培养系统[/b],它为科学家提供CO2浓度,O2浓度,温度和气流可调的环境用于显微镜观察实验。[img=显微镜活细胞培养箱]http://www.f-lab.cn/Upload/Mio2.jpg[/img][img=显微镜活细胞培养箱]http://www.f-lab.cn/Upload/MOFI-600_.jpg[/img][b]显微镜活细胞培养箱[/b]可匹配全世界所有品牌所有型号的商用显微镜,为实时活细胞实验提供理想可控的环境。科学家拥有这种显微镜活细胞培养箱可观察细胞内和细胞为发成的变化,以往,没有这种CO2显微培养箱时,科学家需要对死亡细胞染色后在显微镜下观察,现在, 这种显微镜CO2培养箱可以架设到显微镜上直接观察培养中的活细胞,它可以控制温度,气流,湿度,CO2浓度,氧气浓度等,为细胞实验创造出局部可控环 境[img=显微镜活细胞培养箱]http://www.f-lab.cn/App/Tpl/Home/Default/Public/images/grey.gif[/img]显微镜活细胞培养系统是全球唯一做到100%可控的封闭空间,其它同类显微镜活细胞培养箱的控制是被动的,随机的,热空气扩散从一个热源发出以维持设定 温度,而这套显微镜活细胞培养箱没有热空气回风口问题,加热空气从培养箱与显微镜结合处的预留缝隙中自然随机逸出,使得腔内的热空气和温度更加均匀,克服 了其它产品温度不均匀问题。即使电流不稳或振动干扰,热点也不漂移,规避了剧烈温度漂移对环境的干扰。[img=显微镜活细胞培养箱]http://www.f-lab.cn/Upload/Mio.jpg[/img][b][b]显微镜活细胞培养箱[/b]特色[/b]独特的热扩散机制,结合领先空气导入和回风机制,提供连续稳定的气流,腔内温度均匀,没有局部温度热点和冷点外部加热器可以远离这个显微镜CO2培养箱,消除电干扰和振动干扰超高温度精度控制和温度稳定性具有最小的温度漂移,达到缓解平衡点后,样品处的温度精度高达±0.1º C,腔内平均温度精度高0.2º C即使开门,领先的气流流型和温度均匀性控制能力也消除剧烈的环境温度变化人体工程学设计,操作方便,XY位移台和聚焦控制器外置于腔体外,大面积开门设计,更为方便操作操作样品,试管等超精密封闭温度探针实时探测内部温度CO2浓度和O2浓度可调高精度控制器控制气流,CO2,O2和温度,并显示当前监测到的浓度数据和温度数据显微镜活细胞培养箱:[url]http://www.f-lab.cn/microscope-incubators/mio.html[/url]
【网络讲座】:显微成像新技术在神经科学研究领域的应用【讲座时间】:2016-08-0910:00【主讲人】:徕卡神经科学产品专家,应用主管,2013年毕业于中科院生化细胞所,细胞生物学和神经生物学专业。攻读学位期间运用共聚焦、转盘共聚焦、微流控钙成像、电生理等技术研究钠离子通道,曾在国际期刊J. Neurosci、J. Biol. Chem.、Cell Res.等杂志上发表文章,在成像领域积累了非常丰富的经验。【会议简介】在过去的十年间,神经科学领域不断涌现出新的成像技术,从解析超微结构到构建大脑整体网络,从离体神经元成像到光学与在体电生理的结合,为科研难题提供了解决方案。此次Webinar中,徕卡神经科学产品专家苏博士将分享超高分辨率显微镜、双光子、光片及激光显微切割等先进的显微成像分析技术在神经科学中的应用实例,为大家的科研提供新的灵感。应用领域包括:神经生物学,细胞生物学等。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名截止时间:2016年08月09日 10:004、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/20065、报名及参会咨询:QQ群—2901017206、扫描下面的二维码,加入生命科学微信群,入群口令“生命科学”。http://ng1.17img.cn/bbsfiles/images/2016/07/201607071638_599649_2507958_3.gif
http://www.bioon.com/biology/UploadFiles/201203/2012030911450761.jpg细胞S-腺苷甲硫氨酸成像图,随着每个时间点蛋氨酸(右下)的增加,荧光强度也增高通过基因工程技术使得细胞表达一种经修饰(改造)过的RNA,又称Spinach,研究人员能对活细胞中的小分子代谢物进行成像,并观察它们随时间变化是如何改变的。每个细胞新陈代谢都会产生代谢产物。假如能得知产物生成效率的话,就能辨识如癌症状态下细胞代谢的异常或确定药物能否将细胞的代谢状况恢复到正常状态。康奈尔大学威尔医学院的研究人员说发表在3月9日的《科学》杂志上的相关论文详细描述了这种先进的技术方法,这一技术将有可能彻底颠覆以往对代谢组学的认识,提供数千种细胞内代谢产物的动态变化的化学指纹图谱。威尔康乃尔医学院药理学副教授Samie R. Jaffrey博士说:“动态观察到代谢产物的变化将为我们提供新的和强大的武器,方便我们了解代谢在疾病状态下是如何改变的,并帮助我们找到可以将它们恢复到正常水平的方法”。Jaffrey博士领导威尔康乃尔的其他三名研究人员共同完成了这项研究。他说:“细胞的代谢水平调控着细胞诸多功能,也正因为如此,代谢水平的变化可以是细胞内在特定的时间内发生什么变化的写照”。例如生物学家都知道,肿瘤细胞存在代谢异常,这些细胞对葡萄糖能源的利用存在异常并产生独特的代谢产物如乳酸,从而有不一样的新陈代谢过程。Jaffrey博士说:“能够看到这些代谢异常的话,就可以了解癌症的发生发展。但是到现在为止,测量活细胞中代谢产物一直非常困难。Jaffrey博士和他的团队展开的科学研究表明:可以用特定的RNA序列来检测细胞中代谢产物的水平。这些RNAs是基于能在细胞发出绿色光的Spinach RNA设计的。Jaffrey博士研究小组修改Spinach的RNAs,使得它们一旦遇到它们专属绑定的代谢物时就关闭,造成Spinach荧光开启。他们设计出了RNA序列以追踪细胞中五个不同代谢产物包括二磷酸腺苷、细胞能量分子ATP和参与调节基因活性的甲基化过程的SAM(S-腺苷蛋氨酸)水平的变化。他说:“在此之前,一直没有人能够实时观察到细胞中代谢产物水平是如何变化的”。Jaffrey博士说:“在活细胞中运用RNA传感器,研究人员能够测量单个细胞中的目标代谢产物水平随着时间的变化而发生的改变,你可以看到这些代谢物如何响应信号刺激或遗传变化进而发生动态变化的。你可以筛选出能使得这些基因异常发生正常化的药物,我们的一个主要目标是确定药物是否能使细胞的新陈代谢正常化。新技术克服了现行的用绿色荧光蛋白(GFP)标记活细胞以充当传感器的缺点。如果将绿色荧光蛋白和其他发光蛋白质融合到能结合某种代谢物产物的自然存在的蛋白质中的话,绿色荧光蛋白和其他发光蛋白质就可以用来充当代谢感应器。但在某些情况下,代谢产物与自然存在的蛋白质结合方式会扭转蛋白质结构,进而影响已经融入到这些蛋白质中的荧光蛋白。另外,对于大多数的代谢产物,并没有可用来融合绿色荧光蛋白以制造传感器的蛋白质。通过使用RNA作为代谢物传感器,这个问题引刃而解了。Jaffrey博士说:“关于RNA令人惊奇的是,你可以得到基本上你想要结合任何一种小分子代谢物的RNA序列。他们可以在几个星期就能生产出来”。然后,这些人造序列融合到Spinach中,并在细胞中以单链RNA的形式表达。Jaffrey博士说:“这种做法能让你得到任何你想研究的小分子代谢物,以及这些小分子代谢物在细胞内的情况”,他和他的同事们将这一技术的运用范围扩大到能检测活细胞内的蛋白质和其他分子。他补充说道:该技术可应用于多种疾病研究中。Jaffrey博士说:“我们非常有兴趣研究导致发育障碍如自闭症的大脑神经细胞内的代谢如何是变化的,有很多的机会能让这一新的工具发挥用处”。这篇研究论文的合著者包括威尔康乃尔医学院药理系Jeremy S. Paige博士、Thinh Nguyen Duc博士、Wenjiao Song博士。这项研究由美国国立卫生研究院的生物医学成像和生物研究所以及McKnight基金会资助。康奈尔科技企业和商业中心(CCTEC)已经代表康奈尔大学提出了这项技术的专利保护申请。Samie Jaffrey博士是Lucerna技术的创始人和科学顾问,并持有该公司股权。此外,Lucerna技术拥有上述描述技术的相关许可证。
现在大多数对细胞超微结构的观察多采用化学染色法固定、染色、脱水、包埋的前处理,电镜观察。想请教一下各位大虾,有没有什么好的技术能实现对活细胞的超微结构的实时动态观察啊?最好不要染色什么的处理,直接在生理状态下就能观察。需要国内能够买到的仪器,谢谢大家了。目前查了一下文献,好像原子力显微镜、相差显微镜说可以,但我看了一下成像,感觉不如电镜的分辨率高啊。还有共聚焦显微镜,需要使用特定的荧光探针。
[b][url=http://www.f-lab.cn/vivo-imaging/micron-iv.html]小动物视网膜成像显微镜Micron IV[/url]特点: [/b]可用于明场、血管结构和荧光(GFP,YFP,mCherry,CFP标记)成像。定制的最先进低噪音三芯片CCD:高灵敏度捕捉微弱的荧光。 近红外成像(可达700-900nm,最高到900nm)视网膜成像精度:小鼠4 μm,大鼠8 μm位滤光片轮,双回补灯及滤光片配置,更加灵活,包含荧光及近红外滤光片,提供亮场和荧光成像模式 实验台:可三维翻转及旋转,便于调整大小鼠眼睛角度清晰成像。[img=小动物视网膜成像显微镜]http://www.f-lab.cn/Upload/Micron-retinal-imaging.jpg[/img]小动物视网膜成像显微镜Micron IV可提供分辨率达4 μm的高清晰视网膜影像,且与荧光显微镜类似,可观察明视野和荧光(Ex. CFP, GFP, mCh erry等) 影像。方便的软件设计可直接从明场成像转换至荧光成像。[url=http://www.f-lab.cn/Upload/retinal-imaging-micron.jpg][img=小动物视网膜成像显微镜]http://www.f-lab.cn/Upload/retinal-imaging-micron.jpg[/img][/url][b]小动物视网膜成像显微镜Micron IV应用范围:[/b]荧光血管造影糖尿病视网膜病变视网膜母细胞瘤视网膜黄斑衰退症早产儿视网膜病变脉络膜新生血管小动物视网膜成像显微镜:[url]http://www.f-lab.cn/vivo-imaging/micron-iv.html[/url]
想问生物显微镜观察细胞,光强会对细胞状态有影响吗,有没有懂这方面的,麻烦说一下谢谢
摘要激光扫描共聚焦显微镜作为80年代发展起来的一种高精度分子细胞生物学分析仪器,具有组织细胞断层扫描、活细胞动态荧光监测、三维图像重建、共聚焦图像定量分析等先进功能,在近年的细胞凋亡这一研究热点中得到了大量创造性的应用。本文拟就对激光扫描共聚焦显微镜在凋亡的形态学、分子水平变化及重要生理过程三方面研究中的应用及其成果做一综述。细胞凋亡(apoptosis)是不同于细胞坏死的一种细胞主动死亡方式,并由特定的基因控制。凋亡细胞在形态上出现变圆皱缩、染色质浓缩边集、核碎裂、凋亡小体形成等变化,并最终由非炎症过程清除。由于细胞凋亡独特地影响着机体的细胞发育和代谢,在监测和清除肿瘤细胞与突变细胞等方面也可能发挥重要的作用,近年来受到了细胞生物学、分子生物学、免疫学等多学科的广泛关注。激光扫描共聚焦显微镜(laser scaing confocal microscopy, LSCM)是80年代发展起来的一种高精度分子细胞生物学分析仪器,辅以各类免疫荧光探针或荧光染料与被测物质特异性结合,不仅可观察固定的细胞组织切片,还可对活细胞的结构、分子和离子进行实时动态地观察和检测。在细胞凋亡的研究中,激光扫描共聚焦显微镜已被广泛地应用于形态学、分子水平监测及重要生理改变等各方面,其中不乏新颖之处,并获得了大量成果,以下将就此做一简单的介绍。激光扫描共聚焦显微镜与凋亡的形态学激光扫描共聚焦显微镜用点光源扫描标本的光学横断面,以代替普通光学显微镜所使用的场光源,并用探测针孔滤去离焦光线,所以消除了来自焦平面以外的衍射或散射光的干扰,可实现高清晰、高分辨率的组织细胞断层扫描。并且由于激光扫描共聚焦显微镜采用数字化成像,因而辅以一定的软件就能对图像进行定量分析及三维重建等操作。过去对细胞凋亡的形态学研究方法局限于活性细胞和组织切片染色、荧光镜观察,或者石蜡切片原位末端标记法。由于普通光镜的分辨率和清晰度有限,而电镜又显然不适合对凋亡这一复杂动态过程的监测,激光扫描共聚焦显微镜的应用使人们对细胞凋亡的形态学观察分析提高到了一个前所未有的新水平。细胞核核膜的破坏对于染色质聚集并形成凋亡小体起重要作用。lamin是构成核片层的蛋白质,位于核膜的内表面,由caase-6介导的lamin裂解可影响核膜的完整性。在McCall等的研究中,对果蝇卵子发生晚期的细胞凋亡现象进行了动态观察。以单抗mAb101标记其哺育细胞核内膜的laminDm0(哺乳类laminB的同源体),用激光扫描共聚焦显微镜加以观察。正常哺育细胞到11期时,染色的lamin呈弥散的雾状分布并围绕核周,而dcp-1GLC哺育细胞即使到了较晚的14期时,仍然显示界线明确的染色。可见dcp-1突变体在核lamin蛋白的酶切或解聚方面存在缺陷。细胞器Li 等在对C(6)-酰基鞘氨醇诱导胞内囊泡产生的研究中,在不产生中毒效应的情况下,加入10microM C(6)-酰基鞘氨醇以诱导鼠纤维母细胞(3T3-L1和3T3-F442A)凋亡。观察到囊泡的形成与C(6)-酰基鞘氨醇的诱导呈时间依从和剂量依从关系。大量小泡在其加入后8小时内出现,并且随时间而增大;大泡最终分布在核周,而小泡分布在细胞边缘。用抗-溶酶体膜蛋白抗体和共聚焦免疫荧光显微分析,证明增大的囊泡为晚期内吞体/溶酶体。另外,胞内的细胞器都有其适用的荧光探针,如高尔基复合体常用的探针有Dceramide、BODIPY ceramide等,内质网常用的有Dil、DiOC6等,经标记均可进行精细的观察。当然,激光扫描共聚焦显微镜在形态学中的优势更在于其对图像的三维重建功能,从而揭示过去只能在平面上显现的凋亡细胞在三维空间中的结构;而对细胞凋亡的动态过程,它可以用三维加时间的四维方式进行观察,来获取最逼真的形态学资料。凋亡过程中一些特征性的三维形态变化正期待着进一步具体的工作去发现。激光扫描共聚焦显微镜对凋亡细胞的分子水平监测随着分子生物学突飞猛进的发展,关于细胞凋亡分子机制的研究已有了很大的突破。细胞凋亡的信号传递途径及其调控涉及到大量的酶级联反应、生物大分子的空间转移等。而激光扫描共聚焦显微镜以其定性、定量、定时的优点,结合众多荧光探针的应用,成为了研究细胞凋亡分子水平变化的有力手段。DNA大分子DNA断裂以及染色质的异常凝聚,是细胞凋亡的关键,同时也是细胞核在细胞凋亡中具有标志性的变化。Columbara等报道将激光扫描共聚焦显微镜与原位TdT和Poll免疫荧光技术相结合,进而确定双链和单链DNA的断裂点。而在对细胞凋亡和细胞坏死区别的研究中,Kreel等在培养的K562细胞中加入放线菌素D以诱导凋亡,并对细胞的DNA片段进行了3’-末端标记。经激光扫描共聚焦显微镜观察发现K562细胞凋亡早期有大量DNA片段出现,且DNA片段弥散分布于除核仁外的细胞核区。伴随着凋亡的进展,细胞核内出现大量高标记密度的圆形小体。而采用NaN3或快速冻融法使细胞坏死,经激光扫描共聚焦显微镜观察证实,在坏死开始阶段并无DNA片段的出现,至少在坏死发生24小时后才有DNA片段产生。Caase家族Caases是一组高度保守的半胱氨酸蛋白酶,目前发现有11个成员。多数细胞凋亡是以Caase家族蛋白的激活并作用于其关键底物而实现的,而caases激活的关键又在于该家族蛋白间的级联反应,因此caases被认为是细胞凋亡的中心环节和执行者,成为研究的热点。Mandal等用激光扫描共聚焦显微镜对细胞凋亡中激活的caase-3的重分布进行了研究。用丁酸处理细胞后,观察到DNA-PKcs的裂解与caase-3的激活成正相关,而Bcl-2的过度表达则可抑制上述两个过程。同时还证明(1)激活后的caase-3重分布到核区,(2)裂解局部的DNA-PKcs和PARP(polyADP-ribosepolymerase,聚腺苷二磷酸核糖多聚酶),(3)裂解产物又被释放到核外的细胞液。caase-3的抑制物四肽DEVD-CHO又可抑制上述的三个连续的步骤。该研究提示:激活的caase-3在核内的重分布构成了丁酸所诱导的细胞凋亡中的一个重要凋亡信号。另外,在用激光扫描共聚焦显微镜对Q79诱导大鼠神经元凋亡的研究中,Sanchez等发现了Q79对caase-8的聚集和激活,而对caase-8的抑制则阻止了被诱导的细胞凋亡;加以Westernblot分析,还建立了caase-8的激活和某些神经退行性疾病(如舞蹈病)的联系。Grazyme丝氨酸蛋白酶grazyme为另一种重要的凋亡信号分子,对某些caase家族蛋白也有激活作用。Trapani等就证明了杀伤淋巴细胞利用穿孔素和grazymeB的协同作用来诱导靶细胞的凋亡,在其研究中通过激光扫描共聚焦显微镜观察到(1)50%细胞的胞核内快速聚集了以FITC荧光标记的grazymeB(最长7分钟,t1/2为2分钟),然后发生凋亡;(2)其它的细胞只有细胞液内有FITC-grazyme B的摄取,避免了凋亡。此间至少在13分钟后才有DNA碎片的出现,说明核内的grazyme B聚集出现在凋亡的执行阶段之前。并且通过对核内液的处理(加入70KDa FITC-dextran),间接观察到grazyme B的转移并非是因为核膜受caases的作用而破损,而是由于穿孔素的协同。其它以上的介绍显示,激光扫描共聚焦显微镜在检测活细胞酶活性动态变化方面有着突出的优势。实际上,对于细胞凋亡的分子机制这样一个极其复杂的课题,激光扫描共聚焦显微镜的应用远不只限于上述的几种离子和大分子,而是渗透到了大量的分枝课题中去。如在对重要的凋亡负调控蛋白Bcl-2的研究中,Beham等利用基因毒性损害(genotoxic damage)诱导细胞凋亡,并以Bcl-2蛋白抑制其凋亡过程。用激光扫描共聚焦显微镜和Immunoblotting观察显示,Bcl-2的作用在于阻止了诱导产生的p53蛋白向核内的转运。而Ohsawa等对独立于caase家族的另一种重要蛋白酶—组织蛋白酶进行了研究,用血清剥夺法诱导PC12细胞凋亡,并用激光扫描共聚焦显微镜监测了其精细超微结构改变过程和细胞内组织蛋白酶B和D的免疫活度的对比变化。又如,在人胰岛淀粉样多肽(hIA)的研究中,Hiddinga等用表达hIA的质粒转染COS-1细胞诱导凋亡,辅以免疫组化染色,用激光扫描共聚焦显微镜证明了hIA在细胞的内质网和高尔基复合体内呈簇状沉积,并与细胞
[b][url=http://www.f-lab.cn/cell-analyzers/puncher.html][b]单细胞转移分离系统[/b][/url]是可用于单细胞转移,单细胞分离和单细胞隔离,单细胞成像应用的多功能单细胞分离操作仪器,它可以实现从微孔芯片转移单细胞到细胞收集管中。单细胞转移分离系统[/b][color=#666666]集单细胞成像,单细胞隔离,单细胞选择功能于一体,自动聚焦成像。[/color][b]单细胞转移分离系统转移单细胞到Eppendorf微管,PCR微孔板或其它反应微管中,[/b][color=#666666]在隔离单细胞后,它可以对选定收集的细胞进行扫描并成像。[/color][b]单细胞转移分离系统[/b][color=#666666]采用Nikon Ti-2倒置荧光显微镜,配备自动扫描显微镜载物台,自动聚焦器件,高灵敏度荧光CCD相机和LED激发光源组建而成。[/color][img=单细胞转移分离系统]http://www.f-lab.cn/Upload/single-cell-isolation.JPG[/img][b]单细胞转移分离系统[/b]特点完全自动化,步进系统高质量单细胞荧光成像单细胞分离的效率超过90% 超过70%分离的细胞增殖 分离后兼容所有的单细胞的WGA工具包(放大器的‐1,picoplex,复制‐G)实惠微Wells基于硅微孔微腔。由薄膜封闭70µ m,井底直径(1µ m),包含一个单孔。样品流体进入威尔斯并从底部的孔隙中流出。单个细胞被拖着走。一旦单个细胞降落到孔隙上,流动停止,其他细胞就不会进入井内。有用的细胞被识别出来。选定的细胞穿孔从微孔到384孔PCR板或离心管等等。单细胞转移分离系统:[url]http://www.f-lab.cn/cell-analyzers/puncher.html[/url]
我们专题主要是研究胶原纤维,费伦有提过胶原纤维存在红外光传输的特征波段,不过在国内外研究极少提到有关细胞与细胞外基质的光传输,大都是提到有关化学反应的过程,现在是想找在胶原纤维的UV与IR光谱里那一个波峰,透过纤连蛋白(fibronectin)传输光讯号到细胞上的受体,之前是有找到有关细胞不含胞器(只剩肌动蛋白丝actin、整键蛋白integrin)也能移动,所以我们就假设细胞的移动可能是胶原纤维所操控,讲得有点多了,因为就只差这一点专题就完成了,可以请专家提出一些意见吗?谢谢[IMG]http://www.cella.cn/book/10/images/image006.jpg[/IMG]
我想做细胞的免疫荧光定位,应该选择什么样的显微镜和摄像机,才能拍到理想的照片
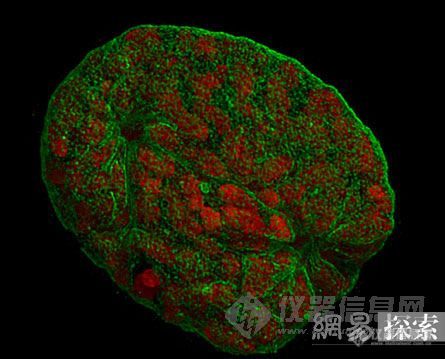
[img]http://ng1.17img.cn/bbsfiles/images/2008/06/200806161533_93273_1622715_3.jpg[/img]用三维结构照明显微镜拍下的细胞核影像[flash]http://www.youtube.com/v/Xib7yoZKspk&hl=en[/flash] 据美国《连线》杂志报道,一种新型的显微镜能够展示高清晰度、多色彩的三维画面,它比以前用的传统显微镜能揭示出更多的细节。此技术能区别细胞内彩色立体的组成结构,捕捉多色彩的三维立体细胞的画面,甚至能够给细胞不同的成份标记上不同的颜色。即使它们只相隔100纳米远,也能分别得清楚。这是一个前所未有的壮举。这一新的发展使得分子细胞生物学有了令人感兴趣的新视角。此研究成果发表在6月6日出版的《科学》杂志上。 德国慕尼黑路德维格-马克西米利安大学(Ludwig Maximilians University)完整蛋白质科学研究中心的赫恩里其劳恩哈德说:“我们为你先前没有看到和研究过的全新结构领域开启了大门。” 光学显微镜具有衍射局限性,其清晰度通常不足大约一半的可见光光波长度,约200纳米。如果二个物体靠近的距离小于这一数字,它们就无法将它们彼此识别出来。而使用更短波长的电子显微镜能看到更加细微的物体,但只限于黑白图像,且只能观察既薄又小的样本。如今,劳恩哈德小组研发的这种新型的显微镜――三维结构照明显微镜(3D-SIM)却打破了这些限制,可以给最细微的样本结构拍下亮丽的立体图像。 三维结构照明显微镜的原理是通过提取这些细微样本制造的干涉图,在电脑的帮助下重建其图像,即使在样本形状不能直接显现的情况下,此显微镜也能提取其形状有关的信息。劳恩哈德解释说,这就像你扫描一张打印照片时所出现的情况,你的眼睛不能分辨出此照片上非常细小的彩色点,但扫描仪能做到,但让你失望的是你看到了扫描图像上布满波纹和阴影。然而,这些干涉图确实包含有价值的信息,“在数学和电脑的帮助下,我们能利用这个来重建其图像。” 确实,劳恩哈德小组利用它在大约100纳米的分辨率下来观看到了哺乳动物老鼠的细胞,制造了高清晰度的图像,呈现出3种不同荧光颜色,而且DNA、细胞核膜和膜孔都分别加有标签。 此技术可以更加细致地研究染色体和其它细胞组成部件是如何在细胞空间里分布的,甚至还能区别DNA片段中哪些是活跃基因哪些是非活跃基因,这对研究衰老和疾病很有帮助。(尼特)
[b]摘要[/b]从首次感染部位向邻近基质的转移入侵是肿瘤发展过程中的关键步骤,研究成果较少。肿瘤入侵的原理以各种体外模型给出了实验性的表述;但是,体内的关键性步骤和机制仍然不清楚。这里,我们通过落射荧光成像和多光子显微镜建立了一个修正的皮肤折叠室模型来阐述关于HT-1080纤维肉瘤细胞的原位移植,生长和入侵。这种策略允许对作为独立细胞或者集体粘丝或者细胞团沿着富含胶原的细胞外基质和增补宿主组织包括纹状肌肉丝和淋巴管的肿瘤生长、肿瘤诱导血管形成和入侵进行重复成像。这个修正的窗口模型将适用于阐述肿瘤转移和入侵的机制,以及相关的实验性治疗。[b]材料与方法[/b]HT-1080双色纤维肉瘤细胞表达细胞质DsRed2和核组蛋白2B(H2B)-EGFP -EGFP (Yamamoto et al. 2004)培养在改良的鹰培养基(PAN Biotech GmbH, Aidenbach, Germany)中,补充10%的胎牛血清(Aurion, Wageningen, The Netherlands),盘尼西林和链霉素(都100ug/ml PAN)和潮霉素B(0.2mg/ml;Invitrogen, Carlsbad, CA, USA)在37%湿润的5%CO2的培养环境中。小鼠被用异氟烷麻醉并被稳定固定在37℃的温控平台上。使用一个落射多光子显微镜[color=red]([/color][color=red]TriM Scope, LaVision BioTec[/color][color=red])[/color],并配备了OPO装置(OPO APE, Berlin, Germany)用于1100nm波段的双光子激发,以及红外修正的20X/0.95N.A(Olympus)物镜。如果没有特定声明,EGFP,DsRed2和SHG的获取都是使用的832nm的激发光。由带通滤波器确定的检测光波段为400/40(蓝),535/50(绿),605/70(红),和710/75(红外)。以5um的步长对深达250um的成像深度进行顺序3D堆栈。通过向尾静脉注射4mg荧光葡聚糖对血管显影。在注射了淋巴归巢环肽LyP-1(100ug)之后活化的淋巴管被检测到。(Laakkonen et al. 2002)图像被使用ImageJ 1.40 g (W. Rasband, NIH), ImSpector 3.4 (LaVision Bio- Tec GmbH), and Photoshop CS 8.0.1 (Adobe Systems Inc.)重构和分析。以宽的平方X长Xπ/6计算肿瘤体积。有丝分裂和细胞凋亡的比例通过H2B-EGFP模式从每区域30到100个细胞中确定。[b]主要结果 [/b][img=,593,498]http://qd-china.com/uploads/bio-product/51.jpg[/img]Fig.1 在背侧皮肤褶皱室中HT-1080纤维肉瘤细胞的滴落和注射方法比较.6(c)、7(d)天后通过明场和落射荧光显微镜观察的细胞应用,生长位置(a,b)和宏观肿瘤形态。在建立的模型中,允许细胞悬浮液或者细胞球粘附到外科手术准备好的真皮组织表面上,获得了在真皮层与盖玻片(a.c)间的3D肿瘤生长。使用细针将细胞球注射进真皮中阻止盖玻片和真皮内产量增加间的反应(b,d)。标尺1mm(概图)和250um(细节)。 [img=,604,379]http://qd-china.com/uploads/bio-product/52.jpg[/img]Fig 2. 肿瘤生长阶段。 a 由落射荧光显微镜监测的移植瘤生长和入侵的时间进程。新生血管的插入,不存在(3天)和存在(7天)。标尺1mm。b 通过以day 1的体积进行归一化的肿瘤体积。mean+-SD(n=9)。c HT-1080移植肿瘤在6天的时候的肿瘤形态,血管化,分生和凋亡。使用多光子显微镜以激发波长1100nm(左)和832nm(右)获取的一个中央中流区域的3D重构。核形态包括了有丝分裂(白色箭头)和凋亡图(黑色箭头)。标尺50um。插图显示了前相(P)、中相(M)和后相(LA)以及凋亡图(A)。d 对时间依赖的分生和凋亡定量化。数据显示3个非依赖性肿瘤的10-25个独立区域的Mean±SEM。 [img=,617,642]http://qd-china.com/uploads/bio-product/53.jpg[/img]Fig 3. 近红外多光子显微镜显示环绕HT-1080双色肿瘤的肿瘤诱导产生血管及其结构。Z轴为一个6天大肿瘤的从肿瘤边缘(-50um)到肿瘤内部区域(-80um)(红色细胞质;黄色细胞核)。通过FITC-葡聚糖注射现实的密布血管(绿),先前存在的线形血管(绿色箭头)和不规则形状的新生血管(蓝色箭头)。胶原纤维(黑色箭头)和肌肉丝(白色箭头),通过二次谐波检测(灰度)。标尺50um。 [img=,583,768]http://qd-china.com/uploads/bio-product/54.jpg[/img]Fig 4. HT-1080双色细胞的原位入侵模型。a 注射后6天入侵类型的分类。缺少入侵(上,左)并且散布单个细胞(上,右;白色箭头),散射的或者紧密地丝状整体入侵(下图)。标尺250um。 b 45个连续的非依赖性肿瘤的按中所分入侵模式的频率。11天时,沿着纹状肌肉纤维集体入侵丝的定位。标尺100um。d 单一细胞侵入脂肪组织随后进行分散的,部分整体的入侵。对照-少量圆的脂肪细胞(星号)被HT-1080细胞包围。1100nm的激发光来检测遍布的血管(Alexa Fluor 660-dextran,红色),,肿瘤细胞质(绿色假彩),SHG(灰度);832nm用于肿瘤细胞核(白色)。标尺100um。[img]http://qd-china.com/uploads/bio-product/55.jpg[/img]Fig 5. HT-1080细胞沿淋巴管的入侵。a 由多光子显微镜对边缘而非肿瘤中心的活化淋巴管产生的单幅图片。用FITC连接的LyP-1缩氨酸来检测。深度已标明在图上(um)。b 3D堆栈投影表明淋巴管内(白色箭头)和外淋巴管入侵(黑色箭头)。标尺100um。