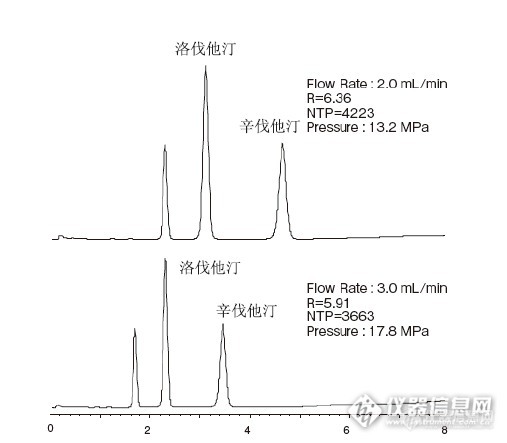
近期,国内仿制药物的一致性评价工作开展的如火如荼,辛伐他汀作为重要品种也受到十分关注。2016年5月26日,国家食品药品监督管理总局发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告,明确规定2018年底前须完成仿制药一致性评价品种目录,共计289个化合物,其中辛伐他汀位于第91个。 辛伐他汀是洛伐他汀的甲基化衍生物,由美国默克公司研制并于1988年首次上市,是目前全球应用最广泛的5个他汀类药物之一。国内生产各种剂量剂型的辛伐他汀片、胶囊的药企约有178家,是口服降血脂药物的重要品种。 生物等效性试验的分析检测方法通常是利用三重四极杆质谱仪([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS)来测定血浆中的药物浓度来进行的。[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS的定性定量能力都非常好,同时为了满足生物等效性试验中样品分析的快速性,通常希望下能够进行准确定量的前提下,分析方法时间越短越好。 Kromasil采用3.5μm颗粒大小的色谱填料的短色谱柱2.1*50mm,开发了血浆中辛伐他汀的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS的快速检测方法,在3.5min内能够完成一个样品的检测,并能与洛伐他汀完全分离,非常适合于BE研究方案中样品的检测。[b]相关图在附件~[/b]
辛伐他汀,在MS/MS条件下(AB400,thermo TSQ)主要是加钠峰(m/z 441),而纠结于辛伐他汀钠(分子量458.6),现在是正离子条件下,也是有441的峰,理论情况下,应该是m/z 437,可是现在这个峰基本不强,为什么?各位仁兄姊妹提点建议啊
辛伐他汀,在MS/MS条件下(AB400,thermo TSQ)主要是加钠峰(m/z 441),而纠结于辛伐他汀钠(分子量458.6),现在是正离子条件下,也是有441的峰,理论情况下,应该是m/z 437,可是现在这个峰基本不强,为什么?各位仁兄姊妹提点建议啊
辛伐他汀(simvastatin)是他汀类(statin)的降血脂药物,是土曲霉发酵产物的合成衍生物。可抑制内源性胆固醇的合成,临床用于治疗高胆固醇血症,冠心病。http://ng1.17img.cn/bbsfiles/images/2016/10/201610111122_613742_2222981_3.jpg以下为使用CAPCELL PAK MGII色谱柱,按照2015年版《中国药典》对辛伐他汀进行分析所得结果,供参考。http://ng1.17img.cn/bbsfiles/images/2016/10/201610111350_613747_2222981_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/10/201610111351_613748_2222981_3.jpg
辛伐他汀(simvastatin)是他汀类(statin)的降血脂药物,用于控制血液中胆固醇的含量以及预防心血管疾病。辛伐他汀是土曲霉发酵产物的合成衍生物。本品可抑制内源性胆固醇的合成,为血酯调节剂。临床用于治疗高胆固醇血症,冠心病。目前,降血脂类药物品种众多,而他汀类药物是降脂药市场的绝对主导,辛伐他汀又是其中的主力。目前,中国有许多家药厂在生产辛伐他汀。迪马科技技术部用Inspire (33 mm*4.6 mm,3 μm)的柱子做了相应的实验以及柱寿命测试实验。结果符合药典要求,并且,在有关供试样品浓度(高浓度)下连续进样300针,结果仍符合药典要求.http://ng1.17img.cn/bbsfiles/images/2011/10/201110211715_325595_1987954_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/10/201110211715_325596_1987954_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/10/201110211716_325597_1987954_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/10/201110211716_325598_1987954_3.jpg附件为辛伐他汀(有关物质)的测定及相关产品
领导希望能探索出一个流动相,可以对辛伐他汀,辛伐他汀铵盐,盐酸环丙沙星,环丙羧酸用一种流动相进行预检,以确定其有关物质情况,有没有人做过这方面的研究,求帮助
本文采用原子吸收光谱法测定辛伐他汀药中锂含量的方法,具体研究样品的溶解方法、仪器的测定条件等,通过实验确定方法的检出限及定量限,采用工作曲线法得出实验结果。方法的线性范围是0.0~0.80μg/mL,检出限为0.030μg/mL,定量限为0.10μg/mL。
化学品名称:辛伐他汀。货号:81047:Inspire 3μm C18, 33 x 4.6mm。今日两位版友答对,就不抽奖了。[color=#ff0000]恭喜活到九十 学到一百和xiahuanihao每人获得3钻石币;[/color][align=center]=================================[color=#ff0000]活动规格[/color]====================================[/align][align=left][color=#ff0000][b]【活动时间】[/b]:每个工作日10:00-15:00[b]【活动内容】:[/b]根据迪马产品资料:《药物检测应用文集》,每日会出一个化药或中药名称标题,版友根据标题找出相应迪马产品,将从回答正确者中利用抽奖软件抽取以下奖项。[/color][/align][align=left][color=#ff0000]【[b]活动奖励】[/b]:一等奖:3个钻石(2人),二等奖:2个钻石币(3人),三等奖:1个钻石币(5个人)。[/color][/align][align=left][color=#ff0000]【[b]注意事项[/b]】:一定要在迪马产品资料[color=#ff0000]《药物检测应用文集》中[color=#ff0000]找出相应迪马产品。[/color][/color][/color][/align]

今天电脑连续故障,实在抱歉,现在才发布题目如题:迪马科技辛伐他汀专用柱的名称和规格是?答案:Inspire C18 3μm, 33 x 4.6 mmPS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。【奖励】一等奖(3钻石币):dahua1981(注册ID:dahua1981)-1楼二等奖(2钻石币):吕梁山(注册ID:shih20j07)-3楼三等奖(1钻石币):千层峰(注册ID:jxyan)-5楼幸运奖(2钻石币):sixingxing(注册ID:v2889187)积分奖励:回答正确但不是前三名及幸运奖的版友奖励10个积分http://ng1.17img.cn/bbsfiles/images/2015/05/201505221505_547079_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/05/201505221505_547080_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/05/201505221505_547081_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/05/201505221505_547082_1610895_3.jpg
对于药品来说,药品说明书就如同人的“出生证明”一般,是药品上市时就随身携带的,包涵药品最基本、最主要的信息。教会患者如何更好、更快、更准确地看懂药品说明书,就从这份药品“出生证明”如何产生说起吧。 首先,如同出生医学证明是婴儿的有效法律凭证一样,药品说明书是在药品注册时由申请人(药品生产企业或者研发者)提出,由国家食品药品监督管理总局(CFDA)审核批准的具有法律效力的文件,是上市后药品使用的依据。 1.“起名” 在药品说明书的【药品名称】项下,包括了通用名称、商品名称、英文名称和汉语拼音。通用名称是药品的法定名称,是在全世界都可以通用的名称,商品名称是生产厂家或企业的产品注册商品名(品牌名)。如果将通用名称比作“学名”的话(比如盐酸氟西汀,抗抑郁药),那么商品名称就像是企业给孩子取的爱称(比如商品名“百优解”)。 此外,我们还能通过药品的通用名称,发现药品属性的小秘密,比如以“他汀”为后缀的药物(如洛伐他汀、辛伐他汀、普伐他汀、阿托伐他汀等)属于他汀类药物家族,具有降血脂的作用,但像同一家族的兄弟一样,它们之间又各有差异。 2.“内在”与“外貌” 药品生产者需要通过实验确证,在药品说明书【成分】项中注明药品的化学信息、中药中各味中药的组成,特别是在患者同时服用多种药物时需要关注“成分”信息,可以避免重复用药。而【性状】则描述了药品的“外貌”与“气味”,药品实物与说明书中性状的对照,可作为药品真伪、是否变质的一个判断依据。 3.“性能测试” 药品说明书的【功能主治】/【适应症】、【用法用量】、【不良反应】、【禁忌】、【注意事项】、【相互作用】、【临床试验】、【药理毒理】、【药代动力学】等内容是由众多药物学家、药理学家、药化专家、医生等专业技术人员通过一系列符合法规、标准和原则的药理学、毒理学、药效学、药物动力学、生物药剂学、药物临床试验,以及药品上市后监测等得到的药品安全性、有效性的重要科学数据和结论。 【功能主治】/【适应症】告诉我们药品可以用于“做什么”,在治疗哪种疾病或者改善缓解哪些症状方面具有“特长”,而【药理毒理】则向我们解释了药品“为什么”能产生这些作用的机理机制。 【用法用量】说的是“怎么用、用多少”,而【药代动力学】则是提示药品在体内吸收、分布、代谢、排泄的情况,为药品“为什么”这样用提供更为详细的实验依据。 【不良反应】俗话说“是药三分毒”,就像是一个人不可避免的总会有缺点一样,不良反应是指药品在正确使用的前提下,也可能出现与治疗目的无关的有害反应。 【禁忌】项是为了避免药物使用给人体带来的损害,明确告诉大家哪些人不能用、哪些事不能做;【注意事项】则是提醒在使用药物过程中我们需要小心注意的内容。 总体上说药品说明书主要包涵了上述内容。写好药品说明书并不是一件容易的事。首先,药品说明书是研究出来的,不是“写”出来的。药品说明书中的每一句话都必须有科学数据作支撑。其次,药品说明书的“雅”与“俗”是十分难以把握的。写得太专业了,一般患者看不懂;写得太通俗了又往往说不准确。这是一个让全世界的药品研发和监管者都十分头疼的事情。有的采取两个版本,专业版本给医生看,通俗版本给患者看。再次,药品说明书不是一成不变的。随着研究的深入和人们认知水平的提高,应不断修订完善。随着我国药品研发水平的提高和药品监管能力的增强,食品药品监管部门将积极探索,规范和完善药品说明书的审批和修订工作,更好地服务于医生和患者。 药品说明书是指导临床正确用药的重要依据,对于安全、合理地使用药品具有重要作用。http://www.sfda.gov.cn/WS01/CL0051/151743.html
据新华社伦敦电 (记者刘石磊)英国医学杂志《柳叶刀》网站19日刊登一项新成果说,主要用于降血脂的他汀类药物可能对多发性硬化症患者有益,帮助他们减缓脑萎缩,缓解相关病情。 多发性硬化症是造成瘫痪的一大病因,患者大脑和脊髓中的神经受损,导致运动能力、平衡能力和视力下降。据介绍,约有一半患者在患病约10年后,进入症状更为严重的后期阶段,目前尚没有专用药物能有效缓解这一阶段的病情。 英国伦敦大学学院等机构的研究人员报告说,他们共征集了140名多发性硬化症患者参与第二期临床实验,这些患者均已进入较严重的患病后期。研究人员将他们随机分为两组,在为期两年的实验中,一组患者每天服用80毫克辛伐他汀,另一组则只服用安慰剂。 定期脑部扫描发现,与对照组相比,服用辛伐他汀的患者脑萎缩速度平均减缓约43%。包括辛伐他汀之内的他汀类药物目前广泛用于降血脂,减少心血管疾病风险。研究人员推测,此类药物可帮助抵抗炎症、保护神经系统,这也许是其有助于缓解多发性硬化症的原因。 不过研究人员强调,这项研究成果只是对他汀类药物这一作用的初步验证,不应夸大其效果。下一步他们将征集更多参与者,开展更大规模的临床试验。来源:中国科技网-科技日报 作者:刘石磊 2014年03月22日
我们每次出去抽样药品,一般是先看后查,针对可疑品种做进一步的筛查。比如使用简单快速的理化反应、[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]扫描、等等。上个月在广州召开的第一届全国药品快速检测研讨会,又出现了一种新的筛查方式,就是利用拉曼光谱。不过设备比较昂贵,估计短时间在国内难以推广开来。 针对[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]扫描,我们使用的模型多数是针对化学药品,其中比较有用的(也可能是造假比较多的)是针对抗生素类药品和部分化学药,至于中药材和中成药基本上没有模型。 之前的一次专项检查中,我们也使用过补肾壮阳类中成药和降糖类中成药的非法添加模型(中检所建的试用模型),主要是筛查枸橼酸西地那非和盐酸二甲双胍,不过用的结果不尽如人意。 [url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url],个人感觉其实是很有用的,也许在定量检测方面没有其他光谱仪器、或者色谱仪器那么准,但是在抽样现场筛查中,可以做到准确快速。最近单位领导又要我们新的模型,真不知道该做些什么(药品方面)。现在市场上造假可能比较多的是补肾壮阳类、减肥类、降糖类、降脂类药品,所以我基本上也就是从这几个方面考虑的,不过有些标准物质、或者原料药很难买到。 第一、补肾壮阳类。用于治疗ED(勃起功能障碍的英文缩写)的“那非”类药物有西地那非、伐地那非、他达那非等药品,不过这类药品应在医生指导下使用,否则会有很严重的副作用。不法分子为利益驱使,在中成药里添加此类西药,并且冠以无毒无副作用的帽子。不过西地那非、伐地那非、他达那非的标准品,或者原料药比较难买到,朋友们有线索的欢迎给俺们提供一二。 第二、减肥类食品,或者药品中,一般是添加西布曲明。 第三、降糖类,主要添加格咧本脲、格列齐特、格列吡嗪、罗格列酮、盐酸二甲双胍、苯乙双胍等药品。 第四、降脂类,主要有他汀类,如辛伐他汀、普伐他汀、氟伐他汀、阿伐他汀;贝特类:常用的贝特类降脂药包括微粒化非诺贝特(力平脂)、苯扎贝特(必降脂)、吉非罗齐(诺衡洁脂);烟酸类:国内有普通型烟酸及阿西莫斯;胆酸酯螯合剂:常用药物包括考来烯胺(消胆胺)、考来替泊(降胆片)。 这些都是在经常在保健食品,或者中成药中非法添加的西药,想用[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]把它们都筛选出来,我感觉比较困难,也不知道从哪里下手。欢迎朋友们给点你们的建议和意见。顺便说一声,有相关标准品,或者原料药的信息给点,有的标准物质,尤其是治疗ED类的很难买。 此外,我还有一个想法是用近红外来检测冬虫夏草。大家都是现在的冬虫夏草价格被炒的几十万一公斤,所以造假现象比较严重。由于它又是贵重药品,所以去检查的时候也不能破坏别人的东西(赔不起呀!),朋友们帮我想想近红外可以筛查吗?
食药监办食监三函〔2014〕235号河北省食品药品监督管理局: 你局《关于非法添加药品酚酞、氟西汀违法行为定性的请示》(冀食药监〔2014〕24号)收悉。经研究,现函复如下: 非法添加的非食用物质不仅限于《食品中可能非法添加的非食用物质名单》和《保健食品中可能非法添加的物质名单》(第一批)中所列物质,酚酞、氟西汀也属于非法添加的非食用物质。 国家食品药品监督管理总局办公厅 2014年5月21日
9月22日,上海市药监局通报,上海市第一人民医院用于注射进而导致病人眼部不适的4瓶Avastin药品为假药。从而揭开了未经进口审批的高档药品走私进入正规医院的灰色事实。 近日,《每日经济新闻》记者深入调查,发现国家未批准进口的药品流入内地,是通过医生涉嫌参与药物流通;香港药房邮递;医药公司代表走私3大灰色路径。路径1:医生涉嫌参与药物流通 广州某眼科教授告诉《每日经济新闻》记者,其实安维汀在内地很多的眼科医院也都在使用,只是国家药监局没有批文,从正规的医药公司处也就买不到,有的是从境外去拿,有的是通过别的一些药商进。 根据上海市食品药品监督管理局通报,上海市第一人民医院和瑞安诊所均涉嫌假药案。瑞安诊所即为瑞安肿瘤特需中心,由香港安美医院与瑞金医院合资合办。在该诊所的八项治疗药物中,便列有Avastin药物。据悉,Avastin已经在香港上市销售多年,拥有合法资质的肿瘤医生均可购买此药。 而此前,曾有权威人士向《每日经济新闻》记者透露,药物是经在上海拥有职业医师资格的香港籍医生从香港带入,进而流入了第一人民医院。 香港安美肿瘤医院有两名香港医生在上海瑞安肿瘤特训中心看专家门诊,并同时在香港安美肿瘤医院从事治疗工作。药物是否由这两位专家带入,目前尚不得而知。路径2:香港药房邮递进入内地 有一位不愿意具名的患者告诉《每日经济新闻》记者,今年他也曾在一家三甲医院的医生的介绍下,在香港祺昌药房购买过内地未上市的药品。他还表示,他在该药房的网站上同样看到有Avastin药品的买卖。“香港那边会提供内地的银行卡账号,然后就会帮我们快递过来。” 《每日经济新闻》记者调查发现,祺昌药房为在香港政府注册的药房。在该药房的网站上可以看到,该药房从事赫赛汀 (herceptin)、安维汀(Avastin)、拉帕替尼(tykerb)等进口肿瘤药品的销售,并称可以为内地顾客提供保温箱加液体冰袋密封的邮递服务,可保持72小时低温环境。然而,记者致电该药房,却始终无人接听。路径3:医药公司代表走私 《每日经济新闻》记者发现,该药品在网络上有很多医药公司均有销售,药品售价从2000元到5000元不等。 《每日经济新闻》记者与网上一家医药公司联系,工作人员表示,Avastin药物该公司有售,100mg的价格为4300元,从北京库房可以低温保存邮递至上海,然后自己去长途车站取货。“我们有24小时的保温箱,自己发货,保证24小时内把药品送到你手上。” 而此前,有医药代表在接受媒体采访时,内地销售的Avastin药品大部分是由境外走私进来的。
今年6月底前后,跨国药企美国默克公司降胆固醇药舒降之(辛伐他汀)和全球药业老大辉瑞公司的抗抑郁药左洛复(舍曲林)先后失去专利保护权,去年这两种药品全球销量分别为44亿美元、34亿美元。同时,包括诺华的兰美抒、赛诺菲安万特的思诺思、百时美施贵宝的普拉固和葛兰素史克(GSK)的枢复宁等在内的全球多个重磅药品,均将在两年内结束其专利保护期。有数据显示,今年年内将有全球年销量约230亿美元的专利药专利到期,而到2008年之前,全球专利到期药品的总价值将超过800亿美元。 全球专利药的集中到期,将给以仿制药为主的中国药企提供巨大商机,国内药企无论在仿制药开发、原料供应还是制剂生产方面都面临很多机会。 研发机构、药企提前“盯”上到期专利药 美国一项名为《全球非专利处方药市场》的最新报告称,未来4年超过30种药物面临专利到期的命运,全球非专利处方药销售将快速上扬,从2005年的282亿美元增至2010年的480亿美元。2004年非专利处方药市场即达到253亿美元,2005年增长了11.2%.预计未来数年内该市场仍将以近似的增速稳定增长。在未来数月内,畅销药物如络活喜、帕罗西汀专利均将陆续到期。对于这一市场空间,业内分析,最先受益的将是靠开发仿制药生存的中国药品研发机构,他们的生意将显得日益兴隆。 “到期专利药的仿制开发在国内十分普遍,包括药厂自己的研究所在内,全国至少有6000个药品研发机构都提前在做类似的事情。”研发型企业广东固志医药科技有限公司总经理吴智南告诉记者,目前委托他们做这种开发的有10多家药企,他们正在对20多个专利即将到期的药品进行开发,主要是根据其已公开的专利技术知识,研究药物的合成路径。吴智南称,一般开发这样的药品要花9个月左右的时间,每个品种收取研发费用约50万元。 其实,与收益相对稳定的研发型企业相比,药厂面对的专利药到期市场无疑是一场苦战。“我现在主要还是生产抗菌类普药,暂且不会考虑去做到期专利药仿制。”广州诺贝华乐制药公司总经理许守良称,专利到期药的研发成本并不高,但报批手续特别烦琐,没有一定渠道很难拿到批文。“往往有上百家药厂去开发一个品种,国内厂商利润已非常低,竞争近乎惨烈。”做药品研发近20年的吴智南认为,这种过度竞争的模式他并不看好。 另外,不仅是仿制药企之间存在竞争,现在原研药厂家也开始介入这一场仿制药的争夺战。据悉,正是瞅准这一市场前景,制药巨头诺华去年已将其位居全球第二位的非专利药业务“山德士”引进中国,并在华积极寻求合作伙伴;而日前,就在美国一家仿制药宣布其生产的辛伐他汀将比默克“舒降之”价格低30%~50%之后,默克即与美国最大健康保险公司UnitedHealth达成协议,专利品牌药“舒降之”今后价格将比任何一家上市的辛伐他汀产品都低。 乙肝药仿制市场集中上演“血拼”大战 这么多“重磅炸弹”可以仿制,对于药企和研发机构而言,哪些品种对他们更有吸引力呢? 据了解,刚在美国专利到期的默克“舒降之”进中国11年并无专利保护,而辉瑞“左洛复”在华行政保护也在几年前到期,这两种药品的仿制品早就“遍地开花”了。业内人士分析,目前到期专利药的仿制大战中,最为激烈的恐怕是乙肝药市场的争夺了。据GSK相关人士介绍,现在国内已有几十家药厂把目光聚焦在专利即将到期的一线乙肝抗病毒药“贺普丁”(拉米夫定)。若以零售价计算,2005年贺普丁在中国销售收入约有10亿元。而今年9-10月,贺普丁在华专利保护就将到期。 最新资料显示,全球目前有4亿乙肝病毒感染者,而中国就占到1/3,慢性乙肝治疗等相关费用每人年均2万元左右,中国整个乙肝病市场至少有100亿元的容量。去年以来,GSK、施贵宝又先后向中国引进了贺维力、博路定两款乙肝新药,诺华公司乙肝新药也即将在华上市。与这些价格不菲的专利药相比,专利行政保护即将到期的贺普丁成了众多患者和药厂的“抢手货”。“目前,公司正在研发一系列抗病毒品种,包括拉米夫定在内总共有几十个品种。”上海新先锋药业副总经理李建文向记者表示,一般他们会提前两年就对将到期的目标药品合成路径及生产工艺进行研发,等到临过期时再开发,市场早就被别人抢走了。“研发费用本身并不贵,像开发拉米夫定一个品种约200万元,最头疼的事情是仿制厂家太多,市场竞争将十分激烈。”李建文称。 不过,对于国内正酝酿的拉米夫定仿制热潮,贺普丁生产商GSK有关人士则表示了不同意见。“贺普丁专利的行政保护权,确实将在2006年第四季度到期,但目前贺普丁在华仍有其他专利可保护。”负责贺普丁市场的GSK抗感染药高级经理黄怡峥向记者表示,贺普丁在华专利包括生产制备方法专利以及拉米夫定活性成分与药用载体相合成的方法专利,这几项专利将在2010年至2015年间到期。问及GSK乙肝新药贺维力与老药贺普丁会不会形成营销冲突,黄怡峥表示,两者可以互补,今后贺普丁也不会撤出中国市场。 专家说法 “首仿药”更应关注 一直以来,国内4500多家药企90%以上在做仿制药,而往往同一个品种集中了上百家甚至几百家药厂在生产,造成了严重的资源浪费和恶性竞争。有关专家据此认为,国内厂商与其一哄而上去拼抢在华专利到期的某一个品种,不如把精力投向已在国外上市却未进入中国市场的“首仿药”市场,虽说投入稍高,但回报将更为客观。 在美国,一旦某个药品专利到期,首家获得仿制权的药企在市场和定价上都有更多优先权。“目前,专利到期的舒降之已被全球最大非专利药公司以色列TEVA首家取得FDA仿制批文,TEVA将获得180天市场独占权”,默沙东(即美国默克)中国公司公共事务高级主任丁燕宁介绍。 今年3月初,国家发改委向相关企业下发了《药品定价方法》征求意见稿,首次提出“首仿药”概念,要求对首仿药(即“首先研究申报国外已上市而在国内未上市的药品”)给予定价优先。该方案称,国内首先仿制生产并上市销售的同种仿制药品的价格经专家论证后,允许在统一定价的基础上适当上浮,上浮范围不超过政府规定的最高上浮范围。 上海市食品药品监督管理局科技情报研究所主任干荣富向媒体表示,国家拟允许“首仿药”价格比同类产品上浮15-20个百分点,且享有一段时间的价格独享权,是国内制药企业不可错过的好机会。干荣富称,他汀类、普利类、沙坦类、抗抑郁药、抗溃疡药等特色原料药已给许多企业创造了利润,这些企业避开了专利,并且在国际上获得了注册、认证以及合同加工订单,特别是在2008-2010年前后,将有一批专利药到期,这会给一大批特色原料药创造巨大的市场需求。
对于目前国内还没有标准品的新合成药品,如何对他进行标定呢?急求,请大家不吝赐教~最好是有很清晰的文字说明,就如药品管理部门制作的标准品一样,谢谢!http://simg.instrument.com.cn/bbs/images/default/emyc1010.gif
请问一下有没有做药品中的多环芳烃,或者这方面的标准,应该参考哪个标准去做搜刮了一下,似乎不是很常见,多环芳烃一般都是玩具啊,消费品这些的,作为环境控制的,为什么没有食品和药品的多环芳烃控制呢?
[color=#00008B][B]几年来国内在食品药品行业内出现的问题层出不穷,食品以奶粉为典型,药品以中药注射液为头等,透露了我国对食品、药品检测及监管的漏洞。以下对几年来发生的药品事件做个回顾:[/B][/color][color=#00008B][B]国内医药事件:[/B][/color][color=#DC143C]1、安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)(时间为2006年)[/color]国家食品药品监督管理局2006年8月10日召开新闻发布会,通报了对安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)引发的药品不良事件调查进展:国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行现场检查,经对2006年6月至7月份所生产的克林霉素磷酸酯葡萄糖注射液的生产过程核查,初步分析认定,企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良事件的原因。药品检验工作正按程序进行。对不良事件的报告病例与药品之间的关联性评价工作正加紧进行。经查,安徽华源生物药业有限公司自2006年6月份以来共生产该产品3701120瓶,销售出3186192瓶,流向全国26个省份。除未售出的已被封存外,截至到8月9日13点,企业已收回755053瓶,收回途中有185528瓶,异地查封161217瓶待收回,合计1586498瓶。目前流向市场的涉及药品已得到控制。[color=#DC143C]2、国家药监局:7类鱼腥草注射液被暂停(时间为2006年)[/color]鉴于鱼腥草注射液、新鱼腥草素钠氯化钠注射液、新鱼腥草素钠注射液、注射用新鱼腥草素钠、复方蒲公英注射液、炎毒清注射液、鱼金注射液等7类含鱼腥草或新鱼腥草素钠的注射液在临床应用中出现严重不良反应,国家食品药品监督管理局1日发布通告,决定从即日起在全国范围内暂停使用,同时暂停受理和审批相关各类注册申请。不过自2007年10月到2008年,广东博罗先锋药业、江西保利制药等七家公司已分批被同意恢复鱼腥草注射液(2ml)的肌内注射使用,但对占鱼腥草注射液95%市场份额的静脉滴注用注射液还在进行再评价工作。 由于存在比较严重的不良反应,2006年6月1日,国家食品药品监督局曾发布了《关于暂停使用和审批鱼腥草注射液等7个注射剂的通告》。“鱼腥草叫停事件”一度引起空前关注。[color=#DC143C]3、广东佰易事件(时间为2007年)[/color]广东佰易药业有限公司人狂犬病免疫球蛋白等7个品种22个药品的批准文号,日前被国家食品药品监管局注销。广东佰易药业有限公司已经被依法吊销《药品生产许可证》,根据《药品注册管理办法》的有关规定,该公司所持有的人狂犬病免疫球蛋白、人血白蛋白、人免疫球蛋白、静脉注射用人免疫球蛋白、人乙型肝炎免疫球蛋白、组织胺人免疫球蛋白、静脉注射用人免疫球蛋白等药品的批准文号自行废止。广东佰易药业有限公司在生产静脉注射用人免疫球蛋白产品过程中,存在严重违规行为。临床应用中发现,该企业的部分产品导致用药者出现丙肝抗体阳性。据了解,除广东佰易药业有限公司之外,1年来,齐齐哈尔第二制药有限公司、福建省天神药业有限公司、河南省许昌华仁制药有限公司,以及保定三九济世生物药业有限公司抗肿瘤药品车间等,因严重违法生产受到严厉制裁,被吊销《药品生产许可证》。[color=#DC143C]4、茵栀黄注射液事件(时间为2008年)[/color]2008年10月19日,卫生部通报了陕西省延安市志丹县医院因使用山西太行药业股份有限公司生产的茵栀黄注射液(批号为071001)后,有4名新生儿发生不良反应,其中1名出生9天的新生儿于10月11日死亡。卫生部要求各地立即停止该批号茵栀黄注射液的临床使用。山西太行药业20日就此发布公告称已主动召回该批次产品,并暂停其他所有批次同型号产品的使用。12月29日,山西省食品药品监督管理局公布,山西太行药业有限公司生产的茵栀黄注射液经国家和省药品检验机构检验后,符合国家药品标准。如此快速的解决了药品不良反应事故,比较少见。而太行药业也有惊无险,其产品依然广泛使用并受好评。[color=#DC143C]5、刺五加事件(时间为2008年)[/color] 2008年10月6日,国家食品药品监督管理局接到云南省食品药品监督管理局报告,云南省红河州6名患者使用了标示为黑龙江省完达山制药厂(2008年1月更名为黑龙江完达山药业公司)生产的两批刺五加注射液(批号: 200712272 1、200712151 1,规格:100ml/瓶)出现严重不良反应,其中有3例死亡。10月7日,国家食品药品监督管理局同卫生部组成联合调查组,在云南、黑龙江两省地方政府及相关部门的配合下,对事件原因展开调查。经查,这是一起由药品污染引起的严重不良事件。完达山药业公司生产的刺五加注射液部分药品在流通环节被雨水浸泡,使药品受到细菌污染,后被更换包装标签并销售。[color=#DC143C]6、江西博雅生物制药公司静脉注射用人免疫球蛋白事件(时间为2008年)[/color]2008年6月1日,江西省食品药品监督管理局向媒体通报,该局5月28日接到报告,5月22日至28日,先后有6名在南昌大学第二附属医院就诊的患者,在使用标识为江西博雅生物制药公司生产的批号为20070514、规格为5%2.5g的静脉注射用人免疫球蛋白(PH4)(液体)发生死亡。[color=#DC143C]5、复方丹参滴丸事件(时间为2009年)[/color]最近有专家在接受相关媒体采访时披露,国内治疗心脑血管疾病用药最广泛的一种中成药叫复方丹参滴丸,存在严重副作用,并且不良反应率达到3.11%,并且通过长期的试验,国家食品药品监督管理局新闻发言人颜江瑛昨日对此作出上述回应。 国家食品药品监督管理局会考虑药品的风险和效益,所以该药品在市场上进行销售和使用时都已要求进行皮试。如果上市药品出现不良反应,将会对上市的药品进行几个方面的处理,一是修改药品说明书;二是生产工艺也许有问题,让它调整和修改生产工艺;三是暂停销售和使用;四是测试,这是我们在药品出现问题后的几种处理方式。 国家食品药品监督管理局透露复方丹参滴丸是根据复方丹参滴丸片进行改剂申报的,无论是改剂型仿制药还是创新药,都是按照注册管理相应申报资料的要求研制单位进行研究的。 [color=#DC143C]6、哈药集团"双黄连"致死事件(时间为2009年)[/color]今年2月11日,卫生部、国家食品药品监督管理局接到报告,青海省大通县3名患者使用标识为黑龙江乌苏里江制药有限公司佳木斯分公司生产的双黄连注射液发生不良反应,并有1例死亡。2月12日,卫生部、国家食品药品监督管理局联合发出紧急通知,要求立即暂停使用和销售该企业生产的双黄连注射液。国家食品药品监督管理局已宣布该厂生产的双黄连注射液经过国家标准的检查,产品质量没有问题,而之前黑龙江和青海药监所也分别作出了产品质量合格的结论。导致此次事件发生的原因是一些医生所开出的联合处方,没有注意到说明书中不能与某些药物混用的提示,违反用药规律,混乱用药,造成了患者死亡。[color=#DC143C]7、清开灵注射液出现不良反应(时间为2009年)[/color]根据国家药品不良反应监测中心通报,近年来陆续收到清开灵注射剂的严重不良反应/事件的报告,其中以全身性损害、呼吸系统损害为主,另外还出现皮肤及其附件、神经系统、心血管系统等的损害。对清开灵注射剂死亡病例报告的分析显示,81%的患者存在合并用药(联合用药)情况,8%存在多种药物混合静脉滴注的情况。而除药品因素外,不排除原患疾病进展、合并用药、过敏体质、救治不及时或不当等因素。此外,死亡病例中,27%的患者为14岁以下儿童。不合理用药、临床使用不规范,是造成中药注射剂不良事件的主要原因,不能归咎于中药注射剂本身的安全性。========================================================================================================================================[color=#00008B][B]国外医药事件(时间为2006年)[/B][/color][color=#DC143C]1、博士伦事件[/color]发生在新加坡的“博士伦事件”(2006年初,新加坡有7名市民患上由真菌引发的角膜炎,患者均戴过隐形眼镜。自去年5月以来,当地共发现19人受影响,其中18人曾使用博士伦公司生产的多功能隐形眼镜护理药水。——记者注)同样让中国公众紧张了一下。很快,北京、广州、杭州、南京、成都等地暂停销售美国工厂生产的进口润明水凝护理液。6月9日,博士伦公司证实,该公司生产的润明水凝护理液配方确实存在问题,可能导致眼角膜真菌感染。
日前,国家食品药品监督管理局正式发布[url=http://www.sda.gov.cn/09ypzcnb/09ypzcnb.rar][color=#800080]《2009年药品注册审批年度报告》。[/color][/url]报告由2009年药品注册管理工作情况、2009年批准药品生产上市情况、2009年批准药品临床研究情况、2009年重要治疗领域的药品批准情况、2009年药品注册申请受理情况和结语6部分组成。报告共7000余字,图文并茂地展示了2009年药品注册工作的进展与成效。 报告从完善药品注册法规体系、加强药品研究过程的监管、加大技术审评科学公开透明、完成应急防控药品审批四个角度,阐述了2009年药品注册工作的重要举措。 报告显示,2009年的药品注册申请受理总量为6428件,其中,境内申请5128件,包括2336件新申请和2792件补充申请;境外申请1300件,包括新申请614件和补充申请686件。药品注册申请全年受理总量已连续3年稳定在6000至7000件左右。 报告显示,2009年国家局共批准生产上市药品申请3100件(以受理号计,下同),其中含2008年集中审评后续批准的过渡期品种2308件。按照新的《药品注册管理办法》规定,审评并批准了新药、改剂型、仿制药及进口药品注册申请共计792件。其中,化药548件,中药92件,生物制品38件。 2009年化药新药占化药批准品种总数的比例为32%,中药新药占中药批准品种总数的比例为78%。2009年首次出现了批准新药比率升高、重复申请降低的现象。这表明2007年新版《药品注册管理办法》颁布以后,我国采取的一系列规范审评、鼓励创新的政策导向产生了良好效应。 通过开展药品注册现场核查、药品批准文号清查、过渡期品种集中审评、实施新修订的《药品注册管理办法》及其配套法规文件等措施,经过连续几年的努力,药品审评审批改革已经取得显著成效,药品注册管理不断规范,药品研制秩序持续好转,药品注册申请数量趋于理性,质量进一步提高,有效保障了人民群众用药安全有效。 从今年起,国家食品药品监督管理局将逐步建立和完善药品注册审批年度报告制度,积极推进药品注册审批信息公开和工作透明,为鼓励新药创制,促进医药产业结构调整和产品结构优化提供有效指导。[table=100%,#d7eaf9][tr][td]附件1:[/td][td][url=http://www.cde.org.cn/attachmentout.do?mothed=list&id=3500]2009年药品注册审批年度报告.rar[/url][/td][/tr][/table]
江苏再次爆出利用新康泰克提炼冰毒的案件,新康泰克成为焦点。 11月23日,葛兰素史克公司公关总监张飒英表示:“用新康泰克制毒,这显然是个社会性问题了。新康泰克是国家药监局批准许可的非处方药,本身肯定不含毒品。” 新康泰克是葛兰素史克在华合资公司中美史克生产的非处方药(OTC)。2009年,中美史克总销售额为19亿元,新康泰克与芬必得一起,占其中近80%。 由于国内多款感冒药大多含有伪麻黄碱成分,这一成分可以被利用来制作冰毒。2008年11月份,国家药监局曾专门下文,要求药店每次出售类似感冒药不得超过5盒。但这一政策贯彻难度较大,时有卫生部官员称,“实践中很难控制,不法分子如果真的要大量购买,完全可以多人多次到多家药店购买。” 但这么多感冒药中,只有新康泰克屡屡被用来制作冰毒,并不是没有原因的。 独特之处 盐酸伪麻黄碱是感冒药中缓解鼻黏膜充血的成分,对于鼻塞有较好的治疗作用。但同时也可以通过化学转化,制成甲基苯丙胺,即俗称的冰毒。 近两年来,国内至少已经发生第五起利用新康泰克提炼冰毒的案件。上述江苏的制毒案中,两涉案人员正是根据网络流传的方法制备冰毒的。 用新康泰克制备冰毒过程并不复杂,需用到甲苯、乙醇、氢氧化钠等简单的化工品。 不过,中医学博士罗兴洪介绍:“想从感冒药中提炼毒品并不那么容易,毕竟药品中含伪麻黄碱的量很低,需要较多的化学过程。”但新康泰克的确有着别的OTC药品不具备的“特点”。说明书显示,新康泰克每粒含盐酸伪麻黄碱90毫克,而白加黑、日夜百服宁、泰诺等主流OTC感冒药,每片中盐酸伪麻黄碱含量均只有30毫克。这使得新康泰克在缓解鼻塞方面明显优于其他产品,成为其独特卖点,但也成为不法分子瞄准的对象。 以此次被破获的江苏案件为例,上述两名涉案人员采购800余盒新康泰克,共提炼出约95克冰毒。康泰克每盒市场价约为12元左右,其提炼的冰毒成本约为每克100元。而如果改用白加黑、泰诺等产品为原料,其成本可能将提高三倍,制作工艺也更复杂。 这一点被不法分子加以利用,令葛兰素史克也十分头疼。葛兰素史克传播经理方芳表示:“新康泰克中的盐酸伪麻黄碱剂量完全符合中国药典标准。同时,我们也正在努力研发将来可替代盐酸伪麻黄碱的有效配方。” 罗兴洪表示:“短期来看,伪麻黄碱这个成分还无法完全替代,其替代品也大多可以被利用来制毒。” 严格管制 康泰克遭遇的上一次危机是2000年,当时因含有容易引发中风的PPA,康泰克被迫在全球更换配方,加入了盐酸伪麻黄碱(PSE),更名为“新康泰克”。 康泰克1999时在华年销售额已经超过5亿元,是国内第一的感冒药品牌。受PPA风波的打击,中美史克直接损失近7亿。同时,其他品牌的感冒药异军突起,新康泰克经历了一段艰难的复苏过程。 但PSE很快被发现可以提炼冰毒。2005年,多名中国留学人员邮寄大量康泰克进入新西兰,引发国际关注。同年,美国通过“反甲基苯丙胺滥用法案”,开始对含PSE的药品进行严格销售限制。 美国目前有41个州有限售措施,要求销售方式为“behind the counter”,作为准处方药对待。购买人需要通过执业药师的许可,并记录个人信息。肯塔基等州甚至通过电子追踪系统跟踪药品流向。加拿大、新西兰、泰国等国家也有类似限售举措。 中国国家药监局在2008年发布限售令之后,又在2009年再次下文,强调含麻黄碱的感冒药每次限售五盒。但这些禁令一直未能彻底杜绝类似药品被利用制毒的现象。 有企业向记者诉苦道:“光北京就有那么多药店,一家买五盒,数目就相当可观了,企业怎么管得住?” 目前,葛兰素史克已经采用“双人双锁”、报批废料等方式控制生产环节,并且主动跟踪销售趋势,分析异常销售。方芳表示:“我们随时接受政府相关部门的检查。将一切调查到的异常情况向政府主管部门进行汇报。” 这一切还是很难避免流通、零售环节的疏漏,浙江、广东甚至出现过垄断、走私新康泰克的案例。罗兴洪表示:“类似药品应该更严格地控制,例如转为处方药进行管理等。”土豆问题:该产品是不是面临严管了?还有哪些药品也有类似危险?
国家食品药品监管局和卫生部昨天联合下发《关于进一步开展整治非药品冒充药品专项行动的通知》,决定从2010年6月至10月底,开展集中整治非药品冒充药品第二阶段专项行动。 《通知》要求,各地要开展对基层医疗卫生机构和民营医疗机构的监督检查,全面检查基层医疗机构中存在的以食品、保健食品、保健用品、化妆品、消毒产品、未标示文号产品冒充药品的违法行为。一经发现上述产品在包装、标签、说明书中宣称具有功能主治、适应症或者明示预防疾病、治疗功能或药用疗效等行为以及产品名称与药品名称相同或相似的,一律予以暂停使用,并按照相关规定对医疗机构进行处理。
新修订的《药品注册管理办法》(以下简称新《办法》)将于2007年10月1日起施行。为做好新《办法》的贯彻实施,保证新旧《办法》的顺利过渡和衔接,国家食品药品监督管理局将有关事宜通知如下: 各省、自治区、直辖市食品药品监督管理局要认真学习宣传和贯彻新《办法》及其相关规定,统一思想,提高认识,落实药品注册监管措施,切实保证药品的安全、有效和质量可控,维护公众健康。 2007年10月1日前已经取得《药物临床试验批件》的品种,其临床试验按照原《药品注册管理办法》关于临床试验的要求和《药物临床试验批件》的内容进行。临床试验结束后按照新《办法》的规定申报生产。 2007年10月1日前受理的申请生产的治疗类大容量化药注射剂、中药注射剂、多组分生化注射剂等高风险品种,国家食品药品监督管理局药品审评中心已经完成技术审评送达药品注册司的,由药品注册司通知申请人申请生产现场检查,并告知国家食品药品监督管理局药品认证管理中心。申请人自收到生产现场检查通知之日起6个月内向国家食品药品监督管理局药品认证管理中心提出生产现场检查的申请,国家食品药品监督管理局药品认证管理中心在收到生产现场检查的申请后,组织对样品批量生产过程等进行现场检查,确认核定的生产工艺的可行性,同时抽取1批药品,送负责该药品标准复核的药品检验所检验。 2007年10月1日前受理的申请生产的治疗类大容量化药注射剂、中药注射剂、多组分生化注射剂等高风险品种,国家食品药品监督管理局药品审评中心尚未完成技术审评的,由国家食品药品监督管理局药品审评中心按照新《办法》的要求通知申请人申请生产现场检查。上述品种的检验费用由国家食品药品监督管理局统一支付。国家食品药品监督管理局根据生产现场检查和药品抽验结果决定是否发给药品批准文号。 生物制品注册申请的生产现场检查,由国家食品药品监督管理局组织对生产工艺的可行性进行核查。 2007年10月1日前受理的申请生产的对除治疗类大容量化药注射剂、中药注射剂、多组分生化注射剂和生物制品之外的其他注册申请,在通过技术审评后,发给药品批准文号,由各省(区、市)局组织开展生产现场检查和首批产品的抽验工作,检验合格后方可上市销售。首批产品的抽验可结合各省(区、市)年度药品抽验计划一并进行,具体工作程序和要求由各省(区、市)局自行制定。 2007年10月1日起,根据新《办法》获得生产批准的品种,其药品标准即为正式标准。此前已批准的药品试行标准,仍按照原《药品注册管理办法》关于药品试行标准转正的程序和要求,申报和办理药品试行标准转正。 按照药品管理的体外诊断试剂的注册,遵照国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》的规定和相关技术要求执行。 国家食品药品监督管理局已发布的药品注册各类规范性文件,新《办法》已有规定的,按照新的规定执行,其原规定同时废止;新《办法》没有规定的,其他规范性文件的相关规定继续有效。 对新《办法》实施中遇到的问题,请各地通过国家食品药品监督管理局网站《28号局令执行专栏》及时反馈。(2007.09.28)---转自国家食品药品监督管理局
各省、自治区、直辖市食品药品监督管理局: 根据《处方药与非处方药分类管理办法(试行)》(国家药品监督管理局令第10号)的规定,经总局组织论证和审定,柴黄胶囊等21种药品(化学药品5种、中成药16种)转换为非处方药。现将转换的21种药品名单及其非处方药说明书范本(见附件)予以发布,请通知行政区域内相关药品生产企业做好以下工作: 一、在2014年10月30日前,依据《药品注册管理办法》等有关规定提出修订说明书的补充申请报备案。说明书的其他内容应当与原批准内容一致。补充申请备案之日起生产的药品,不得继续使用原药品说明书。分别按处方药和非处方药管理的双跨品种除外。 二、应当将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。 三、药品标签涉及相关内容的,应当一并修订。 附件:1.转换为非处方药的21种药品名单 2.柴黄胶囊等21种非处方药说明书范本 国家食品药品监督管理总局办公厅 2014年9月18日http://www.sfda.gov.cn/directory/web/fileTypeImages/icon_doc.gif食药监办药化管〔2014〕176号 附件.docx转换为非处方药的21种药品名单序号药品名称规格(成分)类别备注1柴黄胶囊每粒装0.5克乙类 2除湿止痒软膏(1)每支装10克;(2)每支装20克乙类 3复方板蓝根口服液[/s
中新网1月20日电 据食品药品监管总局网站消息,食药监总局日前发布关于16批次药品不合格的通告,成都地奥集团天府药业股份有限公司生产的批号为151208的沉香化气丸,以及河南省百泉制药有限公司生产的批号为140201的小儿泻速停颗粒等药品上榜。通告称,经云南省食品药品检验所等7家药品检验机构检验,标示为山西康威制药有限责任公司等11家药品生产企业生产的白带丸等16批次药品不合格。现将相关情况通告如下:一、不合格产品的标示生产企业、药品品名和生产批号为:山西康威制药有限责任公司和山东孔圣堂制药有限公司生产的批号分别为4140303和15050100的白带丸,成都地奥集团天府药业股份有限公司生产的批号为151208的沉香化气丸,山东临清华威药业有限公司和华润三九(临清)药业有限公司生产的批号分别为14031902、14061702、14082301和15050101的磁朱丸,国药集团三益药业(芜湖)有限公司和上海通用药业股份有限公司委托上海世康特制药有限公司生产的批号分别为160302、160401、160501和150503、150401的醋酸氟轻松冰片乳膏,上海旭东海普药业有限公司生产的批号为140301的辅酶Q10胶囊,锦州本天药业有限公司生产的批号为150213的蒲地蓝消炎片,河南省百泉制药有限公司生产的批号为140201的小儿泻速停颗粒,四川省三星堆制药有限公司生产的批号为151211的炎可宁片。不合格项目包括性状、含量测定,以及检查项下的细菌数、装量差异、溶散时限、有关物质、重量差异等(详见附件)。二、对上述不合格药品,山西、辽宁等省(区、市)食品药品监督管理局已采取查封扣押等控制措施,要求企业暂停销售使用、召回产品。国家食品药品监督管理总局要求生产企业所在地的省(区、市)食品药品监督管理局对上述企业依据《中华人民共和国药品管理法》等规定立案调查,依法处理;并责令生产企业彻查原因,彻底整改;相关情况及时向社会公开。
欧洲、南美和日本使用药品“反应停”,竟然出现1万多个海豹样胎儿,他们缺胳膊少腿、手足直接与身体相通,而且大多还活着,造成大于1万例海豹样畸胎。这个案例鲜活地说明了,药品是一柄双刃剑,一方面可以用来防病治病,也可能出现危害机体的不良反应。 是药三分毒,即使是经过国家审批的合格上市药品,也不是百分百安全,也不可避免出现药品的不良反应。今天,记者将带领大家乘坐药品安全专列,走进社区听听“药品安全大讲堂”,听听专家是如何向消费者传授预防药品不良反应“秘诀”的。 三大原因引起药品不良反应 据介绍,药品不良反应是合格的药品产生的,它既不是假药、劣药等质量有问题药品导致的损害,也不是患者的个体差异,更不是医疗事故。即使通过了国家食品药品监管部门的审批的药品,也会存在药品不良反应。 专家提醒,引起不良反应有三大原因: 一是药品药理作用。药品因其含有一定的化学成分可能具有多种药理作用,它对疾病发挥的作用属于治疗作用,不发挥的作用,就会成为毒副作用。 二是临床实践表明,不同种族、民族、年龄、性别的人,在遗传、新陈代谢、体内酶系统的活性等方面具有不同的特点,即使同一个人,在本人肝肾功能等生理病理不同的情况下,对药物药理作用的反应情况也存在着一定的差异。 三是新药的审批主要是根据动物实验和临床试验的结果,但是临床试验的时间短、人数少,有些病人虽有适应症,但按规定不能参加,试验期间一般不许合并用药,因而许多发生率低、潜伏期长的不良反应在药品审批时难以发现。 合理用药减少不良反应发生 记者在讲座上了解到,多药合用容易引起药物与药物、药物与机体之间的相互作用,使不良反应发生率明显增高。有资料显示,当合并用药数为2~5种,不良反应的发生率为4.2% 合并用药数21种,不良反应的发生率为45%。 但专家表示,合理用药可以减少药品不良反应的发生。由于医师和药师在选择药物前会充分考虑药品的药理作用、代谢过程、药物间相互作用及药品不良反应的情况。因此,在医师药师指导下的合理用药可以减少药品不良反应的发生。 其次,严格按照说明书使用是减少药品不良反应的保证。说明书中的适应症、用法用量、给药途径都是经过临床试验验证的,特殊人群的用药资料、禁忌症、注意事项和药物相互作用等资料都是在临床试验的基础上总结出来的。用药前详细阅读药品使用说明书,熟悉药物的药理作用及其代谢过程,避免同时服用可能发生相互作用的药物或食物(如西柚汁、酒精等),可以最大限度地减少药品的不良反应。 及时发现主动报告不良反应 据专家介绍,即使在医师药师指导下遵照说明书的规定用药仍有可能出现药品不良反应。只要患者在药品使用过程中出现了不适或痛苦,并且这种不适或痛苦不能用原有病情的进展或合并用药解释,应该考虑这种不适或痛苦是药物或药物间相互作用导致的不良反应。 任何个人一旦发现药品不良反应,要立即停药,去医院就诊,并向就诊的医疗机构、购药的药店或深圳市食品药品监督管理局报告,也可以登录药品不良反应监测网(www.szadr.gov.cn)进行上报。有些药物的不良反应被发现,并不是简单地意味着它的历史宣告结束,而是提醒人们更严格、更谨慎地使用,以发挥它的优势避免它的弊端。没有安全的药物,只有科学的使用。
中新网2月12日电 据国家食品药品监督管理局网站消息,历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)12日对外发布,将于2011年3月1日起施行。 《药品生产质量管理规范》是药品生产和质量管理的基本准则。中国自1988年第一次颁布药品GMP至今已有20多年,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。 据悉,新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。新版药品GMP吸收国际先进经验,结合中国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。 中国现有药品生产企业在整体上呈现多、小、散、低的格局,生产集中度较低,自主创新能力不足。实施新版药品GMP,是顺应国家战略性新兴产业发展和转变经济发展方式的要求。有利于促进医药行业资源向优势企业集中,淘汰落后生产力;有利于调整医药经济结构,以促进产业升级;有利于培育具有国际竞争力的企业,加快医药产品进入国际市场。 新版药品GMP修订的主要特点如下: 一是加强了药品生产质量管理体系建设,大幅提高对企业质量管理软件方面的要求。细化了对构建实用、有效质量管理体系的要求,强化药品生产关键环节的控制和管理,以促进企业质量管理水平的提高。 二是全面强化了从业人员的素质要求。增加了对从事药品生产质量管理人员素质要求的条款和内容,进一步明确职责。如,新版药品GMP明确药品生产企业的关键人员包括企业负责人、生产管理负责人、质量管理负责人、质量受权人等必须具有的资质和应履行的职责。 三是细化了操 作 规 程、生产记录等文件管理规定,增加了指导性和可操作性。 四是进一步完善了药品安全保障措施。引入了质量风险管理的概念,在原辅料采购、生产工艺变更、操作中的偏差处理、发现问题的调查和纠正、上市后药品质量的监控等方面,增加了供应商审计、变更控制、纠正和预防措施、产品质量回顾分析等制新制度和措施,对各个环节可能出现的风险进行管理和控制,主动防范质量事故的发生。提高了无菌制剂生产环境标准,增加了生产环境在线监测要求,提高无菌药品的质量保证水平。 新版药品GMP将于2011年3月1日起施行,自2011年3月1日起,新建药品生产企业、药品生产企业新建(改、扩建)车间应符合新版药品GMP的要求。现有药品生产企业将给予不超过5年的过渡期,并依据产品风险程度,按类别分阶段达到新版药品GMP的要求。 此外,国家食品药品监督管理局要求药品生产企业结合自身实际,制定实施计划并组织实施。同时要求各级药品监督管理部门加强对企业的督促检查和指导。 据了解,国家食品药品监督管理局正在制定新版药品GMP的贯彻实施意见,将于近期发布。----------转自“中国质量新闻网”,仅仅为传递更多质量信息。
昨天(27日),国家食品药品监督管理局副局长吴浈做客中国网。他表示,今年国家药监局将采取评审人员集体负责制以及审批责任追究制等办法完善药品审批制度,防止腐败。 “三制一化”防止腐败 由于郑筱萸案暴露出药品审批中的腐败,昨天吴浈表示,药品审批过程当中出现了一些腐败现象,应该要正视。虽然是少数人,但已让整个系统蒙羞。他说,今年国家药监局会加强药品审评审批的管理,在药品审评审批中实行“三制一化”。所谓“三制一化”,就是实行审评人员集体负责制,目的就是防止个别人滥用审评审批权力;实行审评审批责任追究制,强化对违法审批行为的责任追究;实行审评审批检验人员公示制,将药品审评审批置于社会监督之下。他说,目前国家药监局正在全力抓药品审批的信息平台建设,目的就是让审批能够公开透明。今后,国家药监局要逐步实行药品审批在网上进行受理。 驻厂监督员无权处罚企业 由于不久前媒体广泛报道了国家药监局将向药厂派驻驻厂监督员,吴浈说,今天第一批派驻监督员将在国家药监局培训。他强调,驻厂监督员不包揽企业的质量责任,企业永远是产品质量的第一责任人。同时,驻厂监督员无权直接处罚企业。 02年批号药品今年再注册 对于国家药监局日前提出的药品再注册,吴浈解释说,药品再注册是对药品批准证明文件有效期满后要求继续生产药品实施再审批过程。根据规定,药品批准文号的有效期都是5年。有效期满以后,都必须按照有关规定进行药品再注册。 目前再注册的范围是,2002年换发批准文号的品种以及2003年新批准上市的品种进行再注册,因为这些药有效期已满5年。并不是所有药品都要再注册。
大洋网3月7日报道 根据卫生部通知要求,黑龙江省卫生厅3月6日晚连夜发出内部明传电报,要求全省各级各类医疗机构立即停止使用吉林一心制药股份有限公司生产的注射用泮托拉唑钠。据悉,3月6日卫生部收到国家食品药品监督管理局通报,经吉林省食品药品监食管理局抽检,吉林一心制药股份有限公司生产的注射用泮托拉唑钠(批号为0809022、0810011、0810012、0810021、0810022)可见异物,检查不合格。国家食品药品监督管理局已于 3 月 6 日下发通知要求停止销售和使用该药品。黑龙江省卫生厅接到卫生部办公厅紧急通知后,连夜发出内部明传电报,要求各级各类医疗机构立即停止使用并封存该批号的药品,并做好相关记录,保证信息完整,可追溯。一经发现与该批药品有关的不良事件,要全力做好医疗救治工作,有效保护好患者的生命安全,并按照规定立即报告同级卫生行政部门和药监部门。目前,黑龙江省医疗机构药品不良反应监测系统尚未接到该药品发生不良事件的报告。(来源:中国广播网)
日前,为加强药品、医疗器械、保健食品广告监督管理,整治违法发布广告行为,进一步规范广告发布秩序,国家食品药品监督管理局发布了2011年第2期违法药品、医疗器械、保健品广告公告汇总。 根据《药品广告审查办法》、《医疗器械广告审查办法》和《保健食品广告审查暂行规定》的有关规定,国家食品药品监督管理局对近期各省(区、市)食品药品监督管理部门违法广告监测情况进行了汇总,公告曝光了北京长城制药厂生产的药品“利脑心片”、西安大唐制药集团有限公司生产的药品“醒脾开胃颗粒”、云南通用善美制药有限责任公司生产的药品“溶栓脑通胶囊”、呼伦贝尔松鹿制药有限公司生产的药品“舒筋丸”、内蒙古乌兰浩特中蒙制药有限公司生产的药品“抗骨质增生丸”、贵州飞云岭药业股份有限公司生产的药品“隔山消积颗粒”、广西平南制药厂生产的药品“前列清茶”、保健食品“智灵牌冬虫夏草胶丸”(卫食健字第040号)等8个违法发布广告的药品、保健食品。 本期公告汇总期间,各省(区、市)食品药品监督管理部门以发布违法广告公告等方式,通报并移送同级工商行政管理部门查处的违法药品广告 15182次、违法医疗器械广告449 次、违法保健食品广告 793次。对未经审批擅自发布、严重篡改审批内容进行违法宣传的广告,各省(区、市)食品药品监督管理部门共撤销和收回药品广告批准文号4个、保健食品广告批准文号22个。对违法广告涉及产品采取了252 次暂停销售的行政强制措施。 国家食品药品监督管理局提醒广大消费者,要在医生或药师的指导下购买药品;保健食品没有治疗作用,不能代替药品,请谨慎购买。 【相关链接】 关于发布2011年第2期违法药品医疗器械保健食品广告公告汇总的通知

来源:国家食药监总局http://ng1.17img.cn/bbsfiles/images/2016/08/201608101404_604267_1610895_3.jpg近期,在国家药品抽验中发现,标示为湖北济安堂药业有限公司生产的蛇胆川贝液、吉林省鑫辉药业有限公司生产的跌打活血散和四川省通园制药有限公司生产的小儿咳喘灵颗粒多批次药品经检验不合格。现将相关情况通告如下:一、经湖北省食品药品监督检验研究院检验,发现标示为湖北济安堂药业有限公司生产的4批次蛇胆川贝液不合格,批号分别为140402A、141004B、141206B和150301A,不合格项目为鉴别。 经中国食品药品检定研究院检验,发现标示为吉林省鑫辉药业有限公司生产的3批次跌打活血散不合格,批号分别为16140702、16141001和16141002,不合格项目为装量差异。经山西省食品药品检验所检验,发现标示为四川省通园制药有限公司生产的3批次小儿咳喘灵颗粒不合格,批号分别为141003、141004和141209,不合格项目为性状。二、对上述不合格药品,吉林、湖北、四川省食品药品监督管理局已采取要求企业暂停生产销售、立即召回产品等措施。三、湖北济安堂药业有限公司、吉林省鑫辉药业有限公司和四川省通园制药有限公司同品种多批次产品不合格,反映该3家企业在生产质量管理方面存在问题。国家食品药品监督管理总局要求吉林、湖北、四川省食品药品监督管理局对上述企业依据《中华人民共和国药品管理法》等规定进行查处;并责令上述企业彻查药品质量问题原因,采取有针对性的措施进行整改,查清原因并整改到位前不得恢复生产;相关情况将及时向社会公开。特此通告。附件:10批次不合格药品名单http://ng1.17img.cn/bbsfiles/images/2016/08/201608101404_604266_1610895_3.jpg