药物(蛋白)的结构表征、理化、纯度及杂质分析都用哪些仪器和方法呀?
[font=微软雅黑][color=#444444]请问各位大佬,DSC测定出来的纯度如果要计算含量是不是还需要像质量平衡法那样,扣除水分残渣残留溶剂,然后乘以[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法出来的纯度?[/color][/font]
[font=微软雅黑][color=#444444]请问各位大佬,DSC测定出来的纯度如果要计算含量是不是还需要像质量平衡法那样,扣除水分残渣残留溶剂,然后乘以[/color][/font][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url][/color][/url][font=微软雅黑][color=#444444]法出来的纯度?[/color][/font]
在进行药物检测方法学研究时,遇到纯度因子问题,如下: 专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。这个纯度因子怎么定义计算,需要进行什么设定吗?在哪可以查到?
手性药物药学研究的基本要求如下:在原料药制备工艺研究时应根据手性中心的引入方式,采取有效的过程控制手段,严格控制产品的光学纯度;在结构确证时,需结合其制备工艺、结构确证用对照品及文献数据等已有的研究基础,选择合适的方式来证明该药物的立体构型;制剂的处方与工艺研究过程中应注意保证手性药物立体构型的稳定;质量研究时应结合工艺确定需研究控制的立体异构体杂质,并注意验证各手性分析方法的立体专属性,在制订质量标准时从各个方面控制产品的光学特性与光学纯度;在稳定性研究时,应设立灵敏的光学纯度质控指标,以监测立体构型的稳定性。 药物的研发一般分为三个不同的专业:药学、药理毒理及临床,在研究的过程中,这三个专业之间是紧密联系、相互印证的。即使在药学专业内部的各项研究间也是如此,在各项研究的过程中需要随时参考其它研究的结果,才能使我们的研究工作更为全面与准确。下面分别论述各药学研究间的关系:
一种药物中间体要想做纯度分析,用HPLC怎么开展及设置方法?说的具体一点:1,对药物中间体进行分析前是否要用溶剂进行溶解?一般用什么溶剂?2,Agilent 1260如何设置百分比分析?3.在用DAD时,是用同一种波长进行分析,还是不同的物质用不同波长进行分析?各位大侠哪位用这方面的资料分亨下,拜求
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=136432]药物熔点测定中的DSC实验影响因素研究[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=136433]差示扫描量热法测定七种药物纯度[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=136435]差示扫描量热法在药剂学研究中的应用[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=136436]差示扫描量热法测定肌醇纯度[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=136437]差示扫描量热法在化学中的应用[/url]
热分析技术在药物分析中的应用进展热分析技术是研究物质在加热或冷却过程中产生某些物理变化和化学变化的技术。自1887年Lechatelier提出差热分析至今已发展成为一门专门的热分析技术。因其具有方法灵敏、快速、准确等优点,该技术及其分析仪器也得到快速发展。不久Sadtler的DTA标准图谱集,热分析专著《Thermal analysis》也相继面世。热分析技术在药物分析领域也广泛应用,如化学药品的鉴别、理化常数测定、纯度考查、稳定性考察以及近年来对中药活性成分的研究、中药材真伪品的鉴别、中药制剂质量分析等。目前,一些发达国家已把热分析方法作为控制药品质量的主要方法之一,美国药典23版与英国药典1993年版均已收载了热分析方法。1 热分析技术的方法分类1.1 差热分析(differential thermal analysis,DTA) DTA是最先发展起来的热分析技术。当给予被测物和参比物同等热量时,因二者对热的性质不同,其升温情况必然不同,通过测定二者的温度差达到分析目的。以参比物与样品间温度差为纵座标,以温度为横座标所得的曲线,称为DTA曲线。1.2 差示扫描量热法(differential scanning calorimentry, DSC) DSC是在DTA基础上发展起来的一种热分析方法。由于被测物与参比物对热的性质不同,要维持二者相同的升温,必然要给予不同的热量,通过测定被测物吸收(吸热峰)或放出(放热峰)热量的变化,达到分析目的。以每秒钟的热量变化为纵座标,温度为横座标所得的曲线,称为DSC曲线,与DTA曲线形状相似,但峰向相反。1.3 热重分析(thermogravimetry,TGA) TGA是一种通过测量被分析样品在加热过程中重量变化而达到分析目的的方法。即将样品置于具有一定加热程序的称量体系中,测定记录样品随温度变化而发生的重量变化。以被分析物重量(%)为纵座标,温度为横座标的所得的曲线即TGA曲线。其它尚有导数热重量分析、热机械分析(TMA)、质谱差示分析等。2 热分析技术在药物分析中的应用 热分析技术常用于新药研究中。药物分析中应用最多的是将TGA与DSC联合使用。热分析技术可用于判断药物的熔点,确定药物的结晶水,测定药物的纯度,处方及辅料筛选等。2.1 药品熔点的判断 熔点是衡量药物质量的重要指标之一。确定药物的熔点需确定这个药物是熔融同时分解还是熔点,再确定其熔融同时分解或熔点的具体温度。如果采用历版中国药典收载的毛细管测定法,很难作到准确判断。如采用DSC与TGA相结合进行测定,则可对其作出准确的判断。80年代初重庆市药品检验所曾用DSC和TGA确定磷酸氯喹的熔点,1986年杨腊虎又用DSC测定九种熔点标准品物质的熔点。2.2 药品的纯度测定 利用热分析技术测定药品纯度的理论依据是范德霍夫方程,即药品熔点的下降与杂质存在的克分子分数成正比。采用逐步加热程序技术(step heating programming technique)可扩大测定范围简化测定过程并缩短测定时间。但此方程的适用条件为被测药物不能熔融同时分解,并药物与共存杂质之间不得形成固溶剂。当不需要得到药物的准确纯度时,可采用与对照品同时测定DSC或TGA曲线,通过分析热分析曲线来确定药物的纯度。文献报道了用热分析技术测定药物的纯度和用DSC测定硝苯地平的纯度。2.3 药物的多晶型分析 不同晶型的药物具有不同的生物利用度,因而具不同疗效。区别药物的晶型,过去通常采用红外分光光度法和X-射线衍射法。后来常用DSC或DTA分析法。用热分析技术不仅可区别同一药物的不同晶型,而且还可提供其热力学变化过程,为选择转晶条件提供依据。如对甲苯咪唑、多沙唑喹、法莫替丁、头孢新酯等的多晶型研究。徐坚等还用热分析技术研究了甲氧氯普胺两种晶型的互变条件及各自的溶解热。2.4 差向异构体的分析 不少的药物存在差向异构体,同一药物不同的差向异构体之间,其生物利用度不同。侯美琴等报导了用DTA和DSC分析双炔失碳的差向异构体,测定出其中α体的纯度,并为其制剂的剂量调整提供依据。2.5 药物中结晶水与吸附水的确定 确定药物分子中有无结晶水和结晶水的个数,过去常用卡氏水份测定法或在一定条件下测定干燥失重来决定。这些方法很难区分是分子中的结晶水还是吸附水。采用DSC-TG技术则可解决此问题。2.6 药物制剂中活性成份分析 热分析技术可用于药物制剂中活性成分的定性分析、定量分析和药物与辅料间的相互作用以及处方的设计。1980年有人报道不经分离直接用DSC技术测定磺胺类药物、硝基呋喃类药物以及解热镇痛类药物的胶囊剂和片剂。近年有文献报道用DSC考察了制剂中,活性成份间及活性成份与辅料间是否发生反应,即通过观察各活性成份、辅料以及制剂的DSC曲线的差异,发现是否出现新峰,以达到考察它们间是否相容,可否进行配伍的目的。2.8 药物的稳定性研究 汤启昭利用热分析技术研究了葡萄糖酸亚铁固体的稳定性,并与气相色谱分析结合,提高了热分析的研究水平;武凤兰用热分析技术研究了固体药物对乙酰氨基酚的分解动力学。
化合物纯度的鉴定方法,从快速,便宜,简便的要求出发,主要来之于以下几点:一 通过TLC的纯度的鉴定, 我将自己的心得分述如下1 展开溶剂的选择,不只是至少需要3种不同极性展开系统展开,我的经验是首先要选择三种分子间作用力不同的溶剂系统,如氯仿\甲醇,环己烷\乙酸乙酯,正丁醇\醋酸\水,分别展开来确定组分是否为单一斑点.这样做的好处是很明显的,通过组份间的各种差别将组分分开,有可能几个相似组份在一种溶剂系统中是单一斑点,因为该溶剂系统与这几个组分的分子间力作用无显著的差别,不足以在TLC区分.而换了分子间作用力不同的另一溶剂系统,就有可能分开.这是用3种不同极性展开系统展开所不能达到的.2 对于一种溶剂系统正如wxw0825所言,至少需要3种不同极性展开系统展开,一种极性的展开系统将目标组分的Rf推至0.5,另两种极性的展开系统将目标组分的Rf推至0.8,0.2。其作用是检查有没有极性比目标组分更大或更小的杂质。3 显色方法,光展开是不够的,还要用各种显色方法。一般一定要使用通用型显色剂,如10%硫酸,碘,因为每种显色剂(不论是通用型显色剂,还是专属显色剂在工作中都遇到他们都有一化合物不显色的时候),再根据组分可能含有混杂组份的情况,选用专属显色剂。只有在多个显色剂下均为单一斑点,这时才能下结论样品为薄层纯二 通过熔程,判断纯度。原理很简单,纯化合物,熔程很短,1,2度。混合物熔点下降,熔程变长。三,基于HPLC的纯度鉴定,对于HPLC因为常用的系统较少,加之其分离效果好,我们一般不要求选择三种分子间作用力不同的溶剂系统,只要求选这三种不同极性的溶剂系统,使目标峰在不同的保留时间出峰。四,基于软电离质谱的纯度鉴定。如ESI-MS,APCI-MS。大极性化合物选用ESI-MS,极性很小的化合物选用APCI-MS,这些软电离质谱的特点是只给出化合物的准分子离子峰,通过正负离子的相互沟通来确定分子量。如果样品不纯,就会检出多对准分子离子峰,不但确定了纯度,还能明确混杂物的分子量。五,基于核磁共振的纯度鉴定,从氢谱中如果发现有很多积分不到一的小峰,就有可能是样品是样品中的杂质。利用门控去偶的技术通过对碳谱的定量也能实现纯度鉴定。好了,不能再多写了。这里只是对常见的纯度鉴定方法做了一个小结,从快速,便宜,简便的要求出发,以第一点最合要求,往后次之,所以对第一点详加讲述。当然每种方法多有各自的局限性,如基于氢谱的纯度鉴定,如果发现有很多积分不到一的小峰,还有可能使样品中的活泼质子,基于软电离质谱的纯度鉴定,如果混杂物的分子量与目标物一样就无法检出。等等还有很多。这需要大家在工做中积累,思考。要讲的话,我看好几篇都讲不完。最后说一下对化合物纯度的要求,世界上不存在100%纯的化合物。你希望要多高的纯度应该与你的目的有关,例如,如想测核磁共振鉴定结构,一般要求95%的纯度,如果想测EI-MS,纯度越高越好。99%以上。还有,以上的方法都不能区分对应异构体。

药物中残留溶剂甲醇含量的不确定度评定报告(*^__^*) 嘻嘻……,甲醇作为一种药物中常用的提取溶剂,已经在很多药物的提取中用到,譬如何首乌根甲醇提取,甘草的甲醇提取等都是天然药物的甲醇提取,还有一些生物药品的甲醇提取等等,已经屡见不鲜了的,俺一个同学课题中最近所用的一种有机药品分析,在溶剂的选择上就是该药品在甲醇中溶解性更好,在乙醇中溶解性差很多,也许因为甲醇极性比乙醇大的缘故吧,在日常的气相色谱和液相色谱分析中经常作为溶剂,不过甲醇又是一种有毒的醇类,因此,药物中的残留溶剂里面也就必须检测甲醇了的。俺们药物临床分析基地的老师前段时间就分析了一份某上级部门给的盲样,是分析该药品中的残留溶剂甲醇含量,报告结果的同时也要做甲醇的不确定度报告。俺只是个助手,(*^__^*) 嘻嘻……,下面就是此次残留溶剂甲醇的不确定度报告,请各位老师继续授业解惑。1材料与方法1.1仪器和试剂:日本岛津GC-15A气相色谱仪(FID检测器),色谱柱:GDX-102,2m*4mm,非极性色谱柱;柱温140℃,气化室200℃;检测室210℃;载气流50ml/min 。十万分之一电子天平,最大误差0.03mg;1.0ml移液管,允差±0.015ml;10ml容量瓶,允差±0.02ml;5ml容量瓶,允差±0.02ml;甲醇,纯度≥99.9%。1.2标准溶液:10ml容量瓶中加入约5ml蒸馏水,于十万分之一电子天平上称取甲醇10.10mg,稀释至刻度,制成1010ug/mL甲醇标准储备液。1.3考核样:国家某机构组织提供的考核盲样一支。1.4 检测方法:按照Ch.P.2010并参考药物临床分析基地醇类化合物检测的SOP要求进行操作。主要包括标准溶液配置,标准曲线制备,被测盲样解吸及样品解吸液上机测定,并根据标准曲线计算甲醇含量4个环节。2.测量结果的不确定度评定2.1 不确定度来源分析:主要采用国家药典分析方法测量甲醇的含量,故不考虑该方法本身的误差。在测量不确定度评定中只需考虑与实验操作有关的不确定度分量,主要包括以下4个方面:由标准曲线得解吸液中甲醇浓度、解吸液体积、标准溶液浓度对测量结果的影响、重复测量产生的不确定度即A类不确定度。2.1.1由标准曲线得解吸液中甲醇浓度的不确定度。用1010ug/ml甲醇标准储备液,配制出浓度分别为10.1、50.5、101、151.5、202、252.5ug/ml的6个标准溶液,其响应值测定结果见表1。采用最小二乘法拟合标准曲线时,计算得到解吸液中甲醇的浓度C的不确定度仅与峰面积的测量不确定度有关,标准溶液浓度不确定度的影响另行讨论。http://ng1.17img.cn/bbsfiles/images/2012/12/201212152020_412847_2355529_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212152020_412848_2355529_3.jpg由表1中的数据进行线性拟合得线性方程y=37.974x-90.421,γ=0.9998。测得解吸液中甲醇的浓度为158ug/mL。于是根据以上公式得标准不确定度u(x)=0.363ug/ml,相对标准不确定urel=0.0023。2.3 解吸液体积不确定度评定。解吸液体积不确定度分量包括刻度吸管校准不确定度和温度影响。实验用1.0ml移液管,以均匀分布估计,标准不确定度分量为0.009mL。温度的变化引起液体体积和量具容积的变化。但是由于液体的膨胀系数远远大于玻璃量具的膨胀系数。因此,可以忽略温度对量具容积的影响。当实验温度为23℃,以均匀分布估计,温度对体积测量的影响为0.001ml。经过汇总总解吸液体积的标准不确定度u(V)=0.0091ml,相对标准不确定度urel(V)=0.0091。2.4 标准溶液浓度不确定度。配制标准溶液先配制标准储备液,然后将标准储备液稀释成标准溶液。计算标准溶液浓度不确定度,应先计算标准储备液浓度不确定度,再计算标准溶液浓度不确定度。2.4.1标准储备液浓度不确定度来源,包括甲醇标准纯度影响、甲醇标准质量、溶液的体积。见表2http://ng1.17img.cn/bbsfiles/images/2012/12/201212152021_412851_2355529_3.jpg2.4.2配制标准溶液时量具校准引入的不确定度。见表3http://ng1.17img.cn/bbsfiles/images/2012/12/201212152022_412852_2355529_3.jpg2.4.3配制标准溶液时温差引入的不确定度。玻璃量器在20℃校准,配置溶液的温度为20±5℃,±5℃温度差引起的不确定度可通过估算温度范围和体积膨胀系数来进行计算。水的膨胀系数为2.1×10-4℃-1, 计算标准不确定度时假设温度变化是矩形分布,则在标准液逐级稀释过程中,由±5℃温差导致体积变化而引入的相对不确定度为:http://ng1.17img.cn/bbsfiles/images/2012/12/201212152022_412853_2355529_3.jpg2.5 A类不确定度评定 随机抽取相同条件下配制的甲醇含量相同的样品15个进行测定。按标准方法要求,样品经解吸后测定,由标准曲线计算解吸液中甲醇的浓度分别为158.75、160.04、156.09、158.44、155.70、160.07、158.01、162.46、159.78、159.01、158.33、155.72ug/mL,测定列的标准差为8.9ug/mL,本次试验测定样品数位一个,解吸液中甲醇浓度平均值为158ug/mL。则该测定结果的A类不确定度为: u[/size
版友们,有药物注册上面的经验人士快来帮忙啊,我目前在订立一个质量标准,在订立指标时遇到光学纯度上的问题,我的样品为一个手性物,在反相色谱中无法分离其对应异构体,我们订立的指标为单个杂质均小于0.1%,这样就不需要对杂质的毒理进行研究,减少很多麻烦,但是唯独其对应异构体无法分开,那么我采用的是手性色谱分离,我订立的指标为:只对样品与其对应异构体积分,主产品的纯度不小于99.5%,言下之意就是其异构体不得大于0.5%的含量,那么我是否要对其异构体进行毒理研究呢?如果我把指标换成99.9%,是否还要研究其对应异构体的毒理呢?
我把药物(纯度为98%)配制在全血里作为样品,进样前要过滤吗?我用的是50μm的毛细管,BGE为pH7.4的PBS溶液。望指教!
药物中间体,也没有GMP要求,只是新公司的一个研发中心,那么这种是否有验证一说?最终成品 用纯度的方法来放行,无含量要求,那么这个纯度方法,是否需要验证,如果需要,那么需要验证哪一些方面?再者,化工原料很多客户要求干燥失重,但是105℃烘或者减压干燥貌似都不是很适用,烘的越久,干燥失重越大,减少越多。而我们这个产品里面大部分是溶剂,做干燥失重的主要目的也是看溶剂的量剩多少,如果用常温常压的干燥器,就是五氧化二磷之类的,能有用吗?我们产品用甲苯结晶,产品熔点122℃左右,我试了一下105℃烘,烘几个小时后,一称,减样量都不一样,而且很大,约12%,很大,所以不确定是甲苯没除去还是样品也分解了……如何选择干燥失重方法呢……愁,求建议~
300时,按 /2 + 1 制剂: 片剂、胶囊剂(非均匀制剂):每批至少10~20 片注射剂(均匀制剂):一般3~5支(测定3次)2.外观性状观察药物的性状是药品质量重要表征之一。如药品的颜色、臭味等因此,对药品外观性状的观察不仅具有鉴别意义,也在一定程度上反映药品的纯度及疗效。3.鉴别鉴别是利用药物的分子结构所表现的特殊的化学行为(如进行化学反应、测定药物的理化常数等)或光谱、色谱特征,来判断药品的真伪。(1)化学鉴别法①干法 将供试品加适当试剂在规定的温度下进行实验,观测所发生的特异现象.例[/
以前博文里说过,我2010年去华盛顿开会时,受到老同学们的热情款待。不过当时好像没提及,其中有同学在美国拿了博士学位后到美国药品及食品管理局(FDA)工作。在与他聊天的过程中,了解到一些FDA药审政策方面的信息。虽然有点感触,但因为是聊天,内容较零散,也就没在那篇博文里多说。此后,我又听到和看到一些中美两国药政管理的具体事例,体会到二者在理念和实践上有一些根本性的差别。我没有全面比较过两国的药政和药审方面的法律法规,而且本文也并未打算做条文上的仔细比较,只是就一些重要问题在这里谈谈我的所见所闻所感,供有兴趣的人参考和讨论。很显然,中国的国家药监局(SFDA)是FDA的翻版。这本来不奇怪,中国是落后国家,所以通过向发达国家学习,通过适当移植并建立自己的药政和药审体系,是一条合理并节约时间的道路,可以减少不必要的试错过程。如果说FDA是世界上最严格的新药评审机构,大概不会有什么异议。现实就是,如果一个药物获得了FDA的批准,基本可以肯定会获得其他国家的准入。FDA的严格不仅体现在于它现行的诸多细致的条文,也体现在为了应对美国新药发展(基本也是世界新药发展前沿)过程中不断出现的新情况和新问题,而对法规进行的不断完善和修订。举一个我的亲身经历。上世纪90年代中期我们在进行抗肿瘤药紫杉醇的开发,由于此药已在美国于1992年上市,因此只能作为仿制药报批。当时的质量标准是我负责建立的。尽管课题总负责人方起程教授在课题研究之初,就力主采用当时在国内尚不普及的HPLC方法进行质控,但当我们看到Bristol-Myers Squibb公司对紫杉醇的质控标准,还是有点吃惊,其中竟然包含了对单个杂质的认定和含量控制。这一标准比起我们自己只控制总杂质的标准,无疑难度要大,尽管我们制定的质量标准也符合当时中国的药审要求。需要指出的是,虽然当时我们的紫杉醇是按照仿制药即二类新药审批的,但据我所知,单以质控标准而言,要求并不低于任何一类新药。此外,关于药品纯度的要求,当时并无统一限定。我记得1990年版药典里的长春碱类药物的纯度只有95%,而紫杉醇的分离纯化其实也很困难,如果订成95%纯度也许能通过。当时课题负责人一度考虑把纯度订为98%,主要目的是甩开竞争对手;后来考虑到生产中可能不容易每次都达标,最后才把纯度订为97%。今天中国的药审标准已经很严格了,仅以质控标准为例,对于1.1类新药杂质控制的要求,恐怕不低于FDA对临床试用新药(IND)要求。有兴趣的人可以自己去对比,我就不在这里啰嗦了。不过需要注意的是,FDA的严格主要体现对用药安全的控制,这可以从近年来主要的药物退市(如著名的抗炎药万络即Vioxx退市事件)和诸多药物的风险警告都是由FDA发起的可以看出一二。相比之下,对于IND的药效要求,FDA的门槛似乎低于SFDA。这是为什么?因为FDA对自身职能的理解是要保护公众的用药安全性;对于药效的要求,只要比已有治疗药物更好即可,究竟好多少无关紧要。如果由于药效与现有治疗药物相比不具有竞争力,导致新药卖得不好,主要是与公司的利益有关,而与公众利益关系不大。例如Avastin尽管生命延长的作用极其有限,仍会被FDA批准。如果按照中国的药审实践,这个药物是否会被批准恐怕很有疑问(尽管我承认这类药在中国首先出现的可能性不大,这只是一个假设的状况而已)。SFDA是否在这点上会向FDA学习,降低药效的门槛;还是在提高安全性门槛的同时,保持对药效要求的高门槛,从而全面超越FDA的药审难度,大家可以留心观察。还有一点明显的不同,就是FDA和SFDA对于法律法规的尊重,以及执法力度。这是当今中国社会的普遍请况,我不想说得太多,以免触碰红线。
目前不知道待测物的纯度,但是将来实验中涉及到计算问题时,纯度肯定要被考虑的。根据同事的记忆,纯度应该是在90多一点(90-93%)。不算很纯。因为待测物在负离子模式下非常灵敏,所以一直在负离子模式下检测的。但是每次都只是看到一个峰,没别的峰存在啊。所以提高了待测物的浓度,先是100倍,后来干脆提高了5个数量级,再进样,还是看不到别的峰出现。当然这只是说明在负离子模式下看不到别的杂质,不代表就纯。可是在EI或者PCI模式下,也是看不到别的峰的存在的,而且能看到很大的柱流失。请问大家,该怎么样检测待测物纯度呢?有没有什么特别有效的办法呢?
请问药品纯度的不确定度如何计算 比如说含量≥99.5%?了解的老师给个提醒,谢谢
化合物纯度的鉴定方法,从快速,便宜,简便的要求出发,主要来之于以下几点:一 通过TLC的纯度的鉴定, 我将自己的心得分述如下1 展开溶剂的选择,不只是至少需要3种不同极性展开系统展开,我的经验是首先要选择三种分子间作用力不同的溶剂系统,如氯仿\甲醇,环己烷\乙酸乙酯,正丁醇\醋酸\水,分别展开来确定组分是否为单一斑点.这样做的好处是很明显的,通过组份间的各种差别将组分分开,有可能几个相似组份在一种溶剂系统中是单一斑点,因为该溶剂系统与这几个组分的分子间力作用无显著的差别,不足以在TLC区分.而换了分子间作用力不同的另一溶剂系统,就有可能分开.这是用3种不同极性展开系统展开所不能达到的.2 对于一种溶剂系统正如wxw0825所言,至少需要3种不同极性展开系统展开,一种极性的展开系统将目标组分的Rf推至0.5,另两种极性的展开系统将目标组分的Rf推至0.8,0.2。其作用是检查有没有极性比目标组分更大或更小的杂质。3 显色方法,光展开是不够的,还要用各种显色方法。一般一定要使用通用型显色剂,如10%硫酸,碘,因为每种显色剂(不论是通用型显色剂,还是专属显色剂在工作中都遇到他们都有一化合物不显色的时候),再根据组分可能含有混杂组份的情况,选用专属显色剂。只有在多个显色剂下均为单一斑点,这时才能下结论样品为薄层纯,二 通过熔程,判断纯度。原理很简单,纯化合物,熔程很短,1,2度。混合物熔点下降,熔程变长。三,基于HPLC的纯度鉴定,对于HPLC因为常用的系统较少,加之其分离效果好,我们一般不要求选择三种分子间作用力不同的溶剂系统,只要求选这三种不同极性的溶剂系统,使目标峰在不同的保留时间出峰。四,基于软电离质谱的纯度鉴定。如ESI-MS,APCI-MS。大极性化合物选用ESI-MS,极性很小的化合物选用APCI-MS,这些软电离质谱的特点是只给出化合物的准分子离子峰,通过正负离子的相互沟通来确定分子量。如果样品不纯,就会检出多对准分子离子峰,不但确定了纯度,还能明确混杂物的分子量。五,基于核磁共振的纯度鉴定,从氢谱中如果发现有很多积分不到一的小峰,就有可能是样品是样品中的杂质。利用门控去偶的技术通过对碳谱的定量也能实现纯度鉴定。好了,不能再多写了。这里只是对常见的纯度鉴定方法做了一个小结,从快速,便宜,简便的要求出发,以第一点最合要求,往后次之,所以对第一点详加讲述。当然每种方法多有各自的局限性,如基于氢谱的纯度鉴定,如果发现有很多积分不到一的小峰,还有可能使样品中的活泼质子,基于软电离质谱的纯度鉴定,如果混杂物的分子量与目标物一样就无法检出。等等还有很多。这需要大家在工做中积累,思考。要讲的话,我看好几篇都讲不完。最后说一下对化合物纯度的要求,世界上不存在100%纯的化合物。你希望要多高的纯度应该与你的目的有关,例如,如想测核磁共振鉴定结构,一般要求95%的纯度,如果想测EI-MS,纯度越高越好。99%以上。还有,以上的方法都不能区分对应异构体。
第一章 药物分析的基础知识第一节 药品的质量标准掌握药品质量标准的定义、主要内容和制订的原则。 一、药品质量标准的制订 药品(质量)标准是国家对药品质量、及检验方法所作的技术规定,是药品生产、经营、使用、检验和药品监督管理部门共同遵循的法定依据。我国现行的药品标准有:国家药典(中国药典)、局标准(国家食品药品监管局药品标准)。制订药品质量标准应遵循的原则:1、必须坚持质量第一的原则。2、制订质量标准要有针对性。3、检验方法的选择应根据“准确,灵敏,简便,快速”的原则。4、质量标准中限度的规定,即保证质量和符合生产实际来制订。 总之要体现“安全有效,技术先进,经济合理”的方针。二、药品质量标准的主要内容:(一)名称1、质量标准中药品的名称包括中文和英文名称,中文是按照CADN命名原则命名的;英文名称原则上按照INN命名原则确定英文名或拉丁文名,再译成中文正式品名。药品名称应明确、简短、发音清晰,全名最好不超过4个音节或四个字母。2、对属于某一相同药效的药物命名,应采用该类药物的词干。3.避免采用给患者以暗示的有关药理学、解剖学、生理学、病理学或治疗学的药品名称,并不得用代号命名。(二)性状1.外观、臭、味:具有鉴别意义,在一定程度上反映药物内在质量2.溶解性:药物重要物理性质,在质量标准中用术语表示,药典凡例对术语有明确规定。3.物理常数:熔点、沸点、比旋度、折光率、粘度等(三)鉴别利用药物分子结构表现出来的特殊化学行为或光谱特征,是鉴别药物真伪的重要依据。鉴别方法有物理方法、化学方法和生物学方法等。(四)检查包括有效性、均一性、纯度要求和安全性四个方面内容。1.有效性检查指和疗效相关,但在鉴别、纯度检查和含量测定中不能有效控制的项目。2.均一性主要是检查制剂的均匀程度。3.纯度要求是对药物中的杂质进行检查,一般为限量检查,不需要测定其含量。(五)含量测定用规定方法测定药物中有效成分的含量,常用方法有化学分析法、仪器分析法、生物学方法和酶化学方法等。使用化学分析法、仪器分析法测定称为“含量测定”,结果一般用含量百分率(%)表示。使用生物学方法和酶化学方法测定称为“效价测定”,结果一般用效价(国际单位IU)表示。
化合物纯度的判定化合物纯度的鉴定方法,从快速,便宜,简便的要求出发,主要来之于以下几点:一 通过TLC的纯度的鉴定, 我将自己的心得分述如下1 展开溶剂的选择,不只是至少需要3种不同极性展开系统展开,我的经验是首先要选择三种分子间作用力不同的溶剂系统,如氯仿\甲醇,环己烷\乙酸乙酯,正丁醇\醋酸\水,分别展开来确定组分是否为单一斑点.这样做的好处是很明显的,通过组份间的各种差别将组分分开,有可能几个相似组份在一种溶剂系统中是单一斑点,因为该溶剂系统与这几个组分的分子间力作用无显著的差别,不足以在TLC区分.而换了分子间作用力不同的另一溶剂系统,就有可能分开.这是用3种不同极性展开系统展开所不能达到的.2 对于一种溶剂系统正如wxw0825所言,至少需要3种不同极性展开系统展开,一种极性的展开系统将目标组分的Rf推至0.5,另两种极性的展开系统将目标组分的Rf推至0.8,0.2。其作用是检查有没有极性比目标组分更大或更小的杂质。3 显色方法,光展开是不够的,还要用各种显色方法。一般一定要使用通用型显色剂,如10%硫酸,碘,因为每种显色剂(不论是通用型显色剂,还是专属显色剂在工作中都遇到他们都有一化合物不显色的时候),再根据组分可能含有混杂组份的情况,选用专属显色剂。只有在多个显色剂下均为单一斑点,这时才能下结论样品为薄层纯二 通过熔程,判断纯度。原理很简单,纯化合物,熔程很短,1,2度。混合物熔点下降,熔程变长。三,基于HPLC的纯度鉴定,对于HPLC因为常用的系统较少,加之其分离效果好,我们一般不要求选择三种分子间作用力不同的溶剂系统,只要求选这三种不同极性的溶剂系统,使目标峰在不同的保留时间出峰。四,基于软电离质谱的纯度鉴定。如ESI-MS,APCI-MS。大极性化合物选用ESI-MS,极性很小的化合物选用APCI-MS,这些软电离质谱的特点是只给出化合物的准分子离子峰,通过正负离子的相互沟通来确定分子量。如果样品不纯,就会检出多对准分子离子峰,不但确定了纯度,还能明确混杂物的分子量。五,基于核磁共振的纯度鉴定,从氢谱中如果发现有很多积分不到一的小峰,就有可能是样品是样品中的杂质。利用门控去偶的技术通过对碳谱的定量也能实现纯度鉴定。好了,不能再多写了。这里只是对常见的纯度鉴定方法做了一个小结,从快速,便宜,简便的要求出发,以第一点最合要求,往后次之,所以对第一点详加讲述。当然每种方法多有各自的局限性,如基于氢谱的纯度鉴定,如果发现有很多积分不到一的小峰,还有可能使样品中的活泼质子,基于软电离质谱的纯度鉴定,如果混杂物的分子量与目标物一样就无法检出。等等还有很多。这需要大家在工做中积累,思考。要讲的话,我看好几篇都讲不完。最后说一下对化合物纯度的要求,世界上不存在100%纯的化合物。你希望要多高的纯度应该与你的目的有关,例如,如想测核磁共振鉴定结构,一般要求95%的纯度,如果想测EI-MS,纯度越高越好。99%以上。还有,以上的方法都不能区分对应异构体。
日本科学技术振兴机构村上达也博士研究员和饭岛澄男研究小组负责人,最近成功完成了利用碳纳米管(CNH)作为药物传送系统运载载体的基础实验。利用这一药物传送系统,科学家成功地使抗炎症药物地塞米松吸附在碳纳米管内,从而确认了碳纳米管具有缓慢释放药物成分和缓释后保持药效的特性,此项研究成果可大大加速碳纳米管的药物运载研究与开发。 实验中,科学家首先使用1比1的水与乙醇混合溶剂,在室温液相中使药物地塞米松吸附在碳纳米管中。碳纳米管直径为80至100纳米,具有高亲和性,而地塞米松也是一种易于吸附的物质。碳纳米管氧化后,管端部和侧面会出现孔洞,经过对开孔与未开孔碳纳米管进行对比发现,开孔后的碳纳米管吸附地塞米松的药量比未开孔的高出6倍多。碳纳米管出现孔洞后,每克碳纳米管能够吸附200毫克地塞米松。碳纳米管吸附地塞米松后,经过两周时间才能释放出一半吸附量,证明具有缓释特征。地塞米松在试管中有促进骨形成作用,使用碳纳米管中释放出的地塞米松进行试验发现了这一作用。同时发现,在药物释放后也能保持药效。 碳纳米管具有高纯度和尺寸一致等优点,对人体毒性较小,在结构上表面积大,能携带大量药物。科学技术振兴机构的科学家正着手对抗癌药物传送系统进行试验,不久后将进入动物试验阶段。
[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]测常温下是固体的有机物纯度有什么好办法吗?我用溶剂去溶解进样,不知浓度是多少才合适,还有纯度要怎么计算得来呢?求解。
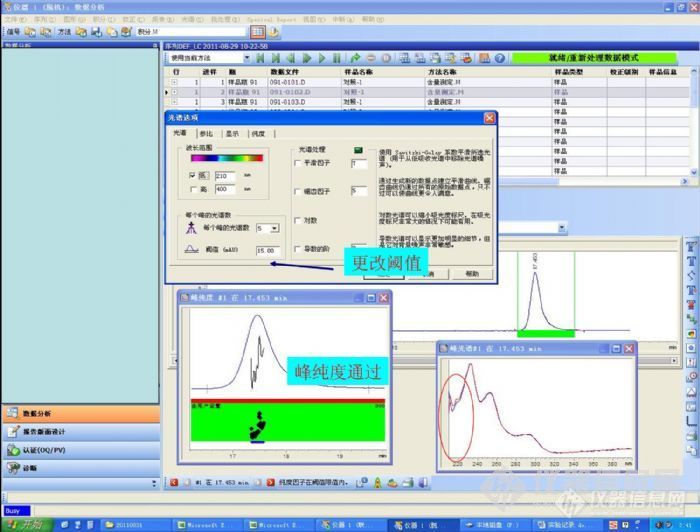
二极管阵列检测器与峰纯度分析1引言 在药物色谱分析方法开发过程初步完成后,需要对分析方法进行验证,验证的内容包括定量限,精密度和专属性等内容…一些人认为分析方法的专属性是首选必须明确的验证项目,如果分析方法专属性不够,最终会影响准确度等验证内容,得出错误的结论。除了传统的验证专属性的方法外,峰纯度(Peak Purity)检查越来越多的用于评价方法的专属性,可以提供峰纯度的检测器有多通道紫外可见光检测器,二极管阵列检测器(DAD)和质谱(MS)。目前一般药物实验室都配备有二级管阵列检测器,在多种资料和国内药物分析培训中,建议在使用二极管阵列检测器做峰纯度分析时候,主峰的纯度因子应大于980。实际上,该建议的纯度因子及其相关参数表述是安捷伦(Agilent)色谱工作站光谱部分采用的峰纯度检查表现形式,别的色谱工作站会采取不同的表现形式,如waters的化学工作站采取计算峰纯度角与阈值角来比较峰纯度的。下面我们以安捷伦的chemsation中光谱选项涉及到的相关参数和处理过程为例讨论二极管阵列检测器与峰纯度分析过程。2评估峰纯度的原理 不同的化合物具有不同的形状的光谱(这里讨论的是紫外-可见光光谱图),在光谱上不同波长比值是一定的,如果色谱峰是均匀的同一种物质,那么在色谱峰流出的各个时间点,不同波长的比值是一定的。图1显示的是同时检测两个波长(信号A和信号B)的色谱图,下图显示的是两个波长(A/B)的比值图。纯的色谱图比值是恒定的,显示为一条直线,不纯的比值图是有波动的。http://ng1.17img.cn/bbsfiles/images/2012/10/201210150742_396570_2265735_3.jpg图1 如果用双波长检测器,同时检测两个波长并绘制比值图就可以评价峰纯度了,问题是选择那两个波长呢?如果选择的其中一个波长几乎没有吸收呢?只选择两个波长比值来评价整个峰纯度足够吗?有没有更加优化的办法呢?二极管阵列检测器可以解决上述问题。二极管阵列检测器可以实时提取色谱流出物的光谱,并采用合适的算法比较色谱峰每个时间点的光谱图,这远比比较光谱图上两个波长点更加准确和可行。下面我们讨论二极管阵列检测器考察峰纯度的过称(以Agilent为例)。3二极管阵列检测器和分析峰纯度的方法 二极管阵列检测器与普通的紫外-可见光检测器的最大构造不同是不对穿过检测池的进行分光。二极管阵列检测器在检测池的后方分光,全波段的光到达二极管阵列并产生信号。二极管阵列检测器可以实时获得检测池物质的紫外-可见光吸收光谱图,这是普通紫外-可见光检测器无法完成的。基于二极管阵列检测器以上特性,安捷伦的chemstation 采用两种方式显示峰纯度:(1)光谱归一化法;(2)光谱相似曲线。 光谱归一化法比较简单,选取色谱图上的3-5个点(这些点一般是峰开始,峰上升,峰顶点,峰下降,峰结束等色谱峰对称的几个点,因为二极管阵列是实时获取光谱图,当然你可以在色谱上选择更多的点),提取这些点的光谱图,把这些点的光谱图叠放,吸收值归一化,看这些光谱图是否重合,从重合的程度来判断峰的纯度。图2显示的是光谱归一化法评价色谱峰纯度,保留时间7.8min的色谱峰光谱图不能完全重合,显然该色谱峰是不纯的。http://ng1.17img.cn/bbsfiles/images/2012/10/201210150748_396571_2265735_3.jpg图2 光谱归一化法直观,与其相比光谱相似曲线从计算相似因子入手,绘制相似曲线,评价峰纯度过程更加精细化,相似因
目前,多数实验室的标准品都是购于厂家生产的,很少是自制标准品。价格相对较昂贵,如果担心质量不合格再自行测定纯度的话,又增加了成本,很多人认为没必要,况且标准品买回来有时候只有一丢丢。今天呢,咱们先不讨论买的标准品需不需要都进行纯度测定,咱们就只讨论一旦要进行纯度测定,应该怎么做。。。。。。常见的纯度分析方法纯度是其成为标准品的重要指标之一。常见的纯度分析方法有:高效液相色谱法、气相色谱法、分光光度法、滴定法和质量平衡法等方法。但这些方法除了各自有其适用范围之外,最大的问题在于都需要有纯度或含量准确的标准物质作为参比,才能给出未知物纯度的信息。差示扫描量热(DSC)测定物质浓度的方法具有操作简单,不需要标准物质等优点,只要物质纯度达到98%以上,即可通过对该物质的DSC曲线进行适当处理给出其纯度信息。该方法已广泛应用于金属、合金等无机物纯度鉴定,因大多数有机化合物存在着受热分解的问题,DSC法纯度检测收到限制。标准品的纯度测定主要有以下两种1.直接测定用液相的峰面积归一法,这样测不是很科学。比如说你采用254nm的波长检测,有些杂质在这个波长处的响应值很低,这样这些杂质的量即使很高也不会在图谱上显示出来,得出的面积归一化结果也不可信。用液相测注意两点:1.波长的选择,尽可能的选择短波长。2.浓度的选择,也是尽可能选择高浓度,不然就是有杂质,你的机器也看不见!直接测定法还有直接滴定和对照品法以及内标法等。2.间接测定间接测定是首先知道它的杂质的含量是多少,我们再间接测定样品的含量。简单的说就是:纯度=100%-杂质含量%杂质通常包括水分、无机杂质(比如硫酸盐、氯化物等)、有机残留等。Q&A:由于标准品是自己分离获得,所以需要测定其纯度。用DAD检测器测其纯度,可能不准,有人建议用LC-MS测定,那么如何测定呢?1. 配同等浓度的溶液,用已知含量的标准品标定自己纯化标准品的纯度。标准品经MS离子化后,检测的主要色谱峰即为目标化合物的色谱峰,水分、重金属、其他结构的杂质即使保留时间一样也不会出峰干扰,结果比较可靠。2. LC-MS进样后检测总离子流,有机杂质可以产生色谱峰,该色谱峰在保留时间上与目标化合物色谱峰的保留时间会有差别,从而可以观察标准品的纯度问题。一些在DAD上不响应的杂质,在MS上会出峰,从而使测定的结果更准确。但也存在一个问题,不同化合物离子化效率不同,同样的浓度会产生不同的峰面积。LC-MS可以测定标准品的纯度,但必须有对照品进行比较,用已知含量的标准品外标法确定自己标准品的量值,然后换算成纯度,属于外标法定量的一种,主要能避免DAD测定纯度过程中杂质带来的干扰。其实使用LC/MS技术也不能保证准确测定纯度,LC/MS测定由于会受所采用离子化技术的限制。样品中某些杂质可能在所使用离子化技术下不能离子化或者离子化效率很低,导致该杂质不能检测到,测定纯度无法实现,当然如果所测杂质和主成分相关,一般可采用与主成分相同的离子化方法,结合适合的色谱分离方法测定。要做高效液相,最近买了四个标准品,有两个的纯度只有91.7%和96.5%,会不会太低了,能不能做啊?从ISO指南和国标工作导则来看,标准品的特性是:性质均匀:由于标准品是每一批次生产的,从中抽样进行分析定值,再装瓶。所以标准品必须性质均匀,使同一批次的产品在标定的性质和值方面是一致的。只有当这个条件满足时,证书上的数值对客户所使用的产品才是有意义的。定值准确:标准品由于用于做为测量的标准,其特性或值必须是非常准确的。这和一般的试剂是不一样的。试剂的含量定值通常是一个比较宽松的范围,如大于98%等。而标准品的含量不仅仅是高,而且生产商对标准品的定值负责,保证标准品的值在证书定值的一定范围以内。因此,标准品的特点不在于含量高,而在于定值准。即使某些标准品由于技术上面的原因纯度较低,如低于90%,只要其定值准,仍是合格的标准品。 不确定度的范围小。证书:标准品的证书上一般包含需要定值的信息,如化学物质标准品包括含量等。附:1.标准物质管理处发布的【标准物质常见问题汇总与答复】1、问:标准物质的用途和应用范围答:药品标准物质不能作为药物或医疗器械而施用于人或动物。我所分发的药品标准物质主要用于法定药品质量标准中的相关项目的检测用,详细内容请见使用说明书。2、问:有效期答:除了说明书上注明有效期的品种外,药品标准物质一般没有像药品一样设置有效期。在规定的储存和使用条件下,我所定期进行特性量值的稳定性核查,若发现影响使用将及时公布相关信息。3、问:储存答:标准物质一般应密闭、避光保存,对有特殊储存要求(如低温、避光等)的标准物质,说明书上均有说明,今后标签上也将注明。建议不要一次购买大量的标准物质,以免储存不当出现问题。需要冷藏或冷冻保存的品种,短时间短距离的冰盒运输对特性不会造成影响。4、问:纯度答:目前含量测定用的化学对照品的标签及说明书均赋有量值,以前发放的部分中药化学含量测定用未赋值的品种,按 100.0%计。5、问:是否能用于说明书用途范围外的检验、科研答:需要用户进行分析与验证。但内毒素国家标准品除按说明书载明的用途外,可用于制造家兔发热模型,使用细菌内毒素检查用水或生理盐水将内毒素国家标准品制备成浓度为5EU/ml的溶液,每只家兔每公斤体重注射1ml,即可使家兔体温升高0.6℃以上。6、问:使用前是否需要干燥答:标准物质说明书上对使用前是否需要干燥等情况,均有相关说明。除另有规定外,对照药材不需要特殊处理。7、问:标准物质证书或测试报告答:我们暂时还不能提供证书或者测试报告。8、问:新批号标准品出来后旧批号能否继续使用答:新旧批号更换过程中,我们将及时公示,请关注我所网站标准物质栏,部分品种将设置3-6个月的缓冲期。9、问:用五氧化二磷干燥的标准物质是否要在相同条件下保存答:不需要。按说明书的条件保存即可。10、问:从哪里可以查到标准物质的结构、物理化学特性等答:中药化学对照品的说明书大多附有结构,化学药品的可以通过中国药典二部查阅。另外,我们分发的标准物质都提供了英文名,可以通过文献查阅有关详情。11、问:内毒素标准品是否有10EU一支的答:我所的标准品均为100EU/支,10EU的工作品是鲎试剂生产企业生产的,低效价的内毒素稳定性差,我们不建议使用这种工作品进行检验工作。12、问:为什么对照品在色谱上不出峰?答:请按国家标准中提供的条件考察自己的色谱条件因素。色谱不出峰一般来讲有如下原因:一是色谱条件不合适;二是信号采集时衰减过高,建议减小衰减;三是采集时间过短,建议增加采集时间。13、问:为什么对照品出2个或多个峰答:我所分发的标准物质除多组分的以外,均只有一个主峰,杂质峰不会超过赋值的范围。如果杂质峰超过赋值的范围,可能属于以下原因:① 配置对照品溶液的容器或溶剂被污染;② 盛放流动相的容器或配置溶剂被污染;③ 进样器被污染;④ 高效液相进样阀被污染;⑤ 色谱柱填充物出现断裂等。附2.中检所关于标准品纯度检测的规定标准品、对照品系指用于药品鉴别、检查、含量测定的标准物质,即药品标准中使用的具有确定的特性或量值,用于对供试药品赋值、定性、评价测定方法或校准仪器设备的物质,其中标准品系指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质。对于中检所已经发放提供的对照品(标准品),且使用方法相同时,应使用中检所提供的现行批 号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用 标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV 法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。对照品(标准品)标定的技术要求:纯度测定方法应选用色谱法,并采用两种以上不同分离机理或不同色谱条件并经验证的色谱方法相互验证比较,同时采用二极管阵列检测器或其它适宜方法检测HPLC法的色谱峰纯度,而后根据测定结果经统计分析确定对照品(标准品)原料的纯度。对于组份单一、纯度较高的药物,对照品(标准品)标定方法宜首选可进行等当量换算、精密度高、操作简便快速的容量法。可根据药物分子中所具有的官能团及其 化学性质,选用不同的容量分析方法,但应符合如下条件:(1)反应按一个方向进行完全;(2)反应迅速,必要时可通过加热或加入催化剂等方法提高反应速 度;(3)共存物不得干扰主药反应,或能用适当方法消除;(4)确定等当点的方法要简单、灵敏;(5)标化滴定液所用
目前,多数实验室的标准品都是购于厂家生产的,很少是自制标准品。价格相对较昂贵,如果担心质量不合格再自行测定纯度的话,又增加了成本,很多人认为没必要,况且标准品买回来有时候只有一丢丢。今天呢,咱们先不讨论买的标准品需不需要都进行纯度测定,咱们就只讨论一旦要进行纯度测定,应该怎么做。。。。。。常见的纯度分析方法纯度是其成为标准品的重要指标之一。常见的纯度分析方法有:高效液相色谱法、气相色谱法、分光光度法、滴定法和质量平衡法等方法。但这些方法除了各自有其适用范围之外,最大的问题在于都需要有纯度或含量准确的标准物质作为参比,才能给出未知物纯度的信息。差示扫描量热(DSC)测定物质浓度的方法具有操作简单,不需要标准物质等优点,只要物质纯度达到98%以上,即可通过对该物质的DSC曲线进行适当处理给出其纯度信息。该方法已广泛应用于金属、合金等无机物纯度鉴定,因大多数有机化合物存在着受热分解的问题,DSC法纯度检测收到限制。标准品的纯度测定主要有以下两种1.直接测定用液相的峰面积归一法,这样测不是很科学。比如说你采用254nm的波长检测,有些杂质在这个波长处的响应值很低,这样这些杂质的量即使很高也不会在图谱上显示出来,得出的面积归一化结果也不可信。用液相测注意两点:1.波长的选择,尽可能的选择短波长。2.浓度的选择,也是尽可能选择高浓度,不然就是有杂质,你的机器也看不见!直接测定法还有直接滴定和对照品法以及内标法等。2.间接测定间接测定是首先知道它的杂质的含量是多少,我们再间接测定样品的含量。简单的说就是:纯度=100%-杂质含量%杂质通常包括水分、无机杂质(比如硫酸盐、氯化物等)、有机残留等。Q&A:由于标准品是自己分离获得,所以需要测定其纯度。用DAD检测器测其纯度,可能不准,有人建议用LC-MS测定,那么如何测定呢?1. 配同等浓度的溶液,用已知含量的标准品标定自己纯化标准品的纯度。标准品经MS离子化后,检测的主要色谱峰即为目标化合物的色谱峰,水分、重金属、其他结构的杂质即使保留时间一样也不会出峰干扰,结果比较可靠。2. LC-MS进样后检测总离子流,有机杂质可以产生色谱峰,该色谱峰在保留时间上与目标化合物色谱峰的保留时间会有差别,从而可以观察标准品的纯度问题。一些在DAD上不响应的杂质,在MS上会出峰,从而使测定的结果更准确。但也存在一个问题,不同化合物离子化效率不同,同样的浓度会产生不同的峰面积。LC-MS可以测定标准品的纯度,但必须有对照品进行比较,用已知含量的标准品外标法确定自己标准品的量值,然后换算成纯度,属于外标法定量的一种,主要能避免DAD测定纯度过程中杂质带来的干扰。其实使用LC/MS技术也不能保证准确测定纯度,LC/MS测定由于会受所采用离子化技术的限制。样品中某些杂质可能在所使用离子化技术下不能离子化或者离子化效率很低,导致该杂质不能检测到,测定纯度无法实现,当然如果所测杂质和主成分相关,一般可采用与主成分相同的离子化方法,结合适合的色谱分离方法测定。要做高效液相,最近买了四个标准品,有两个的纯度只有91.7%和96.5%,会不会太低了,能不能做啊?从ISO指南和国标工作导则来看,标准品的特性是:性质均匀:由于标准品是每一批次生产的,从中抽样进行分析定值,再装瓶。所以标准品必须性质均匀,使同一批次的产品在标定的性质和值方面是一致的。只有当这个条件满足时,证书上的数值对客户所使用的产品才是有意义的。定值准确:标准品由于用于做为测量的标准,其特性或值必须是非常准确的。这和一般的试剂是不一样的。试剂的含量定值通常是一个比较宽松的范围,如大于98%等。而标准品的含量不仅仅是高,而且生产商对标准品的定值负责,保证标准品的值在证书定值的一定范围以内。因此,标准品的特点不在于含量高,而在于定值准。即使某些标准品由于技术上面的原因纯度较低,如低于90%,只要其定值准,仍是合格的标准品。 不确定度的范围小。证书:标准品的证书上一般包含需要定值的信息,如化学物质标准品包括含量等。附:1.标准物质管理处发布的【标准物质常见问题汇总与答复】1、问:标准物质的用途和应用范围答:药品标准物质不能作为药物或医疗器械而施用于人或动物。我所分发的药品标准物质主要用于法定药品质量标准中的相关项目的检测用,详细内容请见使用说明书。2、问:有效期答:除了说明书上注明有效期的品种外,药品标准物质一般没有像药品一样设置有效期。在规定的储存和使用条件下,我所定期进行特性量值的稳定性核查,若发现影响使用将及时公布相关信息。3、问:储存答:标准物质一般应密闭、避光保存,对有特殊储存要求(如低温、避光等)的标准物质,说明书上均有说明,今后标签上也将注明。建议不要一次购买大量的标准物质,以免储存不当出现问题。需要冷藏或冷冻保存的品种,短时间短距离的冰盒运输对特性不会造成影响。4、问:纯度答:目前含量测定用的化学对照品的标签及说明书均赋有量值,以前发放的部分中药化学含量测定用未赋值的品种,按 100.0%计。5、问:是否能用于说明书用途范围外的检验、科研答:需要用户进行分析与验证。但内毒素国家标准品除按说明书载明的用途外,可用于制造家兔发热模型,使用细菌内毒素检查用水或生理盐水将内毒素国家标准品制备成浓度为5EU/ml的溶液,每只家兔每公斤体重注射1ml,即可使家兔体温升高0.6℃以上。6、问:使用前是否需要干燥答:标准物质说明书上对使用前是否需要干燥等情况,均有相关说明。除另有规定外,对照药材不需要特殊处理。7、问:标准物质证书或测试报告答:我们暂时还不能提供证书或者测试报告。8、问:新批号标准品出来后旧批号能否继续使用答:新旧批号更换过程中,我们将及时公示,请关注我所网站标准物质栏,部分品种将设置3-6个月的缓冲期。9、问:用五氧化二磷干燥的标准物质是否要在相同条件下保存答:不需要。按说明书的条件保存即可。10、问:从哪里可以查到标准物质的结构、物理化学特性等答:中药化学对照品的说明书大多附有结构,化学药品的可以通过中国药典二部查阅。另外,我们分发的标准物质都提供了英文名,可以通过文献查阅有关详情。11、问:内毒素标准品是否有10EU一支的答:我所的标准品均为100EU/支,10EU的工作品是鲎试剂生产企业生产的,低效价的内毒素稳定性差,我们不建议使用这种工作品进行检验工作。12、问:为什么对照品在色谱上不出峰?答:请按国家标准中提供的条件考察自己的色谱条件因素。色谱不出峰一般来讲有如下原因:一是色谱条件不合适;二是信号采集时衰减过高,建议减小衰减;三是采集时间过短,建议增加采集时间。13、问:为什么对照品出2个或多个峰答:我所分发的标准物质除多组分的以外,均只有一个主峰,杂质峰不会超过赋值的范围。如果杂质峰超过赋值的范围,可能属于以下原因:① 配置对照品溶液的容器或溶剂被污染;② 盛放流动相的容器或配置溶剂被污染;③ 进样器被污染;④ 高效液相进样阀被污染;⑤ 色谱柱填充物出现断裂等。附2.中检所关于标准品纯度检测的规定标准品、对照品系指用于药品鉴别、检查、含量测定的标准物质,即药品标准中使用的具有确定的特性或量值,用于对供试药品赋值、定性、评价测定方法或校准仪器设备的物质,其中标准品系指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质。对于中检所已经发放提供的对照品(标准品),且使用方法相同时,应使用中检所提供的现行批 号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用 标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV 法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。对照品(标准品)标定的技术要求:纯度测定方法应选用色谱法,并采用两种以上不同分离机理或不同色谱条件并经验证的色谱方法相互验证比较,同时采用二极管阵列检测器或其它适宜方法检测HPLC法的色谱峰纯度,而后根据测定结果经统计分析确定对照品(标准品)原料的纯度。对于组份单一、纯度较高的药物,对照品(标准品)标定方法宜首选可进行等当量换算、精密度高、操作简便快速的容量法。可根据药物分子中所具有的官能团及其 化学性质,选用不同的容量分析方法,但应符合如下条件:(1)反应按一个方向进行完全;(2)反应迅速,必要时可通过加热或加入

[align=center][b][img=,600,336]https://ng1.17img.cn/bbsfiles/images/2019/09/201909121439522763_1873_932_3.jpg!w690x387.jpg[/img][/b][/align][b]质量研究与质量标准质量研究[/b]🔥 原料药的质量研究合成多肽原料药的质量研究除参考一般化学药物的研究思路进行常规项目的研究外,还应根据合成多肽的结构特征、制备工艺特点和生物学特点等进行针对性的研究,研究项目一般包括:外观性状、理化常数、鉴别、氨基酸组成分析、水分、反离子含量、纯度、有机溶剂和反应试剂残留量、生物学安全性检查、含量和/或活性效价测定等。检测方法研究和验证的基本思路和要求与已颁布的相关技术指导原则相一致。对于合成多肽药物,除常规项目外,理化常数一般需要关注其比旋度、等电点(pI)、溶解性(主要为水和缓冲液中)等。一般而言,多肽药物的常规检查项目与其它化学药物相同。此外,与多肽药物的结构及合成特点相关的一些检查项目,例如氨基酸组成分析、反离子(例如三氟醋酸或醋酸根)含量、反应试剂残留量(例如从树脂上裂解多肽使用了氢氟酸,需要检查氟化物残留量)等,则需要在原料药质量研究中予以重视。相关肽检查(或称有关物质检查)是反映多肽化学纯度的重要指标之一,根据多肽的理化性质、分子大小,可选择合适的色谱、电泳等方法进行。短肽可参考一般化学药品有关物质检查的研究思路选用适宜的方法;长肽的有关物质检查方法除常见的RP-HPLC外,还可考虑使用高效离子交换色谱(HPIEC)、毛细管电泳技术等,非解离条件下的高效分子排阻色谱(HPSEC)、聚丙烯酰胺凝胶电泳(PAGE)以及激光散射粒度测定等技术可用于聚合体/低聚体的检查。有关物质检查的方法学验证应能证明所采用的方法可以有效分离目标多肽与工艺杂质(例如缺失肽等)、降解产物(例如二硫键交换或氧化产物等)、聚合物等。一般应考察两种以上不同原理的方法,高效液相色谱法至少应包括一种梯度洗脱方法,并采用多肽粗品和强制降解试验等对方法的专属性等进行考察、对比,此外还应注意研究多波长检测的结果并选择合适的检测波长等。合成多肽因结构特征不同于通常的小分子化学药品,纯度检查有时难以从根本上有效控制产品安全性,需要进行必要的生物学安全性检查(如过敏试验、降压物质、升压物质、异常毒性等)以全面控制产品质量、保证安全性。此外,根据产品具体情况,对于长肽,有时尚需进行免疫原性或抗原活性等生物特性的研究。含量测定是评价多肽质量的重要指标之一,理化方法测定其含量时称为“含量测定”,生物学方法或酶化学方法测定其效价时称为“效价测定”。对于短肽,理化方法测得的含量可以反映其有效程度时,首选简单、通用的含量测定方法;对于具有一定空间结构才能发挥其活性的多肽,需进行生物学方法或酶化学方法测定药物活性(效价)的研究,包括含量与活性的关系、相应的方法学验证等。🔥 制剂的质量研究合成多肽制剂的质量研究基本思路和要求可参照《化学药物质量标准建立的规范化过程技术指导原则》、《化学药物制剂研究基本技术指导原则》等相关内容,根据合成多肽的具体特点,在原料药质量研究的基础上,结合剂型特点、处方工艺以及临床使用特点,重点研究所用辅料和制剂工艺对产品质量的影响、制剂辅料和制剂产生的降解产物对检测方法的影响以及与剂型相关的质量要素。研究项目一般亦应包括性状、鉴别、检查(安全性、均一性、纯度要求与有效性指标等)、含量或效价测定等几个方面。[b]质量标准[/b]合成多肽药物质量标准的制订原则、要求与《化学药物质量标准建立的规范化过程技术指导原则》是一致的。即,在系统的质量控制研究基础上,充分考虑药品安全、有效、质量可控的要求,以及生产、流通和使用等环节的影响,确定能够揭示、控制药物内在品质的检测项目、分析方法和限度要求,如原料药质量标准应包括氨基酸组成、等电点、中长肽的肽图等。合理可行的质量标准应能有效控制产品质量以保证临床用药的安全性和有效性,并有效地控制药品批间质量的一致性。相关质控项目的限度确定也应参考相关的指导原则,例如对于有关物质检查限度的确定可以参考《化学药物杂质研究的技术指导原则》、仿制品种同时还可参考《化学药品仿制研究技术指导原则》等的原则性要求,并结合产品本身的特性及临床使用情况,视具体情况而定。随着药物研发进程的深入,研究数据积累的不断丰富、方法学研究的完善和药物研究技术的不断发展,质量标准在不同研究阶段需要不断修订和完善。[b]稳定性研究[/b]合成多肽药物稳定性研究的基本原则应遵循《化学药物稳定性研究技术指导原则》的一般性要求。与一般化学药物相比,多肽药物的稳定性较差。引起多肽药物不稳定的原因主要有水解、氧化、外消旋化、二硫键的断裂及重排、β消除、凝聚、沉淀、吸附等。当多肽处于溶液中或高湿下保存时,其降解或聚合的速度会比干燥条件下大为增加。因此,稳定性研究应根据多肽药物稳定性的特点合理选择试验条件、考察项目。加速试验和长期留样试验的试验条件应依据药物对温度、湿度和光照等条件的敏感程度的考察(影响因素试验)基础上选择;考察项目除常规项目(例如原料药的比旋度、有关物质和含量等)外,根据具体情况,可能还需要考察其生物活性的变化。与其他化学药物不同,多肽药物可能具有一定程度的表面活性,有与直接接触药品的包装材料和容器发生吸附等相互作用的可能,从而引起制剂效价、生物活性下降。例如有些多肽分子能够与玻璃表面的硅醇基发生相互作用。因此,在包装材料的选择方面需注意其与多肽药物相互作用的研究,有些情况下可选择特殊处理后的包装容器,如表面经硅烷化处理的容器等。[b]名词解释非天然氨基酸:[/b][color=#717070]除自然界生物体中存在的氨基酸外,其它由人工合成制备的氨基酸。[/color][b]反离子:[/b][color=#717070]和多肽形成离子对的带有相反电荷的离子。[/color][b][b][/b][/b]参考文献1.Guidance for Industry for the Submission ofChemistry,Manufacturing,and Controls Information for Synthetic Peptide Substances,FDA,1994。2.合成多肽专题研讨会会议纪要,药品审评中心,2001。3.多肽药物分析方法研究进展,叶晓霞,俞雄,中国医药工业杂志,2003,34(7)。[b]著 者《合成多肽药物药学研究技术指导原则》课题研究组。[/b]
第八章 药物的杂质检查掌握药物中杂质的来源和分类,杂质限量的定义和计算;氯化物、硫酸盐、铁盐、重金属、砷盐、溶液颜色、易炭化物、澄清度、炽灼残渣、干燥失重、有机溶剂残留量等检查项目的原理和方法。第一节 杂质和杂质的限量检查一、杂质来源和分类1.杂质是指药物中存在的无治疗作用或影响药物的稳定性和疗效,甚至对人健康有害的物质。2.杂质的来源,主要有两个: 一是由生产过程中引入。(精制未能完全除去,原料不纯或存在反应不完全,中间产物与副产物)。 二是在贮藏过程中产生。(贮藏过程外界条件影响,或因微生物的作用,发生水解、氧化、分解、异构化、晶型转变、聚合、潮解和发霉等变化,产生有关的杂质)。3.杂质按来源分类,可分为一般杂质和特殊杂质。一般杂质是指在自然界中分布较广泛,在多种药物生产和贮藏过程中容易引入的杂质。如酸、碱、水份、氯化物、硫酸盐等。特殊杂质是指在个别药物的生产和贮藏过程中引入的杂质。 杂质按其性质还可分为信号杂质和有害杂质,信号杂质本身一般无害,其含量多少可以反映出药物纯度水平。有害杂质如重金属、砷盐,在质量标准中要严格控制,以保证用药安全。二、杂质的限量检查由于杂质不可能完全除尽,所以在不影响疗效和不发生毒性的原则下,既保证药物质量,又便于制造、贮藏和制剂生产,对于药物中可能存在的杂质,允许有一定限量,通常不要求测定其准确含量。《药典》中规定的杂质检查均为限量(或限度)检查。 杂质限量:指药物中所含杂质的最大容许量。 表示方法:通常用百分之几或百万分之几(ppm)来表示。对危害人体健康、影响药物稳定性的杂质,必须严格控制其限量。检查时可用杂质的纯品或对照品在相同条件下来比较。限量计算:杂质限量=杂质量/供试品量 ×100% =标准溶液体积×标准溶液浓度/供试品 ×100% 或 L=V×C/S ×100%也有不用标准液对比,只在一定条件下观察有无正反应出现。
[font='Times New Roman'][font=宋体]结晶是指溶质自动从过饱和溶液中析出形成新相的过程,这一过程不仅包括溶质分子凝聚成固体,也包括这些分子有规律的排列在一定的晶格中。药物晶型的设计影响到药物的稳定性、纯度、溶出速率、流动性、压缩堆密度以及生物利用度,因此通过结晶控制实现对药物晶型形态的控制显得尤为重要。将近红外检测技术应用于药物结晶过程,可以实现在线结晶度的检测,确定多晶型,提供有关晶体结构的信息。[/font][/font]
在看方法时,方法提到试剂:Pentane(正戊烷), J.T. Baker ‘Baker Analyzed’ or equivalent请问正戊烷纯度是什么纯度阿?百度了下Baker Analyzed也没有相关的信息,那位知道的?谢谢了
我们购买的标准物质都不是100%的纯物质,都是有一定杂质含量的,如果我想验证一下厂家给出的标准物质的纯度是否正确,那么怎样来测定农药标准物质的纯度呢?哪些地方可以检测?需要用到什么仪器和方法?大概需要的标准物质的量是多少呢?请大家指教,非常感谢!