各位大佬求指点,新手小白用的是实验室的便携式拉曼,785nm,溶液装在仪器配套的石英比色皿里面,用的是配套的固定装置(就有个孔,直接把探头伸进去接触比色皿),把水当做背景扣了,然后测1g/ml的药物溶液,没峰,平的??????
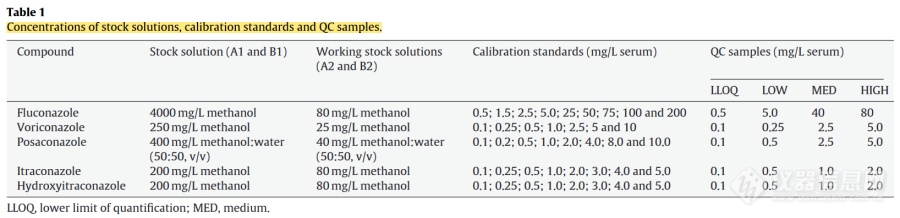
这篇文献里用的是不同浓度的甲醇或者甲醇-水配制,意思是各自从储备液稀释到系列工作溶液了,再各取100μ配个混标溶液吗?配制溶液的时候用不同浓度的甲醇或者甲醇-水不会很麻烦吗?还是说这个calibration standards的浓度是混标溶液里算出来该药物的浓度?怎么算呢?我对混标溶液的理解是,各自配1 mg/ml的储备液,然后从这各自的储备液里就各取100μ,配制混标,稀释得到系列工作溶液,再继续稀释到标曲的浓度[img=,690,167]https://ng1.17img.cn/bbsfiles/images/2022/10/202210161045239449_1230_5833917_3.png!w690x167.jpg[/img][img=,690,411]https://ng1.17img.cn/bbsfiles/images/2022/10/202210161045240738_2760_5833917_3.png!w690x411.jpg[/img]
梯度方法测定药物头孢克洛中有关物质时,空白溶剂在主峰后面总有许多杂峰,样品溶液和对照溶液相应位置也有。这是什么原因?当使用高纯试剂时要少点。
使用的是岛津GC-2010plus ,AOC5000顶空进样器,FID检测器,在外标法测药物残留时,第一针对照溶液峰面积总是与其余几针对照峰面积相差较大(其余几针对照溶液峰面基几乎相差无几)。本人气相小白一枚http://simg.instrument.com.cn/bbs/images/default/em09502.gif,为什么会这样呢?还望各位老师解答。
在人体中,大部分的环境是水相环境,体液、血液和细胞浆液都是水溶液,药物要转运扩散至血液或体液,需要溶解在水中,要求药物有一定的水溶性(又称为亲水性)。而药物在通过各种生物膜(包括细胞膜)时,这些膜是由磷脂所组成的,又需要其具有一定的医`学教育网搜集整理脂溶性(称为亲脂性)。由此可以看出药物亲水性或亲脂性的过高或过低都对药效产生不利的影响。 在药学研究中,评价药物亲水性或亲脂性大小的标准是药物的脂水分配系数,用P来表示,其定义为:药物在生物非水相中物质的量浓度与在水相中物质的量浓度之比。 由于生物非水相中药物的浓度难以测定,通常使用在正辛醇中药物的浓度来代替。Corg表示药物在生物非水相或正辛醇中的浓度;CW表示药物在水中的浓度。P值越大,则药物的脂溶性越高,为了客观反映脂水分配系数的影响,常用其对数lgP来表示。 药物分子结构的改变对药物脂水分配系数的影响比较大。影响药物的水溶医`学教育网搜集整理性因素比较多,当分子中官能团形成氢键的能力和官能团的离子化程度较大时,药物的水溶性会增大。相反若药物结构中含有较大的脂环等非极性结构时,则导致药物的脂溶性增大。 各类药物因其作用不同,对脂溶性有不同的要求。如:作用于中枢神经系统的药医`学教育网搜集整理物,需通过血脑屏障,应具有较大的脂溶性。吸人性的全身麻醉药属于结构非特异性药物,其麻醉活性只与药物的脂水分配系数有关,最适lgP在2左右。
对于固体药物,其理化性质通常包括:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,吸湿性,溶液pH, 分配系数,解离常数,除此之外,对于将用于制剂生产的药物,还需要了解其物理形态,如多晶型、溶剂化物或水合物等,那么对于多晶型和溶剂化物应该如何进行研究?或者说关于这一部分信息应该如何进行叙述?
请问药物代谢实验中,IS,待测物,血浆,流动相的加入顺序是什么样的?有什么要求啊? 如果物质有吸附性,加入顺序是不是跟一般的顺序不同啊?
化学药物残留溶剂研究的技术指导原则一、概述 药物中的残留溶剂系指在原料药或辅料的生产中、以及在制剂制备过程中使用或产生而又未能完全去除的有机溶剂。根据国际化学品安全性纲要,以及美国环境保护机构、世界卫生组织等公布的研究结果,很多有机溶剂对环境、人体都有一定的危害,因此,为保障药物的质量和用药安全,以及保护环境,需要对残留溶剂进行研究和控制。 本指导原则是在参考人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)颁布的残留溶剂研究指导原则,美国药典(the United States Pharmacopoeia,USP)、英国药典(British Pharmacopoeia, BP)、欧洲药典(European Pharmacopoeia,EP)、中国药典(Chinese Pharmacopoeia, ChP)相关内容的基础上,结合我国药物研发的特点,通过分析、研究残留溶剂问题与药物的安全性、有效性及质量可控性之间的内在关系而制定的。本指导原则总结了对残留溶剂问题的一般认识,旨在帮助药物研发者科学合理的进行残留溶剂方面的研究,也为药物评价者提供参考。 考虑到残留溶剂研究涉及的范围比较广泛,本指导原则主要对原料药的残留溶剂问题进行讨论,并以此为基础,探讨和总结药物研究过程中对残留溶剂问题的一般性原则。药物研发者可参考本指导原则对制剂和辅料的残留溶剂问题进行研究。 考虑到药物研究开发的阶段性,本指导原则适用于药物研发的整个过程。 二、基本内容 (一)残留溶剂研究的基本原则 1、确定残留溶剂的研究对象 从理论上讲,药物制备过程中所使用的有机溶剂均有残留的可能,均应进行残留量的研究。但是,药物研发者可以通过对有机溶剂的性质、药物制备工艺等进行分析,提出科学合理的依据,有选择性的对某些溶剂进行残留量研究,这样,既可以合理有效的控制产品质量,又有利于降低药物研究的成本,避免不必要的浪费。因此,药物研发者在进行残留溶剂研究之前,需要首先对药物中可能存在的残留溶剂进行分析,以确定何种溶剂需要进行残留量的检测和控制。 2、确定残留溶剂时需要考虑的问题 原料药中有机残留溶剂与其制备工艺密切相关,同时也需要结合其制剂的临床应用特点来考虑如何对可能残留的溶剂进行研究。 2.1 原料药制备工艺 原料药制备工艺中可能涉及的残留溶剂主要有三种来源:合成原料或反应溶剂、反应副产物、由合成原料或反应溶剂引入。其中作为合成原料或反应溶剂是最常见的残留溶剂来源,本部分主要对此进行讨论。 影响终产物中残留溶剂水平的因素较多,主要有:合成路线的长短,有机溶剂在其中使用的步骤,后续步骤中使用的有机溶剂对之前使用的溶剂的影响,中间体的纯化方法、干燥条件,终产品精制方法和条件等等。 2.1.1 合成路线 由于有机化学反应及后处理工艺的复杂性,对于在得到终产物之前的第几步工艺中使用的溶剂可能在终产物中残留不可能有准确定论。但是,一般来说,后面几步中使用的溶剂的残留可能性较大,因此,对于较长路线的工艺,尤其需要关注后几步所使用的各类溶剂。 2.1.2 后续溶剂的影响 后续使用的溶剂对此前使用溶剂的影响是非常复杂的,取决于各溶剂的性质、后续反应中物料状态以及后续步骤除去溶剂的方法等。 2.1.3 中间体的影响 中间体的处理方法、纯化方法和干燥条件等影响中间体的残留溶剂情况,从而影响终产品的溶剂残留情况。 2.2 制剂及其临床应用特点 控制原料药的残留溶剂,最终目的是控制制剂的残留溶剂,使之符合规定。有时候根据制剂的一些特点,可能对原料药残留溶剂的研究和限度要求进行特殊性的考虑。需要注意,以下所列的因素并不是孤立的,在考虑下列因素时需要注意它们之间的相互影响。 2.2.1 剂型、给药途径 不同制剂发挥疗效的机理不同,对其残留溶剂的要求也可能有所不同。例如注射剂与某些局部使用局部发挥药效的皮肤用制剂相比,残留溶剂的要求就可能相对比较严格。 2.2.2 处方 辅料的残留溶剂也是制剂残留溶剂的组成部分。通过对处方中所使用辅料的残留溶剂水平的了解,可以估算原料药中所能允许存在的残留溶剂水平。 2.2.3 工艺 制剂的制备工艺可能引入新的溶剂,也可能使原料药和辅料中的残留溶剂水平降低。例如素片包衣可能引入新的残留溶剂,干燥工艺可能降低残留溶剂水平等。 2.2.4 适应症 出于治疗一些特殊疾病的考虑,有时候较高水平甚至超出安全值水平的残留溶剂也可能被允许,但需要进行充分的利弊分析。 2.2.5 剂量、用药周期 高剂量、长期用药的制剂,与低剂量、短期用药的制剂相比,对于残留溶剂的要求可能相对严格一些。 3、残留溶剂分类及研究原则 根据有机溶剂对人体及环境可能造成的危害的程度,分为以下四种类型进行研究: 3.1 第一类溶剂及研究原则 第一类溶剂是指人体致癌物、疑为人体致癌物或环境危害物的有机溶剂。因其具有不可接受的毒性或对环境造成公害,在原料药、辅料以及制剂生产中应该避免使用。当根据文献或其他相关资料确定合成路线,涉及到第一类溶剂的使用时,建议重新设计不使用第一类溶剂的合成路线,或者进行替代研究。 由于有机溶剂的选用是合成工艺中比较重要的一点,建议替代研究在工艺研究初期即开始进行,这样,有利于将由于溶剂替换对后续的结构确证、质量研究、稳定性考察的影响降至最低。但替代研究是一项比较复杂、耗时的工作,有时候由于条件、时间等的限制,替代研究工作在临床研究前可能无法充分进行。在严格控制残留溶剂量的前提下,可使药物进入临床研究。在临床研究期间、注册标准试行期间、注册标准转正后,仍可进一步进行替代溶剂的研究工作。 因为溶剂的改变可能导致产品物理化学性质以及质量的改变,因此如发生溶剂的替代,则需要进行溶剂改变前后的产品物理化学性质、质量的对比研究,必要时还需要进行结构对比确证,以说明产品的结构是否发生变化。 如果工艺中不可避免的使用了第一类溶剂,则需要严格控制残留量,无论任何步骤使用,均需进行残留量检测。 3.2 第二类溶剂及研究原则 第二类溶剂是指有非遗传毒性致癌(动物实验)、或可能导致其他不可逆毒性(如神经毒性或致畸性)、或可能具有其他严重的但可逆毒性的有机溶剂。此类溶剂具有一定的毒性,但和第一类溶剂相比毒性较小,建议限制使用,以防止对病人潜在的不良影响。 考虑到第二类溶剂对人体的危害以及所使用的溶剂在终产品中残留的可能性,建议对合成过程中所使用的全部第二类溶剂进行残留量研究,以使药物研发者全面掌握产品质量情况,为最终制定合理可行的质量标准提供数据支持。 3.3 第三类溶剂及研究原则 第三类溶剂是GMP或其他质量要求限制使用,对人体低毒的溶剂。第三类溶剂属于低毒性溶剂,对人体或环境的危害较小,人体可接受的粗略浓度限度为0.5%,因此建议可仅对在终产品精制过程中使用的第三类溶剂进行残留量研究。 3.4 尚无足够毒性资料的溶剂及研究原则 这类溶剂在药物的生产过程中可能会使用,但目前尚无足够的毒理学研究资料。建议药物研发者根据生产工艺和溶剂的特点,必要时进行残留量研究。 随着对这类溶剂毒理学等研究的逐步深入,将根据研究结果对其进行进一步的归类。 (二)研究方法的建立及方法学验证 在确定了需要进行残留量研究的溶剂后,需要通过方法学研究建立合理可行的检测方法。目前,常用的检测方法为气相色谱法(Gas Chromatography,GC),也有其他一些检测方法。 1、研究方法的建立 1.1 气相色谱法(GC法) GC法具有检测灵敏度较高,选择性较好的特点,采用此法所需的样品用量较少,基本可以满足所有残留溶剂测定的要求。采用GC法时,需要结合药物和所要检测的溶剂的性质,通过方法学研究确定合适的检测条件。由于通常要同时检测多种溶剂,为操作的可行性和简便性,建议尽量采用同样的检测条件控制尽量多种类的残留溶剂。 1.1.1 进样方法 GC法包括溶液直接进样和顶空进样两种进样方法。通常情况下,沸点低的溶剂建议采用顶空进样法,沸点高的溶剂可以采用溶液直接进样法,当样品本身对测定有影响时,也建议采用顶空进样法。 1.1.2 供试品溶液和对照品溶液的配制 对于固体原料药,如采用溶液直接进样法,需先用水或合适的溶剂使原料药溶解,以使其中的有机溶剂释放于溶液中,才能被准确测定。如采用顶空进样法,通常以水作溶剂;当药物不溶于水,但可溶于一定浓度的酸或碱液中时,可采用不挥发的酸或碱液为溶剂,但不能使用盐酸溶液或氨水;对于非水溶性药物,可采用合适的溶剂,如N,N—二甲基甲酰胺、二甲基亚砜等为溶剂。 不管采用何种进样法,所选择的溶剂应能够尽量同时溶解样品和待检残留溶剂,所
为了减少在配置过程中肽类吸附于容器壁,在配好工作溶液后,稀释系列标准溶液是不是可以用空白血浆
液质联用,由于测定药物溶解度的关系,在药物母液中加盐酸调了PH。对柱子、质谱有伤害嘛?知道是流动相肯定是不能用盐酸调PH的,但是,有其他前辈有的说母液加盐酸可用,有的说不可以。也问了维修工程师,说应该影响不大,但是他说具体找应用方面的工程师,今天休息。拜托各位了~
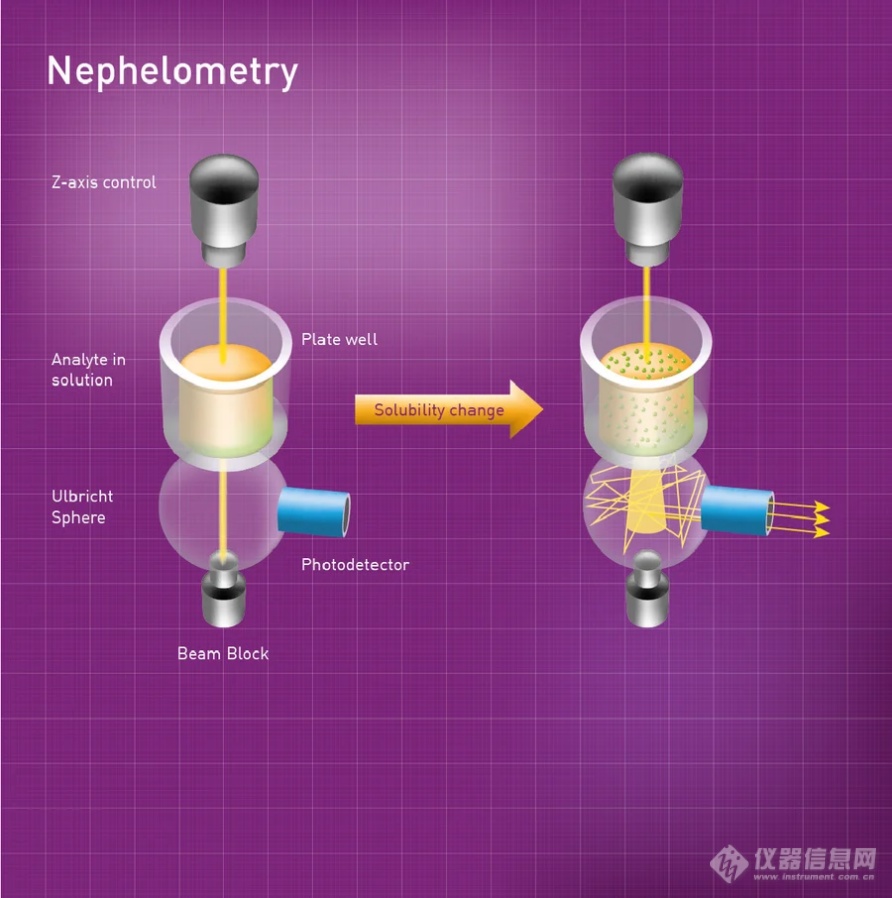
在药物开发过程早期进行ADMET(吸收、分布、代谢、排泄和毒性)评估的能力在当今的药物发现环境中是至关重要的。这意味着需要进行高通量分析,以尽早发现潜在的ADMET问题,从而减少损耗。溶解度是药物的关键特性之一,对分析方法开发、药物生物利用度、吸收和毒性研究,以及药物剂量和药物配方都有重要影响。低溶解度化合物的开发难度更大,获得可再现的ADMET筛选数据也更费时费力。因此,在药物开发的后期阶段进行成本更高的检测之前,研究人员需要一种快速、经济高效的解决方案来确定溶解度。[align=left][b]药物溶解度研究[/b][/align]药物溶解度研究旨在评估药物在不同条件下,在各种溶剂或缓冲液中的溶解度。通常需要测量药物在特定温度或pH值下可溶解的量。溶解度通常表示为药物在溶剂中的最大溶解浓度,也称为饱和浓度。药物溶解度测定在药物发现过程中的不同阶段都至关重要。在早期化学筛选的所有标准中,不理想的溶解度是最不利的性质之一,溶解度低的分子具有很高的失败风险。因此,在药物发现过程中要尽早进行溶解度测定。低溶解度不仅会阻碍新药活性的测试,还可能引发其他不良后果,包括影响其他检测、隐藏其他不良特性,以及对药物动力学和动态性质的潜在影响。总之,这可能会导致药物开发时间大大延迟,或者在尝试改良之前就出现失败。常见的平衡溶解度测定的方法是在恒温条件下将药物和靶标一起振荡至少24小时并测量溶液中的药物浓度(摇瓶法;图 2)。最终浓度通常通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法测定,整个过程耗时较长,且通量较低。[b]散射比浊法节省时间并提高通量[/b]散射比浊法是一种快速、可扩展、灵敏且精确的颗粒物质浓度测定方法,有利于药物溶解度研究。另外,这还是一种无损技术,可用于动力学分析,只需制备很少的样品,且可以适应高通量微孔板格式。[url=https://www.bmglabtech.cn/]BMG LABTECH[/url]的NEPHELOstar [i]Plus[/i]是一种专用的微孔板散射浊度仪,可通过测量前向散射光来检测液体样品中的不溶性颗粒。这种方法基于对样品中不溶性颗粒散射光强度的检测。NEPHELOstar [i]Plus[/i]的高强度光源是波长为635 nm的激光。激光穿过样品孔,进入Ulbricht球散射光检测器。如果光线没有被颗粒偏转,会直接穿过球体,不会产生信号。如果样品中存在不溶颗粒,散射光会在球体内部反射,被光电二极管检测到。Ulbricht球可收集散射角度高达 80 度的光线。[align=left][b]结论[/b]散射比浊法是一种快速、可靠、低成本的溶解度筛选方法,可利用384孔板进行高通量筛选。使用NEPHELOstar [i]Plus[/i] 在384孔板中进行全自动动力学溶解度筛选,可在75分钟内分析24种化合物,批间差异率为5%。在提交的化合物中,其中约有90%的化合物,其动力学溶解度可通过此方法得出并排序。[/align]
纳米技术改善难溶性药物吸收前景光明 近日,由中国药学会和美国药学科学家协会主办、沈阳药科大学和辽宁省药学会承办的“第二届亚洲阿登制药技术研讨会暨中国药学会药剂专业委员会2010年学术年会”在沈阳召开,会议主题为“难溶药物的剂型策略”。在为期3天的研讨中,与会专家表示,改善难溶性药物的溶解度,促进药物的吸收,提高药物的生物利用度是药剂学领域亟待攻克的难题,而纳米技术这一助推器有助于加速该难题的解决,我国学者应加强相关研究。 溶解度成为制约瓶颈 药物的溶解性是影响药物生物利用度的重要因素之一,难溶性药物因在水中的溶解度小,难以被机体吸收,导致生物利用度较差。随着组合化学、基因技术、高通量筛选技术等在药物研发中的广泛应用,大量具有活性的候选药物被发现。但是,沈阳药科大学崔福德教授表示,由于存在水溶性差的缺陷,四成左右的侯选药物不能上市而限制了其在临床充分发挥疗效。据估计,全球每年约有650亿美元的药品因生物利用度差而造成治疗费用与疗效比例的严重失调。而实际上,许多难溶性药物有着很强的生物活性,在治疗肿瘤、心血管疾病等领域有着良好疗效。因此,如何提高药物的溶解度和吸收率,成为药剂学研究的热点与难点,迫切需要发展新的制剂技术和剂型来解决这一问题。 崔福德介绍,当前,在药剂学研究中提高难溶性药物的溶解度和溶解速率有多种方法,如加入助溶剂、增溶剂和亲水性介质(适用于液体制剂);制成固体分散体和包含物(适用于固体制剂);制成微粒分散系统(适用于液体和固体制剂);还可以采取减少粒径的措施,比如做成药物的纳米结晶(适用于各种剂型)。 “但是这些方法都有一定的局限性。”中国药学会药剂专业委员会主任委员、北京大学药学院张强教授具体分析说,比如成盐类的方法就只适用于一些难溶性弱酸或弱碱类药物,而不适用于所有分子结构的药物;加入助溶剂和亲水性物质的方法,可供选择的溶剂等也是有限的;增溶剂主要是表面活性剂,毒性问题也限制了其使用;包合物同样存在可供选择的品种较少和毒性问题;固体分散体也有老化现象和需要使用大量赋型剂的缺陷;而费用较高和稳定性问题又限制了微粒化方法的使用。 新技术助力难题解决 解决上述问题,纳米技术的应用优势日益显现:纳米化使药物的粒度大大减小,表面积大大增加,水溶性差的药物在纳米载体中可形成较高的局部浓度;药物的黏附性增强,在吸收部位的滞留时间延长;纳米载药系统可以提高药物的透膜能力和稳定性,也有利于提高药物的生物利用度,特别是对于生物药剂学分类体系(BCS)Ⅱ类(低溶解度、高通透性)和Ⅳ类(低溶解度、低通透性)的药物,这一技术越来越受到国内外一些研究机构、制药公司的青睐。 在药剂学领域,一般将制剂中纳米粒子的尺寸界定在1~1000纳米范围,主要包括纳米载体与纳米药物两个方面。纳米载体是指溶解或分散有药物的各种纳米粒,如纳米乳、聚合物纳米粒(纳米囊或纳米球)、脂质纳米粒等;纳米药物则是指直接将原料药物加工成的纳米粒,实质上是微粉化技术、超细粉技术的发展。 张强介绍,纳米乳/微乳是一种由水、油、表面活性剂和一些复合表面活性剂自组装成的粒径小于100纳米的半透明溶液,其易于制备、相对稳定,而且可使大多数水不溶性药物的生物利用度提高显著。自1943年被报道以来,纳米乳/微乳已经得到了广泛的研究,但上市的产品却不多,1995年诺华公司上市了环孢素A的微乳产品,在临床迅速得以推广。现在上市的同类品种还有雷帕霉素自微乳化给药系统。 纳米粒(纳米球或纳米囊)一般是指由天然或合成的高分子材料制成的、粒径在纳米级的固态胶体微粒,可用于包裹亲水性药物,也可包裹疏水性药物,具有在胃肠道中稳定、药物不易被破坏,以及能够调整药物的理化性质、释放和生物学行为等优点。自1976年Birrenbach等人首先提出了纳米粒和纳米囊的概念后,目前以合成高分子材料为聚合物的纳米粒研究得最为广泛。但张强遗憾地表示:“30多年来,这个研究领域没有取得实质性的突破,无论是口服制剂还是注射制剂都没有产品上市。”而天然聚合物的纳米粒所使用的材料包括壳多糖、白蛋白、右旋糖苷、明胶等,其中以口服壳聚糖纳米粒的研究最为广泛。值得一提的是,白蛋白结合紫杉醇纳米粒注射混悬液2005年上市,成为制剂领域的一个重大突破;但口服给药方面仍没有产品面市。 脂质纳米粒是以生物相容性良好的脂质材料为载体,将药物溶解、包裹于脂质核或是吸附于纳米粒表面的新型载药系统。第一代脂质纳米粒是固体脂质纳米粒(SLN),其性质稳定、制备较简便,具有一定的缓释作用,主要适合于难溶性药物的包裹;随后又发展了第二代纳米结构脂质载体(NCL),解决了第一代脂质纳米粒载药量不佳的问题,稳定性也更好。张强谈到,近年来,对脂质纳米粒的研究也相当广泛,特别是第二代脂质纳米粒自1999年开始研究以来,在外用领域如化妆品领域进展很快,开发程度好于脂质体,但至今还没有用于临床的产品。 在表面活性剂和水等附加剂存在下直接将药物粉碎加工成纳米微粒,可以提高药物的吸收或靶向性,特别适合于大剂量的难溶性药物的口服吸收和注射给药,能增加溶出度,提高生物利用度,增加稳定性。此外,它无需载体材料,只有少量的表面活性剂,安全性更高。此类技术分为纳米混悬剂和纳米结晶制备技术。其中,纳米结晶制备技术发展较快,目前已有5种产品利用这种技术生产并在美国上市,包括惠氏公司的Rapamune(西罗莫司)、默克公司的Emend(阿瑞吡坦)、雅培公司的Tricor(非诺贝特)以及Par公司的Megace ES(甲地孕酮)等。
有个原料药的其中一个重要的指标——磷结合率的测定要做方法验证,碰到一些问题,想请教大家。磷结合率,就是指此药在一定条件下和定量的磷酸根结合,考察每克药物结合了多少摩尔量的磷酸根。这也是此药的用药机理。通过测定起始和结束的磷酸根含量,就得到结合掉的磷酸根。质量指标是5.0~6.5mol/g。问题是反应过程中涉及到很多因素。例如药物在磷酸根溶液中搅拌,总会有一些药物被甩到溶液上的瓶壁上而未反应。例如要过滤掉药物来测定溶液中的磷酸根而不能冲洗药物,药物上总会残留磷酸根。这样的话,方法的重现性就不好。我想这种药物的应用性能指标的测定,质量指标范围是很宽的。那么它的方法验证是不是可以特殊对待?但我手里没有具体的指导文件。请教各位能人来解答。
[align=center][b]水产品中14种磺胺类药物残留液相检测法小结[/b][/align][align=left] 磺胺类药物为人工合成的抗菌药,具有[url=https://baike.baidu.com/item/%E6%8A%97%E8%8F%8C%E8%B0%B1/8335581][color=windowtext]抗菌谱[/color][/url]较广、性质稳定、使用简便等优点,在水产养殖中应用非常广泛。但能产生过敏、、肝损害、泌尿道损害等副作用。近年来国内外对水产品中磺胺类药物残留检测越来越严格,为了更准确检测出水产品中磺胺类药物残留,查阅相关资料,并经多次实验后对农业部958号公告-12-2007方法中样品的提取、净化、色谱条件等进行了优化小结,节约前处理时间,检出限、回收率均十分满意。[/align][align=left][b] 一、检测材料与方法[/b][/align] (一)主要仪器设备与试剂 1、主要仪器设备 电子分析天平(感量0.0001)、电子分析天平(感量0.01)、高速组织捣碎机、旋转蒸发仪、均质机、高速冷冻离心机、涡旋混合器、马神炉、玻璃抽滤器、固相萃取装置、安捷伦1260高效液相色谱仪配紫外检测器。 2、试剂 乙酸乙酯、正已烷、乙腈(色谱纯)、甲醇(色谱纯)、冰乙酸(优级纯)、无水乙酸钠。 3、标准品 14种磺胺类药物标准溶液(100Uug/mL)。 4、其他耗材 HLB固相萃取柱(60mg、3 mL)。 (二)液相色谱条件 色谱柱:安捷伦C18柱4.6mm×100mm,粒度3.5um;流动相:乙腈、甲醇和3%乙酸溶液梯度洗脱;流速0.6mL/min;柱温:40℃;检测波长:270nm;进样量:5uL。 (三)样品前处理 称取5.00g样品,置于50mL离心管中,加入20mL乙腈,超声1 min,加入5g无水乙酸钠,涡旋1 min、超声2 min,3000r/min离心10min,将乙腈层转移到100mL梨形瓶中。再向离心管中加入25mL乙腈,旋涡混匀1 min,3000r/min离心10min,将乙腈层转移到100mL梨形瓶中,加入5mL正丙醇于30℃水浴中减压浓缩至近干。依次向梨形瓶中加入1.0mL1:1乙腈水溶液涡旋混匀,超声1 min溶解残渣,转移到50mL离心管中;再向梨形瓶中加入1mL乙腈饱和正已烷溶液,涡旋混匀, 3000r/ min离心5min,弃上层正已烷,转移到50mL离心管中,重复操作一次。3mL甲醇洗脱HLB固相萃取柱,洗脱液30℃减压浓缩至干,用1mL流动相定容,过0.45um滤膜,供液相色谱测定。 具体优化方法如下: 1、调节流动相中的PH值,可以抑制弱碱的离解,从而导致保留时间的改变。乙腈、甲醇和2%乙酸溶液梯度洗脱,酸度过高,很难将14种磺胺类药物分离,其中磺胺二甲基嘧啶与磺胺氯哒嗪、磺胺甲氧哒嗪与磺胺基异唑,保留时间几乎一致。酸度过低有明显的拖尾现象。乙腈、甲醇和3%乙酸溶液梯度洗脱,不但实现了14种磺胺类药物完全分离,而且各峰间分离度大、峰形尖锐、峰对称性好。 2、提取过程用乙腈代替乙酸乙酯,可以更好的脱去脂肪,减少杂质干扰。 3、旋转蒸发前加入正丙醇,可以加快蒸发速度,减少药物损失,提高回收率。 4、用涡旋1 min、超声2 min代替14000r/ min均质1 min提取,减少了均质过程中加标损失;又节约了均质过程中每个样品逐一清洗刀头时间所浪费的时间。 (四)校准曲线与加标回收情况 1、校准曲线 以14种磺胺类药物中间溶液配成标准的工作曲线浓度分别为0.001ug/mL、0.002ug/mL、0.005ug/mL、0.01ug/mL、0.02ug/mL、0.05ug/mL、0.1ug/mL、0.2ug/mL、0.5ug/mL。以峰面积为纵坐标,以浓度为横坐标做校准曲线,做一校准曲线,相关系数为0.9998。14种磺胺类药物在1-500ng/mL范围内线性良好。 2、加标回收 取10份样品分别加入浓度为0.10.1ug/mL的14种磺胺类药物标准溶液25uL、50 uL、250 uL,每个浓度做三个重复,做一个空白。按上述方法进行前处理和检测,测得回收率范围在85%-92%。[b] 三、注意事项[/b] 1、旋转蒸发近干要严格控制好,旋转蒸发时蒸发太干、时间太长会导致回收率降低。 2、调节流动相中的PH值,从而导致保留时间的改变。酸度过高很难将14种磺胺类药物分离,酸度过低有明显的拖尾现象。乙腈、甲醇和3%乙酸溶液梯度洗脱,不但实现了14种磺胺类药物完全分离,而且各峰间分离度大、峰形尖锐、峰对称性好。[b] 四、结论[/b] 综上所述本文探索改进的水产品中14种磺胺类药物检测方法,样品前处理时间、样品出峰时间比标准缩短,节省了人力物力,且14种磺胺类药物在1-500ng/mL范围内线性良好,相关系数为0.9999,回收率范围85%-92%。
各位:有没有人知道光纤药物溶出仪,与普通的溶出仪的相比,优势是什么?谢谢!
一、案例磺胺类药物是一类应用最早的人工合成抗菌药物,能抑制革兰阳性菌及一些阴性菌,可以治疗多种细菌感染,具有抗菌谱广、疗效强等优点。磺胺类药物特别是磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲氧嘧啶、磺胺甲基异嗯唑等作为饲料添加剂或动物疫病治疗药物被广泛应用。然而磺胺类药物在体内作用时间和代谢时间较长,过量使用必会导致磺胺类药物在食用动物产品中的蓄积。食品磺胺类药物残留,可引起过敏、中毒和导致耐药性菌的产生,它还能引起造血系统障碍,发生急性溶血性贫血、粒细胞缺乏症、再生障碍性贫血等。二、选用的标准农业部1025号公告-7—2008动物性食品中磺胺类药物残留检测——酶联免疫吸附法。三、测定方法1.样品的制备与保存取新鲜或解冻的空白或供试动物组织,剪碎,置于组织匀浆机中高速匀浆。取鸡蛋去除壳后用均质器500r/min匀浆20s,使蛋清和蛋黄充分混合。将已制备的样品在-20℃冰箱中储存备用。2.提取称取样品(2.00±0.02)g于50ml离心管中,加乙腈8mL,振荡20min,4000r/min离心5min:分取上清液2.5ml。于10mL离心管中,于50℃水浴下用氮气吹干;加正己烷1mL,涡动20s溶解残留物,再加缓冲液工作液1mL,涡动1min,4000r/min离心10min,取下层水相20μL分析。3.测定①使用前将试剂盒于室温(19~25℃)下放置1~2h。②每个标准溶液和试样溶液按两个或两个以上平行计算,将所需数目的酶标板条插入板架。③加系列标准溶液或试样液20μL于对应的微孔中,随即加酶标记物工作液50μL/孔,再加磺胺类药物抗体工作液80μL/孔,轻轻振荡混匀,用盖板膜盖板,置25℃避光反应60min。④倒出微孔中的液体,将酶标板倒置在吸水纸上拍打,以保证完全除去孔中的液体。再加洗涤工作液250μL/孔,重复操作两遍以上(或用洗板机洗涤)。⑤加底物液A液和B液各50μl/孔,轻轻振荡混匀,用盖板膜盖板,室温下避光反应30min。⑥加终止液50μL/孔,轻轻振荡混匀,置酶标仪于450nm波长处测量吸光度值。4.结果判定和表述用所获得的标准溶液和试样溶液吸光度值的比值进行计算。相对吸光度值(%)=B/B0×100%式中 B一一标准(试样)溶液的吸光度值;B0——空白(浓度为0的标准溶液)的吸光度值。将计算的相对吸光度值(%)对应磺胺类药物标准品浓度(μg/L)的自然对数作半对数坐标系统曲线图,对应的试样浓度可从校正曲线算出。方法筛选结果为阳性的样品,需要用确证的方法进行确证。5.竞争物的交叉反应率见表1。表1竞争物的交叉反应率竞争物交叉反应率/%竞争物交叉反应率,%磺胺二甲嘧啶磺胺二甲氧嘧啶磺胺二甲基嘧啶磺胺嘧啶磺胺甲基异毂唑10023121%1%磺胺噻唑磺胺吡啶磺胺喹彀啉磺胺问甲氧嘧啶1%1%1%6.试剂①乙腈②正已烷③十二水合磷酸氢二钠。④二水合磷酸氢二氢钾。⑤氯化钠。⑥氯化钾⑦磺胺类药物快速检测试剂盒:2~8℃保存。a.系列标准工作溶液:O、1μg/L、3μg/L、9μg/L、27μg/L、81μg/L。b.包被有磺胺类药物偶联抗原的96孔板,12×8孔。c.磺胺类药物抗体工作液。d.酶标记物工作液。e.底物液A液。f.底物液B液。g.终止液。h.20倍浓缩洗涤液。i.20倍浓缩缓冲液。⑧洗涤工作液:用水将20倍浓缩液按1:19的体积比进行稀释(1份20倍浓缩洗涤液+19份水),用于酶标板的洗涤。2~8℃保存,有效期1个月。⑨缓冲工作液:用水将20倍浓缩缓冲液按1:19的体积比进行稀释(1份20倍浓缩洗涤液+19份水),用于酶标板的洗涤。2~8℃保存,有效期1个月。7.仪器①酶标仪(配备有450nm滤光片)。②氮气吹干装置。③均质器。④振荡器。⑤离心机。⑥天平(感量0.01g)。⑦微量移液器(单道20~200/μl、100~1000μL;多道250μL)。
我做了氟苯尼考的混悬乳剂,现在要测制剂中药物的含量。参考文献上的说法,我应该先用溶剂破乳,提取药物,净化后上HPLC检测含量。氟苯尼考不溶于水,易溶于二甲基甲酰胺、乙腈、甲醇等有机溶剂。我试过用100倍的乙腈和甲醇去溶解制剂,均能将制剂稀释成透明溶液。可问题就在于,当我加蒸馏水定容时,溶液马上就变得浑浊了。就算我不用水定容,当进样时,流动相里也有大比例的水成分存在,当流动相混合时,系统里的溶剂还是浑浊,弄不好会堵塞系统管道。我想请教一下,有什么办法可以将我的制剂处理变得可行呢?谢谢!
菜鸟求助液相色谱测定药物浓度的方法问题,谢谢大家以前没接触过高效液相色谱,前不久做试验(抗癌药物异环磷酰胺在无机吸附剂上的吸附)需要测药物随时间在溶液中浓度变化,以前课题组都用紫外,做出标准曲线即可,但是我的药物存在紫外末端吸收,因此数据老是不对头忽大忽小,因此考虑用高效液相色谱测浓度。也有此药的文献,但都是医学方面测其在血清中浓度,但我的实验目的很简单,就是测这个药(原料药)在水溶液中的浓度(没有其他的东西),那么我该怎么做呢?(那也不存在对照品供试品等称呼了吧)我自己想的是,可不可以将系列浓度溶液进样先做出浓度-面积工作曲线,然后将需要测的样进样之后,根据峰面积带入标准曲线求即可? 现在试验刚刚开始做,发现的问题是1在主峰前面有两个小峰,同学说是因为我的溶剂是水,与流动相(乙腈水)不同产生的噪音,这样解释合理吗?2保留时间在乙腈:水=35:65时为四分钟左右,是不是可以调整流动相比例使出峰时间在五六分钟,这样结果会更准确?3药物浓度在10-5000mg/l都可以测到,做标准曲线的话应该取在哪个范围?低于10mg/l怎么只有前面的那两个峰了,主峰就不见了(文献中提到最低检测限0.5mg/l呢),为什么我的灵敏度就不行了呢?(仪器型号岛津LC-10AVP,紫外检测器SPD-10AVP,柱型号ALIGENT-ECLIPSE XDB-C18)4外标法(标准曲线法)大家认为准确度可以吧?
一、概述药物中的残留溶剂系指在原料药或辅料的生产中、以及在制剂制备过程中使用或产生而又未能完全去除的有机溶剂。根据国际化学品安全性纲要,以及美国环境保护机构、世界卫生组织等公布的研究结果,很多有机溶剂对环境、人体都有一定的危害,因此,为保障药物的质量和用药安全,以及保护环境,需要对残留溶剂进行研究和控制。本指导原则是在参考人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)颁布的残留溶剂研究指导原则,美国药典(the United States Pharmacopoeia,USP)、英国药典(British Pharmacopoeia, BP)、欧洲药典(European Pharmacopoeia,EP)、中国药典(Chinese Pharmacopoeia, ChP)相关内容的基础上,结合我国药物研发的特点,通过分析、研究残留溶剂问题与药物的安全性、有效性及质量可控性之间的内在关系而制定的。本指导原则总结了对残留溶剂问题的一般认识,旨在帮助药物研发者科学合理的进行残留溶剂方面的研究,也为药物评价者提供参考。考虑到残留溶剂研究涉及的范围比较广泛,本指导原则主要对原料药的残留溶剂问题进行讨论,并以此为基础,探讨和总结药物研究过程中对残留溶剂问题的一般性原则。药物研发者可参考本指导原则对制剂和辅料的残留溶剂问题进行研究。考虑到药物研究开发的阶段性,本指导原则适用于药物研发的整个过程。
在动物性食品中,需要检测的不仅有农药残留污染物,还有兽药以及其他添加物。而动物性食品的主要基质干扰来自于蛋白质、多肽、氨基酸和脂肪等。样品萃取净化的主要困难来自于极性药物与强水溶性基质(蛋白质、氨基酸)的分离和弱极性药物与亲脂性基质的分离。由于兽药的化学性质差异很大,使多残留同时检测具有非常大的难度。样品预处理:肝脏组织1 g与3 mL水混合匀浆,取0.4 mL(等于100 mg肝脏组织)中加入1 mL去离子水,并在超声波水浴中振荡5 min后6000 g离心10 min。上清液A供萃取酸性及中性药物。样品离心后得到的沉淀物中加入枯草杆菌蛋白酶的Tris溶液,混合均匀后(pH 10.5),60℃水解1 h。水解完成后,将样品冷却至室温,用10%(体积分数)磷酸将样品的pH调节至6~7,并在6000 g离心10 min。所得到的上清液(B)用于萃取碱性药物。固相萃取柱:Bond E1ut Certify非极性/阳离子交换混合柱,130mg/3 mL,Varian公司。柱预处理:2 mL甲醇,2 mL磷酸缓冲溶液。样品过柱:0.4 mL上清液A过柱。柱洗涤:1 mL水,0.5 mI,磷酸缓冲溶液(pH 4.0)。柱干燥:50μL甲醇,空气。目标物洗脱:4 mL丙酮/氯仿(1:1,体积比),洗脱酸陛和中性药物(馏分A)。柱预处理:2 mL磷酸缓冲溶液(使用上述同一根萃取柱)。样品过柱:上述上清液B过柱。柱洗涤:1 mL 1 mol/L醋酸(pH 2.4),2 mL丙酮/氯仿(1:1,体积比。柱干燥:50μL甲醇,空气。目标物洗脱:2 mL 2%(体积分数)氨化乙酸乙酯,洗脱碱性药物(馏分B)。浓缩/分析:分别将丙酮/氯仿洗脱馏分及氨化乙酸乙酯洗脱馏分在氮气氛40℃浓缩至约100μL,然后进行GC分析。
求助!!!不溶于水的脂溶性药物,查到它的pka是8.13呈现碱性,用MCX小柱过柱,5%氨化甲醇洗脱,备用液为了提高极性是80%甲醇水复溶(每100毫升含有50微升甲酸),结果柱回收率只有70左右,要怎么提高啊?或者有没有简便的看甲醇水里面的甲酸含量能不能使药物完全离子化的方法啊?

药物中残留溶剂甲醇含量的不确定度评定报告(*^__^*) 嘻嘻……,甲醇作为一种药物中常用的提取溶剂,已经在很多药物的提取中用到,譬如何首乌根甲醇提取,甘草的甲醇提取等都是天然药物的甲醇提取,还有一些生物药品的甲醇提取等等,已经屡见不鲜了的,俺一个同学课题中最近所用的一种有机药品分析,在溶剂的选择上就是该药品在甲醇中溶解性更好,在乙醇中溶解性差很多,也许因为甲醇极性比乙醇大的缘故吧,在日常的气相色谱和液相色谱分析中经常作为溶剂,不过甲醇又是一种有毒的醇类,因此,药物中的残留溶剂里面也就必须检测甲醇了的。俺们药物临床分析基地的老师前段时间就分析了一份某上级部门给的盲样,是分析该药品中的残留溶剂甲醇含量,报告结果的同时也要做甲醇的不确定度报告。俺只是个助手,(*^__^*) 嘻嘻……,下面就是此次残留溶剂甲醇的不确定度报告,请各位老师继续授业解惑。1材料与方法1.1仪器和试剂:日本岛津GC-15A气相色谱仪(FID检测器),色谱柱:GDX-102,2m*4mm,非极性色谱柱;柱温140℃,气化室200℃;检测室210℃;载气流50ml/min 。十万分之一电子天平,最大误差0.03mg;1.0ml移液管,允差±0.015ml;10ml容量瓶,允差±0.02ml;5ml容量瓶,允差±0.02ml;甲醇,纯度≥99.9%。1.2标准溶液:10ml容量瓶中加入约5ml蒸馏水,于十万分之一电子天平上称取甲醇10.10mg,稀释至刻度,制成1010ug/mL甲醇标准储备液。1.3考核样:国家某机构组织提供的考核盲样一支。1.4 检测方法:按照Ch.P.2010并参考药物临床分析基地醇类化合物检测的SOP要求进行操作。主要包括标准溶液配置,标准曲线制备,被测盲样解吸及样品解吸液上机测定,并根据标准曲线计算甲醇含量4个环节。2.测量结果的不确定度评定2.1 不确定度来源分析:主要采用国家药典分析方法测量甲醇的含量,故不考虑该方法本身的误差。在测量不确定度评定中只需考虑与实验操作有关的不确定度分量,主要包括以下4个方面:由标准曲线得解吸液中甲醇浓度、解吸液体积、标准溶液浓度对测量结果的影响、重复测量产生的不确定度即A类不确定度。2.1.1由标准曲线得解吸液中甲醇浓度的不确定度。用1010ug/ml甲醇标准储备液,配制出浓度分别为10.1、50.5、101、151.5、202、252.5ug/ml的6个标准溶液,其响应值测定结果见表1。采用最小二乘法拟合标准曲线时,计算得到解吸液中甲醇的浓度C的不确定度仅与峰面积的测量不确定度有关,标准溶液浓度不确定度的影响另行讨论。http://ng1.17img.cn/bbsfiles/images/2012/12/201212152020_412847_2355529_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/12/201212152020_412848_2355529_3.jpg由表1中的数据进行线性拟合得线性方程y=37.974x-90.421,γ=0.9998。测得解吸液中甲醇的浓度为158ug/mL。于是根据以上公式得标准不确定度u(x)=0.363ug/ml,相对标准不确定urel=0.0023。2.3 解吸液体积不确定度评定。解吸液体积不确定度分量包括刻度吸管校准不确定度和温度影响。实验用1.0ml移液管,以均匀分布估计,标准不确定度分量为0.009mL。温度的变化引起液体体积和量具容积的变化。但是由于液体的膨胀系数远远大于玻璃量具的膨胀系数。因此,可以忽略温度对量具容积的影响。当实验温度为23℃,以均匀分布估计,温度对体积测量的影响为0.001ml。经过汇总总解吸液体积的标准不确定度u(V)=0.0091ml,相对标准不确定度urel(V)=0.0091。2.4 标准溶液浓度不确定度。配制标准溶液先配制标准储备液,然后将标准储备液稀释成标准溶液。计算标准溶液浓度不确定度,应先计算标准储备液浓度不确定度,再计算标准溶液浓度不确定度。2.4.1标准储备液浓度不确定度来源,包括甲醇标准纯度影响、甲醇标准质量、溶液的体积。见表2http://ng1.17img.cn/bbsfiles/images/2012/12/201212152021_412851_2355529_3.jpg2.4.2配制标准溶液时量具校准引入的不确定度。见表3http://ng1.17img.cn/bbsfiles/images/2012/12/201212152022_412852_2355529_3.jpg2.4.3配制标准溶液时温差引入的不确定度。玻璃量器在20℃校准,配置溶液的温度为20±5℃,±5℃温度差引起的不确定度可通过估算温度范围和体积膨胀系数来进行计算。水的膨胀系数为2.1×10-4℃-1, 计算标准不确定度时假设温度变化是矩形分布,则在标准液逐级稀释过程中,由±5℃温差导致体积变化而引入的相对不确定度为:http://ng1.17img.cn/bbsfiles/images/2012/12/201212152022_412853_2355529_3.jpg2.5 A类不确定度评定 随机抽取相同条件下配制的甲醇含量相同的样品15个进行测定。按标准方法要求,样品经解吸后测定,由标准曲线计算解吸液中甲醇的浓度分别为158.75、160.04、156.09、158.44、155.70、160.07、158.01、162.46、159.78、159.01、158.33、155.72ug/mL,测定列的标准差为8.9ug/mL,本次试验测定样品数位一个,解吸液中甲醇浓度平均值为158ug/mL。则该测定结果的A类不确定度为: u[/size
我有一个药物它在水和酸溶液中都不溶,只有在乙腈中溶解,现在我要分析它里面的钯残留量,采用原子吸收石墨炉法测定,由于它溶解性不好,不能溶解后直接测定,请问样品该怎么处理?。
需要一种强极性药物来做实验,不是学药的,不了解有哪些是水溶性药物,最好是抗生素,请各位帮帮忙
第八章 药物的杂质检查掌握药物中杂质的来源和分类,杂质限量的定义和计算;氯化物、硫酸盐、铁盐、重金属、砷盐、溶液颜色、易炭化物、澄清度、炽灼残渣、干燥失重、有机溶剂残留量等检查项目的原理和方法。第一节 杂质和杂质的限量检查一、杂质来源和分类1.杂质是指药物中存在的无治疗作用或影响药物的稳定性和疗效,甚至对人健康有害的物质。2.杂质的来源,主要有两个: 一是由生产过程中引入。(精制未能完全除去,原料不纯或存在反应不完全,中间产物与副产物)。 二是在贮藏过程中产生。(贮藏过程外界条件影响,或因微生物的作用,发生水解、氧化、分解、异构化、晶型转变、聚合、潮解和发霉等变化,产生有关的杂质)。3.杂质按来源分类,可分为一般杂质和特殊杂质。一般杂质是指在自然界中分布较广泛,在多种药物生产和贮藏过程中容易引入的杂质。如酸、碱、水份、氯化物、硫酸盐等。特殊杂质是指在个别药物的生产和贮藏过程中引入的杂质。 杂质按其性质还可分为信号杂质和有害杂质,信号杂质本身一般无害,其含量多少可以反映出药物纯度水平。有害杂质如重金属、砷盐,在质量标准中要严格控制,以保证用药安全。二、杂质的限量检查由于杂质不可能完全除尽,所以在不影响疗效和不发生毒性的原则下,既保证药物质量,又便于制造、贮藏和制剂生产,对于药物中可能存在的杂质,允许有一定限量,通常不要求测定其准确含量。《药典》中规定的杂质检查均为限量(或限度)检查。 杂质限量:指药物中所含杂质的最大容许量。 表示方法:通常用百分之几或百万分之几(ppm)来表示。对危害人体健康、影响药物稳定性的杂质,必须严格控制其限量。检查时可用杂质的纯品或对照品在相同条件下来比较。限量计算:杂质限量=杂质量/供试品量 ×100% =标准溶液体积×标准溶液浓度/供试品 ×100% 或 L=V×C/S ×100%也有不用标准液对比,只在一定条件下观察有无正反应出现。
[color=#444444]做液相色谱药物分析时,第一次进样在一个位置出现了一未知杂峰,随后将原进样瓶溶液和原容量瓶溶液又进了一次(原仪器,原色谱柱),结果在那个位置又没峰了,说明配的溶液没问题,这是仪器或色谱柱有什么问题吗?各路大神有没有遇到过类似情况,怎么解决和预防这种情况?[/color]
我想做细胞培养的课题,用几个药物处理细胞,不知道文献上的药物浓度都是怎么得来的呀?还有药物要选择溶液,怎么和临床药物浓度折算呀?我是学临床的,请教高人指点呀!多谢多谢!
第十三章 杂环类药物的分析 (上)掌握异烟肼、尼可刹米的鉴别、杂质检查和含量测定方法。 掌握盐酸氯丙嗪、奋乃静的鉴别、杂质检查和含量测定方法。 掌握地西泮、氯氮卓及其制剂的鉴别、杂质检查和含量测定方法。 本章讨论化学合成的杂环类药物,选择应用比较广泛的三类杂环药物中的几个典型药物予以重点介绍:即吡啶类中的尼可刹米、异烟肼;吩噻嗪类中的氯丙嗪、奋乃静;苯骈二氮杂卓类中的地西泮和氯氮卓。 第一节 异烟肼的分析一、结构与性质 本类药物母核吡啶环上的氮原子为碱性氮原子,吡啶环γ位上被酰肼取代,酰肼基具有较强的还原性,并可与某些含羰基的试剂发生缩合反应。 二、鉴别试验 1.制备衍生物测定熔点酰肼基与芳醛缩合形成腙,析出结晶,可测定其熔点。最常用的芳醛为香草醛。2.银镜反应 取异烟肼约10mg,置试管中,加水2ml溶解后,加氨制硝酸银试液1ml,即发生气泡与黑色浑浊,并在试管壁上生成银镜。 3.红外光谱三、异烟肼中游离肼的检查 异烟肼是一种不稳定的药物,其中的游离肼是由制备时原料引入,或在贮存过程中降解而产生。而肼又是一种诱变剂和致癌物质,因此国内外药典多数规定了异烟肼原料药及其制剂中游离肼的限量检查。中国药典对异烟肼原料和注射用异烟肼中游离肼的检查均采用薄层色谱法。 检查方法 取本品,加水制成每1ml中含50mg的溶液,作为供试品溶液。另取硫酸肼加水制成每1ml中含0.20mg(相当于游离肼50μg)的溶液,作为对照溶液。吸取供试液10μl 与对照溶液2μl,分别点于同一硅胶薄层板(用羧甲基纤维素钠溶液制备)上,以异丙醇-丙酮(3:2)为展开剂,展开后,晾干,喷以乙醇制对二甲氨基苯甲醛试液,15min后检视,在供试品主斑点前方与硫酸肼斑点相应的位置上,不得显黄色斑点。 异烟肼斑点呈棕橙色的清晰斑点,Rf值约为0.21。游离肼斑点呈鲜黄色,Rf值约为0.3。本法检出肼的灵敏度为0.1μg,检出限量约为0.02%。四、含量测定:异烟肼具有还原性,可用氧化还原滴定法测定含量。中国药典采用溴酸钾法,用甲基橙指示剂指示终点;同时采用本法测定异烟肼片和注射剂的含量。 测定方法 取本品约0.2g,精密称定,置100ml量瓶中,加水使溶解并稀释至刻度,摇匀;精密量取25ml,加水50ml、盐酸20ml与甲基橙指示剂1滴,用溴酸钾滴定液(0.01667mol/L)缓缓滴定(温度保持在18~25℃)至粉红色消失。 还可采用碘量法、溴量法、非水滴定法测定含量。
[B][center]药物中杂质的来源及杂质限量检查[/center] [/B]药物只有合格品与不合格品;一般化学试剂分为4个等级(基准试剂、优级纯、分析纯、化学纯) [B]药物中一般杂质检查 [/B][B]氯化物为一指示性杂质。[/B] 通过对氯化物的控制,可同时控制与氯化物结合的一些阳离子以及某些同时生成的副产物。可从氯化物检查结果显示药物的纯度,间接考核生产、贮藏过程是否正常。 1. 原理 药物中微量的氯化物在硝酸酸性条件下与硝酸银反应,生成氯化银的胶体微粒而显白色浑浊,与一定量的标准氯化钠溶液在相同条件下产生的氯化银浑浊程度比较,判定供试品中氯化物是否符合限量规定。 Ag+ + Cl- → AgCl ↓ [B]硫酸盐检查法 [/B] 1. 原理 药物中微量的硫酸盐在稀盐酸酸性条件下与氯化钡反应,生成硫酸钡的微粒而显白色浑浊,与一定量的标准硫酸钾溶液在相同条件下产生的硫酸钡浑浊程度比较,判定供试品中硫酸盐是否符合限量规定。 [B]铁盐检查法 [/B]硫氰酸盐法 巯基醋酸法 砷盐检查法 1. 古蔡氏法 1. 原理 金属锌与酸作用产生新生态的氢,与药物中微量砷盐反应生成具挥发性的砷化氢,遇溴化汞试纸产生黄色至棕色的砷斑,与同条件下一定量标准砷溶液所生成的砷比较斑,判断砷盐的含量。 [B]硒、氟及硫化物检查法 [/B]1. 氧瓶燃烧法 适用于以共价键结合的卤素、硫、硒的有机药物。 本法系将有机药物防入充满氧气的密闭燃烧瓶中进行燃烧,将燃烧所产生的欲测组分吸收于适当的吸收液中,然后根据欲测组分的性质,选用合适的分析方法进行鉴别、检查或含量测定。 [B]注意事项及讨论 [/B]1. 根据被燃烧分解的样品量选用适宜大小的燃烧瓶。 2. 测定氟化物时应改用石英燃烧瓶。 1. 硒检查法 (1). 操作方法 样品与对照品液,调节Ph2.0±0.2,加盐酸羟胺,二氨基萘,比色。 [B]硫化物检查法 [/B] 方法同砷盐检查第一法,不装醋酸铅棉花,以醋酸铅试纸代替溴化汞试纸。 标准液取1ml 5/ml [B]澄清度检查法 [/B]将一定浓度的供试品溶液与浊度标准液分别置于配对的比浊用玻璃管,同置黑色背景上,在漫射光下观察。浊度标准液 硫酸肼与乌洛托品溶液混合分五个等级,未超过0.5等级即为澄清。BP98规定未超过1等级即为澄清。 [B]溶液颜色检查法 [/B]CHP2000 [B]1. 比色法[/B] 色调标准贮备液 黄色液 重铬酸钾液(BP98用氯化铁) 红色液 氯化钴液 蓝色液 硫酸铜液 配成各种色调色号标准比色液共50种。 [B]2. 分光光度法 [/B] [B]易碳化物检查法 [/B]检查药物中含有的遇硫酸易碳化或易氧化而呈色的有机杂质。 对照品液 样品液 加硫酸5后,加供试品。 [B]炽灼残渣检查法[/B] 取供试品1.0~2.0g或个药品项下规定的重量,置已炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完全碳化,放冷至室温;除另有规定外,加硫酸使湿润,低温加热至硫酸蒸气除尽后,在700~800炽灼使完全灰化,移至干燥器内,放冷至室温,精密称定,再在700~800炽灼至恒重,即得。残渣限量一般为0.1~0.2% 一般应使炽灼残渣量为1~2mg 若需将炽灼残渣留作重金属检查时,炽灼温度必须控制在500~600。 [B]干燥失重测定 [/B]1. 常压恒温干燥法 2. 干燥剂干燥法 3. 减压干燥法 [B]水分测定法 [/B][B]费休氏法 [/B] 本法是根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的原理以测定水分。 [B]甲苯法[/B] 在加热状态下,甲苯夹带着水分蒸出,收集蒸出的水分测定。 [B]药物中特殊杂质检查 [/B] [B]一、物理法 [/B] [B]二、化学反应法 [/B](一)容量分析法 (二)重量分析法 (三)比色法和比浊法 [B]三、色谱法 [/B]1.纸色谱法 薄层色谱法 TLC是药典中最常用的特殊杂质限量检查方法。 1.在一定供试品及检查条件下,不允许有杂质斑点存在 2.以待测杂质对照品检测 3.将供试品稀释到适当浓度作为杂质对照品溶液 4.选用质量符合规定的与供试品相同的药物作为杂质对照品 [B]高效液相色谱法 [/B] [B][url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法 [/B] 1.面积归一化法 2.主成分自身对照法 3.内标法测定 4.内标法加校正因子法 5.外标法 有机溶剂残留量测定法 [B]分光光度法 紫外分光光度法 比色法 [url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法[/B]
摘 要 本文综合介绍各种药物中残留溶剂测定的多种方法,包括气相色谱法、紫外分光光度法、高效液相色谱法剂及多种方法的联合应用等。关键词 药物 残留溶剂 测定方法 药品中的残留溶剂是指在合成原料、辅料或制剂生产过程中使用或产生的挥发性有机化学物质。他们在生产过程中未能被全部清除,服用后对人体有毒性和致癌作用,近年来日益引起各方面的重视,在新药研究中要求越来越严格。从1994 年起, ICH(人用药物技术要求国际协调会议) 着手编撰关于溶剂残留量的指导原则。1997 年美国FDA 根据此原则发布题为“杂质:残留溶剂(Q3C) 的指导原则(草案) ”。ICH程序委员会广泛征求意见后通过此原则,欧盟、美、日三方签字后正式生效1 。我国在1995 年药典也规定7种限制溶剂残留项2 ,在2000 年药典中3 ,根据ICH 的限度要求对这7 种溶剂残留限量进行调整。ICH 要求检测的溶剂就有69 种,虽然我国药典并未要求按ICH的规定实施,但在新药研究中对于残留溶剂的要求事实上是参照ICH 的规定执行的。这是SDA 对新药研究从严从高要求的体现,也是与国际接轨,适应WTO规则的需要。在实际工作中,药品的合成、制剂、消毒工作涉及到的有机溶剂有上百种,气相色谱法是中国药典对有机残留溶剂测定的法定检测方法,也是检测有机溶剂的最常用、最适用的方法之一,但其他现代分析手段的应用,比如比色法、HPLC 法、核磁共振法、热重分析法以及多种方法联合应用,是对气相色谱法的补充,也是残留溶剂测定新方法有益尝试。最近十多年,残留溶剂测定的文献报道越来越多,为加强学习,也为使初学者对残留溶剂的测定方法有一个全面的了解,作者查阅各种文献,结合自己的工作经验稍做总结,对残留溶剂的测定方法作一简要介绍,希望能给读者一点启示。