各位大侠: 按照药典方法测定乳酸钠林格注射液中氯化钠的含量,吸光度在0.1左右,线性很不好,同样样品,运行两次结果相差也很大,不知道是什么原因,希望能给予帮助,谢谢!!!!
求助文献:复方乳酸钠葡萄糖注射液中12个元素杂质的质量研究作者:李正艳、周芸芸
复方氨基比林注射液说明书(兽用)【兽药名称】通用名:复方氨基比林注射液 英文名:Compound Aminophenzone Injection 汉语拼音:Fufang Anjibilin Zhusheye【主要成分】为氨基比林与巴比妥混合制成的灭菌水溶液。含氨基比林7.15%和巴比妥2.85%。【性 状】本品为无色或淡黄色的澄明液体。【药理作用】本品给药后即时产生镇痛作用,其解热镇痛作用强而持久,氨基比林与巴比妥合用能增强其镇痛作用,有利于缓解疼痛症状。本品还有抗风湿和消炎作用。半衰期为1~4小时。【适 应 症】用于发热性疾患、关节炎、肌肉痛和风湿症等。【用法用量】 肌内、皮下注射:一次量,马、牛20~50mg;羊、猪5~10mg。【注意事项】连续长期应用可引起粒性白细胞减少症,应定期检查血象。【停 药 期】28日,弃奶期7日。【有 效 期】二年【规 格】10ml【包 装】10ml /支×5支/盒【贮 藏】遮光、密闭保存。
想配制一个不含主药成分的注射液空白,看了下某注射液的辅料,为丙二醇,但没写浓度。有人告诉我大概就按照1%~10%的浓度配制这个辅料溶液就可以了,但我一估算,主药成分是10ml:0.1g,相当于1%的浓度。想不到名为辅料,这个浓度居然跟主药浓度相当甚至还超过啊,所以有点吃不准,特来请教各位老师,还望赐教。
注射液是常用的药品之一,而且因其药效迅速、作用可靠,正越来越广泛地应用于临床。因注射液直接进入血液,对其无菌性的要求非常高,《中国药典》规定,注射液中不应含有任何活的微生物,这就需要抗氧剂来帮忙。那么在注射液中常用的抗氧剂 有哪些?

10,抽取5个版友);中奖名单:夏天的雪(注册ID:bingwang228)捌道巴拉巴巴巴(注册ID:v3082413)sixingxing(注册ID:v2889187)yifan1117(注册ID:yifan1117)dahua1981(注册ID:dahua1981)http://ng1.17img.cn/bbsfiles/images/2016/10/201610241505_614864_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/10/201610241505_614865_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================地塞米松磷酸钠注射液方法:HPLC基质:药品应用编号:101419化合物:地塞米松磷酸钠固定相:Diamonsil C18色谱柱/前处理小柱:Diamonsil C18, 250 x 4.6mm样品前处理:【有关物质】 取本品,加流动相定量稀释制成每1ml中约含地塞米松磷酸钠0.5mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。另取地塞米松对照品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含0.5mg的溶液,精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照品溶液。 【含量测定】 精密量取本品适量,用水定量稀释制成每1ml中约含地塞米松磷酸钠0.4mg的溶液,精密量取5ml,置50ml量瓶中,流动相稀释至刻度,摇匀,测定。色谱条件:检测波长:UV 242 nm 流动相:三乙胺溶液(三乙胺7.5ml,加水稀释至1000ml,用磷酸调pH至3.0±0.05)-甲醇-乙腈(55:40:5) 洗脱方式:等度 进样量:20 ul文章出处:迪马科技关键字:地塞米松磷酸钠,钻石二代,diamonsil C18(2),《中国药典》2010版,摘要:地塞米松磷酸钠注射液检测谱图:http://www.dikma.com.cn/Public/Uploads/images/12334(1).JPG
喜炎平脉络宁注射液引起严重过敏2012年06月27日08:47新华网国家食品药品监督管理局26日发布通报,提示生产企业和医患人员关注喜炎平注射液和脉络宁注射液引起严重过敏反应的问题。据了解,喜炎平注射液的成分是穿心莲内酯磺化物,主要用于解热消炎。2011年,国家药品不良反应监测中心病例报告数据库有关喜炎平注射液的病例报告数共计1476例,其中涉及14岁以下儿童报告达1048例。主要不良反应表现为过敏样反应、过敏性休克、紫绀、呼吸困难等。脉络宁注射液是2009版国家基本药目录品种,其功能与主治为清热养阴、活血化瘀。用于血栓闭塞性脉管炎、动脉硬化性闭塞症、脑血栓形成及后遗症、静脉血栓形成等。2011年,国家药品不良反应监测中心病例报告数据库共收到有关脉络宁注射液药品不良反应病例报告1500例,其中严重病例报告189例。严重不良反应主要为呼吸系统损害、全身性损害和心血管系统损害等。国家食品药品监管局建议,由于这两种注射液易发生过敏反应,建议医护人员在用药前详细询问患者的过敏史,特殊人群和过敏体质者应慎重使用。使用时应严格按照说明书规定的用法用量给药,不得超剂量使用;谨慎联合用药。如确需联合使用其他药品时,应谨慎考虑与此两种药品的间隔时间以及药物相互作用等问题。对于药品生产企业,国家食品药品监管局建议,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;完善生产工艺、提高产品质量标准,开展相应安全性研究。(新华网)
我测的是注射液里的钠,钾,铯,可是注射液里有葡萄糖和枸橼酸,是不是必须硝化啊,硝化的方法在那里着找啊,我是新手,忘各位前辈指点指点。我在一些专利网上没有查到。
【中国药典】从1985年版至1995年版均采用显微镜法检查注射液中的不溶性微粒。检查≥10μm与≥25μm两档,与美国药典标准基本相同。在2000年版【中国药典】显微镜法检查注射液中不溶性微粒的基础上增加了第二法----光阻法。在2005年版【中国药典】中增加了对小剂量注射液的检测。【中国药典】2005年版初稿对注射液中不溶性微粒污染的监控作了修订,将光阻法修订为第一法,显微镜法为第二法。修订后的结果判定也与美、英、欧共体、日本基本一致。原文来自:http://pssnicomp.cn/zhuanti.html
看到氢化可的松注射液的辅料里有乙醇和注射用水,想扣除辅料干扰就得配制相应浓度的辅料,谁能透露下,这处方里头的乙醇大概浓度多少啊? 叩谢各位大大。
近日有群友求助,群里尚未有人应答,现在版面上贴出,希望有人予以回应: 依据依######注射液处方,配制#####注射液作为制剂空白。精密量取B、Mg、Al、K、Ca、Cr、Fe、Zn、Ba、As、Cd、Pb、Co、Ti、Mn、Sb标准液适量于10ml量瓶中,用1%硝酸稀释至刻度,得对照储备液精密量取对照储备液适量于50ml量瓶中,加入制剂空白溶液10ml, 1%硝酸稀释至刻度,得系列浓度溶液。以含20%制剂空白的1%硝酸溶液为标准空白溶液。测定标准空白溶液和标准溶液系列,仪器自动绘制标准曲线。然后根据此线性进行样品测定,及方法学考察。不知这样的做法是否有不妥的地方?
大家好,我不是做[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]的,但我现在在做一个注射液的砷盐限量检查,其中用到了湿法消解,由于是第一次接触,很多地方不明白,也不知道如何掌握尺度,需要向大家请教,在这里多谢了。我的检测方法是这样的:处方组成:黄芩,熊胆粉,山羊角,金银花,连翘。颜色为红棕色的澄明液体。取本品5ml,加数粒玻璃珠后加硝酸高氯酸混合液(4:1)15ml,放置5分钟后,小火缓慢加热,待作用缓和后取下放冷,沿瓶壁加硫酸5ml,升高温度至产生白烟,溶液应为无色澄明液体(必要时放冷后再加入硝酸高氯酸溶液,至有机质破坏完全,溶液澄明),放冷,加水煮沸至产生白烟为止,放冷,转移至50ml量瓶中,定容至刻度,摇匀,取4ml,加盐酸5ml和蒸馏水19ml,自“再加入碘化钾试液”起依法测定(中国药典2005年版附录IX J第一法),含砷盐不得过百万分之二。问题:1、 小火缓慢加热,待作用缓和后,小火如何控制,什么叫作用缓和,我看到论坛中的大部分方法都是这么描述的,但是我的注射液加热后就是冒红棕色的烟,反应并不剧烈,所以应该烧到什么程度,是到冒完红烟后冒白烟然后溶液变无色算消解好了么,还是烟的红色中夹杂白色但溶液仍为红色就可以了呢。2、加硫酸的目的是什么,至产生白烟,是开始产烟就取下,还是没白烟才取下,产烟是在瓶口还是在瓶内。3、加水的目的是什么,产烟的问题同上。4、我曾经这样做过:加硝酸和高氯酸后用电炉加热至溶液无色,加硫酸烧了约5分钟,加水至产生白烟,结果我的样品和标准砷斑均无颜色,也就是砷没了,这是怎么回事呢,砷在哪一步跑掉的呢。5、请大家帮我算一下限度是否是百万分之二,我不会算。请经验丰富的同仁们多多帮忙了。
为对庆大霉素和林可霉素注射液的安全性进行毒理学评价,采用急性毒性试验、溶血试验、局部血管刺激性试验、肌肉及皮肤刺激试验及豚鼠全身用药的过敏试验,考察庆大霉素和林可霉素注射液制剂的安全性。结果表明,庆大霉素和林可霉素注射液对小鼠肌肉注射的LD 。为4.989 mL/kg,0.1~0.5 mL该注射液在4 h内对兔红细胞不产生溶血和凝聚作用;静脉注射部位血管及周围组织均未见充血、水肿、出血和坏死等病理改变,肌肉注射部位充血范围在0.5 cm×1.0 cm 以下,4块股四头肌反应级的最高与最低之差等于0,家兔四块股四头肌反应级之和小于1O;以相当于临床用量2倍的剂量涂抹皮肤,停药后1、24、48、72 h镜下观察均未见明显异常的病理变化;豚鼠首次致敏后第14天及第21天静脉注射液攻击,在观察期内未见过敏反应。表明庆大霉素和林可霉素注射液在该试验条件下是安全的。过敏试验猪链球菌病是由猪链球菌引起的人畜共患传染病,是规模化养猪场中最常见的细菌病之一(蔡宝祥,2001)。本病一年四季均可发生,但以5一l1月发生较多,大小猪均能感染发病,但多见于断奶仔猪和育肥猪。庆大霉素和林可霉素注射液主要用于治疗断奶仔猪链球菌病,临床多肌肉注射给药。为了考察该给药方法的安全性,根据《新药注册管理办法》及有关法规的要求,作者对庆大霉素和林可霉素注射液进行了急性毒性试验、溶血试验、局部刺激性试验(肌肉、血管、皮肤)及全身过敏试验,供临床参考。
2010版药典中盐酸利多卡因注射液含测项下结果乘以1.156是什么意思,这个数据是根据什么公式得来的呢?
复方氨基酸注射液采用丁基胶塞密封,胶塞中的硫磺可能会浸出到注射液中,需要对药液中的硫磺含量进行测定。但是,方法学建立过程中,进行药液的加标回收率测定,发现其不合格,并且随氨基酸浓度升高,硫磺回收率降低。求助可能的原因,有哪位大神做过相关的实验吗?请不吝赐教,大谢
多多药业有限公司生产的双黄连注射液被叫停。今天,国家食品药品监督管理局在其网站上发出通知,要求各地暂停销售使用标示为多多药业有限公司生产的双黄连注射液。 16日,国家药品不良反应监测中心报告称,标示为黑龙江多多药业有限公司生产的双黄连注射液在使用中出现严重不良事件。为确保公众用药安全,决定暂停销售和使用标示为多多药业有限公司生产的双黄连注射液。 目前,国家食品药品监督管理局和卫生部正在对该事件发生的原因进行调查。 大家对此事件如何看待的,有什么想法、看法、观点,说说,晒晒![em09502]
药典制剂通则中注射剂项下没有色泽均匀或一致的规定,如发现同批注射液色泽深浅不一、经检验均符合标准规定,如何下结论?
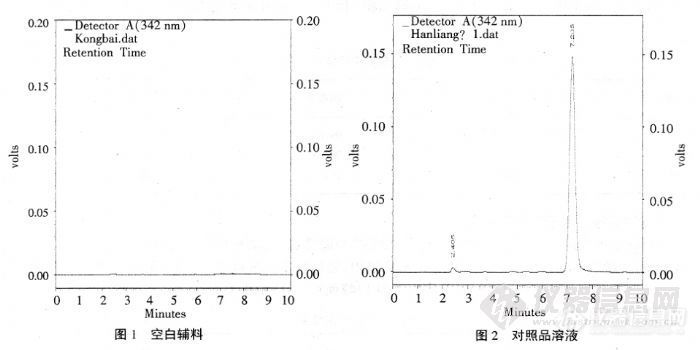
标题:5.1 甲钴胺注射液含量的方法学研究作者:常 明 1, 李 晶 1, 武玉洁 2, 张文双 2( 1.石家庄学院 化工学院, 河北 石家庄 050035; 2.石家庄栢奇制药有限公司, 河北 石家庄 050035)摘要: 摘 要: 以乙腈- 甲醇- 0.05 mol /L磷酸二氢钾溶液( 10∶ 20∶ 70) (用磷酸调节 pH 值为 4.0)为流动相, 采用迪马钻石 C18( 250 mm× 4.6 mm, 5 μ m)色谱柱及紫外检测器, 建立了甲钴胺注射液中甲钴胺含量的反相高效液相色谱检测方法. 柱温: 40℃; 检测波长为 264 nm; 流速: 1.0 mL /min. 本方法测定的日内精密度为 0.59%, 日间精密度为 0.67%, 回收率为 99.7%~ 100.5%, 在 160~ 240 μ g /mL范围内线性关系满足要求( r=0.999 9) ; 结果表明方法准确、 操作简单、 专属性强, 可用于定量测定甲钴胺注射液含量.http://ng1.17img.cn/bbsfiles/images/2012/07/201207161648_377914_2379123_3.jpg
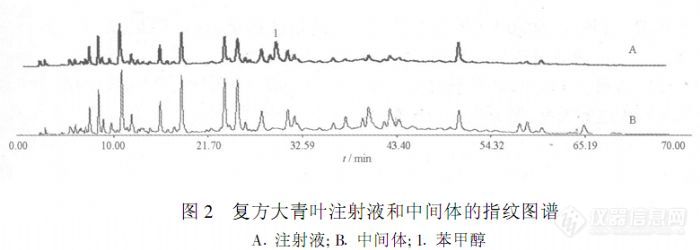
【作者中文名】刘瑞; 刘志刚; 李磊; 任冲; 袁波; 李发美;【作者英文名】LIU Rui; LIU Zhi-gang; LI Lei; REN Chong; YUAN Bo; LI Fa-mei(School of Pharmacy; Shenyang Pharmaceutical University; Shenyang 110016; China);【作者单位】沈阳药科大学药学院; 沈阳药科大学药学院 辽宁沈阳; 辽宁沈阳;【摘要】目的:采用HPLC建立复方大青叶注射液的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,甲醇-水-磷酸为流动相进行梯度洗脱,流速1.0 mL.min-1,检测波长254 nm。结果:建立了复方大青叶注射液的HPLC对照指纹图谱,标示了注射液中的20个共有峰,并初步确定注射液的相似度阈值为0.85。结论:该方法准确、重复性好,为复方大青叶注射液的质量控制提供了依据。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131758_383604_2379123_3.jpg
土霉素注射液用高效液相怎么检测?谢谢!
5-单硝异山梨醇酯检查时HPLC的问题5-单硝异山梨醇酯注射液检查有关物质时,色谱图在溶剂峰处有时会出现一个很大很尖的峰,有时又没有,有做过的来讨论一下。有时含量测定时也会出现。是5-单硝异山梨醇酯分解产物吗?困惑。
摘要: 目的 通过处方筛选试验确定利巴韦林葡萄糖注射液的制备工艺。 方法 通过一系列处方筛选优化试验和药物稳定性研究试验,初步确定质量表现稳定的利巴韦林葡萄糖注射液的完整处方。并通过灭菌工艺选择和验证研究,使生产工艺符合国家化学药品注射剂的技术要求。 结果 确定了质量表现稳定的利巴韦林葡萄糖注射液的完整处方,并针对在试验中发现的活性炭对利巴韦林吸附较大的问题,通过试验确定了主药后加的工艺流程,避免了活性炭的吸附影响。结论 本品经由试验确定的制剂工艺具有路线短,污染小,成本较低的优点,有利于转化为产业化大生产,将具有较好的经济效益和社会效益。关键词:利巴韦林;葡萄糖;注射液;制剂;利巴韦林(Ribavirin)是一种广谱抗病毒核苷类药物,在体内、体外对多种病毒的脱氧核糖核酸(DNA)或核糖核酸(RNA)的合成有显著抑制作用。data:image/png;base64,R0lGODlhxQDNAHcAMSH+GlNvZnR3YXJlOiBNaWNyb3NvZnQgT2ZmaWNlACH5BAEAAAAALAIABQC/AL8AhQAAAAAAAB0AAAAAHQAAMwAdPQAdMgAcSAAzWh0zWh1GbDMAAD0dADQdNDMeRzNbgEgcAEgdHUceM1ozAEg0AFszM11/f0huf1l/bmxGHW5dXX9/XX9uSG6AbmaIiIBbM4iIZgECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwb/QIBwSCwaj8ikcslsOo2BKOFJrVqv2Kx22/wEigEFd0wum89ar5iYCTzQ8Lh8joVMjYsDfc/vzwVJA36DhIVWAQhHE1+GjY6PAIxHkpCVlnICekYQgpeen2ScF3iaoKanVZRDqqitrpNgr7KzRQtRAaW0uru8vb6/wMHCw2esxMd9xsjLcsrMz2bO0NNPxtLU2ErW2dxU293gS6zXV17WUQAMt52Rt2vhyarkWLhGEUQC70ITd/CE8nBsLVlwJJc/PwDPOIhURAIRgkUmGDyYLBYcZxCLTKTIJyGZhQAWsHM4xNatW7miJOJIx2MZDgL6PSw4JAEAmPpYXgRzsqdP/59FQALwMoWkkAU5JRrJsFFnnHlX2hioRdNIU6fFzAgV0kYm0ogTM2DdA1ULP3xHZI7taGYRuoZCIKxbdWttxVZv7KIpayin3jF8C51U+5de4XCBDwNLrNgX48a9HkPWJXmyt3o8Me+1jPDIvaec/dhaSTa0n4WqjEYzfRqAXCKqyVRmXQWkyCGxucymjSXmTt59hBIFoPrnSSa7gT/ZKrVBNeN1lQcv0lW2dEdnrV+X4zYMXO3bF4cXlnx8o/LmoWxelf53Vvbty7jUQgl9/PlZ6seXTwS9/v26WQQeQwDSJyBg/RVoIHz8MahgKgcimOCDEE64moMUNvHfe0LYt/8dfhJimGESIAZo4YjaRNggik6UiGAUBrUBI4sEiohGG1fR6KIZo323i1xRsHMcEUAGQJghO2pFgXe4/QKIEWolyZYhC8mVF3G/fEWEUjZ6eAgktwmTERGl2HFEHo54udwQvmHpi5ZDcAlAJkdwkqYjWxnpZi8m9VSKM2o+RyUYBjj3ZlJ/krZloN5YouebVc0ZiKOEbDXEkbPAuU+Z7DyU4yBvkRVqk5BaNYQXigLQxpWU8pZPRDK1QdoirF7CKDRFCunOQ9GhMuqIv0Li363IBHuniaYZi2RlxFLTbDVCmDPJqMqGVu0jmg3xWYfmXWuIQCTe9wlqPgLorWA0tlP/iW0joXguHzBhSuGzSORZlI6XSJUuvUdYWh2L/DaRnbuGdJdTbg9WVqS86VZ4hZQNI2eYeg9HXCMVZpJSccSM0blJp9ByvDEsX4pcBaqKuFFywx1vZOfK+2IB8lETs0xPqm3UHHNUiMSp8sg7Y9Hnp+JYHHC4JoeMXFlH28V0YFA1vVbUOiNtszjMXiP1WFoPSPHV00ajzNZYjQ3a10HTNcc4Rqt40YZBv7si2U4xIrXdRsv9Nt068c1t0thafDGSgg+OruB67+V332Qnbu6xhTsu2+J130153YQXrjaol1f+T+eM89ur5urGQ3p/ooNe+bOjny75w6qXzXrsq7f0/3qGtwt6OhS5L0277Iy2vns7wfc+r/FICD888Xsvz7uayi8ffX7I41496r87Dd323A/pfGbdh//T99OKb/711p9vPvnJc8i+2wu+D39+8qMdYv1/r4i/4VtkX5iH/vsLAPdno/jtb4AE5J8B8YdAAjbwgO5jYATr90AJXsiBE5RfBRPIwTEsjEhz6dD0PjiEXNEFfayZz5OKIC8VpgVwDhrTPqx2Ik0BQE4sylgtSiFDIbjsSGiimanS5bEivCwkiDpCEYnEDhvikGDtO8pPNgKokkyRZanahyR6+MQOZfGGP3Mi0fazQiM0MVJoQcIZh0ijI3qqJEn82Jl4GEcaoTSMDT8LCRpP1TM8XqmHABjjfmTlM1aVcR8tnJUqXrUlhlGoT0YMIfGYhIfWmVCEUfALNIIAADs=图1-1 利巴韦林的分子结构目前利巴韦林已在全球44个国家上市,相关制剂从口服、注射到外用,可谓应有尽有。本课题通过一系列处方筛选优化试验和药物稳定性研究试验,初步确定利巴韦林葡萄糖注射液的完整处方。通过灭菌工艺选择和验证研究,使生产工艺符合国家化学药品注射剂的技术要求。并针对在试验中发现的活性炭对利巴韦林吸附较大的问题,在查找、研究文献的基础上,通过试验确定了主药后加的工艺流程,避免了活性炭的吸附影响。1材料1.1 试剂利巴韦林(湖北潜江制药股份有限公司,国药准字H19999139);针用活性炭(上海活性炭厂);氢氧化钠、盐酸均为分析纯。1.2 仪器梅特勒pH计PE20K(梅特勒);Agilent 1100型HPLC(安捷伦);岛津UV2450紫外分光光度(岛津);电热鼓风干燥箱DHG-9123A(上海精宏实验设备有限公司);美的冰箱 BCD-183CM(美的集团冰箱制造合肥有限公司);YB-2照度仪(天津天光光学仪器有限公司)。2方法2.1 处方与依据利巴韦林葡萄糖注射液为利巴韦林和葡萄糖的灭菌水溶液。目前,利巴韦林葡萄糖注射液在国内上市的规格有100 ml : 0.1 g、100 ml : 0.2 g、100 ml : 0.5 g、250 ml : 0.25 g、250 ml : 0.5 g、500 ml : 0.5 g,在临床上用于治疗由呼吸道合胞病毒感染而引起的病毒性肺炎及支气管炎。在不改变原使用方法的情况下,我们拟开发规格为100 m l: 0.1 g、100 m l: 0.2 g、100 ml : 0.5 g的利巴韦林葡萄糖注射液。2.2 处方筛选按照注射液研究的一般要求,设计以下处方,逐步开展试验。2.2.1 处方1首先,对规格为100 ml: 0.5 g的注射液,进行处方筛选试验。处方1的设计方案如下: 利巴韦林 5 g 葡萄糖 50 g 注射用水 加至1000 ml 称取上述处方量的主药和葡萄糖,加入80%注射用水,搅拌使完全溶解,然后再加入注射用水至全量,检查外观,并测定pH值。2.2.2 处方2 处方2的设计方案如下: [td=1,
中药注射液,确切的说我要做香丹注射液的重金属及有害元素检查,可以制剂取10ml加5ml置赶酸仪中130°,加热至近干,就稀释等上机做可以吗?
紫外分光光度法测定盐酸麻黄素注射液含量关键词: 麻黄素;可见和紫外分光光度法[摘要] 目的:探讨盐酸麻黄素注射液含量测定的新方法,以求更快速、准确地适应临床用药需要。方法:用不同厂家不同批号的盐酸麻黄素注射液做供试品,用标准麻黄素做对照品,用紫外分光光度计测出标准品的最大吸收度,求出浓度与吸收度关系,得其回归方程,测其回收率。求出含量与药典法进行比较。结果:在256±1 nm处有最大吸收,以256 nm为测定波长,盐酸麻黄素浓度与吸收度呈标准曲线线性范围0.2~1.2 mg/ml(r=0.999 9),平均回收率为(100.31±1.02)%,两种方法测定结果差异无显著性(P>0.05)。结论:紫外分光光度法,可以做为盐酸麻黄素注射液含量测定的新方法。[中国图书资料分类法分类号] R 974.3;O 657.32 [文献标识码] A[文章编号] 1000-2200(2000)05-0380-02 盐酸麻黄素是拟肾上腺素药,目前对该病及其制剂的含量测定方法有非水滴定法[1]、银量法[1]及中和法[2]。本文采用紫外分光光度法[1],测定盐酸麻黄素注射液的含量[3],并与1995年版药典的非水滴定法进行比较,兹作报道。1 材料与方法1.1 仪器 Du-640型紫外分光光度计(美国贝克曼公司)。1.2 试药 盐酸麻黄素对照品,盐酸麻黄素注射液(上海信谊制药厂,批号951201-1,951201-2;无锡市第七制药厂,批号960117-1,960117-2,960610;规格均为1 ml∶50 mg)。1.3 测定方法 (1)盐酸麻黄素紫外吸收光谱:取盐酸麻黄素对照品适量,用蒸馏水溶解并配制成0.6 mg/ml的溶液,以蒸馏水为空白,在230~300 nm波长之间扫描,在256±1 nm波长处有最大吸收,故采用256 nm为测定波长。(2)标准曲线的绘制:精密称取经105℃干燥至恒重的盐酸麻黄素对照品50 mg,置25 ml量瓶中,加水溶解并稀释至刻度,摇匀。精密量取该药液1.0、2.0、3.0、4.0、5.0、6.0 ml分别置10 ml量瓶中,加水稀释至刻度,摇匀,以水为空白,在256 nm处分别测定吸收度。结果表明,在0.2~1.2 mg/ml浓度范围内,浓度与吸收度呈良好的线性关系。得其回归方程为:A=0.8256 C+0.012 0(r=0.999 9,n=6)。(3)稳定性实验:取(2)项下的各溶液于配制后0、1、2、3、4、8、16、24 h分别测吸收度,结果几无变化。(4)回收率试验:精密称取经105℃干燥至恒重的盐酸麻黄素对照品约25 mg,置50 ml量瓶中,加水溶解并稀释至刻度,以水为空白,在256 nm波长处依法测定吸收度,求出回收率。(5)样品测定:取不同批号的盐酸麻黄素注射液,精密量取1 ml,分别置于100 ml量瓶中,加水稀释至刻度,摇匀,以水为空白,在256 nm处测吸收度,计算其含量,并将本法测定的结果与中国药典1995年版收载的非水滴定法测定的结果进行比较。1.4 统计学方法 采用配对t检验。2 结果 紫外分光光度法回收率试验结果见表1;与药典法测定样品中盐酸麻黄素注射液的含量结果比较见表2。表1 回收率试验结果(n=5) 编号 加入量(mg) 测得量(mg) 回收率(%) ±s(%) 1 26.40 26.42 100.08 2 24.80 25.20 101.61 3 25.20 25.08 99.52 100.31±1.02 4 24.30 24.57 101.11 5 25.00 24.81 99.24 表2 两种方法测定结果比较(ni=15;±s) 测定方法 标示量(%) ±sd td P 紫外分光光度法药典法 100.17±1.07100.18±0.48 0.01±0.80 0.02 >0.05 3 讨论 盐酸麻黄素注射液是卫生部规定的控制药品。为保证患者用药的准确有效,防止在生产这类药品过程中盐酸麻黄素原料的流失,对其含有盐酸麻黄素的药品进行快速、简便、准确的含量测定显得尤为重要。传统的本品测定方法,不但操作过程繁琐,消耗试药量大,且非水滴定法中的醋酸汞试剂对人体有害,污染环境。 麻黄素属β肾上腺素受体激动剂,可直接或间接激动肾上腺素受体。对心血管系统、支气管平滑肌、中枢神经系统都有较强的作用。在临床上应用较为广泛且剂量要求十分准确,所以对其含量的准确、快速测定更为重要。特别是临床上经常使用“盐酸麻黄素滴鼻剂”是医院自配药品,效期短,配制频繁,在其准确的基础上,快速测定及时保证药品的临床供应,并指导临床用药有一定的意义。 两种方法测定结果差异无显著性(P>0.05),表明紫外分光光度法可以做为盐酸麻黄素注射液的含量测定新方法。且本法操作简便、快速、准确,重复性好。作者简介:郗 颖(1967-),女,安徽灵璧县人,药剂师.[参考文献][1]中华人民共和国卫生部药典委员会.中国药典二部[M].广州:广东科学技术出版社,1995.18,693~694.[2]中华人民共和国卫生部药政局.中国医药制剂规范*西药制剂[M].北京:中国医药科学技术出版社,1996.166~167.[3]熊凤英,简 洁,周淑群.紫外分光光度法测定米非司酮血药浓度[J].中国医院药学杂志,1998,18(6)∶262.
最近在测注射液中的Ca,选用了Ca43,44,He碰撞模式和标准模式(无反应碰撞气)都选了,发现Ca44标准模式的测定结果比Ca44 He模式、Ca43 He模式和Ca43标准模式这3种的结果高不少,后面3种模式差不多一致。然后做了样品加标实验,发现4种模式的加标回收率都是合格的,这是什么原因导致的呢,Ca44标准模式的测定存在干扰吗?Sr88双电荷吗?
维生素K1注射液可能引起严重过敏反应。昨天,国家食品药品监督管理局发布药品不良反应信息通报。记者从市药品不良反应监测中心获悉,本市已接报相关不良反应报告超过百余例,均以过敏为主,包括过敏性休克、皮疹、发热等,但并未出现严重后果。据市药品不良反应监测中心杜文民教授介绍,维生素K1注射液是2009版国家基本药物目录品种,主要用于各种维生素K缺乏引起的出血性疾病的治疗。2004年1月1日至2011年5月31日,国家药品不良反应监测中心病例报告数据库中有维生素K1注射液严重不良反应/事件报告893例,其中过敏性休克328例(占36.7%),严重过敏反应是维生素K1最为突出的不良反应。分析显示,维生素K1注射液临床使用中存在一些不合理现象,如超适应症用药、超剂量用药、不适宜的给药途径等,这些不合理使用加大了维生素K1注射液安全风险。市药品不良反应监测中心统计也显示,近年来本市接到维生素K1不良反应报告100多例,均以过敏为主,包括过敏性休克、皮疹、发热等,但并未出现严重后果。杜文民提醒,医务人员在用药前应详细询问患者的过敏史,对维生素K1及注射液所含成份过敏者禁用,过敏体质者慎用。

ELSD法测定某种药注射液中吐温-80的含量前言:吐温80(Tweem80,聚山梨醇脂80),是一种非离子型表面活性剂。常作为增溶剂,乳化剂、分散剂或稳定剂广泛应用于食品和药品的生产。随着中药注射剂在临床上的广泛应用,含吐温80的中药注射剂经常出现一些不良反应,为控制中药注射剂中吐温80的含量,需要拥有准确快速的检测方法来保证产品的质量,保障临床用药安全。1.仪器与试药仪器:安捷伦1260高效液相色谱仪(四元泵,385蒸发光检测器)及色谱工作站万分之一电子天平(型号T-214 美国DENVER)十万分之一电子天平(型号TB-215 D 美国DENVER)KQ-5200超声仪试药:乙腈为色谱纯,水为纯化水,其余试剂均为分析纯对照品:吐温-80(批号:G01359 USP)样 品:某种药注射液批号: 20120206,20121002,20121012,20121119,20121132,20121203,20121234,20130109,20130134,20130202,20130314,20130501,20130506,20130517,201311062.含量测定方法学考察2.1色谱条件色谱柱:TSKgel G2000SWXL(7.8mm*300mm,5μm)及保护柱;流动相:20mmol·L-1醋酸铵一乙睛(88:12),流速:0.6mL·min-1;柱温:30℃;ELSD检测条件:蒸发器温度80℃,雾化器温度60℃,氮气流速2L·min-1;进样量:对照品溶液10μL与[
[center]脑蛋白水解物注射液药品标准不完善[/center] 据国家药监局网站消息,为确保公众用药安全,国家药监局日前通知要求各地进一步加强对脑蛋白水解物注射液的监督检查。 通知称,在全国开展注射剂类药品生产工艺和处方核查工作中,发现脑蛋白水解物注射液品种在药品标准和执行工艺处方等方面存在着较为突出的问题,主要是企业选用猪脑原料的质量标准不完善;企业之间现行生产工艺差别较大;猪脑水解所用的蛋白酶种类、酶量及水解温度、时间等不一致,甚至有补加氨基酸的行为。针对上述突出问题,部分地区已采取了控制措施。 通知指出,一、要充分认识到脑蛋白水解物注射液在产品质量方面存在的安全风险,各地应在注射剂类药品生产工艺和处方核查工作的基础上,积极组织力量认真做好监督检查工作。要建议辖区内脑蛋白水解物注射液生产企业主动停止该品种的生产,并要求脑蛋白水解物注射液生产企业按相关技术要求,组织开展改进工艺和质量控制方法的研究工作,在相关工艺改进和质量标准未经批准前,暂不宜恢复生产。 二、对于生产企业认为其脑蛋白水解物注射液生产工艺合理、质量可控,继续进行生产的,所在地省级食品药品监督管理局应对其生产全过程予以跟踪检查,并对监督生产的产品进行现场抽样,由省级药品检验所检验。 凡生产企业存在未按批准变更生产处方工艺生产,或在制成品中补加氨基酸等违法违规行为,以及现场抽样检验不合格的,应依法予以严厉查处。 三、国家局将组织有关专家开展脑蛋白水解物注射液有效性、安全性评价工作,组织对脑蛋白水解物注射液生产工艺的改进、质量控制标准的提高工作,并在此基础上提出监管措施和改进意见。信息来源:中国新闻网
中药注射液的前途渺茫还是?大家说说看[em0801]
本人用的是mars微波消解仪,以前做的都是固体样品, 现在要做注射液,不知取样量应该为多少毫升合适,消解加温程序如何,用杨树叶测得准的话,是不是可以不测回收率了。还望高手不吝赐教!谢了先