共焦显微镜因其高分辨率和能三维立体成像的优点被广泛应用在生物、医疗、半导体等方面。文章首先分析了影响共焦显微镜分辨率的因素,主要有光源、探测器孔径和杂散光等;并结合这些因素介绍了双光子共焦碌微镜、彩色共焦显微镜、荧光共焦显微镜、光纤共焦显微镜;然后从提高系统成像速度的方面介绍了波分复用共焦显微镜和频分复用共焦显微镜;最后分析了共焦显微镜的发展趋势。一、引言随着人们对于生物医学的研究,传统的光学显微镜已经无法满足研究的需要,人们需要可以实现三维成像的显微镜。1957年Marvin Minsky提出了共焦扫描显微镜的原理。1969年,耶鲁大学的Paul Davidovits和M.David Egger设计了第一台共焦显微镜,1987年第一台商业化共焦显微镜的问世,真正实现了三维立体成像。与普通光学显微镜相比,共焦显微镜具有极其明显的优点:能对物体的不同层面进行逐层扫描,从而获得大量的物体断层图像;可以利用计算机进行图像处理;具有较高的横向分辨率和纵向分辨率;对于透明和半透明物体,可以得到其内部的结构图像;还可以对活体细胞进行观察,获取活细胞内的信息,并对获得的信息进行定量分析。自共焦显微原理被提出以来,引起了研究者的广泛关注,提高显微系统的分辨率和改善系统的性能是研究者开发新型显微镜时考虑的主要因素。近几十年,国内外学者通过对共焦显微成像系统的三维点扩散函数、光学传递函数等方面的分析,得出影响显微系统分辨率的因素,主要包括系统的激励光源、探测器孔径、杂散光等。此外,共焦显微镜的成像速度也是决定系统性能的一个重要因素,专家们也一直在进行提高系统成像速度的研究。本文主要从提高显微系统分辨率和系统成像速度这两个方面来介绍共焦显微镜的发展情况。二、共焦扫描显微镜分辨率的提高光源、探测器孔径和杂散光等是影响共焦显微镜分辨率的几个主要因素,因此可以通过改善这些方面来提高显微系统的分辨率。1.光源显微镜的成像性质在很大程度上取决于所采用光源的相干性,有关研究表明,光源相干性好的系统其分辨率要比相干性差的系统要好,并且照明光源对分辨率的改变范围达到了26.4%。因此,选取适合的照明光源对提高显微系统的分辨率有很大帮助。常规的共焦扫描显微镜主要使用普通单色激光作为光源,随着技术的进步,目前已经出现了使用飞秒激光、超白激光、高斯光束作为光源的共焦显微镜,以提高系统性能,获得更高的分辨率。①飞秒激光为光源的双先子扫描共焦显微镜双光子扫描共焦显微镜通常使用近红外的飞秒激光作为激发光源,由于红外光具有较强的穿透性,它能探测到生物样品表面下更深层的荧光图像,并且生物组织对红外光吸收少,随着探测深度的增加衰减会变小,另一方面红外光的衍射低,光束的形状保持性好。2005年,Wild等人利用双光子扫描共焦显微技术实时观察和定量分析了PAHs在植物叶片表面和内部的光降解过程。后来又进一步研究了菲从空气到叶片的迁移过程、菲在叶片内部的运动及其分布情况等,该技术可观测PAHs在叶片内部的最大深度约为200μm。②白激光( supercontinuum laser)为光源的彩色共焦显微镜彩色共焦显微镜是利用光学系统的彩色像差,光源的不同光谱成分会聚焦到样品的不同深度,通过分析由样品反射的光谱能有效地获得样品的扫描深度。2004年,美国宾夕法尼亚州立大学的Zhiwen Liu课题小组使用光子晶体光纤产生的超连续谱白光作为彩色共焦显微镜的光源,这种超连续谱白光具有大的带宽,能够提高系统的扫描范围,能达到7μm扫描深度。另外超白激光有较高的空间相干性,无斑点噪声,能提高系统的信噪比和扫描速度。③使用高斯光束的荧光共焦显微镜荧光共焦显微镜是通过激光照射样品激发样品发出荧光,再通过探测器接受荧光对样品进行观察的共焦显微镜。华南农业大学的杨初平等人研究了不同光源孔径和束斑尺寸的高斯光束对荧光共焦显微镜分辨率的影响表明:与一定孔径尺寸的平行光束相比,采用高斯光束系统可以获得更好的分辨率。 2. 探测器孔径和杂散光共焦显微镜中探测器孔径能滤除部分杂散光,提高系统的分辨率和信噪比。根据相关文献对共焦扫描显微镜的三维光学传递函数与探测器孔径之间的依赖关系的研究,可以得到探测小孔直径为:d=β*1.22λ/NA,式中,β为物镜的放大率,λ为光的波长,NA为物镜的数值孔径。由该公式确定探测器小孔的直径,一方面满足了共焦扫描系统对探测器小孔直径的要求,从而保证高的横向和纵向分辨率,另一方面,又最大限度地使由试样中发射的荧光能量被探测器接收。为了更进一步提高系统分辨率,许多研究者对共焦显微镜中探测孔径进行了改进,例如使用单模光纤代替普通针孔孔径,还有双D型孔径等。① 使用单模光纤的光纤共焦显微镜在光纤共焦显微镜中用光纤分路器代替传统共焦显微镜中的光束分路器,并以单模光纤来代替光源和探测器的微米尺寸针孔孔径。使用单模光纤的优点在于:首先,在采用寻常针孔制作的共焦显微镜中,光源、针孔、探测器等有可能不在一条直线上从而会引起像差;但是在光纤作为针孔的共焦显微镜中,即使有的部件偏离直线时也不会引入像差。其次,使用单模光纤代替微型针孔,容易清除针孔的污染,而且不易受污染。第三,在使用光纤的系统中,可以自由移动显微镜部分而不必挪动探测器。2006年德克萨斯大学使用光纤共焦显微镜进行口腔病变检测,测得的系统横向和轴向分辨率分别为2. 1µm和10µm,成像速度为15帧/s,可观测范围为200µm×200µm。② 具有D型孔径的共焦显微镜近几年,具有对称D型光瞳的共焦显微成像技术引起广泛的关注,图1所示是该系统示意图。2006年美国东北大学的Peter J.Dwyer等人使用这种共焦显微镜进行了人体皮肤内部成像的实验,测得横向分辨率为1.7士0.1µm。2009年新加坡国立大学的Wei Gong等人采用傍轴近似方法理论分析了在共焦显微镜中使用双D型孔径对轴向分辨率的影响。分析表明在图1中的d值给定时,进入瞳孔的光信号强度l会随着探测器尺寸的增加而增加;但是在探测器尺寸给定时,光信号强度I会随着d的增加而单调递减。在使用有限大小的探测器时,改变d的大小,轴向分辨率可以得到改善。 http://www.biomart.cn//upload/userfiles/image/2011/11/1321512815.png 图1 双D型孔径共焦成像系统示意图在共焦成像光学系统中,到达像面的杂散光会在像面上产生附加的强度分布,从而进一步降低了像面的对比度,限制了系统分辨率的提高,因此在显微系统设计时,杂散光的影响也是不容忽视的。一般除了使用探测小孔来抑制杂散光,其他的一些设备例如可变瞳滤波器等对杂散光也有很好的过滤作用。最近以色列魏茨曼科学研究所的O.sipSchwartz and Dan Oron等人提出在系统中使用可变瞳滤波器,这个滤波器能够使多光子荧光共焦显微镜达到分辨率阿贝极限的非线性模拟,从而改善系统的分辨率。三、共焦扫描显微成像速度的提高共焦显微镜快速的成像速度为研究者观察生物细胞中快速动态反应提供了良好的条件。在共焦扫描显微成像系统中,传统的方法是通过改善扫描探测技术来提高成像速度。现有的扫描探测技术主要有Nipkow转盘法、狭缝共焦检测法、多光束的微光学器件检测法。这些方法可以改善扫描速度,但是与系统分辨率,视场之间都存在矛盾,因此又诞生了两种提高成像速度的新型显微镜:波分复用共焦显微镜和频分复用共焦显微镜。
分子级高分辨率的激光扫描共焦显微镜和结构照明显微镜是在细胞生物学和其他相关领域强有力的研究工具,但是它们高昂的价格也使很多潜在用户望而却步。波士顿大学的科学家最近开发出一种显微新技术 (HiLo Microscopy),能够将普通的广域荧光显微镜变成可与激光扫描共焦显微镜和结构照明显微镜相媲美的高分辨率生物显微镜。这一技术包括一个简单的可以在均衡光源和结构光源之间自由转换的显微镜附件和一套功能强大的图像处理软件。该软件仅通过处理在均衡光源和结构光源条件下拍摄的两张分辨率不同的照片就可以得到全分辨率的三维图像。这一技术可用于任何现有的广域荧光显微镜,而成本大大低于激光扫描共焦显微镜和结构照明显微镜。由于成像机理简单,该技术的成像速度是常用的生物显微技术中最快的,而且操作简便,不受样本移动的影响。波士顿大学目前正在积极寻求企业合作,争取早日将这一突破性的技术推向市场。
2010年4月13日,由北京理化分析测试技术学会和北京市电镜学会共同主办的“北京市2010年度激光共聚、原子力显微学最新进展学术研讨会”在北京北科大厦举办。来自科研院所、大专院校、检测机构等单位的150余人参加了此次会议。会议旨在推动北京市及周边省市激光共焦扫描显微学、原子力显微学的进步和发展,提高广大相关工作者的学术及技术水平,促进上述学科在生命科学等领域中的应用和发展。闲话少说,让我们一起走进会议现场吧~~~[img]http://simg.instrument.com.cn/bbs/images/brow/em09511.gif[/img]
[align=center][font='times new roman'][size=16px][b]超高分辨[/b][/size][/font][font='times new roman'][size=16px][b]显微镜及其在生物医学领域的应用[/b][/size][/font][/align][align=center][font='times new roman'][size=14px]刘皎[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][font='times new roman'][size=14px],[/size][/font][font='times new roman'][sup][size=14px] [/size][/sup][/font][font='times new roman'][size=14px]吴晶[/size][/font][font='times new roman'][sup][size=14px]1[/size][/sup][/font][/align][align=center]1. [font='times new roman']北京大学医药卫生分析中心,北京,[/font][font='times new roman']100191[/font][/align][font='times new roman'][b]摘要[/b][/font][font='times new roman'][b] [/b][/font][font='times new roman']超高分辨显微镜([/font][font='times new roman']Super-Resolution Microscopy[/font][font='times new roman'])作为一类强大的科学工具,可以突破传统光学显微镜的分辨极限,实现对微小结构的高分辨率成像,已经在生物医学领域引起了广泛的关注和应用。本文将探讨超高分辨显微镜的不同类型和原理,介绍[/font][font='times new roman']其[/font][font='times new roman']在生物医学领域的应用[/font][font='times new roman']及展望其未来发展[/font][font='times new roman']。[/font][font='times new roman'][b]Abstract[/b][/font][font='times new roman']Super Resolution Microscopy[/font][font='times new roman'], as a powerful scientific tool, can break through the resolution limit of traditional optical microscopes and achieve high-resolution imaging of small structures. It has attracted widespread attention and application in the biomedical field. This article will explore the different types and principles of Super Resolution Microscopy, introduce their applications in the biomedical field, and look forward to their future development[/font][font='times new roman'].[/font][font='times new roman'][b]关键词[/b][/font][font='times new roman']超高分辨[/font][font='times new roman']显微镜,[/font][font='times new roman']成像技术[/font][font='times new roman'],应用[/font][font='times new roman'][b]1 [/b][/font][font='times new roman'][b]引言[/b][/font][font='times new roman']显微镜的产生和发展对于生命科学研究的进步有至关重要的作用[/font][font='times new roman'],它将微观世界呈现在大家面前,包括微生物的存在、组织细胞结构及生理病理活动等。显微镜技术的不断革新将成像分辨率不断提高,但相当长一段时间内光学成像无法突破一个极限值,即[/font][font='times new roman']xy[/font][font='times new roman']轴横向分辨率约[/font][font='times new roman']200nm[/font][font='times new roman'],[/font][font='times new roman']z[/font][font='times new roman']轴纵向分辨率约[/font][font='times new roman']500nm[/font][font='times new roman'],因此小于这个尺寸的生命活动和结构[/font][font='times new roman'],如病毒、亚细胞结构等,[/font][font='times new roman']是无法清楚地观察到的[/font][font='times new roman']。[/font][font='times new roman']聚焦点的光强会根据点扩散函数([/font][font='times new roman']point spread functio[/font][font='times new roman']n[/font][font='times new roman'],[/font][font='times new roman']PSF[/font][font='times new roman'])而展开[/font][font='times new roman'],[/font][font='times new roman']对于圆形孔径,[/font][font='times new roman']PSF[/font][font='times new roman']呈现为艾里斑([/font][font='times new roman']Airy disk[/font][font='times new roman'])的模式[/font][font='times new roman']。[/font][font='times new roman']激光扫描共聚焦显微镜([/font][font='times new roman']Confocal Laser Scanning Microscopy, CLSM[/font][font='times new roman'])的分辨率取决于[/font][font='times new roman']PSF[/font][font='times new roman']的大小,如果焦点很小,则每个像素[/font][font='times new roman']点[/font][font='times new roman']获取到的信息也很小,从而得到清晰锐利的图像;反之,则结果图像变得模糊。因此,[/font][font='times new roman']CLSM[/font][font='times new roman']成像的[/font][font='times new roman']主要挑战在于实现越来越小的[/font][font='times new roman']PSF[/font][font='times new roman']以获得更好的分辨率。德国物理学家恩斯特[/font][font='times new roman'][/font][font='times new roman']阿贝([/font][font='times new roman']Ernst Abbe[/font][font='times new roman'],[/font][font='times new roman']1840-1905[/font][font='times new roman']年)在[/font][font='times new roman']19[/font][font='times new roman']世纪[/font][font='times new roman']70[/font][font='times new roman']年代首次[/font][font='times new roman']提出阿贝衍射极限,即[/font][font='times new roman']由于衍射效应,[/font][font='times new roman']PSF[/font][font='times new roman']大[/font][font='times new roman']小与[/font][font='times new roman']λ/NA[/font][font='times new roman']成正比([/font][font='times new roman']d=0.61λ/NA[/font][font='times new roman']),其中[/font][font='times new roman']λ[/font][font='times new roman']是光的波长,[/font][font='times new roman']NA[/font][font='times new roman']是物镜最重要的参数[/font][font='times new roman']——[/font][font='times new roman']数值孔径[/font][font='times new roman']。由于可见光波长范围在[/font][font='times new roman']400-760nm[/font][font='times new roman']之间,[/font][font='times new roman']NA[/font][font='times new roman']值最大在[/font][font='times new roman']1.7[/font][font='times new roman']左右,所以分辨率极限在[/font][font='times new roman']200nm[/font][font='times new roman']左右。随着物理学和测量技术的进步,突破衍射极限的显微镜不断涌现,目前公认的超高分辨显微镜主要有三类,包括[/font][font='times new roman']结构照明显微镜([/font][font='times new roman']Structured Illumination Microscopy[/font][font='times new roman'],[/font][font='times new roman']SIM[/font][font='times new roman'])[/font][font='times new roman'],受激发射减耗显微镜([/font][font='times new roman']Stimulated Emission Depletion Microscopy[/font][font='times new roman'],[/font][font='times new roman']STED[/font][font='times new roman']),和[/font][font='times new roman']单分子定位显微镜。单分子定位显微镜包括光敏定位显微镜([/font][font='times new roman']Photoactivation Localization Microscopy[/font][font='times new roman'],[/font][font='times new roman']PALM[/font][font='times new roman'])和随机光学重建显微镜([/font][font='times new roman']Stochastic Optical Reconstruction Microscopy[/font][font='times new roman'],[/font][font='times new roman']STORM[/font][font='times new roman'])[/font][font='times new roman']。[/font][font='times new roman']2014[/font][font='times new roman']年三位科学家[/font][font='times new roman']史蒂芬[/font][font='times new roman'][/font][font='times new roman']霍尔([/font][font='times new roman']Stefan W. Hell[/font][font='times new roman'])[/font][font='times new roman']、埃里克[/font][font='times new roman'][/font][font='times new roman']贝兹([/font][font='times new roman']Eric Betzig[/font][font='times new roman'])和威廉[/font][font='times new roman'][/font][font='times new roman']莫纳([/font][font='times new roman']William E. Moerner[/font][font='times new roman'])因他们在超[/font][font='times new roman']高[/font][font='times new roman']分辨显微镜技术领域的贡献而获得了诺贝尔化学奖。[/font][font='times new roman'][b]2 [/b][/font][font='times new roman'][b]不同类型的超高分辨显微镜[/b][/font][font='times new roman'][b]2.1[/b][/font][font='times new roman'][b] [/b][/font][font='times new roman'][b]结构照明显微镜([/b][/font][font='times new roman'][b]Structured Illumination Microscopy[/b][/font][font='times new roman'][b],[/b][/font][font='times new roman'][b]SIM[/b][/font][font='times new roman'][b])[/b][/font][font='times new roman']SIM[/font][font='times new roman']本质是利用两束激发光在样品上进行干涉,产生明暗交替的莫尔条纹,高空间频率的莫尔条纹会放大激发条纹与样品空间频率不一致的结构,从而将样品中的高频信息整合入收集到的图像中。[/font][font='times new roman']通过投射特殊的光照明模式如格点或条纹光栅,以一定的模式照射样品,引入空间频率信息,采集多个图像并经过复杂的数据处理之后,重建高分辨率图像。由于每个图像都采用不同的结构照明模式,包含了不同的信息,合并后的图像能够展示出比传统显微镜更多的细节[/font][font='times new roman']。[/font][font='times new roman']相比于其他超高分辨成像技术,[/font][font='times new roman']SIM[/font][font='times new roman']最大的优势就是宽场[/font][font='times new roman']成像,速度快,基本可以达到实时观察。[/font][font='times new roman']SIM[/font][font='times new roman']技术的前身可以追溯到[/font][font='times new roman']20[/font][font='times new roman']世纪[/font][font='times new roman']70[/font][font='times new roman']年代初。当时,光学学家特奥多尔[/font][font='times new roman'][/font][font='times new roman']赫普恩([/font][font='times new roman']Theodor [/font][font='times new roman']H?upl[/font][font='times new roman'])首次提出了使用周期性光栅照明来提高显微镜分辨率的想法。这奠定了[/font][font='times new roman']SIM[/font][font='times new roman']技术的基础,尽管当时还没有实际的[/font][font='times new roman']SIM[/font][font='times new roman']显微镜。[/font][font='times new roman']21[/font][font='times new roman']世纪初期,史蒂芬[/font][font='times new roman'][/font][font='times new roman']霍尔([/font][font='times new roman']Stefan W. Hell[/font][font='times new roman'])和埃里克[/font][font='times new roman'][/font][font='times new roman']贝兹([/font][font='times new roman']Eric Betzig[/font][font='times new roman'])等科学家分别独立开发了[/font][font='times new roman']SIM[/font][font='times new roman']的现代版本。[/font][font='times new roman']SIM[/font][font='times new roman']技术开始广泛传播,吸引了生物学家和显微镜专家的关注。它被认为是一种相对低成本的[/font][font='times new roman']超高分辨[/font][font='times new roman']率成像方法,因为它不需要昂贵的激光设备或复杂的样品准备。[/font][font='times new roman'][b]2.2 [/b][/font][font='times new roman'][b]受激发射减耗[/b][/font][font='times new roman'][b]显微镜([/b][/font][font='times new roman'][b]Stimulated Emission Depletion Microscopy[/b][/font][font='times new roman'][b],[/b][/font][font='times new roman'][b]STED[/b][/font][font='times new roman'][b])[/b][/font][font='times new roman']STED[/font][font='times new roman']技术的概念最早由斯德哥尔摩大学的斯蒂芬[/font][font='times new roman'][/font][font='times new roman']霍尔([/font][font='times new roman']Stefan W. Hell[/font][font='times new roman'])提出。他的想法是通过将激发光束与一个特殊的抑制光束结合,从而实现对荧光标记物的光抑制,[/font][font='times new roman']通过受激辐射淬灭光斑外围的荧光分子,[/font][font='times new roman']使其在空间上变得更加紧凑,[/font][font='times new roman']减少[/font][font='times new roman']PSF[/font][font='times new roman']从而提高分辨率。[/font][font='times new roman']我们也叫“甜甜圈”技术。[/font][font='times new roman']STED[/font][font='times new roman']显微镜背后基本思想就是利用非线性光学设计一个低于阿贝衍射极限的更小[/font][font='times new roman']PSF[/font][font='times new roman']。[/font][font='times new roman']分辨率与[/font][font='times new roman']STED[/font][font='times new roman']光强有关,提高[/font][font='times new roman']STED[/font][font='times new roman']光的强度可以使荧光光斑焦[/font][font='times new roman']点中心直径趋于[/font][font='times new roman']0[/font][font='times new roman'],但是实际应用中,光损伤较大,[/font][font='times new roman']STED[/font][font='times new roman']光强不可能无限增加,顾[/font][font='times new roman']其分辨率[/font][font='times new roman']最高[/font][font='times new roman']可达到[/font][font='times new roman']3[/font][font='times new roman']0[/font][font='times new roman']nm[/font][font='times new roman']左右[/font][font='times new roman']。[/font][font='times new roman']目前的[/font][font='times new roman']STED[/font][font='times new roman']只能应用于较薄的组织器官或细胞,光毒性较强,成像厚度有限不太适合活体或活细胞长时间成像。[/font][font='times new roman']STED[/font][font='times new roman']光路较为复杂,对系统稳定性要求较高。[/font][font='times new roman'][b]2.3 [/b][/font][font='times new roman'][b]单分子定位显微镜[/b][/font][font='times new roman']单分子定位显微镜[/font][font='times new roman']中荧光标记的单个分子被分别激发和检测。单分子的中心可以以极高的精度确定从而实现高分辨率,包括光敏定位显微镜([/font][font='times new roman']Photoactivation Localization Microscopy[/font][font='times new roman'],[/font][font='times new roman']PALM[/font][font='times new roman'])和随机光学重建显微镜([/font][font='times new roman']Stochastic Optical Reconstruction Microscopy[/font][font='times new roman'],[/font][font='times new roman']STORM[/font][font='times new roman'])。[/font][font='times new roman']PALM[/font][font='times new roman']的历史可以追溯到[/font][font='times new roman']2006[/font][font='times new roman']年,由埃里克[/font][font='times new roman'][/font][font='times new roman']贝兹([/font][font='times new roman']Eric Betzig[/font][font='times new roman'])和哈拉尔德[/font][font='times new roman'][/font][font='times new roman']赫斯([/font][font='times new roman']Harald Hess[/font][font='times new roman'])提出了单分子定位这一概念。在[/font][font='times new roman']PALM[/font][font='times new roman']中,样品中的分子被标记上特定的荧光染料。这些染料可以通过光激活从一个基态转变到一个激发态,此过程可通过使用激活光(通常是紫外光)来实现。同期[/font][font='times new roman']STORM[/font][font='times new roman']的成像技术也发展起来,代表科学家是华人庄小威。[/font][font='times new roman']STORM[/font][font='times new roman']的工作原理与[/font][font='times new roman']PALM[/font][font='times new roman']类似,是通过特殊的分子标记和随机活性化,实现单分子定位进而实现超高分辨率成像。具有光激活能力的标记物通常在某种光照条件下会发光,但也会在某一时刻被随机地熄灭。这种随机光熄灭是[/font][font='times new roman']PALM[/font][font='times new roman']技术的关键,因为它允许在不同时间点捕获标记物的位置。通过记录标记物的位置,可以得到它们的坐标。这一过程需要在短时间内多次拍摄样品,以获得足够多的数据点。最后,通过将多个标记物的坐标叠加在一起,可以生成高分辨率的图像。这种以成像时间换取空间分辨率的形式,使得[/font][font='times new roman']PALM[/font][font='times new roman']或[/font][font='times new roman']STORM[/font][font='times new roman']的分辨率通常能够达到数十纳米。[/font][font='times new roman'][b]3 [/b][/font][font='times new roman'][b]应用领域和未来发展[/b][/font][font='times new roman']超高分辨显微镜可以探索微观世界的无限可能性,已经彻底改变了科学研究的方式。在细胞生物学领域,它被用于研究[/font][font='times new roman']亚细胞结构,如微丝、微管、肌动蛋白等,[/font][font='times new roman']细胞器[/font][font='times new roman']如线粒体、溶酶体等,[/font][font='times new roman']分子分布和细胞膜动态、观察蛋白质的相互作用;在神经科学领域,它可用于观察神经元的亚细胞结构和突触的细节,有助于解剖和理解神经系统的结构和功能,以及神经系统相关疾病的机制;在癌症研究领域,被用于研究癌细胞的特征、蛋白质分布以及肿瘤微环境,这对于癌症的早期诊断和治疗规划非常重要;在材料科学领域,它被用于研究纳米材料的结构和性质、帮助科学家精确控制和制备纳米结构;在药物研发领域,它可用于研究药物靶标蛋白的定位和与其他分子的相互作用,这对于药物设计和筛选非常重要[/font][font='times new roman'];在微生物领域,对于研究细菌[/font][font='times new roman']结构变化至关重要,规避了电子显微镜无法进行活体成像等弊端,可以更加推进微生物学发展。[/font][font='times new roman']当然,[/font][font='times new roman']超[/font][font='times new roman']高[/font][font='times new roman']分辨成像技术[/font][font='times new roman']也有一定的挑战。超高分辨成像技术[/font][font='times new roman']通常需要高度复杂的设备和精密的校准,这使得其设备成本相对较高,[/font][font='times new roman']再加上样本制备的困难,[/font][font='times new roman']限制了其广泛应用。[/font][font='times new roman']样品准备在超高分辨成像中具有重要作用,新的标记技术和荧光探针的发展将提高成像的灵敏度和特异性[/font][font='times new roman'],[/font][font='times new roman']开发更友好、无损伤的样品准备方法,以减少对样品的干扰[/font][font='times new roman'],[/font][font='times new roman']甚至[/font][font='times new roman']包括无标记成像技术以减少样品标记的需求。开源软件和自动化工作流程将使超高分辨成像技术更易于使用和共享,促进科学研究的进展。[/font][font='times new roman']超高分辨技术通常对于三维成像和大样本的深度成像有限制,需要克服分辨率和深度之间的权衡。[/font][font='times new roman']同时超高分辨[/font][font='times new roman']成像的时间分辨率还可以继续提升[/font][font='times new roman']。[/font][font='times new roman']虽然[/font][font='times new roman']目前[/font][font='times new roman']SIM[/font][font='times new roman']和[/font][font='times new roman']minflux[/font][font='times new roman']更适合[/font][font='times new roman']观察[/font][font='times new roman']活细胞[/font][font='times new roman']动态过程,但时间分辨率的提高仍然是一个挑战,特别是对于极短时间尺度的现象[/font][font='times new roman'],[/font][font='times new roman']这将使科学家能够更深入地探索微观世界,并获得更多信息。[/font][font='times new roman']随着技术的不断进步,[/font][font='times new roman']超高分辨[/font][font='times new roman']成像有望在[/font][font='times new roman']包括临床医学[/font][font='times new roman']等[/font][font='times new roman']更多领域得到广泛应用[/font][font='times new roman'],未[/font][font='times new roman']来如果能实现超高分辨的动物甚至人的[/font][font='times new roman']活体成像,减少样品固定和处理的需求,允许观察生物过程的实时发生[/font][font='times new roman']将会更有现实意义[/font][font='times new roman']。[/font][font='times new roman']并且在科学研究的需求下,[/font][font='times new roman']多模态[/font][font='times new roman']或多尺度[/font][font='times new roman']成像将[/font][font='times new roman']与[/font][font='times new roman']不同[/font][font='times new roman']的[/font][font='times new roman']超高分辨[/font][font='times new roman']技术相结合,[/font][font='times new roman']例如,结合光学成像和质谱成像[/font][font='times new roman'],[/font][font='times new roman']从分子水平到组织水平[/font][font='times new roman']提供[/font][font='times new roman']生命活动[/font][font='times new roman']更全面的信息。[/font][font='times new roman']也可以[/font][font='times new roman']发展高通量的样品处理和成像技术,以便更快速地获得大规模的数据。[/font][font='times new roman']超高分辨[/font][font='times new roman']成像生成的数据量巨大,处理和分析这些大数据需要强大的计算资源和高效的算法。数据存储和传输也是挑战。[/font][font='times new roman']超高分辨[/font][font='times new roman']成像数据可能受到噪声和伪迹的影响,这需要高级的图像处理技术来减少其影响,以获得准确的图像。数据分析通常需要复杂的算法和数学模型,需要专业知识和技能。对于某些应用,如神经科学中的活体成像,需要实时数据分析,这增加了挑战。深度学习和人工智能技术[/font][font='times new roman']有望[/font][font='times new roman']在数据分析中发挥越来越重要的作用,[/font][font='times new roman']实现[/font][font='times new roman']自动处理和解释图像数据。发展实时数据分析技术,使科学家能够在数据采集过程中获得及时反馈。开发更易用的高级图像处理工具,使非专业用户也能够进行数据分析。结合不同成像技术和数据源的信息,以提供更全面的信息。开发自动化和高通量的数据分析工作流程,以应对大规模数据的挑战。促进数据共享和开放科学,以促进合作和加速科学研究的进展。未来,随着计算能力的提高和新技术的引入,[/font][font='times new roman']超高分辨[/font][font='times new roman']成像数据分析将变得更加强大和高效。这将有助于更深入地理解微观世界,并在生物学、医学、材料科学等领域推动创新和发展。[/font][font='times new roman']总的来说,尽管[/font][font='times new roman']超高分辨[/font][font='times new roman']成像面临一些挑战,但其前景充满希望。未来的发展将使这一领域更加强大,有望在科学研究和实际应用中提供更多的机会和洞察力。[/font][font='times new roman'][b]4 [/b][/font][font='times new roman'][b]结论和展望[/b][/font][font='times new roman']超高分辨显微镜的成像原理基于破解传统显微镜的分辨极限,通过结构照明、图像重建[/font][font='times new roman']和单分子成像等策略,实现对微小结构的高分辨率成像。这一技术的应用领域包括生物学、材料科学、纳米技术和医学等,有望推动科学研究的进一步发展。超高分辨显微镜已经在生物医学领域取得了显著的突破,使研究人员更深入地理解细胞和分子结构。然而,仍然存在挑战,包括样品准备和数据分析的复杂性。未来,我们可以期待更多技术的发展,以进一步提高分辨率和扩大应用领域。[/font][font='times new roman']随着技术的不断发展,我们可以期待更多超分辨显微镜技术的突破,如更高分辨率、更高灵敏度和更快成像速度。超分辨显微镜的应用也将继续扩展到新的领域,如药物研发、个性化医学和环境科学。它将为我们提供更多工具来解决生物学的重要问题,如疾病机制、药物研发和生态系统健康。总之,超分辨显微镜技术的未来展望是光明的,它将继续推动科学研究向前迈进,揭示微观世界的微小奥秘,为改善生活质量和解决全球挑战做出贡献。这个领域的不断创新将激发更多科学家的热情,共同追求更深入的科学知识和更广泛的应用。[/font][font='times new roman'][b]参考文献[/b][/font][font='times new roman']Hell[/font][font='times new roman'] [/font][font='times new roman']S [/font][font='times new roman']W[/font][font='times new roman'].[/font][font='times new roman']Far-field[/font][font='times new roman'] [/font][font='times new roman']optical[/font][font='times new roman'] [/font][font='times new roman']nanoscopy[/font][font='times new roman'][J][/font][font='times new roman'].[/font][font='times new roman']Science[/font][font='times new roman'],[/font][font='times new roman']2007[/font][font='times new roman'],[/font][font='times new roman']316(5828)[/font][font='times new roman']:[/font][font='times new roman']1153-1158[/font][font='times new roman']Hell[/font][font='times new roman'] [/font][font='times new roman']S W[/font][font='times new roman'],[/font][font='times new roman']Wichmann J[/font][font='times new roman'].[/font][font='times new roman']Breaking[/font][font='times new roman'] [/font][font='times new roman']the diffraction[/font][font='times new roman'] [/font][font='times new roman']resolution[/font][font='times new roman'] [/font][font='times new roman']limit[/font][font='times new roman'] [/font][font='times new roman']by stimulated[/font][font='times new roman']-[/font][font='times new roman']emission[/font][font='times new roman']-[/font][font='times new roman']depletion fluorescence[/font][font='times new roman'] [/font][font='times new roman']microscopy[J][/font][font='times new roman'].[/font][font='times new roman']Optics[/font][font='times new roman'] [/font][font='times new roman']Letters[/font][font='times new roman'],[/font][font='times new roman']1994[/font][font='times new roman'],[/font][font='times new roman']19(11)[/font][font='times new roman']:[/font][font='times new roman']780-782[/font][font='times new roman']Dani A[/font][font='times new roman'],[/font][font='times new roman']Huang B[/font][font='times new roman'],[/font][font='times new roman']Bergan J[/font][font='times new roman'],[/font][font='times new roman']et[/font][font='times new roman'] [/font][font='times new roman']a1[/font][font='times new roman'].[/font][font='times new roman'] Super-resolution[/font][font='times new roman'] [/font][font='times new roman']imaging of chemical synapses[/font][font='times new roman'] [/font][font='times new roman']in the brain[J][/font][font='times new roman'].[/font][font='times new roman']Neuron[/font][font='times new roman'],[/font][font='times new roman']2010[/font][font='times new roman'],[/font][font='times new roman']68(5)[/font][font='times new roman']:[/font][font='times new roman']843[/font][font='times new roman']—[/font][font='times new roman']856[/font][font='times new roman']PATTERSON[/font][font='times new roman'] [/font][font='times new roman']G[/font][font='times new roman'],[/font][font='times new roman']DAVIDSON[/font][font='times new roman'] [/font][font='times new roman']M[/font][font='times new roman'],[/font][font='times new roman']MANLEY[/font][font='times new roman'] [/font][font='times new roman']S[/font][font='times new roman'],[/font][font='times new roman']et[/font][font='times new roman'] [/font][font='times new roman']al[/font][font='times new roman']. [/font][font='times new roman']Superresolution[/font][font='times new roman'] imaging using single-molecule localization[/font][font='times new roman'][J][/font][font='times new roman'].[/font][font='times new roman']A[/font][font='times new roman']nnual Review of Chemistry[/font][font='times new roman'],[/font][font='times new roman']2010[/font][font='times new roman'],[/font][font='times new roman']6[/font][font='times new roman']1:345-367[/font]
本人最近急需有关电子显微学方面的资料,哪位达人有的话,能否告诉我。可以发到我的邮箱 denniszzh1688@sina.com以下书目急需:材料评价的分析电子显微学方法材料评价的高分辨电子显微学方法薄晶体电子显微学高空间分辨分析电子显微学谢谢了!
请教激光共聚焦显微镜的分辨率是多少?
近日,德国IBIDI公司成功开发出一款超高分辨率生物显微镜。该公司宣称基于新型随机光学重建显微技术“(d)STORM”,利用该公司独创的特殊塑料底板“μ-Slides”可实现超高分辨率观察活体细胞。 STED,SIM,(F)PALM 和(d)STORM等新型光学显微技术可有效避免衍射极限,获得纳米级水平的超高分辨率成像。这些超高分辨率显示技术可应用到生物实验研究,观察了解组织细胞分子结构。IBIDI公司采用了创新性的含有亲水性膜涂层的塑料材质底板“μ-Slides”替代传统玻璃底板,首次实现了“活体细胞”超高分辨率观察。这种被成为“ibi-Treat”的亲水性膜涂层性能可以与标准的细胞培养瓶和培养皿相媲美。 IBIDI公司相关研发工作受到了德国联邦教研部《生命科学领域光学技术—基本细胞功能》项目的资助。
http://www.cas.cn/ky/kyjz/201207/W020120712608069274506.jpg验收专家现场核查设备情况 7月11日,中国科学院计划财务局组织专家在生物物理研究所对徐涛研究员负责的“光敏定位超高光学分辨率显微镜系统”仪器研制项目进行了现场验收。 验收专家组听取了研制工作报告及经费决算报告、用户报告和技术测试报告,现场核查了设备的运行情况,审核了相关文件档案及财务账目。经过提问与讨论,验收专家组一致认为该项目实现了预期的研制目标,完成了实施方案规定的各项任务,同意通过验收。 2006年9月,美国科学家Eric首次在Science杂志上提出光敏定位显微镜(PALM)的概念,使得光学显微镜能够获得与电子显微镜相匹配的分辨率。PALM的基本原理是将荧光分子附著在目标蛋白上,利用全内反射显微镜(TIRFM)技术和单分子定位技术得到细胞内荧光蛋白纳米级分辨率的精确定位。“光敏定位超高光学分辨率显微镜系统”研制项目总体设计灵活高效,结合了TIRFM、EMCCD成像系统、闭环锁焦系统等技术,提出了新的单分子定位算法,实现了三维防漂移反馈校正、细胞内单分子的三维定位和超精细结构观察,完成了一套具有国际领先水平的超高分辨光学显微成像系统,具有较高的创新性。 目前,该系统已在细胞内单分子(如微管蛋白、离子通道等)成像方面发挥了关键作用。研究人员在Nature Methods、PNAS等杂志上发表了世界领先的研究成果,可应用于细胞生物学的超高分辨荧光成像,具有广泛的应用前景。 该项目研制的仪器符合目前蛋白质科学和系统生物学对创新仪器设备和技术的有关需求,有望产生一定的经济效益。
单位新安装了激光共焦显微镜Olympus 3100放大倍数:120x-14400x分辨率:XY 0.12um;Z 0.05um观察模式:明场,暗场,激光共焦,微分干涉。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=67336]Olympus 3100 手册[/url]
《分析电子显微学导论》作者:戎咏华 王晓东 黄宝旭 李 伟出版社:高等教育出版社 分析电子显微学是揭示材料介观和微观世界的有力工具,它能对材料显微组织的形貌、结构、成分进行三位一体的原位分析,是材料研究的重要现代技术之一。本书是材料科学与工程专业硕士生的课程教材。全书共分六章,内容包括分析电子显微镜的构造及其功能,样品的制备方法,电子衍射花样的特征和标定方法,晶体衍射中的数学处理,电子衍射衬度运动学和动力学理论及其应用,高分辨和高空间分析电子显微术的原理和应用以及分析电子显微学的进展。 本教材是掌握分析电子显微术原理和应用的入门书,故注重基本的物理概念和相关的数学推导,并附许多实例和思考题、练习题以便读者理解和掌握重点。本书配有电子课件和练习答案的光盘,便于教师授课。本教材也可作为正在从事该领域学习和研究的科技人员的参考书。如有需要该书的课件,可以留下邮箱,发给大家共享!![em31]
激光扫描共聚焦显微镜是近十年发展起来的医学图像分析仪器,与传统的光学显微镜相比,大大地提高了分辨率,能得到真正具有三维清晰度的原色图像。并可探测某些低对比度或弱荧光样品,通过目镜直接观察各种生物样品的弱自发荧光。能动态测量Ca2+ 、pH值,Na+、Mg2+等影响细胞代谢的各种生理指标,对细胞动力学研究有着重要的意义。同时激光扫描共聚显微镜可以处理活的标本,不会对标本造成物理化学特性的破坏,更接近细胞生活状态参数测定。可见激光扫描共聚焦显微镜是普遍显微镜上的质的飞跃,是电子显微镜的一个补充,现已广泛用于荧光定量测量,共焦图像分析,三维图像重建、活细胞动力学参数分析和胞间通讯研究等方面,在整个细胞生物学研究领域有着广阔的应用前景。1. 定量荧光测量ACAS可进行重复性极佳的低光探测及活细胞荧光定量分析。利用这一功能既可对单个细胞或细胞群的溶酶体,线粒体、DNA、RNA和受体分子含量、成份及分布进行定性及定量测定,还可测定诸如膜电位和配体结合等生化反应程度。此外,还适用于高灵敏度快速的免疫荧光测定,这种定量可以准确监测抗原表达,细胞结合和杀伤及定量的形态学特性,以揭示诸如肿瘤相关抗原表达的准确定位及定量信息。2. 定量共聚焦图像分析借助于ACAS激光共焦系统,可以获得生物样品高反差、高分辨率、高灵敏度的二维图像。可得到完整活的或固定的细胞及组织的系列及光切片,从而得到各层面的信息,三维重建后可以揭示亚细胞结构的空间关系。能测定细胞光学切片的物理、生物化学特性的变化,如DNA含量、RNA含量、分子扩散、胞内离子等,亦可以对这些动态变化进行准确的定性、定量、定时及定位分析。3. 三维重组分析生物结构ACAS使用SFP进行三维图像重组,SFP将各光学切片的数据组合成一个真实的三维图像,并可从任意角度观察,也可以借助改变照明角度来突出其特征,产生更生动逼真的三维效果。4. 动态荧光测定Ca2+、pH 及其它细胞内离子测定,利用ACAS能迅速对样品的点,线或二维图像扫描,测量单次、多次单色、双发射和三发射光比率,使用诸如Indo-1、BCECF 、Fluo-3等多种荧光探针对各种离子作定量分析。可以直接得到大分子的扩散速率,能定量测定细胞溶液中Ca2+对肿瘤启动因子、生长因子及各种激素等刺激的反应,以及使用双荧光探针Fluo-3和CNARF进行Ca2+和pH的同时测定。5. 荧光光漂白恢复(FRAP)——活细胞的动力学参数荧光光漂白恢复技术借助高强度脉冲式激光照射细胞某一区域,从而造成该区域荧光分子的光淬灭,该区域周围的非淬灭荧光分子将以一定速率向受照区域扩散,可通过低强度激光扫描探测此扩散速率。通过ACAS可直接测量分子扩散率、恢复速度,并由此而揭示细胞结构及相关的机制。6. 胞间通讯研究动物细胞中由缝隙连接介导的胞间通讯被认为在细胞增殖和分化中起非常重要的作用。ACAS可用于测定相邻植物和动物细胞之间细胞间通讯,测量由细胞缝隙连接介导的分子转移,研究肿瘤启动因子和生长因子对缝隙连接介导的胞间通讯的抑制作用,以及胞内Ca2+、PH和cAMP水平对缝隙连接的调节作用。7. 细胞膜流动性测定ACAS设计了专用的软件用于对细胞膜流动性进行定量和定性分析。荧光膜探针受到极化光线激发后,其发射光极性依赖于荧光分子的旋转,而这种有序的运动自由度依赖于荧光分子周围的膜流动性,因此极性测量间接反映细胞膜流动性。这种膜流动性测定在膜的磷脂酸组成分析、药物效应和作用位点,温度反应测定和物种比较等方面有重要作用。8. 笼锁-解笼锁测定许多重要的生活物质都有其笼锁化合物,在处于笼锁状态时,其功能被封闭,而一旦被特异波长的瞬间光照射后,光活化解笼锁,使其恢复原有活性和功能,在细胞的增值、分化等生物代谢过程中发挥功能。利用ACAS可以人为控制这种瞬间光的照射波长和时间,从而达到人为控制多种生物活性产物和其它化合物在生物代谢中发挥功能的时间和空间作用。9. 粘附细胞分选ACAS是目前唯一能对粘附细胞进行分离筛选的分析细胞学仪器,它对培养皿底的粘附细胞有两种分选方法: ① Coolie-CutterTM法,它是Meidian公司专利技术,首先将细胞贴壁培养在特制培养皿上,然后用高能量激光的欲选细胞四周切割成八角形几何形状,而非选择细胞则因在八角形之外而被去除,该分选方式特别适用于选择数量较少诸如突变细胞、转移细胞和杂交瘤细胞,即使百万分之一机率的也非常理想。 ② 激光消除法,该方法亦基于细胞形态及荧光特性,用高能量激光自动杀灭不需要的细胞,留下完整活细胞亚群继续培养,此方法特别适于对数量较多细胞的选择。10. 细胞激光显微外科及光陷阱技术借助ACAS可将激光当作“光子刀”使用,借此来完成诸如细胞膜瞬间穿孔、切除线粒体、溶酶体等细胞器、染色体切割、神经元突起切除等一系列细胞外科手术。通过ACAS光陷阱操作来移动细胞的微小颗粒和结构,该新技术广泛用于染色体、细胞器及细胞骨架的移动。
上个月末,通用电气医疗集团(GE Healthcare)签署了一项协议,收购细胞成像产品制造商Applied Precision,具体收购金额不详。随着这次收购行动,GE Healthcare有望进入快速增长的细胞成像领域。 总部位于华盛顿西雅图郊外的Applied Precision开发并制造高分辨率以及超高分辨率的显微镜仪器,让研究人员能够以其他类型显微镜无法实现的规模来研究细胞过程。 一般显微镜所拥有的分辨率能让研究人员观察到200 nm及以上的物体。因此,对于大小在10 nm左右的胰岛素,一般的显微镜是无法看到的。然而,有了超高分辨率显微镜,研究人员就能看到。电镜的分辨率与超高分辨率显微镜相似,但它们不能活体观察细胞,而后者能做到。 GE Healthcare负责细胞技术的总经理Amr Abid向国外媒体透露,通过在此水平研究细胞功能,研究人员能够对功能异常细胞的机制有了更深入的了解。他举了一些例子,比如利用超高分辨率显微镜来研究HIV病毒如何穿透细胞,这为新药开发提供了信息。 几个世纪以来,科学家们都是利用光学显微镜对肉眼无法看到的结构进行观测,目前光学显微镜已经成为了实验室必备的实验器材之一,但是随着研究的深入,光学显微镜的分辨率已经无法达到科学家们的要求了。2008年,《Nature》杂志将超高分辨率显微技术评为年度技术。 Abid估计,如今整个显微镜市场大概在20亿-30亿美元。其中,超高分辨率显微镜占了约20%。Applied Precision和徕卡(Leica)是硬件方面的行业领先者,他们各自的市场份额大约为30%-35%。 GE目前不提供超高分辨率显微镜,也不曾开发它们。Applied Precision的产品是对GE细胞分析产品线的很好补充。GE也在探索一些方法,将其现有的细胞研究技术与Applied Precision的仪器捆绑起来。 目前,GE在细胞成像方面的旗舰产品是2009年上市的IN Cell平台。IN Cell Analyzer平台提供了一整套从自动化图像获取到数据的定量和深度分析以及可视化的强大工具,来协助整个高内涵分析过程。前不久,GE推出了最新版本的分析平台——IN Cell 6000。 据Abid透露,由于Applied Precision在高分辨率以及超高分辨率显微镜方面声名卓著,故GE打算保留其名称。该公司还计划保留全部130名员工,并在技术上继续投资。 GE还打算加大力度提高Applied Precision在亚太地区(如中国、印度和日本)的知名度,对于超高分辨率显微镜而言,这些区域是一个增长点,然而,Applied Precision目前的份额还很有限。
激光扫描共聚焦显微镜还能这么用! 众所周知,激光共聚焦显微镜主要的应用方向在观察活细胞结构及特定分子、离子的生物学变化,而在石笋这样的样品观察上使用激光扫描共聚焦显微镜,可以说脑洞大开了!让我们来看看原文,从Nikon A1激光扫描共聚焦显微镜使用者的角度看看,怎么把这个工具用活了! 激光扫描共聚焦显微镜在古气候纹层学的应用 第一作者:赵景耀 通讯作者:程 海 1984年第一台商业化的激光扫描共聚焦显微镜(Laser Scanning Confocal Microscope,简称 LSCM)出现,随之共聚焦显微镜技术成为了一个热点,并广泛应用在国内外生物和工业检测领域。现今,我们将LSCM首次应用于国内古气候纹层学研究。纹层学一直是古气候研究重要内容,特别是荧光微层在很多古气候载体中是重要的年代标尺和气候指标。2000年,Ribes等首次将LSCM应用于石笋荧光微层研究,发现LSCM分辨率可达1μm,因此,可适用于各种不同厚度的石笋年纹层;2008年,Orland等将LSCM与离子探针采样结合,首次发现了石笋δ18O的季节性信号,并表示以色列Soreq Cave单层δ18O季节波动可达2.15‰;2010年,Dasgupta等通过LSCM识别石笋纹层中的碎屑和粘土层,据此重建了美国明尼苏达州过去3000年极端暴雨事件,发现20世纪全球升温以来,其暴雨频率明显增加;2015年,Wendt利用LSCM,在巴西TBV Cave石笋纹层中发现了罕见的“双纹层”,且均出现在高生长速率的Heinrich事件期间,认为这与Heinrich期间,Intertropical Convergence Zone(ITCZ)南支南移所导致一年内存在2个雨季有关;2015年,Orland等再次将LSCM与离子探针技术应用于中国苦栗树洞石笋研究,发现全新世和B?lling-Aller?d暖期的夏季降水比例明显多于Younger Dryas时期。而目前,国内主要依赖于普通透射光和荧光显微镜,这一定程度上限制了国内古气候学研究。笔者在西安交通大学机械制造系统工程生物制造中心,利用购置的LSCM组件(图1a),观察石笋“年纹层”和砗磲“天纹层”,取得初步认识,以下分别就LSCM及其在古气候荧光微层方面的应用及注意事项作一简介。 图1 激光扫描共聚焦显微镜(LSCM)组件(a)及其原理(b) 1.倒置荧光显微镜(Inverted fluorescence microscope);2.荧光探测器(Flurescence detector);3.激光发生器(Laser generator);4.LSCM总控制器(Main controller);5.扫描头(Head of laser scanner);6.明场及电动载物台开关(Switch of bright-field microscopy and electric stage);7..荧光光源开关(Switch of fluorescent source);8.电动载物台(Electric stage);9.LSCM连接电脑(Computer and Monitor) LSCM以激光为点光源,由照明针孔与探测针孔对被探测点的共轭关系(图1b),实现对被探测点所在焦面的逐点激发,逐点扫描,该技术称为共聚焦。与普通荧光显微镜一次性照明整个视野不同,LSCM通过逐点扫描探测,呈现标本荧光层的2维或3维图像(图2),因此其对不同焦点和焦面的辨析能力,是普通荧光显微镜所不能达到的。其中,图2a中3D切片z轴步进间距(即焦面间距)为3μm,当前仪器上限25nm(仪器型号:Nikon A1)。在LSCM标本纹层成像过程中,放置于探测器前的探测针孔(Pinhole)(图1b)起着关键作用,有效地阻挡了不同焦点带来的杂散光,只有被探测点所发射的荧光透过Pinhole,到达探测器形成图像,这对图像对比度和分辨率有重要影响(图2)。而且LSCM采用光电倍增技术,可将微弱荧光信号进一步放大。综上,利用LSCM可以真正地实现10μm级荧光纹层的清晰辨别,其分辨率和辨识度是普通荧光显微镜所不能实现的,在此基础我们可以观察并辨别10μm左右石笋“年纹层”(图2d)和3~5μm级别砗磲“天纹层”(图2e)。 图2 石笋荧光层3D切片拟合(a)、石笋荧光“年纹层”(b、c和d)和砗磲荧光“天纹层”(e) 所有图像在1024扫描分辨率下,利用波长为488-nm的蓝色激光作为激发光源激发,然后用荧光滤光片滤选发射波长为505~539nm绿色发射光,最终被检测器探测并扫描成像;图片(a)由LSCM连续拍摄31层平行荧光焦面拟合而成,3μm/层;石笋样品(a)和(c)取自湖北省犀牛洞,(b)取自南京葫芦洞,(d)取自吉林省琉璃洞;(e)砗磲取自中国南沙群岛永暑礁 不同于普通光学显微镜,通过制作极薄的显微镜[url=http://www.gengxu.cn]滤光片[/url](≤1mm)实现对于杂散光或荧光焦面的控制。LSCM装配倒置荧光显微镜直接对古气候标本切面观察,源于LSCM对不同焦面荧光信号的精准解析和辨别能力,对于石笋和砗磲等古气候标本,无需制作显微镜薄片,只需将样品切面抛光磨平,即可实现对抛光表面荧光微层和透光微层定焦高分辨率扫描。LSCM极大地简化标本处理,不仅能够更好地节约和保护标本,且能和其他分析(如稳定同位素分析)在同一样品上进行,有利于精细对照,对于古气候研究有重要意义。例如,最近Li等在其他方法精确定年困难的情况下,利用LSCM方法精确确定了近百年石花洞的石笋样品年代序列;对著名的南京葫芦洞样品的初步工作显示,将能够重建上个冰期精细到年的时间序列及气候变化的变率(图2b),而又不破坏极其珍贵的样品。 但是由于LSCM以激光作为光源,在镜下观察过程中发现,根据物镜倍数(10×、20×、40×、60×和100×)不同,导致激光聚光强度不同,会出现不同程度的荧光猝灭,对于常用倍数10×和20×,荧光猝灭微弱,肉眼无法识别,可忽略。但是在60×油镜及以上倍数,荧光猝灭快速,因此在使用过程中,要注意调焦与拍摄时间的平衡。另外,计算机对焦过程是纳米级对焦,在标本前期处理过程中,保证样品观察面平整,是快捷对焦、自动扫描和拼接大图的工作基础。对于目前使用的型号Nikon A1,由于LSCM电动载物台承重和规格限制,以及明场聚光器位置限制(图1a),要求古气候标本观察面≤6cm×6cm,厚度≤5cm,但可根据需要选择不同型号的载物台。最后,由于各种LSCM在许多研究机构和医学院都具备,且使用费用不高,因此进行该研究不必购置新设备。
显微学表征技术主要扫描电镜(SEM)、透射电镜(TEM)、扫描探针显微镜(SPM/AFM)及其相关领域的技术。显微学技术以其独特的优势在材料、生命科学、机械、电子、化工等学科中得到了广泛的推广与应用。显微表征新技术也一直被研究领域乃至生产行业高度关注,2017年诺贝尔化学奖授予Jacques Dubochet,Joachim Frank和Richard Henderson 3位科学家,以表彰他们在发展利用冷冻电子显微学技术解析溶液中生物大分子高分辨率结构方面做出的开创性贡献,至此,业界对显微学技术的关注再次掀起热潮。 与此同时,面对市场的需求,各大显微技术仪器设备生产商也纷纷加大对新技术、新产品研发的投入,以期在需求不断增长的市场中博得一席之地。
各位论坛的老师你们好,学生刚接触此方向,请教个有关超高分辨率傅里叶光谱仪的问题:超高分辨率傅里叶红外光谱仪的意义在哪里?具体实现起来有哪些技术难度不能被攻克?
◎降低噪音:(1)傅立叶变换过滤法:布拉格滤波、环形滤波和孪生滤波,用Gatan的DigitalMicrograph都可以搞定布拉格滤波:选择周期性的布拉格点,主要是突出周期性信息;环形滤波:选择感兴趣的频率信息,可以用来处理界面和多次孪晶等的高分辨像;孪生滤波:选择两个布拉格点。(2)实空间平均法主要用于处理生物大分子的图像,也有人用来处理沸石的低剂量高分辨像,主要有两个过程:相关计算和图像强度的叠加。◎图像模拟:用的最多的就是C-M多层法了,现在国内常用的程序有EMS,JEMS,Cerius2,在线模拟:http://cimewww.epfl.ch和http://emaps.mrl.uiuc.edu/default.asp◎图像处理(透过图像处理可以直接得到样品的出射波或投影势分布):%解卷法:最大熵解卷和直接法解卷,代表人物:物理所的李方华先生和范海福先生,国内专业做高分辨像处理的独此一家,使用的软件:VEC(完整晶体)和DEC(缺陷),这两个软件都是李老师和范老师他们那个组自己发展起来的,厉害!!%波函数重构:(1)TIE/MEM(强度等效传递/最大熵),代表人物:陈福荣等(2)抛物面法(Van Dyck方法),代表人物:M.Op de Beeck和D.Van Dyck(比利时)(3)最大似然法,代表人物:W.M.J.Coene和A.Thust(荷兰)(4)Wiener过滤,代表人物:A.I.Kirkland(Oxford) 前三种方法要求有20张高分辨像,而且这些像必须是系列焦点的,如果有一张像因为震动或其他原因而模糊,那么这个系列就不能用了。这三种方法中最大似然的方法比较成熟,可以处理完整晶体和缺陷的高分辨像,已经有商业化的程序TrueImage,贾春林老师和陈江华老师用的都是这个方法。 Wiener过滤的方法只需要4、5张高分辨像。Kirkland这个人比较厉害,原来在剑桥,跟Saxton在一起,现在跑到牛津去了,好像年纪不大,四十岁左右,现在已经是教授了。
[center]真实色共焦显微镜与激光扫描共焦显微镜主要特点对比[/center]真实色共焦显微镜与激光扫描共焦显微镜,二者在成像原理上基本是一样的,最大不同之处是照明光源不同。1、激光扫描共焦显微镜激光扫描共焦显微镜的照明光源是激光,即单色光。其实际成像过程是根据被观察物体对该单色激光的反射光的强弱来成像的。由于是单色光照明,不能分辨颜色,对于在同一试样的同一视场内,颜色不同,但对该单色激光反射光强度相同的不同组织或成分不能分辨。容易产生同相异色,同色异相的现象,不利于对微观组织和成分的正确分辨。2、真实色共焦显微镜真实色共焦显微镜的光源是氙光源,即白光。其实际成像过程是在白光照明的条件下,对物体形貌(包括颜色)进行综合的成像。 由于是多色光照明和成像,真实色共焦显微镜能够更真实的反应物体的颜色和形貌,避免了激光扫描共焦显微镜产生的同相异色,同色异相的现象发生,观察者可以通过颜色,分辨和判断试样的成分和组织。在这方面,其分辨率远强于激光扫描共焦显微镜 综合分析:在有颜色差异的试样的观察条件下,真实色共焦显微镜避免了激光扫描共焦显微镜产生的同相异色,同色异相的现象发生,观察者可以通过颜色,分辨和判断试样的成分和组织。在这种条件下,真实色共焦显微镜的分辨率高于激光扫描共焦显微镜。在单色试样的观察条件下,分辨率才接近各自的技术指标。然而,在实际观察的试样中,绝大多数不同的组织和成分都是有颜色差异的。对应于没有颜色差异或颜色差异小的试样,可以通过人为的染色(例如腐蚀处理),提高图像的分辨能力。在这一方面,激光扫描共焦显微镜是无能为力的。 另外,分辨率是在特定条件下所能达到的一项技术指标,当在实际使用中,不满足该技术条件时(实际是常常不能满足),其分辨率是达不到所给出的数值。
[url=http://www.leica-microsystems.com/cn/%E4%BA%A7%E5%93%81/%E5%85%B1%E8%81%9A%E7%84%A6%E6%98%BE%E5%BE%AE%E9%95%9C/]激光共聚焦显微镜[/url]用于对样品(如贴片细胞)进行荧光成像,一般具有几条不同波长的激光作为激发光,研究人员可根据自身不同的实验需要来选择合适的激光进行荧光成像。共聚焦显微镜相对于传统的荧光显微镜具有极大的优势。首先,激光共聚焦显微镜具有极高的层切能力,可以对样品进行三维成像。与普通荧光显微镜不同,共聚焦显微镜可以对待观察样品的某一平面清晰成像,通过改变样品的垂直位置对样品的不同平面进行依次成像,还可对样品的特定平面进行实时动态成像。其次,共聚焦显微镜相对于传统的荧光显微镜具有极高的分辨率,基本达到了光学显微镜分辨率的理论极限。再次,由于激光共聚焦显微镜基于单点扫描的成像模式,因此可以在此基础上开发出其他传统荧光显微镜不能达成的技术,如荧光漂白恢复技术,荧光相关光谱技术等。共聚焦显微镜在生物学和化学领域具有极其广阔的应用,如对样品的荧光信号进行定性定量分析,对组织样品进行三维结构观察等。
[url=http://www.f-lab.cn/microscopes-system/picotweezers.html][b]高分辨率光镊系统[/b][/url]采用了德国picotweezers技术的细胞单分子力学捕获系统,是全球领先的超高分辨率激光光镊系统,是进口光镊品牌中具有超低光镊价格Optical Tweezers产品.[b]高分辨率光镊系统[/b]不仅具有光镊功能,还提供微视图像计算能力,非常方便单细胞生物力学分析.[b]高分辨率光镊系统通[/b]常与德国蔡司Axiovert、AxioA1或D1型显微镜配套使用,配备1W或5W的红外光纤激光器,提供激光捕获力高达400pN~2nN范围。高分辨率光镊系统配备压电定位位移台,在XYZ三轴三个方向具有200μm分辨率的扫描能力.[b]高分辨率光镊系统[/b]还具有视频分析功能,至少2.5nm的横向和轴向分辨率,其图像拍摄速率为200帧/秒,X、Y、Z互相成像速度为400赫兹,可对生物大分子进行0.1PN作用力分辨率的实时分析。[img=高分辨率光镊系统]http://www.f-lab.cn/Upload/ionovation-explorer.jpg[/img] [b]高分辨率光镊系统特色[/b]定量分析,在三维方向实现0.1 PN分辨率的生物为微力分析最大光阱捕获力可在1 W光纤激光器下达到400 PN通过光镊实现对捕获对象精度为纳米级别的操控 [b][b]高分辨率光镊系统[/b]应用[/b]单分子与活细胞的操控和分析 弹性模量分析、微流控分析 分子相互作用、纳米孔分析 [color=#666666][color=#000000]高分辨率光镊系统:[url]http://www.f-lab.cn/microscopes-system/picotweezers.html[/url][/color][/color]
激光共聚焦扫描显微镜简介一、 激光共聚焦显微镜的基本组成激光扫描共聚焦显微镜(laser scanning confocal microscope LSCM)是20世纪80年代发展起来的一项具有划时代意义的高科技新产品,是当今世界最先进的细胞生物学分析仪器。激光共聚焦显微镜利用激光作为光源,在传统光学显微镜基础上采用共轭聚焦的原理和装置,以及通过针孔的选择和PMT的收集,并带有一套对其所观察到的对象进行数字图像分析处理的系统软件。与传统光学显微镜相比,它具有更高的分辨率,实现多重荧光的同时观察并可形成清晰的三维图象等优点。所以它问世以来在生物学的研究领域中得到了广泛应用。激光共聚焦显微镜主要有四部分组成:1、显微镜光学系统。2、扫描装置。3、激光光源。4、检测系统。整套仪器由计算机控制,各部件之间的操作切换都可在计算机操作平台界面中方便灵活地进行。1.1 显微镜光学系统 显微镜是LSCM的主要组件,它关系到系统的成象质量。显微镜光路以无限远光学系统可方便地在其中插人光学选件而不影响成象质量和测量精度。物镜应选取大数值孔径平场复消色 差物镜,有利于荧光的采集和成象的清晰。物镜组的转换,滤色片组的选取,载物台的移动调节,焦平面的记忆锁定都应由计算机自动控制。1.2 扫描装置 LSCM使用的扫描装置在生物领域一般为镜扫描。由于转镜只需偏转很小角度就能涉及很大的扫描范围,图象采集速度大大提高,512×512画面每秒可达4帧以上,有利于那些寿命短的离子作荧光测定。扫描系统的工作程序由计算机自动控制。1.3 激光光源 LSCM使用的激光光源有单激光和多激光系统。多激光器系统在可见光范围使用多谱线氩离子激光器,发射波长为457nm、488nm和514nm的蓝绿光,氦氖绿激光器提供发射波长为543nm的绿光,氦氖红激光器发射波长为633nm的红光,新的405nm半导体激光器的出现可以提供近紫外谱线,但是小巧便宜而且维护简单。1.4 检测系统 LSCM为多通道荧光采集系统,一般有三个荧光通道和一个透射光通道,能升级到四个荧光通道,可对物体进行多谱线激光激发,样品发射荧光的探测器为感光灵敏度高的光电倍增管PMT,配有高速12位A/D转换器,可以做光子计数。PMT前设置针孔,由计算机软件调节针孔大小,光路中设有能自动切换的滤色片组,满足不同测量的需要,也有通过光栅或棱镜分光后进行光谱扫描功能的设置。二、激光共聚焦显微镜的特点以及在生物领域的应用传统光学显微镜相比,激光共聚焦显微镜具有更高的分辨率,实现多重荧光的同时观察并可形成清晰的三维图象等优点,在对生物样品的观察中,激光共聚焦显微镜有如下优越性:1、对活细胞和组织或细胞切片进行连续扫描,可获得精细的细胞骨架、染色体、细胞器和细胞膜系统的三维图像。2、 可以得到比普通荧光显微镜更高对比度、高解析度图象、同时具有高灵敏度、杰出样品保护。3、***图象的获得,如7 维图象(XYZaλIt): xyt 、xzt 和xt 扫描,时间序列扫描旋转扫描、区域扫描、光谱扫描、同时方便进行图像处理。 4、细胞内离子荧光标记,单标记或多标记,检测细胞内如PH和钠、钙、镁等离子浓度的比率测定及动态变化。5、荧光标记探头标记的活细胞或切片标本的活细胞生物物质,膜标记、免疫物质、免疫反应、受体或配体,核酸等观察;可以在同一张样品上进行同时多重物质标记,同时观察; 6、对细胞检测无损伤、精确、准确、可靠和优良重复性;数据图像可及时输出或长期储存。 由于共聚焦显微镜的以上优点,激光共聚焦显微镜在以下研究领域中应用较为广泛:1、细胞生物学:如:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化、细胞凋亡机制;各种细胞器、结构性蛋白、DNA、RNA、酶和受体分子等细胞特异性结构的含量、组分及分布进行定量分析;DNA、RNA含量、利用特定的抗体对紫外线引起的DNA损伤进行观察和定量;分析正常细胞和癌细胞细胞骨架与核改变之间的关系;细胞黏附行为等 2、生物化学:如:酶、核酸、受体分析、荧光原位杂交、杂色体基因定位等,利用共聚焦技术可以取代传统的核酸印迹染交等技术,进行基因的表达检测,使基因的转录、翻译等检测变的更加简单、准确。3、药理学:如:药物对细胞的作用及其动力学;药物进入细胞的动态过程、定位分布及定量 4、生理学、发育生物学:如:膜受体、离子通道、离子含量、分布、动态;动物发育以及胚胎的形成,骨髓干细胞的分化行为;细胞膜电位的测量.荧光漂白恢复(FRAP)、荧光漂白丢失(FLIP)的测量等。 5、遗传学和组胚学:如:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断; 6、神经生物学:如:神经细胞结构、神经递质的成分、运输和传递; 7、微生物学和寄生虫学:如:细菌、寄生虫形态结构; 8、病理学及病理学临床应用:如:活检标本的快速诊断、肿瘤诊断、自身免疫性疾病的诊断; 9、免疫学、环境医学和营养学。如:免疫荧光标记(单标、双标或三标)的定位,细胞膜受体或抗原的分布,微丝、微管的分布、两种或三种蛋白的共存与共定位、蛋白与细胞器的共定位;对活细胞中的蛋白质进行准确定位及动态观察可实时原位跟踪特定蛋白在细胞生长、分裂、分化过程中的时空表达,荧光能量共转移(FRET)。
随着计算机技术和光电技术的飞跃发展,八十年代后期开始实际应用的激光共聚焦扫描显微镜(LSM),使人们在医学生物学上对活细胞的动态观察、细胞无损伤探测、免疫荧光标记和离子荧光探针的观察和研究上有了更加得心应手的手段和工具。随着计算机、光学显微镜、大数值孔径复消色差物镜、高分辨率分析显示、激光源、激光功率、高敏感度探测器、声光转换电子控制和各种荧光标记物的发展,使得LSM向更精、更快、多维和无损伤性分析的方向发展。

三维显微激光拉曼光谱仪三维显微激光拉曼光谱仪装置Nanofinder30 Nanofinder30 三维显微激光拉曼光谱仪装置是日本首创,世界最初的分析装置。它能在亚微米到纳米范围内,测定物质化学状态的三维图像。它由共焦激光显微镜,压电陶瓷平台(或电动扫描器)和光谱仪组成。并能自选追加原子力显微镜和近场表面增强拉曼测定的功能。 最新测量数据[ 变形Si的应力测定]PDF刊登 用二维的平面分析来评价变形Si。空间分辨率130nm, 变形率0.01%(0.1cm偏移)。 半导体/电子材料(异状物,应力,化学组成,物理结构)薄膜/保护膜(DLC,涂料,粘剂)/界面层,液晶内部构造结晶体(单壁碳纳米管,纳米晶体)光波导回路,玻璃,光学结晶等的折射率变化生物学(DNA, 蛋白质, 细胞 组织等) 以亚微米级分辨率和三维图像,能分析物质的化学结合状态空间分辨率200nm(三维共焦点模式),50nm(二维TERS模式)能同时测定光谱图像(拉曼/萤光/光致荧光PL),共焦显微镜图像,扫描探针显微镜图像(AFM/STM)和近场表面增强拉曼图像(SERS)能高速度,高灵敏度地测定样品(灵敏度:与原来之比10倍以上)不需要测定前样品处理,在空气中能进行非破坏测定全自动马达传动系统的作用,测定简单 共焦显微镜模式不能识别结晶缺陷,然而光致荧光(PL)模式却能清楚地测到结晶缺陷 共焦激光显微镜模式的形状测定 光谱窗 560 nm 用光致荧光(PL)模式测到的结晶缺陷的光谱图像(560nm的三维映像) 用AFM和共焦显微拉曼法同时测定CNT,能判定它的特性 (金属,半导体)和纯度。 同时测定单壁碳纳米管(CNT)的原子力显微镜(AFM) 形貌图像和拉曼光谱图像的例子 :拉曼光谱: 激光488nm,功率1.5mW,曝光时间2 sec,物镜100×Oil, NA=1.35, 积分时间100 sec (AFM和拉曼图像测定时) AFM形貌图像(右上)表示了单壁碳纳米管混合物的各种形状结构。图像中用数字1到8来表示其不同形状。数字1-6测得了拉曼光谱(上图所示),判定为半导体CNT。但7-8测不到拉曼光谱,所以不是半导体CNT,而可能是金属CNT(可用He-Ne激光633nm验证)。最上面表示了RBM(173cm-1), G-band(1593cm-1)及D-band(1351cm-1)的拉曼光谱图像 综合激光器和光谱分析系统的长处,坚固耐用的复合设计,卓越的仪器安定性,是纳米技术测定装置中的杰出产品。 ※日本纳米技术2004大奖“评价和测量部门”得奖. ※日本第16届中小企业优秀技术和新产品奖 “优良奖”得奖. 光学器件配置图Nanofinder30 [img]http://ng1.17img.cn/bbsfiles/images/2008/12/200812071751_122565_1634361_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2008/12/200812071751_122566_1634361_3.jpg[/img][~122567~][~122568~]
摘要: 本文扼要介绍了电子显微镜的现状与展望。透射电子显微镜方面主要有:高分辨电子显微学及原子像的观察,像差校正电子显微镜,原子尺度电子全息学,表面的高分辨电子显微正面成像,超高压电子显微镜,中等电压电镜,120kV,100kV分析电镜,场发射枪扫描透射电镜及能量选择电镜等,透射电镜将又一次面临新的重大突破;扫描电子显微镜方面主要有:分析扫描电镜和X射线能谱仪、X射线波谱仪和电子探针仪、场发射枪扫描电镜和低压扫描电镜、超大试样室扫描电镜、环境扫描电镜、扫描电声显微镜、测长/缺陷检测扫描电镜、晶体学取向成像扫描电子显微术和计算机控制扫描电镜等。扫描电镜的分辨本领可望达到0.2—0.3nm并观察到原子像。 关键词 透射电子显微镜 扫描电子显微镜 仪器制造与发展 中图法分类号 TN16 O766.1 Q336 电子显微镜(简称电镜,EM)经过五十多年的发展已成为现代科学技术中不可缺少的重要工具。我国的电子显微学也有了长足的进展[1]。电子显微镜的创制者鲁斯卡(E.Ruska)教授因而获得了1986年诺贝尔奖的物理奖[2]。 电子与物质相互作用会产生透射电子,弹性散射电子,能量损失电子,二次电子,背反射电子,吸收电子,X射线,俄歇电子,阴极发光和电动力等等。电子显微镜就是利用这些信息来对试样进行形貌观察、成分分析和结构测定的。电子显微镜有很多类型,主要有透射电子显微镜(简称透射电镜,TEM)和扫描电子显微镜(简称扫描电镜,SEM)两大类。扫描透射电子显微镜(简称扫描透射电镜,STEM)则兼有两者的性能。为了进一步表征仪器的特点,有以加速电压区分的,如:超高压(1MV)和中等电压(200—500kV)透射电镜、低电压(~1kV)扫描电镜;有以电子枪类型区分的,如场发射枪电镜;有以用途区分的,如高分辨电镜,分析电镜、能量选择电镜、生物电镜、环境电镜、原位电镜、测长CD-扫描电镜;有以激发的信息命名的,如电子探针X射线微区分析仪(简称电子探针,EPMA)等。 半个多世纪以来电子显微学的奋斗目标主要是力求观察更微小的物体结构、更细小的实体、甚至单个原子,并获得有关试样的更多的信息,如标征非晶和微晶,成分分布,晶粒形状和尺寸,晶体的相、晶体的取向、晶界和晶体缺陷等特征,以便对材料的显微结构进行综合分析及标征研究[3]。近来,电子显微镜(电子显微学),包括扫描隧道显微镜等,又有了长足的发展。本文仅讨论使用广泛的透射电镜和扫描电镜,并就上列几个方面作一简要介绍。部分透射电镜和扫描电镜的主要性能可参阅文献[1]。 透射电子显微镜 1、高分辨电子显微学及原子像的观察 材料的宏观性能往往与其本身的成分、结构以及晶体缺陷中原子的位置等密切相关。观察试样中单个原子像是科学界长期追求的目标。一个原子的直径约为1千万分之2—3mm。因此,要分辨出每个原子的位置需要0.1nm左右的分辨本领,并把它放大约1千万倍。70年代初形成的高分辨电子显微学(HREM)是在原子尺度上直接观察分析物质微观结构的学科。计算机图像处理的引入使其进一步向超高分辨率和定量化方向发展,同时也开辟了一些崭新的应用领域。例如,英国医学研究委员会分子生物实验室的A.Klug博士等发展了一套重构物体三维结构的高分辨图像处理技术,为分子生物学开拓了一个崭新的领域。因而获得了1982年诺贝尔奖的化学奖,以表彰他在发展晶体电子显微学及核酸—蛋白质复合体的晶体学结构方面的卓越贡献[4]。 用HREM使单个原子成像的一个严重困难是信号/噪声比太小。电子经过试样后,对成像有贡献的弹性散射电子(不损失能量、只改变运动方向)所占的百分比太低,而非弹性散射电子(既损失能量又改变运动方向)不相干,对成像无贡献且形成亮的背底(亮场),因而非周期结构试样中的单个原子像的反差极小。在档去了未散射的直透电子的暗场像中,由于提高了反差,才能观察到其中的重原子,例如铀和钍—BTCA中的铀(Z=92)和钍(Z=90)原子[5]。对于晶体试样,原子阵列会加强成像信息。采用超高压电子显微镜和中等加速电压的高亮度、高相干度的场发射电子枪透射电镜在特定的离焦条件(Scherzer欠焦)下拍摄的薄晶体高分辨像可以获得直接与晶体原子结构相对应的结构像。再用图像处理技术,例如电子晶体学处理方法,已能从一张200kV的JEM-2010F场发射电镜(点分辨本领0.194nm)拍摄的分辨率约0.2nm的照片上获取超高分辨率结构信息,成功地测定出分辨率约0.1nm的晶体结构[6]。 2.像差校正电子显微镜 电子显微镜的分辨本领由于受到电子透镜球差的限制,人们力图像光学透镜那样来减少或消除球差。但是,早在1936年Scherzer就指出,对于常用的无空间电荷且不随时间变化的旋转对称电子透镜,球差恒为正值。在40年代由于兼顾电子物镜的衍射和球差,电子显微镜的理论分辨本领约为0.5nm。校正电子透镜的主要像差是人们长期追求的目标。经过50多年的努力,1990年Rose提出用六极校正器校正透镜像差得到无像差电子光学系统的方法。最近在CM200ST场发射枪200kV透射电镜上增加了这种六极校正器,研制成世界上第一台像差校正电子显微镜。电镜的高度仅提高了24cm,而并不影响其它性能。分辨本领由0.24nm提高到0.14nm[7]。在这台像差校正电子显微镜上球差系数减少至0.05mm(50μm)时拍摄到了GaAs〈110〉取向的哑铃状结构像,点间距为0.14nm[8]。 3、原子尺度电子全息学 Gabor在1948年当时难以校正电子透镜球差的情况下提出了电子全息的基本原理和方法。论证了如果用电子束制作全息图,记录电子波的振幅和位相,然后用光波进行重现,只要光线光学的像差精确地与电子光学的像差相匹配,就能得到无像差的、分辨率更高的像。由于那时没有相干性很好的电子源,电子全息术的发展相当缓慢。后来,这种光波全息思想应用到激光领域,获得了极大的成功。Gabor也因此而获得了诺贝尔物理奖。随着Mollenstedt静电双棱镜的发明以及点状灯丝,特别是场发射电子枪的发展,电子全息的理论和实验研究也有了很大的进展,在电磁场测量和高分辨电子显微像的重构等方面取得了丰硕的成果[9]。Lichte等用电子全息术在CM30 FEG/ST型电子显微镜(球差系数Cs=1.2mm)上以1k×1k的慢扫描CCD相机,获得了0.13nm的分辨本领。目前,使用刚刚安装好的CM30 FEG/UT型电子显微镜(球差系数Cs=0.65mm)和2k×2k的CCD相机,已达到0.1nm的信息极限分辨本领[10,11]。
最近在了解高温观察用激光共焦扫描显微镜,看了很多有关采用CLSM观察的高温熔化、凝固和固态相变的观察,感觉很不错。但是我在论坛里看见采用激光扫描共焦显微镜拍摄的很多三维组织图像照片,这种激光共焦扫描显微镜和宝钢、首钢的那种高温观察用的激光扫描共焦显微镜是不是不一样啊??激光共焦扫描显微镜是不是也分好几种啊,请专家解惑,我刚刚接触,不是很了解。另外高温观察用激光共焦扫描显微镜大概多少钱啊,在哪里买呢,谢谢大家
http://203.64.230.194/web/Content.asp?ID=39269【汉语拼音】dianzi xianweixue 【中文词条】电子显微学 【外文词条】electron microscopy 【作 者】郭可信 用电子显微镜研究物质的显微组织﹑成分和晶体结构的一门科学技术。电子显微镜是用一束电子照射到样品上并将其组织结构细节放大成像的显微镜。根据成像特点﹐目前广泛使用的电子显微镜有﹕透射电子显微镜﹔扫描电子显微镜﹔扫描透射电子显微镜。 透射电子显微镜 (transmission electron microscopy﹐简写为TEM)。 构造原理 电子显微镜的构造原理与光学显微镜相似﹐主要由照明系统和成像系统构成(图1 光学显微镜与电子显微镜的对比 )。照明系统包括电子枪和聚光镜。钨丝在真空中加热并在电场的作用下发射出电子流﹐经聚光镜会聚﹐照射到样品上。成像系统主要是物镜和投影镜﹐后者相当于光学显微镜中的目镜。从样品上物点发射出的散射电子波﹐经过物镜的聚焦成像作用在其像面上产生一次放大像﹐再经过投影镜在荧光屏上产生二次放大像﹐可供直接观察或拍摄相片。在电子显微镜中所有透镜都是磁透镜﹐利用强磁场使电子束聚焦。 分辨极限 光学显微镜的分辨极限受所用光波波长的限制﹐大约相当于波长的一半。可见光的波长为0.4~0.7微米﹐因此不能观察小于0.2微米的细节﹐放大倍数不过一两千倍。电子的运动也具有波动特征﹐加速电压越高﹐波长越短。下列是常用的一些加速电压与电子波的波长﹕ 加速电压(kV) 100 200 500 1000 波长(0.01A) 3.70 2.51 1.42 0.87显然﹐根据电子波长得出的电子显微镜的理论分辨极限远小于0.1A﹐但是由于磁透镜的球面象差和象散﹐电压与电流的波动﹐仪器的震动﹐样品的漂移等等﹐透射电子显微镜的实际分辨本领远逊于此值。1939年第一台商品电子显微镜问世(1932年在实验室中就已研制成功)﹐使用单聚光镜和两个成像透镜﹐分辨本领优于100A。现在的一级电子显微镜普遍采用双聚光镜和3~4个成像透镜(在物镜与投影镜之间安装1~2个中间镜﹐见图3 改变中间镜物距(改变透镜电流)可以在中间镜像面上得到二次放大像或一次放大衍射图。BB及CC截面相当于图4(b)及(c)的情况﹐前者是散焦的像﹐后者是散焦的衍射图 )﹐可以直接得到放大一百万倍的像﹐分辨本领为2~3A﹐不但可以分辨点阵平面像(图9 金膜的(200)及(020)点阵平面象 )﹐而且可以分辨原子﹐直接观察到晶体与分子中的原子(图10 金原子在 (111)点阵平面上的分布 )。由此可见﹐放大倍数高﹐分辨极限可以小到原子尺度﹐这是透射电子显微镜的最显著的特点。
共焦激光扫瞄显微镜ZEISS所提供之英文数据,内容包含:1.影像构成原理2.电子信号处理[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=32959]共焦激光扫瞄显微镜[/url]

[img=,550,310]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171819522461_4148_5659437_3.png!w550x310.jpg[/img][size=14px]课程兼顾理论与实践的结合,由吴老师[/size][size=14px][color=#3daad6][b]根据自己多年的教学及科研经验[/b][/color][/size][size=14px],组织和整理本次课程内容从共聚焦显微镜的背景、结构、基本操作及注意事项、各类扫描模式及应用等方面展开详细讲解,让我们拒绝做一名只会机械操作,不懂原理的实验工具人![/size][size=14px][img=,128,128]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171820520008_9055_5659437_3.png!w128x128.jpg[/img]原价:[/size][size=14px][b]599[/b][/size][size=14px][b]元[/b][/size][size=14px]课程[b]限时:39元[/b][/size][b][size=16px]讲师介绍[/size][/b][img=,690,812]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171821243917_661_5659437_3.png!w690x812.jpg[/img][color=#3daad6][b][size=14px]吴晶,北京大学医药卫生分析中心教师,助理研究员[/size][/b][/color][size=14px]2013-2015年北京大学神经科学研究所从事博士后研究工作,出站后加入北京大学医药卫生分析中心生物成像与分析实验室,致力于成像技术的研发和创新,掌握多种成像技术如双光子、超高分辨、单分子检测等,支持发表高水平文章如Cell Research, Advanced Materials等多篇。[/size][size=14px]参与多项基金,近5年以一作身份发表SCI文章6篇,专利2项。[/size][size=14px]多次获北京大学实验技术成果奖,中国分析测试协会科学技术奖。撰写的“激光扫描共聚焦显微镜的检测模式及其在生物医学领域的应用”获第十五届科学仪器网络原创作品大赛三等奖,并收录于《科研仪器案例库》。[/size][size=14px]多次获北京大学实验技术成果奖,中国分析测试协会科学技术奖,及第一届“信立方杯”高校分析测试技术培训微课大赛最受欢迎主讲老师。[/size][b][size=16px]课程预览[/size][/b] [size=14px]详细介绍了激光扫描共聚焦显微镜的结构、原理、功能及应用,基本操作流程与日常操作中的注意事项等,可帮助初学者快速掌握全面的掌握仪器基本知识。详细介绍了激光扫描共聚焦显微镜的结构、原理、功能及应用,基本操作流程与日常操作中的注意事项等,可帮助初学者快速掌握全面的掌握仪器基本知识。[/size][b][size=16px]这门课,你将获得什么?[/size][/b][size=14px]激光共聚焦显微镜背景、结构、原理介绍[/size][size=14px]激光共聚焦显微镜基本操作及注意事项[/size][size=14px]激[/size][size=14px]光共聚焦显微镜的扫描模式[/size][color=#3daad6][b][size=14px][/size][/b][/color][size=14px]激[/size][size=14px]光共聚焦显微镜的实际应用[/size][size=16px][b]课程获取[img=,128,128]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171820520008_9055_5659437_3.png!w128x128.jpg[/img][/b][/size][size=14px]原价:[/size][size=14px][b]599[/b][/size][size=14px][b]元[/b][/size][size=14px]课程[/size][size=14px][color=#ff4c00][b]限时:69元[/b][/color][/size][size=16px][b]报名须知[/b][/size]1、本课程为精品课程,无考试无证书,课程有效期内全部学习完可以在线申请培训证明。2、课程为虚拟产品,购买后不支持退换。3、购买时可申请增值税电子普通发票,如需专票请联系客服。4、课程有效期为购买后的360天内,课程有效期内可不限次数学习观看。
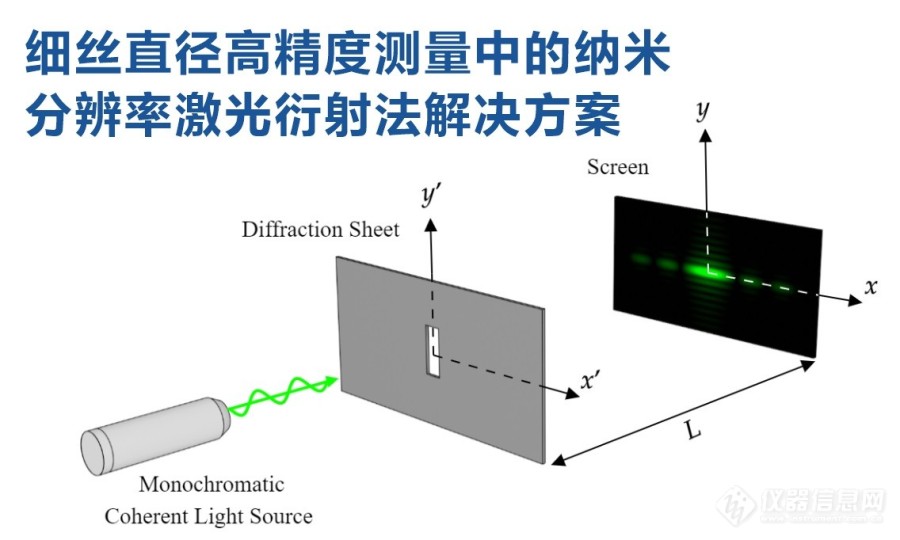
[align=left][b][color=#339999]摘要:碳纤维单丝热膨胀系数是碳纤维复合材料设计、生产与可靠性和寿命评估的重要参数,本文针对单丝径向高温热膨胀系数测试这一难题提出了相应的解决方案。解决方案的核心内容是基于激光衍射法和高温辐射加热,并采用衍射轮廓拟合技术以及相应的校准、真空温度控制等技术,可实现几个纳米的测量分辨率。此解决方案不仅可以测量各种粗细单丝的直径及其热膨胀,还可以拓展应用于细丝的直径分布、截面形状和径向热膨胀测量。[/color][/b][/align][align=center][size=16px] [img=碳纤维单丝径向高温热膨胀系数激光衍射法测试解决方案,600,360]https://ng1.17img.cn/bbsfiles/images/2023/05/202305300838571272_2512_3221506_3.jpg!w690x414.jpg[/img]~~~~~~~~~~~~~~~~~~~[/size][/align][size=18px][color=#339999][b]1. 项目背景[/b][/color][/size][size=16px] 随着碳纤维增强复合材料应用的扩大,其设计也变得越来越精密。温度变化引起的热应力是复合材料设计中需要考虑的重要因素之一,而碳纤维的热膨胀系数是控制热应力的基本物理性能值。另外,碳纤维的热膨胀系数不仅是复合材料设计中的重要参数,也是预测制造工艺、可靠性和寿命的重要参数。[/size][size=16px] 由于碳纤维一般具有很强的方向性,其热膨胀系数主要包括轴向和径向热膨胀系数。本文将针对1~10微米直径的碳纤维单丝,提出径向热膨胀系数测试方法,特别是提出高温下径向热膨胀系数测试的解决方案。[/size][size=18px][color=#339999][b]2. 激光衍射法测量原理[/b][/color][/size][size=16px] 在假设碳纤维单丝是直径均匀、截面积形状为圆形细丝的前提下,按照热膨胀系数的定义,碳纤维单丝高温热膨胀系数的测试可以归结为不同温度下单丝直径的测量问题,具体测试涉及到单丝温度和单丝直径的精确测量。[/size][size=16px] 对于微小细丝直径的测量,只能选择非接触光学测量方法。可选择的测试方法主要有显微镜观测法、光学投影法和激光衍射法,但由于碳纤维测试需要涉及到高温和真空环境,显微镜直接观察方法很难实现较高温度,而投影法则是无法达到纳米量级的测量精度,因此本项目将选择激光衍射法,以实现纳米精度的单丝直径测量。[/size][size=16px] 激光衍射测量原理如图1所示。单色激光垂直照射被测细丝后在焦平面上形成衍射图形,通过对图形参数等的测量,可准确测得细丝直径。[/size][align=center][size=16px][img=01.激光衍射线径测量原理图,550,329]https://ng1.17img.cn/bbsfiles/images/2023/05/202305300841272151_4630_3221506_3.jpg!w690x413.jpg[/img][/size][/align][align=center][size=16px][color=#339999][b]图1 激光衍射法细丝直径测量原理图[/b][/color][/size][/align][size=18px][color=#339999][b]3. 细丝径向热膨胀测量装置[/b][/color][/size][size=16px] 基于激光衍射法的细丝径向高温热膨胀系数测量装置结构如图2所示。整个测量装置包括水冷真空系统、样品装置、温控加热装置和激光衍射测量装置四部分。[/size][align=center][size=16px][img=02.单丝碳纤维高温径向热膨胀系数激光衍射法测量装置结构示意图,500,452]https://ng1.17img.cn/bbsfiles/images/2023/05/202305300841487917_7673_3221506_3.jpg!w690x625.jpg[/img][/size][/align][align=center][size=16px][color=#339999][b]图2 单丝碳纤维高温径向热膨胀系数激光衍射法测量装置结构示意图[/b][/color][/size][/align][size=16px][color=#339999][b](1)水冷真空系统[/b][/color][/size][size=16px] 真空系统由水冷真空腔体内、真空泵和真空度控制系统构成。在整个高温测试过程中,需要对真空腔体抽真空,以便在整个高温测试过程中形成真空环境避免碳纤维细丝样品的氧化或烧断。真空腔体壁内通循环冷却水以对内部高温形成热防护。同时还需对循环冷却水温度和腔体内部真空度进行精密恒定控制,使得腔体温度和内部真空度所引起的腔体变形和光学窗口倾斜始终保持恒定和可重复。[/size][size=16px][color=#339999][b](2)样品装置[/b][/color][/size][size=16px] 采用悬空水平方式固定被测细丝碳纤维样品,细丝样品一端采用螺接压紧方式固定,另一端经过滑动装置采用砝码拉近,通过砝码重量提供的微小张力始终使细丝样品处于水平拉直状态。对于不同强度和粗细的碳纤维细丝,可通过更换砝码来提供不同的拉紧张力。[/size][size=16px][color=#339999][b](3)温控加热装置[/b][/color][/size][size=16px] 采用细管加热炉对整个样品进行辐射加热,测试过程中的温度变化按照步进台阶式形式变化,在每个设定点温度恒定后再进行激光衍射测量。这种加热方式的优点是用加热炉内的温度代替被测样品温度,由此可避免对细丝样品温度进行直接测量的困难性。[/size][size=16px][color=#339999][b](4)激光衍射测量装置[/b][/color][/size][size=16px] 激光衍射测量装置主要由激光源、衍射图像传感器和计算机图像分析系统组成。激光源和图像传感器分别水平布置在真空腔体的两侧,激光束垂直照射在被测细丝上,所形成的衍射图像由传感器接收。[/size][size=18px][color=#339999][b]4. 衍射轮廓的高精度测量[/b][/color][/size][size=16px] 细丝直径测量中采用激光衍射装置和图像传感器获得的衍射轮廓如图3所示。纤维直径根据测量衍射轮廓的第一个暗条纹之间距离,并由衍射公式计算获得。但如果直接采用图像传感器的固有位置分辨率,则只能获得10nm左右的直径测量分辨率,这显然无法获得足够高的直径变化检测精度。[/size][align=center][size=16px][color=#339999][b][img=03.图像传感器衍射轮廓示意图,550,402]https://ng1.17img.cn/bbsfiles/images/2023/05/202305300842072248_1383_3221506_3.jpg!w690x505.jpg[/img][/b][/color][/size][/align][align=center][size=16px][color=#339999][b]图3 图像传感器衍射轮廓示意图[/b][/color][/size][/align][size=16px] 为进一步提高细丝直径测量的分辨率,本文提出了以下几方面具体措施:[/size][size=16px] (1)对图3所示的衍射轮廓进行细分,具体细分技术是对衍射轮廓曲线进行参数拟合,拟合中需考虑衍射光以及背景光强度,如光学元件和窗口的散射光以及样品在高温下发出的光。[/size][size=16px] (2)采用已知直径的细丝对成像物镜的焦距进行高精度标定,减小系统误差。[/size][size=16px] (3)在CCD 前增加滤光片,在成像物镜前增加一平行于衍射方向的长条状光阑。[/size][size=16px] 通过上述措施,可将激光衍射法细丝直径测量的分辨率提高到几个纳米范围内。[/size][size=18px][color=#339999][b]5. 总结[/b][/color][/size][size=16px] 本文所述解决方案,除了可以实现1~10微米量级粗细的碳纤维单丝直径和热膨胀系数测试之外,还具备以下几方面的测试能力:[/size][size=16px] (1)本文所述解决方案在设计的同时,还同时考虑了碳纤维轴向方向上热膨胀系数测试功能的实现,即采用激光干涉法测试细丝样品在轴向方向上收缩和膨胀过程中的位移变化。在真空腔体形状和空间尺寸上都考虑了激光干涉法位移测量装置的布置,采用相同的加热和测温装置也可提供碳纤维细丝轴向热膨胀所需的温度变化和测量。[/size][size=16px] (2)由于具有几个纳米的超高分辨率,通过增加扫描装置,此解决方案可以用于碳纤维单丝外径分布和外径形状的测量。[/size][size=16px] (3)为各种粗细的线状材料外径测量提供了一种高精度的激光衍射测量方法,非接触光学测试方法和高温加热能力,也可推广应用到低温范围内的测试应用。[/size][align=center][color=#339999][b][/b][/color][/align][align=center][size=16px][color=#339999][b]~~~~~~~~~~~~~~~~~[/b][/color][/size][/align]
激光共聚焦显微镜系统的原理和应用激光扫描共聚焦显微镜是二十世纪80年代发展起来的一项具有划时代的高科技产品,它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了30%--40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如Ca2+ 、PH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。激光共聚焦成像系统能够用于观察各种染色、非染色和荧光标记的组织和细胞等,观察研究组织切片,细胞活体的生长发育特征,研究测定细胞内物质运输和能量转换。能够进行活体细胞中离子和PH值变化研究(RATIO),神经递质研究,微分干涉及荧光的断层扫描,多重荧光的断层扫描及重叠,荧光光谱分析荧光各项指标定量分析荧光样品的时间延迟扫描及动态构件组织与细胞的三维动态结构构件,荧光共振能量的转移的分析,荧光原位杂交研究(FISH),细胞骨架研究,基因定位研究,原位实时PCR产物分析,荧光漂白恢复研究(FRAP),胞间通讯研究,蛋白质间研究,膜电位与膜流动性等研究,完成图像分析和三维重建等分析。一.激光共聚焦显微镜系统应用领域:涉及医学、动植物科研、生物化学、细菌学、细胞生物学、组织胚胎、食品科学、遗传、药理、生理、光学、病理、植物学、神经科学、海洋生物学、材料学、电子科学、力学、石油地质学、矿产学。二.基本原理传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共聚焦显微镜利用激光束经照明针孔形成点光源对标本内焦平面的每一点扫描,标本上的被照射点,在探测针孔处成像,由探测针孔后的光点倍增管(PMT)或冷电耦器件(cCCD)逐点或逐线接收,迅速在计算机监视器屏幕上形成荧光图像。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点不会在探测针孔处成像,这样得到的共聚焦图像是标本的光学横断面,克服了普通显微镜图像模糊的缺点。三.应用范围:细胞形态学分析(观察细胞或组织内部微细结构,如:细胞内线粒体、内质网、高尔基体、微管、微丝、细胞桥、染色体等亚细胞结构的形态特征;半定量免疫荧光分析);荧光原位杂交研究;基因定位研究及三维重建分析。1.细胞生物学:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化2.生物化学:酶、核酸、FISH(荧光原位杂交)、受体分析3.药理学:药物对细胞的作用及其动力学4.生理学:膜受体、离子通道、细胞内离子含量、分布、动态5.神经生物学:神经细胞结构、神经递质的成分、运输和传递、递质受体、离子内外流、神经组织结构、细胞分布6.微生物学和寄生虫学:细菌、寄生虫形态结构7.病理学及临床应用:活检标本诊断、肿瘤诊断、自身免疫性疾病诊断、HIV等8.遗传学和组胚学:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断四.激光共聚焦显微镜在医学领域中的应用A.在细胞及分子生物学中的应用1. 细胞、组织的三维观察和定量测量2. 活细胞生理信号的动态监测3. 粘附细胞的分选4. 细胞激光显微外科和光陷阱功能5. 光漂白后的荧光恢复6. 在细胞凋亡研究中的应用B.在神经科学中的应用1. 定量荧光测定2. 细胞内离子的测定3. 神经细胞的形态观察C.在耳鼻喉科学中的应用1. 在内耳毛细胞亚细胞结构研究上的应用2. 激光扫描共聚焦显微镜的荧光测钙技术在内耳毛细胞研究中的应用3. 激光扫描共聚焦显微镜在内耳毛细胞离子通道研究上的应用4. 激光扫描共聚焦显微镜在嗅觉研究中的应用D.在肿瘤研究中的应用1. 定量免疫荧光测定2. 细胞内离子分析3. 图像分析:肿瘤细胞的二维图像分析4. 三维重建 E.激光扫描共聚焦显微镜在内分泌领域的应用1. 细胞内钙离子的测定2. 免疫荧光定位及免疫细胞化学研究3. 细胞形态学研究:利用激光扫描共聚焦显微镜 F.在血液病研究中的应用1. 在血细胞形态及功能研究方面的应用2. 在细胞凋亡研究中的应用 G.在眼科研究中的应用1. 利用激光扫描共聚焦显微镜观察组织、细胞结构2. 集合特殊的荧光染色在活体上观察角膜外伤修复中细胞移行及成纤维细胞的出现3. 利用激光扫描共聚焦显微镜观察视网膜中视神经细胞的分布以及神经原的树枝状形态4. 三维重建H. 激光扫描共聚焦显微镜在肾脏病中的应用可以系统观察正常人肾小球系膜细胞的断层扫描影像及三维立体影像水平,使图像更加清晰,从计算机分析系统可从外观到内在结构,从平面到立体,从静态到动态,从形态到功能几个方面对系膜细胞的认识得到提高。北京中科研域科技有限公司(蔡司显微镜代理商)地址:北京市朝阳区建国路15号院甲1号北岸1292,一号楼406室联系人:张辉13911188977 邮编:100024电话:010-57126588 传真:010-85376588E-mail:[email=zhs_8000@126.com][color=#0365bf]zhs_8000@126.com[/color][/email]
有谁在用激光共焦显微拉曼光谱仪?外光源和激光是怎么相互切换的?注明仪器和切换方式,谢谢众位前辈!!!