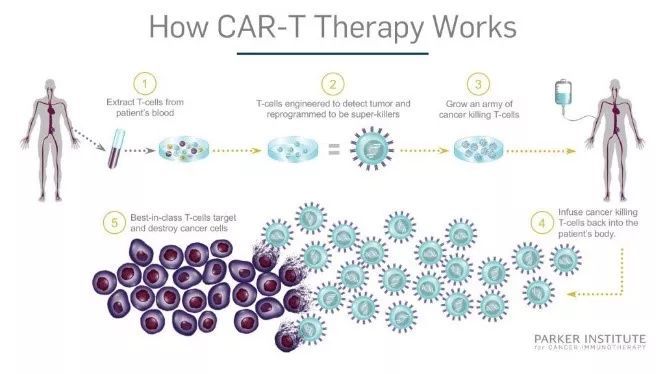
天壤之别!胚胎基因编辑伦理不容,另一项基因编辑技术却在造福人类!
p style=" text-indent: 2em text-align: justify " 近日刷爆朋友圈的不仅是抗癌“神药”Vitrakvi& reg 的问世,还有一则是首例基因编辑婴儿的诞生! /p p style=" text-align: justify text-indent: 2em " 来自中国深圳的科学家贺建奎向外界公布,一对名为露露和娜娜的基因编辑婴儿于11月在中国健康诞生。 /p p style=" text-align: justify text-indent: 2em " 她们的基因已经经过人为修饰,能够天然抵抗艾滋病。消息一出,舆论哗然,遭到百余位中国科学家发表联署声明谴责,国家相关部委对此已经做出回应,对违法违规行为坚决予以查处! /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201811/uepic/bfe6a416-98de-499b-bf93-960d34dd0bf9.jpg" title=" 1.jpg" alt=" 1.jpg" width=" 541" height=" 230" style=" width: 541px height: 230px " / /p p style=" text-align: justify text-indent: 2em " 人类生殖细胞的基因编辑可能诱发非常严重的伦理问题,即被改写的生殖细胞会影响其子孙后代,甚至随着现象的普及、改变整个人类的基因池。 /p p style=" text-align: justify text-indent: 2em " 因为存在高风险,基因编辑技术并未在人体上广泛应用。过去有少数科学家曾在人类早期胚胎上进行实验,但只是停留在胚胎阶段。& nbsp /p p style=" text-align: justify text-indent: 2em " 2003年颁布的《人胚胎干细胞研究伦理指导原则》规定,可以以研究为目的,对人体胚胎实施基因编辑和修饰,但体外培养期限自受精或者核移植开始不得超过14天,而此次“基因编辑婴儿”如果确认已出生,必将引起一场轩然大波!& nbsp /p p style=" text-align: justify text-indent: 2em " span style=" color: rgb(192, 0, 0) " strong 引发轩然大波的基因编辑到底是一种什么技术? /strong /span /p p style=" text-align: justify text-indent: 2em " 中国农业大学生物化学与分子生物学系教授吴森向中新网记者介绍,DNA结构被发现之后,科学家需要通过一项技术去研究每个基因的功能,基因编辑技术便于上世纪80年代后期应运而生。& nbsp /p p style=" text-align: justify text-indent: 2em " 当时,基因编辑技术被称作基因打靶技术。科学家以小鼠作为模型,通过基因打靶的方法改变小鼠的特定基因,借由观察其表型或者行为变化,研究这个基因的功能。& nbsp /p p style=" text-align: justify text-indent: 2em " 基因编辑技术实际上是基因打靶技术的“升级换代”。“基因编辑是一种重构基因序列的手法,就像一个制作精良的橡皮擦,能针对出了毛病的基因,进行精准的‘擦除’。”同济大学医学院教授、同济大学丽丰再生医学研究院执行院长高正良这样评价基因编辑的作用。& nbsp /p p style=" text-align: justify text-indent: 2em " 吴森表示,在过去30年里,基因打靶技术在基础科学研究领域和生物医学领域的用途非常广泛,做出了很多有价值的研究,包括在肿瘤治疗领域中的CAR-T技术(嵌合抗原受体T细胞免疫疗法)等。& nbsp /p p style=" text-align: justify text-indent: 2em " span style=" color: rgb(192, 0, 0) " strong 为什么CAR-T不违背伦理? /strong /span /p p style=" text-align: justify text-indent: 2em " CAR-T技术实质上也是一种基因工程技术,但是为何不违背伦理?很重要的一点是,该技术是通过对体细胞(即免疫细胞)而非体细胞进行基因编辑,遗传基因不会发生改变,对于人类子孙后代不会造成影响。& nbsp /p p style=" text-align: justify text-indent: 2em " 据欧洲药品管理局资料,CAR-T疗法先后须经专利药品委员会、高级治疗委员会和欧盟委员会批准后方可获得临床应用。在中国,同样需要相关职能部门审核通过,才能进行临床试验及应用。我国的CAR-T细胞治疗研究虽然较国外整体起步较晚,但后期发展突飞猛进。& nbsp /p p style=" text-align: justify text-indent: 2em " 从2012年我国首次在clinicaltrial.gov上登记CAR-T细胞临床试验以来,我国每年新注册的CAR-T项目以数倍的速度爆发式增加,目前我国在clinicaltrial.gov上登记的CAR-T项目超过170项,已经超过美国的103项,成为世界上CAR-T细胞临床试验注册数量最多的国家,文末有招募信息。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201811/uepic/280c8040-d0e2-4a0e-84d7-d65c14acf8b6.jpg" title=" 2.jpg" alt=" 2.jpg" width=" 457" height=" 374" style=" width: 457px height: 374px " / /p p style=" text-align: justify text-indent: 2em " strong span style=" color: rgb(192, 0, 0) " CAR-T是一种什么样的技术? /span /strong /p p style=" text-align: justify text-indent: 2em " CAR-T疗法是一种通过T细胞基因改造实现肿瘤靶向杀伤的免疫治疗技术。它通过基因转导技术,把识别肿瘤相关抗原的单链抗体和T细胞活化序列的融合蛋白表达到T细胞表面,经过纯化、体外扩增和活化,输注回患者体内,对抗肿瘤。& nbsp /p p style=" text-align: justify text-indent: 2em " 全称为(Chimeric antigen receptor T-cell therapy)嵌合抗原受体 T细胞疗法,本质上一种肿瘤基因疗法,也是免疫疗法。对于这个中文名您一定还是一头雾水,即便中文名也是看不懂。 /p p style=" text-align: justify text-indent: 2em " 首先,我们必须先对T细胞有初步的认识,T细胞是一种免疫细胞,负责保护身体免于外来病原的攻击。 /p p style=" text-align: justify text-indent: 2em " 而身体裡面的T细胞有又分很多种,其中一种名为细胞毒性T细胞(cytotoxic T cell),它的功能主要是辨识异常的细胞,分泌细胞毒素(如穿孔素、颗粒酶素B),并消灭这些异常细胞。 /p p style=" text-align: justify text-indent: 2em " CAR-T疗法,简单来说就是,我们在原本无法辨识癌细胞的T细胞上,装上一个名为CAR(嵌合抗原受体)的雷达。如此一来,经过改造的T细胞就会像导弹一样,精准的定位癌细胞位置,并将这些癌细胞杀死。 /p p style=" text-align: justify text-indent: 2em " 这样的技术,开启了细胞疗法新的扉页。将来,面对不同的癌症,只要找出适合的雷达-CAR,我们就能请T细胞代劳,替我们对抗癌症。 /p p style=" text-align: justify text-indent: 2em " span style=" color: rgb(192, 0, 0) " strong 原理讲完了,再给您介绍下CAR-T的治疗流程,很easy。 /strong /span /p p style=" text-align: justify text-indent: 2em " 1、分离:从癌症病人身上分离免疫T细胞。 /p p style=" text-align: justify text-indent: 2em " 2、修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,也即制备CAR-T细胞。 /p p style=" text-align: justify text-indent: 2em " 3、扩增:体外培养,大量扩增CAR-T细胞。一般一个病人需要几十亿,乃至上百亿个CAR-T细胞(体型越大,需要细胞越多)。 /p p style=" text-align: justify text-indent: 2em " 4、回输:把扩增好的CAR-T细胞回输到病人体内。 /p p style=" text-align: justify text-indent: 2em " 5、监控:严密监护病人,尤其是控制前几天身体的剧烈反应。& nbsp /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201811/uepic/5f16e10d-c481-41a8-9337-3ed0d9b85536.jpg" title=" 3.jpg" alt=" 3.jpg" / /p p style=" text-align: justify text-indent: 2em " 目前,已经有两项CAR-T技术获得美国FDA批准上市。 /p p style=" text-align: justify text-indent: 2em " 2017年8月,FDA批准诺华的CAR-T疗法Kymriah(tisagenlecleucel)上市,用于治疗罹患B细胞前体急性淋巴性白血病(ALL),且病情难治或出现两次及以上复发的25岁以下患者,这是人类历史上批准的首款CAR-T疗法。 /p p style=" text-align: justify text-indent: 2em " 紧接着,2个月后,FDA宣布批准了Kite Pharma公司开发的用于治疗特定类型大B细胞淋巴瘤成人患者的CAR-T疗法Yescarta(axicabtagene ciloleucel)上市。 /p p style=" text-align: justify text-indent: 2em " CAR-T疗法无疑已成为肿瘤免疫治疗领域中新的国际研究热点。& nbsp /p p style=" text-align: justify text-indent: 2em " span style=" color: rgb(192, 0, 0) " strong CAR-T在肿瘤治疗领域有何贡献? /strong /span /p p style=" text-align: justify text-indent: 2em " 提到CAT-T治疗,最出名的就是在2012年被Carl June博士用来治愈了6岁的小女孩Emily Whitehead后,由此被认为是最有希望攻克肿瘤的手段之一,迅速引发了全球性的研发热潮。 /p p style=" text-align: justify text-indent: 2em " 2012年至今,6年过去了,6岁的小女孩已经长成12岁亭亭玉立的少女,那么,Emily的现状怎么样呢? /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201811/uepic/9fa16f1c-61a5-4c42-afe6-1d1af37da321.jpg" title=" 4.jpg" alt=" 4.jpg" width=" 572" height=" 337" style=" width: 572px height: 337px " / /p p style=" text-align: justify text-indent: 2em " 今年8月份,家人刚刚为她庆祝了十二岁生日。除了曾经患过白血病之外,Emily与普通的孩子并无区别,脸色红润,头发蓬松,与小伙伴们在海滩上嬉戏,显得生气勃勃。根本无法想象在6年前,她是一名晚期癌症患者。& nbsp /p p style=" text-align: justify text-indent: 2em " 她是第一个接受CAR-T治疗的孩子,在治疗的早期临床试验中被认为是一种危险的治疗方法。而如今CAR-T已经获得FDA批准用于临床肿瘤治疗后,Emily成为治疗效果的象征,CAR-T疗法的新型癌症免疫疗法挽救了她的生命,并为数以千计的白血病患儿接受该治疗增加了信心。& nbsp /p p style=" text-align: justify text-indent: 2em " span style=" color: rgb(192, 0, 0) " strong 中国首例!CLL1新靶点CAR-T治疗10岁转化型急性髓系白血病女孩获成功 /strong /span /p p style=" text-align: justify text-indent: 2em " 广州市妇女儿童医疗中心血液肿瘤科张辉主任团队结合现有治疗手段和经验,并根据小慧白血病细胞的免疫分型特点,大胆尝试了CLL1新靶点的CAR-T临床试验性治疗。 /p p style=" text-align: justify text-indent: 2em " 据悉,CAR-T技术用于急性白血病治疗,已有多个成功案例,但针对CLL1靶点的CAR-T治疗,在全国尚属首次! /p p style=" text-align: justify text-indent: 2em " 治疗两个月后,小慧体内的大部分白血病细胞被成功清除,目前已进入观察期,只需定期复查即可。 /p p style=" text-align: justify text-indent: 2em " 如果顺利度过了18至24个月的观察期,小慧有望和美国的Emily(全球首位接受CAR-T治疗急性淋巴细胞白血病的儿科患者)一样被彻底治愈,恢复健康。(来源:金羊网)& nbsp /p p style=" text-align: justify text-indent: 2em " strong span style=" color: rgb(192, 0, 0) " 中、美CAR-T临床试验招募信息 /span /strong /p p style=" text-align: justify " strong span style=" color: rgb(192, 0, 0) " 美国 /span /strong /p p style=" text-align: justify " span style=" color: rgb(192, 0, 0) " 1、EGFR806 CAR T细胞免疫治疗儿童和青少年复发/难治性实体肿瘤 /span /p p style=" text-align: justify " 小儿实体肿瘤:生殖细胞肿瘤、视网膜母细胞瘤、肝母细胞瘤、Wilms肿瘤、横纹肌样瘤、骨肉瘤、尤文肉瘤、横纹肌肉瘤、滑膜肉瘤、透明细胞肉瘤、恶性周围神经鞘瘤、增生性小圆细胞肿瘤、软组织肉瘤、神经母细胞瘤 /p p style=" text-align: justify " 入组医院:西雅图儿童医院 /p p style=" text-align: justify " 入组人数:36 /p p style=" text-align: justify " 截止日期:2021年10月& nbsp /p p style=" text-align: justify " span style=" color: rgb(192, 0, 0) " 2、CD19 + CAR T细胞治疗淋巴恶性肿瘤 /span /p p style=" text-align: justify " 肿瘤类型:白血病、淋巴瘤 /p p style=" text-align: justify " 入组医院:MD安德森癌症中心 /p p style=" text-align: justify " 入组人数:30 /p p style=" text-align: justify " 截止日期:2021年12月& nbsp /p p style=" text-align: justify " span style=" color: rgb(192, 0, 0) " 3、EGFR-vIII CAR-T细胞用于复发性GBM治疗 /span /p p style=" text-align: justify " 肿瘤类型:脑胶质瘤 /p p style=" text-align: justify " 入组医院:杜克癌症研究所 /p p style=" text-align: justify " 入组人数:24 /p p style=" text-align: justify " 截止日期:2021年12月31日& nbsp /p p style=" text-align: justify " strong span style=" color: rgb(192, 0, 0) " 中国 /span /strong /p p style=" text-align: justify " span style=" color: rgb(192, 0, 0) " 1、CAR-T细胞在间皮素阳性实体瘤中的应用研究 /span /p p style=" text-align: justify " 肿瘤类型:成人实体瘤 /p p style=" text-align: justify " 入组医院:解放军总医院 /p p style=" text-align: justify " 入组人数:10 /p p style=" text-align: justify " 截止日期:2019年11月& nbsp /p p style=" text-align: justify " span style=" color: rgb(192, 0, 0) " 2、恶性肿瘤的自体CAR-T / TCR-T细胞免疫治疗 /span /p p style=" text-align: justify " 肿瘤类型:B细胞急性淋巴瘤、白血病淋巴瘤、骨髓性白血病、多发性骨髓瘤、肝癌、胃癌、胰腺癌、间皮瘤、结直肠癌、食道癌、肺癌、胶质瘤、黑色素瘤、滑膜肉瘤、卵巢癌、肾癌 /p p style=" text-align: justify " 入组医院:郑州大学第一附属医院 /p p style=" text-align: justify " 入组人数:73 /p p style=" text-align: justify " 截止日期:2023年3月1日 /p p style=" text-align: justify " span style=" color: rgb(192, 0, 0) " 3、研究评估CAR-T治疗儿童复发或难治性神经母细胞瘤的疗效和安全性 /span /p p style=" text-align: justify " 肿瘤类型:复发或难治性神经母细胞瘤 /p p style=" text-align: justify " 入组医院:南京儿童医院 /p p style=" text-align: justify " 复旦大学附属儿童医院 /p p style=" text-align: justify " 入组人数:22 /p p style=" text-align: justify " 截止日期:2020年9月 /p